Значение и показания для диагностики жизнеспособного миокарда
Добавил пользователь Дмитрий К. Обновлено: 21.01.2026
Метод исследования построен на способности сердечной мышцы накапливать радиоактивный фармпрепарат, излучение которого улавливается регистрирующим аппаратом (гамма-камерой).
Перейти к прайсу
Однофотонная эмиссионная компьютерная томография миокарда позволяет получить оценку кровоснабжения миокарда на уровне микроциркуляторного звена. Метод основан на оценке функциональной активности митохондрий кардиомиоцитов и неповрежденного коронарного кровотока.
Дополнительно выполняемая низкодозная рентгеновская компьютерная томография обеспечивает полное сопоставление анатомо-топографических структур функциональных и морфологических сканов - минимизируя погрешности наслоения органов от экскурсии грудной клетки и брюшной полости при дыхании.
Синхронизация с ЭКГ предоставляет диагностическую информацию не только о состоянии коронарной микроциркуляции, но и дает возможность получить сведения о размерах левого желудочка, выявить нарушения сократительной функции, обнаружить локальные нарушения сократимости и определить систолическое утолщение миокарда. На основании расчета степени тяжести и объема функциональных нарушений левого желудочка проводят стратификацию риска и оценку прогноза большинства сердечно-сосудистых заболеваний, выбор тактики лечения и осуществляют мониторинг эффективности лекарственной терапии.
ПОКАЗАНИЯ ДЛЯ ПРОВЕДЕНИЯ ИССЛЕДОВАНИЯ
- диагностика ишемической болезни сердца: у пациентов с высокой вероятностью, в том числе с сомнительными результатами нагрузочной пробы, неинформативной ЭКГ, а также для идентификации жизнеспособного миокарда;
- стратификация риска: у пациентов с инфарктом миокарда и и лиц с высоким риском кардиоваскулярных осложнений перед некардиохирургических операциях;
- оценка результатов хирургического и интервенционного лечения: проходимости шунтов к коронарным артериям, эффективности ангиопластики, динамическая оценка эффективности тромболитической терапии;
- диагностика инфаркта миокарда при рецидивирующем болевом синдроме, неинформативной ЭКГ и увеличении концентрации тропонина в плазме крови.
- оценка жизнеспособности миокарда при токсическом поражении миокарда
КАК ПРОВОДИТСЯ РАДИОНУКЛИДНОЕ ИССЛЕДОВАНИЕ МИОКАРДА
Обследование выполняется в двух режимах - в «покое» (RESТ) и «нагрузке» (STRESS). Последнее осуществляется путем имитации физической нагрузки введением фармакологического лекарственного средства. Данные анализа объективно отражают состояние сосудистого обеспечения, унифицированную выраженность нарушений и «бассейн» изменений. Сравнении полученных результатов обеспечивает возможность как своевременно обеспечить хирургическое вмешательство и стентирование, так и отказаться от него.
Определение жизнеспособности миокарда у больных с ишемической болезнью сердца при помощи стресс-эхокардиографии с добутамином.
Одной из задач лечения ишемической болезни сердца (ИБС) является улучшение систолической функции левого желудочка (ЛЖ), которая может быть нарушена как вследствие перенесенного инфаркта миокарда (ИМ), так и в результате хронической гипоперфузии миокарда при наличии значимого сужения венечных артерий. Таким образом, асинергичные участки миокарда - это не всегда необратимые повреждения или рубец. В таких случаях особый интерес представляет определение зон миокарда с нарушенной сократимостью, в которых возможно улучшение функции после восстановления кровоснабжения - реваскуляризации путем шунтирования или стентирования венечных артерий.
В 1989 г. S.H. Rahimtoola и соавторы [20] дали определение гибернированному миокарду как "миокарду с нарушенной сократимостью в состоянии покоя в связи с ограничением коронарного кровотока, способного к частичному или полному восстановлению сократительной функции при увеличении доставки кислорода". Еще ранее, в 1975 г., G.R. Heyndrickx и соавторы впервые предложили концепцию "оглушенного" миокарда, получившую дальнейшее развитие в работе E. Braunwald и R.A. Kloner (1982), в соответствии с которой после короткого эпизода ишемии может иметь место обратимое нарушение сократимости миокарда [8, 9, 12]. До сих пор не уточнены молекулярные механизмы гибернации и остается открытым вопрос, являются ли изменения миокарда атрофическими или дегенеративными [23]. Чаще всего причиной нарушения сократительной функции сердца является ИМ, реже - хроническая гипоперфузия, связанная с выраженным атеросклеротическим сужением просвета венечных артерий. Оглушенный и гибернированный миокард считают жизнеспособным, о чем свидетельствует улучшение или полное восстановление исходно сниженной сократимости при восстановлении коронарного кровотока у больных с хронической ИБС. В ряде исследований было показано, что у более чем 50 % пациентов со сниженной глобальной систолической функцией ЛЖ возможно клинически значимое ее улучшение после хирургической реваскуляризации [17]. При разном исходном функциональном состоянии миокарда от 22 до 60 % сегментов ЛЖ с нарушенной сократимостью являются жизнеспособными [6, 15, 18]. Выявление жизнеспособного миокарда позволяет прогнозировать улучшение сократимости после хирургической реваскуляризации у пациентов с ИБС и имеет особое значение для отбора пациентов, у которых проведение реваскуляризации будет максимально эффективным [16, 19].
Выявление жизнеспособного миокарда при стресс-эхокардиографии с добутамином основано на определении улучшения региональной систолической функции ЛЖ в ответ на инотропную стимуляцию низкими дозами добутамина (5-10 мкгЧкг-1Чмин-1). Другим маркером жизнеспособности миокарда, имеющим значение для прогнозирования улучшения глобальной систолической функции ЛЖ после реваскуляризации, является увеличение глобальной фракции выброса (ФВ) ЛЖ на 5 % и более после введения низких доз добутамина у пациентов с исходно сниженной ФВ (менее 30 %) [4, 18]. Эффективность реваскуляризации зависит от ряда факторов: достижение адекватной анатомической реваскуляризации, состояние ЛЖ в целом, протяженность рубцового участка, наличие аневризмы ЛЖ. Кроме того, необходимо большое количество жизнеспособного миокарда (более 25 % от площади всего ЛЖ), чтобы прогнозировать улучшение глобальной систолической функции ЛЖ и увеличение ФИ на 5 % после реваскуляризации [5, 15, 16]. Данные литературы относительно прогноза для выживаемости пациентов после реваскуляризации при отсутствии жизнеспособного миокарда по данным стресс-эхокардиографии с добутамином противоречивы [7]. Результаты метаанализов показали, что наименьший уровень выживаемости был у пациентов с наличием жизнеспособного миокарда, которым не проводили реваскуляризацию, а после проведения реваскуляризации больным, у которых не был выявлен жизнеспособный миокард с помощью различных методов, выживаемость не увеличивалась [14] или даже ухудшалась [3].
Цель нашего исследования - определить значение стресс-эхокардиографии с добутамином для прогнозирования улучшения региональной систолической функции левого желудочка после стентирования венечных артерий у пациентов с перенесенным инфарктом миокарда с зубцом Q, а также оценить ценность таких критериев жизнеспособного миокарда, как двухфазный ответ и стойкое улучшение сократительной функции при проведении стресс-эхокардиографии с добутамином.
Материал и методы
Для оценки диагностической значимости стресс-эхокардиографии с добутамином в выявлении жизнеспособного миокарда было проведено обследование 15 пациентов в возрасте в среднем (54±6) лет (из них 2 женщины) с ранее перенесенным ИМ с зубцом Q давностью (5,6±3,0) мес.
Всего в динамике оценивали функцию 113 сегментов с исходными нарушениями сократимости у 15 больных, до и после стентирования. До реваскуляризации пациентам проводили стресс-эхокардиографию с добутамином. Критерием жизнеспособности сегмента ЛЖ считали улучшение его сократимости на любом этапе проведения пробы, причем ответ был разделен на "двухфазный" - при улучшении сократимости на малых дозах добутамина (5-10 мкгЧкг-1Чмин-1) и ухудшении на последующих этапах введения добутамина, и "стойкое улучшение" - улучшение на малых или пиковых дозах добутамина и отсутствии последующего ухудшения сократимости сегмента ЛЖ. Нежизнеспособными считали сегменты без улучшения сократимости - с фиксированным (сократимость не изменялась) или ишемическим (сократимость ухудшалась) ответом.
Полную хирургическую реваскуляризацию миокарда методом стентирования выполнили всем пациентам в течение 7-30 дней после стресс-эхокардиографии с добутамином. В среднем одному пациенту было установлено (2,27±1,22) стента. Исходная медикаментозная терапия пациентов включала - аспирин (14 пациентов), b-адреноблокаторы (13 пациентов), ингибиторы ангиотензинпревращающего фермента (11 пациентов), статины (6 пациентов), нитраты длительного действия (9 пациентов). Трое пациентов получали мочегонную терапию в связи с симптомами застойной сердечной недостаточности. После проведения стентирования все пациенты в течение полугода принимали клопидогрель (75 мг/сут), затем продолжили прием аспирина (100 мг/сут), статины и прекратили прием нитратов длительного действия; остальная терапия практически не изменялась. Повторные эхокардиографические исследования проводили через 3, 6 и 12 мес после стентирования. При этом оценивали показатели глобальной (ФВ ЛЖ, суммарный индекс сократимости) и региональной систолической функции ЛЖ (сократимость каждого сегмента ЛЖ оценивали в динамике в баллах). Велоэргометрию (ВЭМ) проводили до операции и через 6 мес после нее 12 из 15 пациентов. Диагностическая ценность стресс-эхокардиографии в выявлении жизнеспособного миокарда выражалась в показателях - чувствительность, специфичность, диагностическая точность (ДТ), ППЗ и ОПЗ, определяемых в процентах.
Данные исследования представлены в виде средних показателей, стандартных отклонений от среднего, процентного соотношения встречаемости показателя в группах. Статистическую обработку результатов проводили с использованием программы "Statistica 5.0". Достоверность различий средних показателей в сравниваемых группах проводили на основе t-критерия Стьюдента. Различия в диагностической эффективности проводились с помощью теста МакНемара и c2 критерия Йетса. Различия считали достоверными при Р
Результаты и их обсуждение
Данные о сократимости исследуемых сегментов представлены в табл. 3. Сегменты, сократимость которых улучшилась (отмечены "+" в таблице), были расценены как жизнеспособные. Улучшением сократимости сегмента ЛЖ считалось изменение гипокинезии на нормокинезию, акинезии и дискинезии на гипокинезию или нормокинезию. При исходной дискинезии изменение в сторону акинезии не считалось улучшением сократимости. Те сегменты, сократимость которых не улучшилась (отмечены "-" в таблице), расценивались как нежизнеспособные.
Через 6 мес после реваскуляризации отмечено улучшение сократимости наибольшего количества сегментов ЛЖ, причем сегменты с двухфазным ответом показали несколько больший прирост сократимости, чем сегменты со стойким улучшением сократимости (соответственно 77 и 64,5 %, Р>0,05). Среди сегментов, расцененных как нежизнеспособные, сегменты с фиксированным ответом показали улучшение сократимости в 37 % случаев через 3 мес после реваскуляризации, и в 29 % случаев через 6 и 12 мес, в то время как сегменты с ишемическим ответом показали несколько большее улучшение сократимости через 6 и 12 мес - в 43 % сегментах отмечено улучшение или восстановление сократимости (Р>0,05). Не отмечено статистических различий в предсказующем значении для восстановления сократимости между двухфазным ответом и стойким улучшением сократимости и между фиксированным и ишемическим ответами, хотя нельзя не отметить низкое предсказующее значение ишемического ответа для оценки миокарда как нежизнеспособного (57 % по сравнению с 71 % через 6 и 12 мес).
Через 6 мес после реваскуляризации чувствительность стресс-эхокардиографии с добутамином для выявления жизнеспособного миокарда составила 80,6 %, специфичность - 54,3 %, точность - 69,9 %, ППЗ - 72 %, ОПЗ - 65,8 %. Стресс-эхокардиография была достоверно более информативной для прогнозирования улучшения сократимости через 6 мес после стентирования (ППЗ составило 53,3; 72 и 65,3 % соответственно через 3, 6 и 12 мес, Р<0,05), в то время как отсутствие улучшения сократимости прогнозировалось с одинаковой точностью на этапах 3, 6 и 12 мес после стентирования (ОПЗ составило 65,8 %).
Ценность стресс-эхокардиографии с добутамином для определения жизнеспособного миокарда также может быть представлена в виде графиков, наглядно демонстрирующих процентное отношение истинных результатов.
Относительно низкая специфичность обусловлена, вероятно, тем, что нежизнеспособные сегменты ЛЖ были расценены как жизнеспособные за счет увеличения амплитуды их систолического движения вслед за соседними жизнеспособными сегментами. В основном ошибки были характерны для сегментов с исходным акинезом. Другой возможной причиной ошибок мы считаем смещение плоскости сканирования на пиковых дозах добутамина при увеличении ЧСС.
Среди сегментов с исходными нарушениями сократимости было 68 - с гипокинезией, 38 - с акинезией и 7 - с дискинезией. Через 3 мес после реваскуляризации было отмечено улучшение сократимости у 32 (47,1 %) сегментов с гипокинезией, у 21 (55,3 %) сегмента с акинезией и не отмечалось для сегментов с исходной дискинезией. Через 6 мес улучшение сократимости отмечено у 73,5 % сегментов с гипокинезией (50 сегментов), у 44,7 % сегментов с акинезией (17 сегментов) и не отмечалось для сегментов с исходной дискинезией. Через 12 мес у 48 (70,6 %) сегментов с исходной гипокинезией, у 13 (34,1 %) сегментов с исходной акинезией и у 1 (14,3 %) сегмента с исходной дискинезией отмечали улучшение сократимости.
Таким образом, наибольший инотропный потенциал был отмечен для сегментов с исходной гипокинезией, причем для них отмечался рост восстановления или улучшения сократимости со временем, в то время как сегменты с исходной акинезией показали меньшее улучшение сократимости, которое снижалось со временем. Для сегментов с исходными дискинезиями было показано отсутствие улучшения сократимости через 3 и 6 мес, и только в одном сегменте произошло улучшение через 12 мес, вероятнее всего за счет улучшения сократимости соседних сегментов.
Также был проведен анализ изменения сократимости после стентирования в соответствии с кровоснабжением сегментов ЛЖ. Исследуемые сегменты были разделены на 3 группы в зависимости от соответствия схеме кровоснабжения ЛЖ - сегменты с кровоснабжением за счет ПМЖВ ЛВА (n=70), ОВ ЛВА (n=22) и ПВА (n=21). Через 6 мес после реваскуляризации при эхокардиографическом исследовании сократимости ЛЖ были получены такие данные: для ПМЖВ из 47 сегментов, показавших улучшение сократимости при стресс-эхокардиографии с добутамином, у 37 сегментов было отмечено восстановление или улучшение сократимости (ППЗ=78,7 %), и у 10 сегментов сократимость не улучшилась; из 23 сегментов, расцененных как нежизнеспособные, у 14 сегментов не отмечено улучшения сократимости (ОПЗ=60,9 %) и у 8 сегментов отмечено улучшение сократимости. Из 18 сегментов, кровоснабжаемых ОВ и показавших улучшение при введении добутамина, восстановление сократимости было отмечено у 12 сегментов (ППЗ=66,7 %), и отсутствие улучшения - у 6 сегментов; все 4 сегмента, расцененные как нежизнеспособные, не показали улучшения сократимости через 6 мес (ОПЗ=100 %). Из 10 сегментов с кровоснабжением из ПВА, которые были расценены как жизнеспособные, восстановление сократимости отмечено у 5 сегментов (ППЗ=50 %), а из 10 сегментов без улучшения в ответ на стимуляцию добутамином отсутствие улучшения сократимости через 6 мес отмечено у 7 сегментов (ОПЗ=63,6 %) и в 3 сегментах отмечено улучшение сократимости.
Не обнаружено статистических различий между ППЗ и ОПЗ стресс-эхокардиографии для выявления жизнеспособного миокарда в бассейнах разных артерий, однако, как видно из представленных данных, отмечена тенденция к большему ППЗ для ПМЖВ и к меньшему ППЗ для ПВА, а также к меньшему ОПЗ для ПМЖВ. При расчете предсказующей значимости стресс-эхокардиографии с добутамином для ЛВА без разделения на ветви, было отмечено статистически значимое большее ППЗ для выявления жизнеспособного миокарда в бассейне ЛВА, чем в бассейне ПВА (соответственно 75,4 и 50 %, Р<0,05).
Таким образом, стресс-эхокардиография с добутамином является эффективным методом выявления жизнеспособного миокарда у пациентов с перенесенным ИМ с зубцом Q. ППЗ в отношении улучшения сократимости сегментов ЛЖ в нашем исследовании составило 72 %, ОПЗ - 65,8 %. Наибольшее улучшение сократимости было отмечено через 6 мес после проведения реваскуляризации методом стентирования венечных артерий. Улучшение сократимости после реваскуляризации отмечается чаще в сегментах ЛЖ с исходной гипокинезией, чем в сегментах с акинезией, и отсутствует в сегментах с дискинезиями. ППЗ стресс-эхокардиографии добутамином для выявления жизнеспособного миокарда в бассейне ЛВА выше, чем для ПВА (соответственно 75,4 и 50 %, Р<0,05). Для оценки сегментов ЛЖ как жизнеспособных возможно использование как двухфазного ответа на введение добутамина, так и стойкое улучшение сократимости на всех этапах проведения пробы. Отмечается несколько более низкое предсказующее значение ишемического ответа для оценки миокарда как нежизнеспособного по сравнению с фиксированным ответом. Проведение стентирования венечных артерий является эффективным для восстановления сегментарной сократимости при наличии гипокинезий, малоэффективно при наличии акинезий и неэффективно для улучшения сократимости в сегментах с дискинезиями. Процесс восстановления сократимости достигает максимума через 6 мес после реваскуляризации, что необходимо учитывать при оценке эффективности проведенного вмешательства.
1.Afridi I., Kleiman N.S., Raizner A.E., Zoghbi W.A. Dobutamine echocardiography in myocardial hibernation // Circulation. - 1995. - Vol. 91. - P. 663-670.
2.Agati L., Arata L., Luongo R. et al. Assessment of severity of coronary narrowings by quantitative exercise echocardiography and comparison with quantitative arteriography // Amer. J. Cardiology. - 1991. - Vol. 67. - P. 1201-1207.
3.Allman K.C., Shaw L.J., Hachamovitch R., Udelson J.E. Myocardial viability testing and impact of revascularization on prognosis in patients with coronary artery disease and left ventricular dysfunction: a meta-analysis // J. Amer. Coll. Cardiology. - 2002. - Vol. 39, № 7. - P. 1151-1158.
5.Bax J.J., van der Wall E. E., Harbinson M. Radionuclide techniques for the assessment of myocardial viability and hibernation // Heart. - 2004. - Vol. 90. (Suppl.). - P. 26-33.
6.Bax J.J., Visser F.C., Poldermans D. et al. Time course of functional recovery of stunned and hibernating segments after surgical revascularization // Circulation. - 2001. - Vol. 104 (Suppl. I). - P. 314-318.
7.Bonow R. Identification of viable myocardium // Circulation. - 1996. - Vol. 94. - P. 2674-2680.
8.Braunwald E., Kloner R.A. The stunned myocardium: prolonged, postischemic ventricular dysfunction // Circulation. - 1982. - Vol. 66. - P. 1146-9.
9.Braunwald E., Rutherford J.D. Reversible ischemic left ventricular dysfunction: evidence for the "hibernating myocardium" // J. Amer. Coll. Cardiology. - 1986. - Vol. 8. - P. 1467-1470.
10.Honma H.H., Kusama Y., Matsuzaki T. et al. Resting ultrasonic tissue characterization and dobutamine stress echocardiography for prediction of functional recovery in chronic left ventricular ischemic dysfunction // Jpn. Circ. J. - 2001. - Vol. 65. - P. 381-388.
11.Kaandorp T.A.M., Lamb H.J., van der Wall E.E. et al. Cardiovascular MR to assess myocardial viability in chronic ischemic LV dysfunction // Heart. - 2005. - Vol. 91, № 10. - P. 1359-1365.
14.Lee K.S., Marwick T.H., Cook S.A. et al. Prognosis of patients with left ventricular dysfunction, with and without viable myocardium after myocardial infarction. Relative efficacy of medical therapy and revascularization // Circulation. - 1994. - Vol. 90. - № 6. - P. 2687-2694.
15.Marwick T.H., Zuchowski C., Lauer M.S. et al. Functional status and quality of life in patients with heart failure undergoing coronary bypass surgery after assessment of myocardial viability // J. Amer. Coll. Cardiology. - 1999. - Vol. 33, № 3. - P. 750-758.
16.Meluzin J., Cerny J., Frelich M.S. et al. Prognostic value of the amount of dysfunctional but viable myocardium in revascularized patients with coronary artery disease and left ventricular dysfunction // J. Amer. Coll. Cardiology. - 1998. - Vol. 32. - P. 912-920.
17.Meluzin J., Cerny J., Spinarova L. et al. Prognosis of patients with chronic coronary artery disease and severe left ventricular dysfunction. The importance of myocardial viability // Eur. J. Heart Fail. - 2003. - Vol. 5. - № 1. - P. 85-93.
20.Rahimtoola S.H. Hibernating myocardium has reduced blood flow at rest that increases with low-dose dobutamine // Circulation. - 1996. - Vol. 94. - P. 3055-3061.
21.Rahimtoola S.H. The hibernating myocardium // Amer. Heart J. - 1989. - Vol. 117. - P. 211-221.
22.Shulz R., Heusch G. Hibernating myocardium // Heart. - 2000. - Vol. 16, № 6. - P. 587-594.
23.Udelson E.J. Steps forward in the assessment of myocardial viability in left ventricular dysfunction // Circulation. - 1998. - Vol. 97, № 9. - P. 833-838.
24.Underwood S.R., Bax J.J., vom Dahl J. et al. Imaging techniques for the assessment of myocardial hibernation. Report of a Study Group of the European Society of Cardiology // Eur. Heart J. - 2004. - Vol. 25, № 10. - P. 815-836.
М.И. Лутай, Е.А. Немчина, А.В. Цыж, И.П. Голикова.
Национальный научный центр "Институт кардиологии им. акад. Н.Д. Стражеско" АМН Украины, г. Киев.
Сегменты, сократимость которых улучшилась (отмечены "+" в таблице), были расценены как жизнеспособные. Улучшением сократимости сегмента ЛЖ считалось изменение гипокинезии на нормокинезию, акинезии и дискинезии на гипокинезию или нормокинезию. При исходной дискинезии изменение в сторону акинезии не считалось улучшением сократимости. Те сегменты, сократимость которых не улучшилась (отмечены "-" в таблице), расценивались как нежизнеспособные.
Значение и показания для диагностики жизнеспособного миокарда
Российский университет дружбы народов, Москва;
НУЗ «Центральная клиническая больница №2 им. Н.А. Семашко» ОАО «РЖД», Москва
Российский университет дружбы народов, Москва;
КБУЗ «Краевая больница №2» Минздрава Хабаровского края, Хабаровск ,
ГАУЗ Московской области «Центральная городская клиническая больница Реутова», кафедра сердечно-сосудистой хирургии Российского университета дружбы народов, Москва, Россия, клиника аортальной и сердечно-сосудистой хирургии Первого Московского государственного медицинского университета им. И.М. Сеченова, Москва, Россия
Кафедра госпитальной хирургии РУДН, Москва;
НУЗ ЦКБ №2 им. Н.А. Семашко ОАО "РЖД", Москва
Российский университет дружбы народов, Москва
кафедра сердечно-сосудистой хирургии Российского университета дружбы народов, Москва, Россия
Жизнеспособный миокард как критерий успешного эндоваскулярного лечения больных с постинфарктным кардиосклерозом
Определена роль и целесообразность оценки жизнеспособности миокарда методом стресс-эхокардиографии с добутамином у больных с постинфарктным кардиосклерозом при планировании эндоваскулярных вмешательств. Показано, что восстановление коронарного кровотока в зоне жизнеспособного миокарда способствует быстрому и лучшему восстановлению кинетики гибернированного миокарда, что в целом повышает эффективность чрескожных коронарных вмешательств у данной группы больных и снижает частоту необоснованных эндоваскулярных вмешательств.
Широкое распространение эндоваскулярных вмешательств во многом изменило тактику лечения больных ишемической болезнью сердца (ИБС). Тем не менее число больных с осложненным течением ИБС в виде прогрессирующей дисфункции левого желудочка, ишемического ремоделирования сердца, застойной сердечной недостаточности продолжает неуклонно расти. У таких больных часто выявляют многососудистое атеросклеротическое поражение коронарного русла [3, 6].
Как известно, при хроническом течении ИБС наблюдают мозаичное поражение миокарда, при котором участки неизмененного миокарда могут чередоваться с зонами нарушенной систолической и диастолической функций. Стойкие изменения кинетики миокарда обычно обусловлены его некротическим поражением с последующим формированием рубцовой ткани. Однако локальные нарушения сократимости миокарда могут быть вызваны развитием обратимой миокардиальной дисфункции на фоне длительно существующей ишемии. Такие участки миокарда содержат кардиомиоциты, в которых сохранен основной клеточный метаболизм, но они активно не сокращаются, а в случае восстановления коронарного кровотока могут вернуться к нормальному функционированию [2, 5]. Это состояние получило название «гибернация миокарда» [12].
Тем не менее проведенные исследования показывают, что подобное равновесие сохраняется лишь в течение определенного срока, и без своевременного восстановления перфузии ишемизированной зоны гибернирующий миокард может погибнуть [4, 7, 10].
Исследование систолической функции миокарда с помощью трансторакальной эхокардиографии в покое не позволяет достоверно судить о жизнеспособности сегментов с нарушенной кинетикой.
Важной отличительной особенностью обратимой дисфункции миокарда является наличие положительного инотропного резерва, который проявляется увеличением сократимости в ответ на инотропную стимуляцию. Положительный инотропный резерв может быть выявлен в случае нетрансмурального поражения миокарда за счет наличия в этих зонах неповрежденных кардиомиоцитов, способных увеличить свою сократимость при нагрузке [11].
В литературе описано несколько методов определения жизнеспособности миокарда у больных постинфарктным кардиосклерозом (ПИКС). Наиболее апробированный метод оценки жизнеспособности миокарда — перфузионная однофотонная эмиссионная компьютерная томография с технетрилом (метоксиизобутил изонитрила, меченый 99m Тс). Захват и внутриклеточная задержка радиофармпрепарата, меченого 99m Тс, зависят от целостности клеточных мембран и функциональной сохранности митохондрий, что служит основанием для их применения в оценке жизнеспособности миокарда. Однако имеются сведения, что специфичность всех радиофармакологических методов при определении жизнеспособного миокарда составляет 50—60% [9].
«Золотым стандартом» для оценки жизнеспособности миокарда принято считать позитронно-эмиссионную томографию с 18 F-деоксиглюкозой, позволяющую получать информацию о метаболизме глюкозы в гипоперфузируемой зоне миокарда [14]. Однако в отечественной практике широкое применение позитронно-эмиссионной томографии ограничено экономическими причинами.
В настоящее время ведется большое число дискуссий в отношении метода стресс-эхокардиографии с добутамином, который можно использовать для определения жизнеспособности миокарда у больных ПИКС ввиду его высокой специфичности и безопасности для больного, а также экономической выгоды.
Добутамин является мощным агонистом β 1 -рецепторов, его эффект на α 1 — и β 2 -рецепторы выражен меньше. В низких дозах (5—10 мкг/кг/мин) он способен повышать сократимость жизнеспособного миокарда без существенного повышения частоты сердечных сокращений. Однако в больших дозах (20—40 мкг/кг/мин) добутамин имитирует физическую нагрузку, увеличивая частоту сердечных сокращений, повышая артериальное давление, что приводит к увеличению потребности миокарда в кислороде. Двухфазный ответ (в виде увеличения систолического прироста при использовании малых доз добутамина и ухудшения сократимости миокарда при использовании высоких доз) из-за несоответствия между доставкой кислорода и потребностью в нем позволяет отнести добутаминовую стресс-эхокардиографию к специфичным методам для определения жизнеспособности миокарда [8].
Однако, несмотря на то что метод стресс-эхокардиографии с добутамином изучается в мире с начала 90-х годов XX века, по непонятным причинам он остается невостребованным в реальной клинической практике большинства лечебных учреждений России.
Цель работы — определение роли и прогностической значимости оценки жизнеспособности миокарда с помощью метода стресс-эхокардиографии с добутамином при планировании эндоваскулярного лечения больных ПИКС в реальной клинической практике.
Материал и методы
В период с января 2012 г. по май 2014 г. в Центре сердечно-сосудистой патологии НУЗ «Центральная клиническая больница № 2 им. Н.А. Семашко» ОАО «РЖД» проводили проспективное исследование, в которое был включен 131 больной с ПИКС. Исследование одобрено Локальным этическим комитетом Центральной клинической больницы № 2 им. Н.А. Семашко ОАО «РЖД».
Критерии включения: стенокардия II—III функционального класса (ФК) по классификации CCS (Canadian Cardiovascular Society); документальное подтверждение ишемии миокарда (по данным нагрузочных тестов); окклюзия или критический стеноз одной или нескольких коронарных артерий по данным цифровой ангиографии; наличие сегментов нарушенной локальной сократимости миокарда левого желудочка; подписанное информированное согласие пациента на участие в исследовании.
Критерии исключения: острый коронарный синдром; стенокардия IV ФК на момент рандомизации; техническая невозможность проведения эндоваскулярного вмешательства; многососудистое поражение коронарного русла, при котором балл по шкале SYNTAX ≥32; наличие другого хронического заболевания, которое могло бы повлиять на ближайший прогноз; отказ пациента от участия в исследовании.
Временно́й интервал от момента инфаркта до включения в исследование составлял от 3 до 18 мес (в среднем 8,5±1,4 мес). Всем больным на этапе отбора проводилась коронароангиография, велоэргометрия, трансторакальная эхокардиография в покое.
Больные были рандомизированы на две группы. В 1-й группе (n=77) эндоваскулярные вмешательства на окклюзированных артериях проводили на основании данных нагрузочных тестов и коронарографии; во 2-й группе (n=54) у больных определяли жизнеспособность миокарда в зонах нарушенной кинетики с последующим выполнением эндоваскулярных вмешательств только на артериях, кровоснабжающих зону жизнеспособного миокарда.
Для оценки жизнеспособности миокарда и динамики изменения локальной кинетики в послеоперационном периоде выполняли стресс-эхокардиографию с добутамином, которую проводили в соответствии со стандартным протоколом, включая определение прироста систолического утолщения миокарда в зонах с нарушенной локальной сократимостью при введении малых доз добутамина, а также ухудшение имеющихся и/или появление новых нарушений региональной сократимости при введении больших доз препарата [1, 13].
Добутамин (HEXAL, Германия) вводили с помощью инфузомата с интервалом в 3 мин в дозах 5, 10, 20, 40 мкг/кг/мин. При частоте сердечных сокращений менее 85% от предельно допустимой по возрасту и отсутствии критериев прекращения пробы дополнительно после введения максимальной дозы добутамина внутривенно вводили по 0,5 мг атропина каждые 2 мин до достижения критериев прекращения теста (максимально до 2 мг атропина в зависимости от массы тела больного).
Эхокардиографическое изображение записывали исходно в покое и в конце каждой ступени, в четырех основных позициях: парастернальной левожелудочковой по длинной и короткой оси, апикальной четырехкамерной и апикальной двухкамерной. На протяжении всего исследования параллельно осуществляли контроль и запись ЭКГ, измерение артериального давления на каждой ступени нагрузки.
Пробу прекращали: при достижении субмаксимальной физической (электрофизиологической) нагрузки, введении максимально возможной дозы фармакологического препарата, появлении признаков нарушения локальной сократимости в сегментах с исходно неизмененной кинетикой, ухудшении сократимости исходно пораженных сегментов, при развитии приступа стенокардии или ее эквивалентов, развитии приступа удушья или выраженной одышки, ишемической динамики по данным ЭКГ, появлении жизнеугрожающих нарушений ритма и проводимости в виде частых политопных, групповых, ранних желудочковых экстрасистол, пароксизмальных нарушений ритма, повышении систолического артериального давления более 230 мм рт.ст., диастолического артериального давления более 130 мм рт.ст.
Результаты оценивали путем одновременного выведения на экран и сравнения четырех эхокардиографических изображений, соответствующих каждой ступени нагрузки. Оценка локальной сократимости проводилась по 4-балльной шкале 16-сегментарной модели с расчетом индекса нарушения региональной сократимости. Индекс рассчитывался как отношение суммы баллов нарушения локальной сократимости каждого сегмента левого желудочка к количеству анализируемых сегментов, где: нормокинез — 1 балл; гипокинез — 2 балла, акинез — 3 балла, дискинез — 4 балла.
Жизнеспособными считали сегменты с улучшением показателя локальной сократимости на 1 балл и более. Пробу признавали отрицательной при отсутствии прироста систолического утолщения миокарда на малых дозах добутамина (5, 10 мкг/кг/мин) или ухудшения сократимости миокарда на фоне введения больших доз (20, 40 мкг/кг/мин).
По клинико-демографическим и ангиографическим показателям группы были сопоставимы между собой (табл. 1, 2).
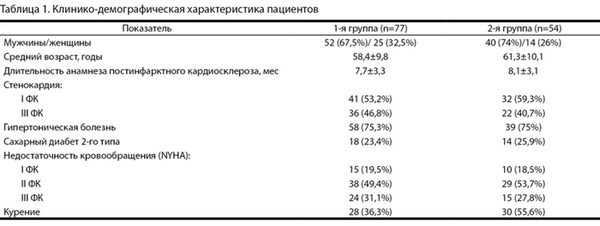
Таблица 1. Клинико-демографическая характеристика пациентов

Таблица 2. Ангиографическая характеристика поражений коронарных артерий
Эндоваскулярные вмешательства выполняли на цифровой ангиографической установке Innova 3100 IQ , «General Electric». Визуализацию зон нарушенной локальной кинетики проводили на аппарате Vivid 3, «General Electric».
Критериями ангиографического успеха стентирования считали: кровоток TIMI III, остаточный стеноз в артерии менее 30%, отсутствие признаков диссекции типа D—F согласно классификации NHBLI.
Всем больным была подобрана оптимальная медикаментозная терапия по поводу ИБС (ингибиторы ангиотензинпревращающего фермента, β-адреноблокаторы, статины, антиагрегантные препараты: клопидогрел в дозе 75 мг 1 раз в сут, ацетилсалициловая кислота). После эндоваскулярного вмешательства антиагрегантные препараты больные принимали в течение 12 мес.
Оценку нарушения локальной кинетики проводили перед проведением чрескожного коронарного вмешательства (осмотр 1), перед выпиской больного из стационара (осмотр 2) и через 12 мес после операции (осмотр 3).
Ближайшие результаты исследования оценивали по следующим критериям: выживаемость, частота сердечно-сосудистых осложнений (смерть, инфаркт миокарда, экстренные повторные вмешательства), регресс стенокардии на 2 и более функциональных класса, увеличение толерантности к физической нагрузке, изменение локальной кинетики миокарда.
Отдаленные результаты оценивали по следующим критериям: выживаемость, частота сердечно-сосудистых осложнений (смерть, инфаркт миокарда, повторные вмешательства), частота рестеноза и тромбоза стента, изменение локальной кинетики миокарда.
Статистический анализ результатов проводили с использованием пакета программ MS Statistica 7.0. Для анализа сопряженности применялся критерий χ 2 Пирсона, для оценки значимости различий между двумя группами — t-критерий Стьюдента, а для множественного сравнения использовали F-критерий и критерий Ньюмена—Кейлса.
Результаты
Всем больным были имплантированы стенты с лекарственным покрытием. Всего имплантировано 194 стента (среднее количество стентов на одного человека 1,57±0,69), из них в 1-й группе — 141 стент (среднее количество стентов на одного человека 1,8±0,02), а во 2-й группе — 67 стентов (среднее количество стентов на одного человека — 1,3±0,16) (р<0,05).
Эндоваскулярное вмешательство успешно выполнено у 91,6 и 96,2% больных соответственно. У 8 больных технически было невозможно выполнить эндоваскулярное вмешательство, в связи с чем указанные больные были выведены из исследования. Таким образом, в дальнейший анализ вошли 123 больных: 71 больной в 1-й группе и 52 больных во 2-й группе.
У всех больных, включенных в исследование, уже к концу госпитализации отмечали клиническое улучшение, проявлявшееся в уменьшении функционального класса стенокардии, и увеличении толерантности к физической нагрузке (табл. 3).
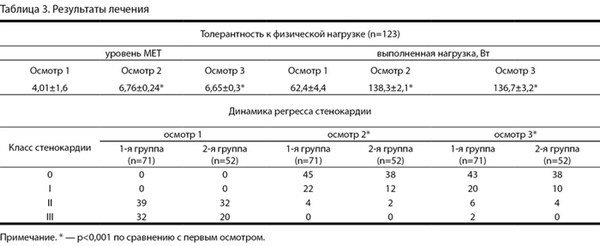
Таблица 3. Результаты лечения Примечание. * — р
Отдаленные результаты через 12 мес были прослежены у всех больных.
По данным коронарографии, причиной рецидива стенокардии у 3 больных явилось прогрессирование атеросклеротического процесса в других сегментах стентированных ранее артерий, потребовавшее повторных вмешательств, а у 2 других больных причиной рецидива стал поздний тромбоз стента, связанный с заменой оригинальных антиагрегантных препаратов на дженерики, также потребовавший повторного вмешательства. У 1 больного из 6 повторное вмешательство осуществляли на стентированном ранее сегменте артерии, в связи с развитием рестеноза в стенте.
Таким образом, частота повторных вмешательств на стентированном (целевом) сосуде и на стентированном ранее сегменте артерии среди всех больных, включенных в исследование, составила по 2,4%. При этом частота тромбоза стента, не сопровождающегося фатальным инфарктом миокарда, составила 1,6%.
По данным трансторакальной эхокардиографии, выполненной в предоперационном периоде, суммарно было исследовано 1136 сегментов миокарда, из них 770 сегментов миокарда были с исходным нарушением кинетики. При этом у больных из 1-й группы исходно кинетика была нарушена в 469 сегментах, а у больных из 2-й группы — в 301 сегменте (табл. 4).
Таблица 4. Динамика нарушений локальной сократимости миокарда левого желудочка
Как видно из представленных данных, динамика восстановления локальной кинетики была более выраженной во 2-й группе: количество сегментов с нарушенной кинетикой в 1-й группе уменьшилось на 8,5% ко второму осмотру и на 24,5% — к третьему, тогда как во 2-й группе уже к концу госпитализации количество сегментов с нарушением систолической функции сократилось на 15,8%, а к концу периода наблюдения на 44,6%, т. е. почти вдвое, по сравнению с исходными данными (p<0,0001). При этом происходило сокращение количества как гипокинетичных сегментов, так и сегментов с признаками акинеза.
Подобную динамику можно объяснить тем, что во 2-й группе отбор больных изначально предусматривал наличие жизнеспособного миокарда в зоне гибернации, в то время как в 1-ю группу могли входить больные как с жизнеспособным миокардом, так и с уже необратимыми нарушениями кинетики, что еще раз подтверждает эффективность восстановления кровотока в зоне жизнеспособного миокарда.
Заключение
Таким образом, метод стресс-эхокардиографии с добутамином, используемый для определения жизнеспособности миокарда у больных с ПИКС, может рассматриваться в качестве ключевого компонента алгоритма планирования эндоваскулярных вмешательств у больных с ПИКС с целью предотвращения нецелесообразных вмешательств на коронарных артериях, а также повышения эффективности чрескожных коронарных вмешательств у таких больных.
Читайте также:
- Патологическая анатомия рака легких. Гистология рака легкого
- Ранние проявления алкоголизма на ЭКГ. Признаки поражения предсердий сердца
- Дифференциальный диагноз поясничной боли. Диагностический подход при поясничной боли.
- Диагностика очагового туберкулеза легких. Инфильтративный туберкулез легких.
- Кавернозная гемангиома глаза: причины, диагностика, лечение
