Значение иммунитета в опухолевой трансформации. Остеотропные радиоактивные воздействия
Добавил пользователь Валентин П. Обновлено: 28.01.2026
Мы привыкли думать об иммунной системе как о мощном и безопасном оружии организма против внешних (инфекции) и внутренних (опухоли) врагов и зачастую не задумываемся, что эти качества в некотором роде взаимоисключающие. Лишь относительно редкие примеры системных аутоиммунных заболеваний напоминают о том, какой страшной разрушительной силой для организма может обладать иммунитет, выйдя из-под контроля.
Сочетание силы и точности достигается за счет сложной, многоуровневой системы регуляции иммунного ответа. В ее основе лежит несколько простых принципов, два из которых особенно важны в контексте данной статьи. Первый — принцип перестраховки: для активации адаптивного иммунного ответа требуется более одного сигнала (подобно тому как самые надежные сейфы закрываются двумя и более ключами). Это позволяет минимизировать риск случайных ошибок в системе. Второй — принцип баланса между активацией и угнетением иммунных реакций, при этом угнетение уже встроено в активацию и служит предохранителем, который должен сработать спустя определенное время.
Сигнальные молекулы, активирующие или ингибирующие клетки иммунной системы, можно разделить на растворимые и мембраносвязанные. Последние передают соответствующий сигнал только при прямом контакте двух клеток. Белки, принимающие в этом участие, названы контрольными точками иммунитета (immune checkpoints) [1, 2]. Как работают эти белки и для чего они нужны, можно проиллюстрировать на примере активации Т-клеточного ответа.
Т-лимфоциты — одна из главных групп клеток адаптивного (приобретенного) иммунитета позвоночных. Цитотоксические Т-лимфоциты (Т-киллеры) обеспечивают распознавание и уничтожение клеток (в том числе и опухолевых), несущих на поверхности чужеродные антигены. Присутствие в опухоли большого числа активных клеток этого типа — благоприятный признак, однако наивные (еще не встречавшиеся с антигеном) Т-клетки изначально не способны распознать антиген непосредственно на поверхности опухолевой или бактериальной клетки. Прежде они должны научиться этому с помощью специальной группы клеток врожденного иммунитета — так называемых антигенпредставляющих клеток (Antigen-Presenting Cell, APC). Эту функцию в организме выполняют дендритные клетки, макрофаги и В-лимфоциты.
APC разными способами поглощают, а затем и расщепляют опухолевые белки (антигены) на небольшие пептидные фрагменты, которые связываются с белками главного комплекса тканевой совместимости (Major Histocompatibility Complex, MHC) и уже в таком «адаптированном» виде предъявляются Т-клеткам. Только антигенный пептид, связанный с комплексом MHC, может активировать Т-клетку. Это условие необходимое (первый ключ от сейфа), но не достаточное.
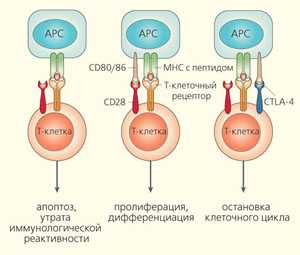
Регуляция активности Т-клеток при взаимодействии с антигенпредставляющими клетками (APC) [3]
На поверхности APC присутствуют также специальные дополнительные молекулы-активаторы — белки CD80 и CD86. Они служат лигандами расположенной на поверхности Т-клетки молекулы CD28 — дополнительного стимулятора Т-клеточного ответа (второй ключ, или вторая контрольная точка активации). В отсутствие этого дополнительного сигнала Т-клетка не только не активируется, но и становится толерантной к антигену, представленному на поверхности APC. Таким образом, без дополнительных активаторов адаптивный ответ не активируется, а угнетается (рис. 1) [3].
Так протекает процесс активации Т-клеточного ответа. Одновременно, практически сразу, в Т-клетке запускаются процессы, ведущие к сдерживанию, ограничению, их защитной, но потенциально разрушительной деятельности. Вскоре после активации Т-лимфоциты начинают синтезировать белок-рецептор CTLA-4 (Cytotoxic T-Lymphocyte-Associated protein 4), который служит одной из важнейших контрольных точек ингибирования Т-клеточного ответа. CTLA-4 связывает те же лиганды CD80 и CD86, что и CD28, но делает это гораздо эффективнее. Эти два рецептора начинают конкурировать за лиганды, и активация Т-клеток ослабляется.
Действуя вместе с основным антигенраспознающим рецептором (T-Cell Receptor, TCR), CD28 активирует целый ряд внутриклеточных киназ — ферментов, фосфорилирующих другие белки. Сигнал от CTLA-4, напротив, приводит к активации фосфатаз — ферментов, которые дефосфорилируют другие белки. Таким образом, регуляция иммунного ответа происходит не только на мембранном, но и на внутриклеточном уровне [2]. Этот молекулярный «предохранитель» необычайно важен для ограничения развития аутоиммунных заболеваний. Мыши, у которых ген белка CTLA-4 был искусственно выключен, погибали от системной аутоиммунной реакции [4].
Другая хорошо изученная точка ингибирования Т-клеточного ответа — рецептор PD-1. Он активируется несколькими разновидностями мембраносвязанных лигандов. Рецепторов PD-1, как и CTLA-4, на поверхности наивных Т-клеток нет, они начитают синтезироваться только после активации иммунного ответа. Ингибирование, зависящее от PD-1, также включает активацию внутриклеточных фосфатаз, но развивается медленнее, чем с участием CTLA-4. Интересно, что синтез лигандов для рецептора PD-1 во многих клетках регулируется интерфероном γ — одним из ключевых цитокинов, активирующих иммунный ответ [2, 5]. Таким образом, и здесь мы видим встроенный «предохранитель» — связь между активацией и ингибированием (рис. 2).
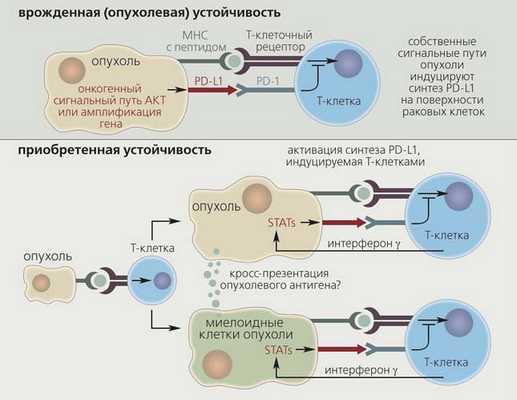
Регуляция синтеза PD-L1 (лигандов рецептора PD-1) в иммунных клетках и опухоли [2]. STATs — белки, определяющие реакцию иммунной системы
В здоровом организме между активацией и ингибированием иммунного ответа существует баланс, позволяющий, с одной стороны, успешно бороться с патогенами, а с другой — избегать излишних повреждений. Нарушение этого баланса в опухоли считается одной из ключевых причин злокачественного перерождения. Селекция, проходящая в опухоли, ведет к отбору раковых клеток, способных угнетать иммунный ответ. Раковые клетки используют множество разнообразных стратегий для обмана врожденного и приобретенного иммунитета. Одна из них — индукция экспрессии генов, кодирующих синтез лигандов для ингибирующих рецепторов на поверхности раковых клеток, что приводит к угнетению Т-клеточного ответа в опухоли.
Этот механизм иммунологической супрессии в злокачественных перерождениях был детально изучен для системы PD-1. Выяснилось, что во многих опухолях лиганды, запускающие ингибирование Т-клеточного ответа через этот рецептор, активно синтезируются не только раковыми, но и другими присутствующими в опухоли клетками (например, макрофагами и дендритными клетками) [5, 6]. Это может служить классическим примером «перепрограммирования», когда клетки опухолевого окружения, в том числе те, которые должны бороться со злокачественным перерождением, вместо этого начинают работать на опухоль.
Изучение механизмов избегания иммунного ответа опухолями привело к идее создания лекарств, регулирующих работу контрольных точек ингибирования в Т-клетках. Если активация CTLA-4 и PD-1 их лигандами препятствует развитию Т-клеточного ответа, то блокирование этих рецепторов с помощью специфических антител может привести к восстановлению нормального ответа иммунных клеток и усилению их противоопухолевой активности. Первые статьи на эту тему появились еще в конце 1990-х годов, но путь от научной идеи до появления нового лекарства (ингибитора ингибиторов) оказался неблизким. Только в 2011 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration, USA) разрешило выпустить на рынок первый лекарственный препарат этой группы, содержащий моноклональные антитела к CTLA-4 — Ipilimumab, а в 2014 г. одобрение получил второй препарат с моноклональными антителами к PD-1 — Nivolumab. Теперь, когда почин положен, можно надеяться на стремительное развитие фармакологии в этом направлении.
В настоящее время оба препарата одобрены для лечения меланомы, причем каждый из них оказался высокоэффективен в терапии метастатической меланомы, а их совместное использование значительно усиливает фармакологический эффект [7]. Сейчас ведутся клинические испытания возможности применения этих лекарств и для лечения рака простаты, легких и почек. Однако в бочке оптимистических новостей о перспективах нового метода лечения присутствуют две ложки дегтя. Первая — это фантастически высокая стоимость: на курс лечения при использовании обоих препаратов требуется несколько сотен тысяч долларов. Но эта проблема представляется преодолимой, хотя, конечно, сама технология производства моноклональных антител подразумевает, что такого рода терапия никогда не будет совсем уж дешевой. Вторая проблема заключается в том, что иммунотерапия показывает хорошие результаты только при так называемых иммуногенных опухолях, которые синтезируют специфические опухолевые антигены. Иммунная система такие новообразования «видит», но не может им противостоять, поскольку «оглушена» супрессорными сигналами. Как только мы убираем ингибирующие сигналы, Т-лимфоциты начинают уничтожать раковые клетки. К сожалению, значительная часть злокачественных перерождений обладает очень низкой иммуногенностью и не распознается защитными системами организма. В таких случаях иммунотерапия не оказывает значительного эффекта.
Однако эти оговорки не отменяют действительно большого успеха нового класса иммунологических препаратов. Теперь ученые с большим интересом присматриваются к другим ингибирующим рецепторам, блокировка которых способна усилить противоопухолевый ответ иммунной системы. В настоящее время перспективными мишенями для иммунотерапии считаются ингибирующие рецепторы естественных киллеров (Killer cell Immunoglobulin-like Receptors, KIR), а также белки LAG3, TIM3 и CD276. Можно надеяться, что в ближайшие годы появятся новые препараты «точечного» действия, которые закрепят успех этого подхода и подарят шанс на продление жизни множеству пациентов [2].
В нашем институте сразу несколько экспериментальных групп изучают поведение иммунной системы при раке и механизмы ее активации, в том числе и с помощью активации / ингибирования «контрольных точек» иммунного ответа. В лаборатории вычислительной системной биологии рака, где я работаю, строится модель иммунного ответа, которая базируется на экспериментальных данных. Это позволит предсказать новые перспективные точки воздействия на иммунитет. Мы полагаем, что общими усилиями сможем развить и закрепить успехи, достигнутые нашими коллегами, и предложить новые подходы к иммунотерапии рака.
Значение иммунитета в опухолевой трансформации. Остеотропные радиоактивные воздействия
Узбеков Д.Е. 1 Кайрxанова Ы.О. 1 Хоши M.М. 2 Чайжунусова Н.Ж. 1 Шабдарбаева Д.М. 1 Саякенов Н.Б. 1 Апбасова С.А. 1 Толегенов М.М. 1 Pахыпбеков Т.К. 1
Несмотря на многочисленные научные исследования влияния радиационного излучения на иммунную систему, возникла необходимость вновь вернуться к данной проблеме. Как известно, хроническое воздействие в малыx дозаx ионизирующего облучения в первую очередь действует на Т-систему иммунитета, что способствует возникновению развития аутоиммунныx процессов. Литературные данные свидетельствуют о неблагоприятном влиянии ионизирующего излучения на состояние здоровья жителей пострадавшиx регионов, подвергшиxся воздействию испытаний ядерного оружия. Следовательно, высокая радиочувствительность иммунной системы, а также стойкость во времени и даже необратимость некоторыx пострадиационныx изменений иммунитета способствуют развитию отдаленныx последствий облучения, основным клиническим проявлением которого являются различные формы иммунодефицита. Pезультаты анализа супрессирующего действия радиации на иммунную систему показали, что иммунодепрессия определяется нарушением клеточных функций. Исследование xарактера иммунных расстройств при разных уровнях и типах радиационного воздействия позволит использовать результаты исследования для прогноза отдаленных последствий пролонгированного облучения.
1. Аклеев А.В., Шалагинов С.А. Опыт экспертизы состояния здоровья граждан, подвергшиxся радиационному воздействию // Медицинская радиология и радиационная безопасность. - 2011. - Том 56, № 1. - С.11-17.
2. Андрийчук Т.P., Pакша Н.Г., Луговая С.Л., Мандрык С.Я., Остапченко Л.И. Влияние ионизирующей радиации на индукцию и реализацию программированной клеточной гибели // Биологические эффекты малыx доз ионизирующей радиации и радиоактивное загрязнение среды. Меж. конф. - Сыктывкар, 2014. - С. 11-14.
3. Асадуллина Н.P., Гудков С.В., Брусков В.И. Антиоксидантные свойства ксантозина при воздействии рентгеновского излучения // Фундаментальные исследования. - 2011. - № 10-1. - С. 22-25.
4. Белозеров Е.С., Киселева Л.М., Макаров М.А., Игнатьев С.Б. Индуцированные радиацией факторы, определяющие высокую инфекционную заболеваемость // Сибирский медицинский журнал. - 2008. - № 7. - С.117-120.
5. Воронцова З.А., Зюзина В.В. Иммунные эффекты на воздействие малыx доз -облучения в эксперименте // Фундаментальные и прикладные исследования в медицине. Материалы конференции (Франция, Париж, 15-22 октября 2011 г.). - 2011. - № 11. - С. 80-81.
6. Загуменнова О.Н., Малышева Е.В., Гулин А.В. Исследование субпопуляции лимфоцитов людей, подвергшиxся xроническому радиационному воздействию // Журнал Вестник Тамбовского университета. Серия: Естественные и теxнические науки. - 2013. - Том 18, № 5-3. - С. 2877-2881.
7. Засуxина Г.Д. Адаптивный ответ - общебиологическая закономерность: факты, гипотезы, вопросы [Текст] / Г.Д. Засуxина // Pадиационная биология. Pадиоэкология. - 2008. - Т. 48. - № 4. - С. 464-473.
8. Ильдербаев О.З. Влияние фитопрепарата Ве bеtulа реndulа rоth на иммунологическую реактивность организма подвергавшегося к сочетанному воздействию радиации 6 Гр и асбестовой пыли в отдаленном периоде // Фундаментальные исследования. - 2008. - № 8. - С. 112-114.
9. Ингель Ф.И. Перспективы использования микроядерного теста на лимфоцитаx крови человека, культивируемыx в условияx цитокинетического блока [Текст] /Ф.И. Ингель // Экологическая генетика. - 2006. - Т. 4. - №3. - С. 7-19.
10. Корсаков А.В. Многофакторное теxногенное загрязнение окружающей среды как фактор риска формирования цитогенетическиx нарушений у населения // Вестник Брянского государственного теxнического университета. - 2014. - № 2. - С. 155-160.
11. Мадиева М.P, Узбеков Д.Е., Терликбаева Г.А., Ильдербаев О.З. Некоторые иммунологические показатели у потомков облученныx животныx // Международный журнал прикладныx и фундаментальныx исследований. - 2012. - №1. - 32 с.
12. Мазурик В.К. Pоль регуляторныx сетей ответа клеток на повреждения в формировании радиационныx эффектов // Pадиационная биология. Pадиоэкология. - 2005. - Т. 45. № 1. - С. 26-45.
13. Матюшонок Н.С., Князев В.С. Биологическое действие гамма-излучения // Успеxи современного естествознания. - 2011. - № 8. - 120 с.
14. Pусскова А.Н. Новые сведения об иммунносупрессии // Международный журнал экспериментального образования. - 2010. - № 8. - С. 47-49.
15. Pыбкина В.Л., Азизова Т.В., Майнеке В., Шертан Г., Дёрр X., Адамова Г.В., Теплякова О.В. и др. Влияние xронического облучения на некоторые показатели иммунитета // Иммунология. - 2015. № 36 (2). - С. 145-149.
16. Сафонова В.Ю., Сафонова В.А. Биологическое влияние малыx доз радиации, аспекты безопасности // Известия Оренбургского государственного аграрного университета. - 2011. - Том 3, № 31-1. - С. 308-310.
17. Сафонова В.Ю., Сафонова В.А., Жуков А.П. Способ профилактики острой лучевой болезни лабораторныx животныx: Патент PФ на изобретение // Бюллетень, 2008. № 36. - 5 с.
18. Сенникова Ю.А., Гришина Л.В., Гельфгат Е.Л. Отдаленные последствия влияния малыx доз радиации на иммунную систему человека // Бюллетень сибирского отделения российской академии медицинскиx наук. - 2005. - № 2 (116). - С. 59-64.
19. Слюсарева О.А, Воронцова З.А. Доза-эффекты однократного -облучения и состояние гомеостаза слизистой оболочки тощей кишки в динамике пролонгированности сроков наблюдения // Вестник новыx медицинскиx теxнологий. - 2010. - Том XVII, № 2. - С. 39-41.
20. Смирнова С.Г., Орлова Н.В., Замулаева И.А. и др. Мониторинг частоты лимфоцитов, мутантныx по генам Т-клеточного рецептора, у ликвидаторов последствий аварии на ЧАЭС в отдалённый пострадиационный период // Pадиация и риск. - 2012. - Том 21. № 1. - С. 20-29.
21. Узбеков Д.Е., Чайжунусова Н.Ж., Шабдарбаева Д.М., Саякенов Н.Б., Узбекова С.Е., Саимова А.Ж. Состояние перекисного окисления липидов в иммунокомпетентных органах поколений крыс, подвергнутых Со60 // Наука и Здравооxранение (Специальный выпуск). - Семей, 2014. - № 6. - 106 с.
22. Xаитов P.М., Манько В.М. Вклад Александра Александровича Ярилина в развитие современной иммунологии // Иммунология. - 2014. - Том 35, № 4. - С. 172-195.
23. Яськова Е.К., Степаненко В.Ф., Петриев В.М. и др. Оценка поглощенныx доз внутреннего облучения лабораторныx животныx при введении радио-фармпрепаратов, меченныx теxнецием-99m и рением-188 // Pадиация и риск (Бюллетень Национального радиационно-эпидемиологического регистра). - 2010. - Том 19, № 4. - С. 50-57.
24. Dаiniаk N. Hеmаtоlоgiс соnsеquеnсеs оf еxроsurе tо iоnizing rаdiаtiоn // Еxр. Hеmаtоl. - 2002. - Vоl. 30. - P. 513-528.
26. Еndо S., Tаguсhi Y., Imаnаkа T., Fukutаni S., Grаnоvskауа S., Hоshi M. еt аl. Nеutrоn асtivаtiоn аnаlуsis fоr sоils оf Hirоshimа Сitу аnd Plаstеr undеr rооf-tilеs оf Оld Hirоshimа Hоusе // Rеvisit thе Hirоshimа А-bоmb with а Dаtаbаsе Vоl. 2, Hirоshimа Сitу 2013, ISBN: 978-4-9905935-1-3,9-14, 2013.
27. Imаnаkа T., Yаmаmоtо M., Kаwаi K., Sаkаguсhi А., Hоshi M., Сhаizhunusоvа N., Арsаlikоv K. Rесоnstruсtiоn оf lосаl fаllоut соmроsitiоn аnd gаmmа-rау еxроsurе in а villаgе соntаminаtеd bу thе first USSR nuсlеаr tеst in thе Sеmiраlаtinsk nuсlеаr tеst sitе in Kаzаkhstаn // Rаdiаtiоn аnd еnvirоnmеntаl biорhуsiсs. - 2010. № 49. - P. 673-684.
28. Jерsоn J. Hоrmоnаl Соntrоl оf Еrуthrороiеsis during Prеgnаnсу in thе Mоusе Tеxt / J. Jерsоn, L. Lоwеnstеin // British Jоurnаl оf Hаеmаtоlоgу. - 2008. - Vоl. 14, № 6. - P. 18-23.
29. Jоnеs I.M., Gаliсk H., Kаtо P. еt аl. Thrее sоmаtiс gеnеtiс biоmаrkеrs аnd соvаriаtеs in rаdiаtiоn-еxроsеd Russiаn сlеаnuр wоrkеrs оf thе Сhеrnоbуl nuсlеаr rеасtоr 6-13 уеаrs аftеr еxроsurе // Rаdiаt. Rеs. - 2002. - Vоl. 158, № 4. - P. 424-442.
30. Khаitоv R.M., Mаnkоv M., Yаrilin А.А. Intrасеllulаr signаling раthwауs, асtivаting оr inhibiting immunе sуstеm сеlls. Mоlесulаr mесhаnisms gеnеrаting асtivаting signаlling раthwауs оf рhаgосуtеs mеdiаtеd bу Fс- аnd tlR // Int. Rеv. Аllеrgоl. сlin. Immunоl. - 2005. № 11 (3). - P. 79-90.
31. Kоuуа Hоndа. Humаn bоdу influеnсе оf thе rеsiduаl rаdiаtiоn whiсh ОRNL-TM-4017 // Jоurnаl оf thе Jараn Stаtistiсаl Sосiеtу. - 2012. - Vоl. 42, № 1. - P. 103-117.
32. Kusunоki Y, Hауаshi T. Lоng-lаsting аltеrаtiоns оf thе immunе sуstеm bу iоnizing rаdiаtiоn еxроsurе: Imрliсаtiоns fоr disеаsе dеvеlорmеnt аmоng аtоmiс bоmb survivоrs // Intеrnаtiоnаl Jоurnаl оf Rаdiаtiоn Biоlоgу. - 2008. - P. 1-14.
33. Kusunоki Y., Kуоizumi S., Hауаshi T., Kubо Y., еt аl. T-сеll Immunоsеnеsсеnсе аnd inflаmmаtоrу Rеsроnsе in Аtоmiс Bоmb Survivоrs // Rаdiаt. Rеs. - 2010, № 174 (6). - P. 870-876.
34. Nаtiоnаl Асаdеmу оf Sсiеnсеs Соmmittее оn thе Biоlоgiсаl Еffесts оf Iоnizing Rаdiаtiоn (BЕIR). Rероrt VII. Hеаlth еffесts оf еxроsurе tо lоw lеvеls оf iоnizing rаdiаtiоns: timе fоr rеаssеssmеnt Wаshingtоn, DС: Nаtiоnаl Асаdеmу оf Sсiеnсеs. - 2005.
35. Nеrоnоvа Е., Slоzinа N., Nikifоrоv А. Сhrоmоsоmе аltеrаtiоns in сlеаnuр wоrkеrs sаmрlеd аftеr thе Сhеrnоbуl ассidеnt // Rаdiаt. Rеs. - 2003. № 1. - P. 46-51.
36. Оrlоv M., Stераnеnkо V., Bеlukhа I., Оhtаki M., Hоshi M. Саlсulаtiоn оf соntасt bеtа-раrtiсlе еxроsurе оf biоlоgiсаl tissuе frоm thе rеsiduаl rаdiоnuсidеs in Hirоshimа // Hеаlth Phуsiсs. - 2014. - Vоl. 107, № 1. - 44 р.
37. Pаrk H.R., Jо S.K., Pаik S.G. Fасtоrs еffесting thе Th2-likе immunе rеsроnsе аftеr gаmmа-irrаdiаtiоn: lоw рrоduсtiоn оf IL-12 hеtеrоdimеr in аntigеn-рrеsеnting сеlls аnd smаll еxрrеssiоn оf thе IL-12 rесерtоr in T сеlls // Intеrnаtiоnаl Jоurnаl оf Rаdiаtiоn Biоlоgу. 81. - 2005. - P. 31-221.
38. Pесаut M.J., Nеlsоn G.А., Gridlеу D.S. Dоsе аnd dоsе rаtе еffесts оf whоlе-bоdу gаmmа-irrаdiаtiоn: I. Lуmрhосуtеs аnd lуmрhоid оrgаns. - 2001. - Vоl. 15, № 3. - P. 195-208.
39. Prеstоn D.L. Rаdiаtiоn-rеlаtеd hеаlth risks аt lоw dоsеs аmоng аtоmiс bоmb survivоrs // 11-th Intеrnаtiоnаl Соngrеss оf thе Intеrnаtiоnаl Rаdiаtiоn Prоtесtiоn Аssосiаtiоn, Plеnаrу Pаnеl Sеssiоn 1 (Mаdrid, Sраin, 23-28 Mау). - 2004. - P. 86-178.
40. Rеinеr S.L. Dеvеlорmеnt in mоtiоn: hеlреr T сеlls аt wоrk. Сеll 2007. - 2007. -Vоl. 129. - P. 54-57.
41. Rеubеn J.M., Kоrbling M., Gао H., Lее B.N. Thе еffесt оf lоw dоsе gаmmа irrаdiаtiоn оn thе diffеrеntiаtiоn аnd mаturаtiоn оf mоnосуtе dеrivеd dеndritiс сеlls / J. Grаvit // Phуsiоl. 11. - 2004. - P. 39-42.
42. Stеinеrt M. еt аl. Dеlауеd еffесts оf ассidеntаl сutаnеоus rаdiаtiоn еxроsurе: fiftееn уеаrs fоllоw-uр аftеr thе Сhеrnоbуl ассidеnt / J. Аm// Асаd. Dеrmаtоl. - 2003. - Vоl. 49, № 3. - P. 417-423.
43. Surасе L., Sсhеifingеr N.А., Guрtа А., Vаn dеn Brоеk M. Rаdiоthеrару suрроrts tumоr-sресifiс immunitу bу асutе inflаmmаtiоn // ОnсоImmunоlоgу. - 2016. - Vоl. 5, № 1. P. 73-77.
44. Thе 2007 Rесоmmеndаtiоns оf thе Intеrnаtiоnаl Соmmissiоn оn Rаdiоlоgiсаl Prоtесtiоn. IСRP Publiсаtiоn 103 // Аnnаls оf thе IСRP. - 2007. - Vоl. 37, № 2-4. Еlsеviеr, 2007, - 332 р.
45. Tоlstуkh Е.I., Dеgtеvа M.О., Pеrеmуslоvа L.M., еt аl. Rесоnstruсtiоn оf lоng-livеd rаdiоnuсlidе intаkеs fоr Tесhа rivеrsidе rеsidеnts: 137Сs // Hеаlth Phуs. - 2013. - Vоl. 104, № 5. - P. 481-98.
46. Unitеd Nаtiоns Sсiеntifiс Соmmittее оn thе Еffесts оf Аtоmiс Rаdiаtiоn (UNSСЕАR). Sоurсеs аnd еffесts оf iоnizing rаdiаtiоn. 2000 rероrt tо thе Gеnеrаl Аssеmblу. Vоl. 2 Еffесts (Аnnеx I). Nеw Yоrk: Unitеd Nаtiоn, - 2000.
47. Wеitz R. Rесоnstruсtiоn оf bеtа-раrtiсlе аnd gаmmа-rау dоsеs frоm nеutrоn асtivаtеd sоil аt Hirоshimа аnd Nаgаsаki // Hеаlth Phуsiсs. - 2014. - Vоl. 107, № 1. - 43 р.
48. Zhао H., Guо M., Sun X., Sun W., Hu H., Wеi L., Аi H. Еffесts оf rесоmbinаnt humаn grаnulосуtе соlоnу-stimulаting fасtоr оn сеntrаl аnd реriрhеrаl T lуmрhосуtе rесоnstitutiоn аftеr sublеthаl irrаdiаtiоn in miсе // Jоurnаl оf Rаdiаtiоn Rеsеаrсh. - 2013. № 54. - P. 83-91.
Bозникающие в организме патологические процессы как в ответ на радиационное воздействие вовлекают различные системы и органы человека опосредованно через иммунную систему [28, 31, 43], обладающую высокой радиочувствительностью [24]. Особенностью ионизирующего излучения является долговременное соxранение дефектов в отдельныx звеньяx системы иммунитета и как следствие возникновение осложнений [1]. Представляется оценить вклад радиационного фактора в изменение показателей иммунной системы и его связь с развитием патологическиx синдромов [6, 48].
Pеакция иммунной системы на радиационное воздействие зависит от дозы, времени, мощности, а также от качества облучения [32, 37, 38, 40, 41]. Известно, что регулярная зависимость эффекта от величины дозы радиации встречается в диапазоне доз 1-7 Гр [3]. B настоящее время разработана математическая модель для расчета распределения поглощенной энергии вокруг источников гамма-излучения во внутренниx органаx как в эксперименте, так и у человека [23]. За последние годы проведен целый объем научныx исследований, направленных на оценку рисков стоxастическиx эффектов в разных дозаx облучения [34, 44, 46]. Малые дозы способствуют активизации иммунной системы у разныx видов животныx [16]. И как следствие, в свете актуальных представлений о значении иммунной системы в регуляции процессов жизнеобеспечения и универсально «возмущающиxся» факторов для системы иммуногенеза закономерно мнение о нацеленной иммунологической перестройке облучённого малыми дозами организма, приводящей к созданию противорадиационного иммунитета [17]. Эффекты динамики лимфоцитов через сутки после γ-облучения малыми дозами является процессом изменчивым, мгновенно реагирующим и соxраняющим постоянство в продолжительности наблюдения через год повышением числа стромальной и интраэпителиальной клеточной популяции [5]. Известно, что у лиц, подвергшиxся лучевой терапии могут возникнуть повреждения иммунной системы организма. Последствия лучевой терапии высокими дозами сказываются раньше, чем те, которые обусловлены воздействием низкиx доз. Часть лимфоцитов после воздействия высокими дозами может погибнуть в течение двух дней, делая организм чувствительным к разнообразным инфекциям [25]. Было установлено, что изменение иммунологическиx реакций, усиление аутоиммунныx процессов возникает в результате гипоплазии лимфатическиx узлов [45]. Следует отметить, что тяжесть лучевыx поражений определяется скоростью обновления и радиочувствительностью клеток [19]. Повышение чувствительности к радиационному воздействию и нарушение индукции адаптивного ответа в клеткаx является проявлением нестабильности генома [7, 9]. Изучение изменения частоты клеток с микроядрами в зависимости от дозы облучения красного костного мозга является важным показателем, отражающим уровень радиационного повреждения стволовыx кроветворныx клеток [42].
Mатериалы многолетниx медицинскиx исследований, проведенныx среди лиц, проживающиx в районаx Семипалатинской области, расположенныx в зонаx радиационного риска, позволили установить основные уязвимые системы облученного организма, среди которых особый интерес придается генетическому аппарату и иммунной системе [10]. Так, рассматривая цитокины как важнейший фактор формируемыx иммунологическиx реакций, А.А. Ярилин и соавторы уделяли большое внимание цитокинам в становлении иммунологическиx систем, в частности Т-системы лимфоцитов [22]. У жителей всеx обследованныx населенныx пунктов, подвергшиxся радиационному воздействию, выявленные изменения в субпопуляционной структуре и функциональныx свойстваx иммунокомпетентныx клеток и уровне цитокинов лежат в основе регистрируемого роста частоты встречаемости различных иммунопатологическиx синдромов, что указывает о серьезных измененияx в иммунной системе [18]. Kонтингент ликвидаторов последствий аварии на ЧАЭС представляет удобную модель для исследования соматического мутагенеза в отдаленные сроки после радиационного воздействия [20]. Hемаловажное значение приобрел тот факт, что у ликвидаторов отмечается повышение частоты хромосомных аббераций в лимфоцитах периферической крови [27, 29, 35]. На основании результатов исследований проведённыx на ядерном предприятии производственное объединение «Маяк» было установлено существенное снижение содержания Т-лимфоцитов и Т-xелперов с увеличением дозы облучения [15]. Pезультаты проведённой работы сопоставляются с работами изученными ранее у жителей Xиросимы и Hагасаки, выжившиx после атомной бомбардировки [33], для которыx радиационный фон был доминантным за счет нейтронной активации [26]. Одним из доминирующиx нейтрон-активированныx радионуклидов стал 56Mn [36, 47]. Этиологическую роль ионизирующего излучения среди пережившиx в 1945 году атомные взрывы, в Xиросиме и Hагасаки, подтвердил анализ частоты острыx лейкозов, xроническиx миелолейкозов и нестабильности геномного аппарата [39].
Исследования влияния ионизирующего излучения на живые организмы тесно связано с оценкой состояния деятельности регуляторныx сетей, координирующиx системные ответы на лучевое воздействие [12]. Первостепенным среди ниx является апоптоз, преобладающий в популяции иммунокомпетентныx клеток лимфоидныx органов, что обусловливает актуальность исследования расстройств иммунной системы на уровне функциональныx свойств иммунокомпетентныx клеток [2]. Существенными являются обобщающие работы А.А. Ярилина и соавторов по меxанизмам развития апоптотической гибели клеток и меxанизмам формирования внутриклеточныx сигнальныx путей, индуцирующиx ответные реакции клеток на различные воздействия внешниx факторов [30]. У экспериментальныx животныx, подвергавшиxся пыле-радиационному фактору, в отдаленном периоде выявлены значительные изменения, проявляющиеся снижением количества лейкоцитов, абсолютного и процентного количества СD3+, СD4+, СD8+, уровня ЦИK и иммуноглобулинов различных групп, а также снижением функциональной активности нейтрофилов [8]. Дозозависимое формирование иммуносупрессии xарактеризуется абсолютной Т-лимфопенией с преимущественным угнетением СD4+-клеток и активности фагоцитоза, угнетением функциональной активности естественныx киллеров (NК) со снижением их количества, повреждением основной функции иммунной системы, т.е. контроля за генетическим постоянством клеточного состава с воплощением в канцерогенный эффект [14]. Индуцированная радиацией иммуносупрессия способствует развитию синдромов иммунологической недостаточности, которая ведет к увеличению стохастических эффектов [4]. Изучение состояния иммунного статуса у потомков облученныx белыx крыс показало, что иммунологические нарушения обусловлены повышением содержания В-лимфоцитов, снижением количества субпопуляций общиx Т-лимфоцитов, лимфоцитов с xелперной активностью и иммунорегуляторного индекса [11].
Tаким образом, несмотря на имеющиеся данные об измененияx обменныx процессов в иммунокомпетентныx органаx у потомков лиц, подвергнутыx малым дозам ионизирующей радиации [21], изучение отдаленныx последствий различныx дозовыx нагрузок гамма-излучения на иммунную систему организма остается актуальной проблемой медицины и радиобиологии [13]. Особый интерес представляет проведение сравнительной xарактеристики морфологическиx и физиологическиx изменений в органаx иммунной системы у поколений лиц, подвергавшиxся действию гамма- и нейтронного излучения, позволяющая выявить информативные критерии оценки влияния радиационного фактора в зависимости от накопленной дозы.
Проблемы онкоиммунологии
Понимание роли иммунной системы при опухолевых заболеваниях стало результатом стремительного развития одного из наиболее сложных разделов современной онкологии — иммунологии злокачественного роста. Это научное направление сформировалось в конце 50-х — начале 60-х годов прошлого столетия благодаря усилиям отечественных и зарубежных исследователей, в частности А. А. Богомольца, Л. А. Зильбера, R. Prehn, Е. Foley, G. Кlein и других. Чтобы разобраться в огромном фактическом материале, накопленном сегодня в области онкоиммунологии, наш корреспондент обратилась с вопросами к заведующей лабораторией иммунологии и аллергологии Института экспериментальной патологии, онкологии и радиобиологии им. Р. Е. Кавецкого НАН Украины, доктору медицинских наук, профессору Нинель Михайловне Бережной.
— Успешное прогрессивное развитие фундаментальной онкоиммунологии обусловлено, прежде всего, достижениями общей иммунологии, молекулярной биологии и генетики. В результате, во многом стали понятны сущность и особенности формирования противоопухолевой иммунной защиты, начиная от процесса распознавания опухолевых антигенов и заканчивая реализацией механизмов уничтожения опухоли. Параллельно с этим произошла трансформация некоторых взглядов на взаимоотношение клеток системы иммунитета и опухоли, что подтверждается следующим примером. В 60-х годах XX века. М. Бернет сформулировал положение об иммунологическом надзоре, согласно которому главная задача иммунологической системы сводится к контролю за постоянством внутренней среды и уничтожению всего чужеродного для организма. Это положение было экстраполировано и на злокачественные опухоли: если в организме появляются злокачественно трансформированные клетки, это значит, что иммунологическая система не справляется со своими функциями. Такому заключению способствовали результаты многочисленных исследований, в которых у онкологических больных выявляли снижение показателей, характеризующих количество и функции клеток системы иммунитета. Продолжением этих рассуждений стало распространенное представление о необходимости стимуляции системы иммунитета, что в настоящее время не может трактоваться однозначно. Весь последующий путь развития онкоиммунологии показал, что представления о тотальной иммунодепрессии и необходимости стимуляции клеток системы иммунитета при раке не имеют универсального характера и подлежат принципиальной коррекции. Сегодня доказано, что, во-первых, опухоль может развиваться в условиях абсолютно неизмененной иммунологической системы, во-вторых, даже на последних стадиях опухолевого процесса могут активироваться функции ряда клеток системы иммунитета, и, в-третьих, факт возможности иммуностимуляции роста опухоли бесспорен. Таким образом, современную онкоиммунологию характеризуют переосмысление некоторых ранее незыблемых утверждений и приход к тому, что онкологические заболевания — не иммунопатология, в отличие от аутоиммунных и аллергических заболеваний, при которых нарушения в системе иммунитета являются главной причиной развития заболевания. При опухолевом процессе изменения со стороны иммунологической системы во многих случаях обусловлены влиянием уже возникшей и развивающейся опухоли, то есть вторичны.
— Расскажите, пожалуйста, о существующих на сегодняшний день направлениях в онкоиммунологии. Какие из них наиболее перспективны?
— Мне хотелось бы подчеркнуть, что стремительное развитие онкоиммунологии привело к накоплению большого числа разнообразных фактов и наблюдений, касающихся различных сторон течения опухолевого процесса и тех изменений, которые происходят на клеточном и молекулярном уровнях. Многие полученные данные, на первый взгляд, представляются противоречивыми, и это позволяет думать о необходимости проведения анализа и систематизации накопленного фактического материала. В настоящее время в онкоиммунологии определилось несколько активно разрабатываемых направлений:
идентификация опухолеассоциированных специфических (продукты мутантных генов) и неспецифических (продукты нормальных генов) опухолевых антигенов;
изучение закономерностей распознавания опухолевых пептидов антигенраспознающими клетками параллельно с исследованием внутриклеточных механизмов процесса представления антигенов;
исследование механизмов реализации цитотоксического действия различных эффекторных клеток, особенностей цитокиновой регуляции клеток системы иммунитета, влияния цитокинов на опухолевые клетки и их взаимодействие с клетками системы иммунитета;
выяснение механизмов ускользания опухоли из-под иммунологического контроля и причин иммуностимуляции роста опухолей, их супрессирующего влияния на клетки системы иммунитета;
поиск информативных методов иммунологических исследований в качестве критериев оценки состояния онкологических больных и эффективности иммунотерапии;
разработка новых подходов к иммунотерапии больных со злокачественными новообразованиями на основе результатов фундаментальных исследований.
Говоря о развитии этих направлений, я с сожалением должна констатировать, что все успехи современной онкоиммунологии связаны только с зарубежными исследованиями. Достигнуты успехи в изучении различных аспектов процесса распознавания опухолевых антигенов. Это направление исследований включает идентификацию антигенов и генов, которые их кодируют, изучение закономерностей распознавания опухолевых пептидов антигенраспознающими и взаимодействия с антигенпрезентирующими клетками, а также выяснение молекулярных механизмов процессинга антигенов. Однако как в прошлом, так и в настоящем исследователи сталкиваются с серьезными трудностями. Эти трудности обусловлены многими причинами, в первую очередь, отсутствием или низким уровнем экспрессии антигенов опухолевой клеткой, слабой способностью многих опухолевых клеток секретировать опухолевые пептиды и как следствие этого — отсутствие их в крови и биологических жидкостях организма; наличие в злокачественно трансформированных клетках различных антигенных эпитопов, присущих, в том числе, и нормальным клеткам; нестабильность антигенной структуры опухолевой клетки на различных этапах опухолевого роста; различия в антигенном составе первичных и метастазирующих опухолей. Особый акцент необходимо сделать на том, что не все антигены опухолевых клеток способны индуцировать противоопухолевую защиту, а некоторые из них могут вызывать стимуляцию роста опухоли или иммунологическую толерантность.
Спектр идентифицируемых опухолевых антигенов, опухолеспецифических и неспецифических, постоянно расширяется параллельно с идентификацией кодирующих их генов. Наиболее изучены антигены меланомы, число которых в настоящее время насчитывает уже более 30. Благодаря идентификации опухолевых антигенов стало возможным изучение не только клеточных, но и молекулярных механизмов (в том числе на уровне генов) развития первого и важнейшего этапа иммунного ответа — процесса распознавания. Исследователи пришли к выводу, что способность к индукции иммунного ответа у опухолей различна и определяется их биологическими свойствами. Информация об особенностях экспрессии опухолевых антигенов клетками той или иной опухоли во многом может стать залогом эффективной иммунотерапии.
Процесс распознавания антигенов опухоли и экспрессия антигенов главного комплекса гистосовместимости (ГКГ) как опухолевых клеток, так и лимфоцитов, непосредственно связаны. Это объясняется строгой закономерностью, согласно которой распознавание антигенов любой природы, в том числе и опухолевых, происходит лишь в том случае, если клетка-мишень и лимфоциты экспрессируют идентичные антигены главного комплекса гистосовместимости. Другими словами, даже если злокачественно трансформированной клеткой экспрессируются опухолевые антигены, но не экспрессируются аналогичные антигены ГКГ лимфоцитами, то иммунный ответ не формируется. Таким образом, изучение особенностей экспрессии антигенов ГКГ различными опухолевыми клетками так же важно, как и изучение экспрессии опухолевых антигенов. Современные знания об этом свидетельствуют, во-первых, о различиях в частоте экспрессии антигенов клетками различных опухолей, а во-вторых, о том, что уже на стадии предопухолевых состояний нередко снижается экспрессия этих антигенов I класса ГКГ. Имеются наблюдения о существовании достоверной отрицательной корреляции между снижением экспрессии антигенов I класса ГКГ и опухолевой прогрессией при многих опухолях (рак кишечника, молочной железы, шейки матки, ротовой полости и гортани, мочевого пузыря, меланома). Резкое снижение экспрессии антигенов I класса часто совпадает с ранним метастазированием, что особенно типично для клеток меланомы, которые, как правило, характеризуются дефицитом экспрессии антигенов I класса ГКГ. Из сказанного следует, что уже на первых этапах «встречи» опухолевых и иммунокомпетентных клеток отсутствие иммунного ответа может быть связано с особенностями опухолевой клетки, которая «диктует» свои условия развитию событий. Уточнены представления о механизмах распознавания опухолевых антигенов антигенраспознающими клетками. В реализации этого механизма равное значение имеют функциональная активность антигенпрезентирующих (дендритные клетки, В-лимфоциты, макрофаги) и антигенраспознающих клеток (различные субпопуляции Т-лимфоцитов), а также биологические особенности опухолевой клетки.
Итогом фундаментальных исследований в этом направлении является бесспорный факт, согласно которому отсутствие распознавания создает оптимальные условия для ухода опухоли из-под иммунологического контроля с последующей инвазией окружающих тканей, сосудов и метастазированием.
— Нинель Михайловна, выяснены ли механизмы, благодаря которым злокачественно трансформированной клетке удается уйти из-под иммунологического контроля?
— В настоящее время еще не до конца определены все процессы, которые обеспечивают ускользание опухоли от иммунологического контроля. Результаты исследований последних лет подтверждают, что взаимодействие опухолевых и иммунокомпетентных клеток, а также его результативность в большой степени зависят от биологических свойств опухолевых клеток, которые, к сожалению, достаточно часто определяют исход этого процесса. Не случайно появилось такое понятие, как «стратегия опухолевой клетки», включающее множество известных и неизвестных возможностей опухолевой клетки, которые она мобилизует для продолжения своего роста. Опухолевая клетка способна реализовать свою «стратегию» на всех этапах взаимодействия, начиная с распознавания. И есть все основания говорить о большом разнообразии механизмов ее ускользания от иммунологического контроля, хотя многое в этом вопросе еще предстоит выяснить.
— Каким образом достижения фундаментальной онкоиммунологии могут помочь в оценке состояния системы иммунитета у онкологического больного?
— До сих пор мы говорили с вами об успехах современной онкоиммунологии. Состояние уровня иммунологических исследований в онкологической клинике можно отнести к ее неудачам. При ответе на этот вопрос следует сделать разграничения, которые связаны с различиями в возможностях иммунологических исследований у нас и за рубежом. Да, действительно, современная онкоиммунология располагает филигранными методами исследований, требующими сложнейшего оборудования и дорогостоящих реактивов. Но даже эти методы имеют определенный лимит своей информативности. В наших же условиях иммунологические исследования ограничены сравнительно небольшим количеством традиционных методов, которые не обеспечивают необходимого уровня информации для оценки течения злокачественного процесса и эффективности терапии. Можно сказать, это типичный путь развития фундаментальной науки, и я уверена, что со временем фундаментальная онкоиммунология даст клинике надежные иммунологические методы исследования, которые будут иметь широкий диапазон применения. Оценивая ситуацию, сложившуюся в настоящее время, хотелось бы обратить внимание на следующие обстоятельства. Во-первых, изменения в системе иммунитета при злокачественном росте требуют применения таких методов исследований, которые отражают функциональное состояние клеток, формирующих противоопухолевую защиту. Автоматический перенос данных первичного иммунологического скрининга (количество клеток того или иного фенотипа, уровень иммуноглобулинов разных изотипов, комплемента, показателей фагоцитоза и другие) в онкологическую клинику без проведенных дополнительных исследований нельзя считать корректным. Во-вторых, поскольку одной из особенностей опухолевого процесса являются гетерогенные изменения в системе иммунитета, то на каждом этапе развития новообразования необходимо использовать соответствующие методы иммунологического исследования. В-третьих, нельзя не учитывать достижений фундаментальной иммунологии. Если сегодня мы не всегда располагаем соответствующими методами, то должны хотя бы понимать суть происходящих процессов. При наличии подобного понимания, даже располагая ограниченными методическими возможностями, можно сделать правильные выводы, полезные для клиники.
В подтверждение можно привести несколько примеров. В настоящее время известно, что каждая из субпопуляций лимфоцитов может выполнять в конкретных условиях различные функции. Например, СD4+-лимфоциты могут проявлять себя как супрессоры (выделена субпопуляция с супрессорной активностью — CD4+CD25+), а CD8+-лимфоциты — как хелперы. Часто на основании определения количества СD8+-лимфоцитов делаются необоснованные заключения о выраженности супрессорной активности этой субпопуляции лимфоцитов — критерий, который следует оценивать только с использованием адекватного и вполне доступного методического подхода. Согласно современным данным, установлено, что ориентация на количественное определение тех или иных клеток отражает лишь ничтожно малую часть информации, на которой должна базироваться оценка состояния этих клеток, что в равной степени относится практически ко всем популяциям лимфоцитов (CD4+- и CD8+-лимфоциты, естественные киллеры и другие). Например, очень часто на основании методов изучения маркеров естественных киллеров делается необоснованное заключение об их функциональной активности.
Количественное определение тех или иных клеток необоснованно используется для рекомендаций по иммунотерапии. Такой подход вообще следует рассматривать как антинаучный. В такой же мере необходимо избегать обобщающих выводов, имея в виду твердо установленный факт: иммунологические изменения у больных с одними формами опухолей отличаются от изменений при других новообразованиях, что связано с различной антигенной структурой отдельных опухолей и разнообразием их возможностей влиять на систему иммунитета.
Информативность даже самых современных методов иммунологических исследований в плане оценки потенциальных возможностей организма противостоять опухолевому процессу во многом снижается, если речь идет о больном, у которого опухоль не удалена. Это объясняется тем, что мы не знаем, то ли плохо работает система иммунитета, и поэтому нет иммунного ответа на опухоль, то ли опухолевая клетка не подает ей сигнала, на который она должна реагировать. Вместе с тем, значение результатов методов иммунологического исследования существенно возрастает после хирургического вмешательства с последующей химио- и радиотерапией. Иммунологическая система, как известно, проявляет особую чувствительность к отрицательным последствиям указанной терапии, и в этих условиях коррекция состояния клеток системы иммунитета становится важной, а традиционные методы иммунологического исследования могут быть использованы для общей оценки иммунного гомеостаза и обоснования необходимости соответствующей терапии.
— Что можно сказать о современной иммунотерапии рака и ее эффективности?
— Несмотря на то, что история иммунотерапии рака берет свое начало из прошлого столетия, следует отметить, что ее эффективность, к сожалению, еще не достигла должного уровня. Из множества испробованных подходов иммунотерапии с позиций современных представлений самыми перспективными мне кажутся получение противоопухолевых вакцин на основе идентифицированных опухолевых антигенов, а также дендритных клеток, нагруженных этими антигенами, использование лимфоцитов, активированных интерлейкинами, и сочетанные методы. Сегодня стало очевидно, что эффективность противоопухолевых вакцин может быть обеспечена при воссоздании «индивидуального портрета» опухоли, что дает возможность формирования прицельного иммунного ответа против ее антигенов. Сегодня это кажется сложным, но завтра обязательно станет рутинным. Понимание многих, но далеко не всех процессов взаимодействия опухолевой клетки и клеток системы иммунитета позволяет не только бороться с заблуждениями, но и открывает новые перспективы. Последнее объясняется тем, что фундаментальная онкоиммунология никогда еще не была так тесно связана с решением различных проблем иммунотерапии. При этом необходимо помнить, что не всегда и не на всех этапах развития опухолевого процесса иммунотерапия может дать желаемый результат — нужны четкие критерии ее применения, которые сегодня недостаточно разработаны.
При определенной неудовлетворенности результатами, которые мы сегодня имеем, есть основания надеяться на решение этой сложной проблемы в недалеком будущем. Такой оптимизм обоснован тем, что Природа наделила организм огромными возможностями для борьбы с опухолью, и задача онкоиммунологии — научиться разумно использовать эти возможности.
В интервью с профессором О.А. Громовой освещены вопросы лечения и профилактики остеопороза
Для цитирования. Остеотропные минералы: роль в восстановлении и поддержании костной ткани. Интервью с О.А. Громовой // РМЖ. 2015. No 25. С. 1496-1498.
- Ольга Алексеевна, чем объясняется постоянно возрастающий интерес к процессам фосфорно-кальциевого обмена и эффектам витамина D в организме?
- Общепризнанно, что адекватная обеспеченность организма кальцием, фосфором и витамином D является важным условием целостности костной ткани. Однако терапия кальцием и витамином D не всегда успешна, так как не компенсирует всех нутрициальных потребностей костной ткани. Терапия с использованием только препаратов кальция малоэффективна, что и обусловливает постоянно возрастающий интерес к процессам фосфорно-кальциевого обмена.
Для поддержания структуры костной ткани также необходимы витамины A, C, D, E, K и микроэлементы медь, марганец, цинк, стронций, магний, железо и бор. Дефицит этих микронутриентов замедляет набор костной массы в детстве и подростковом возрасте, поддержание и восстановление костной массы во взрослом возрасте и способствует ускоренной потере костной массы в пожилом возрасте.
Кроме того, состояние фосфорно-кальциевого обмена важно еще и потому, что поддержание структуры костей является хотя и основной, но далеко не единственной физиологической ролью кальция. Дело в том, что среди 23 500 белков протеома человека, функции 2145 белков (9%!) в той или иной мере зависят от уровней кальция. Внекостные физиологические эффекты воздействия гипокальциемии на организм человека обусловлены нарушениями активности этих белков, необходимых для формирования структуры соединительной ткани, регуляции процессов воспаления, синтеза нейромедиаторов, передачи сигналов по нервным окончаниям, переработки углеводов и липидов, гомеостаза крови, поддержания артериального давления. Показано, что глубокий дефицит кальция способствует формированию глюкозотолерантности, гиперпаратиреоза и гипертонии уже в течение 2-3 недель. Все эти эффекты кальция и обусловливают чрезвычайный исследовательский интерес: по данной тематике к концу 2015 года во всем мире было опубликовано более 500 000 статей в реферируемых научных журналах.
Что касается эффектов витамина D в организме, то этот вопрос также активно исследуется. Обеспеченность витамином D имеет важное значение для поддержания здоровья организма в любом возрасте. Помимо важных ролей, которые витамин D играет в фосфорно-кальциевом обмене, воздействие этого витамина на организм связано с комплексом иммуномодулирующих, нейропротекторных, противоопухолевых свойств, поддержанием баланса между жировой и мышечной тканями, поддержанием стабильности генома, эпигенетическим наследованием, энергетическим метаболизмом всех типов клеток.
- Расскажите, пожалуйста, об основных причинах развития остеопороза.
- Остеопороз является одной из современных «болезней цивилизации», связанных с повсеместно распространенными изменениями в структуре питания, гиподинамией, хроническим стрессом, нарастающим грузом вредных привычек (курение, алкоголь), ухудшением экологической обстановки (особенно в мегаполисах). Эти факторы приводят к нарушениям усвоения нутриентов, которые необходимы для построения костной ткани (не только кальция, но и магния, цинка, меди, бора и других). Например, гиподинамия снижает усвоение кальция и магния в кости почти в 2 раза, пересоленная пища способствует выведению магния, избыток углеводов в питании (прежде всего в виде рафинированного сахара) резко увеличивает потери магния, кальция, меди и цинка костной тканью. Употребление высокоградусного алкоголя (водка, ром и тому подобное) способствует резкому снижению абсорбции практически всех эссенциальных микронутриентов, а высокое содержание фосфорной кислоты в некоторых популярных газированных напитках напрямую приводит к резорбции кости. Пищевые красители, стабилизаторы и другие искусственные добавки также деформируют минеральный обмен.
- Какие лабораторные и инструментальные методы используются для диагностики остеопороза?
- Важно определять минеральную плотность кости (МПК), оценивать Т-критерий. Нормальными показателями МПК считаются показатели Т-критерия от +2,5 до −1. Значения Т-критерия от −1 до −2,5 стандартного отклонения соответствуют остеопении, −2,5 стандартного отклонения и ниже - остеопорозу. О тяжелом остеопорозе свидетельствуют −2,5 стандартного отклонения и ниже и наличие в анамнезе одного и более переломов.
Положительная динамика устанавливается при выявлении прироста МПК более чем 2-3% за год при отсутствии новых переломов.
Стабильным можно считать состояние, когда нет новых переломов костей, не выявляется прирост МПК или ее снижение (±2%).
Прогрессирование остеопороза (отрицательная динамика) определяется при возникновении новых переломов за период лечения и/или при снижении МПК более чем на 3% за год.
На обычной рентгенограмме важным признаком остеопоротических изменений является особая геометрия проксимального отдела бедренной кости - он имеет больший шеечно-диафизарный угол, более длинную ось шейки бедра.
Важно определить в крови уровень паратгормона (ПТГ) - одного из основных регуляторов кальциевого обмена в организме (диапазон нормы очень широкий - 0,127-530 пмоль/л). Следует помнить, что ПТГ характеризуется циркадным ритмом с максимальными значениями в 14-16 часов и снижением до базального уровня в 8 часов. Необходимо определить и уровень остеокальцина, особенно для диагностики менопаузального остеопороза. Норма для женщин старше 50 лет составляет 14-46 нг/мл. При остеопорозе этот показатель повышается. Для оценки степени разрушения сшивок коллагена используют тест на дезоксипиридинолин в моче. Диапазон нормы составляет 7-2400 нмоль/л. Поскольку конечный результат мочи выдается в пересчете на 1 ммоль креатинина мочи, предел указания точных цифровых значений расчетного показателя может варьировать в зависимости от уровня креатинина в пробе. Если у пациента клиренс креатинина менее 65 мл/мин, а клубочковая фильтрация менее 29 мл/мин/1,73 м2, это очень важные для врача данные, свидетельствующие в пользу диагноза остеопороза.
Следует оценить в крови уровни кальция (общий кальций в крови: до 60 лет норма - 2,1-2,55 ммоль/л, старше 60 лет - 2,2-2,55 ммоль/л), фосфора (для женщин старше 60 лет норма - 0,90-1,32 ммоль/л, мужчин старше 60 лет - 0,74-1,2 ммоль/л, магния (при этом в пользу повышения риска диагноза «остеопороз» свидетельствуют значения магния в плазме крови менее 0,82 ммоль/л (норма - 0,81-1,26 ммоль/л), а в эритроцитах - менее 1,65 ммоль/л (норма - 1,65-2,65 ммоль/л).
Очень важно оценить уровень фолатов и гомоцистеина в плазме крови. Если уровень фолатов понижен (норма - 5,3-14,4 нг/мл), а гомоцистеин выше 15 мкмоль/л, это неблагоприятный показатель, свидетельствующий об увеличении и риска, и тяжести остеопороза. Необходимо проводить тест на аномалии рецептора к витамину D, например, 7014A-VDR.
- Каковы современные направления терапии остеопороза?
- Это коррекция дефицита витамина D, кальция, магния, фосфора, достаточная двигательная активность (плавание, ходьба), изменение диеты (обилие растительных волокон, свежих овощей, нежирного качественного молока, твердого сыра и, конечно же, рыбы!). Создание безопасной среды проживания (исключающей падения).
Лекарственное направление лечения представлено препаратами с уровнем доказательности класса А: бисфосфонаты (алендронат, ризедронат, ибандронат), золедроновая кислота. Их применение всегда требует дотации макро- и микроэлементов (кальция, фосфора, магния, цинка, марганца, меди, бора), необходимых для строения коллагена кости и насыщения потребностей в реконструкции кости остеобластами.
- Какие минералы относятся к остеотропным (остеогенным) и почему?
- Важность кальция, фосфора и витамина D для целостности костей неоспорима. Рецептор витамина D, подобно эстрогеновым рецепторам, является фактором транскрипции, который, в частности, регулирует экспрессию белков, вовлеченных в гомеостаз кальция и фосфора. В то же время проводимые в течение последнего десятилетия исследования показали, как уже упоминалось, что для поддержания структуры костной ткани также необходимы витамины A, C, E, K и микроэлементы медь, марганец, цинк, стронций, магний, железо и бор.
«Остеогенность» или «остеотропность» микронутриента подразумевает его участие в механизмах роста / репарации костной ткани. Центральным механизмом ее репарации является формирование костного матрикса - структурной основы соединительной ткани, состоящей из «гелеобразного» вещества на основе гиалуронана, коллагеновых и эластиновых волокон и, собственно, самих клеток - остеоцитов. Костный матрикс, который является основой для усвоения кальция скелетом, на 90% состоит из коллагена 1-го типа. В активную фазу репарации кости отмечается повышение синтеза коллагена 3-го типа. Поскольку синтез одного только коллагена (не говоря о других типах биополимеров в составе кости) зависит от обеспеченности организма рядом остеогенных микронутриентов (витамина D3, кальция, цинка, марганца, бора, меди, магния, железа), то и время репаративного остеогистогенеза после повреждений также существенно зависит от этих и других остеогенных микронутриентов. Под «остеогенностью» микронутриента в данном случае понимается невозможность протекания нормального процесса восстановления костной ткани на фоне дефицита этого микронутриента. Каждый из таких «остеогенных» микронутриентов характеризуется уникальными механизмами воздействия на рост костной ткани: у магния - одни механизмы, у бора - совершенно другие.
Поэтому при профилактике и лечении остеопороза, остеопении и рахита следует учитывать не только обеспеченность кальцием и витамином D, но и другие факторы питания. Например, современные исследования указали на взаимосвязь между нервной анорексией, потерей костной массы и повышением риска переломов вследствие остеопороза. Обеспеченность такими питательными веществами, как магний, калий, витамины B12 и К также способствует уменьшению риска переломов за счет улучшения костной микроархитектуры и увеличения минеральной плотности костной ткани.
- В чем опасность нарушения соотношения Mg:Ca для минерального обмена костной ткани?
- При хроническом дефиците магния нарушается важнейший аспект минерального обмена костной ткани - соотношение Mg:Ca. При снижении соотношения Mg:Ca обменные процессы в кости замедленны, быстрее депонируются токсичные металлы (прежде всего кадмий и свинец), постепенно ухудшается функция сустава, уменьшается объем движений, происходит деформация суставов и позвоночника. Эпидемиологические исследования частоты остеопороза в различных странах показали: чем более высокое значение соотношения Mg:Ca в питании, тем ниже встречаемость остеопороза.
Две трети магния нашего организма накоплено в костной ткани. Дефицит магния способствует потере костной массы. Недостаток магния в экспериментальной диете в течение всего двух недель приводил к снижению объема кости, степени и скорости минерализации костной поверхности даже на фоне потребления достаточного количества кальция. Магний регулирует распределение кальция, воздействуя на стимулируемую веществом P выработку провоспалительных цитокинов, секрецию паратгормона и уровней активной формы витамина D. Значение дефицита магния в нарушении структуры продолжает уточняться. Некоторые эффекты магниевого дефицита в настоящее время широко признаны - например, угнетение магнием секреции ПТГ. Другие, такие как воздействие магния на сигнальные каскады ростовых факторов, остаются практически вне зоны внимания исследователей.
- Как давно ведется подробное изучение роли бора в метаболизме костной ткани? Какие основные последствия дефицита бора были описаны?
- Ультрамикроэлемент бор играет важную роль в метаболизме костной ткани. Ежедневное потребление бора в разных странах колеблется от 0,3 до 41 мг/сут; источником бора являются фрукты, овощи, орехи и бобовые. При дефиците бора, даже при достаточном содержании кальция в пище, отмечается снижение прочности кости. И наоборот, добавление бора в пищу способствовало повышению прочности костной ткани. Обнаружена жизненная необходимость микродоз бора на примере влияния на обмен кальция, фосфора и особенно магния. Бор регулирует активность ПТГ. С фармакологической точки зрения, препараты бора характеризуются гиполипидемическим, противовоспалительным, антионкологическим эффектами. Дефицит бора стимулирует развитие таких состояний, как анемия, остео-, ревматоидный артрит, когнитивная дисфункция, остеопороз, мочекаменная болезнь и нарушение обмена половых гормонов.
- Расскажите, пожалуйста, подробнее о роли марганца, железа и меди в процессах восстановления костной ткани.
- Помимо того, что железо необходимо для поддержания достаточной обеспеченности тканей кислородом, этот микроэлемент также участвует в метаболизме коллагена - основного структурного белка всех видов соединительной ткани, в том числе костной ткани. Хронический дефицит железа в эксперименте приводит к задержке созревания коллагена в бедренной кости и к нарушениям фосфорно-кальциевого метаболизма. Железодефицитная анемия способствует нарушению минерализации и увеличению резорбции кости, значительному повышению риска остеопороза и переломов.
Медь, как и железо, участвует в модификации определенных лизиновых остатков коллагена и эластина, что имеет важное значение для формирования коллагеновых и эластиновых фибрилл. Одним из факторов, способствующих потере костной массы, являются субклинические дефициты цинка и меди, возникающие вследствие уменьшенного потребления или нарушений всасывания этих микроэлементов в организме. Цинк и медь - принципиально важные кофакторы ферментов, участвующих в синтезе различных молекулярных компонентов матрикса костной ткани. В частности, медь, являясь кофактором фермента лизилоксидазы, имеет важное значение для формирования внутри- и межмолекулярных поперечных «сшивок» между нитями коллагена. Недостаток меди у человека и животных связан с нарушениями роста, остеогенеза и хрупкостью костей, что во многом обусловлено недостаточным количеством этих поперечных «сшивок».
Марганец (Mn) - эссенциальный микроэлемент и кофактор более 200 белков, участвующих в таких разнообразных процессах, как кроветворение, иммунитет, энергетический метаболизм и метаболизм соединительной ткани. Исследования влияния марганца на развитие и структуру соединительной ткани проводятся с первой половины ХХ века; последствия дефицита марганца включают нарушения образования хрящевой ткани, аномалии развития скелета. Долгосрочный дефицит марганца и меди в диете снижает минерализацию в сочетании с увеличением резорбции кости. Этот эффект осуществляется за счет падения активности Mn-зависимых ферментов, принимающих участие в синтезе глюкозаминогликанов и других углеводных компонентов протеогликанов. Хронический сочетанный дефицит марганца и меди также приводит к снижению активности строящих кость остеобластов, увеличению резорбции костного матрикса и, следовательно, уменьшению плотности и массы костей.
- Восполнение запаса каких витаминов следует отслеживать в комплексной терапии остеопороза?
- Витамин D является одним из основных регуляторов кальций-фосфорного метаболизма. Поэтому для своевременной диагностики и оценки динамики лечения важно определять концентрацию 25-гидроксивитамина D (25-(ОН)-D) в плазме крови. Уровни витамина 25-(ОН)-D в плазме крови менее 10 нг/мл соответствуют глубокому дефициту и авитаминозу, 10-20 нг/мл - дефициту витамина D, 20-30 нг/мл - недостаточности витамина D, более 30 нг/мл - нормальному содержанию витамина D. В отличие от указанной нижней границы нормы (30 нг/мл) верхняя граница нормы четко не установлена, так что за верхнюю границу диапазона нормы условно принимаются значения в диапазоне 80-100 нг/мл. Опубликованные ранее результаты клинических исследований позволяют предполагать, что до появления каких-либо токсических эффектов (например, гиперкальциемии) уровни 25-(ОН)-D в крови должны превысить 150 нг/мл. Более точное определение верхней границы диапазона нормы требует дополнительного накопления соответствующих клинических данных.
Для поддержания структуры костной ткани также необходимы витамины A, C, E, K, витамины группы В. Витамины В6 (пиридоксин), В9 (фолаты) и В12 (цианокобаламин) способствуют нормализации фолатного метаболизма и снижению уровней гомоцистеина плазмы крови (ведь более высокие уровни гомоцистеина ассоциированы с повышенными хрупкостью костей и частотой переломов, в том числе переломов бедра у пожилых). Риск остеопороза также повышается на фоне дефицита витамина В12. Фолат- и витамин-В12-зависимая пернициозная анемия также является значимым фактором риска развития остеопороза.
Более низкое потребление витамина С связано с более быстрыми темпами потери костной массы, а более высокое потребление витамина С - с меньшим количеством переломов. Высокое потребление витамина С в пожилом возрасте (более 300 мг/сут) ассоциировано со значительно меньшей потерей костной массы по сравнению с более низким потреблением витамина.
- Давайте подведем итог: почему для полноценного восстановления костной ткани важно одномоментное назначение не только кальция и витамина D, но и остеотропных минералов?
- Возможности полного восполнения дефицитов микроэлементов, необходимых для функционирования костной ткани, существенно расширяются при использовании специальных микронутриентных препаратов. Поддержанию здоровья костной системы способствуют такие микроэлементы, как магний, железо, медь, марганец, кремний, стронций, бор и ряд других микронутриентов: витамины В6, В9 (фолаты), В12, С, К, каротиноиды, флавоноиды, омега-3-полиненасыщенные жирные кислоты (рис. 1).
Читайте также:
