Молекулярно-генетические методы исследования при диагностике туберкулеза
Похожие темы научных работ по фундаментальной медицине , автор научной работы — Журавлев Вячеслав Юрьевич, Арчакова Л.И., Маничева О.А., Виноградова Т.И., Елькин А.В.
МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕТОДЫ В ДИАГНОСТИКЕ И ТЕРАПИИ ТУБЕРКУЛЕЗА ЛЕГКИХ
В. Ю. Журавлев, Л. И. Арчакова, О. А. Маничева, Т. И. Виноградова, А. В. Елькин,
Санкт-Петербургский НИИ фтизиопульмонологии, г. Санкт-Петербург
Напряженная эпидемическая ситуация по туберкулезу в Российской Федерации обусловлена несколькими факторами, а именно поздней диагностикой специфического поражения, циркуляцией в популяции штаммов возбудителя с множественной резистентностью к противотуберкулезным препаратам, высокой заболеваемостью лекарственно-резистентными формами, недооценкой наследственной предрасположенности к туберкулезу и, как следствие, низкой эффективностью терапии.
Целью нашего исследования была оценка молекулярно-генетических методов в опти-100
мизации этиологической диагностики, химиотерапии туберкулезного процесса и изучении наследственной предрасположенности к туберкулезу органов дыхания.
Материал и методы
Рис. Схема размещения дискриминирующих олигонуклеотидов для одновременного обнаружения возбудителя туберкулеза и выявления мутаций, приводящих к устойчивости к рифампицину и изониазиду. ТБ-БИОЧИП (МДР)
ли славянской национальности, проживали в северо-западном регионе России.
Результаты подвергнуты обработке с помощью непараметрического критерия %2 с поправкой Йетса. Показатель относительного риска развития заболевания (RR) определяли методом Вульфа. Показатель RR выше 1 принимали за значимый, если RR был меньше 0,5 — ассоциацию расценивали как достоверно отрицательную.
Результаты и их обсуждение
Наиболее опасными в клиническом и эпидемиологическом плане являются штаммы МБТ с множественной лекарственной устойчивостью, характеризуемые одновременным наличием лекарственной устойчивости к наиболее эффективным противотуберкулезным препаратам первого ряда — рифам-пицину и изониазиду.
Мишенью рифампицина (R) является РНК-полимераза. В присутствии рифампицина РНК-полимераза не в состоянии удлинять дочернюю цепочку РНК после присоединения нескольких первых рибонуклеотидов. Таким образом, синтезируются только очень короткие олигомеры. Мутации, вызывающие устойчивость к рифампицину, расположены в гене rpoB [9]. Несмотря на довольно значительный размер белка — 1172 аминокислоты,— у M. tuberculosis почти все мутации происходят в сегменте гена rpoB, состоящем из 81 основания и кодирующем аминокислоты 507—533.
Мутации в гене rpoB определены в 323 (67%) случаях. При этом чаще всего определяли замену в кодоне 531 у 164 (50,8%), в том числе Ser531-Leu — у 136 (42,3%) пациентов. Данная мутация наиболее распространена среди устойчивых к R штаммов в мире и чаще всего связана с генотипом Beijing [5].
Другие вариации мутаций в этом кодоне встречались значительно реже (p Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Определение групп риска по параметрам возникновения и неблагоприятного течения туберкулеза органов дыхания очень важно и связано с идентификацией генов, от которых зависит восприимчивость или резистентность организма человека к туберкулезной инфекции, в частности генов II класса главного комплекса гистосовместимости локусов HLA-DRB1* и HLA-DQB1*.
Для локуса HLA-DRB1* известно 13 типов аллелей, распределение которых изучено у пациентов с туберкулезом легких (n=114) и здоровых доноров (n=434). Анализируя результаты, полученные при проведении исследования, можно констатировать, что 16 аллель достоверно более часто фиксировался у больных туберкулезом органов дыхания (17,5% против 6,9% у здоровых; р Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
ahpC-oxyR genes), and rifampicin (rpoB gene) was studied. Hereditary predisposition to tuberculosis of the lungs on the basis of molecular genetic typing of class II genes of the main HLA-DRB1* and HLA-DQB1* loci histocompatibility complex was investigated. Application of molecular genetic technologies permits to identify simultaneously mutations responsible for sensitivity of tuberculosis agent to the basic antituberculous preparations, to form the groups with elevated risk of unfavourable effect of tuberculous lesion, to fulfill intensive individualized therapy and to raise efficiency of treatment.
Keywords: tuberculosis, diagnosis, nano-chips, resistance, HLA-typing, hereditary predisposition.
Контактная информация: Журавлев Вячеслав Юрьевич, канд. мед. наук, доцент, зав. лабораторией молекулярно-генетических исследований Санкт-Петербургского НИИ фтизиопульмонологии, 191036, г. Санкт-Петербург, Лиговский пр, 2/4, тел. 8 (812) 950-25-84












Молекулярно-генетические методы в диагностике туберкулеза
В настоящее время туберкулез считается одной из самых важных глобальных проблем здравоохранения во многих странах мира и занимает ведущее место как причина инвалидизации и смертности.
В настоящее время туберкулез считается одной из самых важных глобальных проблем здравоохранения во многих странах мира и занимает ведущее место как причина инвалидизации и смертности. Сложность ситуации с состоянием окружающей среды и заболеваемостью туберкулезом в Узбекистане заключается не только в том, что она несет в себе аккумулятивный результат игнорирования экологической проблемы на протяжении многих десятилетий, но и в том, что практически все сферы обитания и состояние здоровья человека подвержены экологическому риску.
Развитие молекулярной биологии позволило значительно повысить эффективность обнаружения микобактерий. Одним из самых современных методов микробиологической диагностики туберкулеза является метод полимеразной цепной реакции (ПЦР), который позволяет определить с большой точностью лекарственную чувствительность и типирование микобактерий.
Нами была изучена полирезистентность к антибактериальным препаратам, обусловленная мутацией генов микобактерий туберкулеза (МТБ), у 112 больных туберкулезом органов дыхания. Больные находились на стационарном лечении в ГКТБ № 1, их лечили по стратегии ДОТС (строго контролируемое лечение коротким курсом химиотерапии), предложенной ВОЗ, и по традиционному методу. Пациентам при поступлении в клинику проводили комплексное обследование по общему диагностическому минимуму, а также по показаниям — дополнительные исследования: биохимические анализы крови, мочи, плевральной жидкости, томография, бронхоскопия, посев патологического материала на питательные среды, исследование на чувствительность МБТ к антибактериальным препаратам (АБП). Больные в основном лечились по I и II категориям стратегии ДОТС. Стандартизированные комбинированные курсы химиотерапии включали: рифампицин, изониазид, пиразинамид, этамбутол или стрептомицин (ежедневно). Больные I категории в интенсивной фазе лечения получали в течение 2-х месяцев АБП до наступления конверсии мазка мокроты.После наступления конверсии больные выписывались для продолжения амбулаторного лечения. В поддерживающей фазе больные получают лечение в течение 4—6 месяцев двумя препаратами (изониазид, рифампицин — 3 раза в неделю). Эффективность лечения оценивалась по следующим критериям: сроки исчезновения симптомов интоксикации, нормализация общего анализа крови; сроки абациллирования, закрытия полостей и рассасывания инфильтрации.
Для улучшения диагностики и проведения адекватного лечения больных туберкулезом в практику ГКТБ № 1 был внедрен метод ПЦР. При проведении исследований были использованы микроорганизмы двух популяций — Mycobacterium tuberculosis (МБТ) и Mycobacterium bovis.
Из анамнеза было выявлено, что 8,9% больных не имели постоянного места жительства, 10,7% больных имели инвалидность по сопутствующим туберкулезу заболеваниям, 31,3% имели судимость, у 12,5% больных выявлен алкоголизм, 6,3% употребляли наркотики. Из вредных привычек у 11,6% больных отмечено сочетание курения и злоупотребления алкоголем. Контакт с больными туберкулезом имели 33% человек.
Следует отметить, что из числа обследованных больных микробиологический метод посева оказался информативнее, чем при микроскопии мазка мокроты. Так, у 46% больных, имевших отрицательные ответы при использовании метода микроскопии, МБТ были выявлены методом посева, т.е. установлен диагноз БК+. Тестирование чувствительности МБТ к АБП выявило, что у 22,2% пациентов была отмечена чувствительность ко всем антибиотикам и у 77,7% отмечено наличие резистентности к основным АБП.
Изучение гетерорезистентности микобактерий туберкулеза было основано на проведении молекулярно-биологического исследования для определения МБТ в мокроте. Анализ был проведен на основе метода обратной гибридизации ПЦР диагностики. Использован также метод для определения мутаций в катгене (katG gene) на резистентность к изониазиду и рифампицину.
Тестирование позволило выявить нормальные типы генов. В препаратах первого ряда определены нормальные, чувствительные типы бактерий.
В препаратах второго ряда наблюдался штамм полирезистентного туберкулеза с мутацией S531L рпоБгенa и с мутацией S315T катгена. Одновременное обнаружение полоски чувствительного типа и полоски мутации (резистентности), т.е. комбинация чувствительных и резистентных бактерий, свидетельствовало о гетерорезистентности.
Для данного исследования от 35 больных туберкулезом были получены культуры, которые затем были подвергнуты обычному тесту на лекарственную чувствительность (ТЛЧ) с использованием системы BACTEC MGIT 960. В соответствии с полученными результатами 13 из 35 изолятов (37%) показали множественную лекарственную устойчивость (МЛУ), 10 (28%) оказались резистентными только к изониазиду и 12 (34%) были полностью чувствительны к изониазиду и рифампицину.
Генотип MTBDR был применен непосредственно к мокроте, а затем и к другому жидкому патологическому материалу. При использовании данного метода было зафиксировано 7 случаев гетерорезистентности, что соответствует 20% от всей выборки. В 5 случаях была выявлена гетерорезистентность к рифампицину и в 3 — к изониазиду.
Гетерорезистентность может быть обусловлена передачей второго штамма пациенту, уже инфицированному туберкулезом, или расщеплением штамма на резистентные и устойчивые родовые клетки, образовавшиеся в результате неэффективной терапии.
Мы разделили формы передачи на 2 категории: категорию А и эндогенную форму — категорию B. Чтобы дифференцировать эти две формы, мы провели так называемое VNTR-типирование. VNTR означает изменяемое число тандемных повторов, основанное на явлении, при котором области генома микобактерий ТБ с тандемными повторами распространены произвольно. Количество этих повторов может варьировать в зависимости от штамма. При помощи ПЦР эти повторы можно усилить. Применяя капиллярный секвенсор, количество повторов может быть визуализировано и математически рассчитано.
VNTR локус MIRU04, два разных числа повторений были обнаружены в одной и той же мокроте одного пациента. Это означает, что в одном образце присутствуют два разных штамма, то есть гетерорезистентность к изониазиду, что в соответствии с нашей классификацией подпадает под категорию A гетерорезистентности.
В общей сложности все 4 случая категории А гетерорезистентности и 3 случая B гетерорезистентности были обнаружены в отобранных для исследования образцах.
Результаты исследований позволили классифицировать штаммы и изоляты в соответствии с их эпидемическим генотипом. Для первых 4-х изолятов не было определено соответствующего генотипа. Это неудивительно, поскольку все указанные случаи гетерорезистентности обусловлены 2 разными штаммами. И напротив, последние три случая принадлежат к категории B гетерорезистентности.
Сопоставив все полученные результаты, мы обнаружили наличие гетерорезистентности изолятов микобактерий туберкулеза у 20% пациентов исследованной нами группы. Гетерорезистент-ность бывает двух разных видов почти одинаковой распространенности: 1-я категория A с двумя различными штаммами микобактерий ТБ и 2-я категория B с одним штаммом, разделенным на чувствительные и резистентные организмы.
В будущем гетерорезистентность можно будет использовать в качестве маркеров качества в программах борьбы с ТБ. Категория А гетерорезистентности может служить маркером для интерпретации цепочки передачи, например в больницах или тюрьмах. Категория В гетерорезистентности может служить маркером качества для курсов терапии for treatment programs, классификации пациентов и качества лекарственных препаратов.
Итак, проведенные нами исследования позволяют сделать следующие выводы. Микробиологическое исследование МБТ методом посева является эффективнее, чем микроскопическое исследование. Так, 46% больных, имевших отрицательные ответы по выявлению МБТ методом микроскопии, были выявлены методом посева. Тестирование чувствительности МБТ к АБП выявило, что у 22,2% отмечена чувствительность ко всем антибиотикам и у 77,7% отмечено наличие резистентности к основным АБП.
Нами были установлены два вида гетерорезистентности: 1-я категория A с двумя различными штаммами микобактерий ТБ и 2-я категория B с одним штаммом, разделенным на чувствительные и резистентные организмы.
В препаратах второго ряда в результате наших исследований был обнаружен штамм полирезистентного туберкулеза с генетическими мутациями. Одновременное обнаружение полоски чувствительного типа и полоски мутации (резистентности), то есть комбинации чувствительных и резистентных бактерий, свидетельствовало о гетерорезистентности.
Полимеразная цепная реакция (далее ПЦР) — это высокоточный метод молекулярно-генетического исследования материла, который позволяет выявить у человека различные инфекционные заболевания и установить генотип возбудителя.
ПЦР для выявления различных заболеваний стала применяться в самом конце прошлого века. Первооткрывателем этого метода исследования является американский биохимик Кэри Муллис. Свое открытие он сделал в 1983 году. Но еще несколько лет понадобилось, чтобы доработать метод.
Суть метода
С помощью ПЦР-диагностики можно обнаружить фрагменты чужеродного ДНК в любой жидкой среде организма. На анализ могут быть взяты такие жидкости:
- Кровь.
- Слюна.
- Мокрота.
- Выделения из половых органов.
- Смывная жидкость бронхов.
- Желудочный сок.
Лечащий врач сам определяет, какую биологическую жидкость лучше взять на анализ при конкретном заболевании.

ПЦР-диагностика позволяет не только обнаружить микрофрагменты чужеродной ДНК, но и определить к какому конкретному виду она относится. То есть с помощью ПЦР можно не только точно установить возбудителя заболевания, но и выяснить к какому виду он принадлежит.
Процесс анализа ПЦР — очень сложный. Он состоит из нескольких этапов:
- Сначала нужно обнаружить фрагменты вредоносной ДНК в предоставленном образце.
- Копирование фрагмента ДНК. Маленького участка ДНК для анализа недостаточно, поэтому его копируют. Нуклеиновая кислота может копироваться в пробирке с помощью фермента полимеразы (вне живого организма). В пробирке образуется множество клонов, то есть происходит цепная реакция. Весь процесс происходит в три этапа под воздействием различных температур.
- Когда генетического материала становится достаточно для исследования, тогда возбудитель определяется обычными методами.
Метод ПЦР очень точен и может выявить наличие любого возбудителя по небольшому фрагменту ДНК или РНК.
ПЦР-исследование туберкулеза
ПЦР-анализ на туберкулез является самым информативным методом диагностирования этого заболевания. Относительно туберкулеза этот метод позволяет не только установить наличие микобактерий в организме, но и определить к какому виду они принадлежат.
Результат ПЦР диагностики может быть простой и расширенный. В простом результате указывается только наличие/отсутствие микобактерии. Расширенный результат дает представление о дополнительных параметрах протекания заболевания. Правильно понять, что написано в результате анализа ПЦР может только фтизиатр.
ПЦР-диагностика туберкулеза не проводится всем без исключения. Это объясняется дороговизной реактивов и недоступностью проведения исследования в некоторых отдалённых районах (в таких местах пользуются другими методами диагностики).

Показаниями для проведения ПЦР-исследования являются:
- Длительный контакт с больным туберкулезом.
- Беременность. ПЦР крови на туберкулез является самым быстрым и безопасным методом для беременной женщины.
- Экстренная ситуация. Например, необходимость срочного оперативного вмешательства, при котором нужно точно установить наличие/отсутствие туберкулеза в организме.
- Аллергическая реакция на туберкулиновые пробы.
- ВИЧ-инфекция.
- Невозможность диагностирования заболевания другими способами, при наличии явных признаков туберкулеза.
- Неоднозначные симптомы, которые не позволяют создать четкую клиническую картину заболевания (болезни верхних дыхательных путей, сопровождающиеся большим количеством мокроты, кровохарканьем и пр.).
Метод ПЦР, при всей своей сложности и дороговизне, проводится и расшифровывается в течение нескольких часов. Что делает этот метод золотым стандартом при диагностике туберкулезной инфекции.
Забор материала — это первый этап при выполнении ПЦР-исследования. Для того, чтобы выполнить качественный анализ, нужно соблюдать определенные правила по сбору материла:
- Для ПЦР мокроты на туберкулез нужно тщательно провести туалет полости рта. Делать это нужно вечером и утром перед анализом. Все это время не есть. Вечером выпить муколитическое средство для лучшего отхождения мокроты.
- Перед сдачей крови на ПЦР нужно не употреблять пищу в течение 8 часов. Лучше всего производить забор крови утором натощак. Курить перед забором крови также нельзя. Кровь берется из вены на локтевом сгибе руки в стерильную пробирку. В эту же емкость добавляется антикоагулянт, чтобы кровь оставалась жидкой. Смешивать антикоагулянт с кровью нужно очень аккуратно, не делая резких движений. Если кровь была взята не в лабораторных условиях, то она должна быть предоставлена лаборанту до истечения пятичасового срока. Иначе результат может быть не точным.
- Моча собирается в стерильную емкость утром, до приема пищи. Перед сбором мочи необходим тщательный туалет промежности.
- Остальные виды жидкостей (смывы с бронхов, спинномозговая жидкость) может собрать только специалист в условиях стационара.
- Перед забором жидкостей на ПЦР-исследование запрещено принимать некоторые препараты (например, прием некоторых антибиотиков нужно прекратить за две недели до забора материала).
- Требования к лаборатории, в которой проводится забор анализов на ПЦР очень строгие. Лаборатория должна быть стерильна, чтобы не произошло перекрестное загрязнение материала. В этом случае результаты могут быть ложноположительными.
ПЦР-тест на туберкулез — высокоточный информативный анализ. И требования к его проведению крайне строгие. Чтобы анализ получился, нужно соблюдать регламент.
Для работы в ПЦР-лаборатории приглашаются специально обученные врачи: бактериологи, вирусологи, микробиологи. Все они прошли дополнительное обучение для работы на сложном оборудовании.

Лаборатория должна иметь лицензию на выполнение работ связанных с бактериологически-опасными вирусами и бактериями.
В самой лаборатории должны быть выделены такие рабочие зоны:
- Зона приемки и сортировки проб.
- Зона подготовки проб. В этом помещении выделяются нуклеиновые кислоты из образцов материала.
- Зона проведения реакционных проб.
- Зона для учета результатов и расшифровки анализов.
Все помещения располагают последовательно. Допуск в эти зоны разрешен только работающим там сотрудникам, которые при входе соблюдают правила личной защиты от бактерий и вирусов.
Лучше, если есть возможность расположить лабораторию в отдельно стоящем здании с собственной системой вентиляции.
В лаборатории соблюдаются стерильные условия работы, чтобы избежать перекрестного загрязнения проб. Даже если один фрагмент чужеродной ДНК попадет в исследуемый материал, ПЦР его размножит, и анализ получится ложноположительным.
В каждой зоне лаборатории имеется свой набор оборудования и посуды для проведения исследований. Также имеются свои холодильники, которые не могут быть использованы в других целях, кроме хранения материала конкретной зоны исследований.
Использованные расходные материалы и остатки биологического материала уничтожаются специальными способами, в соответствии с инструкциями.
Плюсы ПЦР-диагностики
ПЦР-тест на туберкулез имеет множество плюсов, которые делают этот метод диагностики все более востребованным:
- Срок проведения. Несмотря на сложность проведения анализа, он готовится намного быстрее других лабораторных методов диагностики туберкулеза (около пяти часов). Это свойство анализа ПЦР становится особенно важным, когда анализ необходимо провести экстренно.
- Анализ ПЦР абсолютно безопасен и может проводиться беременным женщинам и детям.
- ПЦР-исследование можно сделать, когда по каким-то причинам нельзя выполнить другие методы диагностики.
- С помощью ПЦР-диагностики можно провести исследование любой биологической жидкости на выбор. В некоторых случаях это имеет большое значение.
- Позволяет обнаружить возбудителя на любой фазе заболевания. Даже после проведенного лечения, сохранившиеся остатки ДНК мертвых микобактерий будут обнаружены.
- Высочайшая чувствительность этого метода позволяет обнаруживать в биологическом материале даже единичные фрагменты ДНК микроорганизмов.
- Метод ПЦР позволяет не только обнаружить присутствие заболевания, но и может определить генотип возбудителя, отличив его от похожих микроорганизмов.
- ПЦР-исследование очень эффективно при рецидивирующем течении заболевания.
- Благодаря высочайшей чувствительности, анализ ПЦР может распознать микобактерии в организме человека, когда он только недавно инфицировался туберкулезом, задолго до появления клинических симптомов.
Казалось бы, метод ПЦР-диагностики содержит в себе только плюсы, но это не так.

Минусы ПЦР-диагностики
Минусы этого метода исследования тоже существенны. При выборе метода исследования туберкулеза это также стоит учитывать:
- Это дорогостоящий метод исследования. Для проведения ПЦР-диагностики нужна специально-оборудованная лаборатория. Оборудование для таких исследований стоит очень дорого, и не во всякой лаборатории оно имеется. В крайнем случае, можно обратиться в платную лабораторию.
- Сразу же после проведенного лечения метод ПЦР применять не рекомендуется. В крови пациента некоторое время сохраняется небольшое количество живых и мертвых микобактерий. Если провести анализ в этот период, он покажет ложноположительный результат.
- При мутациях микобактерий, анализ будет недостоверным, так как нормальная ДНК не сможет синтезироваться.
- Для ПЦР-исследования имеет значение правильный выбор биологической жидкости на анализ.
- Сверхчувствительность. Это тот случай, когда достоинство метода становится его недостатком. Если при проведении анализа в биологический материал каким-то образом попадет даже единичный фрагмент чужеродного ДНК, то ПЦР его размножит, и будет получен ложный результат.
Где пройти ПЦР-исследование на туберкулез
ПЦР-лаборатория имеется только в крупных противотуберкулезных диспансерах и диагностических центрах.

Объясняется это высокой стоимостью оборудования и высокими требованиями к содержанию лаборатории (реактивы, обработка).
Медицинские чиновники не сильно переживают из-за отсутствия ПЦР-лаборатории в каком-то конкретном населенном пункте, поскольку анализы на туберкулёз можно провести другими методами (культивирование микобактерий, микроскопическое исследование).
Если в населённом пункте нет бесплатной ПЦР-лаборатории, пациент по желанию может обратиться в платное учреждение.
В последнее время ПЦР-диагностика занимает все более прочные позиции в диагностике туберкулеза и других заболеваний, отодвигая на задний план другие методы диагностики.
Сайт предоставляет справочную информацию исключительно для ознакомления. Диагностику и лечение заболеваний нужно проходить под наблюдением специалиста. У всех препаратов имеются противопоказания. Консультация специалиста обязательна!
Основное количество случаев туберкулёза обнаруживается при первичном обращении больного к докторам общей практики. Пациент, чувствуя недомогание, не сразу обращается за помощью к врачу. Появляется субфебрильная температура до 37,5 С, поддерживающаяся постоянно. Спустя некоторое время, присоединяется сухой кашель, иногда с выделением мокроты ( заядлые курильщики чаще всего не обращают на него внимания, ссылаясь на свою вредную привычку ). Вот тогда и стоит забеспокоиться, настало время обратиться к врачу. Каждый врач знает о широкой распространённости туберкулёза, поэтому при обращении пациента с характерными симптомами, должен задать больному контрольные вопросы, такие как:
- Болел ли ранее пациент туберкулёзом
- Болели ли его родственники туберкулёзом
- Находился ли он в контакте с больными туберкулёзом
- Не стоит ли пациент на учете в противотуберкулёзном учреждении по поводу наличия повышенной чувствительности на туберкулин
- Проходил ли ( и когда ) пациент флюорографию лёгких
- Находился ли пациент в заключении или в контакте с людьми, находившимися ранее в тюрьме
- Является ли он мигрантом, бездомным, проживает в неблагоприятных условиях и так далее
Общение с пациентом играет очень важную роль в диагностике туберкулёза. Из рассказа пациента можно узнать некоторые ключевые моменты заболевания, например перенесённые им ранее повторные респираторные инфекции или некоторые признаки скрытой туберкулёзной интоксикации, на которые указывает пациент.
После сбора анамнеза и тщательного обследования пациента приступают к проведению лабораторных и инструментальных исследований.
Туберкулинодиагностика
Тест Манту
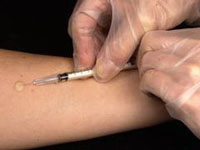
Небольшой участок кожи на внутренней поверхности предплечья, а именно средней его трети, обрабатывается этиловым спиртом. Иглу вводят внутрикожно, параллельно поверхности кожи, срезом иглы вверх. Вводится 0,1 мл туберкулина, что составляет одну его дозу. На месте введения туберкулина в коже образуется небольшой ( диаметр 7-8 мм ) белесоватого цвета пузырёк в виде лимонной корочки. Очень важно, чтоб пробу Манту производила специально обученная медицинская сестра, так как при неправильной технике выполнения результаты становятся недостоверными. Результаты пробы оцениваются через 72 часа после проведения пробы. Оценка производится доктором либо специально подготовленной медицинской сестрой. Вначале осматривают предплечье в месте введения туберкулина. Так можно обнаружить отсутствие внешних признаков реакции, наличие покраснения кожи или же скопление инфильтрата.
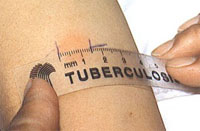
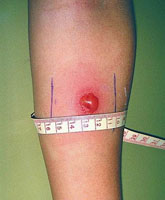
Нельзя путать покраснение кожи с инфильтратом. Для этого необходимо сравнить толщину кожной складки предплечья над здоровым участком, а затем на месте введения иглы. Отличие заключается в том, что при покраснении складки остаются одинаковой толщины, а при инфильтрате, складка над местом введения туберкулина утолщается. После внешнего обследования производят измерение диаметра реакции при помощи прозрачной линейки.
Выделяют три вида ответной реакции на туберкулин:
1. Отрицательная реакция – характеризуется полным отсутствием покраснения кожи и инфильтрата ( 0 – 1 мм ).
2. Сомнительная реакция – покраснение кожи различного размера или наличие инфильтрата диаметром 2 – 4 мм/
3. Положительная реакция – обязательное наличие инфильтрата диаметром 5 мм и более.
В свою очередь положительные реакции так же можно разделить на несколько видов, в зависимости от диаметра инфильтрата:
- Слабоположительная – 5 – 9 мм.
- Средней интенсивности – 10 – 14 мм.
- Выраженная – 15 – 16 мм.
- Гиперергическая – у детей и подростков 17 мм и более, а у взрослых от 21 мм. Так же к этой категории относятся везикулонекротические реакции на коже.
- Усиливающаяся – реакция, сопровождаемая увеличением инфильтрата на 6 мм и более по сравнению с предыдущей пробой.
Лабораторные методы выявления микобактерии туберкулёза
1. Сбор и обработка мокроты: процедуру производят в специально подготовленном помещении, подальше от посторонних лиц. Наиболее распространённым методом является забор материала из гортани с помощью тампона. Слизь собирают во время кашля либо отхаркивания мокроты. Тампон помещается в специальный герметический контейнер и немедленно направляется на микробиологическое исследование. Так же сбор материалов производят при исследовании промывных вод бронхов и/или желудка, исследовании спинно-мозговой жидкости, плевральной жидкости, бронхоскопии, биопсии плевры, биопсии лёгкого.
2. Микроскопия мокроты:

Является самым быстрым и дешёвым методом выявления микобактерии туберкулёза. Метод основан на способности микобактерий сохранять свою окраску даже после обработки различными кислотными растворами. Так, они выявляются при помощи микроскопа в окрашенных мазках мокроты. На ряду с простой микроскопией используется и флюоресцентная микроскопия, в основу которой заложено использование, для выявления микобактерий, ультрафиолетовых лучей.
Молекулярно-генетические методы диагностики микобактерии туберкулёза
1. Полимеразная цепная реакция: заключается в расшифровке генетического материала микобактерии туберкулёза. Предназначен для обнаружения возбудителя в мокроте и распознавания разновидности бактерий. Метод обладает особой чувствительностью и специфичностью.
2. Определение лекарственной резистентности возбудителя
Чувствительными к какому либо определённому препарату считаются те штаммы микобактерий туберкулёза, на которые данный препарат в минимальной концентрации оказывает бактериостатическое или бактерицидное действие.
Устойчивыми или резистентными к данному препарату называются те штаммы микобактерий, которые способны размножаться при воздействии на них препарата в минимальной или повышенной концентрации.
3. Серологические методы диагностики туберкулёза
Серологические методы исследования компонентов плазмы крови основаны на обнаружении многочисленных антигенов, относящихся к туберкулёзу, а также разнообразных иммунных ответов, вызванных различными формами туберкулёза.
4. Анализ крови
Гемоглобин и эритроциты в большинстве случаев остаются неизменёнными, за исключением случаев, сопровождаемых острой потерей крови. Показателем, свидетельствующим о наличии активного туберкулёзного процесса, является скорость оседания эритроцитов. Ускоренная СОЭ характерна не только для свежего активного туберкулёза, но и для обострения хронического процесса.
Остальные показатели анализа крови сильно варьируют в зависимости от характера повреждения лёгких.
5. Анализ мочи
В анализе мочи у больного туберкулёзом лёгких не отмечается заметных отклонений от нормы. Изменения появляются только при туберкулёзном поражении почек и мочевыводящих путей.
6. Рентгенологические методы диагностики 
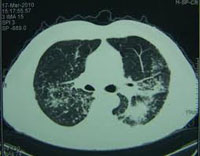
Наиболее часто при диагностике туберкулёза лёгких используются следующие методы:
- Рентгенография
- Рентгеноскопия
Флюорография- Томография
7. Эндоскопические методы диагностики туберкулёза
- Трахеобронхоскопия
- Бронхоскопический лаваж
- Торакоскопия ( плевроскопия )
- Трансбронхиальная биопсия
- Трансторакальная игловая биопсия
- Плевральная пункция и пункционная биопсия плевры
Все данные методы исследования доступны только в специализированно оснащённых медицинских учреждениях.
Читайте также:


