Белые мыши восприимчивы к вирусу
Провинция Юньнань притаилась на юго- западе Китая . Она знаменита своими известняковыми пещерами, окруженными бамбуковыми зарослями, куда стекаются ученые со всего мира. Этих исследователей называют охотниками за вирусами. Прежде, чем войти в пещеру, они надевают защитные костюмы, очки, толстые перчатки и респираторы. Не дай бог, чтобы оголился хоть сантиметр кожи. Нельзя допустить контакта с пометом или мочой летучих мышей, в которых содержатся неизвестные науке смертоносные вирусы.
Перед входом в пещеру исследователи растягивают сети и ждут наступления сумерек. Когда солнце садится, тысячи летучих мышей устремляются на охоту и увязают в расставленной ловушке. В этот момент и начинается работа ученых. Они аккуратно снимают сети, усыпляют пойманных рукокрылых и берут у них образцы венозной крови, анализ флоры из глотки, а также собирают образцы помета.
Как только образцы собраны, их отправляют на изучение в лаборатории по всему миру.
Питер Дасзак - известный американский зоолог, специалист по экологии болезней. Коллеги зовут его охотником за вирусами. За последние 10 лет он объездил более 20 стран, изучая пещеры, где обитают летучие мыши, в надежде отыскать неизвестные опасные патогены. Точнее, открыть новые виды коронавируса.
- Мы собрали более 15 тысяч образцов биоматериалов летучих мышей, что привело к открытию почти 500 новых коронавирусов, - отмечает Дасзак в разговоре с CNN.
И один из них, найденный в китайской пещере в 2013 году, был потенциальным предком нынешнего COVID-19.
НАЙТИ РАЗЛИЧИЯ
До эпидемии атипичной пневмонии в 2002-2003 годах изучение коронавирусов не привлекало особого внимания ученых. За все это время было обнаружено всего лишь два коронавируса, передающихся от человека к человеку, и то они были открыты в 1960-х годах. Но после эпидемии атипичной пневмонии ситуация кардинально изменилась. В мире стали возникать целые центры, специализирующиеся на изучении зоонозных инфекций (передающиеся от животных человеку - ред.).
Как отмечает Петер Дасзак, возглавляющий научно-исследовательскую организацию EcoHealth Alliance, летучие мыши могут быть переносчиками до 15 тысяч штаммов коронавируса, из которых известно всего лишь несколько сотен.
Штамм считается новым, если более 20% его ДНК отличается от генетической цепочки уже известных вирусов. При этом установить возраст инфекции не предоставляется возможным. Подчас обнаруженный учеными неизвестный прежде патоген может распространяться в природе уже несколько лет.

Когда солнце садится, тысячи летучих мышей устремляются на охоту и увязают в расставленной ловушке. В этот момент и начинается работа ученых. Фото: GLOBAL LOOK PRESS
Когда же появились первые заболевшие, у которых установили загадочный COVID-19, вирусолог Ши Чжэнли из Уханьского института вирусологии сравнила геном нового вируса со всеми имеющимися образцами коронавирусов. Выпало лишь одно совпадение. Новый штамм совпал с образцом, взятым у подковоносой летучей мыши из пещеры в провинции Юньнань в 2013 году. Он оказался идентичен на 96,2%.
АЗИАТСКИЙ СЛЕД
Самым привлекательным регионом для изучения зоонозных инфекций является Юго-Восточная Азия и Китай. Именно там большая часть населения регулярно контактирует с дикой природой (охота, рыбалка, продажа зверей на влажных рынках, употребление их мяса в пищу).
Специалисты из команды Дасзака установили, что в провинции Юньнань у 3% китайцев, живущих рядом с пещерами, где обитают летучие мыши, в крови были найдены антитела к вирусам, переносчиками которых являются только рукокрылые. Выходит, небольшой процент жителей оказались подвержены воздействию патогена.
Чтобы у вируса появилась способность передаваться от человека к человеку, у патогена должен быть промежуточный хозяин. Это может быть верблюд, цивета, панголин или кто-то из домашнего скота. Изначально резервуаром для различных патогенов типа вируса Эбола, атипичной пневмонии, Марбургского вируса являются именно летучие мыши.
- Поскольку летучие мыши - это летающие млекопитающие, из-за полетов их организм подвергается стрессу, который обычно вызывает реакцию со стороны иммунной системы. Чтобы справиться со стрессом, организм снижает стойкость иммунной системы, что делает летучих мышей более восприимчивым к вирусам, превращая их в патогенные резервуары, - сингапурский вирусолог Линфа Вонг.
ЧИТАЙТЕ ТАКЖЕ
Правда ли что все мировые пандемии вышли из Китая
Александр Чепурнов, работавший над вакцинами против SARS и Эбола, пояснил особенности нынешних исследований
28.01.2020 в 21:19, просмотров: 80757
Вирусолог Александр Чепурнов, который участвовал в разработке вакцины против первого китайского коронавируса, а также вакцин против африканских лихорадок Эбола и Марбурга, не исключил возможности создания этнического биологического оружия — хотя сейчас наука для этого еще недостаточно развита. С Чепурновым мы обсудили нынешнюю эпидемию коронавируса 2019-nCoV.

– Это правда, что есть коронавирусы, которые могут поражать людей определенной расы?
Я, правда, по ряду причин с этим не согласен. Тем более, что одно время я сам работал с болезнью вилюйский энцефалит, которая поражает только якутов, эвенков и эвенов. Только основываясь на этом, можно не быть столь категоричным. Но пока все-таки я не вижу возможности для создания этих этнических вариантов.
– В соцсетях и на форумах пользователи активно обсуждают сообщения из Ухани, откуда начал распространяться коронавирус 2019-nCoV, что там, якобы, обследуют исключительно китайцев. А европейцы, мол, не восприимчивы к этой заразе.
– Я напомню еще одну вещь, лет 15 - 20 назад была легенда, что русские СПИДом не болеют. Все дело оказалось в пограничном кордоне. Как только наши граждане стали активно путешествовать по миру, выяснилось, что болеют, да еще как.

– На самом деле у этого нового китайского коранавируса очень высокая заражаемость?
- Это так. Человек становится заразным с переходом от непродолжительного периода продрома, инкубационного периода, к собственно болезни. Так же было и с вирусом Эбола. За день до острой фазы я еще не могу найти у человека в крови вирус, а через день он уже болеет. Болезнь развивается стремительно.
А в случае короновируса 2019-nCoV я не могу собрать данные и подсчитать уровень летальности. Сведения поступают достаточно скупо, пробиваются данные, что пожилые и дети умирают чаще. На одном из китайских сайтов указано количество больных в тяжелом, крайне тяжелом состоянии и умерших. Но не понятно, с чем это соотносить.
У меня в голове все время крутится вопрос, а была ли эта исходная точка на рынке морепродуктов единичная? Китайцы опубликовали данные, что были взяты пробы на рынке, и из почти 700 проб 33 оказались положительными. Правда, непонятно, специалисты пробы чего брали: смывы с прилавков на уже закрытом рынке или пробы животных, которые там продавались? Или то и другое? Но 33 — это все-равно уже какая-то множественность. Я думаю, а может быть болезнь уже расползалась потихонечку? Поскольку у нее признаки все-таки классические - мало ли пневмоний?
Сегодня они могут диагностировать эпидемиологические цепочки от того самого вируса, о котором они объявили 31 декабря. А, может быть, это уже последствия других таких случаев? Посмотрите, вирус уже распространился по всему Китаю. На мой взгляд, уж слишком быстро для одного месяца.
– Почему вся зараза идет из Юго-Восточной Азии?
Вроде как строго доказано, что хозяин тот же, что и в 2002 году, это - летучая мышь. Но после этого вирус, видимо, прошел через другого хозяина, как предполагают - через змей, Ну и все, дальше он попал к человеку при той же разделке змеи на мясо. Тем более, если на руке бвли какие-то порезы, ссадины или царапины. И произошло заражение.
– Когда расшифровывают геном вируса, результаты становятся публично доступными?
- В данном случае — да. Китайцы, надо заметить, это достаточно лихо сделали. 31 декабря они поставили диагноз, что это новая нозологическая форма и оповестили ВОЗ. А к 12 января они разослали структуру генома всем заинтересованным странам. Что при современной технике позволяет где угодно начать конструировать диагностические наборы.
Для меня сейчас главный вопрос - запросили и получили ли наши институты от китайцев вирус? И готовы ли они приступить к работе над вакциной?
– Вы в 2003 году, во время первой вспышки атипичной пневмонии, работали над созданием вакцины. Как быстро ее можно получить?
- Вакцина — это долгая песня, потому что там есть несколько сдерживающих факторов. Даже если будет получен какой-то прототип, который покажет хороший эффект, его нужно будет проводить по всем канонам. Это доклинические и клинические исследования. Потом проверка на добровольцах. Это полгода в хорошем темпе.
Можно сразу зайти на несколько типов вакцин, чтобы параллельно смотреть, что будет эффективно. Но самое главное, что мне мешало в 2002-2003 годах — не было восприимчивых к этому вирусу животных, на которых было бы видно: вот оно здоровое, вот я его заразил, оно заболело, и вот из этих животных столько-то погибло. Если такого не будет, значит можно пытаться адаптировать, изменить свойства вируса по отношению к новому хозяину, к тем же морским свинкам. С Эболой была ровно такая же история. Для всех вирус был безвреден, кроме человекообразных обезьян.
– То есть, лабораторные кролики, морские свинки, крысы не реагировали на вводимые препараты?
– Для Эболы они не подходили. Как и для того коронавируса, который был в 2002-2003 годах. Я тогда попробовал работать на кроликах, морских свинках, мышах, хомячках, но ни одно из этих животных не оказалось восприимчиво к вирусу.
– Если удается получить вакцину, она раздается бесплатно или ее продают за деньги, в том числе другим странам?
– Поскольку ее будет производить какое-то предприятие, оно должно за это получать деньги. Другое дело, что в критических ситуациях государство берет на себя все расходы. Поскольку эпидемия наносит колоссальный вред, я не очень себе представляю страну, которая бы отказалась заниматься этим. Представляете, какой сейчас финансовый урон понесет Китай? Никто не уезжает, никто не приезжает. Многие не работают.
– Что касается методов диагностики, уже объявлено, что получены отечественные тест-системы, с помощью которых в кратчайший срок можно выявить коронавирус.
– Это не очень дорогое удовольствие. Это работа, которую могут сделать многие молекулярные биологи и биотехнологи.
– Как быстро может быть купирована вспышка, и что для этого делается?
– Это делается исключительно противоэпидемическими мерами. До появления какой-нибудь блестящей вакцины, как например, произошло с Эбола, тут работают только противоэпидемические мероприятия. То есть все моют руки, соблюдают режим, все носят маски, минимизируются контакты и так далее. В 2003 году это сработало безукоризненно. Правда, разница с тем временем теперь колоссальная, за эти 17 лет китайцы начали массово путешествовать, им финансы теперь позволяют это делать. В Китае работает и учится очень много европейцев, в том числе и наших граждан. Так что все теперь очень не просто. Но китайцы предпринимают очень мощные усилия, которые вызывают огромное уважение. Надеюсь, что и мы сможем, если, не дай Бог, сюда что-то прорвется, оказаться на высоте.
– Нам пока бить тревогу не стоит?
- Нам надо готовиться, это безусловно. Китайцы, например, сейчас столкнулись с нехваткой масок. В тот же город Ухань из Манилы сейчас прислали три миллиона масок. А что это такое для 8-миллионного города? И нам надо быть готовыми, надо подтягивать какие-то резервы.
Заголовок в газете: Вирус рас не выбирает
Опубликован в газете "Московский комсомолец" №28182 от 30 января 2020 Тэги: Наука, Вирус Эбола, Дети , Биотехнологии, Медицина Места: Китай
Энцефаломиелит мышей — инфекция лабораторных мышей, проявляющаяся вялыми параличами преимущественно задних конечностей. Заболевание вызывают несколько вирусов: оригинальный шт. ТО-Тейлора, а также шт. FA, GD-VII и родственные им штаммы. Встречается повсеместно.
Штамм ТО впервые выделил в 1933 г. Тейлор из головного мозга белых мышей у которых наблюдал клинические признаки энцефалита. Аналогичный вирус Тейлора можно легко выделить из организма клинически здоровых белых мышей, что свидетельствует о широком вирусоносительстве.
Клинические признаки и патологоанатомические изменения. Вирус ТО обычно вызывает латентную инфекцию у лабораторных мышей. Аналогичные вирусы выделяли от диких мышей, хлопковых крыс и мешотчатых грызунов. Патологические изменения в ЦНС от шт. ТО сходны с поражениями, вызываемыми вирусом полиомиелита у человека. Отмечается деструкция клеток передних рогов, особенно спинного мозга, и связанная с ней воспалительная реакция. Изменения, обусловленные шт. FA и GD-VII, характеризуются диффузным энцефалитом и не совсем сходны с изменениями при полиомиелите у человека, как в случаях с вирусом ТО.
Штаммы вируса энцефаломиелита мышей Тейлора распределены в 2 группы: GDVII и DA (или ТО). Нейровирулентная группа, которая быстро убивает мышей, и демиелинизирующая группа, которая вызывает нелетальную инфекцию двигательных нервов с последующей персистентной инфекцией белого вещества с демиелини-зирующими повреждениями, сходными с множественным склерозом. На основании исследования 3-мерной структуры вируса предполагают, что различия в патогенезе двух групп вируса Тейлора являются результатом различий в процессах иммунологического или рецептор опосредованного узнавания.
Референтные шт. GDVII и DA. Штаммы подгруппы GDVII являются высоковирулентными и вызывают острый энцефаломиелит у мышей. При этом не наблюдается ни персистенции, ни демиелинизации. Штаммы DA менее вирулентны и устанавливают персистентную инфекцию в спинном мозге мышей несмотря на энергичную гуморальную иммунную реакцию, сопровождающуюся хронической демиелинизацией. Вирус представляет собой превосходную модель для изучения множественного склероза человека, при котором также наблюдается демиелинизация. Большинство клеток, инфицированных вирусом, производит 100—500 копий генома, что намного меньше, чем необходимо для определяемой экспрессии вирусных белков. Ограниченный синтез вирусных белков ведет к уменьшению цитопатического эффекта. Анализ последовательностей мутантных вирусов, устойчивых к нейтрализующим МКА к БД идентифицировал 4 аминокислотных мутации капсидных белков и все они локализовались на рецепторе или вблизи связывающего вирус. Мутантные вирусы показали уменьшение демиелинизирующей активности. Эти находки предполагают, что нейтрализация антител зависит от связывания вируса с клеточным рецептором и что демиелинизация и вирусная персистенция могут интерферировать с предотвращением прикрепления вируса к рецепторам особых типов клеток. Белок 17 кД (L-белок) синтезируется в штаммах субгруппы DA. Изучение вирусного мутанта DA без L-npo-теинового синтеза показало, что этот белок является важным для вирусного роста в особых типах клеток и является критическим для демиелинизирующей болезни и вирусной персистенции. Инактивация гена рецептора у-интерферона делает мышей I29/SV чувствительными к персистентнОой инфекции и ДБ, а инактивация гена у-интерферона у мышей 157ВL/6 придает им чувствительность к персистентной инфекции, а не к клинической ДБ. Эти различия фенотипа обусловлены различиями генетического фона. Полное секвенирование генома в потомстве F2 из двух скрещиваний показало, что ДБ является результатом двух независимых факторов: высокой вирусной нагрузки и локуса Tmevd5 в хромосоме 11.
Морфология, химический состав и устойчивость. РНК-содержащий вирус Тейлора имеет размеры 20—25 нм, устойчив в диапазоне рН 3—10, а также к эфиру, хлороформу, фенолу, гипертоническому раствору NaCl, глицерину, алюминиевым квасцам. Разрушается под воздействием 20 %-ного раствора этилового спирта, 50 %-ного ацетона, 2 %-ного раствора КМп04, 1,5 %-ного раствора формалина. Длительно сохраняется при низких температурах (-40 ° — 70 °С), неустойчив к прогреванию (50 °-70 °С) и высокочувствителен к лиофильному высушиванию. АГ структура не изучена. У больных мышей старше года обнаруживают ВНА, ПА, анти-ГА.
Штаммы ТО, FA и GD-VII родственны, но не идентичны. ВЭМТ индуцирует ген c-fos в чистых культурах покоящихся астроцитов мозга мыши. Экспрессия c-fos зависит от дозы ВЭМТ и достигает максимума при множественности заражения 100. Экспрессия c-fos максимальная через 30 мин и исчезает через 2 ч. Методом проточной цитометрии показано, что ВЭМТ быстро интернализируется после связывания со специфическим рецептором и активно реплицируется в цитоплазме астроцитов и что мРНК c-fos может транслироваться в ядре. Индукция c-fos нейтрализуется антителами к ВЭМТ. Очищенные белки VP1, VP2 и VP3 ВЭМТ не индуцируют экспрессию ВЭМТ. Быстрая индукция c-fos может являться первой стадией заражения астроцитов ВЭМТ.
Изучение структуры ВЭМТ позволило предположить, что глубокая впадина на поверхности вирионов участвует в прикреплении вируса к рецептору. Для проверки этого предположения у менее вирулентного варианта ВеАп ВЭМТ сконструировали замены четырех аминокислотных остатков (V1091, Р1153, А1225 и Р1379). В каждом из этих сайтов сделаны три аминокислотные замены: одна консервативная и две более радикальные. Получены семь жизнеспособных мутантов вируса и изучены их связывание с клетками ВНК-21, стабильность капсидов при 40 °, репликация РНК, кинетика роста в одиночном и множественных циклах заражения и трансляция вирусных белков. Три из указанных остатков участвуют в прикреплении вируса к клеточным рецепторам.
Шт. GD-VII в отличие от других (FA и ТО) агглютинирует эритроциты человека группы 0 при температуре 4 °С до разведения выше 1:2000. После обработки трипсином ГА-активность штамма повышается и проходит при температуре 20 °С с эритроцитами человека и 4 °С с эритроцитами обезьяны. После обработки трипсином два других штамма (FA и ТО) также приобретают ГА-свойства при температуре 20 °С.
Латентно инфицированные мыши выделяют вирус с фекалиями в течение 53 дней.
Экспериментальная инфекция. Экспериментальная инфекция шт. ТО воспроизводится на мышах 3—4-недельного возраста при интрацеребральном, интраназальном, интраперитонеальном и внутримышечном введениях (гибель при первом методе введения в 100 % случаев). Взрослые мыши не заболевают или легко переболевают и становятся вирусоносителями. Вирус проникает В ЦНС и другие органы через 2—5 дней после заражения. Он локализуется, в основном, в стенке кишечника и оттуда проникает в мезентериальные лимфоузлы и далее в ЦНС. У зараженных мышей старшего возраста может развиваться прогрессирующий вялый паралич, у еще более старших — латентная инфекция. После первичного выделения шт. GD-VII обычно вызывает вялый паралич, после пассирования на мышах — генерализованный энцефалит. Шт. FA также постоянно вызывает только диффузный энцефалит. Вялые параличи отмечают только после интраперитонеальной инокуляции.
Внутримышечная инокуляция любого из трех штаммов вызывает локальный миозит, по крайней мере шт. GD-VII, видимо, размножается в мышцах. Получена серия мутантов штамма DA со специфическими мутациями вирусного капсидного белка VP1, определяющего связь вируса с рецепторами клетки. Мутант вируса с заменой в петле IJ/PJ треонина на аспарагин (T81D) формирует крупные бляшки, но обладает пониженной способностью к репликации in vitro. При инъекции этого мутанта восприимчивым мышам выявляется измененный тропизм в острой стадии заболевания и не развивается хроническое демиелинизирующее заболевание. При замене треонина на валин (T81V) вирус не вызывает изменения, характерные для заболевания мышей. При замене в этой позиции триптофана (T81W) развивается сходное острое заболевание, но не развивается хроническая болезнь. Изменение аминокислот в гидрофобной области вдавления стенки, в позиции 91 VP1, в гидрофильный треонин (V91T), приводит к острому или хроническому заболеванию в отсутствие персистен-ции вируса. Таким образом, замены аминокислот в области петли I VP1 вируса приводят к изменению взаимодействия вируса с хозяином.
Культивирование. Вирус FA размножается в КЭ, зараженных на ХАО, в желточный мешок или в аллантоисную полость. Кроме эмбрионов, вирус размножается в культуре фибробластов КЭ, в культуре клеток печени и почек мышей, а также в ВНК-21. Особенности внутриклеточной репродукции не изучены. Шт. DA вызывает в клетках L929 персистенцию, которая обусловлена продукцией интерферона. Синтез РНК В клетках ВНК-21, зараженных шт. GDVI1 Или DA снижается через 3 ч после заражения, достигает максимального уровня через 6 ч, затем снижается. Изучена чувствительность первичных культур нейронов штаммами DAh GDVTI ВЭМТ. Высоковирулентный штамм GDVII заражает более 90 % Нейронов через 12 ч после инокуляции, а через 24 час. после заражения вызывает сильный цитопатический эффект. Антигены ВЭМТ обнаруживаются только через 24 ч после заражения вызывающим хрони-ческеую демиелинизирующую болезнь штаммом DA, который инфицирует не более 2 % нейронов даже через 6 дней. Заражение штаммом DA не вызывает цитопатичес-кого эффекта. С использованием рекомбинантных ВЭМТ показано, что капсид действительно отвечает за картину заражения, наблюдаемую in vitro. Таким образом, уровень нейровирулентности штаммов DA и GDVII коррелируете их способностью заражать культуры нейронов и контролируется капсидом. Штамм GD VII не индуцирует наработку полипептида вследствии его плохого размножения в мышиных L-клетках.
Источники и пути передачи инфекции. Источником инфекции при спонтанном энцефалите служат больные мыши, выделяющие вирус во внешнюю среду с калом и мочой, а также мыши-вирусоносители. Они являются основным резервуаром вирусов в природе. Заражаются мыши в основном алиментарным путем, через инфицированный экскрементами корм. Передавать вирус здоровым животным могут кровососущие насекомые.
Кроме белых мышей, восприимчивы серые дикие мыши, хлопковые крысы. У морских свинок удавалось вызвать латентную инфекцию. Кролики, белые и водяные крысы, лесные мыши и обезьяны к вирусу резистентны. На ранней стадии инфииирования мышей штаммом Даниеля вируса энцефаломиелита мышей вирус обнаруживается в нейронах и глии. В белом веществе вирус персистирует дольше, тогда как под воздействием иммунной системы происходит его ранняя элиминация из серого вещества. Из рыжей полевки выделен неизвестный ранее пикорнавирус, названный вирусом Люген. Принадлежность к пикорнавирусам была установлена на основании данных ЭМ и секвенирования. Рассчитанные аминокислотные последовательности капсидных белков VP2 и VP3 вируса Люген были сходны с таковыми вируса ЕСНО-22 (сходство около 70 %). 5'-некодирующая область РНК вируса Люген характеризовалась наибольшим сходством с кардиовирусами.
Иммунитет и специфическая профилактика. Иммунитет не изучен, специфическая профилактика не разработана. Новорожденные мышата и мышата-сосунки приобретают пассивный иммунитет с материнскими AT. Вскоре после отъема они становятся вирусоносителями и обладают повышенной резистентностью к инфекции. С возрастом процент вирусоносителей уменьшается: в 7,5 месяца он составлял всего 50 % и в дальнейшем понижался. Инфекция мышей вирусом энцефаломиелита Тейлора напоминает по клиническим проявлениям рассеянный склероз (PC) человека. Сконструированы экспрессирующие эукариотические векторы, кодирующие капсидные белки VP1, VP2 и VP3. Вакцинировали мышей SJL/J внутримышечно однократно, дважды или трехкратно кДНК различных капсидных белков. Затем мышей заражали в мозг. Трехкратная вакцинация мышей кДНК, кодирующей VP2 вируса, приводит к частичной защите их ЦНС от демиелинизирующего заболевания: уменьшались клинические симптомы и гистопатология. Вакцинация с помощью кДНК, кодирующей VP3, также приводила к уменьшению клинических проявлений. В то же время, вакцинация кДНК, кодирующей VP1, вызывала более тяжелое заболевание, причем симптомы заболевания появлялись раньше, а гистопатология усиливалась в сравнении с контролем. Это не коррелировало с титрами антител против и течением болезни. Таким образом, вакцинация с помощью ДНК способна изменять течение хронического демиелинизирующего заболевания. Это может найти применение в лечении PC.
Вирус КЭ патогенен для ряда лабораторных и диких животных. Наибольшей чувствительностью обладают новорожденные и молодые белые мыши. После заражения в мозг, интраперитонеально, внутримышечно у этих животных развивается энцефалит, заканчивающийся гибелью животных. Из сельскохозяйственных животных наиболее восприимчивы к вирусу КЭ козы, менее восприимчивы овцы и коровы, и слабо восприимчивы лошади. Вирус КЭ обладает цитопатогенным действием (ЦПД), вызывая цитопатические изменения в первичных и перевиваемых культурах клеток почек эмбриона свиньи (СПЭВ и ПЭС) и размножается без выраженного ЦПД во многих других клеточных культурах. В мозге инфицированных мышей и культуральной жидкости зараженных культур происходит накопление вируса КЭ и специфических вирусных антигенов: комплементсвязывающих, гемагглютинирующих, преципитирующих и др.
Вирус КЭ длительное время сохраняется при низких температурах (оптимальный режим -60 град. С и ниже), хорошо переносит лиофилизацию, в высушенном состоянии сохраняется много лет, но быстро инактивируется при комнатной температуре. Кипячение убивает его через 2 минуты, а в горячем молоке при 60 град. С погибает через 20 минут.
Инактивирующим действием обладают также формалин, фенол, спирт и другие дезинфицирующие вещества, ультрафиолетовое излучение.
Реакция нейтрализации основана на способности специфических иммунных сывороток гасить инфекционное действие вирусов. Применяется в двух направлениях:
1) для типирования выделенных вирусов;
2) для титрования антител в сыворотках переболевших.
1. На лабораторных животных. Критерием наличия вируса
служит гибель лабораторных животных. Высчитывается LD50
- предельное разведение вирусной суспензии, которое
вызывало гибель 50% зараженных животных. Для
идентификации вируса клещевого энцефалита проводят
внутримозговое заражение белых мышей.
2. В тканевых культурах. Учет результатов проводят
- по цитопатическому действию (ЦПД)
- по методу цветной пробы, основанной на изменении цвета
индикатора среды в результате дегенерации клеток;
3. В Курином эмбрионе. Учет результатов проводится по
появлению оспин по хорионаллантоисной оболочке.
РТГА
Эта реакция применяется в вирусологической практике:
- для определения типа вируса (на стекле);
- для обнаружения в сыворотке больных (развернутая).
При постановке ориентировочной реакции торможения гемагглютинации на стекло наносят по 1 капле типоспецифических иммунных сывороток, затем добавляют по 1 капле испытуемого материала и 1 капле 5% взвеси эритроцитов.
Учет результатов: тип вируса определяют по той сыворотке, с которой реакция не произошла, так как иммунная сыворотка, специфическая для выделенного вируса, подавляет его гемагглютинирующую активность, и эритроциты не агглютинируются.
ИФА
В качестве метки используются ферменты: пероксидаза, щелочная фосфатаза и др.
Индикатором реакции является способность ферментов вызывать цветные реакции при действии на соответствующий субстрат. Например, субстратом для пероксидаза является раствор ортофенилдиамина.
Наиболее широко применяется твердофазный ИФА. Сущность ИФА аналогична РИА.
Результаты ИФА можно оценить визуально и измерением оптической плотности на спектрофотометре.
К преимуществам ИФА следует отнести:
- отсутствие контакта с радиоактивными веществами;
- простота методов оценки реакции;
- легко поддаётся автоматизации.
Однако, по сравнению с РИА, отмечают более низкую чувствительность метода, но в некоторых случаях чувствительность превосходит РИФ и РИМ.
В качестве примеров приводятся следующие типы ИФА:
Предназначена для выявления поверхностного антигена вируса гепатита В (НВз Ад) в сыворотках и плазме крови при диагностике вирусного гепатита В и определения носительства НВ5 Ад.
1) исследуемый материал сыворотка или плазма крови;
2) антитела к НВз Ад, адсорбированные на поверхности лунки полистиролового микропланшета;
3) коньюгат — мышиные моноклониальные антитела к НВз Ад, меченые пероксидазой,
4) ортофенилендиамин (ОФД) -субстрат;
5) фосфатно-солевой буфер;
6) контрольные сыворотки:
— положительная (сыворотка с НВе Ад);
— отрицательная (сыворотка без НВз Ад). Ход работы
1) Внесение контрольных и исследуемых сывороток.
2) Инкубация 1 час при 37 «С.
3) Отмывание лунок.
4) Внесение конъюгата.
5) Инкубация 1 час при 37 «С.
6) Отмывание лунок.
7) Внесение ОФД. При наличии НВз Ад раствор а лунках желтеет.
Учёт ИФА проводят по оптической плотности с помощью фотометра. Степень оптической плотности будет обратно пропорциональной концентрации исследуемых НВз Ад.
Реакция протекает в три фазы:
1) НВз Ад исследуемой сыворотки (плазмы) связывается с гомологичными АТ, адсорбированными на поверхности лунки. Образуется ИК АГ-АТ. (НВз Ад — агл\ НВз АТ).
2) Антитела НВз Ад, меченые пероксидазой, связываются с оставшимися свободными детерминантами НВз Ад комплекса АГ-АТ. Образуется комплекс АТ-АГ-меченые АТ <ап!1 НВз АТ-НВз Ад-ап(1 НВз АТ, меченые пероксидазой).
3) ОФД взаимодействуют (с пероксидазой) комплекса АТ-АГ-АТ и происходит жёлтое окрашивание.
Является основной тестовой реакцией диагностики ВИЧ-инфекции.
Цель: серологическая диагностика ВИЧ-инфекции — обнаружение антител к антигенам ВИЧ, Компоненты:
1) исследуемый материал — сыворотка крови;
2) синтетические пептиды, имитирующие 2-х антигенов ВИЧ: др 120 и др 41, адсорбированные на поверхности полистироловой лунки;
3) антиглобулиновая сыворотка, меченная пероксидазой, полученная путём иммунизации кроликов глобулинами человека (АТкАТ-м);
5) фосфатно-солевой буфер;
6) контрольные сыворотки:
1) Внесение контрольных и исследуемых сывороток. 2> Инкубация 30 минут при 37 «С.
4) Внесение антиглобулиновой сыворотки, меченой ферментом.
5) Инкубация 30 минут при 37 «С.
7) Внесение ОФД. Механизм
Реакция протекает в 3 фазы:
1) Антитела к ВИЧ исследуемой сыворотки связываются с гомологичными антигенами (др 120 и др 41), и на поверхности сорбента образуется ИК АГ-АТ <АТ к ВИЧ — АГ ВИЧ).
2) Образование ИК АГ-АТ-АТ, меченое пероксидазой, т.к. АТ исследуемой сыворотки являются антигенами для антиглобулиновой сыворотки.
3) ОФД взаимодействует с пероксидазой комплекса АГ-АТ-АТ, и происходит жёлтое окрашивание раствора лунки. Степень ферментативной активности прямо пропорциональна концентрации исследуемых АТ.
Учет реакции ИФА
1. Полистироловый планшет;
2. Антитела к HbsAg;
3. Конъюгат - мышиные моноклониальные антитела, меченые
4. Контрольные сыворотки;
5. Фосфатно-солевой буфер;
6. Ортофенилдиамин (ОФД).
Реакция протекает в две фазы. HbsAg связывается с гомологичными антителами, меченными пероксидазой. Затем ставят цветную реакцию с использованием ОФД, происходит желтое окрашивание.
Учет ИФА - по оптической плотности с помощью фотометра, при этом степень оптической плотности будет обратно пропорциональна концентрации HbsAg антигена вируса гепатита В.
РИФ
В качестве метки используются светящиеся флюорохром-ные красители (изотиоционат флюорисцеина и др.).
Существуют различные модификации РИФ. Для экспресс-диагностики инфекционных заболеваний — для выявления микробов или их антигенов в исследуемом материале применяется РИФ по Кунсу.
Выделяют два метода РИФ по Кунсу: прямой и непрямой.
Компоненты прямой РИФ:
1) исследуемый материал (испражнение, отделяемое носоглоткой и др.);
2) меченая специфическая иммунная сыворотка, содержащая АТ-ла к искомому антигену;
3) изотонический раствор хлорида натрия.
Мазок из исследуемого материала обрабатывают меченой антисывороткой.
Происходит реакция АГ-АТ. При люминесцентном микроскопическом исследовании в том участке, где локализуются комплексы АГ-АТ, обнаруживают флюоресценцию — свечение.
Компоненты непрямой РИФ:
1) исследуемый материал;
2) специфическая антисыворотка;
3) антиглобулиновая сыворотка (АТ-ла против иммуноглобулина), меченая флюорихромом;
4) Изотонический раствор хлорида натрия.
Мазок из исследуемого материала сначала обрабатывают иммунной сывороткой к искомому антигену, а затем — меченой антиглобулиновой сывороткой.
Светящиеся комплексы АГ-АТ — меченые АТ обнаруживаются при помощи люминесцентного микроскопа.
Преимущество непрямого метода состоит в том, что нет необходимости приготовления широкого набора флюоресцирующих специфических сывороток, а применяется лишь одна флюоресцирующая антиглобулиновая сыворотка.
Также выделяют 4-компонентную разновидность непрямой РИФ, когда дополнительно вводится комплемент (сыворотка морской свинки). При положительной реакции образуется комплекс АГ-АТ — меченые — АТ-комплемент.
Реакция относится к серологическим реакциям с участием меченых антигенов или антител.
Проводится прямым и непрямым методами.
При прямом методе обнаруживают антиген в материале от больного. Используется диагностическая флюоресцирующая сыворотка, которая содержит иммуноглобулины, выделенные из иммунных сывороток и меченные флюорохромами.
Специфический антиген обнаруживается в виде ярко-зеленых люминесцирующих конгломератов, а фон препарата окрашивается в оранжево-красный цвет.
Компоненты реакции прямой иммунофлюоресценции:
Для поиска антигена при экспресс-диагностике:
1) исследуемый материал;
2) специфическая люминесцентная сыворотка;
3) люминесцентный микроскоп.
При диагностике гриппа проводят дифференциацию от возбудителей парагриппа и аденовирусной инфекции. Носоглоточный мазок обрабатывают флюоресцирующей гриппозной сывороткой или гриппозным иммуноглобулином.
Компоненты реакции непрямой иммунофлюоресценции
Для поиска антигена при экспресс-диагностике:
1) исследуемый материал (антиген);
2) специфическая сыворотка;
3) антиглобулиновая люминесцентная сыворотка
4) люминесцентный микроскоп.
Сывороточные антитела адсорбируются на антигене.
Используется антиглобулиновая сыворотка с антителами, меченными флюорохромами. Образуется комплекс антиген+антитело (I) + антиглобулиновая сыворотка (II), который светится.
37)Серологическая диагностика Вич,с помощью реакции иммуноблотинга
По рекомендации ВОЗ иммуноблотинг (вестерн-блот) используется при диагностике ВИЧ-инфекции в качестве дополнительного экспертного метода, который должен подтверждать результаты ИФА . Обычно этим методом перепроверяют положительный результат при ИФА, поскольку он считается более чувствительным и специфичным, хотя более сложным и дорогим.
Иммунный блоттинг сочетает в себе иммуноферментный анализ (ИФА) с предварительным электрофоретическим разделением белков вируса в геле и их переносом на нитроцеллюлозную мембрану. Процедура иммуноблота состоит из нескольких стадий ( рис. 27 ). Сначала предварительно очищенный и разрушенный до составных компонентов ВИЧ подвергается электрофорезу, при этом все входящие в состав вируса антигены разделяются по молекулярному весу. Затем методом блоттинга антигены переносят из геля на полоску нитроцеллюлозы или нейлонового фильтра, которые отныне содержат невидимый пока глазом спектр белков, характерный для ВИЧ. Далее на стрип наносится исследуемый материал (сыворотка, плазма крови пациента и т.п.), и если в пробе есть специфические антитела, то они связываются со строго соответствующими им полосками белков-антигенов. В результате последующих манипуляций (подобных ИФА) результат этого взаимодействия визуализируется - делается видимым. Наличие полос на определённых участках стрипа подтверждает присутствие в исследованной сыворотке антител к строго определённым антигенам ВИЧ.
Иммунный блоттинг чаще всего используют для подтверждения диагноза ВИЧ-инфекции. ВОЗ считает положительными сыворотки, в которых методом иммунного блотинга обнаруживаются антитела к каким-либо двум белкам оболочки ВИЧ. Согласно этим рекомендациям, при наличии реакции только с одним из белков оболочки ( gp160 , gp120 , gp41 ) в сочетании или без реакции с другими белками, результат считается сомнительным и рекомендуется повторное исследование, с использованием набора другой серии или другой фирмы. Если и после этого результат остается сомнительным, исследования продолжаются через каждые 3 месяца.
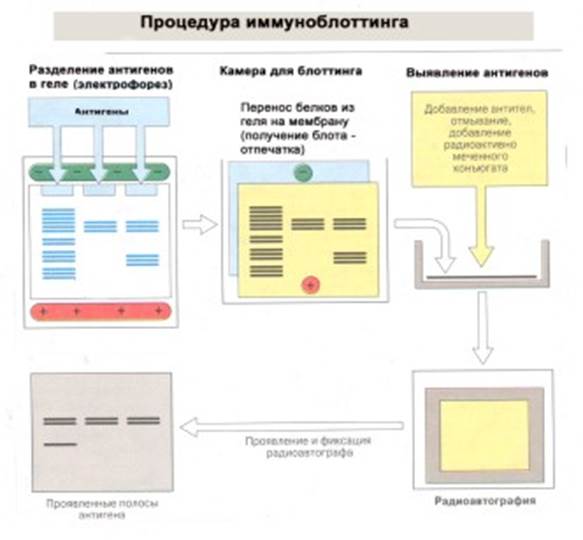
Для проведения иммуноблотинга на первом этапе белки, содержащиеся в сыворотке крови, разделяют в геле по их молекулярной массе и заряду с помощью электрического поля (методом электрофореза в геле). Затем на гель накладывают нитроцеллюлозную или нейлоновую мембрану и "промокают" (это и есть блоттинг). Это осуществляют в специальной камере, которая позволяет осуществить полный пернос материала из гела на мембрану. В результате та картина расположения белков, которая была на геле, воспроизводится на мембране (блот), с которой можно далее легко манипулировать. Первоначально мембрану обрабатывают антителами к искомому антигену, а после отмывки несвязанного материала, добавляют радиоактивно меченный коньюгат, который специфически связывается с антителами (как в ИФА). Местоположение образующегося комплекса антиген - антитело - меченый коньюгат определяют с помощью авторадиографии с использованием рентгеновской пленки. После ее проявления все становится ясным, есть антигены в крови или их нет.
Последнее изменение этой страницы: 2017-01-19; Нарушение авторского права страницы
Читайте также:


