Чистая культура вирусов бактерий других микроорганизмов или культура клеток
Сижу читаю новости и так так громко, так оглушительно громко! Но когда узнал откуда и где, понял, что что то тут не чисто. В сколково кажется только бабло отмывали, а тут такое. У меня 9 классов образования, но мне было смешно. Ибо насколько я знаю 1) там написано Это приводит к появлению различных форм кислорода и водорода, которые повреждают клетки вирусов. А разве вирус состоит из клеток? Вирус это даже не клетка а набор РНК или ДНК (то есть белков). Может я не знаю, вики не читал. поправите если что. 2) «Одна десятая процента соли такой кислоты в воде препятствует размножению коронавируса. А разве вирус может размонжаться в воздухе или воде? Он кажется проникает в клетку и за счет ее материала реплицирует себя. В другой среде он может просто сохраняться (какое то время), пока не найдет среды для размножения, или погибнет. Ну там статья. Может еще что там на грани фантастики, но мне этого хватило. Вот вся статья:
Российские ученые из Сколково нашли способ эффективно бороться против бактерий, грибков и вирусов. Специалисты выяснили, что обработанная холодной плазмой вода может стать смертельным оружием даже против коронавируса SARS-CoV-2
Работает технология следующим образом. Установка производит холодную плазму — газ из заряженных и незаряженных частиц, который поступает в простую воду. После этого атомы теряют часть электронов и в итоге уже не могут соединиться в молекулу H2O.
Это приводит к появлению различных форм кислорода и водорода, которые повреждают клетки вирусов.
Использовать такую воду можно как для обработки масок и различных поверхностей, так и для распыления в воздухе. Она безопасна для человека и довольно дешевая в производстве — порядка 100 рублей за тысячу литров.
Ребята, возможно, сделали узконаправленый антисептик. А дальше учёный изнасиловал журналистов.
Пока рано судить.
Ничем не лучше. Такая же лабуда для тех, кто прогуливал/забыл школу. Мне аж интересно стало, какие новые формы есть у водорода и кислорода.
Это вопрос к журналистам, а не к компании.
пояснил глава компании Дмитрий Балаболин
Заебись, человек с такой фамилией просто не может врать.
Дмитрий Балаболин - это годится, это зачет)))))
Почему мне кажется знакомым этот человек? Как будто двадцать лет знал
Да хуле антисептик?!
Мы вон йогурты и живыми бактериями можем морозить так, что будешь доставать из морозилки, размораживать и есть как свежие. Пиво морозим без консервантов. Икру.
Тоже физика. И тоже вместо теории будем всякую хуйню рассказывать.
Что бы конкуренты не догадались как это работает.
Хуле доебались? Как-то сделали и как-то работает уже. С какого перепугу я должен вместо того что бы толкать по всему миру оборудование вдруг взять и каким-то пидарасам разболтать секреты.
Делается из воды. 99 процентов. Могу сделать что бы убивало и бактерий и вирусов а могу что бы только вирусов.
Можно пить. Имеется акт проверки в Евросоюзовской лаборатории питьевой воды.
К 9 мая будет сертификация в ЕС.
Там внутри хитрая физика. Будет патент там и почитаете.
Это рывок! Нет, прорыв! 100 рублей за 1000 литров! Но тут наверняка есть подвох, это же "Сколково". Сто процентов наноопрыскиватель для той воды (ручной, с бачком на 8 литров) будет стоить 100500 рублей и для его производства надо строить завод с инвестициями 100500 лярдов.

Я хуй знает откуда ты взял всю ту бредятину которую тут написал, но надеюсь что на моменте
Я хуй знает откуда ты взял всю ту бредятину которую тут написал
ты не забыл хрюкнуть как сучара.
Означает: ржал аки конь :)

Инфодемия: фейк vs. коронавирус
ЛОЖЬ: японские врачи рекомендуют пить каждые 15 минут, чтобы смывать вирус COVID19 в желудок, где его убьет желудочный сок.
-----
Италия, Венесуэла, Колумбия
Ложь: кофе может вылечить Covid-19.
------
Индия
ЛОЖЬ: банкноты 2000 рупий, разбросанные по Дели, для распространения коронавирусной инфекции.
ЛОЖЬ: Некоторые страны сбрасывают инфицированные COVID-19 трупы в море, поэтому будьте осторожны при потреблении морепродуктов.
ЛОЖЬ: Доктор Чарльз Либер, заведующий кафедрой химии и химической биологии Гарвардского университета, был арестован за изготовление и продажу коронавируса в Китай.
Ложь: президент Колумбии Иван Дуке занял третье место в мире по борьбе с пандемией Covid-19
ЛОЖЬ: 18 стран, включая США, Великобританию и Австралию, просят премьер-министра Индии Моди возглавить оперативную группу, чтобы остановить Коронавирус.
ЛОЖЬ: правительство Индии может снизить пенсию работникам на 30% и отменить пенсии для лиц старше 80 лет, чтобы направить средства на управление службами здравоохранения и решить проблему пандемии коронавируса в стране.
ЛОЖЬ: рН коронавируса варьируется от 5,5 до 8,5. Чтобы победить новый вирус, нам нужно потреблять больше щелочных продуктов, превышающих уровень pH вируса.
ЛОЖЬ: американские граждане поставили обнаженную статую президента Трампа в Нью-Йорке, потому что он не справился с ситуацией с коронавирусом в США.
Ложь: боливийское правительство получило более 500 миллионов долларов на борьбу с COVID-19.
Ложь: COVID-19 передается через фрукты и овощи в Гонконге.
ЛОЖЬ: После употребления змеиной крови во время тренировок в Таиланде американские солдаты отправились в Ухань на Всемирные военные игры. Солдаты США были первыми зараженными и переносчиками COVID-19.
ЛОЖЬ: В сообщении говорится, что Барак Обама предупреждал африканцев не принимать европейские или американские вакцины.
ЛОЖЬ: преступники раздают маски с химикатами, чтобы люди потеряли сознание, а потом людей грабят.
Ложь: в принадлежащих мусульманам ресторанах в Бангалоре поварам дают указания шеф-повара плевать в пищу, тем самым распространяя коронавирус.
ЛОЖЬ: Эпидемия коронавируса - это обман, используемый для сокрытия того, что сеть 5G тайно устанавливается в столице Хорватии Загребе.
Ложь: воздействие 5G / радиационное загрязнение нарушает структуру и функцию гемоглобина в клетках и усиливает пандемию COVID-19.
ЛОЖЬ: Майк Райан, директор ВОЗ, сказал, что меры изоляции усиливают пандемию.
-----
Средний Восток, Северная Африка
ЛОЖЬ: Индусы сбрасывают свои религиозные статуи в море из-за их бесполезности в кризисе COVID-19.
Ложь: ссылка, чтобы получить 160 000 песо помощи от колумбийского правительства.
ЛОЖЬ: видео предполагаемого владельца отеля в Нью-Йорке, который выпрыгнул из окна после увольнения всех своих сотрудников. Отель обанкротился из-за карантина.
--------------------
Ну что, хвастайтесь, у кого какие бредовые репосты прилетали?
Добавим треша! :-)
Передается ли вирус COVID-19 человеку от кошки? Как СМИ провоцируют массовую панику с помощью фейков
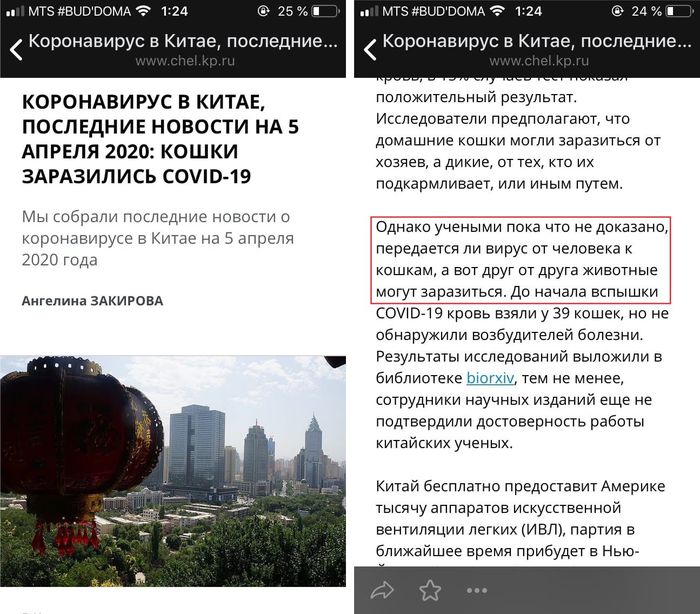
Весь интернет пестрит информацией о том, что учёные Уханьского института вирусологии и Хуачжунского сельскохозяйственного университета обнаружили в организме исследуемых кошек антитела к SARS-CoV-2 - возбудителю инфекционного заболевания, вызвавшего пандемию COVID-19. И изложение этой новости некоторыми изданиями и пабликами встретило крайне негативный отклик со стороны владельцев питомцев и волонтеров. В чем же главные ошибки авторов статей и постов и почему они получили огромное количество хейта со стороны читателей? Они в хайповой и искаженной подаче материала из официальных источников, громких фейковых заголовках в условиях массовой истерии и абсолютной безграмотности авторов. Самое печальное в этой ситуации, что это источники с многотысячной и даже многомиллионной аудиторией.
Приведем пару примеров, с которыми мы успели ознакомиться:
Только вот автор забыл указать пару очень важных нюансов и то, с какой целью были даны рекомендации для владельцев питомцев, о чем мы и расскажем далее.
А представители ежедневной газеты и крупного интернет-издания "Комсомольская правда" попытались убедить недовольных, что статья была написана лишь в целях снижения паники владельцев животных и для "раскладывания по полочкам" официальной информации. Только вот эффект от статьи получился обратный, а разбор совсем не "по полочкам", а, скорее, поверхностный, без уточнения очень важных деталей, которые бы осветили данную информация с правильной стороны без негативных последствий для домашних питомцев.

ЧТО ЖЕ ТАКОЕ КОРОНАВИРУС КОШЕК?
Кошачий коронавирус кошек (FCoV) принято подразделять на две группы по степени патогенности штаммов (чистая культура вирусов, бактерий, других микроорганизмов или культура клеток, изолированная в определённое время и в определённом месте):
— штаммы, вызывающие легкие энтериты (заболевание тонкой кишки) или вообще безопасные для здоровья – кишечные коронавирусы кошек (feline enteric coronavirus - FECV).
— высокопатогенные штаммы – вирус инфекционного перитонита кошек (feline infectious peritonitis virus - FIPV).
Обе группы штаммов считаются единой популяцией вирусов, но с различной степенью патогенности. Однако, было установлено, что FIP является мутацией FECV, которая происходит спонтанно в организме кошек во время течения болезни. Следует также отметить, что сам коронавирус кошек практически безвреден, и его мутация происходит только под воздействием внешних факторов, таких как стресс, хирургические операции, раннее отлучение от матери, транспортировка, голодание, скученное содержание и т.п.
В естественных условиях существует несколько клинических синдромов коронавирусной инфекции кошек, но в большинстве случае не наблюдается никаких клинических симптомов болезни. FECV поражает в основном клетки слизистой оболочки тонкого кишечника кошки и вызывает диарею. Именно коронавирус энтерита заразен, путь заражения – фекально-оральный, а для котят источником заражения становится их мать. FIP уникален тем, что поражает клетки иммунной системы кошек и разносится по всему организму, поражая практически все органы. Эта болезнь на данный момент считается неизлечимой и практически в 100% случаев заканчивается гибелью животного. FIP размножается и существует в клетках крови, а не кишечника, и поэтому не выделяется с фекалиями. Другими словами, он не передается от животного к животному, а возникает вследствие заражения коронавирусом энтерита, который мутирует в форму, поражающую кровяные клетки.
Заболевание широко распространено среди домашних кошек по всему миру. Некоторые исследования подтверждают, что в среднем от 60 до 80% кошек имели контакт, либо были заражены коронавирусом. Из них около 25% свободно живущих кошек и до 95 % кошек питомников и приютов имеют антитела к коронавирусной инфекции кошек. Редко возникающие вспышки FIP в питомниках или приютах затрагивает не более 5-10% поголовья.
Из чего мы делаем вывод, что почти все волонтеры и многие владельцы питомцев ежедневно контактируют с кошками-носителями кошачьего коронавируса вируса и не заражаются им. Даже те, кто регулярно сталкивается с мутацией у кошки вируса в FIP с почти 100% летальным исходом.

ИССЛЕДОВАНИЕ УХАНЬСКОГО ИНСТИТУТА ВИРУСОЛОГИИ. НЕМНОГО ИСТОРИИ
Статьи и посты гласят о том, что ученые Уханьского института вирусологии и Хуачжунского сельскохозяйственного университета в ходе лабораторного эксперимента обнаружили антитела к SARS-CoV-2 (возбудителя COVID-19) в организме 15 из 102 испытуемых кошек из Уханя. При этом многие издания "забывают" указать, что при этом самого COVID-19 в пробах, взятых у кошек, исследователи не нашли.
Для начала давайте разберемся, что такое "антитела".
Антитела - это вид белковых соединений плазмы крови, синтезирующихся плазматическими клетками в организме человека и других теплокровных животных в ответ на попадание в него чужеродных или потенциально опасных веществ (антигенов). (Википедия)
Проще говоря, это то, что вырабатывает организм для борьбы с молекулами из бактерий или вирусов, белковых токсинов и т.п. Даже если у кошек, которые контактировали с зараженными COVID-19 людьми, и нашли антитела, этот факт указывает лишь на то, что организм кошки способен побороть вирус и эта информация может стать полезной при разработке вакцины. Но это никак не доказывает обратную передачу вируса от кошки к человеку.

ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ. ВИРУСНАЯ НАГРУЗКА
Микробиологи Уханьского института провели и другой эксперимент, ЦЕЛЕНАПРАВЛЕННО заразив домашних животных в лабораторных условиях вирусом SARS-CoV-2 путем ввода большого количества патогена в их организм. Из чего следует, что дозы были очень высокими и данный эксперимент нельзя считать моделью передачи вируса от питомца к хозяину в реальной жизненной ситуации.
"У двух из пяти собак исследователи в итоге обнаружили вирусную РНК только в фекалиях. У кур, уток и свиней генетический материал патогена и вовсе не был выявлен. Также учёные выяснили, что в организмах кошек и хорьков коронавирус нового типа реплицируется (производится заражёнными клетками) в больших количествах. Это означает, что потенциально они способны передавать заболевание человеку. Однако многие эксперты, прокомментировавшие работу, сходятся во мнении, что кошки вряд ли могут представлять опасность для человека, так как выделяемое ими количество вируса будет всё же недостаточным (прим.: именно по этой причине, мы невосприимчивы ко многим вирусным инфекциям животных — наш организм успевает вырабатывать антитела). Добавим, что отдельный эксперимент показал: три заболевшие COVID-19 кошки заразили ещё одну. Животные были помещены в соседние клетки, поэтому, возможно, передача вируса произошла воздушно-капельным путём. При этом ни у одной из кошек не было симптомов респираторного заболевания, хотя организмы всех четырёх полосатых существ произвели антитела к вирусу SARS-CoV-2."
К сожалению, во всей этой ситуации скорее всего пострадают лишь сами животные, на которых сейчас будут массово проводить эксперименты!
МАССОВАЯ ИСТЕРИЯ ВЛАДЕЛЬЦЕВ ЖИВОТНЫХ
Обсудим еще один важный момент, который спровоцировал большое количество обращений владельцев животных с целью изоляции и даже эвтаназии своего питомца.
Как указывает официальный источник (WORLD ORGANISATION FOR ANIMAL HEALTH): "При подозрениях на заболевание ветеринарная станция может взять мазки для исследования животного на COVID-19, в случае, если оно контактировало с подтвержденным больным". НО! В России такой услуги нет!
Все, что могут предложить ветеринарные клиники в нашей стране - это ПЦР (полимеразная цепная реакция) исследование питомца на обнаружение коронавирусной инфекции у кошек. А как мы выяснили ранее, этот вирусные возбудители не опасны для человека, да и в большинстве случаев - даже для своих носителей.
Для примера прикрепляем результат исследования ПЦР нашей Пенелопы (на момент обращения в клинику назвали Дымкой):

Соответственно те, кто побежали вперед паровоза сдавать своим питомцам анализы, проверяли их кошачий коронавирус, а не COVID-19. Каждый уважающий себя ветеринар, в случае подобного обращения, будет обязан объяснить разницу между этими вирусными возбудителями, хотя они и имеют общее название. И, разумеется, не подвергать животное эвтаназии без медицинских показаний к этому, в которые не входит латентное носительство этого вируса.
ТАК ПЕРЕДАЕТСЯ ЛИ ВИРУС ОТ КОШКИ К ЧЕЛОВЕКУ?
Широкое распространение COVID-19 по миру позволяет лишь предположить, что некоторые животные могли заболеть им, если близко контактировали с зараженными людьми. На данный момент нет примеров и доказательств, что животные, зараженные людьми, внесли хоть какой-то вклад в распространение COVID-19. Все случаи заражения были от человека к человеку. Обнаруженные на сегодня случаи заражений собак и кошек являются индивидуальными или внутрилабораторными случаями, эти животные не могут считаться распространителями вируса. Соответственно, нет никаких причин предпринимать какие-либо действия относительно своих домашних любимцев.
Всемирная организация по охране здоровья животных напоминает:
"COVID-19 стал причиной множества слухов и домыслов. Важно сохранять спокойствие и находить источники информации с доказательной базой. Не следует относиться к питомцам иначе, чем до вспышки вируса. Как и прежде, не следует искать контакта с неизвестными вам животными, а в случае контакта достаточно соблюдать базовые правила гигиены."
Из всего вышесказанного — нет официальных подтверждений тому, что кошки являются потенциально опасными переносчиками COVID-19 для человека. Учитывая приведенные факты с лабораторными исследованиями, у вас в миллион раз больше шансов заразиться от человека в очереди за хлебом, чем от вашего питомца.
У нас только один вопрос: что мешает источникам, о которых шла речь в статье, проверять информацию и публиковать только официально подтвержденные факты без создания лишней паники? Или хайп стоит жизней сотней домашних питомцев? В этот сложный период мы должны заботиться друг о друге как никогда. Будьте благоразумны, не доверяйте громким заголовкам, проверяйте источники информации, берегите себя и своих пушистых друзей!
Бактериальная культура — совокупность бактерий, выросших на твердой или жидкой питательной среде.
Для получения бактериальной культуры достаточно внесения в питательную среду хотя бы одной микробной клетки, которая при оптимальных условиях за короткое время дает большое число поколений. Скорость размножения зависит от особенностей данного бактериального вида и от условий роста (питательная среда, pH, температура, аэрация и др.). Рост бактериальной культуры в жидкой питательной среде проявляется в помутнении среды, образовании осадка или поверхностной пленки. На плотной питательной среде бактерии образуют колонии (см. Колония бактериальная), которые имеют характерную морфологию и наряду с типом роста в жидкой питательной среде служат тестом для идентификации. При высеве большого числа бактерий на поверхность плотной питательной среды образуется сплошной рост культуры бактерий — газон. Если на питательной среде вырастают бактерии одного вида, культура считается чистой. Смесь двух или более видов бактерий носит название смешанной бактериальной культуры. В естественных условиях бактерии находятся в ассоциациях и при посеве на питательные среды вырастают в виде смешанных культур. Выделение чистых бактериальных культур требует применения специальных методов, основанных либо на механическом разобщении бактериальных клеток, которые затем выращиваются изолированно, либо на использовании биологических особенностей бактерий выделяемого вида, которые позволяют освободить их от сопутствующих бактерий. В чистой культуре проверяют видовую принадлежность бактерий с помощью системы тестов, включающей изучение морфологии и комплекса биологических свойств (см. Идентификация микробов). Выделение чистой бактериальной культуры и ее идентификация составляют основу бактериологического исследования (см. Бактериологические методики). После выделения и идентификации чистую бактериальную культуру называют штаммом (см.).
Бактериальная культура с различной степенью отклонений от свойств, характерных для данного вида, носят название атипичных. Отклонения могут касаться только одного свойства, часто важного в системе тестов, используемых для идентификации, или ряда свойств. В последнем случае идентификация стандартными методами затруднительна. Принципы идентификации атипичных бактериальных культур основаны на попытках их реверсии, а также на использовании дополнительных биохимических и биофизических методов исследования.
Бактериальные культуры, выращенные на различных питательных средах, носят соответствующие названия — агаровая культура, желатиновая, бульонная. Для получения агаровой бактериальной культуры применяют питательные среды, куда добавлен агар (см.) в концентрации, зависящей от целей исследования и вида микроорганизма. Для выращивания бактерий на поверхности твердой питательной среды применяют концентрации агар-агара 1—2%.
При концентрации 0,7% и ниже агар называют мягким или полужидким и используют для засева бактерий в глубину среды. Засев бактерий в питательную среду с желатиной применяется лишь со специальными целями, так как образуемый желатиной гель (10—15%) плавится при t° 25° и разжижается протеолитическими ферментами бактерий. Для многих исследований исходным материалом служит бульонная бактериальная культура, выращенная в течение ночи в термостате (примерно 16—18 часов). После разведения в свежей среде и подращивания легко получить бактериальную популяцию в любой фазе роста. При высокой концентрации клеток в быстрорастущей бактериальной культуре аэробов приходится прибегать к аэрации для пополнения содержания кислорода в среде (аэрированная бактериальная культура). Применяют либо встряхивание небольшого количества среды в сосуде относительно большого объема, либо пропускание через среду стерильного воздуха. Аэрация широко применяется в производственной практике при выращивании бактерий в реакторах больших объемов (глубинные бактериальные культуры).
Чистая бактериальная культура, растущая на питательной среде, представляет популяцию генетически идентичных особей. Тем не менее эти особи могут отличаться друг от друга по ряду физиологических признаков: по размерам, составу клеточной оболочки, возрасту и пр. Часть различий удается устранить при синхронизации деления бактерий. Принцип получения синхронных бактериальных культур состоит в остановке деления бактерий воздействием физических или химических факторов при сохранении физиологической активности. После устранения фактора, задерживающего деление, бактерии начинают делиться одновременно. Синхронность деления выявляется наиболее четко в течение первых 2—3 генераций.
Количественную оценку размножения бактерий в культуре проводят определением какой-либо величины, характеризующей интенсивность размножения. В зависимости от целей исследования такой величиной может служить общая масса бактерий либо число отдельных микроорганизмов в 1 мл культуры. При росте бактериальных культур масса и число бактерий изменяются независимо друг от друга, и в разные периоды роста отношение общей массы к числу бактерий колеблется. Характер процесса размножения бактериальных культур в конечном итоге определяется системой, в которой происходит размножение. В закрытой системе при ограниченном объеме среды (пробирка с бульоном) различают несколько последовательных фаз размножения, которые заканчиваются гибелью части популяции (см. Бактерии). В поточной культуре, напр, в открытой системе типа хемостата (см.), размножение бактерий непрерывно поддерживается подачей свежей среды и одновременным удалением части биомассы бактерий. Концентрация бактерий регулируется скоростью поступления свежей среды и зависит от концентрации одного или нескольких лимитирующих метаболитов.
Сохранение бактериальной культуры должно обеспечить постоянство состава бактериальной популяции в течение неограниченно долгого времени. Это достигается поддержанием жизнеспособности максимального числа бактерий, взятых для сохранения, так как при гибели значительной части популяции всегда существует возможность отбора вариантов. Исходную культуру рассевают на чашках для получения изолированных колоний. Убедившись в отсутствии загрязнения, отбирают для получения субкультур несколько десятков колоний. Это исключает, с одной стороны, возможность отбора мутантов из-за их редкости, с другой стороны, предупреждает отбор часто встречающихся вариантов немутационной природы, возможный при отсеве единичных колоний. При сохранении методом лиофильной сушки субкультуры колонии суспендируют в специальной многокомпонентной среде и подвергают быстрому испарению в комбинации с охлаждением и замораживанием. Лиофильная сушка (см. Лиофилизация) позволяет сохранить жизнеспособность существенной части популяции в течение ряда лет и исключает отбор.
Для сохранения бактериальной культуры на питательных средах используют засев на 0,6% питательный агар в столбике с добавлением сыворотки. При хранении ауксотрофов в среду следует добавлять необходимые факторы роста. Для предохранения от высыхания выросшие культуры заливают сверху стерильным вазелиновым маслом или запаивают пробирки и хранят их при t°—4°. Рекомендуется проводить пересевы культуры после проверки основных свойств не реже одного раза в 6 месяцев. Хранение на питательных средах при температуре выше 0° не исключает деления бактерий. Для некоторых видов бактерий необходимы более частые пересевы. Спорообразующие бактерии, напротив, могут храниться без обновления среды длительное время.
Бактериальные штаммы, используемые в производстве и научно-исследовательской работе, хранят в музеях живых культур при институтах и лабораториях соответствующих профилей. Организован обмен бактериальными штаммами между лабораториями различных стран.
Порядок хранения, обращения, отпуска и учета бактериальных культур патогенных Микроорганизмов установлен соответствующими инструкциями.
Сборник методик по генетике микроорганизмов, под ред. Р. Клауса и У. Хейса, пер. с англ., М., 1970, библиогр.; Тимаков В. Д. и Гольдфарб Д. М. Основы экспериментальной медицинской бактериологии, М., 1958; Экспериментальная микробиология, под ред. С. Бырдарова, пер. с болг., София, 1965,библиогр.
Цель занятия. Освоить технику посева микроорганизмов на плотные и жидкие питательные среды и методы выделения чистых бактериальных культур. Ознакомить студентов с основными культуральными характеристиками микроорганизмов и методами определения количества бактерий.
Оборудование и материалы. Бульонные и агаровые культуры В. cereus, Е. coli и S. aureus в пробирках и в чашках Петри, смешанная бульонная культура Е. соli и S. aureus, стерильные МПА и МПБ в пробирках, чашках Петри, солевой МПА (8 % хлорида натрия) в чашках Петри, стеклянные шпатели, стерильные пипетки Пастера, бактериологические петли.
Культура микроорганизмов — это популяция (расплодка) клеток на питательной среде. Посев и пересев культур микроорганизмов на питательные среды — наиболее частый методический прием, который используют для первичного выделения микроорганизма из какого-либо объекта, а также для поддержания культур в жизнеспособном состоянии в лабораторных условиях.
Чистая культура — это популяция бактерий одного вида или биологического варианта (биовара), выращенная на питательной среде.
Штаммы — чистые культуры микроорганизмов одного вида, выделенные из разных объектов или из одного и того же объекта, но в разное время.
Колония — макроскопически видимое скопление клеток микроорганизма на поверхности или внутри плотной питательной среды, образовавшихся в результате размножения одной жизнеспособной клетки. По этой причине колонию обычно рассматривают как чистую культуру микроорганизма.
Техника посева микроорганизмов. Посевы из нативного материала чаще проводят пастеровской пипеткой, из культур микроорганизмов—бактериологической петлей в зоне стерильного воздуха над пламенем горелки. На культуральных сосудах (пробирки, чашки Петри, колбы и т.д.) пишут номер экспертизы, под которым зарегистрирован материал, дату посева.
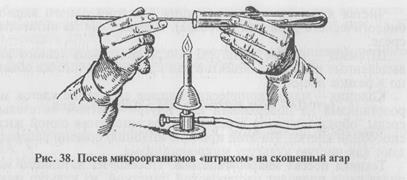
Посев на жидкую питательную среду. Пробирку с исследуемым материалом и пробирку с питательной средой держат в левой руке, в правую руку берут бактериологическую петлю или пипетку и'пробки от пробирок (рис. 37). Над пламенем горелки обжигают края пробирок, бактериологическую петлю (пипетку) вводят в пробирку с материалом, переносят материал в пробирку со стерильной питательной средой и стряхивают с петли в среду, не смачивая при этом петледержатель. Края пробирок вновь проводят над пламенем горелки, закрывают пробирки пробками, стерилизуют петлю и ставят ее в штатив. Использованную пипетку опускают концом вниз в банку с дезинфицирующим раствором.
Посев на плотную питательную среду. Выполняют разными способами.
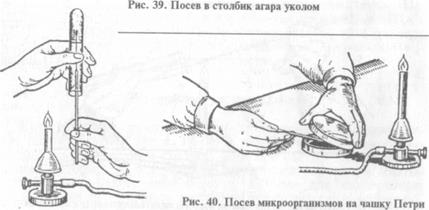
При посеве на чашку Петри: чашку берут в левую руку, большим пальцем левой руки слегка приподнимают крышку, обжигают на пламени горелки края чашки в зоне щели, вносят посевной материал на поверхность питательной среды, затем растирают его при помощи стеклянного шпателя или бактериологической петли (рис. 40).
Посев на полужидкую питательную среду. Выполняют методом укола в столбик питательной среды.
Выделение чистых культур микроорганизмов. При бактериологическом исследовании искомый микроорганизм обнаруживают в материале, как правило, в смеси с бактериями других видов. Классическими методами бактериологии возможно идентифицировать микроорганизм только при условии, что он находится в виде чистой культуры.
Методы, основанные на механическом разобщении клеток. Эти методы наиболее часто применяют при выделении чистых культур микроорганизмов.
Метод Пастера (метод разведений): из исследуемого материала готовят ряд последовательных, чаще десятикратных разведений на стерильной жидкой питательной среде в пробирках или колбах (10 -1 …10 -10 ). Предполагают, что количество микробных клеток в каждом последующем разведении будет меньше, чем в предыдущем, и в какой-то из пробирок останется только одна микробная клетка, которая и даст/начало чистой культуре Микроорганизма. Однако для успешного применения этого метода необходимо, чтобы искомый микроорганизм в материале количественно преобладал над сопутствующими видами.
Метод Коха (метод заливок): исследуемый материал в небольшом количестве вносят в пробирку с расплавленным и охлажденным до 45. 50 "С МПА, перемешивают, затем каплю питательной среды переносят во вторую пробирку с расплавленным МПА и т. д. Количество разведений зависит от предполагаемой численности микроорганизмов в исследуемом материале. Затем содержимое каждой пробирки выливают в стерильные чашки Петри, после затвердения среды посевы помещают в термостат. Фиксированные в плотной среде микробные клетки при размножении формируют колонии, из которых можно отвить (пересеять) чистую культуру микроорганизма.
Метод Дригальского: берут три—пять чашек Петри с плотной питательной средой. В одну из чашек вносят посевной материал и распределяют его шпателем по поверхности питательной среды. Не обжигая шпатель, оставшийся на нем материал последовательно растирают на поверхности среды во второй, третьей и остальных чашках. В последних чашках Петри после инкубирования в термостате обычно наблюдают формирование изолированных колоний бактерий.
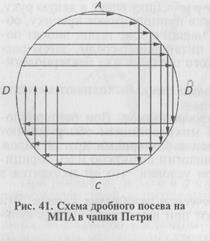
Более экономичен следующий способ получения изолированных колоний. Бактериологической петлей с посевным материалом несколько раз делают параллельные штрихи в одном секторе чашки Петри с питательным агаром (рис. 41). Пет- о лю прожигают в пламени горелки, дают остыть и часть материала из первого сектора <А) аналогичным образом распределяют во втором секторе (В), затем в третьем (С) и четвертом (Д) секторах. Даже при рассеве бактериальной массы из колоний в секторе Д при таком способе получают рост изолированных колоний.
Методы, основанные на биологических особенностях микроорганизмов.Направлены на подавление роста сопутствующей микрофлоры.
Прогревание: при выделении чистой культуры споро-образующего вида бактерий исследуемый материал прогревают при 80 °С 20 мин или кратковременно кипятят. Вегетативные клетки сопутствующей микрофлоры в этих условиях погибают, а споры искомого микроорганизма сохраняют жизнеспособность и прорастают после посева на питательные среды.
Использование селективных питательных сред, которые содержат вещества, подавляющие рост сопутствующей микрофлоры (антибиотики, красители и т. д.), — частый прием при исследовании контаминированного материала. Однако необходимо учитывать, что селективные факторы часто находятся не в бактерицидных, а в бактериостатических концентрациях, поэтому клетки сопутствующих микроорганизмов не растут, но остаются жизнеспособными на поверхности питательной среды и при отвивке колоний исследуемой культуры на обычные среды могут быть причиной получения смешанной культуры.
При выделении чистых культур некоторых видов бактерий используют их другие биологические особенности. Например, способность микроорганизма расти при низких (листерии) или высоких (термофильные бактерии) температурах, которые лежат за пределами температурных диапазонов сопутствующих видов бактерий. Для выделения культуры P. vulgaris используют способность данного вида давать ползучий рост (роение) на поверхности плотной питательной среды. С этой целью материал, содержащий P. vulgaris, засевают в конденсационную воду на дне пробирки со скошенным МПА, не касаясь поверхности среды. Сопутствующая микрофлора растет в нижней части питательной среды, а протей в виде прозрачной пленки распространяется вверХ.
Для выделения С. tetani материал засевают точечно на плотную питательную среду в чашках Петри и после выращивания отвивают культуру с периферии ползучего роста.
Культуральные свойства микроорганизмов. В процессе идентификации наряду с другими свойствами у микроорганизмов изучают культуральные признаки — особенности роста на плотных, жидких и полужидких питательных средах при определенных условиях.
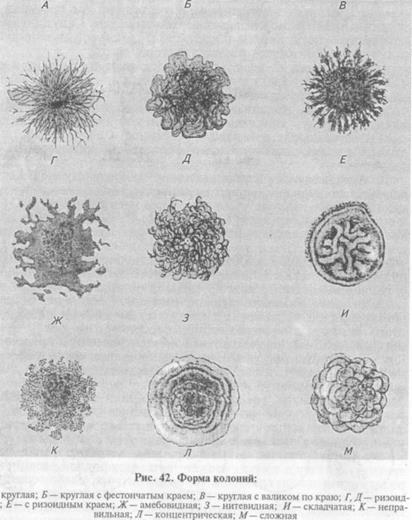
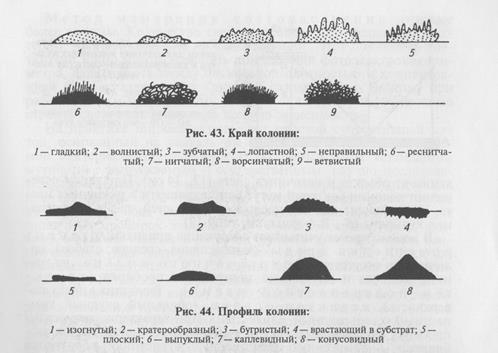
На плотных средах изучают колонии микроорганизмов. Бактерии каждого вида формируют колонии с определенными признаками, которые обычно учитывают при идентификации. Размер колоний: крупные — диаметром 4. 6 мм и более, средние—2. 4 мм, мелкие — 1. 2мм и точечные колонии диаметром менее 1 мм. Форма колоний может быть правильной круглой, неправильной (амебовидной, розеткообразной), корневидной (рис. 42). Цвет зависит от способности микроорганизма образовывать пигмент: белый, желтый, красный, сине-зеленый и т. д. Бактерии, не синтезирующие пигмент, формируют бесцветные колонии. Учитывают характер поверхности, которая может быть шероховатой, блестящей, матовой, сухой, влажной, гладкой, радиально или концентрически исчерченной. Края колонии могут быть ровными, волнистыми, зазубренными, бахромчатыми, их исследуют невооруженным глазом и под малым увеличением микроскопа (рис. 43). Рельеф (профиль) определяют, рассматривая колонию сбоку; различают плоские, конусообразные, куполообразные, плоские с конусовидным центром или углублением в центре колонии, с утолщенными (валикообразными) краями (рис. 44). Учитывают прозрачность колонии: непрозрачная, полупрозрачная, прозрачная. Структура может быть однородной, зернистой, волокнистой и т.д. (рис. 45). Ее выявляют при слабом увеличении микроскопа. Консистенция может быть пастообразной, слизистой, плотной (сухой) и т.д.; ее определяют, дотрагиваясь до колонии бактериологической петлей. Колонии некоторых видов врастают в толщу питательной среды, что также определяют при помощи бактериологической петли. Запах: многие виды бактерий в процессе роста на питательных средах выделяют специфические ароматические вещества.
В жидких средах учитывают следующие признаки: степень помутнения среды (интенсивное, среднее, слабое), наличие или отсутствие пристеночного кольца на границе мениска и внутренней поверхности пробирки, характер поверхностной пленки (толщина, цвет, поверхность), характер осадка (обильный, скудный, компактный, хлопьевидный, слизистый). При характеристике осадка пробирку слегка встряхивают и учитывают результат: осадок разбивается в гомогенную равномерную суспензию; образуются мелкие или крупные хлопья, глыбки; слизистый осадок при встряхивании обычно поднимается в виде косички. Пигментообразующие микроорганизмы вызывают окрашивание питательной среды и осадка (желтое, зеленоватое, красное и т. д.).
Определение количества бактерий. При характеристике развития микробной популяции, санитарной оценке кормов, продуктов питания, при вычислении показателя вирулентности микроорганизма необходимо устанавливать количество микробных клеток в единице объема того или иного материала.
Определение общего количества микроорганизмов. Можно применять метод прямого счета и метод измерения светорассеяния.
Метод прямого счета: бактерии подсчитывают в камерах Горяева, Тома или в окрашенных мазках. В последнем случае 0,01 мл бактериальной суспензии микропипеткой наносят на предметное стекло и равномерно распределяют на 1 см2. Мазок фиксируют, окрашивают и подсчитывают клетки в 10. 15 полях зрения по диагонали квадрата. Определяют среднее число клеток в одном поле зрения. Делят 1 см 2 на площадь поля зрения, которую измеряют методом микрометрии (см. тему 1), затем частное умножают на среднее число микробных клеток в поле зрения, получают их количество в 0,01 мл взвеси бактерий.
Метод измерения светорассеяния считают более точным. Количество света, рассеиваемого суспензией бактерий, пропорционально их концентрации. Этот показатель достаточно точно можно измерить при помощи фотоэлектроколориметра. Зависимость между оптической плотностью и концентрацией клеток различна для бактерий разных видов. Поэтому при работе с таким прибором для каждого вида бактерий необходимо строить свою калибровочную кривую зависимости.
Например, в пробирку поместили 0,1 мл суспензии бактерий, содержащей неизвестное количество клеток. Для уравнивания оптической плотности исследуемой суспензии со стандартом мутности 10 ед. в пробирку добавили 0,9 мл физиологического раствора, т. е. исходную суспензию развели в 10 раз. Известно, что суспензия данного вида бактерий при оптической плотности 10 ед. содержит 1,3*10 9 кл/мл. Следовательно, концентрация исследуемой суспензии составляет 1,3*10 10 кл/мл.
Определение количества живых микроорганизмов. Метод основан на выводе, что бактериальная колония — это результат деления единичной клетки на плотной питательной среде (исключение составляют бактерии, образующие цепочки из клеток).
Мерной пипеткой объемом 1 мл добавляют 1 мл культуры Е. coli в бактериологическую пробирку с 9 мл стерильного физиологического раствора, подогретого до 37. 38 °С (разведение 10-1). Далее аналогичным способом готовят разведения культуры от 10 -2 до 10 -8 . Для каждого разведения используют новую пипетку того же объема и класса. Из пяти последних пробирок суспензию бактерий по 0,1 мл наносят на поверхность подсушенного МПА в две чашки Петри. Внесенный материал стерильным шпателем распределяют по поверхности питательной среды. Посевы инкубируют при 37. 38 ºС 24 ч.
Учет результатов: в чашках Петри, где выросло более 150. 300 и менее 10 колоний, результаты не учитывают. Выбирают чашки Петри с параллельными посевами (из одного разведения), содержащими 10. 150 колоний. Подсчитывают колонии на чашках из одного разведения, суммируют, определяют среднее число колоний и с учетом степени разведения рассчитывают содержание жизнеспособных клеток (колониеобразующих единиц) в 1 мл исходной суспензии бактерий.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
1. Провести пересев бульонной и агаровой культур бактерий на скошенный МПА и в МПБ в пробирках.
2. Провести посев смешанной бульонной культуры на МПА в чашках Петри по методу Дригальского.
3. Описать характер роста Е. coli, S. aureus, В. cereus на МПА (колонии) и в МПБ.
4. Определить количество микробных клеток в 1 мл бульонной культуры Е. coli методом прямого счета и при помощи стандарта мутности.
5. Провести посев бульонной культуры Е. coli на МПА в чашках Петри с целью определения количества жизнеспособных клеток.
Контрольные вопросы
1.Что такое культура, смешанная культура, чистая культура, штамм и колония бактерий?
2.Какие методы применяют для получения чистых культур микроорганизмов?
3.Какие культуральные признаки учитывают при идентификации бактерий?
4.Какими методами определяют общее число микроорганизмов и количество жизнеспособных клеток?
Читайте также:


