Иммуногенность новой гриппозной вакцины
Грипп и гриппоподобные заболевания занимают первое место по частоте и количеству случаев в мире. Эпидемия гриппа ежегодно приходит с наступлением осенне-зимнего сезона, и каждый раз иммунная система не готова к встрече с
Грипп и гриппоподобные заболевания занимают первое место по частоте и количеству случаев в мире. Эпидемия гриппа ежегодно приходит с наступлением осенне-зимнего сезона, и каждый раз иммунная система не готова к встрече с ним. Почему? Грипп является чемпионом среди вирусов по способности к генетической изменчивости, которая позволяет ему уходить от иммунного надзора. Вирус с изменившимися поверхностными белками уже не распознается специфическими противогриппозными антителами к штаммам-предшественникам.
Наиболее эффективным, безопасным и экономически оправданным средством профилактики гриппа является вакцинация. Чтобы вакцина защищала от гриппа, должно быть четкое соответствие вакцинных штаммов эпидемическим. В отличие от большинства других вакцинных препаратов, существует необходимость ежегодного обновления штаммового состава противогриппозных вакцин и, следовательно, необходимость ежегодной иммунизации. Проблема гриппа давно вышла за пределы одной страны. Центрами по гриппу ВОЗ, организованными по всему миру, проводится регулярный мониторинг и сбор информации по сезонным циркулирующим штаммам вируса гриппа и вспышкам заболеваемости. На основании анализа присланного материала эксперты делают прогнозы относительно разновидностей гриппа, которые будут циркулировать в следующем эпидсезоне, а также предлагают вирусы-кандидаты в вакцинные штаммы для производителей.
С учетом того, что дифференциальная диагностика гриппа от других ОРВИ затруднена, показатели иммуногенности вакцин принято оценивать по уровню специфических антител к гемагглютинину (ГА). Защитный эффект ГА-специфических антител неоднократно был продемонстрирован как у животных, так и у людей. Антитела нейтрализуют вирус гриппа, предотвращая его связывание с рецепторами, при этом уровень антител к гемагглютинину напрямую коррелирует с уровнем защищенности. При оценке потенциальной эффективности вакцины титр антител не менее чем 1:40 считают защитным. Антитела к другому изменчивому поверхностному белку вируса гриппа — нейраминидазе — не могут предотвратить инфекцию, однако играют важную роль в защите от тяжелых форм гриппа, препятствуя выходу вирусных частиц из инфицированных клеток и дальнейшему распространению вируса в организме. Гемагглютинин и нейраминидаза названы протективными белками, а вакцины, содержащие только эти очищенные белки, — субъединичными.
Снижение антигенной нагрузки в вакцинирующей дозе обеспечивает максимальный профиль безопасности препарата. Антигены с адъювантом образуют комплекс, который стимулирует гуморальное и клеточное звенья иммунитета. Это приводит к образованию специфических к протективным белкам антител, отвечающих за защиту от гриппа, и повышает общую резистентность организма к инфекции.
Клинические исследования безопасности и иммуногенности Гриппол ® Нео проводились с участием добровольцев в высокоспециализированных исследовательских центрах по изучению вакцинных препаратов и поствакцинальных реакций.
Изучение частоты местных и общих реакций, а также соматической и инфекционной заболеваемости во всех группах наблюдения, проведенное в рамках данного исследования, показало, что препараты хорошо переносятся и обладают низкой реактогенностью. Целью данной публикации является анализ результатов иммуногенности вакцины Гриппол ® Нео в сравнении с коммерческим препаратом — вакциной Гриппол ® .
Материалы и методы
Вакцины
Дизайн исследования
Исследования проведены в соответствии с утвержденными протоколами и согласно разрешению МЗ РФ на клинических базах ФГУ НИИ ДИ Росздрава и ГОУ ВПО СПбГМУ им. ак. И. П. Павлова в соответствии с требованиями Надлежащей клинической практики (GCP).
Дизайн исследования: рандомизированное, двойное слепое, контролируемое сравнительное в параллельных группах. Вакцинация добровольцев проведена после подписания информированного согласия.
Участники были отобраны в соответствии с критериями включения/исключения, определенными протоколом клинического испытания. Всего было вакцинировано 300 здоровых добровольцев в возрасте 18–55 лет (средний возраст — 24,5 ± 0,5 года). Перед прививкой все добровольцы были осмотрены врачом, было проведено измерение температуры тела, артериального давления, женщинам — тест на беременность.
Методом случайного выборочного распределения было сформировано три группы по 100 человек. Вакцинацию проводили однократно в дельтовидную мышцу в объеме 0,5 мл.
Постановка реакции и учет результатов
Иммуногенность оценивали в соответствии с требованиями Европейского комитета к противогриппозным вакцинам (СPMP/BWP/214/96), согласно которым должен выполняться по крайней мере один из трех критериев:
Статистика
Результаты исследований статистически обработаны с использованием t-критерия Стьюдента. Вариационный анализ полученных результатов проводили с применением пакета прикладных программ Statistica 6.0.
Результаты и обсуждение
Серологическое обследование с целью оценки иммунологической эффективности вакцинации проводили, сравнивая уровень антител в парных сыворотках, взятых до прививки и на 21-й день после вакцинации. Во всех экспериментальных группах в сыворотках привитых регистрировали статистически достоверное нарастание титров антител. По всем анализируемым критериям не наблюдалось статистически достоверной разницы в иммунном ответе на серии вакцины Гриппол® Нео с различными дозировками антигенов. В таблицах приведены данные, относящиеся к серии, содержащей по 5 мкг гемагглютинина каждого штамма.
Подсчеты числа лиц с серопротекциями (защитными титрами антител (≥ 1:40)) показали, что в каждой группе уровень этих антител соответствует критерию CPMP (табл. 1).
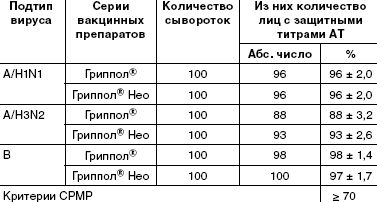
Наиболее иммуногенными оказались компоненты вакцин H1N1 и B. У привитых вакциной Гриппол ® Нео по 5 мкг уровень серопротекций составил 96% и 97% соответственно, у привитых вакциной Гриппол ® — 96% и 98%. Число людей с защитным титром антител (сероконверсий) против штамма A/H3N2 было несколько ниже — 93% для Гриппола® Нео и 88% для Гриппола ® . Достоверных различий по данному показателю между исследуемыми вакцинами и препаратом сравнения вакциной Гриппол ® (p > 0,05) не выявлено. Кратность нарастания антител и доля лиц с 4-кратным и более приростом титра антител являются важными характеристиками иммунного ответа на вакцинацию, особенно у людей, ранее не встречавшихся с данными разновидностями вируса гриппа. В табл. 2 показаны результаты вакцинации серонегативных добровольцев — людей с низким ( ® Нео и Гриппол ® число сероконверсий к подтипу А/H1N1 составило 89,4% и 92,6%; для подтипа А/H3N2 — 77,8% и 77,4%; для типа В — 91,2% и 76,0% соответственно. Кратность прироста титра антител у серонегативных лиц составила от 7,5 до 18,5 для Гриппола ® Нео и от 8,5 до 13,9 — для препарата сравнения.
Известно, что человеческая популяция неоднородна по наличию антител к различным штаммам и подтипам вируса гриппа вследствие гриппозных эпидемий и предыдущих вакцинаций. Среди вакцинированных добровольцев выявлены как серонегативные, так и серопозитивные участники (исходно имевшие защитный титр). Представлялось интересным оценить эффективность иммунизации в общей популяции людей (табл. 3).
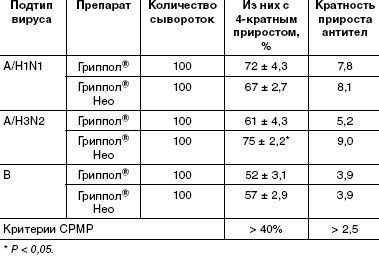
Уровень сероконверсий в целом по группам привитых для штаммов типа А составил 67–75% для вакцины Гриппол ® Нео и 61–72% для вакцины сравнения. Уровень сероконверсий для штамма В составил 57% для вакцины Гриппол ® Нео и 52% для Гриппола ® . Отметим, что в препарате сравнения содержание антигена типа В вдвое выше (11 мкг), чем в тестируемой вакцине — Гриппол ® Нео (5 мкг), однако статистически достоверных различий по иммуногенности к этому компоненту не выявлено.
Выводы и заключение
В настоящее время вакцина Гриппол ® Нео зарегистрирована (РУ № ЛСР-006029/09 от 23.07.2009 г.). Таким образом, семейство вакцин Гриппол ® пополнилось новым полноправным членом, а профилактическая медицина обрела новый инструмент для контроля такого заболевания, как грипп. Гриппол ® Нео стал первой в мире субъединичной адъювантной вакциной с клеточной технологией получения антигенов. При этом впервые вакцинация против гриппа разрешена людям с аллергией на белок куриного яйца. Исследования по расширению показаний к применению вакцины продолжаются.
Ключевые слова: вакцина, грипп, Гриппол ® Нео, клеточная культура
Всемирная система мониторинга циркуляции вирусов, новые технологии выделения и очистки отдельных протективных субъединиц и использование новых субстратов для выращивания вакцинных вирусов позволяют производить эффективные и безопасные препараты в необходимых объемах. Отечественные современные высокотехнологичные инактивированные гриппозные вакцины можно рассматривать как наглядный пример реализации накопленных знаний в сочетании с применением инновационных технологий.
Доклиническая оценка вакцины Гриппол® Нео проводилась несколькими аккредитованными организациями согласно утвержденным протоколам. В различных моделях было показано, что в дозах, многократно превышающих человеческую, вакцина не оказывает токсического, пирогенного, аллергизирующего действия как на взрослых, так и на неполовозрелых и новорожденных животных, безопасна для иммунной системы как в короткие, так и в отдаленные сроки после вакцинации. Результаты доклинических исследований позволили рекомендовать ее к проведению клинических исследований.
Цель данной статьи — ознакомить читателей с результатами клинических исследований вакцины Гриппол® Нео.
Оценка безопасности вакцины Гриппол® Нео у взрослых добровольцев
Клиническое рандомизированное сравнительное двойное слепое контролируемое исследование в параллельных группах (Фаза I), проводимое с целью оценки безопасности, включало 60 здоровых добровольцев обоего пола в возрасте 18–54 лет [2]. Все участники, отобранные в соответствии с критериями включения/исключения, были случайным образом распределены в три группы по 20 человек. Течение поствакцинального процесса, регистрацию и классификацию реакций осуществляли в соответствии с утвержденным протоколом и с учетом требований национальных регулятивных документов и рекомендаций [3–5]. Оценка реактогенности показала, что из симптомов нарушения общего состояния в основном регистрировали слабость (у 3,1% вакцинированных); из местных реакций у 4,0% вакцинированных регистрировали боль в месте инъекции при физической нагрузке или надавливании.
В целом на основании анализа результатов наблюдений сделано заключение о том, что обе дозировки вакцины, полученной с применением клеточной технологии, безвредны и слабо реактогенны. Не зарегистрировано сильных поствакцинальных реакций и серьезных нежелательных явлений. Полученные результаты стали основанием рекомендовать вакцину Гриппол® Нео для проведения исследований на расширенном контингенте вакцинируемых [6]. Задачей клинического исследования Фазы II явилась оценка реактогенности, безопасности, иммуногенной активности двух доз вакцины Гриппол® Нео (5 + 5 + 5) мкг ГА и (10 + 10 + 10) мкг на расширенном контингенте добровольцев в сравнении с референс-препаратом — вакциной Гриппол®. Работа проведена в период с декабря 2008 года по февраль 2009 года на базе кафедры инфекционных болезней и эпидемиологии ГОУ ВПО СПбГМУ им. академика И. П. Павлова и НИИ детских инфекций Росздрава. Рандомизированное двойное слепое контролируемое исследование в параллельных группах включало 300 здоровых добровольцев обоих полов в возрасте 18–54 лет. В соответствии с протоколом было сформировано три группы по 100 человек: две группы участников были вакцинированы Грипполом® Нео, одна группа — вакциной сравнения. В поствакцинальном периоде (5 дней наблюдения после вакцинации) оценивали реактогенность препарата по частоте местных и общих реакций. В течение трех месяцев после вакцинации проводился мониторинг интеркуррентной заболеваемости.
В табл. 1 представлено общее число вакцинированных по группам с местными и общими реакциями на прививку.
Местные реакции выражались в форме боли при надавливании, гиперемии, уплотнения и зуда в месте инъекции. Все регистрируемые реакции были слабой степени выраженности и проходили в течение двух дней. Среди общих реакций преобладали недомогание, ринит; в единичных случаях зарегистрированы субфебрильная температура, боль в горле, кашель, увеличение регионарных лимфоузлов. Продолжительность выявленных реакций, как правило, не превышала одного-двух дней. По результатам трехмесячного мониторинга число случаев соматической, инфекционной и аллергической заболеваемости привитых по группам составило 6, 6 и 5 человек [7].
Таким образом, на основании анализа результатов исследований было установлено, что препарат Гриппол® Нео безвреден для вакцинации людей. Не выявлено сильных поствакцинальных или неожиданных реакций, серьезных нежелательных явлений. Вакцина рекомендована для проведения клинических исследований по расширению контингентов с включением детей 3–17 лет.
Безопасность вакцины Гриппол® Нео при вакцинации детей 3–17 лет
Для вакцинации детей использовали инактивированную субъединичную адъювантную вакцину Гриппол® Нео, в одной вакцинирующей дозе (0,5 мл) содержащую по 5 мкг очищенных протективных антигенов (гемагглютинин и нейраминидаза), выделенных из вируса гриппа типа А и В, выращенного в культуре клеток МDCK, связанных с водорастворимым иммуноадъювантом Полиоксидоний®. Исследования проведены в соответствии с протоколом, утвержденным компетентными регулятивными органами и согласованным с Комитетом МИБП и ФГУН ГИСК им. Л. А. Тарасевича. После получения информированного согласия от самих участников или их родителей дети были рандомизированно распределены в две группы, по 90 человек в каждой: первую группу вакцинировали Грипполом® плюс, вторую Грипполом® Нео. Вакцинацию проводили в три этапа. На первом этапе иммунизировали детей старшей возрастной группы (12–17 лет). После оценки реактогенности вакцины у детей старшего возраста была проведена иммунизация следующей возрастной группы (7–11 лет), далее — в аналогичном режиме — вакцинировали детей младшей возрастной группы (3–6 лет). После введения вакцины привитые в течение 30 минут находились под наблюдением врача, ответственного за проведение вакцинации, и в течение 5 дней под амбулаторным наблюдением медицинского персонала.
Оценку реактогенности проводили в поствакцинальном периоде с нулевого по пятый дни исследования, анализируя жалобы на недомогание, лихорадку и любые другие симптомы как проявление системных реакций, а также боль в месте инъекции, появление гиперемии и отека как симптомы местных реакций. Далее оценивали состояние пациентов в течение трех недель после прививки. Дополнительно в течение трех месяцев после вакцинации были собраны данные обо всех случаях инфекционных, соматических и аллергических заболеваний.
Местные вакцинальные реакции расценивали как слабые, если отек и гиперемия в месте введения вакцины не превышали 25 мм в диаметре, средние при диаметре 25–50 мм и сильные при диаметре более 50 мм. В качестве местной вакцинальной реакции регистрировали также болезненность по субъективным ощущениям слабой степени, средней и выраженную. Из местных реакций у одного ребенка регистрировали боль в месте инъекции при надавливании.
В табл. 2 представлены данные по количеству местных и общих реакций у привитых.
При анализе общих реакций всего было зарегистрировано жалоб на нарушение общего характера в группе привитых вакциной Гриппол® Нео в 4,4% и Гриппол® плюс в 5,6% случаев соответственно. Регистрируемые общие реакции включали единичные случаи субъективных жалоб на недомогание, головную боль; все они отмечены у детей старшего возраста (два ребенка в группе 7–11 лет, один ребенок в группе 12–17 лет). В младшей группе у одного вакцинированного отмечена кратковременная температурная реакция (37,2 °C), не повлиявшая на общее состояние. Все наблюдаемые системные реакции были легкими, не вызывали нарушения самочувствия и проходили самостоятельно в течение нескольких часов после вакцинации. Было отмечено, что оба препарата малореактогенны, хорошо переносятся детьми: местные реакции практически отсутствовали, общие реакции, зарегистрированные у незначительного числа детей, относятся к нормальным реакциям слабой степени выраженности.
Таким образом, 94,4% привитых вакцинацию переносили бессимптомно. Полученные результаты свидетельствуют о высоком профиле безопасности и хорошей переносимости вакцины [8].
Мониторинг заболеваемости вакцинированных в течение трех месяцев после прививки выявил по два случая заболевания легкими формами ОРВИ в каждой группе.
На основании проведенных исследований были внесены изменения в инструкцию по применению вакцины Гриппол® Нео: вакцина рекомендована для вакцинации детей с трех лет и взрослых без ограничения возраста.
Иммуногенность вакцины Гриппол® Нео
Оценку иммуногенности проводили у тех же контингентов для двух дозировок гриппозной субъединичной адъювантной вакцины Гриппол® Нео — по 5 и по 10 мкг гемагглютинина (ГА) каждого из трех рекомендованных штаммов.
Парные сыворотки, взятые до и спустя 21 день после иммунизации, анализировали в методе реакции торможения гемагглютинации (РТГА) в соответствии с описанием МУ 3.3.21758–03.
Уровень сероконверсий (процент лиц с четырехкратным увеличением титра антител после вакцинации) для трех вакцинных штаммов А/H1N1, A/H3N2 и В варьировал в диапазоне от 77,4% до 92,6%; уровень серопротекций (процент людей с защитными титрами антител после вакцинации) составил от 93% до 97%, кратность прироста титров антител — 7,5 до 18,5 соответственно. Результаты оценки иммуногенности двух доз вакцины Гриппол® Нео у исходно серонегативных взрослых представлены в табл. 3.
Из таблицы видно, что две дозы вакцины (по 5 и по 10 мкг ГА каждого из актуальных штаммов) достоверно не отличаются. В качестве конечной дозировки была выбрана доза (5 + 5 + 5) мкг ГА каждого штамма.
Таким образом, Гриппол® Нео обладает хорошей иммуногенностью и удовлетворяет всем трем критериям, сформулированным Европейским комитетом для гриппозных вакцин [9].
Заключение
Неоднократно показано, что сезонная вакцинопрофилактика гриппа является надежным средством, не только обеспечивающим защиту от гриппа, но и способствующим повышению резистентности организма к другим вирусным ОРВИ. Именно результаты независимых исследований, показавшие высокую профилактическую эффективность иммунизации, стали основанием для включения прививки от гриппа в Национальный календарь профилактических прививок. А необходимость ежегодной вакцинации, в свою очередь, стала стимулом для создания ареактогенных вакцин, обладающих высочайшим профилем безопасности.
Живая боевая.
Российская вакцина от гриппа покоряет мир
Вспышка пневмонии, вызванная уханьским коронавирусом, изрядно напугала человечество. Видимо, в первую очередь из-за того, что явление это новое, неизученное.
От гриппа на планете ежегодно умирают 300-600 тысяч человек, но никакой паники в связи с этим не наблюдается. Грипп мы знаем, известны и средства его профилактики. Тем более что вакцины улучшаются каждый год – над этим работают ученые во всем мире. Весомый вклад вносят и российские иммунологи.
Мы занимаемся усовершенствованием гриппозных вакцин, обеспечивающих специфическую защиту от гриппа,
– начинает рассказ Ирина.
Это защита именно от вируса гриппа, то есть выработанный иммунный ответ не будет защищать от других инфекций. Существует еще неспецифическая профилактика гриппа – это когда мы повышаем устойчивость организма к вирусам за счет здорового образа жизни, ношения защитных масок, избегания скопления людей в сезон эпидемий.
Какие вакцины считаются живыми? Что означает повышение их иммуногенности и расширение спектра действия?
Разве вирус может быть безвредным?
Поэтому такая безвредная живая вакцина лицензирована в России для применения у людей в возрасте от трех лет, а аналогичная американская вакцина – в возрасте от двух. Такой вирус размножается на слизистых оболочках верхних дыхательных путей и стимулирует выработку различных звеньев иммунного ответа, не вызывая при этом никаких клинических симптомов заболевания.
А это что такое?
Как вы усиливаете иммуногенность и расширяете спектр действия вакцин с помощью генно-инженерных и иммуногенетических подходов?
Кроме того, в мире накоплен большой массив данных о способности вирусов гриппа, несущих укороченный вариант NS1-белка, вызывать образование более высоких показателей специфического противовирусного иммунного ответа. Таким образом, укорачивая кодирующую последовательность белка NS1 вакцинного штамма с 237 до 126 аминокислот, мы не только повысим иммуногенность живой гриппозной вакцины, но и сделаем ее более безопасной.
А для расширения спектра защитного действия вакцины мы планируем на место удаленного участка белка NS1 встроить кусочки других вирусных белков. И тут подключаются иммуногенетические подходы – отбор перспективных иммуногенных участков вирусных белков (их называют эпитопами), иммунитет к которым способен подавлять размножение обширного спектра вирусов гриппа.
Значит, вы занимаетесь не только вакцинами для людей, но и для животных?
Наш основной фокус – вакцины для людей. Но известно, что вирусы гриппа птиц способны периодически вызывать инфекции у людей, находящихся в тесном контакте с зараженной птицей. Мы используем такие вирусы птичьего гриппа для дизайна новых вакцин, предназначенных для применения у людей.
В этом году заговорили о коронавирусе из Китая. Действительно ли он опасен и будут ли новые вакцины, над которыми вы работаете, включать этот вирус?
Действительно, из-за высокой степени изменчивости вируса гриппа противогриппозные вакцины обновляются практически ежегодно. Во всем мире рекомендуют делать прививку от гриппа каждый год: осенью – для Северного полушария, весной – для Южного. Что касается нового коронавируса, появившегося в конце 2019 года в Китае, то он действительно представляет определенную опасность из-за отсутствия на момент его выявления специфических средств профилактики и лечения. Однако по уровню трансмиссивности (способности передаваться от человека к человеку воздушно-капельным путем) и смертности он значительно уступает вирусам гриппа, ежегодно уносящим сотни тысяч человеческих жизней во всем мире.
А почему такая паника во всем мире?
Работы по созданию вакцин против нового коронавируса ведутся в разных странах, однако сложно предсказать, когда такие экспериментальные разработки будут готовы для применения в широкой практике. На их создание могут уйти годы. Мы не планируем работать с коронавирусом в рамках нынешнего проекта, он полностью посвящен разработкам в области создания вакцин от гриппа. Однако разработкой коронавирусной вакцины занимаемся в рамках гранта Российского научного фонда. В геном вакцинного вируса гриппа мы встраиваем иммуногенные участки (эпитопы) от других возбудителей ОРВИ. Получается поливалентная вакцина, способная обеспечить защиту и от гриппа, и от других респираторных вирусов.
Отличаются ли вакцины от гриппа в разных странах? Сотрудничаете ли вы с зарубежными коллегами?
Гриппозные вакцины, применяемые в разных странах, могут различаться по технологии производства. Но по сути это те же два класса вакцин, о которых я уже говорила: инактивированные и живые. Если инактивированные вакцины производит большое количество фармацевтических компаний по всему миру под различными брендами, то живых гриппозных вакцин в мире существует только две.
Мы, то есть отдел вирусологии им. А.А.Смородинцева Института экспериментальной медицины, первыми зарегистрировали такую вакцину еще в 1987 году, тогда как американцы аналогичную вакцину ввели в практику только в 2003-м.
Важно отметить, что российская технология производства живой гриппозной вакцины применяется и в других странах. Построены новые заводы или адаптированы существующие производства в Индии, Китае, Таиланде. Отдел вирусологии Института экспериментальной медицины сотрудничает со Всемирной организацией здравоохранения – мы готовим вакцинные штаммы для живой гриппозной вакцины, которые поставляются на производства за рубеж.
Кроме того, у нас установились тесные международные научные связи и в области фундаментальных исследований. В частности, мы ведем совместные проекты с Центром по контролю и профилактике заболеваний (Атланта, США), Государственным университетом штата Джорджия (Атланта, США), Институтом иммунологии им. P.Doherty (Австралия), Национальным институтом общественного здравоохранения и окружающей среды (Билтховен, Нидерланды). Все эти организации признают преимущества нашей технологии, нашей вакцины и сами инициируют проведение совместных исследований. Такое сотрудничество позволяет получать результаты мирового уровня и, безусловно, поднимает престиж отечественных разработок на мировой арене.
Как вы считаете, можно ли победить грипп, как в свое время победили опасные инфекционные заболевания?
Это очень трудный вопрос. Вирус гриппа очень пластичен и достаточно легко находит способы ухода от иммунной системы восприимчивого организма. Кроме того, у вирусов гриппа, пожалуй, самый обширный природный резервуар: всевозможные варианты вирусов циркулируют среди водоплавающих птиц и разных видов млекопитающих. В этом резервуаре постоянно происходит мутационная изменчивость, и периодически неизбежно возникает такой вариант мутантного гена (или сразу нескольких генов) вируса, который способен заражать человека, а главное – передаваться от одного человека к другому воздушно-капельным путем, тем самым вызывая очередную пандемию гриппа. Искоренить грипп из популяции пернатых и животных в принципе невозможно, так как в подавляющем большинстве случаев инфекция протекает бессимптомно, а дикие перелетные птицы постоянно переносят из одного континента на другой новые антигенные варианты вирусов гриппа.
- Сейчас в перечне кандидатных вакцин против COVID-19, который формирует Всемирная организация здравоохранения, числится 83 разработки, - сообщила пресс-служба Роспотребнадзора . Как отмечают в ведомстве, в этот список включено 9 вакцин, разработанных в России . То есть на отечественные разработки приходится более 10% перечня ВОЗ.
- Пептидная вакцина на платформе, использовавшейся ранее для создания вакцины против вируса Эбола
- Живая векторная вакцина на основе вируса кори
- Рекомбинантная интраназальная вакцина на основе вируса гриппа А
- Векторная вакцина на основе вируса везикулярного стоматита
Еще две вакцины — разработки компании БИОКАД:
- Инкапсулированная в липосомы мРНК
И еще одна вакцина разработана Санкт-Петербургским научно- исследовательским институтом вакцин и сывороток. В ее основе рекомбинантный белок, наночастицы (на основе S-белка и других эпитопов).
КОММЕНТАРИЙ ЭКСПЕРТА
Безопасная и эффективная вакцина может появиться в марте — апреле следующего года
- Среди российских разработок вакцин представлены препараты многих типов. Это хорошо, потому что означает: потенциально мы как страна претендуем на то, что можем работать практически со всеми известными технологиями разработки вакцин, - отмечает иммунолог, эксперт по исследованиям, разработке и регистрации лекарственных средств, кандидат медицинских наук Николай Крючков.

Иммунолог, эксперт по исследованиям, разработке и регистрации лекарственных средств, кандидат медицинских наук Николай Крючков. Фото: Личный архив
- Также плюсом можно назвать то, что нет монополии разработок, - продолжает эксперт. - В борьбе с коронавирусом участвуют разработчики вакцин и из нескольких государственных институтов, и ученые крупной биотехнологической компании.
Теперь о том, чего нельзя допустить, на что нужно обращать пристальное внимание. Очень важно, чтобы были проведены качественные клинические исследования. Многие страны, включая нашу, пошли на ускоренную, упрощенную процедуру доклинических испытаний (на клеточных культурах и на животных). И если это еще допустимо, то неоправданное ускорение исследований на людях может сыграть злую шутку. Во время таких испытаний определяется безопасность и иммуногенность вакцин (то есть их способность формировать иммунитет). Если не соблюсти необходимые процедуры исследований, то можно получить в лучшем случае неработающие вакцины. А в худшем случае — опасные для здоровья побочные эффекты.
- Какой срок нужен, чтобы убедиться, что разработанные вакцины действительно качественные и эффективные? На совещании у Владимира Путина академик Александр Гинцбург сообщил, что испытания одной из вакцин на людях начнутся уже в июне этого года.
- Если отталкиваться от этой даты, то расклад такой. В клинических исследованиях на людях — здоровых добровольцах — определяется сначала безопасность вакцины. На следующем этапе — ее иммуногенность (по сути — эффективность). Для этого должно быть проведено либо два отдельных исследования, либо одно многоэтапное. Как минимум это может занять в лучшем случае 5 — 6 месяцев. Затем идут процедуры регистрации вакцины. С учетом всех упрощений и сокращений на этом этапе может пройти около двух месяцев. Если параллельно разработчики уже начнут производить вакцину, то первых вакцинаций можно будет ожидать в марте — апреле следующего года.
Спаситель человечества в толстовке.Знаете, как выглядит главный разработчик российской вакцины против коронавируса? Скорее всего, не так, как вы себе его представляете
ПО ТЕМЕ
Уже отобраны 60 человек, которых привьют первыми: среди них — разработчик вакцины. Как за ними будут наблюдать и какие есть риски — в нашем материале (подробности)
ЧИТАЙТЕ ТАКЖЕ
Можно ли переболеть коронавирусом дважды, передается ли он через воду и как понять, что переносишь инфекцию бессимптомно
Мы собрали самые распространенные вопросы россиян и задали их ведущим ученым (подробности)
Читайте также:


