Как вирусы взаимодействуют с магнитными наночастицами

На микрофотографии изображены магнитные игольчатые наночастицы диоксида хрома (CrO2), полученные методом гидротермального синтеза в присутствии малых модифицирующих добавок олова (Sn) и сурьмы (Sb).
Частицы собраны в форме яйца, что обусловлено их высокими магнитными характеристиками. Этот материал может применяться в устройствах магнитной записи и спиновой электронике.
Ансамбли магнитных наночастиц находят весьма широкое применение в современных нанотехнологиях. Достаточно упомянуть такие важные приложения магнитных наночастиц, как сверхплотная магнитная запись информации, магнитные жидкости с уникальными реологическими свойствами, высококоэрцитивные постоянные магниты, пр. В последнее время быстро развиваются весьма перспективные биомедицинские применения магнитных наночастиц, такие как магнитная резонансная томография, адресная доставка лекарств, магнитная гипертермия, глубокая очистка биосред от токсинов и примесей, и.т. д.
Химики, физики, инженеры и технологи долгие годы работают с разнообразными ансамблями магнитных наночастиц, добиваясь оптимизации физико-химических свойств ансамблей для разнообразных технический применений. Эта работа еще далека от завершения. Это связано во-первых с тем, что само явление магнетизма достаточно сложно для изучения. А во вторых, весьма непросто работать с нано- объектами, наблюдать которые можно лишь с помощью совершенных электронных микроскопов.
Ферромагнитное вещество обладает особым магнитным порядком, который отсутствует в обычных веществах. А именно, в каждой точке ферромагнитного тела существует вектор намагниченности M®, длина которого постоянна, и равна физической величине, называемой намагниченностью насыщения вещества, |M®| = Ms. Намагниченность насыщения – это количество элементарных магнитных моментов в единице объема ферромагнитного вещества, поведение которых скоррелировано квантово-механическим обменным взаимодействием [1,2]. Основным предметом изучения в ферромагнетизме является анализ возможных типов распределения вектора M® по объему ферромагнитного тела в зависимости от приложенного магнитного поля и других факторов. Оказывается, что вектор M® не может меняться резко, скачками, а может лишь плавно разворачиваться в намагниченном теле от точки к точке, сохраняя свою длину. Таким образом, по сути дела магнетизм – это трехмерное векторное поле.
Заметим, что мы живем в окружении различных физических полей. Например, неоднородное распределение температуры внутри и вокруг нас есть трехмерное скалярное поле температуры. Это поле описывается единственной функцией T(r,t), которая может зависеть не только от положения точки в пространстве r, но и от времени t. Для описания же векторного поля нужны три функции – проекции этого вектора на оси декартовой системы координат,
1/r3, то есть оно является дальнодействующим. Это значит, что даже достаточно удаленные участки намагниченного тела связаны магнитным взаимодействием, то есть их поведение согласовано.
Эти два обстоятельства – нелинейность уравнений, которые описывают распределение вектора M® в пространстве, и дальнодействующий характер магнитного взаимодействия, чрезвычайно затрудняют теоретический анализ свойств ферромагнитных материалов. Хотя основные уравнения феноменологического ферромагнетизма были сформулированы Ландау и Лифшицем очень давно, в их знаменитой работе 1935 года [3], существенный прогресс в разработке теории ферромагнетизма произошел лишь в 90-х годах прошлого века, в связи с развитием мощных методов компьютерного моделирования. До сего времени магнитные наночастицы остаются одним из центральных объектов теории ферромагнетизма, и все еще являются важной областью экспериментальных изысканий. Дело в том, что протяженное ферромагнитное тело обладает большим числом магнитных степеней свободы. Действительно, в макроскопически большом теле вектор M® может разворачиваться в пространстве огромным числом способов. Об этом явлении говорят, как о наличии большого числа устойчивых распределений намагниченности, которые могут к тому же легко преобразовываться друг в друга. Поэтому свойствами протяженного ферромагнетика трудно управлять, так как сложно фиксировать магнитное состояние такого тела.
Ясно, однако, что число магнитных степеней свободы резко уменьшается с уменьшением объема тела. Действительно, квантово-механическое обменное взаимодействие разрешает лишь достаточно плавные изменения вектора M® в пространстве, на характерных длинах, превышающих так называемую обменную длину Lex. В хороших ферромагнетиках, таких как железо, кобальт, никель и их сплавы, обменная длина составляет по порядку величины 20-30 нанометров. Если характерный размер наночастицы D меньше или порядка обменной длины, D Dc, то в такой частице могут развиваться неоднородные распределения намагниченности, как правило, вихревого типа.

Рис. 1. Состояние однородного намагничивания в сферической наночастице кобальта диаметром D = 36 нм (слева) и неоднородное вихревое состояние в такой же наночастице диаметром D = 56 нм (справа), полученные с помощью трехмерного компьютерного моделирования.
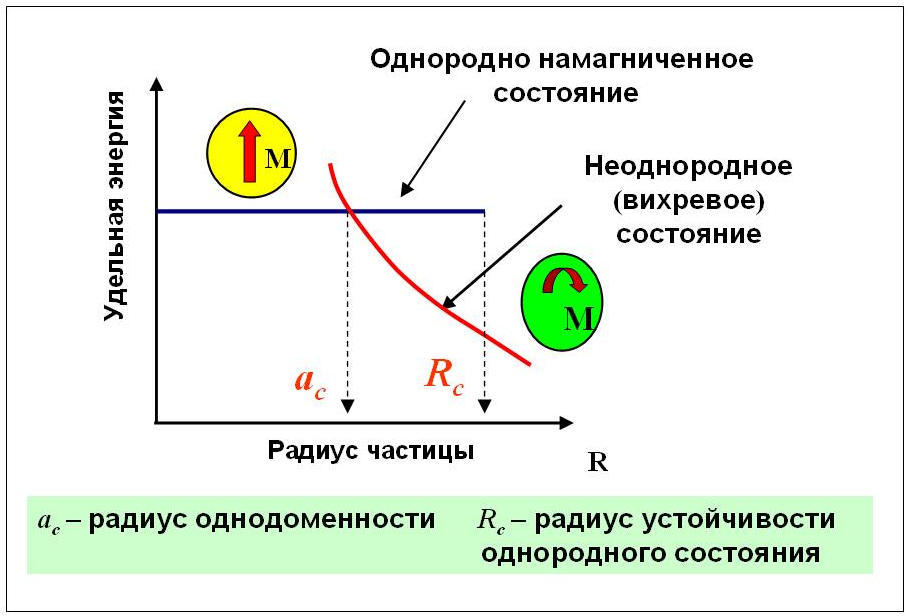
Рис. 2. Схематическая энергетическая диаграмма устойчивых магнитных состояний наночастицы в зависимости от ее радиуса.
Как видно из Рис. 2, полная удельная энергия однородно намагниченного состояния частицы (черная линия) не зависит от радиуса частицы, в то время как полная энергия вихревого состояния (красная кривая) быстро уменьшается с увеличением ее радиуса. Точка пересечения указанных кривых определяет радиус однодоменности частицы ac = Dc/2. Если радиус частицы r ac, то нижайшим по энергии будет вихревое состояние. При этом однородное состояние может существовать как метастабильное в интервале радиусов ac (50 – 70)kBT, [7] где T – температура окружающей среды, kB – постоянная Больцмана. С уменьшением диаметра частицы энергетический барьер быстро падает, но большое значение константы магнитной анизотропии частицы позволяет сохранять указанное неравенство и для частиц нанометровых размеров. К большому сожалению, выращенные методом самосборки частицы FePt [6] находятся в раз -ориентированном магнитном состоянии, когда атомы железа и платины занимают произвольные позиции в кристаллической решетке. А в этом случае, константа магнитной анизотропии вещества оказывается малой, на несколько порядков меньше указанного паспортного значения. Несмотря на значительные усилия по переводу частиц FePt в упорядоченное магнитное состояние с помощью отжига и других методов, эта принципиальная проблема до сих пор не решена. Вообще, проблема влияния на магнитное состояние малых частиц температурных флуктуаций их магнитных моментов известна как суперпарамагнитный предел [7], и все еще ждет своего разрешения.
Итак, температурные флуктуации магнитных моментов частиц приводят к значительным трудностям при создании магнитных носителей сверхплотной записи информации. В то же время, они оказываются весьма полезными для развития одного из интересных биомедицинских приложений магнитных наночастиц, а именно, метода магнитной гипертермии, предназначенного для лечения опасных онкологических заболеваний. Экспериментально доказано, [8] что поддержание температуры пораженного органа около 42°C в течении 20 – 30 мин. приводит к некрозу раковых клеток, более подверженных влиянию повышенной температуры, чем нормальные ткани. Многие ферромагнитные материалы способны поглощать энергию внешнего переменного магнитного поля и тем самым нагревать окружающие ткани. Однако, магнитные наночастицы имеют существенные преимущества для магнитной гипертермии, поскольку: а) ансамбли суперпарамагнитных наночастиц способны обеспечить чрезвычайно большие значения удельного поглощения энергии, порядка 1 кВт на грамм вещества; б) в силу малых размеров, наночастицы могут глубоко проникать в биологические материалы; в) наночастицы железных окислов нетоксичны, либо слабо токсичны, для живого организма, г) они обладают короткими сроками выведения из организма.
Как мы видели выше, магнитная наночастица является очень сильным природным магнитом, так как характерное поле перемагничивания даже магнито- мягкой частицы окисла железа при комнатной температуре достаточно велико, Hc(0)
400 Э. Важно, однако, что величина энергетического барьера, разделяющего магнитные потенциальные ямы, 
, уменьшается с уменьшением объема частицы, V
R3, и может сравниваться с характерной тепловой энергией kBT. В таком случае, из-за тепловых флуктуаций магнитного момента частица теряет среднюю постоянную намагниченность, становится суперпарамагнитной. Характерное время пребывания магнитного момента в заданной потенциальной яме (Неелевское время релаксации) оценивается как 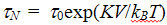
, где константа 
[9]. Время релаксации экспоненциально быстро уменьшается при уменьшении диаметра частицы. Как только 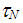
становится порядка или меньше характерного времени измерения магнитного момента 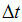
, средний по времени магнитный момент частицы оказывается равным нулю.
Но явление суперпарамагнетизма имеет и положительную сторону. Тепловые флуктуации, раскачивая магнитный момент частиц в потенциальной яме, эффективно понижают энергетический барьер и существенно уменьшают величину поля перемагничивания частицы. Поэтому ансамбль суперпарамагнитных частиц способен перемагничиваться во внешнем переменном магнитном поле умеренной амплитуды, H0
100 – 200 Э, что чрезвычайно важно для магнитной гипертермии, поскольку это упрощает условия создания переменного магнитного поля и удешевляет стоимость необходимого оборудования.
Как известно из термодинамики [1,2], интенсивность поглощения энергии переменного магнитного поля пропорциональна площади петли гистерезиса ансамбля магнитных наночастиц. В нашей группе были проведены теоретические расчеты низкочастотных петель гистерезиса разреженных ансамблей магнитных наночастиц различных типов [10,11], а также соответствующие экспериментальные измерения, выполненные по оригинальной методике [12, 13]. Теоретические расчеты показали существенную зависимость петель гистерезиса от частоты переменного магнитного поля как это показано на Рис. 4.
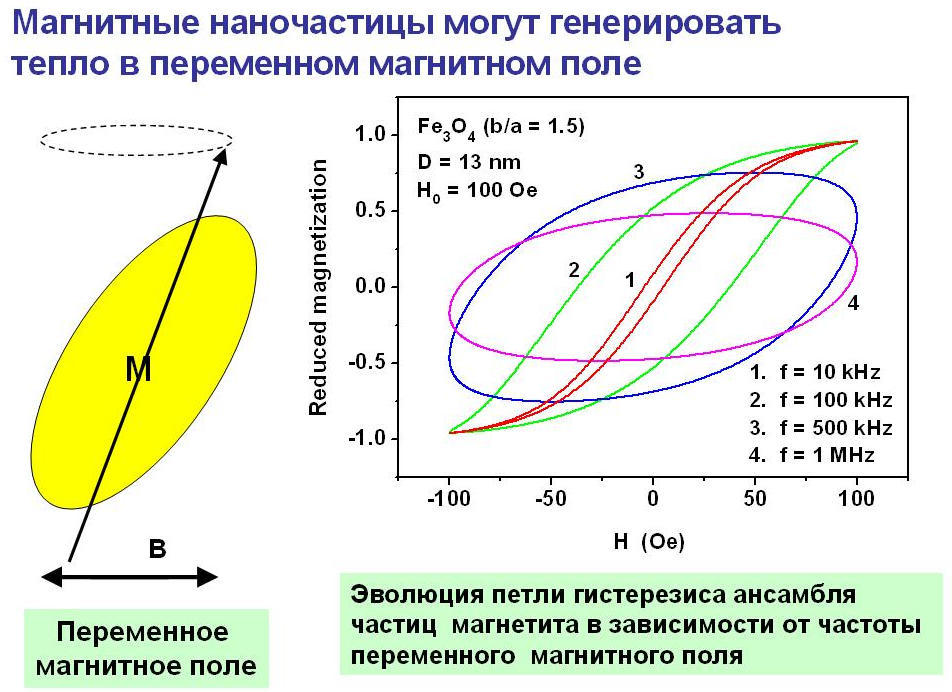
Рис. 4. Магнитные наночастицы способны эффективно дистанционно поглощать энергию переменного внешнего магнитного поля, и тем самым нагревать окружающую среду. Однако эта способность существенно зависит от частоты воздействия, и ряда других физических параметров.
Теоретический анализ показывает [10] (см. Рис. 5), что петли гистерезиса суперпарамагнитного ансамбля весьма резко зависят также от среднего диаметра частиц, если частицы неподвижно зафиксированы в окружающей немагнитной среде. Этот важный факт нашел подтверждение в ряде недавних экспериментов, хотя одновременно была продемонстрирована существенная зависимость удельного поглощения энергии от ряда других факторов, таких как влияние магнито- дипольного взаимодействия в плотных ансамблях магнитных наночастиц [12, 13].
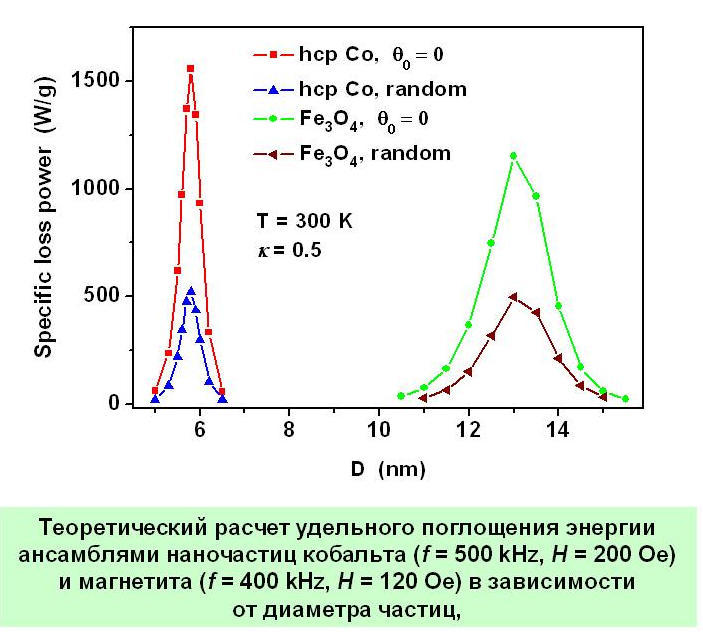
Рис. 5. Теоретический расчет [] удельного поглощения энергии переменного магнитного поля разреженными ансамблями наночастиц кобальта (f = 500 кГц, H = 200 Э) и магнетита (f = 400 кГц, H = 120 Э) в зависимости от диаметра частиц.
Магнитная гипертермия, будучи локальным и дистанционным воздействием, по-видимому, не имеет столь серьезных побочных эффектов, как химио- или радиотерапия [8]. Представляется, что успешное развитие магнитной гипертермии будет зависеть от успешного решения нескольких проблем. Прежде всего, необходимо улучшить методики приготовления ансамблей наночастиц с достаточно большим удельным поглощением энергии в переменном магнитном поле умеренной амплитуды. Это позволит снизить дозу наночастиц, достаточную для достижения положительного лечебного эффекта. В идеале, было бы желательно научиться локально прогревать малые объемы тканей, чтобы подавлять на раннем этапе мелкие, весьма опасные новообразования. Далее, необходимо обеспечить создание переменного магнитного поля достаточной амплитуды, с необходимым пространственным распределением в заданной области тела, при разумных затратах на энергетику, гарантированной безопасности от поражения током, умеренной стоимости. Наконец, необходимо научиться контролировать само воздействие, подбирая амплитуду и частоту магнитного поля, магнитные и геометрические параметры наночастиц, время и периодичность воздействия, с учетом электродинамических и тепловых параметров среды. Весьма желательно также контролировать пространственное и временное распределение температуры в области воздействия. В настоящее время эти проблемы находятся в центре внимания исследователей различного профиля.
08 февраля 2010
- 10911
- 9,4
- 0
- 6
Если бы, — говорит, — был лучше мелкоскоп, который в пять миллионов увеличивает, так вы изволили бы, — говорит, — увидать, что на каждой подковинке мастерово имя выставлено: какой русский мастер ту подковку делал.
Николай Лесков. Левша
Что же нанотехнологии могут предложить обществу, если отвлечься от сугубо фундаментальных научных исследований? Если перечислять очень кратко, то это и материалы с необычными свойствами (наноматериалы), и наномедицина и фармацевтика, обещающие не только принципиально новые средства диагностики, но и мощную платформу для лечения многих заболеваний, и электроника, и новые приборы и методы исследований, и новый подход к робототехнике, и системы вооружения, и многое другое. Отдельно стоит отметить область так называемых нанобиотехнологий, которой предрекают стать революционной в здравоохранении [1]. Наночастицы начали в массовом порядке применяться и в косметических составах — чаще всего, в солнцезащитных кремах, кондиционерах и лосьонах. В рунете уже появилось множество сайтов, очень подробно освещающих достижения и перспективы нанотехнологий.
Словарик
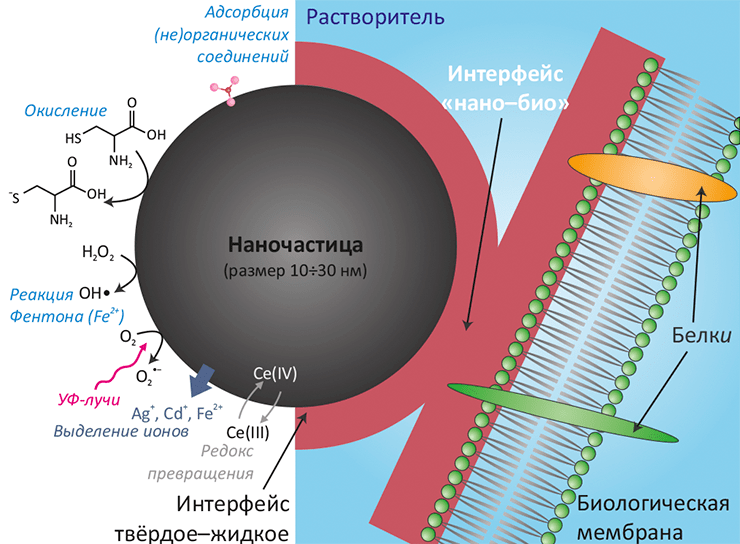
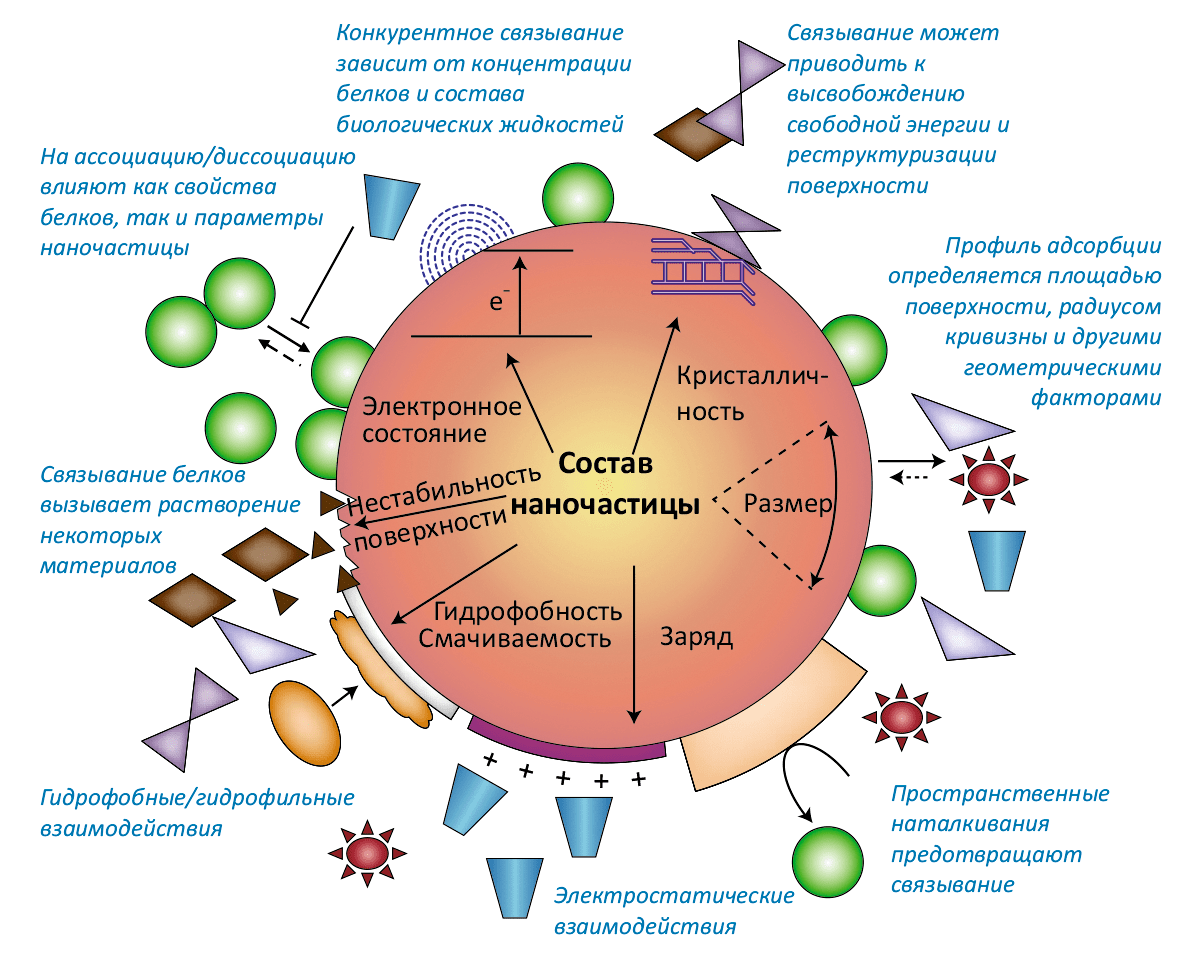
- Свойства наночастицы: Размер, форма и площадь поверхности. — Поверхностные заряд и энергия, изрезанность и пористость. — Валентность и проводимость. — Функциональные группы. — Кристалличность и наличие дефектов. — Гидрофильность / гидрофобность;
- Качества окружающей среды: Молекулы воды. — Кислоты и основания. — Соли и мультивалентные ионы. — Растворённые органические соединения. — Сурфактанты. — Полиэлектролиты;
- Интерфейс твёрдое–жидкое: Гидратация и дегидратация поверхности. — Реструктуризация поверхности и высвобождение свободной энергии. — Адсорбция зарядов и органических молекул. — Образование двойного электрического слоя, ζ-потенциал, изоэлектрическая точка. — Электростатические и электростерические взаимодействия. — Агрегация, дисперсия и растворение. — Гидрофильные и гидрофобные взаимодействия;
- Интерфейс нано–био: Специфические и неспецифические взаимодействия с мембраной. — Взаимодействия рецептор–лиганд. — Обволакивание мембраной (инициирующие и блокирующие факторы). — Взаимодействия с биомолекулами (липидами, белкáми, ДНК), ведущие к структурно-функциональным эффектам. — Перенос свободной энергии на биомолекулы и их окислительное повреждение. — Конформационные изменения биомолекул. — Повреждение митохондрий и лизосом.
При захвате наночастицы внутрь клетки, она встречается со всё новыми и новыми интерфейсами — уже внутриклеточными. Детальная характеризация процессов и действующих сил на этих границах разделов может стать — и уже становится — основой новых высокоточных методов биологических исследований.
Силы, формирующие интерфейс нано–био
На первый взгляд может показаться, что в случае наночастиц в биологической системе действуют все те же силы, что и в классических задачах коллоидной химии. Действительно, тут работают и силы ван-дер-Ваальса, и электростатика, и влияние растворителя, и гидрофобный эффект. Однако требуется существенная корректировка предпосылок с учётом наноскопического масштаба происходящего и наличия в системе биологических объектов. Особенность наносистем заключается в том, что они содержат сравнительно небольшое число атомов, и характер взаимодействия между частицами будет существенно зависеть от их взаимной ориентации и диэлектрической проницаемости (рис. 2). Чтобы подчеркнуть био особенности интерфейса нано–био, можно сравнить силы, связывающие две взаимодействующие наночастицы SiO2, и силы между такой же частицей SiO2 и живой клеткой (например, фибробластом).
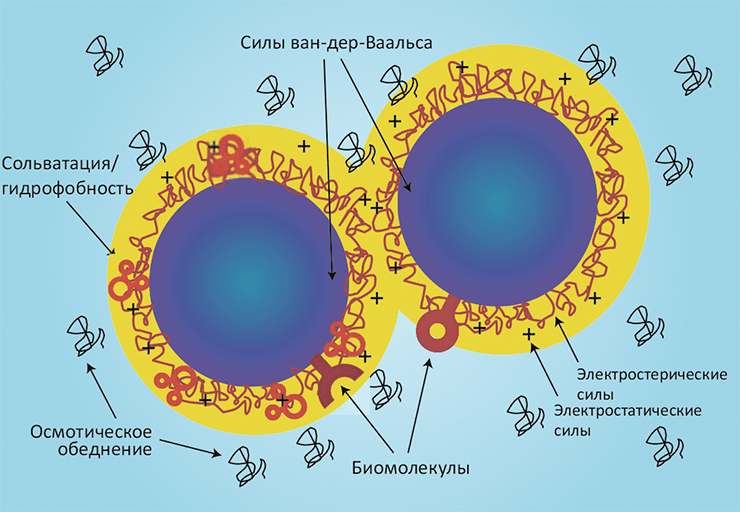
Две неорганические наночастицы SiO2 в растворе притягиваются под действием сил ван-дер-Ваальса и расталкиваются электростатическим взаимодействием, поскольку поверхности обеих частиц в растворе ионизуются и получают отрицательный заряд. (В биологических жидкостях, имеющих ионную силу порядка 150 мМ, электростатические взаимодействия могут быть экранированы за счёт диэлектрической проницаемости.) Существенную роль играют также сольватационный и гидрофобный эффекты. Эти явления довольно хорошо изучены в коллоидной теории ДЛФО (см. рис. 2, табл. 1).
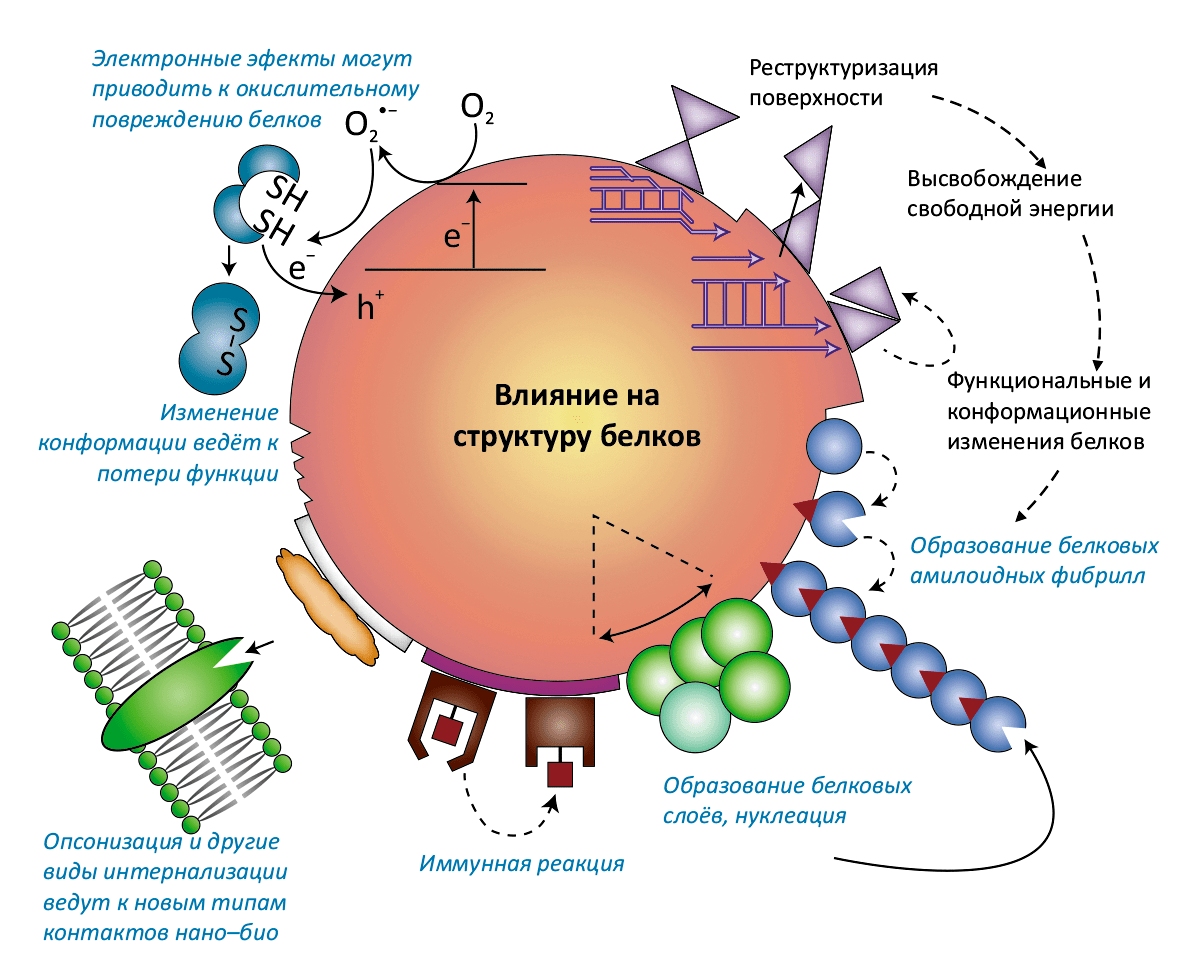
Белки и другие органические вещества увеличивают растворимость наночастиц (например, ZnO, CdSe, оксидов железа и алюминия), но и наночастицы могут влиять на белковые молекулы, заставляя их агрегировать, окисляя боковые группы, снижая ферментативную активность или изменяя их конформацию. Это обстоятельство уже вызывает определённые опасения — ведь то, что в лабораторном эксперименте наночастицы оксида церия вызывают образование фибрилл микроглобулина β2, может означать, что в определённых условиях возможен аналогичный процесс и в организме человека, — например, в мозгу это приведёт к развитию болезни Альцгеймера. (На настоящий момент, впрочем, нет ни одного свидетельства, что наночастицы как-то участвуют в развитии нейродегенеративных заболеваний.)
Захват наночастиц биомембранами

Проникновение внутрь клетки возможно и без участия рецептора: например, наночастицы, модифицированные определёнными амфифильными группами, могут сами проникать через мембрану, нисколько её при этом не повреждая. Схожий механизм используют и амфифильные пептиды-переносчики или поликатионные полимеры, которые могут использоваться для направленной доставки частиц в клетку.
50 нм. (Трансферрин активно используется для доставки соединений с плохой фармакокинетикой [5].)
Учитывая, с одной стороны, бóльшую эффективность захвата внутрь клетки, а с другой — меньшую вероятность фагоцитоза, оказывается, что для направленной доставки в клетку лучше всего подходят не сферические, а именно цилиндрические (или дискообразные) частицы, которые лучше ещё тем, что проще проходят через просвет капилляров.
Наночастицы внутри клетки: в процессе эндоцитоза
Пути и взаимодействия наночастиц после того, как они попадут внутрь клетки, изучены пока довольно слабо, хотя это и представляет огромный интерес в смысле направленной доставки лекарств в клетку [4]. Не очень понятно и как клетка выбирает конкретный путь захвата: это может быть фагоцитоз, пиноцитоз, рецептор-опосредованный или кавеолин-опосредованный эндоцитоз, причём этот выбор зависит как от клетки, так и от параметров частицы.
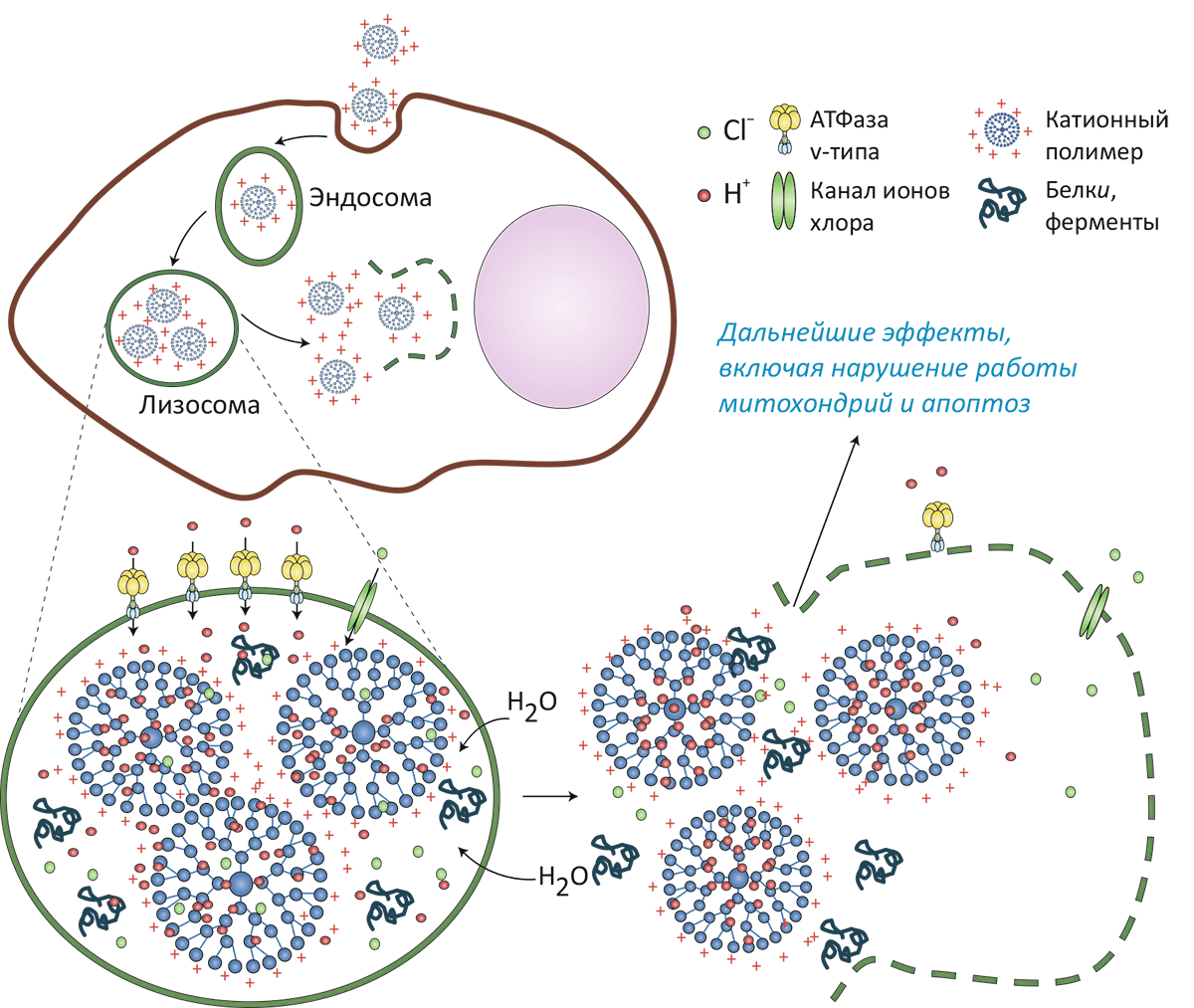
Эффект наночастиц на организм в целом
Наноматериалы, благодаря своим уникальным свойствам (и не в последнюю очередь интерфейсу нано–био), имеют широчайшие перспективы применения в биологии и медицине:
Однако полноценно эксплуатировать преимущества, которые сулит применение нанотехнологий в медицине, можно только адекватно оценив связанные с наноматериалами опасности и приняв соответствующие меры по защите. Свойства барьера нано–био непосредственно определяют биосовместимость наноматериала в целом — то есть, будет ли он токсичным, какой способ введения наночастиц в организм (например, с диагностической или терапевтической целью) будет наиболее эффективным, насколько активно частицы будут выводиться из организма.
Интересно отметить, что наноматериалы — в частности, знаменитые углеродные нанотрубки, — ведут себя подобно двуликому Янусу — уникальные терапевтические и диагностические свойства (см. табл. 2) сочетаются с токсическим эффектом, оказываемым на лёгкие.
Катионные (положительно заряженные в растворе) антимикробные пептиды интересуют учёных всё больше из-за их способности действовать сразу на множество микроорганизмов и уничтожать даже те из них, которые выработали устойчивость против большинства современных антибиотиков. В основе их действия лежат главным образом неспецифические взаимодействия с отрицательно заряженной клеточной стенкой бактерий и разрушение мембраны, за которым следует лизис и гибель микроорганизма.
Испытания новых наночастиц на ряде микроорганизмов — бактерий (в том числе, устойчивых к антибиотикам), грибов и дрожжей — показали высокую активность (минимальная ингибирующая концентрация
10 μМ) и, что самое главное, не обнаружили вредных побочных эффектов: гемолиз практически отсутствовал, равно как и токсическое действие наночастиц на почки и печень (проверено на животных). Под электронным микроскопом в мембранах убитых бактерий видны многочисленные поры, образованные наночастицами, что, видимо, привело к обнажению протопласта и лизису микроорганизмов.
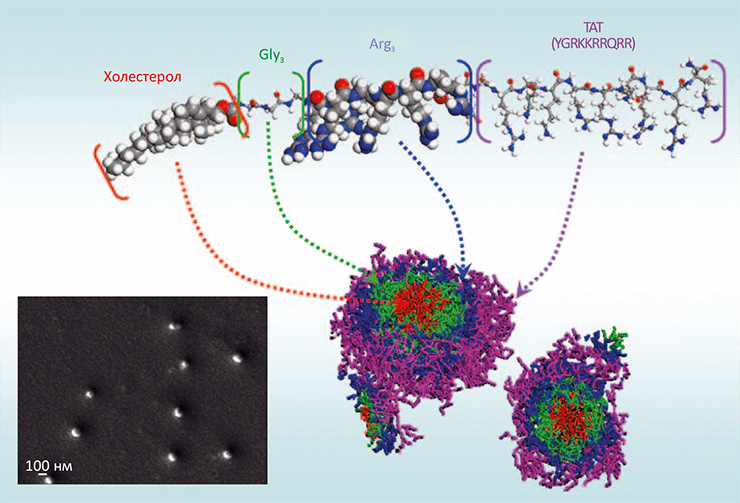
Рисунок 6. Структура пептида, образующего наночастицы с антимикробными свойствами. Показана схема образования мицеллы пептида составом Хол–G3–R6–TAT, в которой холестерол (Хол) образует гидрофобное ядро, а положительно заряженные в растворе остатки устилают поверхность наночастицы. На врезке — сканирующая электронная микрофотография, позволяющая оценить размер образующихся наночастиц (≈100–150 нм).
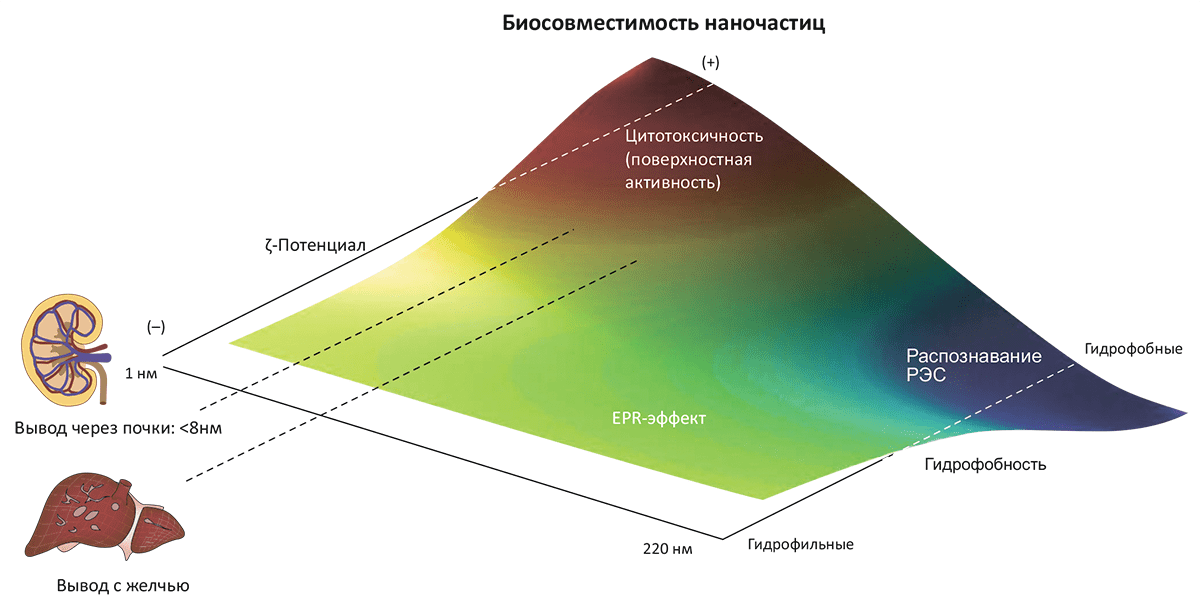
Рисунок 7. Биосовместимость наночастиц в зависимости от их физических характеристик. Эта качественная картина получена на основе анализа >130 видов наночастиц, используемых в терапевтических целях. Основные параметры, определяющие биосовместимость (изображённую цветовым спектром) — размер, ζ-потенциал в растворе и гидрофобность. Так, катионные частицы небольшого размера и с высокой реакционной способностью поверхности почти всегда оказываются токсичными — по сравнению с более крупными гидрофобными частицами, которые довольно быстро и безопасно выводятся из организма при участии ретикулоэндотелиальной системы (РЭС). Частицы, избегающие немедленного вывода почками или печенью, обладают средними размерами и нейтральным поверхностным зарядом; они имеют тенденцию аккумулироваться в опухолевой ткани из-за эффекта повышенной проницаемости и удерживания (EPR-эффекта). Именно это свойство делает их оптимальными агентами для терапии онкологических заболеваний.
Что касается поверхностного заряда частиц, то катионные (положительно заряженные) частицы в большинстве случаев токсичны и вызывают гемолиз и агрегацию эритроцитов. (Однако если вспомнить предыдущий пример с антимикробными катионными частицами, станет понятно, что зависимость не абсолютная.)
Безопасные наноматериалы будущего
- 1756
- 1,2
- 0
- 8
Опухоль в момент атаки наночастицами

Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.
Зачем нужна адресная доставка лекарств?
Липосомы: все дело в волшебных пузырьках
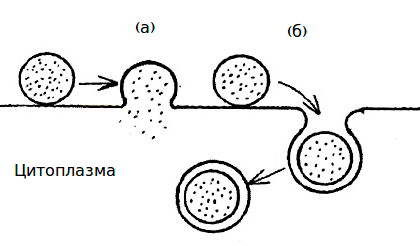
Рисунок 1. Типы взаимодействия липосом с клеточной мембраной: слияние (а) и эндоцитоз (б)
Липосомы — это сферические пузырьки из двойного слоя липидов размером 25–100 нм, заполненные жидкостью. Липосомы эффективны, потому что состоят из нативных липидов и обладают высоким сродством к клеточным мембранам. После контакта с плазматической мембраной, содержимое липосом проникает в клетку при слиянии мембран, или по пути эндоцитоза (рис. 1).
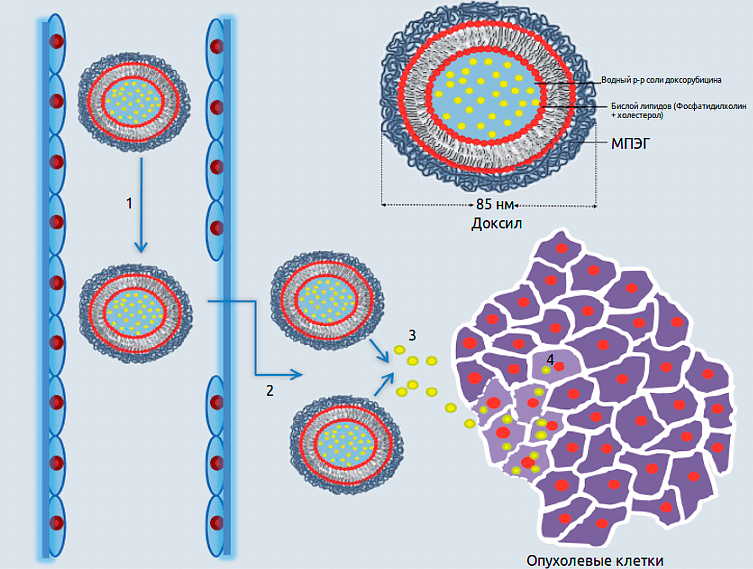
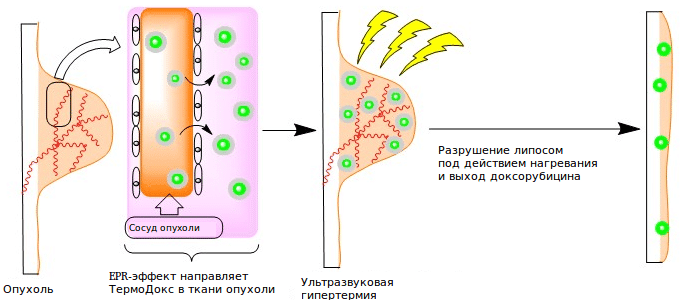
На примере доксорубицина и ряда других антибиотиков с опасными побочными эффектами была доказана эффективность и безопасность липосомальной доставки. EPR-эффект — основная движущая сила, направляющая наночастицы в опухоль. Однако чрезмерная плотность слоев раковых клеток препятствует доставке препарата вглубь опухоли. Также не все опухоли демонстрируют EPR-эффект: например, поры отсутствуют в сосудах опухолей головного мозга. Поэтому для повышения эффективности доставки могут использоваться некоторые клеточные механизмы транспорта. В настоящее время исследуют наночастицы, проникающие в опухоль за счет взаимодействия рецепторов на мембранах раковых клеток с лигандами на поверхности наночастиц [6].
Одним из них является рецептор трансферрина — TfR, — необходимый для импорта железа в клетку. Трансферрин — это белок, образующий комплексы с ионами железа [15]. Свободное железо токсично для организма, поэтому в организме оно связано в комплекс с трансферрином. В свою очередь, комплекс взаимодействует с рецептором TfR на поверхности клеток и проникает внутрь по механизму эндоцитоза (рис. 4). Такие липосомы активно захватываются из сосудов опухоли мозга клетками эндотелия.
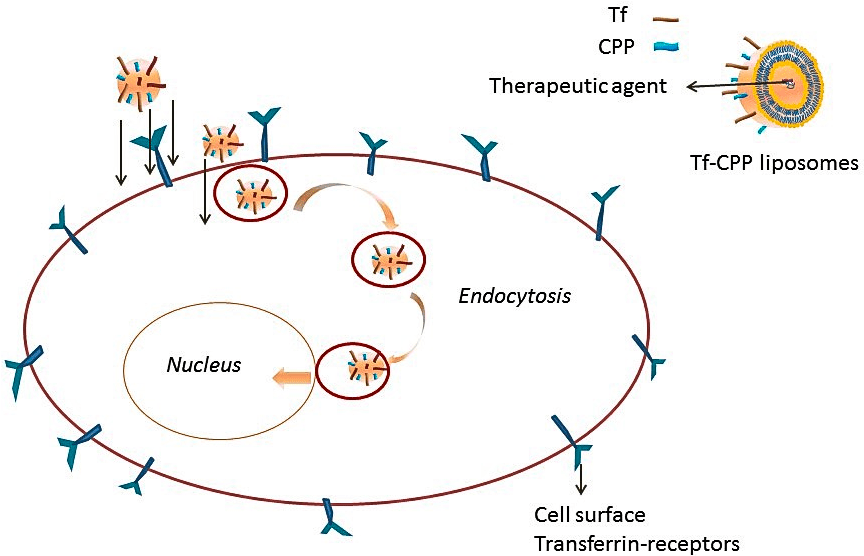
Рисунок 4. Трансферриновые липосомы активно проникают в клетку за счет взаимодействия с рецептором TfR. Молекулы трансферрина пришиваются к липосоме за свободные концы ПЭГ.
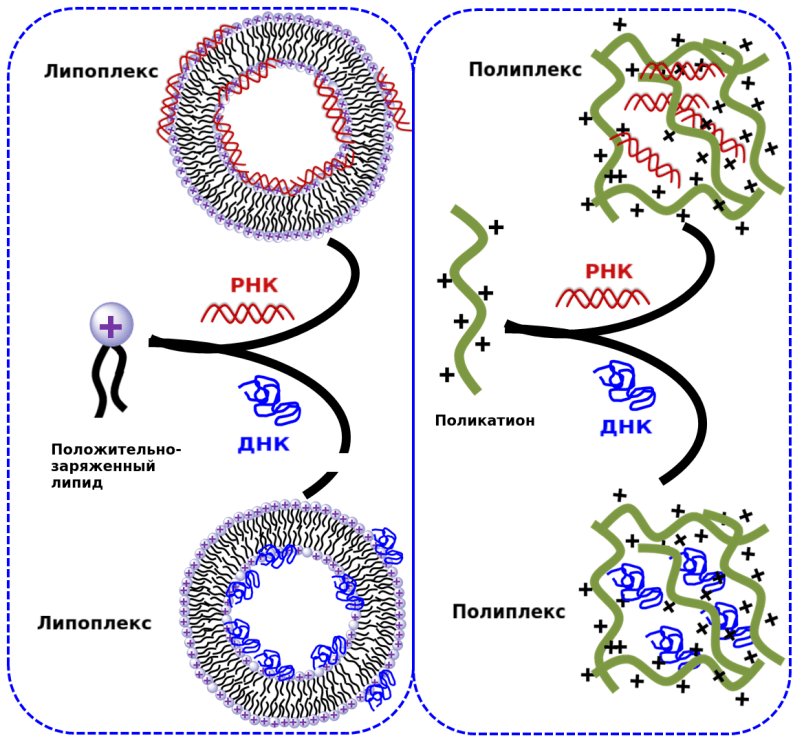
Рисунок 5. Схема строения липоплекса и полиплекса
Данный вид терапии невозможен без адресной доставки, поскольку время жизни свободной РНК в крови исчисляется минутами, а распознавание свободной нуклеиновой кислоты иммунной системой дает аллергические реакции. Для доставки РНК могут использоваться липоплексы. Липоплекс — это липосома, содержащая липиды с положительно заряженными аминогруппами: с ними и взаимодействуют фосфатные группы РНК (рис. 6) [18].
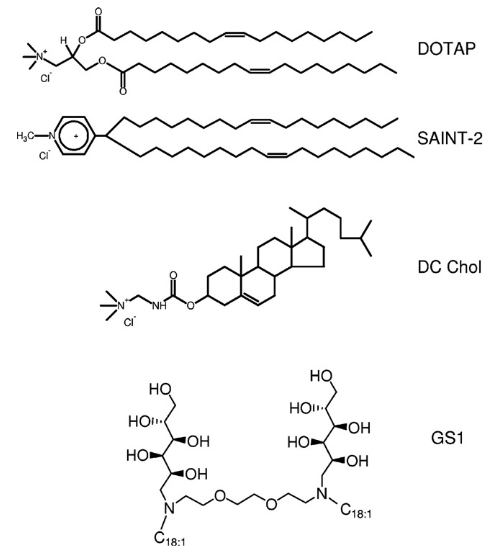
Рисунок 6. Структурные формулы некоторых положительно заряженных липидов
В отличие от незаряженных липосом, липоплексы проникают в клетку по механизму эндоцитоза. При этом вокруг липоплекса формируется эндосома. Аминогруппы липоплекса нарушают кислотно-щелочной баланс (рН) внутри эндосомы, что приводит к ее разрушению и выходу РНК в цитоплазму. Разработан ряд липосомных препаратов киРНК, некоторые из которых проходят клинические испытания (табл. 1) [19], [20].
| Препарат | Гены-мишени | Функция генов | Заболевания |
|---|---|---|---|
| ALN-VSP02 | KSP и VEGF | Моторный тубулин-зависимый белок, осуществляющий расхождение хромосом при митозе. Сигнальный белок для стимуляции роста сосудов | Рак печени |
| Atu027 | PKN3 | Регуляторный белок, сверхэкспрессирующийся в опухолевых клетках | Рак легких |
| TK080301 | PLK1 | Нейроэндокринные опухоли, адренокортикальный рак | |
| DCR MYC | MYC | Твердые опухоли, меланолма, лимфома |
Полиплексы: плюс на минус дает плюс?
Другие носители киРНК — поликатионы — высокомолекулярные соединения из положительно заряженных органических мономеров. В растворе они самопроизвольно образуют комплексы-наночастицы с отрицательно заряженными нуклеиновыми кислотами — полиплексы. Наиболее часто используемые поликатионы — полиэтиленимин, поли-L-лизин, полиамидоамин и хитозан (рис. 5) [21]. Полиплекс также проникает в клетку по пути эндоцитоза, где разрушает мембрану лизосом за счет сдвига pH внутри органоида [21], [22].
Эффективность поликатионов зависит от их молекулярной массы. Полиэтиленимин (ПЭИ) и полиамидоамин с высокой молекулярной массой отлично проникают в клетку, однако сами полимеры способны повреждать плазматическую мембрану, вызывая гибель клеток. Полимеры малой длины обладают минимальной токсичностью, но их эффективность невелика. Сополимеризация с гидрофобными молекулами, такими как ПЭГ, улучшает свойства носителя. Препарат ICS-283 компании Intradigm представляет собой сополимер ПЭИ, ПЭГ и пептида Арг—Гли—Асп, несущий киРНК к фактору ангиогенеза VEGF. В доклинических испытаниях показана высокая эффективность препарата [21].
Другой широко используемый поликатион — хитозан (производное натурального полимера хитина) — слишком сильно взаимодействует с РНК и плохо диссоциирует внутри клеток. Модификация полимера по гидроксильной группе (С-3) и аминогруппе (С-2) гидрофобными молекулами жирных или жёлчных кислот повышает сродство полимера к клеточной мембране и одновременно ослабляет взаимодействие с киРНК [22].
В водном растворе полимер N-сукцинилхитозан–поли-L-лизин–пальмитат (NSC-PLL-PA) образует наномицеллы. Они доставляют в клетки доксорубицин и киРНК MDR1 одновременно (рис. 7) [24].
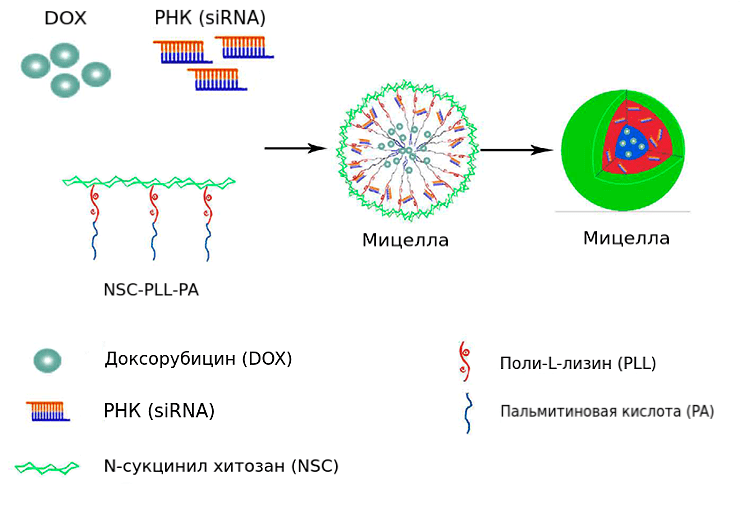
Рисунок 7. Строение амфифильной мицеллы для совместного транспорта киРНК и доксорубицина. В ядре находится пальмитат, в промежуточном слое — поли-L-лизин, а оболочка образована N-сукцинилхитозаном. При смешивании полимера с гидрохлоридом доксорубицина и киРНК MDR1 они распределяются в ядре и промежуточном слое соответственно.
Противоопухолевая активность комбинированного препарата в два раза выше, чем у мицелл с доксорубицином. Количество всевозможных комбинаций полимеров практически не ограничено и открывает широкий простор для исследователей.
Первый препарат киРНК на основе циклодекстриновых наночастиц — CALAA-01 с киРНК к гену RRM2 (рис. 8) — проходит клинические испытания.
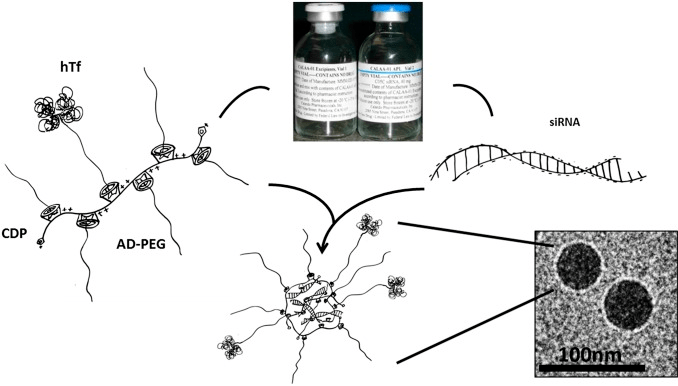
Рисунок 8. Структура препарата CALAA-01 на основе циклодекстриновых наночастиц. CALAA-01 состоит из четырех компонентов, входящих в состав двух растворов. В первом растворе содержится сополимер поликатиона и β-циклодекстрина (CDP), ячейки которого служат матрицей для адамантан-ПЭГ (AD-PEG) и адамантантрансферрина (hTf). Второй раствор содержит сайленсинг киРНК к гену рибонуклеотидредуктазы RRM2. При смешивании растворов происходит конденсация поликатиона и нуклеиновой кислоты с образованием 75-нанометровых наночастиц.
В ходе испытаний была показана высокая безопасность и эффективность доставки киРНК, а также снижение экспрессии RRM2 на 50% [26].
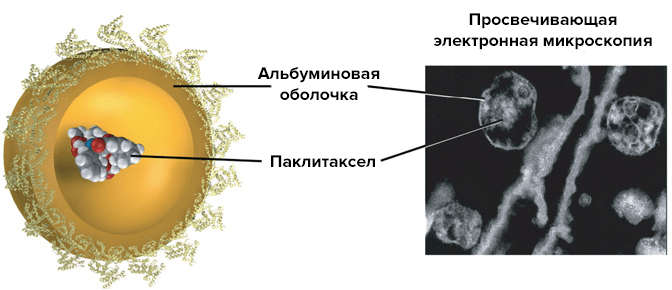
Белковые наночастицы
Наночастицы золота
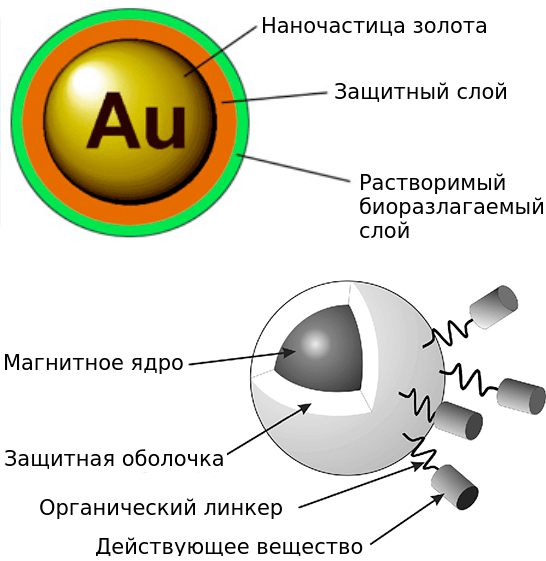
Рисунок 10. Строение наночастиц золота, применяемых в медицине
Магнитные наночастицы
Идея использовать магнитные наночастицы для доставки биоактивных молекул была предложена в 1970-х годах. С помощью магнитного поля частицы собираются в нужной точке в организме. Для этого разработали модифицированные аппараты МРТ. В качестве магнитного материала могут использоваться магнетит (Fe3O4), маггемит (Fe2O3), смешанные оксиды железа и других переходных металлов [28].
Магнитные наночастицы применяли в клинике много лет в основном как контрастирующие агенты для магнитно-резонансной томографии. Чтобы использовать их в качестве носителя для нуклеиновых кислот и лекарств, требуется создание подходящей защитной оболочки.
В настоящее время проведено всего несколько клинических испытаний с применением магнитных наночастиц. В 1996 году они были использованы для транспорта эпирубицина. Наночастицы были стабилизированы оболочкой из полимера глюкозы, на который сорбировался эпирубицин. Коллоидный раствор наночастиц представлял собой ферромагнитную жидкость, которая вводилась мышам в виде инъекций и направлялась в опухоль под действием магнитного поля (рис. 11) [29]. Магнитные наночастицы способны генерировать тепло в изменяющемся магнитным поле или БИК (так же, как и наночастицы золота). Терапия Nano-Cancer заключается во введении в опухоль 12-нанометровых наночастиц Fe3O4 с защитной оболочкой из полимера аминосилана. Установлено, что комбинированное воздействие магнитного поля и БИК создает исключительно высокое нагревание и эффективно подавляет рост опухоли [30].
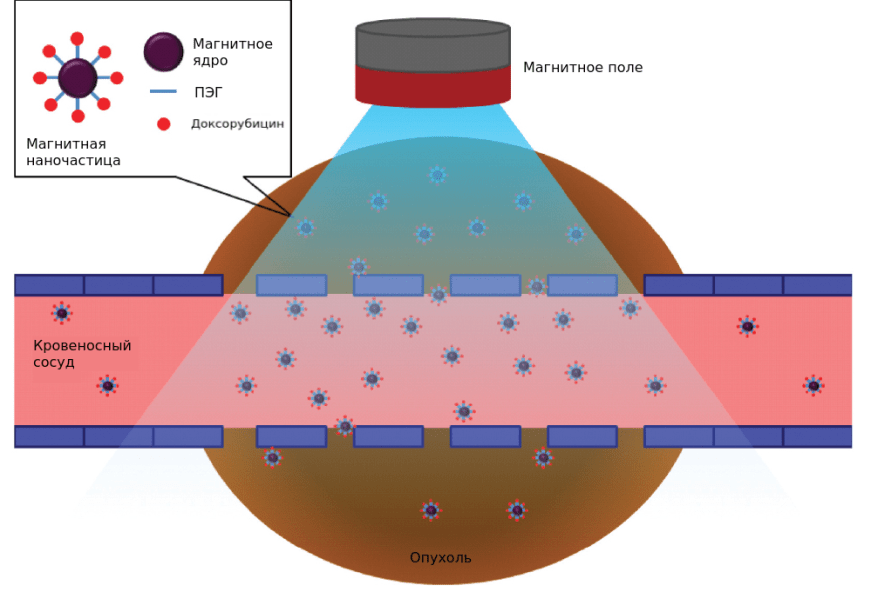
Рисунок 11. Магнитное поле направляет магнитные наночастицы в опухоль
Наночастицы на основе графена
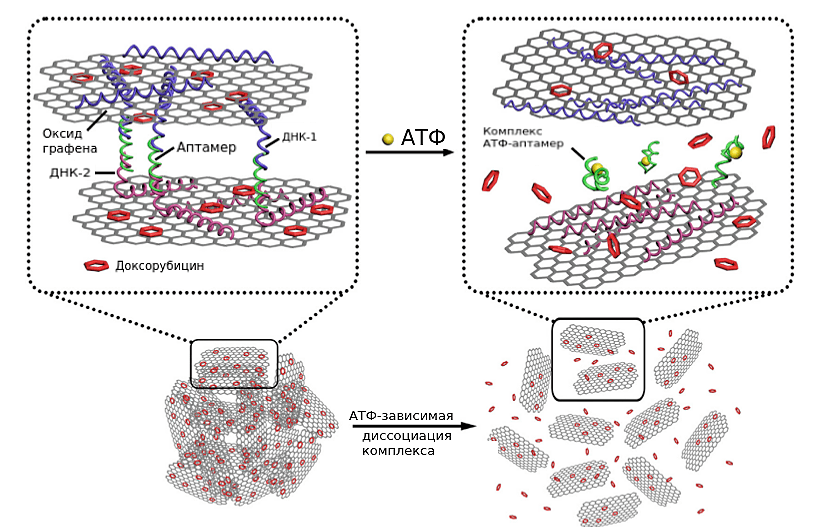
Рисунок 12. Наночастицы оксида графена с АТФ-зависимым высвобождением доксорубицина. Свободные концы ДНК-1 и ДНК-2 комплементарно взаимодействуют с АТФ-аптамером. Таким образом образуется двухслойная структура из оксида графена. На слои оксида графена адсорбированы молекулы доксорубицина.
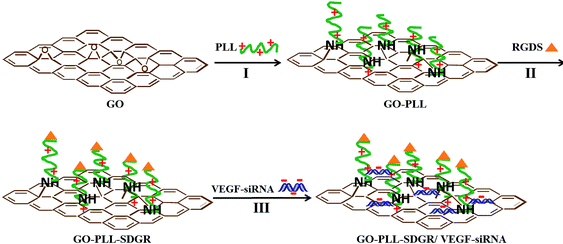
Рисунок 13. Комбинированные наночастицы оксида графена и поли-L-лизина для транспорта сайленсинг РНК
Способность связываться как с нуклеиновыми кислотами, так и с антибиотиками делает графеновые материалы перспективными для комбинированной терапии по аналогии с наномицеллами.
Рынок адресной доставки
Не обойдем вниманием и экономический аспект внедрения наночастиц в терапию рака. Число публикаций по теме targeted drug delivery постоянно растет. В 2017 году вышло более двух тысяч таких публикаций, и было проведено 17 клинических испытаний. На сегодняшний день в авангарде разработки нанолекарств остаются небольшие стартапы, в то время как крупные фармацевтические компании обходят данную тематику. Причина —высокая стоимость производства препаратов. Однако более аккуратный расчет стоимости лечения, включающий госпитализацию и уход за больным в процессе химиотерапии, показал, что использование препаратов на основе наночастиц приводит к значительной экономии. Видимо, число таких исследований пока что недостаточно велико, чтобы побудить фармацевтических гигантов к выходу на этот рынок. Однако ситуация меняется уже сейчас, и к 2021 году ожидается рост рынка технологий лекарственной доставки на 24% по сравнению с состоянием на 2018 год [34–36].
Заключение
Управлять уничтожением клетки можно, либо используя описанное контролируемое высвобождение антибиотика, либо какой-нибудь ингибируемый фермент, производящий, к примеру, свободные радикалы [32], [41].
Таким образом, наноробот, попав внутрь клетки, сможет самостоятельно принимать решение о ее дальнейшей судьбе.
Читайте также:


