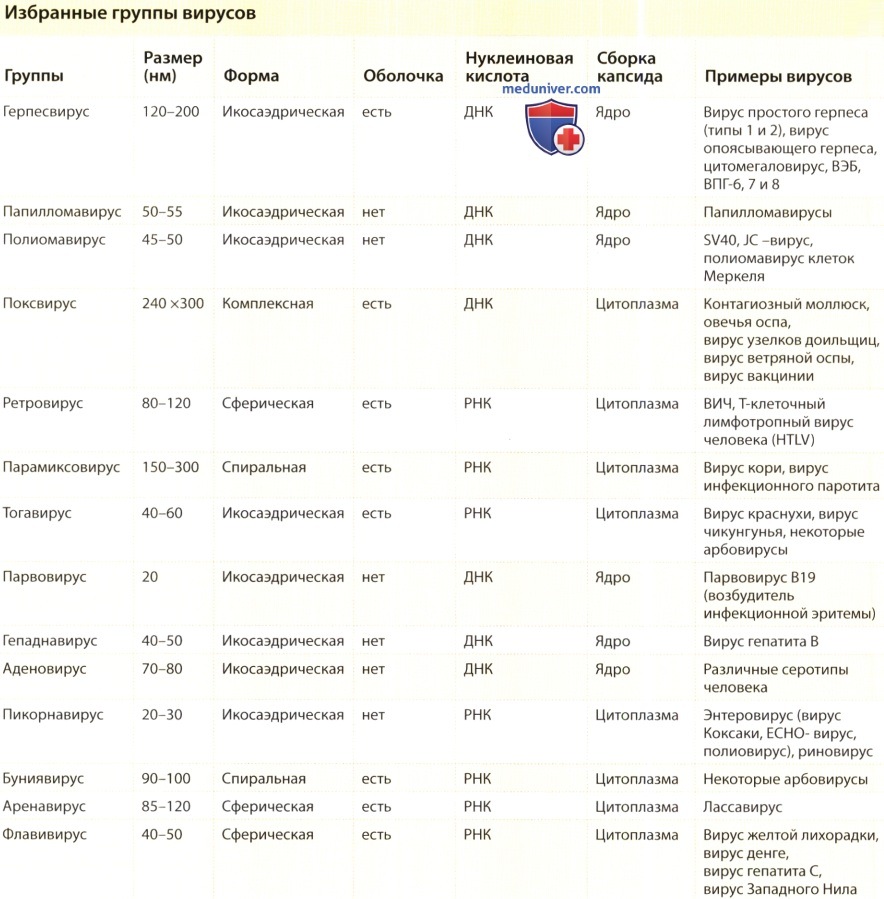
Лабораторная диагностика вирусных заболеваний кожи
Методы лабораторной диагностики вирусных инфекций подразделяются на несколько больших групп.
- Прямые методы, состоящие в выявлении непосредственно в биологическом материале самого вируса или антител к нему.
- Непрямые методы-заключаются в искусственной наработке вируса в значительных количествах, и его дальнейшем анализе.
К наиболее актуальным в повседневной практике методам диагностики относятся:
Серологические методы диагностики - выявление в сыворотке крови пациента определенных антител или антигенов в результате реакции антиген-антитело(АГ-АТ). То есть, при поиске у пациента определенного антигена используется соответствующее искусственно синтезированное антитело, и, соответственно, наоборот-при выявлении антител используют синтезированные антигены.
Реакция иммунофлуоресценции (РИФ)

Основана на использовании меченых красителями антител. При наличии вирусного антигена он связывается с мечеными антителами, и под микроскопом наблюдается специфическая окраска, которая говорит о положительном результате. При этом методе, к сожалению, невозможна количественная интерпретация результата, а только лишь качественная.
Возможность количественного определения дает иммуноферментный анализ(ИФА). Он похож на РИФ, однако в качестве маркеров используют не красители, а ферменты, превращающие бесцветные субстраты в окрашенные продукты, что и дает возможность количественной оценки содержания как антигенов, так и антител.

- Отмывают не связавшиеся антитела и антигены.
- Добавляют бесцветный субстрат, и в лунках с антигеном, который мы определяем, произойдет окрашивание, т.к. там будет связанный с антигеном фермент, после чего на специальном приборе оценивают интенсивность свечения окрашенного продукта.
По похожей схеме происходит и выявление антител.

Реакция непрямой(пассивной) гемаглютинации (РПГА).
Метод основан на способности вирусов связывать эритроциты. В норме эритроциты падают на дно планшета, образуя так называемую пуговку. Однако если в исследуемом биологическом материале находится вирус, он свяжет эритроциты в так называемый зонтик, который не упадет на дно лунки.


Теперь остановимся на методах диагностики непосредственно нуклеиновых кислот исследуемых вирусов, и прежде всего о ПЦР ( Полимеразная Цепная Реакция) .
Суть этого метода заключается в обнаружении специфического фрагмента ДНК или РНК вируса путём его многократного копирования в искусственных условиях. ПЦР можно проводить только с ДНК, то есть для РНК-вирусов предварительно необходимо произвести реакцию обратной транскрипции.
Непосредственно ПЦР проводят в специальном приборе, под названием амплификатор, или термоциклер, который поддерживает необходимый температурный режим. ПЦР-смесь состоит из добавленной ДНК, которая содержит интересующий нас фрагмент, праймеров (короткий фрагмент нуклеиновой кислоты, комплиментарный ДНК-мишени, служит затравкой для синтеза комплиментарной цепи), ДНК-полимеразы и нуклеотидов.
Стадии цикла ПЦР:
- Деннатурация-первая стадия. Температура повышается до 95 градусов, цепочки ДНК расходятся друг относительно друга.
- Отжиг праймеров. Температуру понижают до 50-60 градусов. Праймеры находят комплиментарный участок цепи и связываются с ним.
- Синтез. Температуру вновь повышают до 72, это рабочая температура для ДНК-полимеразы, которая, отталкиваясь от праймеров, строит дочерние цепи.

Цикл многократно повторяется. Через 40 циклов из одной молекулы ДНК получается 10*12 степени копий копий искомого фрагмента.

При проведении ПЦР в режиме реального времени синтезируемые копии фрагмента ДНК метятся красителем. Прибор регистрирует интенсивность свечения и по ходу реакции строит графики накопления искомого фрагмента.
Современные методы лабораторной диагностики с высокой достоверностью позволяют выявить присутствие вируса - возбудителя в организме, нередко, задолго до появления первых симптомов заболевания.
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ
Студент должен знать:
-морфологию, экологию, физиологию вирусов, методы их изучения;
-основы эпидемиологии вирусных инфекций (типы инфекций);
-основы химиотерапии и химиопрофилактики вирусной инфекции;
-факторы иммунитета при вирусных инфекциях.
Студент должен уметь:
-проводить профилактику вирусных инфекций;
-составлять алгоритмы действия в условиях эпидемии.
Вопросы для фронтального обсуждения:
1.Дайте понятие вирусам. Охарактеризуйте особенности строения и жизни вирусной частицы.
2.Какими факторами осуществляется защита организма человека от вируса.
3.Назовите группу и механизм действия препаратов на вирусы. Приведите примеры препаратов.
4.Назовите типы инфекции, вызываемые вирусами.
5. Назовите представителей кишечных, кровяных, респираторных вирусных инфекций, инфекций кожных покровов и слизистых.
7.Назовите, как называются мероприятия, ликвидирующие эпидемический процесс.
Самостоятельная работа студентов:
Запишите определения методов исследования вирусных инфекций.
Зарисйте в атлас внутриклеточные включения при натуральной оспе (тельца Гварниери), при бешенстве (тельца Бабеша-Негри).
3.Составьте план противоэпидемических мероприятий на вирусную инфекцию (инфекцию определяет преподаватель).
Краткие теоретические положения
Введение
Расширение возможностей в лечении и профилактике вирусных болезней с использованием противовирусных препаратов, иммуномодуляторов и вакцин с различным механизмом действия нуждается в быстрой и точной лабораторной диагностике. Узкая специфичность некоторых противовирусных препаратов также требует быстрой и высокоспецифичной диагностики инфицирующего агента. Появилась необходимость в количественных методах определения вирусов для мониторинга противовирусной терапии. Помимо установления этиологии заболевания лабораторная диагностика имеет важное значение в организации противоэпидемических мероприятий.
Ранняя диагностика первых случаев эпидемических инфекций позволяет своевременно провести противоэпидемические мероприятия – карантин, госпитализацию, вакцинацию и пр. Реализация программ по ликвидации инфекционных заболеваний, например натуральной оспы, показала, что по мере их выполнения возрастает роль лабораторной диагностики. Существенную роль играет лабораторная диагностика в службе крови и акушерской практике, например, выявление доноров, инфицированных вирусом иммунодефицита человека (ВИЧ), вирусом гепатита В (HBV), диагностика краснухи и цитомегаловирусной инфекции у беременных.
Методы диагностики вирусных инфекций
Для успешного выделения вирусов клинический материал должен быть взят в соответствии с патогенезом предполагаемого заболевания и в наиболее ранние сроки.
Как правило, берутся:
– при респираторных инфекциях – носоглоточный смыв;
– при энтеровирусных инфекциях – смыв и фекалии (рео-, энтеровирусы);
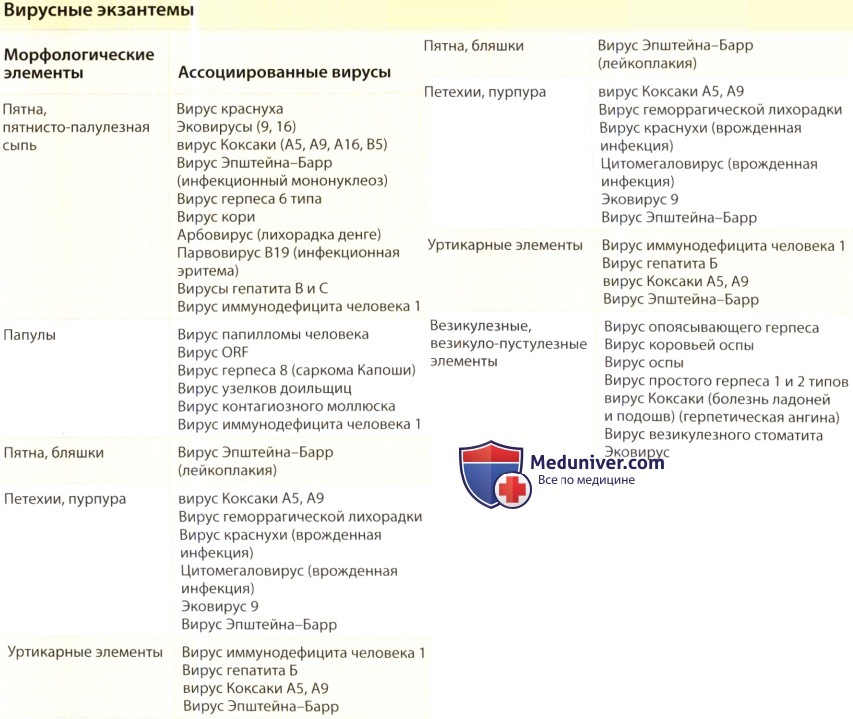
– при поражениях кожи и слизистых оболочек – соскобы, содержимое пузырьков (герпес, ветряная оспа);
– при экзантемных инфекциях – смывы (корь, краснуха);
– при арбовирусных инфекциях – кровь, спинномозговая жидкость.
1.Быстрые (экспресс-методы) — прямое обнаружение вируса или его компонентов (антигенов, НК), включений непосредственно в клиническом материале.
А. Вирусоскопический метод заключается в обнаружении вируса в исследуемом материале под микроскопом. Чаще всего используют электронный микроскоп. Световая микроскопия из-за ничтожно малых размеров вирусов практически не применяется. При данном методе можно определить тип НК, размеры вириона, форму вириона, а также выявить внутриклеточные включения, которые образуются в пораженных клетках при некоторых инфекциях.


II. Вирусологический метод основан на:
культивировании вирусов в чувствительных биологических системах (клеточных культурах, курином эмбрионе, организмах лабораторных животных),их индикации по цитопатогенному действию на биологическую систему (рис.1), идентификации по ингибиции действия вирусов соответствующими противовирусными антителами (рис.2).

Рис. 1. Цитопатическое действие вирусов на клетку: А-нормальный рост, Б-ЦПД вирусов на клетку

Рис.2 Ингибиция вируса антителами
Вирусологическое исследование - это "золотой стандарт" вирусологии и должно проводится в специализированной вирусологической лаборатории. В настоящее время оно используется практически только в условиях возникновения эпидемической вспышки того или иного вирусного инфекционного заболевания.
III. Серологический метод — определение противовирусных антител (оптимально — IgM) и/или определение динамики нарастания их титров за определенный период заболевания в парных сыворотках. Диагностически значимым считают нарастание титра антител в 4 и более раз.
Метод парных сывороток:осуществляем сбор венозной крови в количестве 10 мл в начале болезни и в конце, приготавливаем сыворотку, определяем количество антител в первой и второй сыворотке.
При этом четырехкратное нарастание титра антител во второй сыворотке в большинстве случаев служит показателем протекающей или свежеперенесенной инфекции. При исследовании одной сыворотки, взятой в острой стадии болезни, диагностическое значение имеет обнаружение антител класса Ig М, свидетельствующее об острой инфекции.
Современные методы диагностики:
1.ПЦР-выявляют персистирующие вирусы по НК, находящиеся в клиническом материале, с трудом обнаруживаемые или не обнаруживаемые другими методами.
2.Радиоизотопный иммунный анализ (РИА)-метод основан на метке антител радиоизотопами, что обеспечивало высокую чувствительность в определении вирусного антигена. Широкое распространение метод получил в 80-е годы, особенно для определения маркеров HBV и других некультивируемых вирусов. К недостаткам метода относится необходимость работать с радиоактивными веществами и использования дорогостоящего оборудования (гамма-счетчиков).
3.Иммуноферментный анализ (ИФА) – Иммуноферментные методы определения вирусных антигенов в принципе сходны с РИФ, но основываются на мечении антител ферментами, а не красителями. Наиболее широко используется пероксидаза хрена и щелочная фосфатаза, применяют также b-галактозидазу и b-лактамазы. Меченые антитела связываются с антигеном, и такой комплекс обнаруживается при добавлении субстрата для фермента, с которым конъюгированы антитела. Конечный продукт реакции может быть в виде нерастворимого осадка, и тогда учет проводится с помощью обычного светового микроскопа, или в виде растворимого продукта, который обычно окрашен (или может флюоресцировать или люминесцировать) и регистрируется инструментально.
Поскольку с помощью ИФА можно измерять растворимые антигены, то не требуется наличия интактных клеток в образце и таким образом могут использоваться различные виды клинического материала.
Другое важное преимущество метода ИФА – возможность количественного определения антигенов, что позволяет применять его для оценки клинического течения болезни и эффективности химиотерапии. ИФА, как и РИФ, может применяться как в прямом, так и в непрямом варианте.
Твердофазный ИФА, дающий растворимый окрашеный продукт реакции, нашел наибольшее распространение. ИФА может быть использован как для определения антигена (тогда на твердую фазу – дно лунки полистиролового планшета – наносятся антитела), так и для определения антител (тогда на твердую фазу наносятся антигены).
4.Реакция иммунофлюоресценции (РИФ) – Метод основан на использовании антител, связанных с красителем, например флюоресцеинизотиоцианатом. РИФ широко применяется для выявления вирусных антигенов в материале больных и для быстрой диагностики.
В практике применяются два варианта РИФ: прямой и непрямой. В первом случае применяются меченные красителем антитела к вирусам, которые наносятся на инфицированные клетки (мазок, культура клеток). Таким образом, реакция протекает одноэтапно. Неудобством метода является необходимость иметь большой набор конъюгированных специфических сывороток ко многим вирусам.
При непрямом варианте РИФ на исследуемый материал наносится специфическая сыворотка, антитела которой связываются с вирусным антигеном, находящимся в материале, а затем наслаивается антивидовая сыворотка к гамма-глобулинам животного, в котором готовилась специфическая иммунная сыворотка, например антикроличья, антилошадиная и т. п. Преимущество непрямого варианта РИФ состоит в потребности лишь одного вида меченых антител.
Метод РИФ широко применяется для быстрой расшифровки этиологии острых респираторных вирусных инфекций при анализе мазков-отпечатков со слизистой оболочки верхних дыхательных путей. Успешное применение РИФ для прямой детекции вируса в клиническом материале возможно лишь в случае содержания в нем достаточно большого числа инфицированных клеток и незначительной контаминации микроорганизмами, которые могут давать неспецифическое свечение.
5.Другие методы диагностики –
РТГА используется для диагностики заболеваний, вызванных гемагглютинирующими вирусами. Она основана на связывании антителами сыворотки больного добавленного стандартного вируса. Индикатором реакции являются эритроциты, агглютинирующиеся вирусом (формирование характерного "зонтика") при отсутствии специфических антител и оседающие на дно неагглютинированными при их наличии.
РСК является одной из традиционных серологических реакций и используется для диагностики многих вирусных инфекций. В реакции принимают участие две системы: антитела сыворотки больного + стандартный вирус и эритроциты барана + антитела к ним, а также оттитрованный комплемент. При соответствии антител и вируса этот комплекс связывает комплемент и лизиса бараньих эритроцитов не происходит (положительная реакция). При отрицательной РСК комплемент способствует лизису эритроцитов. Недостатком метода является его недостаточно высокая чувствительность и трудность стандартизации реагентов.
Для учета значимости РСК также, как и РТГА, необходимо титрование парных сывороток, то есть взятых в начале заболевания и в период реконвалесценции.
РПГА – агглютинация сенсибилизированных вирусными антигенами эритроцитов (или полистироловых шариков) в присутствии антител. На эритроцитах могут быть сорбированы любые вирусы, независимо от наличия или отсутствия у них гемагглютинирующей активности. В связи с наличием неспецифических реакций сыворотки исследуются в разведении 1:10 и более.
РНГА – агглютинация эритроцитов, сенсибилизированных специфическими антителами в присутствии вирусных антигенов. Наибольшее распространение РОПГА получила при выявлении HBs-антигена как у больных, так и у доноров крови.
Инфекционные болезни — это заболевания, вызванные проникновением в организм бактерий, грибков или вирусов. Самая важная часть диагностики инфекций — это определение возбудителя и его концентрации. Для этих целей используются разнообразные лабораторные методы, которые позволяют выяснить, чем именно и как давно атакован организм, а в некоторых случаях — спрогнозировать эффективность лечения тем или иным препаратом.
Особенности диагностики инфекционных заболеваний
В клинической практике данный тип заболеваний встречается очень часто. Именно они, по данным Всемирной организации здравоохранения, становятся причиной 26% всех смертей. В список самых распространенных инфекционных заболеваний входят инфекционная пневмония и другие воспалительные заболевания дыхательных путей, гепатит, ВИЧ, туберкулез, малярия, воспаления органов половой системы и мочевыводящих путей, гистоплазмоз, ротавирусные инфекционные заболевания, ветряная оспа, герпес, вирус папилломы человека и еще несколько десятков болезней. Хотя бы раз в жизни каждый из нас сталкивается с инфекционными заболеваниями и необходимостью быстрой постановки диагноза.
Все инфекционные болезни делятся на пять типов — прионные, вирусные, бактериальные, протозойные и грибковые поражения. Далее будут рассмотрены последние четыре типа как наиболее распространенные. Разные возбудители иногда могут вызывать одно и то же заболевание. В частности, пневмония может быть результатом как вирусной, так и бактериальной инфекции. Лечение зависит не от проявлений, а от возбудителя болезни. Противовирусные препараты бесполезны в борьбе с бактериями и грибками, антибиотики не действуют на вирусы. Поэтому основная задача лабораторной диагностики инфекционных заболеваний — выявление типа возбудителя.
Способы лабораторной диагностики инфекционных болезней можно разделить на два типа: неспецифические и специфические методы.
К неспецифическим относятся общий анализ крови и исследование соотношения ее белковых фракций, печеночные пробы, общий анализ мочи и кала. Эти методы не дают информации о виде возбудителя, но позволяют узнать, в какой мере болезнь затронула органы и системы организма, что именно в их работе нарушено и насколько далеко зашел процесс.
Специфические — вирусологический и бактериологический методы, микроскопическое исследование возбудителей, анализы на антигены и антитела — направлены непосредственно на обнаружение возбудителя.
Современная медицина располагает множеством методов выделения возбудителей бактериальной инфекции:
Бактериоскопический . Исследуется окрашенный специальным образом мазок.
Бактериологический . Биоматериал высеивается в питательную среду, и через некоторое время специалист исследует колонию бактерий, выросшую в ней.
Биологический . Направлен на определение патогенности микроорганизмов.
Серологический . Выявляет антитела и антигены в сыворотке крови — особые вещества, которые вырабатываются организмом при контакте с возбудителем определенной болезни.
Чаще всего для исследований используют кровь или сыворотку крови, реже — слюну, мочу, кал, клетки эпителия (мазок и соскоб) и другой биоматериал.
В лабораторной диагностике вирусных заболеваний используются:
Вирусологическое исследование . Световая и электронная микроскопия дает возможность выявить наличие вирусных включений и сами вирусы и идентифицировать их.
Серологическое исследование для обнаружения антител и антигенов. Этот метод дает возможность быстро выявить агрессора, как и в случае с бактериальными инфекциями. Для диагностики используются разнообразные способы исследования материала — реакции гемадсорбции, гемагглютинации или метод непрямой иммунофлюоресценции. Имунноблоттинг, в частности, позволяет выявлять антитела сразу к нескольким инфекциям и считается современным и точным диагностическим методом.
Молекулярно-генетические методы . Последнее слово в лабораторной диагностике. Позволяют обнаружить вирус даже тогда, когда его концентрация ничтожно мала — то есть на самых ранних стадиях. Самым известным из этих методов является ПЦР, при которой фрагмент вируса многократно копируется до тех пор, пока специалист не получит достаточно материала для определения типа вируса и его изначальной концентрации.
Для выявления вирусов обычно требуется сделать анализ крови.
Так называют инфекции, вызванные простейшими паразитами, например, амебами. Малярия, амёбиаз, токсоплазмоз, лямблиоз, трихомониаз, сонная болезнь — вот неполный список самых распространенных протозойных инфекций. Лабораторная диагностика таких заболеваний включает в себя следующие методы:
Микроскопический . Простейшие паразиты выявляются путем исследования под микроскопом окрашенных образцов биоматериала. Самый простой и надежный метод для многих возбудителей.
Культуральный . Посев биоматериала в питательную следу для дальнейшего исследования размножившихся простейших. У этого метода есть существенный недостаток: результатов нужно ждать долго, сам процесс может занять не менее 5-6-ти дней.
Серологический . Используют редко ввиду малой информативности.
Аллергический . Также не является распространенным. Кожные аллергопробы делают для того, чтобы подтвердить лейшманиоз и токсоплазмоз. Это вспомогательный диагностический метод.
В качестве биоматериала для исследований в основном используется кровь, иногда — – кал или моча.
Микроскопическое исследование . Препарат окрашивается и рассматривается под мощным микроскопом. Посредством иммунофлюоресцентной микроскопии исследуется проба, помеченная флюоресцеинами — специальным красителем. Наиболее быстрый способ выявления грибка по сравнению с другими методами.
Культуральный . Происходит посев пробы на питательную среду и дальнейшее исследование полученной в результате колонии грибков.
Серологический . Используется для выявления грибковых поражений, однако для микозов он считается не особенно точным.
Гибридизация нуклеиновых кислот . Самый современный способ выявления грибковых инфекций, его применяют для идентификации основных возбудителей системных микозов. Из культуры извлекается РНК и вносится особым способом помеченная молекула ДНК. Если в пробе наличествует один из основных патогенных грибков, ДНК объединится с его РНК, создав легко различимую структуру. Несомненным преимуществом метода является возможность определить инфекцию на самых ранних стадиях.
Биоматериалом для исследований являются клетки кожи, волос и ногтей, клетки слизистых оболочек (мазок или соскоб), мокрота, моча, секрет простаты, сперма, грудное молоко.
Современные методики диагностики инфекций позволяет выявить их на начальном этапе, Чем раньше болезнь будет обнаружена, тем проще ее вылечить. Поэтому сдавать анализы на инфекции желательно регулярно, даже если вы ни на что не жалуетесь и не замечаете никаких перемен в самочувствии.

Перед сдачей биоматериала для исследований иногда требуется определенная подготовка. Так, кровь обычно сдают с утра, натощак, а перед забором мазка не рекомендуется принимать душ. Эти требования очень важны: они обеспечивают точность результата, поэтому узнайте у врача заранее о подготовительных мерах и точно следуйте всем его рекомендациям.
а) Диагностика вирусных инфекций кожи. Для диагностики вирусных инфекций используется несколько лабораторных методов. Эти методы базируются на идентификации вируса, как в культуре, так и путем определения вирусных антигенов, а также на применении непрямых методик, таких как микроскопия и серология. В лабораторной диагностике вирусных инфекций все чаще применяется новая молекулярная диагностическая методика, основанная на определении вирусных нуклеиновых кислот.
Результаты любого диагностического метода необходимо интерпретировать в контексте клинической картины. Всегда следует учитывать сочетанные с вирусом инфекции, не относящиеся к вирусному заболеванию. В настоящее время для многих вирусов серийно выпускаются чувствительные и специфические быстрые тесты на молекулярной основе.
Золотым стандартом является традиционная диагностика выделения вируса в культуре клеток. При необходимости, более точную идентификацию культивированного вируса устанавливают с помощью специфических тестов на вирусную нуклеиновую кислоту или вирусный антиген. Культуральный метод для ВПГ довольно чувствительный, диагностические изменения в клетках часто появляются через 1-2 дня после инокуляции. Близкородственный вирус опоясывающего герпеса (VZV) вырастить в культуре довольно сложно, что часто приводит к ложноотрицательным результатам.
При необходимости культурального анализа, образцы, взятые в момент острого эпизода на ранней стадии болезни, часто дают более точные результаты, чем образцы, взятые на поздних стадиях. При везикулярных клинических формах жидкость из ранней везикулы типично является хорошим источником вируса. Материал из очагов невезикулярных экзантем с меньшей степенью вероятности даст положительный результат.
Образцы собирают в стерильную пробирку с 2-5 мл буферного изотонического солевого раствора, содержащего пенициллин и стрептомицин. Собранный материал на льду следует лучше всего немедленно транспортировать в лабораторию. Альтернативно, образцы при возможности замораживают при -70 °С. Необходимо указать подозреваемый патоген (или патогены), поскольку это может определить тип клеточной культуры или тестовое животное для инокуляции.
Имеются другие диагностические тесты, которые могут дать результаты быстрее, чем выделение вируса в культуре. Такой подход особенно продуктивен для определения вирусов, которые сложно вырастить в культуре, а также, например, для папилломавирусов, для которых отсутствует воспроизводимая культуральная система. Методом прямой микроскопии можно идентифицировать характерные клетки, как в случае мазков Тцанка на герпесвирус (этот тест не дифференцирует вирусы простого и опоясывающего герпеса) или характерные тельца включения в инфицированных вирусом контагиозного моллюска клетках. Для очагов, содержащих большое количество вирусных частиц, морфологическую идентификацию вируса можно установить с помощью электронной микроскопии очага или его содержимого, хотя этот метод требует высокоточного лабораторного оборудования, дорогостоящий и доступен не повсеместно.
Эффективны и широко доступны быстрые диагностические тесты на вирусные антигены. Флуоресцентное определение антител обычно применяется для идентификации и дифференцировки между инфекциями ВПГ-1, ВПГ-2 и VZV. Другими методами идентификации вирусного антигена с применением вирус-спец-ифических антител являются радиоиммунный анализ, иммуносорбентный анализ с ферментной меткой, им-мунопероксидазный метод и иммуноэлектронная микроскопия.
Серологические исследования, определяющие вирусные антитела, могут использоваться в эпидемиологических целях, для идентификации инфекций таких вирусов, как ВИЧ и гепатит В, а также в ситуациях, в которых сыворотка в острой стадии содержит диагностические антитела, как в случае гетерофильных антител при инфекционном мононуклеозе. В целом, наиболее точным методом серологической диагностики этого острого вирусного заболевания является сравнение титров антител иммуноглобулина G в сыворотке острой и конвалесцентной стадий. Ограниченность этого метода состоит, однако, в ретроспективной постановке диагноза. На острую стадию может указывать также положительный титр иммуноглобулина М.
Забор материала острой стадии необходимо производить как можно раньше, а материал конвалесцентной стадии берется спустя 2-4 недели. Сыворотку следует сразу же отделить от форменных элементов крови и поместить в холодильник, а предпочтительнее заморозить при -20°С до проведения анализа одновременно на обоих образцах. Четырехкратное увеличение титров антител между острой и конвалесцентной стадиями обычно указывает на недавнюю инфекцию. Для идентификации определенного типа реакции антиген-антитело применяются различные методы, причем эффективность любого конкретного анализа частично обусловлена типом вируса.
Культуральные методы имеют некоторые, связанные со специфичностью вируса ограничения, однако любой вирус можно теоретически идентифицировать по составу вирусной нуклеиновой кислоты, если для специфического вируса (или вирусов) имеется достаточное количество проб и праймеров. Молекулярные диагностические методы оказали большое влияние как на лабораторную идентификацию, так и на наше понимание роли микробов при определенных заболеваниях.
Чаще всего молекулярные тесты базируются на методе полимеразной цепной реакции (ПЦР), но для диагностики вирусных инфекций могут применяться другие молекулярные методы, в том числе Саузерн-блот гибридизация и гибридизация in situ.
Тесты на основе ПЦР и родственные методики являются высокоспецифичными, а также очень чувствительными, нередко способными среди 10000 клеток обнаружить всего одну инфицированную клетку. Основным недостатком ПЦР является тот факт, что высокая чувствительность метода создает возможность ложноположительных результатов вследствие перекрестной контаминации минимальными количествами вирусной нуклеиновой кислоты. Тщательное внимание к деталям и соответствующий контроль, а также технология закрытой системы, которая все больше применяется, обычно помогают преодолеть этот потенциальный недостаток. Метод ПЦР in situ, сочетающий чувствительность ПЦР с гистологической локализацией, является еще более усовершенствованным методом определения вируса.
Картина кожных проявлений вирусной инфекции иногда достаточна для клинического диагноза. Выбор точного метода лабораторной диагностики, если она необходима, будет зависеть от комбинации факторов, таких как ресурсы, клиническое подозрение на заболевание, дифференциальная диагностика, немедленное получение результатов и точность теста.
б) Лечение и профилактика вирусных инфекций кожи. Вирусы являются достаточно трудной терапевтической мишенью, поскольку их репликация происходит только в пределах клетки-хозяина и опирается на происходящие в клетке процессы биосинтеза. Специфическая, нацеленная на вирус противовирусная терапия не может осуществиться без последствий для организма-хозяина. Стратегии, направленные на уникальные функции вируса или вирусных белков, являются решающими для безошибочной диагностики, терапии и профилактики заболевания. Для эффективной терапии необходимо знать специфику вирусного цикла и вирусных белков.
Для лечения вирусных инфекций разрешено более 40 лекарств, и некоторые из них играют ключевую роль в терапии кожных вирусных инфекций. Большинство этих лекарств обладают гиростатическим, но не вирицидным действием. Системные и местные медикаменты, применяемые для лечения таких инфекций, включают ингибиторы вирусных ферментов и вирусных рецепторов, препараты химиотерапии и иммуномодуляторы. Более глубокое понимание циклов специфических вирусов, взаимодействий вирусов с клетками-хозяевами и иммунного ответа хозяина способствовало повышению эффективности терапии некоторых вирусных инфекций. Специфические методы противовирусной терапии рассматриваются в соответствующих главах данного раздела.
Хотя в последние десятилетия наблюдается значительный прогресс в противовирусной терапии, особенно в лечении ВИЧ-инфекции, инфекции герпесвирусов и вирусов гриппа, стратегии, нацеленные на профилактику вирусной инфекции, для большинства вирусов пока оказались более успешными, чем специфическая терапия развившихся инфекций. Вакцины оказались исключительно полезными в профилактике различных вирусных болезней и являются одним из первостепенных медицинских достижений двадцатого столетия.
В 2006 году Управление по надзору за качеством продуктов и лекарственных средств США одобрило две новых противовирусных вакцины: профилактическую вакцину против опоясывающего герпеса для лиц 60 лет и старше и профилактическую вакцину против генитальной инфекции ВПЧ у женщин для профилактики рака шейки матки, вызываемого ВПЧ-16 и ВПЧ-18, и генитальных бородавок, вызываемых ВПЧ-6 и ВПЧ-11. Еще одна вакцина для профилактики рака шейки матки, вызванного ВПЧ-16 и ВПЧ-18 (но не против ВПЧ-6 и ВПЧ-11) была одобрена в 2009 году. В настоящее время исследуется ряд других вакцин, в том числе для ВПГ, цитомегаловируса, вируса денге, вируса Западного Нила и ВИЧ.
Технология рекомбинантной ДНК позволяет разработать эффективные, неинфекционные, субъединичные вакцины, состоящие только из вирусного белка (такие, как вакцины против ВПЧ и вируса гепатита В), в отличие от традиционных вакцин, которые содержат либо ослабленные штаммы патогена, либо инактивированный препарат целого вируса. Кроме вакцин, которые индуцируют активный иммунитет в избранных клинических ситуациях, полезно пассивное назначение специфических антител вскоре после контакта с вирусом, например детям с ослабленным иммунитетом при контакте с вирусом ветряной оспы, а также при острых инфекциях бешенства. Чувствительные процедуры для определения вирусов гепатита В, гепатита С и ВИЧ у потенциальных доноров крови резко уменьшили частоту передачи этих возбудителей при переливании крови.
Мероприятия органов общественного здравоохранения, в частности пропаганда безопасного секса, применения одноразовых игл, контроля москитов и соблюдения гигиенического мытья рук, продолжают сохранять первостепенное значение для профилактики вирусных заболеваний.
- Вернуться в оглавление раздела "дерматология"
Редактор: Искандер Милевски. Дата публикации: 2.5.2019
Читайте также:


