Накопление вирусов и риккетсий при производстве вакцин




Штамм перевиваемых клеток МСВ № 44/6/ (коллекция перевиваемых клеток позвоночных Института вирусологии им. Д.И. Ивановского АМН СССР), используемый для культивирования риккетсий и вирусов. (П с:
H ASTQPCHOMY СВИДЕТЕЛЬСТВУ
ГОСУДАРСТВЕННЫЙ НОМИТЕТ СССР
ПО ДЕЛАЯ ИЗОБРЕТЕНИЙ И ОТНРЫТИЙ (21) 3526935/28-13 (22) 18. 11.82 (46> 15; 02, 85. Бюл. М 6 (72) О.С. Гудима, Н.К. Мисуренко и A.Ì. Амченкова (71) Ордена Трудового Красного Знамени институт эпидемиологии и микробиологии им. почетного академика
Н. Ф, Га мал еи (53) 576.8.093.35(088.8) (56> 1. Earle W R. Changes Induced
in à Strain of Fibroblasts from а Strain СЗН House by the Action of
Report). — J. Nat Cancer Just, 1943 3.
2. Стромская Т.П., Ставровская А.А .
Кариотипические особенности и прививаемость некоторых клеточных линий млекопитающих. — "Вопросы онкологии",1974 т. 20, У 2, 60 (прототип).
„„SU„, 1! 397И (54) ШТАММ ПЕРЕВИВАЕМЫХ КЛЕТОК МСВ, ИСПОЛЬЗУЕМЫЙ ДЛЯ КУЛЬТИВИРОВАНИЯ
РИККЕТСИЙ И ВИРУСОВ. (57) Штамм перевиваемых клеток МСВ
Н 44/6/ (коллекция перевиваемых клеток позвоночных Института вирусологии им. Д.И. Ивановского AlfH СССР), используемый для культивирования риккетсий и вирусов.
Изобретение относится к экспериментальной биологии и может быть использовано для генетических исследований.
Известна перевиваемая линия клеток L полученная из эмбрионов мы— шей (1 ).
Однако она контаминирована микоплаэмами, вирусами и клетками других линий . IO
Известен также штамм перевиваемых клеток мышей М-22 с высокой интенсивностью размножения ь.2 3.
Этот штамм получен путем трансформации эмбриональных фибробластов 15
ы,>шей С57В Ь вирусом SV-40, однако он не способен пролиферировать при супраоптимал иной температуре.
Целью изобретения является получение нового штамма перевиваемык 20 клеток, обладающего высокой интенсивностью размножения, формирующего стабильный пласт фибропластоподобнык клеток, чувствительного к воэбу— дителям риккетсиозных инфекций и 25 вирусам, не контаминированного микоплазмами и вирусными агентами и способного пролиферировать при супра,оптимальных температурах.
Поставленная цель достигается ЗО с помощью штамма перевиваемых клеток MCB.
Штамм хранится в коллекции перевиваемык клеток позвоночных Института вирусологии им. Д.И. Ивановского под номером 44/6/.
Для получения штамма MCB перевиваемых клеток используют эмбрионы, стерильно извлеченные из матки мышей С57В /6/в последние дни бере — 4О менности. Тела эмбрионов измельчают и подвергают трипсинизации при 37 С в 0,25%-ном растворе трипсина. Суспензию клеток в концентрации 1-10 клеток в 1 мп среды 199 с 10% сыво- 45 ротки крупного рогатого скота в объеме 250 мл вносят в матрацы.
В первый месяц культивирования п1 оизведены два пересева в отношен lH 1:2. После второго пересева размножение клеток практически прекра— щается. В матрацах образуется рыхлая сеть, состоящая из крупнык, полиморфных клеток с длинными отростками.
Жизнеспособность этих клеток поддерживают, периодически сменяя питательную среду. Через 3 мес после первичного высева эмбриональных клеток в одном из шести матрацев обнаруживают колонию мелких, округлых плотно прилегающих друг к другу клеток. Размеры колонии постепенно увеличиваются за счет митотического деления клеток. Колонию снимают с поверхности стекла матраца и переносят в пробирку с 1 мл питательной среды. Клетки этой колонии являются началом перевиваемой линии клеток MCB. Линия клеток MCB поддерживается в лаборатории риккетсиозов ИЭМ им. Н.Ф.Гамалеи в течение 6 лет, проведено свыше 350 пассажей с высоким индексом пролиферации — 6.
Штамм перевиваемык клеток МСВ имеет следующие морфологические„ физиологические и кариологичЕские характеристики.
Культура MCB состоит из фибробластоподобных клеток веретеновидной и полигональной формы с четкими границами. Ядро круглое или овальное, четко контурировано, содержит
2-3 небольших ядрышка, кариоплазма заполнена мелкозернистым хроматином.
Цитоплазма клеток мелкозернистая, как правило, не вакуолизирована, без включений.
Рост клеток однослойный.
При фиксации препаратов жидкостью
Буэна или смесью по Шабадашу окраска их гематоксилином и зозином несколько слабее, чем, например, перевиваемых мышинных клеток Ь.
При высеве единичные клетки в процессе размножения образуют островки полигональной формы, которые по мере роста сливаются, формируя сплошной пласт клеток. При высеве 10 клеток в 1 мл сплошной пласт в пробирке или флаконе (матраце) образуется на
4-5-е сутки. Клетки легко отделяются от стекла 0,02%-ным раствором версе3 на, 0,25%-ным раствором трипсина или механическим путем.
Ддгезивная активность клеток хорошая.
Пересев клеток MCB производят после образования сплошного пласта.При пересеве механическим путем из сосуда удаляют старую питательную среду и добавляют 1-10 мп (в зависимости от емкости сосуда для культивирования) свежей среды, в которую очищают шпаделем клетки со стекла. Взвесь клеток доводят свежей питательной средой до требуемой концентрации и
Перевиваемая линия клеток MCB чувствительна к риккетсиям возбудителя эпидемического сыпного тифа ."Э . (Rickettsia prowazeka) и риккетсиозной оспы (R. akari) и к вирусам VSV и ЕМС. высевают в новые сосуды. Пересевы с помощью версена или трипсина производят по известной методике., Культура клеток MCB адаптирована к питательной среде следующего соста— ва: среда 199 отечественного производства с 10Х (нативной) сыворотки крупного рогатого скота без антибиотиков. Добавление антибиотиков пенициллина и стрептомицина (100 ед/мл) — не влияет на морфологию и пролиферативную активность клеток MCB.
Хранение клеток МСВ.
Для поддержания жизнеспособности 5 клеток МСВ их пересевают 1 раз в
4-7 дней при разведении клеточной суспензии 1:5-1:8. В условиях термоо стата при 35 С пласт клеток сохраняется в течение 10 сут без смены пита- 2G тельной среды. При комнатной температуре 18 — 21 С клетки сохраняются в течение двух неделb..
Изучаемая культура является гетероплоидной с широкими колебаниями чис- 25 ла хромосом (20-100) . При этом 9Х клеток содержит более 100 хромосом.
Метафазные пластинки со свойствен— ным для клеток мыши числовым набором хромосом (40) составляют 37 всей клеточной популяции. Модальный класс равен 82-84. Модальный класс составляет около трети всей клеточной популяции. При исследовании 10 метафазных пластинок, входящих в модальный класс, видно, что большую часть хромосомного набора составляют акроцентрические хромосомы (74-80). Кроме того, присутствуют метацентрические и субметацентрические хромосомы; в
8 из изученных клеток были обнаружены микрохромосомы.
Тесты на онкогенность отрицательны. Подкожное введение клеток линии

В условиях пандемии многие государства приступили к созданию лекарств и вакцин от нового коронавируса. Сообщается, что в России разработка прошла первую фазу — так ли это? Значит ли, что скоро можно ждать появления препарата? Чтобы разработать новое лекарство от неизвестного заболевания по всем правилам научного поиска нужно от 5 до 15 лет. Разобрали весь процесс на примере COVID-19 вместе с Равилем Ниязовым, специалистом по регуляторным вопросам и разработке лекарств Центра научного консультирования.
COVID-19 — инфекционное заболевание, вызываемое коронавирусом SARS-CoV-2. В тяжелых формах оно поражает легкие, иногда — сердце и другие органы. Особенно тяжело заболевание протекает, если у больного есть другие нарушения со стороны дыхательной или сердечно-сосудистой систем. Молниеносно возникшая пандемия COVID-19 поставила вопрос разработки лекарств и вакцин от новой инфекции. Это долгий процесс с множеством стадий, на каждой из которых исключают вещества-кандидатов. Только одно или небольшая группа таких веществ в итоге сможет стать безопасным и эффективным лекарством.
Шаг 1: понять, как развивается новое заболевание
Любая болезнь нарушает естественные физиологические и биохимические процессы в организме. Причины заболеваний могут быть разными, в том числе — инфекционными. Инфекционный агент (в случае COVID-19 это коронавирус SARS-CoV-2) заимствует и эксплуатирует биохимический аппарат клеток, перехватывая управление им, в результате чего клетки перестают выполнять свою физиологическую функцию. Для вируса SARS-CoV-2 основной мишенью являются клетки дыхательного эпителия, отвечающие за газообмен, то есть за дыхание.
Лекарством для лечения COVID-19 будет считаться любое вещество или комбинация веществ, которое будет способно (1) инактивировать вирус еще до того, как он успеет поразить клетку, или (2) нарушать жизненный цикл вируса внутри зараженной клетки, или (3) защищать новые непораженные здоровые клетки от инфицирования.
Чтобы создать лекарство от SARS-CoV-2, нужно хорошо знать, каков жизненный цикл вируса в организме человека:
- с какими клетками человека и через какие рецепторы на поверхности клеток он связывается, какой собственный вирусный аппарат для этого он использует;
- как вирус проникает в клетку;
- как вирус эксплуатирует биохимический аппарат клетки, чтобы воспроизводить собственный генетический материал и белки, нужные для сборки новых вирусных частиц;
- как вирус покидает инфицированную клетку, чтобы инфицировать новые клетки;
- как формируется иммунитет против вируса и какой вклад иммунитет вносит в тяжесть заболевания (чрезмерная иммунная реакция может вызывать тяжелое поражение внутренних органов).

Всё перечисленное — это совокупность фундаментальных знаний, необходимых для перехода к следующему этапу разработки лекарства — синтезу или биосинтезу веществ, которые могут нарушать свойства вирусных частиц, убивая вирус и при этом не вредя человеку. Например, так работают лекарства от ВИЧ-инфекции или гепатита C. Но при этих заболеваниях важно применять сразу несколько веществ из разных классов, чтобы вирус не становился устойчивым к терапии. Об этом нужно будет помнить и при разработке лекарств против SARS-CoV-2.
Для лечения вирусных заболеваний также могут использоваться иммуносыворотки, содержащие антитела, способные инактивировать вирус. Такие сыворотки можно получать от животных, например, лошадей или кроликов, но также и от человека, уже переболевшего заболеванием.
Однако самый эффективный подход — профилактика заболевания. Для этого используют вакцины — естественные или генетически модифицированные белки вируса, а иногда и живой, но ослабленный вирус. Вакцина имитирует инфекционное заболевание и стимулирует организм к формированию иммунитета. В последнее время также разрабатываются РНК- и ДНК-вакцины, но пока одобренных препаратов нет.
В отличие от традиционных вакцин, РНК-/ДНК-вакцины содержат не вирусные белки, а гены, кодирующие основные вирусные белки. Введение такой вакцины приводит к синтезу клетками белков вируса, на которые должна реагировать иммунная система и вырабатывать иммунитет против этих белков вируса. Гипотетически это должно препятствовать началу инфекционного процесса при заражении настоящим патогенным вирусом. Важно отметить, такие РНК- и ДНК-вакцины не должны кодировать те белки вируса, которые способны были бы привести к настоящей вирусной инфекции.
Шаг 2: поиск хитов
На ранней стадии разработки синтезируют и тестируют множество веществ — библиотеку. Основная цель этого этапа — найти группу хитов (hit — попадание в цель), которые бы связывались с нужной вирусной мишенью. Обычно это один из белков вируса. Иногда отбор идет из библиотек, состоящих из миллиардов низкомолекулярных веществ. Сейчас активно используют компьютерные алгоритмы — машинное и глубокое обучение — чтобы искать новые потенциально активные молекулы. Одна из компаний, успешно работающая в этом направлении, — InSilico Medicine, создана российскими математиками.
Другой источник потенциальных лекарств — выздоровевшие люди: в их крови содержатся антитела, часть из которых способны связываться с вирусом и, возможно, нейтрализовать его.
Шаг 3: поиск и тестирование лидов
Когда находят группу хитов, способную связываться с вирусным белком, переходят к следующему этапу скрининга. На этом шаге исключаются вещества, которые:
- нестабильны и быстро разлагаются;
- тяжелы/затратны в синтезе;
- токсичны для различных клеток человека в условиях лабораторных экспериментов на культуре клеток. Вещества не должны быть токсичны сами, токсичностью также не должны обладать продукты их метаболизма в организме, продукты их разложения и примеси, возникающие в процессе производства; вместе с тем если процесс производства способен с помощью очистки удалять продукты разложения или примеси, то такой хит может и не будет выведен из разработки;
- плохо растворимы в воде — лекарство должно в достаточном количестве растворяться в биологических жидкостях, чтобы распределиться по организму;
- быстро разлагаются в живом организме;
- плохо проникают через слизистые оболочки, клеточные мембраны или внутрь клетки, в зависимости от пути введения лекарства и расположения вирусной мишени.
Хиты, которые выдерживают эти испытания и проходят все фильтры, переводят в категорию лидов (lead — ведущий).
Лиды тестируют в еще более широкой серии экспериментов для принятия так называемых решений Go/No-Go о продолжении или остановке разработки. На этой стадии инициируются испытания на животных. Такая схема отбора нужна чтобы как можно раньше вывести из разработки бесперспективные молекулы, потратив на них минимальные время и ресурсы, поскольку каждый последующий этап является еще более затратным.
Те несколько лидов, которые успешно проходят очередные испытания, становятся кандидатами. К этому моменту разработка может длиться уже от трех до семи лет.
Шаг 4: испытания кандидатов и клинические исследования

Прежде чем перейти к испытаниям на людях, нужно выполнить исследования на животных и подтвердить отсутствие неприемлемой для человека токсичности, подобрать первоначальную безопасную дозу. На этом этапе кандидаты тоже могут отсеиваться — например, из-за генотоксичности (токсичности для генетического аппарата клетки) или канцерогенности (способности вызывать рак). Еще они могут оказаться небезопасными для беременных женщин или женщин детородного возраста, вызывать поражение головного мозга, печени, почек, сердца или легких. В зависимости от природы молекулы исследования проводят на грызунах, собаках, обезьянах, минипигах, кроликах и т.д.
В зависимости от природы заболевания, особенностей его терапии и свойств лекарства, какие-то исследования могут не проводиться или быть не значимы. Например, оценка канцерогенности лекарства не потребуется, если оно будет применяться в лечении краткосрочных заболеваний, как в случае COVID-19. Генотоксичность не оценивают для биопрепаратов или если лекарство предназначено для лечения метастатического рака и т. д. Суммарно доклинические исследования могут занимать 3–5 лет. Часть из них проводится параллельно с клиническими исследованиями.
Если доклинические исследования успешны, начинается клиническая разработка, которая условно делится на фазы. Это нужно, чтобы постепенно и контролируемо тестировать лекарство на все большем количестве людей. И снова стадийность процесса позволяет прекратить разработку на любом этапе, не подвергая риску многих людей.
- Первая фаза: здесь подтверждают первичную безопасность для людей в принципе, изучают поведение лекарства в организме человека, его биодоступность (способность достигать места действия в достаточных концентрациях), его взаимодействие с другими лекарствами, влияние пищи, половых и возрастных различий на свойства лекарства, а также безопасность для людей с сопутствующими заболеваниями (особенно важны заболевания печени и почек — эти органы отвечают за метаболизм и выведение лекарств), проверяют, не вызывает ли лекарство нарушение ритма сердца. Кроме того, на I фазе оценивают безопасный диапазон доз: эффективные дозы не должны быть неприемлемо токсичными.
- Вторая фаза: здесь начинают проверять эффективность лекарства на пациентах с заболеванием. На ранней II фазе оценивают, работает ли кандидатная молекула на людях с изучаемым заболеванием в принципе, а на поздней II фазе подбирают режим дозирования, если кандидатное лекарство было эффективным. При этом вещество, эффективное в лабораторных экспериментах, на животных моделях заболевания и даже в ранних клинических исследованиях на людях, вполне может не быть таким же рабочим в реальной медицинской практике. Поэтому и нужен длительный процесс поэтапной исключающей разработки, чтобы на выходе получить эффективное и безопасное лекарство.
- Третья фаза: здесь подтверждают эффективность и безопасность лекарства, а также доказывают, что его польза компенсирует те нежелательные реакции, которые неминуемо будет вызывать лекарство. Иными словами, в исследованиях третьей фазы надо понять, что баланс пользы и рисков положителен. Это всегда индивидуально. Например, у людей с ВИЧ в целом допустимо, если противовирусные лекарства вызывают некоторые нежелательные реакции, а в случае онкологических заболеваний приемлемы и более выраженные токсические реакции.
В случае вакцин, которые рассчитаны на здоровых людей, и особенно детей, приемлемы лишь легкие нежелательные реакции. Поэтому найти баланс трудно: вакцина должна быть высоко эффективной, и при этом вызывать минимальное число тяжелых реакций, например реже, чем 1 случай на 1000, 10 000 или даже 100 000 вакцинированных людей. Клиническая разработка может длиться до 5–7 лет, однако низкомолекулярные противовирусные лекарства для краткосрочного применения, как в случае COVID-19, можно протестировать быстрее — за 1–2 года.
Разработка многих отечественных противовирусных и иммуномодулирующих препаратов не соответствует такому научно выверенному процессу разработки.
Шаг 5: производство
Важный этап — наладить производство лекарства. Разработка процессов синтеза начинается в самом начале отбора лидов и постепенно дорабатывается, оптимизируется и доводится до промышленного масштаба.
В настоящее время против SARS-CoV-2 разрабатывается много разных методов лечения:
- низкомолекулярные соединения, которые нарушают жизненный цикл вируса. Трудность в том, что может быть нужно применять сразу несколько противовирусных лекарств. Сейчас надежды возлагают на ремдесивир. Есть данные, что может быть эффективен давно известный гидроксихлорохин, действующий не на сам вирус, а влияющий на иммунитет. Информацию, что комбинация лопинавира и ритонавира оказалась неэффективной у тяжелобольных пациентов, стоит интерпретировать с осторожностью: она может быть эффективна при более легких формах, или для профилактики, или у каких-то определенных подгрупп;
- противовирусные, в том числе моноклональные, антитела, которые связываются с ним на поверхности и блокируют его проникновение в клетку, а также помечают вирус для клеток иммунной системы. Антитела можно получать как биотехнологически, так и выделять из крови переболевших людей. Сейчас тестируются препараты, получаемые с помощью обоих методов;
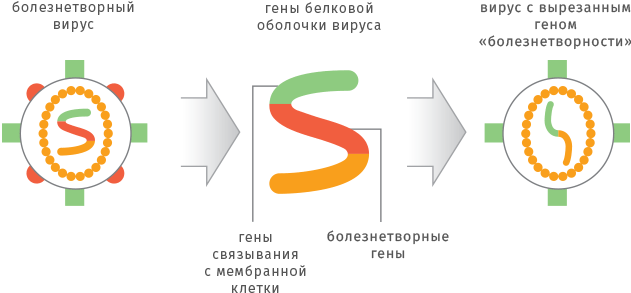
- вакцины. Они могут представлять собой естественные или модифицированные белки вируса (модификации вводят для усиления выработки иммунитета), живой ослабленный вирус, вирусоподобные наночастицы, синтетический генетический материал вируса (РНК-вакцины) для того, чтобы сам организм человека синтезировал некоторые белки вируса и смог выработать антитела к нему. Одна из проблем в случае вакцин — простое введение белков вируса, пусть и модифицированных, не всегда позволяет сформировать иммунитет, способный защитить от реального заболевания — так называемый стерильный иммунитет. Даже образование антител в ответ на введение вакцины не гарантирует защиты: хорошим примером являются те же ВИЧ и гепатит C, хотя вакцина против гепатита B достаточно проста и при этом высокоэффективна. Хочется надеяться, что отечественные разработчики следуют рекомендациям Всемирной организации здравоохранения по проведению доклинических и клинических исследований вакцин, включая исследования провокации и изучение адъювантов;
- препараты для РНК-интерференции. Так называемые малые интерферирующие рибонуклеиновые кислоты (РНК) — это небольшие отрезки синтетически получаемой РНК, которые способны связываться с генетическим аппаратом вируса и блокировать его считывание, мешая синтезу вирусных белков или воспроизведению генетического материала вируса.
Процесс разработки лекарства — это научный поиск с неизвестным исходом. Он занимает много времени и требует участия большой команды профессионалов разных специальностей. Однако только реальный клинический опыт позволит оценить, удалось ли получить не только эффективное, но и безопасное лекарство, поэтому любое точное определение сроков получения лекарства — спекуляция. Получить эффективную и безопасную вакцину к концу года, если следовать всем правилам научного поиска, вряд ли удастся.
Детальные обсуждения процессов разработки новых лекарств и возникающих в связи с этим проблем — на YouTube-канале PhED.
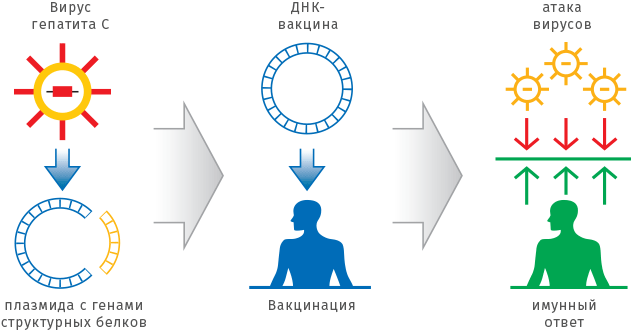
Используя один и тот же плазмидный или вирусный вектор, можно создавать вакцины против различных инфекционных заболеваний, меняя только последовательность, кодирующую необходимые белки-антигены. При этом отпадает необходимость работать с опасными вирусами и бактериями, становится ненужной сложная и дорогостоящая процедура очистки белков. Препараты ДНК-вакцин не требуют специальных условий хранения и доставки, они стабильны длительное время при комнатной температуре.
Уже разработаны и испытываются ДНК-вакцины против инфекций, вызываемых вирусами гепатитов B и C, гриппа, лимфоцитарного хориоменингита, бешенства, иммунодефицита человека (ВИЧ), японского энцефалита, а также возбудителями сальмонеллеза, туберкулеза и некоторых паразитарных заболеваний (лейшманиоз, малярия). Эти инфекции крайне опасны для человечества, а попытки создать против них надежные вакцинные препараты классическими методами оказались безуспешными.
ДНК-вакцинация — одно из самых перспективных направлений в борьбе с раком. В опухоль можно вводить разные гены: те, что кодируют раковые антигены, гены цитокинов и иммуномодуляторов.
Проведя компьютерный (in silico) анализ генома, исследователь получает не только список кодируемых белков, но и некоторые их характеристики, например, принадлежность к определенным группам, возможная локализация внутри бактериальной клетки, связь с мембраной, антигенные свойства.
Третий подход основан на протеомной технологии. Ее методы дают возможность детализировать количественную и качественную характеристики белков в компонентах клетки. Существуют компьютерные программы, которые по аминокислотной последовательности могут предсказать не только трехмерную структуру изучаемого белка, но и его свойства и функции.
Используя эти три метода, можно отобрать набор белков и соответствующие им гены, которые представляют интерес для создания вакцины. Как правило, в эту группу входит около 20-30% всех генов бактериального генома. Для дальнейшей проверки нужно синтезировать и очистить отобранный антиген в количествах, необходимых для иммунизации животных. Очистку белка проводят с помощью полностью автоматизированных приборов. Используя современные технологии, лаборатория, состоящая из трех исследователей, может в течение месяца выделить и очистить более 100 белков.
Важно не только создать вакцину, но и найти наилучший способ ее доставки в организм. Сейчас появились так называемые мукозальные вакцины, которые вводятся через слизистые оболочки рта или носа либо через кожу. Преимущество таких препаратов в том, что вакцина поступает через входные ворота инфекции и тем самым стимулирует местный иммунитет в тех органах, которые первыми подвергаются атаке микроорганизмов.
Существующие терапевтические вакцины для лечения хронических воспалительных заболеваний, вызванных бактериями или вирусами, получают классическими методами. Такие вакцины способствуют развитию иммунитета к входящим в их состав микроорганизмам и активизируют врожденный иммунитет.
Одна из важнейших целей разработчиков терапевтических вакцин — ВИЧ-инфекция. Уже проведена серия доклинических и клинических испытаний нескольких препаратов. Их способность вызывать развитие клеточного иммунитета у здоровых людей не вызывает сомнений. Однако убедительных данных о том, что вакцины подавляют размножение вируса у больных, пока нет.
Схема изготовления дендритной вакцины такова: из крови больного выделяют клетки, которые дают начало дендритным клеткам, и размножают их в лабораторных условиях. Одновременно из опухоли пациента выделяют белки-антигены. Дендритные клетки некоторое время выдерживают вместе с опухолевыми антигенами, чтобы они запомнили образ врага, а затем вводят больному. Такая стимуляция иммунной системы заставляет организм активно бороться с опухолью.
Дендритные вакцины можно использовать для лечения как спонтанных опухолей, так и новообразований, ассоциированных с вирусами. Первые результаты испытания дендритных противораковых вакцин на людях (в небольших группах пациентов IV стадии заболевания) показали безвредность таких вакцин, а в ряде случаев зарегистрирован положительный клинический эффект.
У мышей дендритные вакцины помогают предупредить повторное развитие карциномы после удаления опухоли. Это позволяет надеяться, что они будут эффективны для продления безрецидивного периода онкологических больных после хирургического вмешательства.
Получения вирусных антигенов-диагностикумов для серологической диагностики вирусов
Негативное взаимодействие вирусов: фенотипичское смешивание, негенетическая реактивация, комплементация, стимуляция, интерференция.
Фенотипическое смешивание. Наблюдается при одновременной репродукции двух генетически различных вирусов; проявляется образованием вирионов с генотипом одного из исходных штаммов, но антигенными свойствами обоих вирусов. При данном виде взаимодействия объединяются только структурные белки вирусов, обмена информацией между их нуклеиновыми кислотами не происходит. Формы со смешанным фенотипом нейтрализуются сыворотками против обоих исходных штаммов, так как в оболочке полученных вирусов имеются структурные белки обоих родительских штаммов. Такие вирионы воспроизводят в первом поколении признаки того штамма, нуклеиновую кислоту которого они содержат.
Негенетическая реактивация. При таком виде взаимодействия инактивированный вирус А в результате денатурации структурных белков (депротеинизации) приобретает способность размножаться благодаря активности фермента другого родственного вируса Б. Катализатором может быть не только жизнеспособный вирус Б, но и вирус В, ДНК которого повреждена и не способна реплицироваться (воспроизводиться). Введение депротеинизирующего фермента в культуру клеток, которая инфицирована инактивированным вирусом, ведет к освобождению ДНК вирионов инактивированного вируса и запускает полноценный цикл репродукции.
Комплементация. Наблюдается в тех случаях, когда при мутации в геноме вируса возникают повреждения, и он лишается способности самостоятельной репродукции. Если в клетку проникают два дефектных штамма, у одного из которых повреждения локализованы в гене, ответственном за синтез ранних белков (ферментов), а у другого штамма — в гене, ответственном за синтез структурных белков, то каждый из них может взаимно использовать фермент, синтез которого индуцируется другим штаммом. В результате такой кооперации два дефектных вируса, не способных репродуцироваться поодиночке, при двойной инфекции проходят полный цикл репродукции. Отличие комплементации от генетической рекомбинации заключается в отсутствии обмена генетическим материалом.
Комплементация может быть:
-двусторонняя, когда каждый из вирусов не способен к самостоятельной репродукции.
Этот вид взаимодействия широко распространен как между родственными, так и неродственными вирусами и тесно связан с дефектностью вирусов. Поскольку в популяции помимо стандартных присутствуют дефектные неинфекционные вирусные частицы, утратившие часть генетического материала, комплементация имеет место в инфекционном цикле многих вирусов. Члены популяции снабжают друг друга продуктами генов, которые дефектны у партнеров (негенетическая реактивация).
Интерференцией вирусов обозначают состояние невосприимчивости к вторичному заражению клетки, уже инфицированной вирусом. Различают интерференцию гетерологическую и гомологическую.
Гетерологическая интерференция. Инфицирование одним вирусом полностью блокирует возможность репликации второго вируса в пределах одной клетки. Один из механизмов гетерологической интерференции связан с угнетением адсорбции другого вируса путём блокирования или разрушения специфичных рецепторов. Другой механизм связан с ингибированием трансляции мРНК любой гетерологичной мРНК в инфицированной клетке. Гомологическая интерференция. Процесс типичен для многих дефектных вирусов, особенно для повторно пассируемых in vitro и с высокой множественностью инфицирования. Дефектные вирусы обычно не способны к самостоятельной репродукции. Их репродукция возможна лишь при заражении клетки совместно с нормальным вирусом. В подобных взаимодействиях последний называют вирусом-помощником.Иногда дефектный вирус может вмешиваться в репродуктивный цикл нормального вируса и образовывать дочерние дефектные интерферирующие (ДИ) вирусные частицы.

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.
Читайте также:


