Производные адамантана обладающие противовирусной активностью
Производные адамантана как физиологически активные вещества находят широкое применение с 70-х годов XX века [20]. Сам адамантан (трицикло[3.3.1.1.]декан, С10Н16) принадлежит к числу трициклических нафтенов мостикового типа (рис. 6).

Рис. 6. Структура молекулы адамантана.
Молекула его состоит из трёх конденсированных циклогексановых колец в конформации кресла. Пространственная модель молекулы адамантана - высокосимметричная конструкция с малой поверхностью и незначительными силами межмолекулярного взаимодействия в кристаллической решётке [23]. Из всех трициклических углеводородов адамантан наиболее устойчив, что объясняется тетраэдрической направленностью связей всех атомов углерода и их фиксированным положением.
Биологическая активность производных адамантана обусловлена симметрией и объёмностью пространственного строения, значительнойлипофильностью жёсткого углеводородного каркаса адамантана, что позволяет им легко проникать через биологические мембраны [3]. Поэтому модификация органических соединений с помощью адамантильного радикала значительно изменяет их биологическую активность, нередко усиливая её. С помощью метода спиновых меток было показано, что адамантан, попадая в липидный бислой, способен разрушать гексагональную упаковку метиленовых группировок, характерную для двойного слоя фосфолипидов, и нарушать осевое расположение алкильных цепей фосфолипидов, модифицируя тем самым функциональные свойства клеточных мембран [18]. Принимая во внимание важность порядка расположения метиленовых групп липидов биологических мембран как фактора функционирования связанных с мембранами ферментов, можно отметить косвенное влияние адамантана на их активность.
На данный момент синтезировано более 1000 новых производных адамантана. Фармакологическое изучение показало наличие среди них веществ, обладающих выраженной психотропной, иммунотропной, противовирусной, курареподобной, антикаталептической, противоаллергической активностями, а также соединений, влияющих на ферментативную систему печени [37]. Амиды адамантанкарбоновых кислот проявляют антибактериальную активность [30].
Есть данные о результатах модификации молекулы энкефалина аминокислотами ряда адамантана. Введённый в положение 5 молекулы энкефалина (S)-адамантилаланин придаёт опиоидному пептиду резистентность по отношению к ферментам, легко разрушающим немодифицированный энкефалин (химотрипсин, проназа, нейтральная протеаза, термолизин) [24].
Показано, что физиологической активностью обладают азотсодержащие производные. Первым в медицинскую практику в 1966 г. вошёл гидрохлорид 1-аминоадамантана, обладающий противовирусной активностью в отношении штаммов вирусов типа А2, его фирменные названия: мидантан, симметрел, амантадин. Эти препараты используются для профилактики респираторных заболеваний, т. к. обладают способностью блокировать проникновение вируса в клетку. Предполагают, что данные препараты способны работать на начальных этапах репродукции вируса, блокируя синтез вирусоспецифичных РНК [3]. Противовирусная активность некоторых аминопроизводных адамантана связана с их способностью ингибировать ПК С [39]. Ремантадин (полирем, флумадин), как липофильное слабое основание способен повышать рН эндосомального содержимого и препятствовать депротеинизации вируса [1].
В клинической практике для лечения вирусных заболеваний применяются также такие препараты, как ацикловир (виролекс, герпесин, зовиракс, лизавир, суправиран), диданозин, фоскарнет (триаптен), ганцикловир (цимевен), ламивудин, рибавирин (виразол, рибамидил), ставудин, трифлуридин, видарабин, зальцитабин (хивид), зидовудин (азидотимидин, ретровир) [9]. Однако, у большинства этих препаратов относительно узкий спектр противовирусного действия, их недостатком является наличие разнообразных побочных реакций, появление резистентных штаммов вирусов и др. [25, 35].
Противовирусной активностью в отношении штаммов вирусов типа А2 обладают и производные алкиладамантанов: 1-гидрокси-3,5диметил-7-этиладамантан, 1-метокси-3,5диметиладамантан, которые, в отличие от мидантана, показали высокую противовирусную активность и в отношении штаммов strains of rhino viruses и herpes simplex [3]. Ряд гидрокси-, галоген- и меркаптопроизводных амидов адамантана тоже обладают противовирусной активностью [7, 19].
Показано, что амантадин способен препятствовать развитию очагов саркомы на зародышевой культуре, другие производные адамантана могут служить снотворными средствами, антималярийными препаратами, инсектицидами [37]. В экспериментах с использованием ВИЧ-инфицированных человеческих лимфобластоидных клеток показано, что некоторые производные адамантана обладают анти-ВИЧ-активностью [21]. Мидантан используется в неврологической клинике для лечения болезни Паркинсона и паркинсонического синдрома. Подобную активность проявляют хлорангидриды 3,5,7-алкилзамещённых 1-аминоадамантанов, некоторые из которых обладают антагонистическими дофамину свойствами. Некоторые четвертичные аммониевые основания с 2-адамантильным радикалом способны действовать как миорелаксанты периферического действия (курареподобная активность). Производные 1-аминоадамантана и 3,3-диамино-1,1-диадамантила противокаталептически активны, бактериостатическое влияние оказывают адамантанкарбоновые кислоты и фосфаты адамантантиолов и их производных. Диалкиламиновые эфиры адамантантиокарбоновой кислоты проявляют бактерицидную, фунгицидную, гербицидную активность [12]. Натриевая соль в-(1-адамантан)-пропионовой кислоты обладает желчегонным действием. 1-адамантиламмоний-в-хлорэтилоксаминоат и некоторые другие производные адамантана типа 1-AdCH2OCH2CH(OH)CH2NRRґ обладают анестезирующим действием [3].
Антибактериальное действие, сравнимое с антибактериальным препаратом 5-нитро-8-гидроксихинолином, оказывают N-(нитрофенил)-адамантил-карбоксамиды и адамантилзамещённые N-(1-метилпиридиний)йодиды [13].
Перфторированный адамантан применяется в качестве компонента искусственной крови [28]. Есть данные об антиагрегационной способности производных адамантана по отношению к различным путям агрегации тромбоцитов [55].
Производные адамантана, влияющие на агрегацию тромбоцитов
Ярко выраженная липофильная природа каркасного углеродного фрагмента адамантана обуславливает высокую биологическую активность его производных. Введение в молекулу производного высоколипофильного радикала усиливает его взаимодействие с гидрофобными областями рецепторных молекул [27].
Показано влияние модифицированных адамантильных и амидных фрагментов амидов N-[(адамантоил-1)-фенил]-антраниловой кислоты на 5-НТ2 рецепторы тромбоцитов человека: снижение их АДФ- и серотонин-индуцированной агрегации [11]. Кроме того, известно, что сродство к данным рецепторам обусловлено наличием объёмного адамантильного заместителя [55, 56, 60, 83]. Была предположена биологическая активность ряда 1-адамантанкарбоксамидов в качестве антагонистов 5-НТ2 рецепторов тромбоцитов. Высокоспецифическое сродство к изучаемым рецепторам и мощный антиагрегационный эффект был подтверждён и in vitro и in vivo для (S)-N-<1-[2-(4-флуорофенил)этил]пирролидин-3-ил>-1-адамантанкарбоксамид гидрохлорид гидрата (10-(S), Y-39241) [55].
Ряд синтезированных адамантильных производных гетерофункциональных соединений проявил свойства антагонистов и синергистов серотонина при исследовании их влияния на серотонин-индуцированную агрегацию тромбоцитов человека [13].

Как вы уже знаете, с марта месяца один из нас начал вести постоянную рубрику в любимом журнале нашего детства - "Химии и жизни". Нынешний текст - о веществе, ставшем химической "подписью" автора - и основой некоторых очень распространенных противовирусных препаратов. Так что этот пост и о истории адамантана, и о истории римантадина
Любопытнее всего то, что вещество с точно такой же структурой было известно уже очень давно. Подобное вещество синтезировал еще великий Александр Бутлеров в 1859 году взаимодействием аммиака и формальдегида. Называется оно уротропин, или гексаметилентетрамин. Правда, в структурных узлах этой молекулы находятся не атомы углерода, а атомы азота.




В 1933 году интерес к адамантану возрос еще больше, поскольку чистое вещество нашли в природе — в нефти. Чешские нефтехимики Ланда и Махачек выделили его из продуктов Годонинского месторождения. Попытки синтеза продолжились, но еще восемь лет ничего не получалось. В качестве примера неудачной попытки можно привести вариант синтеза из флороглюцина и циклогексанона.



У производных адамантана могут быть оптические изомеры
Но мы до сих пор ничего не сказали о практической пользе таких молекул. Прошло чуть более четверти века со дня первого синтеза адамантана, и его простенькое производное — аминоадамантан, или амантадин, — стали использовать в качестве противовирусного средство.

Оказалось, что эта небольшая молекула весьма опасна для вируса гриппа. Чуть позже выяснилось, что амантадин неплохо снимает симптомы паркинсонизма — быстрее леводопы и с минимумом побочных эффектов. В этих направлениях и поныне развивается фармакохимия адамантанов. Два самых известных препарата адамантана как раз относятся к этим направлениям.
Первый — римантадин. Это тоже однозамещенный адамантан, к которому прикреплена группа CH3CHNH2. Его начали тестировать как противовирусное средство еще до амантадина (если первый получили в 1967 году, то римантадин — еще в 1963-м). Его до сих пор активно используют против самых разных вирусов — от гриппа А и герпеса до клещевого энцефалита. Он подавляет репродукцию вирусов на начальном этапе — сразу после проникновения их в клетку.

Второй — мемантин. Как можно понять из названия, этот препарат воздействует на память. Он действительно улучшает ее у пациентов с болезнью Альцгеймера, но мемантин пытаются приспособить и к лечению других видов деменций.

Так что адамантан, ставший почти случайно моей химической подписью, — не только безупречная по форме молекула, но интересное и полезное вещество с яркой биографией.
2.2. ФАРМОКОЛОГИЧЕСКИЕ СВОЙСТВА АДАМАНТАНА
Высокая липофильность и объемная структура адамантильного радикала при его введении в молекулы различных биологически активных соединений в значительной мере модифицирует их фармакологическое действие. Таким образом была модифицирована структура ряда антимикробных, противоопухолевых, иммунодепрессивных, гормональных, аналгетических, противовоспалительных, нейротропных средств. [133] Так введение адамантила в 1-β-D-арабинофуранозил, цитозин привело к пролонгированию эффекта полученного соединения. При этом молекулярный механизм действия этого вещества не изменяется, так как для проявления им цитостатической активности требуется гидролиз и освобождение от адамантана. Присоединение адамантильного радикала к пуриновому антиметаболиту 6- тиоинозину также усилило иммуносупрессивную активность производного по сравнению с исходным соединением. [4]
Предполагают, что модификация биологической активности связана с изменением пространственного строения, гидрофобности и липофильности соединений, более благоприятными условиями их транспорта через биологические мембраны. [3]
На данный момент синтезировано более 1000 новых производных адамантана, в том числе и по мостиковому положению. Фармакологическое изучение показало наличие среди них веществ, обладающих выраженной психотропной, курареподобной, иммунотропной, противовирусной, антикаталептической, противоаллергической активностями, а также соединений, влияющих на ферментативную систему печени. [5]
2.3. КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ ПРОИЗВОДНЫХ АДАМАНТАНА
Введение в адамантан в положение 1 или 3 различных заместителей приводит к тому, что его можно использовать во многих областях медицины. Еще в 1966 г. в медицинскую практику был введен гидрохлорид 1-аминоадамантана в качестве антивирусного средства. В медецине это соелинение часто называют мидантаном или амантадином, но фирменное название симметрел: [2]

Изначально его применяли только как антигриппозный препарат. В настоящее же время мидантан наиболее часто используется в неврологической клинике для лечения болезни Паркинсона и паркинсонического синдрома (паркинсонизм является одним из наиболее распространенных заболеваний центральной нервной системы и встречается у 1-2,5% людей, причем риск заболевания с возрастом увеличивается). [4]
Механизм действия симметрела состоит в том, что он не убивает вирусы, а лишь блокирует их проникновение в клетку, вследствие чего он особенно эффективен для профилактики и на ранних этапах заболевания. Имеется, однако, другая точка зрения на механизм действия препарата, согласно которой аминоадамантан и его производные “вмешиваются” в ранние этапы репродукции вирусов, а их ингибирующее действие связано с латентным периодом – началом репликации и синтеза вирусспецифических РНК. [2]
В качестве других средств против заболеваний центральной нервной системы в клинике прошли испытания бемантан (I) (2-(N-бензоиламино)адамантан), димантан (II) (2,2`-ди(адамантил)амин гидрохлорид), кемантан (III) (1-гидроксиадамантан-4-он), адапромин (IV) (2-этил-1-адамантанметиламина гидрохлорид) и мемантин (V) (1,3-диметил-5-аминоадамантана). [4]
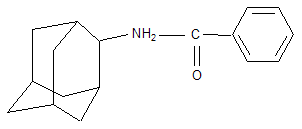
(I)
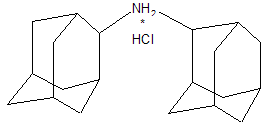
(II)

(III)

(IV)
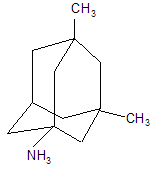
(V)

(VI)
В медицине широко используется ремантадин (VI) (2-метил-1-адамантанметиламина гидрохлорид) как антигриппозное лекарственное вещество. [2] Помимо этого ремантадин ингибирует репродукцию вируса Синдбис из-за того, что он как липофильное слабое основание способен повышать рН эндосомального содержимого и препятствует депротенизации вируса. [6]
2.4. ПРОТИВОВИРУСНАЯ АКТИВНОСТЬ АДАМАНТАНА
Среди вирусных инфекций грипп и другие острые заболевания дыхательных путей, вызываемые РНК-содержащими вирусами, занимают ведущее место. Поскольку стадии размножения вируса в зараженной клетке еще до конца не изучены, то трудно сказать с каким именно процессом связано противовирусное действие активных производных адамантана. Однако установлено, что производные адамантана не влияют на адсорбцию вирусных частиц на поверхности чувствительных клеток и проникновение вируса в клетку [7].
Как уже упоминалось, антивирусной активностью обладают аминопроизводные адамантана (ремантадин и симметрел). Механизм их действия связан с блокированием функции ионных каналов клетки или белка вируса группы А. В институте нефтехимического синтеза были разработаны новые лекарственные вещества, которые ингибировали репродукцию вирусов гриппа А и В, а также вирусов простого герпеса. Эти лекарственные вещества представляют собой комплексные препараты адамантанов и полимерных матриц (поликарбоксилаты анионного типа на основе малеинового ангидрида и дивинилового спирта). Данные соединения обладают токсичностью в 5-10 раз ниже, чем у ремантадина [8].
Также осуществлена трехкомпонентная конденсация инозиндиальдегида, пропандиенфосфонистой кислоты и 1-аминометиладамантана, приведшая к образованию 9-[(1`,4`-морфолил)-3`-окси-N`-(1-адамантилалкил)-5`-пропандиенфосфинат-6`-оксиметил-2`]-гипоксантинов, обладающих противовирусной активностью в отношении РНК и ДНК-содержащих инфекционных и онкогенных вирусов [3].
Из литературных данных известно, что одним из лекарственных средств против вируса гриппа А и В является 2-(адамант-2-ил) пиперидин [9]:
Противовирусные препараты — соединения природного или синтетического происхождения, применяющиеся для лечения и профилактики вирусных инфекций. Действие многих из них избирательно направлено на различные стадии развития вирусной инфекции и жизненного цик
Противовирусные препараты — соединения природного или синтетического происхождения, применяющиеся для лечения и профилактики вирусных инфекций. Действие многих из них избирательно направлено на различные стадии развития вирусной инфекции и жизненного цикла вирусов.
В настоящее время известно более 500 вирусов, возбудителей заболеваний человека. Вирусы содержат одно- или двухцепочечную рибонуклеиновую кислоту (РНК) или дезоксирибонуклеиновую кислоту (ДНК), заключенную в белковую оболочку — капсид. У некоторых из них есть и внешняя оболочка из липопротеидов. Многие вирусы содержат ферменты или гены, обеспечивающие репродукцию в клетке-хозяине. В отличие от бактерий у вирусов нет собственного обмена веществ: они используют метаболические пути клетки-хозяина.
РНК-содержащие вирусы или синтезируют матричную РНК (мРНК), или сама РНК выполняет функцию мРНК. На ней синтезируются вирусные белки, в том числе РНК-полимераза, при участии которой образуется мРНК вируса. Транскрипция генома некоторых РНК-содержащих вирусов осуществляется в ядре клетки-хозяина. Под действием обратной транскриптазы ретровирусов на основе вирусной РНК синтезируется комплементарная ей ДНК (провирус), которая встраивается в геном клетки-хозяина. В дальнейшем при транскрипции образуется как клеточная РНК, так и мРНК вируса, на которой синтезируются вирусные белки для сборки новых вирусов. Вирусы и заболевания, которые ими вызываются, отражены в табл. 1.

На стадии заражения вирус адсорбируется на клеточной мембране и проникает в клетку. В этот период применяются препараты, нарушающие этот процесс: растворимые ложные рецепторы, антитела к мембранным рецепторам, ингибиторы слияния вируса с клеточной мембраной.
На следующем этапе начинается внутриклеточный синтез вирусных компонентов. На этом этапе эффективны ингибиторы вирусных ДНК-полимераз, РНК-полимераз, обратной транскриптазы, геликазы, праймазы, интегразы. На трансляцию вирусных белков действуют интерфероны (ИФН), антисмысловые олигонуклеотиды, рибозимы и ингибиторы регуляторных белков. На протеолитическое расщепление воздействуют ингибиторы протазы.
ИФН и ингибиторы структурных белков активно воздействует на сборку вируса.
Заключительный этап репликационного цикла включает выход дочерних вирионов из клетки и гибель инфицированной клетки-хозяина. На этом этапе эффективны ингибиторы нейраминидазы, противовирусные антитела и цитотоксические лимфоциты.
Существуют различные классификации противовирусных средств. В данной статье представлена классификация по воздействию на тот или иной вирус (табл. 2).

Рассмотрим противогриппозные и противогерпетические препараты.
Классификация противовирусных препаратов, разрешенных к применению на территории России.
- руппа противогриппозных препаратов:
– Амантадин;
– Арбидол;
– Осельтамивир;
— Римантадин. - Препараты, действующие на герпесвирусы:
– Алпизарин;
– Ацикловир;
– Бонафтон;
– Валацикловир;
– Ганцикловир;
– Глицирризиновая кислота;
– Идоксуридин;
– Пенцикловир;
– Риодоксол;
– Теброфен;
– Тромантадин;
– Фамцикловир;
– Флореналь. - Антиретровирусные препараты:
– Абакавир;
– Ампренавир;
– Атазанавир;
– Диданозин;
– Залцитабин;
– Зидовудин;
– Индинавира сульфат;
– Ламивудин;
– Нелфинавир;
– Ритонавир;
– Саквинавир;
– Ставудин;
– Фосфазид;
– Эфавиренз. - Другие противовирусные препараты:
– Инозин пранобекс;
– Интерферон альфа;
– Интерферон альфа-2;
– Интерферон альфа-2b;
– Интерферон бета-1а;
– Интерферон бета-1b;
– Йодантипирин;
– Рибавирин;
– Тетраоксо-тетрагидронафталин (Оксолин);
– Тилорон;
– Флакозид.
Арбидол — производное индолкарбоновой кислоты. Механизм действия препарата складывается из подавления репродукции вируса гриппа, влияния на синтез ИФН, повышения количества Т-лимфоцитов и функциональной активности макрофагов, а также антиоксидантного эффекта.
Препарат проникает в неизмененном виде как в незараженные, так и в зараженные клетки и определяется в ядерной и цитоплазматической фракциях. Арбидол ингибирует процесс слияния липидной вирусной оболочки с мембранами эндосом (при рН 7,4), приводящий к высвобождению вирусного генома и началу транскрипции. В отличие от амантадина и римантадина, Арбидол ингибирует освобождение самого нуклеокапсида от наружных белков, нейраминидазы и липидной оболочки. Таким образом, Арбидол действует на ранних стадиях вирусной репродукции.
У препарата отсутствует штаммовая специфичность (в культурах клеток он подавляет репродукцию вируса гриппа А на 80%, вируса гриппа В — на 60% и вируса гриппа С — на 20%, а также воздействует и на вирус птичьего гриппа, однако слабее, чем на репродукцию человеческих штаммов вируса гриппа).
Синтез ИФН нарастает, начиная с приема 1 таблетки до 3 таблеток. Однако дальнейшего увеличения уровня ИФН при приеме Арбидола не наблюдается. Быстрое нарастание синтеза ИФН может оказывать профилактическое действие при приеме препарата до начала заболевания гриппом.
Арбидол оказывает иммуномодулирующее действие, приводя к повышению общего количества Т-лимфоцитов и Т-хелперов. Причем нормализация данных показателей наблюдалась у пациентов с исходно сниженным числом CD3- и CD4-клеток, а у лиц с нормальным функционированием клеточного звена иммунитета практически отсутствовали изменения количества Т-лимфоцитов и Т-хелперов. При этом применение Арбидола не ведет к существенному снижению абсолютного числа Т-супрессорных лимфоцитов — таким образом, стимулирующая активность препарата не связана с угнетением функции супрессорных клеток. Арбидол увеличивает общее число макрофагов с поглощенными бактериями и фагоцитарное число. Предполагается, что активирующими стимулами для фагоцитарных клеток явились цитокины и, в частности, ИФН, продукция которого усиливается под воздействием препарата. Увеличивается также содержание натуральных киллеров — NK-клеток, что позволяет характеризовать препарат как индуктор активности естественных киллеров.
Препарат быстро всасывается из желудочно-кишечного тракта (ЖКТ). Т1/2 составляет 16–21 ч. Экскретируется в неизмененном виде с калом (38,9%) и мочой (0,12%). В течение первых суток выводится 90% введенной дозы.
Лекарственные взаимодействия Арбидола с другими лекарственными препаратами в литературе не описаны.
Практически единственными побочными эффектами препарата являются аллергические реакции. Препарат разрешен к применению с 2-летнего возраста.
Арбидол обладает достаточно широким спектром противовирусного действия и используется для профилактики и лечения гриппа типов А и В, в том числе осложненного бронхитом и пневмонией; острых респираторных заболеваний (ОРВИ); хронического бронхита, пневмонии, рецидивирующей герпетической инфекции; в послеоперационном периоде — для нормализации иммунного статуса и профилактики осложнений.
Амантадин и римантадин — производные адамантана. Оба препарата даже в малых дозах подавляют репродукцию вируса А. Их противовирусная активность обусловлена двумя механизмами.
Во-вторых, они могут действовать и на этапе сборки вируса, по-видимому, за счет изменения процессинга гемагглютинина. Этот механизм возможен у некоторых штаммов вирусов.
Среди диких штаммов устойчивость к препаратам возникает редко, однако от больных, принимающих их, получают устойчивые штаммы. Чувствительность и устойчивость вирусов к амантадину и римантадину перекрестная.
Оба препарата хорошо всасываются при приеме внутрь, имеют большой объем распределения. Большая часть амантадина выводится с мочой в неизмененном виде. Период полувыведения (Т1/2) у молодых людей составляет 12–18 ч, у пожилых возрастает почти вдвое, а при почечной недостаточности увеличивается еще больше. Поэтому дозу препарата необходимо уменьшать даже при незначительном изменении функции почек. Римантадин активно метаболизируется в печени, Т1/2 в среднем составляет 24–36 ч, 60–90% препарата выводится с мочой в виде метаболитов.
При приеме обоих препаратов наиболее часто отмечают незначительные дозозависимые нарушения со стороны ЖКТ (тошнота, снижение аппетита) и центральной нервной системы (ЦНС) (раздражительность, бессонница, нарушение концентрации внимания). При приеме высоких доз амантадина возможно значительное нейротоксическое действие: спутанность сознания, галлюцинации, эпилептические припадки, кома (эти эффекты могут усиливаться при одновременном приеме Н1-блокаторов, М-холиноблокаторов, психотропных средств и этанола). Безопасность применения во время беременности не установлена. Разрешено применение с 7-летнего возраста.
Препараты применяются для профилактики и лечения гриппа А. Их прием во время эпидемий гриппа позволяет избежать инфекции в 70–90% случаев. У лиц с неосложненным гриппом А лечение препаратами в течение 5 дней в возрастных дозировках, начатое на ранней стадии заболевания, на 1–2 сут уменьшает длительность лихорадки и общих симптомов, ускоряет выздоровление и иногда сокращает период выделения вируса.
Осельтамивир является неактивным предшественником, который в организме превращается в активный метаболит — осельтамивира карбоксилат. Он является переходным аналогом сиаловой кислоты и избирательным ингибитором нейраминидазы вирусов гриппа А и В. Кроме того, он подавляет штаммы вируса гриппа А, устойчивые к препаратам — производным адамантана.
Нейраминидаза вируса гриппа отщепляет концевые остатки сиаловых кислот и, таким образом, разрушает рецепторы, находящиеся на поверхности клеток и новых вирусов, т. е. способствует выходу вируса из клетки по окончании репродукции. Активный метаболит осельтамивира вызывает изменения в активном центре нейраминидазы и подавляет ее активность. Происходит агрегация вирусов на поверхности клетки и замедляется их распространение.
Устойчивые штаммы вируса гриппа А обнаруживают у 1–2% больных, принимающих препарат. Устойчивых штаммов вируса гриппа В на сегодняшний день не обнаружено.
При приеме внутрь препарат хорошо всасывается. Прием пищи не влияет на его биодоступность, но снижает риск побочного действия на ЖКТ. Препарат подвергается ферментативному гидролизу в ЖКТ и печени с образованием активного метаболита. Объем распределения препарата приближается к объему жидкости в организме. Т1/2 осельтамивира и его активного метаболита составляет 1–3 и 6–10 ч соответственно. Оба соединения выводятся главным образом почками в неизмененном виде.
При приеме внутрь возможны незначительные неприятные ощущения в животе и тошнота, которые уменьшаются при приеме препарата во время еды. Желудочно-кишечные расстройства обычно проходят через 1–2 сут, даже если больной продолжает прием препарата. Клинически значимых взаимодействий осельтамивира с другими препаратами не выявлено. Препарат применяют у детей старше 1 года.
Осельтамивир применяют для лечения и профилактики гриппа. Профилактический прием осельтамивира в период эпидемий снижает заболеваемость как среди вакцинированных противогриппозной вакциной, так и среди невакцинированных. При лечении гриппа этим препаратом выздоровление наступает на 1–2 сут раньше, а количество бактериальных осложнений снижается на 40–50%.
Прежде чем перейти к обсуждению противогерпетических средств, необходимо вспомнить различные вирусы герпеса и заболевания, вызываемые ими (табл. 4). К сожалению, в арсенале современных противовирусных средств нет препаратов, действующих на все вирусы герпеса одновременно (табл. 5).


Вирус простого герпеса типа 1 вызывает поражение кожи, рта, пищевода и головного мозга, вирус простого герпеса типа 2 — поражение наружных половых органов, прямой кишки, кожи и мозговых оболочек. Первым из допущенных к применению противогерпетических препаратов был видарабин (1977). Однако ввиду высокой токсичности его применяли для лечения заболеваний, вызванных вирусом простого герпеса и Varicella–zostervirus, лишь по жизненным показаниям. С 1982 г. для лечения больных с менее тяжелым течением заболевания стали применять ацикловир.
Ацикловир — ациклический аналог гуанозина, а валацикловир — L-валиновый эфир ацикловира. Ацикловир подавляет синтез вирусной ДНК после фосфорилирования вирусной тимидинкиназой внутри зараженных клеток. Образующийся в клетке ацикловиртрифосфат встраивается в синтезируемую в клетке-хозяине цепь ДНК, что приводит к прекращению роста вирусной цепи ДНК. Молекула ДНК, в состав которой входит ацикловир, связывается с ДНК-полимеразой, необратимо инактивируя ее.
Устойчивость вируса может возникнуть в результате снижения активности вирусной тимидинкиназы и изменения вирусной ДНК-полимеразы. Изменение активности ферментов возникает в результате мутаций.
Биодоступность ацикловира при приеме внутрь составляет всего 10–30% и уменьшается с увеличением дозы. В отличие от ацикловира, биодоступность валацикловира при приеме внутрь достигает 70%. Препарат быстро и почти полностью превращается в ацикловир. Ацикловир проникает во многие биологические жидкости, в том числе в содержимое везикул при ветряной оспе, спинно-мозговую жидкость, накапливается в молоке, околоплодных водах и плаценте. Концентрация его во влагалищном содержимом колеблется в широких пределах. Сывороточная концентрация препарата у матери и новорожденного примерно одинаковы. Через кожу препарат практически не всасывается. Т1/2 ацикловира составляет в среднем у взрослых 2,5 ч, у новорожденных — 4 ч, у больных с почечной недостаточностью может увеличиваться до 20 ч. Препарат практически полностью выводится почками в неизмененном виде. При беременности фармакокинетика препаратов не меняется.
Как правило, ацикловир переносится хорошо. При применении мази на основе полиэтиленгликоля возможно раздражение слизистой половых органов и чувство жжения. При приеме внутрь препарат изредка вызывает головную боль, головокружение, сыпь и диарею. Еще реже отмечаются почечная недостаточность и нейротоксическое действие. Побочные эффекты валацикловира сходны с таковыми у ацикловира — тошнота, диарея, головная боль; высокие дозы могут вызвать спутанность сознания, галлюцинации, поражения почек и — очень редко — тромбоцитопению. При внутривенном введении больших доз ацикловира могут развиться почечная недостаточность и поражения ЦНС.
Фамцикловир сам неактивный, но при первом прохождении через печень быстро превращается в пенцикловир. Пенцикловир — это ациклический аналог гуанозина. Механизм действия препарата сходен с механизмом действия ацикловира. Как и ацикловир, пенцикловир действует главным образом на вирусы простого герпеса и Varicella–zostervirus. Устойчивость к пенциклавиру в клинике встречается редко.
В отличие от пенцикловира, биодоступность которого при приме внутрь составляет лишь 5%, фамцикловир хорошо всасывается. При приеме фамцикловира биодоступность пенцикловира возрастает до 65–77%. Прием пищи совместно с препаратом замедляет всасывание последнего, но в целом биодоступность не снижается. Объем распределения пенцикловира в 2 раза превышает объем жидкости в организме, Т1/21/2 увеличивается до 9,9 ч. Препарат легко удаляется при гемодиализе.
Переносится ацикловир хорошо, но иногда возможно возникновение головной боли, тошноты, диареи, крапивницы, а у пожилых людей — галлюцинаций и спутанности сознания. Препараты для местного применения могут вызвать контактный дерматит и изъязвления.
Безопасность препарата во время беременности, а также взаимодействие его с другими лекарственными средствами не установлена.
Ганцикловир — это ациклический аналог гуанозина. Механизм действия препарата сходен с механизмом действия ацикловира. Активен в отношении всех герпесвирусов, но наиболее эффективен в отношении цитомегаловируса.
Биодоступность ганцикловира при приме внутрь во время еды составляет 6–9% и несколько меньше при приеме натощак. Валганцикловир хорошо всасывается и быстро гидролизуется до ганцикловира, биодоступность которого возрастает до 61%. При приеме валганцикловира во время еды биодоступность ганцикловира повышается еще на 25%. При нормальной функции почек Т1/2 составляет 2–4 ч. Более 90% препарата выводится почками в неизмененном виде. При почечной недостаточности Т1/2 увеличивается до 28–40 ч.
Основной дозалимитирующий побочный эффект ганцикловира — угнетение кроветворения (нейтропения, тромбоцитопения). У 5–15% больных отмечают поражения ЦНС разной степени тяжести (от головной боли до судорог и комы). При внутривенном введении возможны флебиты, азотемия, анемия, сыпи, лихорадка, изменение биохимических показателей печени, тошнота, рвота, эозинофилия.
У лабораторных животных препарат оказывал тератогенное и эмбриотоксическое действие, необратимо нарушал репродуктивную функцию. Цитостатические препараты усиливают побочное действие ганцикловира на костный мозг.
Идоксуридин — йодсодержащий аналог тимидина. Механизм противовирусного действия до конца не изучен. Известно, что фосфорилированные производные препарата встраиваются в вирусную и клеточную ДНК, но ингибируют репликацию только вирусной ДНК. При этом ДНК становится более хрупкой, легко разрушается, при ее транскрипции чаще возникают ошибки. Устойчивые штаммы выделяют от больных герпетическим кератитом, получавших идоксуридин. Препарат разрешен лишь для местного применения. При его использовании возможны боль, зуд, воспаление и отек в области глаз, аллергические реакции.
Успехи антимикробной терапии ХХ столетия привели к почти полному контролю над бактериальными инфекциями. Задачей инфекционистов и фармакологов ХХI века является обеспечение контроля над вирусной инфекцией. Помимо высокой эффективности новые противовирусные препараты должны обладать хорошей переносимостью. В настоящее время разрабатываются новые средства с принципиально новыми механизмами действия. Перспективными могут оказаться средства для подавления патологических иммунных реакций и иммунотерапия моноклональными антителами и вакцинами.
Н. М. Киселева, кандидат медицинских наук, доцент
Л. Г. Кузьменко, доктор медицинских наук, профессор
РГМУ, Москва
Читайте также:


