Ретровирусы патогенные для человека
Ретровирусы содержат две идентичные молекулы геномной РНК и РНК-зависимую ДНК-полимеразу (обратную транскриптазу, ревертазу). Ретровирусы выделены от множества видов животных и проявляют разнообразный спектр патогенного потенциала. Семейство включает вирусы 7 родов: альфа-, бета-, гамма-, дельта-, эпсилонретровирусы, лентивирусы и спумавирусы. Семейство включает вирусы, патогенные для человека и многих видов животных.
Большинство ретровирусов обладают выраженным тропизмом к клеткам лимфОретикулярной и гемопоэтической системы. Ретровирусы у специфических для них видов животных встречаются повсеместно. В борьбе с ретровирусными инфекциями основной мерой является предотвращение передачи вируса.
Вирионы ретровирусов представляют собой округлые оболочечные частицы диаметром 80—100 нм, обладающие уникальной трехслойной структурой. Центральная часть вириона представлена нуклеопротеиновым комплексом, который включает около 30 молекул ревертазы и имеет спиральную симметрию. Эта структура окружена икосаэдрическим капсидом диаметром около 60 нм, покрытым оболочкой, происходящей из мембраны клетки, от которой отходят гликопротеиновые пепломеры. Лентивирусы имеют на поверхности примерно 72 шишкоподобных пепломера длиной около 10 нм с яйцевидным концевым уплотнением.
Ретровирусы имеют диплоидный геном, представляющий инвертированный димер из двух молекул линейной позитивной полярности, оцРНК; каждая молекула содержит 7-11 тн и имеет полиА последовательность на З'-конце и КЭП-структуру на 5'-конце. Детальная организация геномов разных ретровирусов широко варьирует.
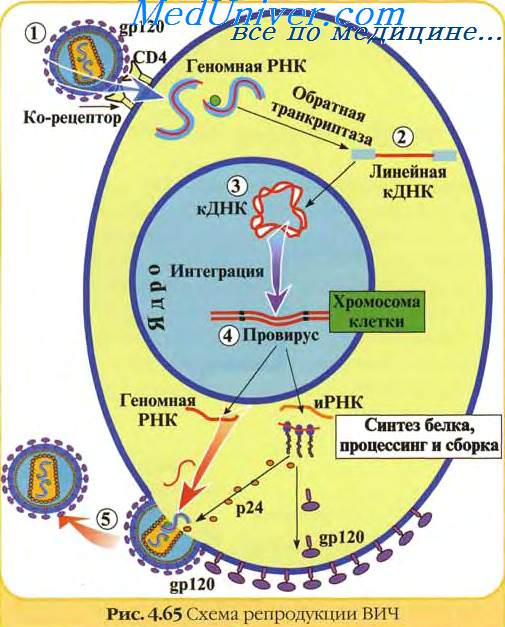
Геном ретровирусов уникален в следующих отношениях:
1) является единственным диплоидным;
2) вирусная РНК синтезируется и изменяется с помощью механизма, изменяющего клеточную мРНК;
3) это единственный геном, связанный со специфическим переносом функции РНК целиком к первичной репликации;
4) это единственная оц(+)РНК, которая не является мРНК вскоре после инфекции;
5) это единственный геном, кодирующий обратную транскриптазу, которая сама по себе уникальна.
Среди многих своих функций обратная транскриптаза служит в качестве РНК-зависимой ДНК полимеразы, а ДНК-зависимая ДНК полимераза, интеграза и РНКаза, каждая в меру своей определенной функции, представляют различную часть белковой молекулы. Геном недефектных ретровирусов содержит три разных гена, каждый из которых кодирует два и более белка. Gag ген кодирует вирионные коровью белки, pol ген кодирует обратную транскриптазу, a env ген кодирует вирионные пепломерные белки. Геном кодирует также несколько определенных вирионных компонентов.
Геном быстро трансформирующих ретровирусов содержит четвертый ген — вирусный онкоген (v-onc). Присутствие онкогена обычно связано с делецией в другом месте генома, обычно в env гене, так что большинство v-onc содержащих вирусов не способны синтезировать полностью оболочку и поэтому являются дефектными по репликации. Они всегда находят связь с недефектными вирусами, которые реплицируются полностью и функционируют в качестве помощников. Вирус саркомы Рауса является исключением. Его геном содержит вирусный онкоген v-src и также полные gag, pol и env гены, и поэтому является репликативнокомпетентным.
Vpu, vpr и vpx найдены в лентивирусах приматов. Vpu способствует созреванию вирусных гликопротеинов и освобождению вирионов почкованием; Vpr -слабый активатор транскрипции; Vpx, по-видимому, способствует репликации в Т-лимфоцитах и макрофагах.
При продуктивной инфекции вирионы формируются и освобождаются почкованием через плазматическую мембрану. Некоторые ретровирусы вызывают образование опухолей.
Спумавирусы являются необычными ретровирусами во многих отношениях. Они выделены от человека, обезьян, КРС, кошек, морских львов и хомяков. Они представляют проблему, когда контаминируют клеточные культуры, но их связь с заболеваниями неизвестна. Существует мнение, что пенящие вирусы ближе стоят к ДНК гепаднавирусам.
Эндогенный ретровирус свиней (PERV) найден у всех исследованных пород свиней. Известны три субгруппы этого вируса: А, В и С. Все свиньи содержат множественные провирусы (около 50) в своем геноме. PERVлатентно инфицирует многие культуры клеток свиньи и, реже, человека. Патогенность этого вируса не установлена.
Онковирусы, в отличие от лентивирусов, реплицируются в делящихся клетках. В составе ретровирусов обнаружено 11-13 белков. Часть из них локализована в сердцевине, а главный внутренний белок Р27 - Р30 - в мембране, окружающей РНК. В составе липопротеиновой оболочки 2-5 гликопротеинов, из которых более крупный образует головку шипика и является главным компонентом оболочки, а более мелкие белки образуют отросток, погруженный в билипидный слой. Различные белки ответственны за групповую и типовую специфичность. Подгрупповые и типоспецифические антигены связаны с наружными гликопротеинами и выявляются в РН, РСК, ИФ и РИД. Группоспецифические антигены связаны с белками сердцевины. Их обнаруживают в РСК, ИФ и РИД. Главный внутренний белок Р27 - РЗО - основной группоспецифический антиген, общий для всех ретровирусов птиц или млекопитающих, относящихся к одной группе.
Согласно предложенной ранее номенклатуре структурные белки ретровирусов обозначали следующим образом: МА - матриксный, СА - капсидный, NC -белок нуклеокапсида, SU - поверхностный, ТМ - трансмембранный, PR- протеаза, RT - ревертаза, IN - белок интеграции.
Одна интересная черта ретровирусов заключается в том, что мы можем понять их эволюцию и эволюцию нашей клеточной защиты. Вирус иммунодефицита человека пришел к нам от приматов. Самый распространенный тип ВИЧ называется ВИЧ-1. Он составляет примерно 60 миллионов человеческих заражений ВИЧ. Это практически единичный случай, когда вирус шимпанзе поразил человека и стал распространяться среди человеческого населения. Мы знаем, что направление заражения именно такое — от шимпанзе к человеку, — потому что у шимпанзе существует больше типов этого вируса, чем у людей.
Существует еще один тип ВИЧ, названный ВИЧ-2, который пришел к нам от африканских обезьян, а именно дымчатого мангобея. И снова разновидностей этого вируса у мангобеев намного больше, чем у человека. Это говорит нам о том, что перенос вируса происходит от обезьяны к человеку. ВИЧ-2 вызывает похожую болезнь, что и ВИЧ-1, у примерно 20–30% людей. Однако у большинства людей не наблюдаются никакие значимые симптомы после заражения ВИЧ-2. Поэтому один из важных вопросов ВИЧ-биологии заключается в поиске отличий между тем вирусом, который заразил 60 миллионов человек, и тем, что не инфицировал даже приблизительно такое число.
У приматов есть похожие вирусы. Более того, большинство африканских приматов имеют вирус, который родственен нашему ВИЧ-1. Обычно мы называем эти вирусы в соответствии с видом, в котором мы их нашли. Вирус шимпанзе называется ВИО (SIV) — вирус иммунодефицита обезьян (simian immunodefiency virus). В таком случае, бывает ли у шимпанзе СПИД? Это не до конца понятно. Не все шимпанзе заражены. Существуют определенные территории, где проживают зараженные шимпанзе. Но так как они не живут жизнью людей, не ведут утонченный образ жизни, а, наоборот, проживают более трудную жизнь, то умирают намного раньше, за ними становится очень сложно следить и выяснять, есть ли у них это заболевание.
Из-за этого долгое время мы думали, что они не страдают никакими болезнями, потому что у них нет такого сильного иммунодефицита, как у людей. Но в последнее время мы стали думать, что они тоже имеют эту болезнь, возможно, в менее суровой форме. Так как они не живут долго, им не приходится страдать от тех симптомов, которые переживает человек.
Таким образом, до конца не известно, что происходит с ретровирусной инфекцией в организме обезьян. У африканских обезьян вирус практически не вызывает никаких заболеваний, поэтому кажется, что имеет место адаптация как носителя, так и самого вируса по такому принципу, что обезьяна может быть инфицирована, но не страдать от болезней. Они могут заразиться в достаточно раннем возрасте, поэтому могут иметь вирус в своем теле, но при этом не ощущать значимых последствий для своей жизни.
Среди других видов ретровирусы тщательно изучались у мышей. Это делалось в основном потому, что ретровирусная инфекция у мышей способна вызывать рак. Мышь заражается ретровирусом, который обычно называют гамма-ретровирус. Оказывается, что эта ретровирусная инфекция вызывает у мышей рак. Люди, изучавшие рак в 1950–1960-х годах, то есть в самом начале подобных исследований, выращивали мышь до тех пор, пока она не становилась очень уязвимой к этой болезни, а потом пытались выяснить, почему у этих мышей развивается рак. Оказалось, что они получали рак, потому что были инфицированы ретровирусом. Эти ретровирусы переносили гены (онкогены), которые вызывали рак. Таким образом, все первичные исследования ретровирусов были направлены на понимание того, как работает рак и что его вызывает.
Когда появился ВИЧ и стал вызывать иммунодефицит, это стало первым случаем, когда такой тип вируса вызвал такую болезнь. До этого мы знали о ретровирусах только из исследований гамма-ретровирусов, вызывающих рак. Ретровирусы — это такие типы вирусов, которые можно рассматривать как вирусы, путешествующие налегке. Так, например, ВИЧ имеет всего девять генов, а другие ретровирусы вообще три. Так что они действительно путешествуют налегке по сравнению с вирусом герпеса, например, который имеет около двухсот генов. Я считаю, что эти вирусы — МО (modus operandi), их стратегия — путешествовать налегке и быть тихими. Их цель при поражении клетки — не активировать ее и не причинить много ущерба. Я думаю, что изначально они не вызывают сильных болезней, но в длительной перспективе эта инфекция может вызвать болезни вроде рака у мышей. Хотя, возможно, они не вызовут рак у диких мышей. Это происходит только тогда, когда мы пробиваем защиту мыши.
Итак, ретровирусы — это относительно милосердные вирусы, я считаю, потому что они не управляют вашим телом, как делают другие вирусы. Главное их отличие в том, что они превращают РНК в ДНК и интегрируют ДНК в хроматин. Это и есть уникальная черта ретровирусов. Некоторые другие вирусы поступают так же, но только в качестве дополнения. Ретровирусы целиком зависят от этого процесса интеграции. Если клетка не может от них избавиться, она должна умереть для избавления себя от вирусной инфекции.
Ретровирусы внедряют свой геном в хроматин хозяина. Стоит этим генам попасть внутрь хроматина — они останутся там навсегда. Клетка в целом относится к ним как к клеточным генам, так что они считываются, производят РНК, а позже эта РНК направляется в цитоплазму. Вирус производит протеин, клетка производит вирусный протеин, новые вирусы формируются, и они готовы двигаться дальше, заражать новые клетки. Так ретровирусы стали отличным инструментом для изучения клеточной биологии, и это потому, что они простые. Некоторые из них имеют всего три гена. Даже сложный ретровирус вроде ВИЧ имеет всего девять генов. Поэтому очень легко взять их, разделить на части и изучать, какая часть за что отвечает.
В поле генной терапии существует трюк, когда берут ретровирус, вынимают из него ретровирусные гены и вставляют те гены, которые нужны. Потом можно сформировать ретровирусные частицы. Этот трюк можно использовать для развития ретровирусного вектора. Работает это так: можно взять ретровирусный геном, который обычно шифрует все ретровирусные гены, избавиться от них и поставить на их место предпочтительный ген, например терапевтический ген или ген, который можно просто измерять, — мы обычно используем ЗФБ (GFP), который заставляет клетки зеленеть. Если вы это сделаете, вы сможете производить ретровирусные частицы, которые будут только заражать клетку и производить белок. В ретровирусе не окажется ретровирусных генов, так что он сможет производить только терапевтические гены или ЗФБ. И это прекрасный инструмент для изучения клеточной биологии.
Например, можно изменить клетку и посмотреть, продолжает ли вирус оказывать на нее свое влияние, или можно, наоборот, изменить вирус и проверить, может ли он теперь инфицировать клетку. Это будет называться генетическим подходом. Можно выяснить роль различных частей вируса в попадании в клеточное ядро, в попадании в клетку, в пересечении цитоплазмы.
РЕТРОВИРУСЫ (Retroviridae) - семейство вирусов, объединяющим признаком для к-рых служит наличие в структуре вирионов ревертазы (обратной транскриптазы) — фермента, синтезирующего ДНК на матрице РНК вируса.
Впервые Р. были описаны в 1908 г. Эллерманном и Бангом (V. Ellermann, О. Bang), изучавшими возбудителей эритро- и миелобластозов птиц. Позже Ф. Раус (1911) описал вирус саркомы кур, получивший название вирус саркомы Рауса. По классификации 1970 г. эти и другие сходные вирусы были объединены в род лейковирусов (Leukovirus; греч. leukos белый, т. е. вирусы, обусловливающие злокачественное белокровие, лейкозы). В 1975 г. эти вирусы были включены в классификацию вирусов как онкорнавирусы [греч. oncos опухоль + RNA (англ. ribonucleic acid) — опухолевые РНК-содержащие вирусы]. Однако эти названия долго не просуществовали, поскольку, с одной стороны, в группу этих вирусов входили вирусы, не только обусловливающие лейкозы, но и приводящие к развитию сарком и опухолей молочной железы, а с другой — в эту группу были включены вирусы, не обладащие онкогенными свойствами, но содержащие ревертазу. Наличие ревертазы, обеспечивающей характерный для таких вирусов обратный (лат. retro назад) поток информации (от РНК к ДНК), и послужило основанием для образования названия этого семейства — Retrоviridae, включающего подсемейства онковирусов, спумавирусов и лентивирусов (табл.).
Наиболее изученными являются вирусы подсемейства онковирусов (Oncovirinae). Им присуща круглая форма, диаметр не превышает 100 нм, а плавучая плотность составляет 1,15—1,19 г/см 3 . Онковирусы содержат РНК, к-рая представлена двумя агрегированными идентичными 35 S-молекулами, состоящими примерно из 10 000 нуклеотидов, мол. вес (масса) каждой молекулы составляет ок. 3*10 6 дальтон, они соединены между собой водородными связями в области 5'-концов. Кроме этой высокомолекулярной РНК, обычно называемой 70 S-РНК, в составе вирионов выявляются также низкомолекулярные РНК (4—5 S), представляющие собой клеточные sPHK или гРНК. Все РНК структурно входят в состав нуклеоида (плавучая плотность 1,26—1,31 г/см 3 ), покрытого оболочкой. Это образование, получившее название сердцевины вириона (плавучая плотность 1,21 — 1,23 г/см 3 ), окружено внешней оболочкой, имеющей отростки и состоящей из внешней и внутренней мембран. Морфологические структуры у онковирусов имеют определенные родоспецифические различия (см. рис. к ст. Онкогенные вирусы). Так, у онковирусов С сердцевина крупная и расположена центрально, у онковирусов В и D сердцевина расположена эксцентрично; нуклеоид у онковирусов В круглый, а у онковирусов D — цилиндрический. Отростки у онковирусов В и С длинные, а у онковирусов D и подрода онковирусов С млекопитающих — короткие.
Помимо онковирусов А и С обычных размеров, описаны также их минимальные формы, размеры к-рых ок. 30—40 нм. Минимальные формы содержат все белки, присущие вирионам нормальных размеров, но значительно меньшие по размерам молекулы рибонуклеиновой кислоты.
Хим. состав онковирусов следующий: РНК — ок. 1—2%, белки (5—8 различных полипептидов) — 60—70%, липиды — 30—40% и углеводы — ок. 1—2%. Главный компонент оболочки — гликопротеид (500—1000 молекул в одном вирионе) с мол. массой 50—80 килодальтон; второй гликопротеид имеет мол. массу 22—45 килодальтон. Присутствуют также негликозилированные белки с мол. массой 15 и 12 килодальтон. В составе сердцевины выделяют главный внутренний белок (мол. масса 24—36 килодальтон) и дополнительные белки, среди к-рых ревертаза (10—20 молекул в вирио-не) и другие ферменты (ДНК-лигаза, ДНК-полимераза, экзо- и эндонуклеазы, РНК-метилаза и др.). Вирусы, относящиеся к одному виду, имеют идентичные (или близкие) главные внутренние белки, названные группоспецифическим антигеном (gs-антиген); подвиды, входящие в состав одного вида, отличаются по антигенным свойствам белков оболочки или отдельных дополнительных внутренних белков. Внутри подвида также могут существовать определенные варианты.
РНК онковирусов — носитель генетических свойств вириона. В ней различают гены, кодирующие синтез наружных белков (ген env), ревертазы (ген pol), внутренних белков (ген gag) и гены, ответственные за трансформацию инфицированных клеток (ген src). Утрата гена src не влияет на способность вирусов репродуцироваться в клетках, тогда, как утрата любого из трех других генов делает вирус дефектным, нуждающимся в вирусе-помощнике.
В лабораторных условиях онковирусы культивируют на животных, для к-рых они обладают онкогенной потенцией, и в клетках как первичных, так и перевиваемых клеточных культур. Цикл репродукции онковирусов в клетках состоит из двух фаз. Первая фаза начинается с адсорбции и проникновения вируса в клетку — процессов, не отличающихся от аналогичных процессов у любых вирусов (см.). Она завершается характерной для онкогенных вирусов (см.) интеграцией с клеточным геномом ДНК-провируса, т. е. ДНК, к-рая синтезировалась ревертазой; на матрице онковирусной РНК, В результате в геном одной зараженной клетки может встроиться от одной до пяти ДНК-провируса, Вторая фаза заключается в экспрессии интегрированной ДНК-провируса, к-рая, однако, не начинается, пока зараженные клетки не пройдут стадию митоза. В результате экспрессии ДНК-провируса образуются РНК онковирусов, затем белки вирусов и, наконец, онковирусы. Завершающим этапом в образовании онковирусов является выход их иа клетки, в процессе к-рого синтезировавшаяся сердцевина вируса связывается с внутренней поверхностью измененного участка плазматической мембраны клетки и по мере выхода из последней окружается этой мембраной.
Онковирусы не вызывают гибели клеток: инфицирование ими носит хронический характер. Репродукция онковирусов сопровождается антигенной конверсией клеток, поскольку на плазматической мембране клеток появляются неклеточные полипептиды — продукты генов env и gag. В случае наличия в геноме онковируса гена src в клетках синтезируется так наз. раковый белок, к-рый обусловливает трансформацию клетки в опухолевую (раковую).
Клетки могут получать геном онковирусов наследственным путем (вертикальный путь передачи). В этом случае все потомство особи, содержащей в своем геноме ДНК-прови-руса, также будет содержать в своей ДНК информацию для синтеза онковирусов. При этом не обязательно, чтобы в случае наследования клетками онковирусных геномов, происходила неизбежная реализация заключенной в них информации. Чтобы такая реализация имела место, необходимо воздействие на эти клетки определенных хим. соединений, известных под названием канцерогенов. Возможна, однако, и спонтанная индукция синтеза онковирусов.
Для выявления онковирусов в тканях (клетках) существует ряд взаимоподтверждающих друг друга методов. Широко применяются методы электронно-микроскопических исследований для обнаружения в клетках онковирусов, обладающих специфической структурой. Используются также методы физикохимические и биохимические (обнаружение вирусных частиц с характерной плавучей плотностью, содержащих 70 S— РНК и ревертазу), иммунологические (выявление в клетках специфических для онковирусов антигенов) и биологические (установление в опытах на животных или с клеточными культурами специфического биологического эффекта).
Онковирусы широко распространены у животных, причем для многих из них доказана роль этиологического фактора в возникновении опухолей (напр., вирус рака молочных желез мышей, вирус саркомы птиц и т. д.). Многими исследователями разделяется гипотеза Хюбнера и Тодаро (R. J. Huebner, G. J . Todaro), сформулированная в 1969 г., о том, что у человека (как и у животных) злокачественные опухоли могут возникать в результате активации унаследованных геномов ретровирусов. Однако у человека такие онковирусы не выявлены. Обнаружение в перевиваемых опухолевых клетках человека онковирусов, в частности подобных тем, что вызывали рак молочной железы у обезьян, большинство вирусологов считают лишь лабораторными вирусами-кон-таминантами. Одним из широко распространенных аргументов против этиологической роли онковирусов в патологии человека принято считать тот общеизвестный факт, что злокачественные опухоли человека не заразны.

Спумавирусы (Spumavirinae; англ. spume пена), или пенящие вирусы, синцитиальные, симпластообразующие вирусы,— подсемейство, объединяющее группу вирусов, к-рые при инфицировании эпителиоидных и фибробластных клеток обусловливают слияние этих клеток с образованием синцитиев, содержащих до 100 и более ядер, и появление в цитоплазме многочисленных вакуолей, что напоминает пену. Под электронным микроскопом спумавирусы (рис. 1) сходны с вирионами онковирусов А. Спумавирусы выделены от обезьян, кошек, хомяков, крупного рогатого скота и человека; вызывают персистентные бессимптомные инфекции у естественных хозяев и экспериментальных животных. Распространяются спумавирусы как респираторным путем (горизонтальный путь передачи), так и наследственным путем. Способность к опухолеобра-зованию или трансформации клеток, равно как и патогенность у этих вирусов, не установлены. Для инфекционного процесса, обусловленного спумавпрусами, свойственно медленное развитие: от момента инфицирования до выявления характерных специфических изменений в цитоплазме клеток проходит несколько недель. Внеклеточный вирус не обнаруживается; его распространение происходит непосредственно из клетки в клетку.

Лентивирусы (Lentivirinae; лат. lentus медленный) — подсемейство Р., объединяющее группу вирусов, характерной чертой к-рых является медленное развитие обусловленного ими инфекционного процесса (см. Медленные вирусные инфекции). Лентивирусы в естественных условиях выделяются только от овец. К ним относятся вирусы висна (рис. 2), мэди и прогрессирующей пневмонии овец. Морфологически они напоминают онковирусы С, размножаются в культурах клеток овец, вызывая симпластообразование. Имеются указания на способность вируса висна вызывать трансформацию клеток, однако опухоли эти вирусы не индуцируют. В антигенном отношении лентивирусы близки, что дает основание нек-рым исследователям рассматривать их как варианты одного и того же вируса.
Вирус мэди вызывает после длительного (2—3 года) инкубационного периода медленно прогрессирующую хроническую интерстициальную пневмонию, заканчивающуюся гибелью животных спустя год после появления признаков заболевания. При вскрытии павших овец у них обнаруживается лимфоцитарная диффузная периваскуляр-ная и перибронхиальная инфильтрация, диффузная пролиферация мезенхимы, увеличение перибронхи-альных, трахеобронхиальных и ме-диастинальных лимфатических узлов, отмечаются изменения ив ц. н. с. В эксперименте вирусом мэди удается инфицировать кроликов, морских свинок и мышей; помимо клеток овец, вирус мэди можно культивировать в клетках почек эмбрионов коров и надпочечников хомячков.
Вирус висна вызывает демиели-низирующее заболевание определенных пород овец, разводимых в Исландии. После инкубационного периода продолжительностью до 4 лет отмечаются симптомы поражения ц. н. с.: скованность, хромота, боковое отклонение головы, затем наступают парезы и параличи. Болезнь длится около месяца, все заболевшие овцы погибают. Патологоанатомические изменения характеризуются признаками диффузного энцефалита с демиелинизацией. При внутрилегочном инфицировании овец вирусом висна отмечаются те же изменения, что и при болезни мэди.
Прогрессирующая пневмония овец впервые была описана в Исландии, но затем наблюдалась во Франции, Голландии, Южной Африке. Инкубационный период может продолжаться до 3 лет. Симптомы заболевания сходны с наблюдавшимися при болезни мэди, однако патологоанатомическая картина несколько отлична от таковой при мэди. Через 3—12 мес. после появления первых симптомов заболевания наступает гибель животных в результате нарушения дыхания.
Таблица. КЛАССИФИКАЦИЯ ВИРУСОВ СЕМЕЙСТВА РЕТРОВИРУСОВ (RETROVIRIDAE) ЖИВОТНЫХ
Ретровирусы - оболочечные, сферические вирусы, которые выходят почкованием через клеточную мембрану хозяина. Они имеют приблизительно 100 нм в диаметре. Геном состоит из двух идентичных линейных односпиральных молекул РНК. Икосаэдральный нуклеокапсид содержит спиральный рибонуклеопротеид и окружен оболочкой состоящей из гликопротеидов и липидов.
Характерная особенность ретровирусов - присутствие в вирионе необычного фермента - РНК зависимой ДНК полимеразы или обратной транскриптазы(отсюда имя retro, означающее обратно). В отличие от классической транскрипции генетической информации от ДНК на РНК, фермент обратная транскриптаза готовит ДНК-копию РНК-генома ретровируса - первоначально РНК-ДНК гибрид, а затем его двухспиральную ДНК-форму. Двухспиральная ДНК-форма ретровирусного генома, называемая провирусом, интегрирует в ДНК инфицированной клетки-хозяина. Именно от провируса транслируются все ретровирусные белки. Заражение онкогенным ретровирусом не ведет к цитолизу или гибели инфицированных клеток, но провирус остается интегрированным в ДНК клетки-хозяина до конца жизни клетки и воспроизводится вместе с клеточным геномом при размножении клеток.
В то время как все онкогенные РНК-содержащие вирусы принадлежат семейству Retroviridae, не все ретровирусы онкогенны. Семейство Retroviridae классифицируется на три подсемейства.
1. Oncovirinaeвключает все онкогенные РНК содержащие вирусы (прежде называемое онкорнавирус).
Ретровирусы широко распространены; их находят почти у всех позвоночных, включая животных, птиц и рептилий. Основываясь на круге хозяев и типах вызываемых болезней, онкогенные Ретровирусы можно разделить на следующие группы:
1. Вирусы лейкозно-саркоматозного комплекса птиц. Группа антигенно родственных вирусов, которые вызывают Avian лейкозы (вирусы лимфоматоза, миелобластоза и эритробластоза) или саркому у домашних птиц (вирус саркомы Рауса, ВСР).
2. Вирусы мышиных лейкозов. Эта группа состоит из нескольких штаммов вирусов мышиной лейкемии и вирусов саркомы, названных по имени исследователи впервые описавших их (например Гросс, Френд, Молони, Раушер).
4. Вирусы лейкозов и сарком других животных.Большое количество вирусов было выделено из лейкозов и сарком различных видов животных - кошек, хомяков, крыс, морских свинок и обезьян.
Видовая специфичность. Ретровирусы обычно поражают только один вид хозяина, специфика обусловлена главным образом присутствием вирусных рецепторов на поверхности клетки-хозяина. В зависимости от их способности расти в клетках другого вида, ретровирусы делятся на 1) экотропные (размножаются только в клетках естественного хозяина); 2) амфитропные (размножаются в клетках естественного и чужих видов); и 3) ксенотропные (размножаются только в клетках чужих видов, но не в клетках естественных хозяев).
Резистентность. Ретровирусы неустойчивы, инактивируются при 56 о С в течение 30 минут, слабыми кислотами, эфиром и формалином. Они устойчивы при – 30 о С
Морфология.Ретровирусы существуют в виде четырех морфологических типов. Частицы типа А существуют только внутри клеток. Они имеют 60-90 нм в диаметре и содержат кольцевидный нуклеоид, окруженный мембраной. Они могут являться формой предшественника других типов. Типы B, C и D являются внеклеточными. Диаметр В частицы – 100-130 nm, с эксцентрическим нуклеоидом и несут поверхностные шипики. Частицы С типа имеют центральный нуклеоид и гладкую поверхностную мембрану. Частицы D типа еще не охарактеризованы. Они имеют эксцентрический нуклеоид и несут короткие поверхностные шипики.
Большинство ретровирусов – частицы С типа. Вирус рака молочных железы мыши - частица типа B, а вирус рака молочной железы обезьян Мэзон-Пфайзера - частица типа D.
Антигены.Имеется два типа антигенов – типоспецифические гликопротеидные антигены, расположенные на оболочке, и группо-специфические нуклеопротеидные антигены, расположенные в ядре вириона. Перекрестные реакции между поверхностными антигенами ретровирусов от различных видов хозяев не наблюдаются.
Геномная структура.Ретровирусы имеют относительно простую геномную структуру.
Провирус стандартного ретровируса (такого как недефектный вирус лейкоза птиц или мышей) состоит из трех генов, требуемых для вирусной репликации - gag, pol, и env. Ген gag кодирует белки нуклеокапсида, которые являются группоспецифическими антигенами, ген polкодирует РНК-зависимую ДНК-полимеразу, ген envкодирует гликопротеиды оболочки. С обоих концов провируса имеется длинный концевой повтор (LTR), непосредственно связывающийся с ДНК клетки-хозяина. LTR-участки обеспечивают контроль регуляции функции генов провируса.
Некоторые ретровирусы (трансрегулирующие вирусы) типа HTLV или HIV несут четвертый ген tat после envгена. Это – трансактивирующий ген, который регулирует функцию вирусных генов.
Ретровирус – это семейство вирусов, в которых генетический материал состоит из РНК. Микроорганизмы содержат обратную транскриптазу.
Ретровирусы – это микроскопические организмы, способные вызывать некоторые виды онкологических заболеваний, различные вирусные инфекции. Причем патологии могут возникать не только у людей, но и у животных. У людей ретровирусы вызывают ВИЧ-инфекцию (СПИД).
Особенности вируса
Ретровирусы – это уникальные организмы. Они способны размножаться, транскрибируясь в ДНК. Они попадают в кровь, начинается процесс транскрипции. После ее завершения вирусный геном получает полный доступ к ДНК клетки хозяина и начинает воспроизводить все происходящие с ней процессы. В дочерних клетках вирусная ДНК создает РНК копии. Этот процесс может продолжаться длительное время, но, в конце концов, копии покидают дочерние клетки и покрываются белковой оболочкой. В результате этого ретровирусы вызывают изменение нормального процесса репликации, происходящего в клетках, при котором задействуется РНК. Этот процесс обращается вспять. Сами же инфицированные клетки длительное время сохраняются в организме. В некоторых случаях изменяемые клетки разрушаются, как это происходит при ВИЧ-инфекции, а иногда превращаются в раковые.
К ретровирусам относится семейство вирусов Retroviridae. Они склонны к мутациям, из-за чего быстро приобретают устойчивость к противовирусным препаратам. Из-за этой особенности бороться с ретровирусной инфекцией сложно.
Некоторые люди считают, что ретровирус – это простой вирус, напоминающий грипп, но это не так. Данная разновидность опасна и с ней практически невозможно бороться. Чтобы оказать противодействие, необходимо разрабатывать особые схемы терапии с использованием противовирусных препаратов. Чтобы не заразиться ретровирусной инфекцией, проще проводить профилактические мероприятия в виде плановых прививок.
Несмотря на то, что ретровирусы способны вызывать опасные для жизни заболевания, их легко побороть обычным мылом и водой: для дезактивации достаточно мыть руки с мылом. Для предотвращения распространения применяют барьерные меры профилактики, в числе которых резиновые перчатки, маски для лица, некоторые марки презервативов.
Классификация ретровирусов
Первые примеры ретровируса и его воздействия на живой организм были описаны более ста лет назад. С тех пор интерес к микроорганизму сильно вырос. Сейчас ретровирусы подразделяются на следующие виды:
- Семейство онкогенных вирусов. Эта разновидность способствует развитию сарком и лейкемии в организме человека и животных. Одним из самых важных представителей этого типа недуга является T-лимфотропный вирус человека.
- Семейство лентивирусов. Ярким представителем группы является ВИЧ.
- Семейство спумавирусов. Этот вид не связан ни с какими патологиями, но способен вызывать изменения на клеточном уровне.
По мере изучения морфологии вируса были выявлены самые разные типы организмов, которые разделили на несколько групп:
- Безоболочечные организмы.
- Оболочечные виды с ацентрическим расположением нуклеокапсидом.
- Оболочечные виды, у которых нуклеокапсид располагается центрально.
- Вирусы крупного размера с минимальным количеством шипов.
РНК вируса имеет несколько рамок считывания информации, соответственно, кодировать она будет только определенные группы структурных белков: группы Gag, CA, MA и NC.

Патологии, вызываемые РНК-вирусами
Существует ряд патологий, которые вызываются РНК-содержащими вирусами. К ним относятся:
- Грипп.
- Краснуха.
- Корь.
- Вирусный энтерит.
- Паротит.
- Энтеровирусные инфекции.
- ВИЧ.
- Т-лимфотропная инфекция человека типа 1.
- Т-лимфотропная инфекция человека типа 2.
РНК-вирусы могут спровоцировать развитие сарком и лейкемий.
Острый ретровирусный синдром при ВИЧ
Среди всех существующих патологий, вызванных РНК-содержащими микроорганизмами, самым распространенным является острый ретровирусный синдром. Это первичное инфицирование вирусом иммунодефицита человека, продолжающееся до полугода после заражения.
После заражения ВИЧ обычно проходит от нескольких недель до нескольких месяцев. В это время нет никаких клинических проявлений инфекции. Этот бессимптомный период называют инкубационным. В некоторых случаях он может длиться до года.
Симптомы ретровируса проявляются постепенно, начиная с поражения верхних дыхательных путей, как при гриппе, хотя намного чаще у больных начало патологии протекает как мононуклеоз:
- появляется стоматит, фарингит с поражением лимфоузлов;
- повышается температура тела;
- снижается аппетит, пациент начинает терять вес;
- тошнота, нарушение стула;
- размеры селезенки и печени увеличиваются;
- на коже появляется сыпь;
- развивается асептический менингит, нарушается психическое состояние пациента, появляются невриты.
Диагностика синдрома
Острая фаза патологии длится около десяти дней. Чтобы установить, что у пациента имеется вирусная патология, необходимо сдать кровь на анализ: в плазме выявляют РНК ВИЧ. Затем проводится подтверждение острой фазы ретровирусного синдрома. Для этого сдает повторный анализ. Если через три недели в крови обнаружат антитела к ВИЧ, а в общем анализе лейкопению и лимфопению, то можно предположить острую фазу.
Если в эту фазу не будет обнаружено заболевание и не назначено лечение, симптомы ретровируса могут затихнуть на несколько лет. Единственным клиническим проявлением может стать увеличение лимфоузлов.
Если диагностика проведена вовремя, а лечение ретровируса назначено верно, то пациенты могут прожить с патологией более двадцати лет.
Лечение
Существует множество самых различных мнений о начальном лечении, но все они сводятся к тому, что терапию следует начинать сразу же после установки диагноза, не дожидаясь клинических проявлений и осложнений.
Зная, от чего погибает ретровирус, врач может правильно подобрать схему лечения и назначить противовирусные препараты. Обычно подбирается два антиретровирусных средства, прием которых ведется под лабораторным контролем сыворотки крови.
Чаще всего назначают:
- препараты, относящиеся к группе нуклеозидов обратной транскриптазы;
- средства из группы протеазы;
- препараты, относящиеся к ненуклеозидным ингибиторам транскриптазы.
Огромную роль в лечение ретровирусной инфекции имеет терапия вторичных патологий. С этой целью врач назначает полное обследование, в ходе которого определяют, какими недугами страдает больной. После выявления хронических заболеваний подбирается терапия, направленная на избавление от болезней или на достижение стойкой ремиссии.
В качестве дополнительного лечения обязательно проводится витаминотерапия, физиолечение, иммунотерапия, коррекция питания.
После лечения пациенту придется всю жизнь наблюдаться у врача, вести здоровый образ жизни, соблюдать строгие рекомендации. В противном случае ретровирус может вновь активироваться.
Т-лимфотропные вирусы человека
Т-лимфотропные патологии делятся на два типа: тип 1 и тип 2. Каждый из них представлен определенными недугами, вызываемыми РНК-вирусами.
К первому типу Т-лимфотропной инфекции относят Т-клеточный лейкоз, лимфому и спастический парапарез тропического типа. В эпидемиологических районах, где наблюдается высокий уровень заражения Т-лимфотропным вирусом, диагностируются дерматиты, пневмонии, артриты.
Т-лимфотропная инфекция второго типа вызывает Т-клеточную лимфому и некоторые виды лейкозов. В редких случаях микроорганизм способен привести к развитию волосатоклеточного лейкоза.
В заключение
Любую инфекцию проще предупредить, чем лечить, и особенно заражение РНК-вирусами. Чтобы быть здоровым, следует соблюдать правила личной гигиены, мыть руки с мылом. Защититься от патологии поможет хороший иммунитет и здоровый образ жизни.
Для профилактики ретровирусных инфекций следует взять за привычку мыть руки каждый раз, зайдя в дом с улицы, перед каждым приемом пищи. В обязательном порядке применяют барьерные средства - презервативы, резиновые перчатки, маски. Эти простые правила помогут снизить до минимума риск заражения ретровирусной инфекцией.
Читайте также:


