Рнк зависимая днк полимераза вируса
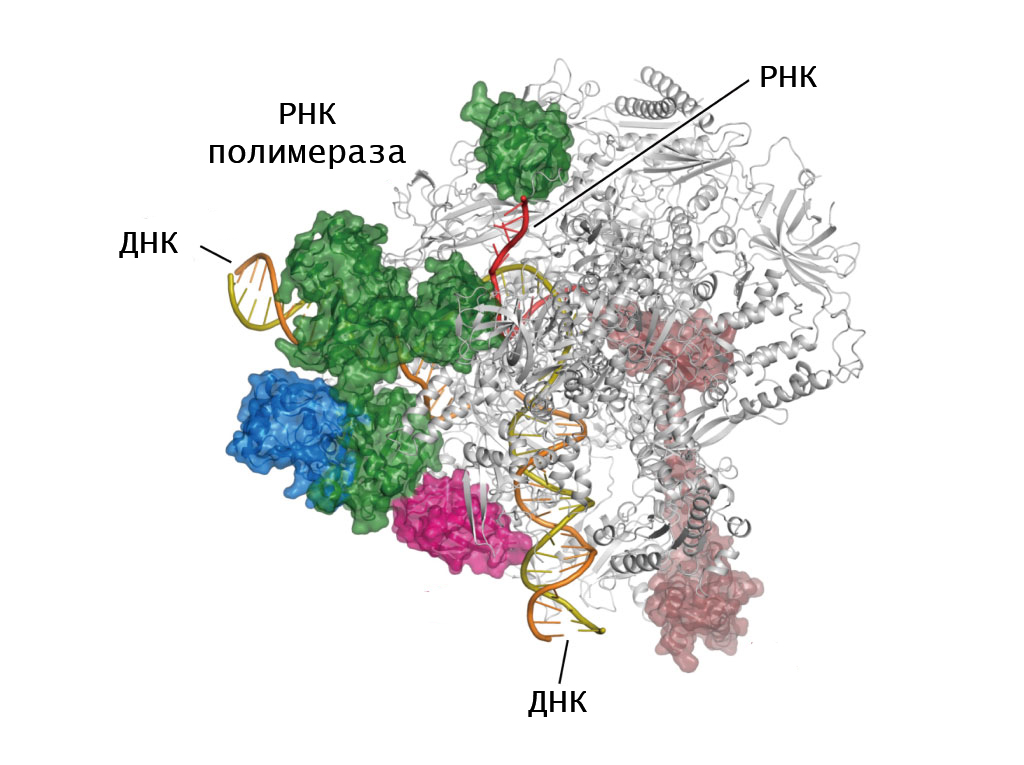
В любой клетке путь реализации генетической информации начинается с транскрипции, то есть с синтеза молекулы РНК на основе ДНК матрицы. РНК -полимераза является основным действующим ферментом этого процесса. Именно она строит цепь рибонуклеотидов, которая необходима для белкового синтеза.
Для всех представителей клеточной формы жизни характерен только один тип РНК-полимеразы — ДНК-зависимая. Однако существует фермент, способный синтезировать рибонуклеиновую кислоту на основе РНК-матрицы. Такая разновидность фермента (РНК-зависимая РНК-полимераза) встречается только у вирусов.
Основные сведения о ферменте
Любая РНК-полимераза представляет собой белок, способный связываться с молекулой нуклеиновой кислоты и, двигаясь по ней, катализировать образование фосфодиэфирной связи между рибонуклеотидами. Этот процесс требует затраты энергии.
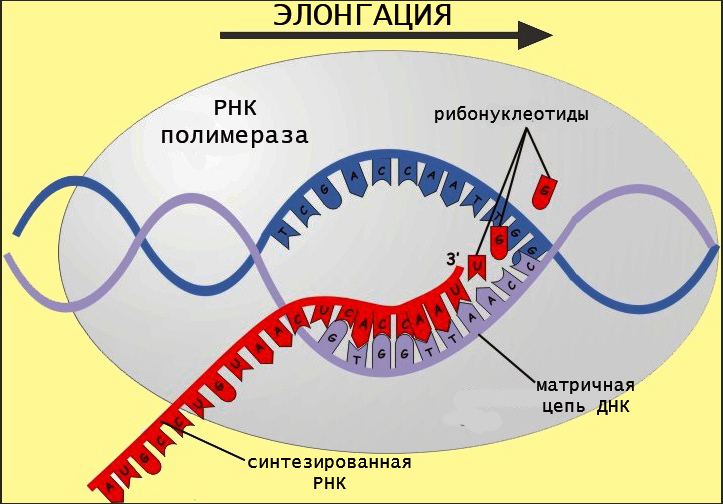
Материалом для синтеза РНК служат рибонуклеозидтрифосфаты (аденин, гуанин, цитозин и урацил), которые подбираются комплементарно матричной последовательности. Чтобы начать синтезировать РНК, полимераза должна связаться с особой последовательностью в геноме, которая называется промотором. Этот участок является посадочной площадкой для фермента.
Любой транскриптон обязательно содержит промотор, предваряющий кодирующую последовательность. Именно на этапе присоединения РНК-полимеразы к промотору происходит регуляция экспрессии определенных генов. От того, насколько успешно фермент с ним про взаимодействует, зависит, будет ли идти транскрипция.
Роль РНК-полимеразы в транскрипции
Главное предназначение этого фермента заключается в синтезе полинуклеотидной последовательности на основании матричной цепи. Для выполнения этой задачи РНК-полимераза осуществляет целый ряд функций, включая:
- распознавание промотора;
- подбор нуклеотидов в цепь по комплементарному принципу;
- замыкание фосфодиэфирных связей между нуклеотидами;
- расплетание участка ДНК и разрезание двойной спирали;
- устранение ошибок в синтезированной цепи.
Последние две функции характерны только для сложно устроенных полимераз, работающих на основе ДНК.
Разновидности РНК-полимераз
РНК-синтезирующие ферменты различаются не только по типу матрицы, на которых они работают (ДНК либо РНК), но и по сложности строения. На основании этого критерия выделяют 2 группы РНК-полимераз:
- Состоящие из одной субъединицы — характерны для некоторых фагов, а также для митохондрий и хлоропластов эукариот. В последнем случае односубъединичными являются только те полимеразы, которые кодируются малыми ядерными ДНК, а не самими органеллами.
- Включающие в состав несколько субъединиц.
Простые полимеразы не требуют участия регуляторных элементов и работают на небольших геномах. Функционал сложных полимераз гораздо шире. Каждая субъединица в составе фермента выполняет свою задачу.
Все РНК-полимеразы обладают общим принципом действия, но различаются по строению и условиям функционирования, которые у разных таксонов живых организмов не одинаковы. Исходя из этого выделяют РНК-синтезирующие ферменты:
- прокариот (бактерий и архей);
- эукариот;
- вирусов.
Отдельно классифицируют РНК-полимеразы эукариот. Эти организмы имеют несколько разновидностей фермента, предназначенных для синтеза разных типов РНК.
РНК-полимеразы прокариот
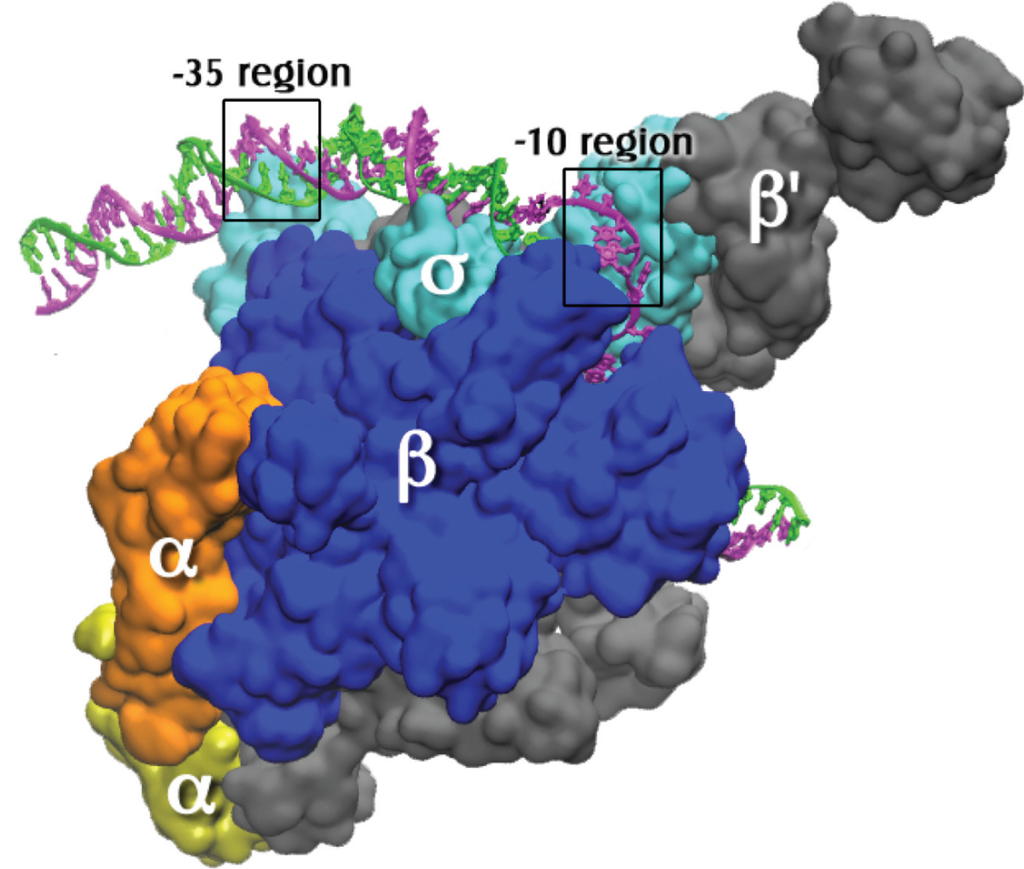
У бактерий для все виды РНК синтезируются одним видом полимеразы. Последняя представляет собой многосубъединичный комплекс, в котором выделяют 2 составных части:
- кор-фермент или основной фермент синтезирует цепь РНК, состоит из 5 протомеров (β, β ` , ω и 2 субъединицы α);
- вспомогательная субъединица σ — узнает промотор и помогает полимеразе связаться с ним, после чего сразу отделяется.
Комплекс из кор-фегмента и σ-фактора называют холоферментом.
РНК-синтезирующие ферменты эукариотической клетки
Эукариотические РНК-полимеразы устроены значительно сложнее и в их состав входит большее количество субъединиц. Однако, для работы этих ферментов требуется огромное количество белковых факторов. Последние помогают полимеразам распознавать и связываться с промотором (полимеразе бактерий достаточно субъединицы сигма), а также участвуют в процессах элонгации и терминации.
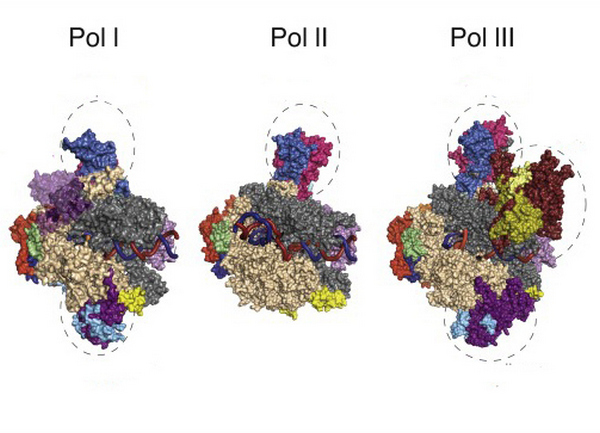
Различают три вида эукариотических РНК-полимераз: Pol l, Pol ll и Pol lll. Все они представляют собой сложные гетеромультимерные комплексы с молекулярной массой 0,5-0,7 Да. Скорость работы эукариотических полимераз составляет 20 нуклеотидов в секунду.
| виды синтезируемых РНК | количество субъединиц в составе фермента | |
| l тип | рибосомальные РНК (рРНК) | 14 |
| ll тип | 12 | |
| lll тип | транспортные РНК (рРНК), 5S-РНК, низкомолекулярные РНК (7SL, 7SK, U6, MRP млекопитающих и др.) | 17 |
Из всех типов фермента только РНК-полимераза ll синтезирует молекулы, служащие прототипом для построения всех белков, — матричные РНК.
Механизм действия фермента
РНК-полимераза является ключевым ферментом на всех стадиях транскрипции (инициации, элонгации и терминации). На первом этапе полимераза связывается с промотором.
Синтез цепи РНК происходит на стадии элонгации, во время которой полимераза скачкообразно движется по матричной цепи, избирательно катализируя присоединение новых рибонуклеотидов (в цепь включаются только те азотистые основания, которые комплементарно спариваются с ДНК/РНК, образуя водородные связи). Цепь удлиняется в направлении от 5 к 3 концу.
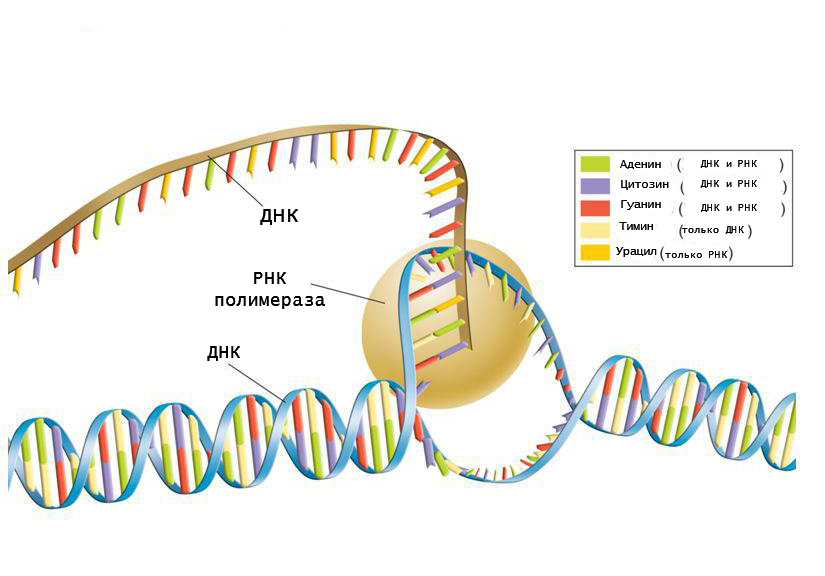
Фермент имеет канал, через который поступают рибонуклеотидфосфаты, активный центр и канал выхода РНК. Замыкание фосфодиэфирной связи осуществляется за счет гидролиза макроэргических соединений. Этот процесс осуществляется в активном центре фермента. Движение РНК-полимеразы имеет скачкообразный характер.
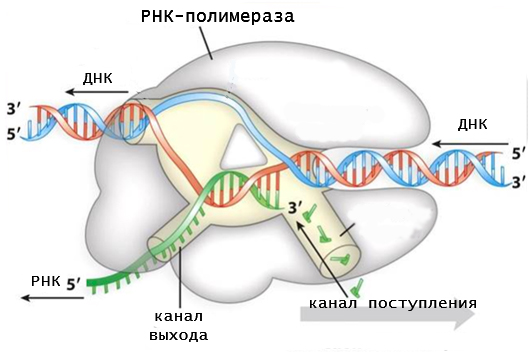
Механизм транскрипции на определенных этапах напоминает процесс удвоения генетического материала (репликации). Действия ДНК-полимеразы и РНК-полимеразы очень похожи, поскольку они катализируют одну и ту же химическую реакцию. Однако, в работе этих ферментов есть ряд существенных отличий. Среди них:
- для работы РНК-полимеразы не нужна затравка в виде праймера;
- материалом для синтеза РНК служат не дезоксирибонуклеотиды, а рибонуклеотиды;
- в процессе продвижения фермента по матричной цепи происходит разъединение гибрида между матрицей и синтезированным продуктом, тогда как во время репликации он сохраняется.
Синтез РНК происходит антипараллельно матричной последовательности. Работающие на ДНК полимеразы по ходу продвижения раскручивают перед собой двойную спираль и разделяют цепи. Позади фермента синтезированная РНК сразу вытесняется, а структура ДНК восстанавливается.
- 367
- 0,3
- 0
- 1
Электронная микрофотография вирионов crAss-подобных фагов
Тщательное изучение вирусных белков, даже самых многочисленных, подчас преподносит исследователям множество сюрпризов. Российские и американские ученые детально изучили РНК-полимеразу бактериофага φ14:2, входящего в семейство сrAss-подобных фагов — самой многочисленной группы вирусов в желудочно-кишечном тракте человека. Этот фермент упаковывается в вирионы вместе с вирусным геномом и участвует в транскрипции генов фага в начале инфекции. Исследователям удалось получить кристаллическую структуру РНК-полимеразы фага φ14:2, которая, как оказалось, очень похожа на эукариотические РНК-полимеразы, задействованные в РНК-интерференции. Авторы работы высказывают предположение, что эукариотические РНК-полимеразы, участвующие в РНК-интерференции, позаимствованы у фага, который, вероятно, инфицировал бактерию — предка митохондрий.
Чтобы совершить удивительное открытие в мире вирусов и микроорганизмов, вовсе не обязательно спускаться в океанские глубины, покорять горные вершины или забираться в другие труднодоступные места: зачастую необычные вещи спрятаны буквально у нас под носом. Так обстоят дела и с crAss-подобными бактериофагами , которые обитают в кишечнике каждого человека, но до сих пор оставались совершенно не изученными. Лишь в 2014 году, ученые, анализируя метагеном кишечного микробиома человека, обнаружили в нем последовательности ДНК, которые удалось собрать в геном длиной 100 тысяч пар оснований. Оказалось, что этот геном принадлежал ранее неизвестному бактериофагу, который получил название crAssphage (по названию метода, используемого для сборки генома — cross assembly) [1]. Выяснилось также, что crAssphage — это самый распространенный фаг в популяции человека. На его геном приходится до 90% всех ридов (прочтений), получаемых при секвенировании вирусной фракции микробиома кишечника человека [1]. Позже группа Евгения Кунина открыла, что в природе существует множество фагов, родственных crAss-фагу, но никто из них не был изучен в лабораторных условиях [2]. И это неудивительно, ведь большинство crAss-подобных фагов не культивировали в лаборатории, и мы знаем о них лишь из исследований метагеномов. Изучение crAss-подобных фагов представляет огромный интерес, поскольку они — самые многочисленные вирусы в кишечнике человека и, безусловно, оказывают влияние на наш микробиом . Кроме того, большинство генов crAss-подобных фагов мало на что похожи и кодируют новые, пока неизвестные белки.
Российские и американские ученые, среди которых специалисты Сколковского института науки и технологий, нашли crAss-подобный вирус — φ14:2, удобно культивируемый в лаборатории, и, используя его как модель, разобрались, каким образом crAss-подобные фаги транскрибируют свои гены [8]. Фаг φ14:2 поражает бактерию Cellulophaga baltica. Один из его генов кодирует большой белок gp66 (2180 аминокислотных остатков, а. о.), аминокислотная последовательность которого содержит маленький участок (всего 50 а. о.), похожий на фрагмент одной из субъединиц клеточных РНК-полимераз. Этот участок включает мотив, содержащий три абсолютно консервативных остатка аспартата, которые в многосубъединичных РНК-полимеразах координируют ионы магния и образуют каталитический центр фермента. Чтобы изучить функции gp66 и его ортологов в других crAss-подобных фагах, ученые экспрессировали ген белка gp66 в клетках кишечной палочки E. coli, очистили белок и показали, что он действительно может синтезировать РНК по матрице ДНК в присутствии ионов магния. И это несмотря на то, что gp66 похож на обычные РНК-полимеразы лишь своим крошечным фрагментом (менее 3% от всей величины белка). Вот уж поистине иголку в стоге сена нашли и предсказали биоинформатики!
Самый достоверный и точный способ узнать, как именно функционирует белок, — разрешить его пространственную структуру. Но для этого необходимо получить кристаллы белка, что часто становится весьма нетривиальной задачей, особенно для таких больших белков, как gp66. Однако исследователи смогли кристаллизовать gp66 и получить его структуру с разрешением в 3,5 ангстрем с помощью рентгеноструктурного анализа.
По структуре gp66 оказался наиболее близок к РНК-полимеразе QDE-1 грибка Neurospora crassa, которая участвует в синтезе малых интерферирующих РНК (рис. 1) [9]. Стоит, однако, отметить, что высокая степень сходства между gp66 и эукариотическими РНК-полимеразами, синтезирующими малые интерферирующие РНК, наблюдается лишь в областях белков, критически важных для выполнения основных функций. РНК-полимераза gp66 значительно больше, чем QDE-1, и имеет много дополнительных доменов с пока неизвестными функциями.
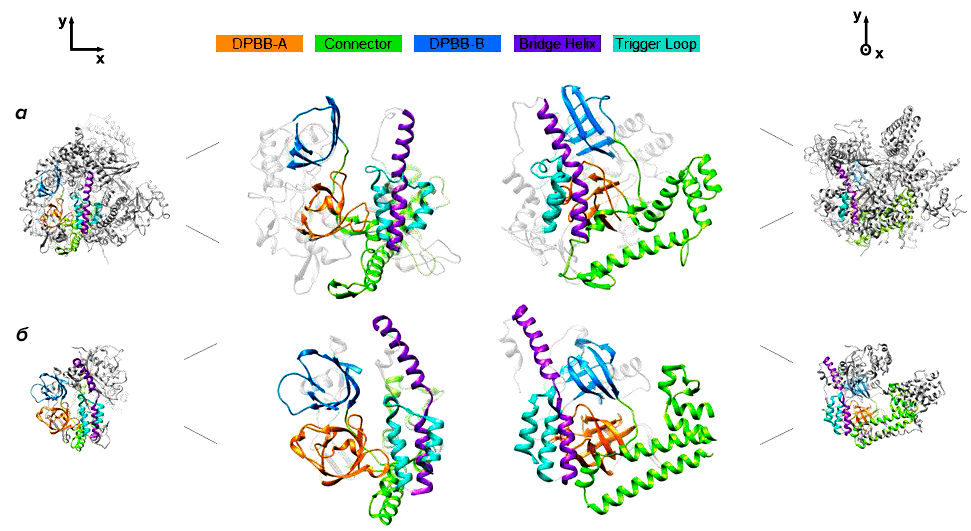
Рисунок 1. Структура gp66 фага φ14:2 (а) и РНК-полимеразы QDE-1 N. crassa [10] (б). Серым цветом окрашены различающиеся структурные элементы, одинаковыми цветами — аналогичные элементы структуры.
РНК-полимераза N. crassa, наиболее близкая к gp66, и ее ортологи широко распространены у современных эукариот и, вероятно, имелись у последнего их общего предка [11]. Эти белки первоначально были описаны как РНК-зависимые РНК-полимеразы, хотя в дальнейшем оказалось, что in vitro они транскрибируют однонитевую ДНК намного эффективнее, чем РНК [12]. Авторы исследования предполагают, что РНК-полимеразы этой группы появились у эукариот благодаря вирусу, инфицирующему бактериального предка митохондрий. К слову, похожий сценарий заимствования РНК-полимераз у вирусов уже был описан. Так, транскрипционный аппарат митохондрий, по всей вероятности, произошел от РНК-полимеразы T7-подобных фагов, не родственной клеточным многосубъединичным РНК-полимеразам и полимеразам crAss-подобных фагов.
Что еще интересного можно сказать про РНК-полимеразы crAss-подобных фагов? Судя по всему, это необычайно гибкие белки, способные к денатурации и структурным перестройкам. Так, при инфицировании бактериальной клетки gp66, состоящий из 2180 а. о., ухитряется протиснуться через канал в хвосте фага диаметром всего около 4 нм. Скорее всего, для этого РНК-полимераза gp66 полностью разворачивается. Попав в цитоплазму клетки-хозяина, gp66 должен приобрести свою нативную структуру. Интересно, что структура, которую получили исследователи, имеет конформацию каталитического центра, ранее не описанную для других РНК-полимераз, и в такой форме не может поддерживать катализ. Вероятно, это способ регулировать активность РНК-полимераз crAss-фагов на поздних стадиях инфекции, и переход в активную форму происходит при упаковке РНК-полимеразы в капсид или во время ее выхода в цитоплазму клетки.
Профессор Центра наук о жизни Мария Соколова, руководившая исследованием, отмечает:
«Это первая работа, где изучили, как происходит развитие инфекции crAss-подобным фагом. До сих пор были опубликованы работы, где изучали распространенность crAss-подобных фагов, их связь с какими-либо заболеваниями и т.п. В одной работе crAss-подобного фага выделили из фекалий человека, но не продвинулись дальше масс-спектрометрического анализа его вирионов. Мы же разобрались в том, как транскрибируются гены фагов этой группы, используя ф14:2 как модельный организм. Кроме того, полученная нами структура — это первая структура РНК-полимеразы, которая имеет общее происхождение с многосубъединичными РНК-полимеразами клеточных организмов, но настолько сильно от них отличается, что совершенно неясно, как она функционирует! Существует какой-то необычный механизм регуляции активности этой РНК-полимеразы, над определением которого мы сейчас работаем. Это очень интересно с точки зрения эволюции РНК-полимераз и процесса транскрипции в целом. Ну и наконец, РНК-полимераза вируса ф14:2 — это первый белок crAss-подобных фагов, для которого была экспериментально установлена функция. Бионформатические подходы, конечно же, очень важны и без них бы мы ничего не знали, но без эксперимента они дают не более чем предсказание.
| РНК-зависимая РНК-полимераза | |
|---|---|
 |
| Поиск | |
|---|---|
| PMC | статьи |
| PubMed | статьи |
| NCBI | белки |
| РНК зависимой РНК-полимеразы | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Условное обозначение | RdRP_1 | ||||||||
| Pfam | PF00680 | ||||||||
| Pfam клан | CL0027 | ||||||||
| InterPro | IPR001205 | ||||||||
| СКОП | 2jlg | ||||||||
| СУПЕРСЕМЕЙСТВА | 2jlg | ||||||||
| |||||||||
| РНК-полимераза направленной РНК, флавивирусной | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Условное обозначение | RNA_pol_flaviviral | ||||||||
| Pfam | PF00972 | ||||||||
| InterPro | IPR000208 | ||||||||
| |||||||||
РНК-зависимой РНК - полимеразы ( RDRP ), ( РДР ), или РНК - репликазы , является ферментом , который катализирует репликацию из РНК из РНК - матрицы. Это в отличие от типичного ДНК-зависимой РНК - полимеразы , который катализирует транскрипцию РНК из ДНК матрицы.
РНК-зависимой РНК - полимеразы (RdRp) является одним из важнейших белок , кодируемый в геномах всех РНК-содержащих вирусов, не имеющих стадии ДНК , т.е. только РНК -содержащих вирусов . Она катализирует синтез РНК - нити , комплементарной данной матрицы РНК. Процесс репликации РНК представляет собой механизм , в два этапа. Во- первых, на этапе инициации синтеза РНК начинается на или вблизи конца 3' - РНК - матрицы с помощью праймера -независимый ( De Novo ), или механизм праймера зависит , который использует вирусный геном белка-сшитый (ВПГ) праймера , De Novo инициация состоит в добавлении нуклеозидтрифосфата (NTP) на 3'-ОН от первого инициирующего NTP. В течение следующей так называемой фазы элонгации, это nucleotidyl реакция передачи повторяется с последующим НПТОМ для создания комплементарного РНКА продукта.
содержание
история
Вирусное RdRPs было обнаружено в начале 1960 - х лет из исследований по mengovirus и вирусу полиомиелита , когда было замечено , что эти вирусы не были чувствительны к актиномицин D , препарат , который ингибирует синтез РНКА клеточной ДНК-направленные. Отсутствие чувствительности предположил , что есть вирус-специфический фермент , который может копировать РНК из РНК - матрицы , а не из шаблона ДНК.
Многие RdRPs тесно связаны с мембранами и, следовательно, трудно учиться. Наиболее известными являются RdRPs polioviral 3Dpol, вирус везикулярного стоматита L, и вирус гепатита С NS5B белка.
Многие эукариоты также RdRPs , участвующих в РНК - интерференции ; они усиливают микроРНК и малые временные РНК и производят двухцепочечную РНК с использованием малых интерферирующих РНК в качестве праймеров. На самом деле эти же RdRPs, которые используются в защитных механизмов может быть захвачено РНК вирусов в их пользу.
RdRps высоко консервативны во всех вирусах и даже связан с теломеразой , хотя причина столь высокого сохранения в таких разнообразных организмах , представляет собой непрерывный вопрос 2009 года Сходство привело к предположению , что вирусный RdRps является предком теломеразы человека.
Состав
Все РНК-направленная РНК-полимераза, и многие ДНК-полимераза направлены, используют складку, чья организация была уподоблена формой правой руки с тремя поддоменов называемых пальцами, ладонью и большим пальцем. Только пальмовое подобласть, состоит из четырех многожильных антипараллельной бета-лист с двумя альфа-спиралей, хорошо консервативными среди всех этих ферментов. В RdRp, ладонь подобласть включает в себя три хорошо консервативные мотивы (А, В и С). Мотив А (Dx (4,5) -D) и мотив С (ДДГ) пространственно сопоставляются; остатки Asp этих мотивов подразумеваются в связывании Mg2 + и / или Mn2 +. Asn остаток мотива B участвует в выборе рибонуклеозидтрифосфаты более дНТФ и, таким образом, определяет, является ли синтезируется РНК, а не ДНК. Организация домена и 3D-структура каталитического центра широкого спектра RdPps, даже те, с общей гомологии последовательности низкой, сохраняются. Каталитический центр образован несколько мотивов, содержащего ряд консервативных аминокислотных остатков.
классификация
Есть 4 надсемейства вирусов, которые охватывают все РНК-содержащие вирусы без стадии ДНК:
- Вирусы, содержащие положительно-нити РНК или двухцепочечной РНК, за исключением ретровирусов и Birnaviridae: вирусные РНК-направленной РНК-полимеразы, в том числе всех положительных-нить РНК-вирусов, без каких-либо стадии ДНК, двухцепочечную РНК-вирусов, а также Cystoviridae, Reoviridae, Hypoviridae, Partitiviridae , Totiviridae семьи
- Mononegavirales (отрицательные пряди РНК-вирусы с несегментированными геном)
- Отрицательные пряди РНК-вирусы с сегментированными геномами, т.е. ортомиксовирусами (в том числе гриппа А, В и С, вирусами Thogotoviruses и вирус анемии инфекционного лососевой), аренавирусы, Bunyaviruses, Хантавирусы, Nairoviruses, Phleboviruses, Tenuiviruses и тосповирусы
- дсРНК вирус семья Birnaviridae
РНК-полимеразы, направленной РНК в первой из указанных выше надсемейств можно разделить на следующие три подгруппы:
- Вся положительная нитей РНК эукариот вирусы без стадии ДНК
- Все РНК-содержащие бактериофаги -Есть два семейства РНК-содержащих бактериофагов: Leviviridae (положительные оцРНК фаги) и Cystoviridae (дцРНК фаги)
- дсРНК вирус семья Reoviridae
Транскрипции РНК аналогична , но не такой же , как ДНК - репликации Флавивирусы производят полипротеин из генома оцРНК. Полипротеина расщепляется на ряд продуктов, одним из которых является NS5. Рекомбинантный тип вируса денге 1 NS5 белок экспрессируется в кишечной палочки проявляет РНК-зависимой РНК - полимеразной активностью. Эта РНК-полимераза направленной РНК обладает рядом коротких областей и мотивы , гомологичных к другим РНК-направленной РНК - полимераз.
В прошлой части эссе вы познакомились с химиотерапевтическими стратегиями, которые могут помочь бороться с вирусными заболеваниями, блокируя возбудителя на ранних этапах его попадания в клетку.
Однако урон вирусу современная химия может нанести и тогда, когда он собрался размножаться, то есть заниматься тем единственным делом, которое отличает его от неживой материи.
Хочу сразу сказать, что вирусы — существа бесполые, так что о сексе нам говорить не придётся. Ну только если в контексте продирания сквозь кучу новой информации. Этакое химико-биологическое чтиво с налётом BDSM.
Как вы поняли из предыдущей части, вирусы, несмотря на морфологическое сходство, очень неоднородны в своей физиологии, т. е. в том, как они взаимодействуют с клеткой организма хозяина.
Эта разнородность, т. е. множество используемых этими организмами жизненных стратегий, ещё лучше видна при переходе к рассмотрению следующей точки возможного лекарственного приложения противовирусных препаратов — их размножению.
Размножение вирусов сводится к тиражированию их нуклеиновой кислоты (НК). Часть вирусов, такие как ВИЧ и вирус гриппа, высвобождает НК прямо в цитоплазму клетки, а часть вирусов доставляет её непосредственно в ядро. Это первый пример разнообразия их внутриклеточного поведения, которого, правда, мы касаться не будем.

Гораздо важнее то, какая именно НК и каким образом копируется. Дальше будет немного скучно, но без этого понять, как можно бороться с тем или иным вирусом на стадии его размножения, невозможно.
Прежде всего, спасибо стоит сказать нобелевскому лауреату Дэвиду Балтимору, который в 1971 году предложил классификацию вирусов в зависимости от содержащейся в них НК и способа её репликации.

Чтобы понять таблицу, надо дать несколько пояснений.
Репликация заключается в том, что НК первичного вириона, который попал в клетку-хозяина, становится матрицей для получения НК дочерних вирионов, которые выходят из клетки. Поскольку молекула НК является полимером, то фермент, который её копирует, именуется полимеразой. ДНК-полимераза синтезирует ДНК, а РНК-полимераза синтезирует РНК. Важно, что является матрицей для копирования. Если матрица — РНК, то фермент является РНК-зависимым, если матрица — ДНК, то ДНК-зависимым. Итого имеется 4 варианта.

Вирус — паразит, ему желательно по максимуму задействовать в своей жизнедеятельности аппарат клетки. Поскольку клетка размножается и синтезирует белок, то в ней тоже есть ДНК-полимеразы и РНК-полимеразы. Но надо чётко помнить, что в клетке возможно только движение от ДНК к ДНК при размножении или от ДНК к РНК при транскрипции для синтеза белка. То есть в клетке могут быть только ДНК-зависимые ДНК-полимеразы или ДНК-зависимые РНК-полимеразы и никаких других.
Второй пример. Имеем однонитевую ДНК в вирионе. Значит фермент — ДНК-зависимая ДНК-полимераза. Поскольку переход ДНК->ДНК в клетке возможен, то репликацию вирусной ДНК может вести как фермент клетки хозяина, так и фермент вируса. Можете потренироваться сами на вирусах других классов по классификации Балтимора.
Вирусы типов VI и VII по классификации Балтимора реплицируют свою НК не напрямую, а через интермедиат, то есть промежуточную молекулу НК. Посмотрите таблицу. Если вы поняли то, что написано выше, разобраться с этими вирусами вам тоже не составит труда. Скажу только, что РНК-зависимую ДНК-полимеразу, которую используют эти вирусы при манипуляциях с НК-интермедиатом, принято называть обратной транскриптазой.
Я надеюсь, что теперь вы самостоятельно сможете предложить химиотерапевтическую стратегию для лечения заболевания, вызванного тем или иным вирусом!
Стратегия это заключается в блокировании фермента, участвующего в репликации вируса. Поскольку вирус III-V классов содержит РНК, то надо блокировать РНК-зависимую РНК-полимеразу. В организме человека такого фермента нет, поэтому побочных эффектов, связанных с непосредственным действием лекарства, быть не должно (что не исключает побочных эффектов другого рода).
Если вирус содержит ДНК, то надо выяснить, чей фермент участвует в её репликации. Если это фермент хозяйской клетки, то, скорее всего, химотерапевтическую стратегию, основанную на подавлении репликации вируса, применять не стоит, так как будет заблокировано деление клеток, что может обернуться проблемой. Если же ДНК-зависимая ДНК-полимераза у вируса своя, то можно пробовать поискать её ингибитор.
Ну и, наконец, для вирусов VI и VII надо блокировать обратную транскриптазу.
Теперь, наконец-то, переходим к химии и рассмотрим примеры лекарственных молекул для лечения вирусных заболеваний, которые ингибируют полимеразы НК.
Помнящие биологию могут предположить, что в качестве таких неправильных ключей применительно к полимеразам НК могут быть использованы аналоги азотистых оснований, слагающих нуклеиновые кислоты, т. е. аналоги аденина, тимина, цитозина, гуанина и урацила.

Ладно, не буду томить, перейду к примерам.
Самый известный пример — ацикловир, который используется для лечения проявлений герпеса, вызываемого одноименным вирусом, содержащим двунитевую молекулу ДНК и собственную ДНК-зависимую ДНК-полимеразу.
Ацикловир очень похож на дезоксинуклеозид дезоксигуанозин.

Действует ацикловир так.
Второй очень известный и важный пример — это азидотимидин, или зидовудин, первое лекарство против СПИДа.

Азитотимидин, как это следует из названия, является аналогом дезокситимидина. Он также фосфорилируется, но уже клеточными ферментами, и блокирует работу вирусной РНК-зависимой ДНК-полимеразы, т.е. обратной транскриптазы, что останавливает размножение вируса.
И зидовудин, и ацикловир являются так называемыми нуклеозидными ингибиторами, так как похожи по строению на нуклеозиды, из которые строятся НК. Обратите внимание, что в обоих структурах модификации подверглась углеводная часть молекулы, а часть от азотистого основания осталась неизменной.
Конечно, для получения нуклеозидного ингибитора модифицировать можно не только углеводную часть молекулы, но и фрагмент азотистого основания. Примером может служить такой ингибитор обратной транскриптазы как эмтрицитабин, применяемый для терапии ВИЧ и гепатита В, вирус которого относится к VII классу по Балтимору и также использует обратную транскриптазу.

Однако ингибиторы полимераз НК совсем не обязательно должны быть похожими на их обычные субстраты, то есть нуклеозиды. Существует обширный класс ненуклеозидных ингибиторов обратной транскриптазы, структуры которых с выше перечисленными соединениями не имеют ничего общего.


Как действуют эти ингибиторы?
Ненуклеозидные ингибиторы обратной транскриптазы как раз и являются такими веществами. Они связываются с ферментом и изменяют его форму таким образом, что он больше не может выполнять свою функцию, это останавливает размножение вируса.
Посмотрите коротенький ролик, визуализирующий изменение формы молекулы обратной транскриптазы под действием невирапина. Обратите внимание, что в ходе такого изменения нарушается связь фермента с растущей цепью РНК (показана серым цветом в верхней части):
Итак, я привёл примеры 2 классов ингибиторов обратной транскриптазы, используемых для лечения болезней, вызываемых вирусами VI и VII классов по Балтимору, а также пример ингибитора вирусной ДНК-зависимой ДНК-полимеразы, который блокирует размножение вируса I класса по Балтимору (вируса герпеса).
Что насчёт других РНК-содержащих вирусов?
Широко известным антивирусным препаратом, который применяется при сравнительно большом спектре заболеваний (гепатит С, геморрагические лихорадки и др.), является рибавирин.

Наличие в молекуле рибавирина фрагмента D-рибозы позволяет отнести его к аналогам рибонуклеозидов, из которых строится РНК, и предположить, что он может ингибировать РНК-зависимые РНК-полимеразы. Кроме того, считается, что рибавирин способствует и тому, чтобы РНК-полимераза делала в своей работе огромное количество ошибок. Это приводит к созданию РНК настолько нашпигованной большим количеством мутаций, что многие вирусные белки, структуру которых она кодирует, попросту оказываются нефункциональными, поэтому несущий её вирион не может сделать с клеткой ничего плохого.
Интересно, что рибавирин может угнетать активность и ДНК-содержащих вирусов. Однако причины такой активности до сих пор точно не установлены.
Вопросы для самоконтроля.
- К какому классу по Балтимору может относится вирус, если спустя некоторое время после попадания его ДНК в клетку, в ней начинает обнаруживаться РНК? Какие уточнения нужны для того, чтобы дать однозначный ответ?
- Известно, что в репликации вирусной НК изучаемого вами вируса принимает участие ферментный аппарат клетки хозяина. К каким классам по Балтимору он может относится? С какими трудностями может быть сопряжена разработка разработка ингибиторов репликации этого вируса?
- Почему при терапии ВИЧ не применяют нуклеозидные ингибиторы-аналоги урацила?
- Как выдумаете, почему практически все нуклеозидные ингибиторы обратной транскриптазы содержат в своей молекуле остаток сахара (модифицированной рибозы или дезоксирибозы)?
- Как вы думаете, почему при терапии ВИЧ возникла необходимость в ненуклеозидных ингибиторах обратной транскриптазы?
- Как вы думаете, к какому классу ингибиторов обратной транскриптазы (нуклеозидные или ненуклеозидные) относится препарат, структура действующего вещества которого изображена ниже?

7. Предложите механизмы действия рибавирина в отношении ДНК-содержащих вирусов.
Читайте также:


