Транскрипция вирусной днк это
Современная биология поражает уникальностью и масштабностью своих открытий. На сегодняшний день эта наука изучает большинство процессов, которые скрыты от нашего глаза. Этим примечательна молекулярная биология – одно из перспективных направлений, которое помогает разгадать сложнейшие тайны живой материи.
Что такое обратная транскрипция
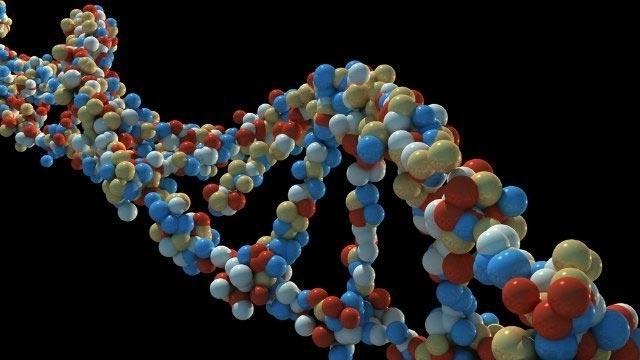
Обратная транскрипция (сокращенно ОТ) – это специфический процесс, характерный для большинства РНК-содержащих вирусов. Главной его особенностью является синтез двухцепочечной молекулы ДНК на базе матричной РНК.
ОТ не характерна для бактерий или эукариотических организмов. Главный фермент – ревертаза – играет ключевую роль в синтезе двухцепочечной ДНК.
История открытия
Идея о том, что молекула рибонуклеиновой кислоты может стать матрицей для синтеза ДНК, считалась абсурдной вплоть до 1970 года. Тогда Балтимор и Темин, работавшие отдельно друг от друга, почти одновременно открыли новый фермент. Они назвали его РНК-зависимая-ДНК-полимераза, или обратная транскриптаза.
Открытие данного энзима безоговорочно подтвердило существование организмов, способных к обратной транскрипции. В 1975 году оба ученых получили Нобелевскую премию. Через некоторое время Энгельгардт предложил альтернативное название обратной транскриптазы – ревертаза.

Почему ОТ противоречит центральной догме молекулярной биологии
Центральная догма – это принципиальная схема последовательного синтеза белка в любой живой клетке. Такая схема строится из трех компонентов: ДНК, РНК и белок.
Согласно центральной догме, РНК может синтезироваться исключительно на матрице ДНК, а уж затем РНК участвует в построении первичной структуры белка.
Эта догма была официально принята в научном обществе раньше, чем произошло открытие обратной транскрипции. Неудивительно, что идея об обратном синтезе ДНК из РНК долго отвергалась учеными. Лишь в 1970 году вместе с открытием ревертазы была поставлена точка в этом вопросе, что отразилось и в принципиальной схеме синтеза белка.
Ревертаза ретровирусов птиц
Процесс обратной транскрипции не обходится без участия РНК-зависимой-ДНК-полимеразы. Максимально изучена на сегодняшний день ревертаза ретровируса птиц.
Всего около 40 молекул этого белка можно обнаружить в одном вирионе этого семейства вирусов. Протеин состоит из двух субъединиц, которые находятся в равном количестве и выполняют три важнейшие функции ревертазы:
1) Синтез молекулы ДНК как на матрице одноцепочечной/двухцепочечной РНК, так и на основе дезоксирибонуклеиновых кислот.
2) Активация РНКазы Н, главная роль которой заключается в расщеплении молекулы РНК в комплексе РНК-ДНК.
3) Разрушение участков молекул ДНК для встраивания в геном эукариот.
Механизм ОТ
Этапы обратной транскрипции могут варьироваться в зависимости от семейства вирусов, т.е. от вида их нуклеиновых кислот.
Рассмотрим сначала те вирусы, которые используют ревертазу. Здесь процесс ОТ делится на 3 этапа:
Такой способ размножения вирионов характерен для некоторых онкогенных вирусов и вируса иммунодефицита человека (ВИЧ).
Стоит отметить, что для синтеза любой нуклеиновой кислоты на матрице РНК нужна затравка, или праймер. Праймер представляет собой короткую последовательность нуклеотидов, комплементарную 3’-концу молекулы РНК (матрицы) и играющую важную роль в инициации синтеза.
Когда готовые двухцепочечные молекулы ДНК вирусного происхождения встраиваются в геном эукариот, запускается обычный механизм синтеза белков вириона. В итоге “захваченная” вирусом клетка становится фабрикой по производству вирионов, где в больших количествах образуются необходимые молекулы протеинов и РНК.
Повторение таких циклов приводит как к репликации генома вируса, так и к образованию мРНК, способных к синтезу белка в условиях зараженной эукариотической клетки.
Биологическое значение обратной транскрипции
Процесс ОТ имеет первостепенное значение в жизненном цикле многих вирусов (в первую очередь ретровирусов, таких как ВИЧ). РНК вириона, атаковавшего клетку эукариот, становится матрицей для синтеза первой цепочки ДНК, на которой не трудно достроить и вторую цепь.
Полученная двухцепочечная ДНК вируса встраивается в геном эукариот, что приводит к активации процессов синтеза белков вириона и появлению большого количество его копий внутри зараженной клетки. В этом и заключается основная миссия ревертазы и ОТ в целом для вируса.
У эукариот также может встречаться обратная транскрипция в контексте ретротранспозонов – мобильных генетических элементов, способных самостоятельно транспортироваться из одного участка генома в другой. Такие элементы, как считают ученые, стали причиной эволюции живых организмов.
Ретротранспозон представляет собой участок ДНК эукариот, который кодирует несколько белков. Один из них, ревертаза, принимает непосредственное участие в делокализации такого ретротраспорозона.
Использование ОТ в науке
С того момента, как удалось выделить ревертазу в чистом виде, процесс обратной транскрипции взяли на вооружение ученые-биологи. Изучение механизма ОТ и сейчас помогает прочитать последовательности важнейших белков человека.
Дело в том, что геном эукариот, в том числе и нас, содержит неинформативные участки под названием интроны. Когда с такой ДНК считывается последовательность нуклеотидов и формируется одноцепочечная РНК, последняя лишается интронов и кодирует исключительно белок. Если с помощью ревертазы на матрице РНК синтезировать ДНК, ее легко потом секвенировать и узнать порядок нуклеотидов.
Нуклеиновая кислота, которая была образована с помощью обратной транскриптазы, называется кДНК. Она часто используется в полимеразной цепной реакции (ПЦР), чтобы искусственно увеличить число копий полученной копии кДНК. Данный метод используется не только в науке, но и в медицине: лаборанты определяют сходство такой ДНК с геномами различных бактерий или вирусов из общей библиотеки. Синтез векторов и внедрение их в бактерии – одно из перспективных направлений биологии. Если с помощью ОТ формировать ДНК человека и других организмов без интронов, такие молекулы легко внедряются в геном бактерий. Так последние становятся фабриками по производству необходимых человеку веществ (например, ферментов).
Для этого ДНК-вирусы осуществляют стратегию эффективного инициирования транскрипции на вирусной ДНК в одном или более специфическом промоторе вскоре после того, как ДНК введена в ядро. Эти промоторы непосредственно управляют транскрипцией так называемых ранних генов.
Энхансеры (гены – усилители). Для того чтобы элементы клеточного транскрипционного аппарата могли взаимодействовать с ранними вирусными промоторами и активизировать транскрипцию, многие ДНК-вирусы содержат гены- усилители или энхансеры — cis-acting регуляторные последовательности, выполняющие роль минимальных промоторов.
В отличие от промоторов, они могут активизировать транскрипцию, находясь выше или ниже сайта связывания, запускающего транскрипцию, со скоростью от тысячи пар азотистых оснований (биты) в секунду. Эта особенность определенных энхансеров подчеркивает конкурентоспособное преимущество к связыванию с вирусными промоторами. Действительно, высокая активность энхансера/промотора ранних генов цитомегаловируса определяет его частое использование в векторах экспрессии. Хотя клеточные гены часто содержат энхансеры, первый ген-усилитель был обнаружен у полиомавируса SV40. Энхансер SV40 состоит из двух тандемных дупликаций 72 п.н., которые содержат сайты связывания, по крайней мере, для шести различных факторов транскрипции, включая множественные сайты связывания для некоторых факторов. Необходимым условием для оптимальной функции энхансера является его специфическое местоположение и кратность факторов, участвующих в транскрипции.
Многие энхансеры также содержат специфические сайты для "архитектурных" белков, которые не имеют функции активации транскрипции, а образуют с энхансером собственный, скорее стереоспецифический, трехмерный комплекс белка и гена, который назван энхансеосомой. Эти комплексы нуклеопротеида могут активировать транскрипцию со значительной мощностью и специфичностью за счет взаимодействия с РНК-полимеразой II.
Факторы транскрипции вириона. В дополнение к энхансерам некоторые ДНК- вирусы кодируют белки, которые упакованы в вирион, вводятся в клетку с вирусной ДНК и, затем, облегчают транскрипцию ранних генов. Классическим примером этого являются поксвирусы, которые реплицируются в цитоплазме, что делает бесполезным клеточный аппарат транскрипции. Поксвирусы кодируют и упаковывают в вирионы собственную РНК-полимеразу, ферменты кэппирования и полиаденилирования и факторы транскрипции. После проникновения в клетку и раздевания, вирусный транскрипционный аппарат активируется и синтезирует вирусные ранние транскрипты. Другой примером является трансактиватор VP16 вируса простого герпеса (HSV). HSV VP16 синтезируется на поздней стадии инфекции и упаковывается в часть вириона, известную как тегумент, который находится между капсидом и оболочкой. После проникновения HSV в клетку, VP16 транспортируется в ядро, где формирует комплекс, по крайней мере, с двумя клеточными белками — Oct-1, который является активатором транскрипции, узнающим 8 п.н. последовательность ДНК, и HCF-1. Этот трехмерный комплекс связывается со специфической ДНК-последовательностью HSV в области TAATGARAT (R = пурин), расположенной выше ранних генов. Специфичность и аффинное сродство обеспечивает Oct-1. Комплекс служит мощным активатором транскрипции. Эта функция связана с С- терминальным активационным доменом VP16, который может связываться фактически с любой последовательностью ДНК, расположенной выше TATA-бокса промотора, в связи с чем, он может активизировать транскрипцию в любой клетке эукариот. Действительно, VP16 является универсальным активатором транскрипции, т.к. активационный домен VP16 может взаимодействовать со многими различными белками клеточного аппарата транскрипции, однако не ясно, какой именно белок наиболее важен для его действия.
Стимуляция генной экспрессии вирусными ранними белками. В процессе внутриклеточного жизненного цикла ДНК-содержащие вирусы экспрессируют свои гены в высоко упорядоченной последовательности. Хотя экспрессия геномов вирусов может регулироваться посттранскрипционно, главный контроль осуществляется на уровне транскрипции. Вирусные ранние гены кодируют белки, которые, будучи транслированы, стимулируют экспрессию так называемых поздних вирусных генов. Это происходит благодаря наличию ранних и поздних промоторов, которые обычно испытывают недостаток энхансеров или специфических сайтов для комплексов транскрипции, подобных тем, что формируются белками вириона или, например, VP16, для того, чтобы эффективно конкурировать с клеточными промоторами транскрипции. Выражение некоторых вирусных генов (например, поздних генов папиломавирусов) ограничено
специфическим состоянием клеточной дифференцировки. В основе этого ограничения может лежать ткане-специфическая экспрессия клеточных факторов транскрипции. Должно также быть отмечено, что несколько вирусов кодируют белки, которые дополнительно стимулируют экспрессию некоторых вирусных генов в специфическое время жизненного цикла вируса. Кроме того, многие вирусы влияют на экспрессию клеточных генов, что может повлечь за собой индукцию или репрессию специфических генов, а также неспецифическое выключение экспрессии генов. Имеется много механизмов, которые связаны с функцией ранних вирусных белков. Например, белок BZLF1 (также известный, как Zta) вируса Эпштейна-Барр (сем. Herpesviridae), может вести себя подобно клеточным факторам транскрипции, которые связываются со специфической последовательностью выше генов и активизируют их транскрипцию. Другие ранние белки увеличивают активность клеточных факторов транскрипции. Например, белок аденовируса E1A замещает членов транскрипции, разрушает комплекс белков семейства E2F и белков-репрессоров семейства Rb. Это увеличивает транскрипцию ранних генов аденовируса, которые содержат E2F-связывающие сайты, что имеет важные последствия для клеточной транскрипции и, косвенно, для репликации вирусной и клеточной ДНК. Другие ранние белки, подобные ICP4 вируса простого герпеса, могут стимулировать транскрипцию путем прямого взаимодействия с транскрипционным аппаратом без связывания со специфическими последовательностями ДНК целевого промотора, или стимулировать экспрессию вирусных генов с использованием механизмов посттранскрипционного процессинга. В любом случае результатом действий этих вирусных белков является то, что клеточный транскрипционный аппарат используется для реализации информационных программ вируса, а не клетки.
Регуляция транскрипции. В вирусных и клеточных системах молекулярные механизмы транскрипции принципиально сходны. Отличие заключается в существовании различных способов регуляции транскрипции вирусных геномов. Необходимость такой регуляции определяется разной потребностью в вирусоспецифических белках. Структурные белки, как правило, требуются в больших количествах, чем ферменты. Белки, обеспечивающие репликацию генома вируса, нужны на ранних стадиях инфекции, а структурные белки – на поздних. Поэтому целесообразно, чтобы разные вирусные гены считывались с разной эффективностью, и эта эффективность менялась во времени.
Процесс транскрипции регулируется на уровне транскриптона за счет работы репрессоров и активаторов белковой природы и энхансеров. Транскрипция регулируется
количественно и качественно и осуществляется как клеточными, так и вирусоспецифическими механизмами. У вирусов установлено существование целого ряда способов регуляции транскрипции:
Временной тип регуляции. У ДНК-содержащих вирусов существует три периода транскрипции: сверхранний, ранний и поздний. При сверхранней и ранней транскрипции считываются сверхранние и ранние гены, при поздней – поздние гены. Количество транскриптов поздних генов превышает количество ранних. Многие сверхранние мРНК являются генами неструктурных белков – ферментов и регуляторов транскрипции и репликации. Поздние мРНК являются генами структурных белков. Фактором регуляции транскрипции у ядерных вирусов также является транспорт мРНК в цитоплазму.
Каскадный тип регуляции транскрипции генов. Суть такой регуляции заключается в том, что продукты сверхранней транскрипции, например ?-белки, необходимы для транскрипции другой группы генов, кодирующих ?-белки, которые в свою очередь включают транскрипцию следующей группы генов - ?-белков.
Полярный тип регуляции определяется порядком расположения генов в геноме. Количество синтезируемых молекул полипептида зависит от расстояния между геном и промотором. Вдоль генома (-)РНК вирусов существует как бы градиент эффективности транскрипции. Чаще транскрибируются гены 3’-региона, реже – гены 5’-конца.
Взаимноерасположениеисиларегуляторныхсигналов. Считывание или несчитывание траскрибируемого участка матрицы зависит от свойств и расположения регуляторных сигналов – промоторов (обеспечивают начало транскрипции) и терминаторов (обеспечивают прекращение траскрипции). Основа регуляции – взаимное расположение регуляторных сигналов и их сила. Активность сигналов может меняться во времени.
Характер образования транскриптов и способ регуляции зависят от того, имеем ли мы дело с вирусами прокариот или эукариот. Напомним, что в клетках прокариот возможна множественная инициация трансляции на полицистронной матрице, тогда как в клетках эукариот на мРНК реализуется только одна точка инициации трансляции и эта мРНК функционально моноцистронна. Ограничения, накладываемые клеткой хозяина, в первую очередь сказываются на механизмах транскрипции и посттранскрипционного созревания мРНК. Приведем конкретные примеры способов регуляции транскрипции вирусных геномов в клетках эукариот, которая осуществляется с помощью более сложных механизмов, чем в клетках прокариот. Кроме промоторов, энхансеров и терминаторов транскрипционная система дополняется разнообразными способами процессинга первичных транскриптов.
Рассмотрим процессинг первичных транскриптов на примере ядерного вируса эукариот – аденовируса. Процессинг – это посттранскрипционные изменения первичных транскриптов или созревание мРНК, включающее кэпирование 5’-конца, полиаденилирование 3’-конца и сплайсинг. У аденовируса лишь кэпирование идет эффективно на разных стадиях репродукции и происходит до завершения синтеза транскрипта. Большой вклад в регуляцию экспрессии генома аденовирусов вносит альтернативное полиаденилирование. Особенно наглядно это видно при образовании поздних мРНК. В первичном транскрипте поздней области генов есть 5 участков, несущих сигнал полиаденилирования (гексануклеотид AAUAAA). Полиаденилирование может произойти в любом участке и из первичного транскрипта может образоваться только одна из 5-ти возможных классов мРНК. От выбора того или иного участка полиаденилирования зависит относительная концентрация той или иной мРНК. Подавляющее большинство кэпированных и полиаденилированных транскриптов аденовирусного генома подвергается альтернативному сплайсингу – удалению различных участков первичного транскрипта, что осуществляется при помощи клеточных механизмов. Наличие альтернативного сплайсинга и альтернативного полиаденилирования при процессинге первичных транскриптов вирусов эукариот определяется моноцистронностью эукариотических мРНК.
Генетическая информация
Важнейшим процессом ассимиляции в клетке является синтез белков. Так как белки выполняют в клетке ряд функций, то клетке необходимо синтезировать тысячи различных белков, тем более что большинство белков имеют ограниченный срок функционирования и синтез таких белков (компонентов мембран, гормонов, ферментов) не прекращается ни на минуту.
Каждый вид живых существ имеет свой собственный, строго определенный набор белков. Белки являются основой уникальности каждого вида, хотя некоторые белки, выполняющие одну и ту же функцию в разных организмах, могут быть похожими и даже одинаковыми. С другой стороны, все особи одного вида хоть немного, но отличаются друг от друга. На земле нет, например, двух абсолютно одинаковых людей или амеб. Индивидуальную неповторимость каждой особи определяют различия в структуре белков.
Свойства белков определяются прежде всего их первичной структурой, то есть последовательностью аминокислот в молекуле белка. Наследственная информация о первичной структуре белка закодирована в виде последовательности нуклеотидов в молекуле ДНК. Следовательно, информация о строении и жизнедеятельности как клетки, так и целого многоклеточного организма закодирована в виде нуклеотидной последовательности молекулы ДНК. Эта информация получила название генетической информации, а участок ДНК, в котором закодирована информация о первичной структуре какого-либо белка, называется геном.
Генетический код
Каждой аминокислоте белка соответствует комбинация из трех нуклеотидов ДНК (см. Рис. 1) – триплетов, или кодонов. Следовательно, первое свойство генетического кода – это триплетность.

Второе свойство генетического кода – это специфичность, то есть один триплет всегда кодирует только одну аминокислоту.

Рис. 2. Состав ДНК

Рис. 3. Таблица соответствия аминокислот и кодонов

Рис. 4. Таблица генетического кода
Генетический код универсален для всех живых организмов, то есть одни и те же триплеты кодируют одни и те же аминокислоты у разных групп организмов, от бактерий до человека. Универсальность – это четвертое свойство генетического кода.
На рисунке 5 представлены все свойства генетического кода.

Рис. 5. Свойства генетического кода
Свойства генетического кода (непрерывность, неперекрываемость)
Детальные изучения свойств генетического кода показали, что он является триплетным, специфичным, вырожденным, универсальным, непрерывным и неперекрывающимся.
Код неперекрывающийся. Характер кода заключается в том, что ни один нуклеотид из одного кодона не является составной частью соседнего. Например, последовательность матричной ДНК, начинающаяся с нуклеотидов АУГ/АГЦ/ГЦА, не считывается как АУГ/УГА/ГАГ (перекрывание по двум основаниям) или АГУ/ГАГ/ГЦГ (перекрывание по одному основанию).
Транскрипция
Данные, полученные с помощью различных экспериментов, показали, что процесс биосинтеза белка проходит в два этапа: транскрипция и трансляция.

Рис. 6. Транскрипция (Источник)

Рис. 7. Синтез иРНК
У прокариот синтезированные молекулы иРНК сразу же могут взаимодействовать с рибосомами и участвовать в синтезе белка. У эукариот иРНК вначале взаимодействует с ядерными белками и через ядерные поры выходит в цитоплазму, где она взаимодействует с рибосомами, и осуществляется биосинтез белка.
Ингибиторы синтеза белка
Рибосомы бактерии отличаются от рибосом эукариотических клеток. Они мельче и содержат более простой набор белков. Это широко используется в клинической практике, так как существуют антибиотики, которые избирательно взаимодействуют с белками рибосом прокариот, но никак не действуют на белки эукариотических организмов. При этом бактерии либо гибнут, либо их рост и развитие останавливается.
Существуют антибиотики, которые избирательно воздействуют на один из этапов синтеза белка, например на транскрипцию. К ним относятся рифамицины, продуцентом которых являются актиномицеты рода Streptomyces. Лучшим антибиотиком из этого класса является Рифампицин.
Список литературы
- Каменский А.А., Криксунов Е.А., Пасечник В.В. Общая биология 10–11 класс Дрофа, 2005.
- Биология. 10 класс. Общая биология. Базовый уровень / П.В. Ижевский, О.А. Корнилова, Т.Е. Лощилина и др. – 2-е изд., переработанное. – Вентана-Граф, 2010. – 224 стр.
- Беляев Д.К. Биология 10–11 класс. Общая биология. Базовый уровень. – 11-е изд., стереотип. – М.: Просвещение, 2012. – 304 с.
- Агафонова И.Б., Захарова Е.Т., Сивоглазов В.И. Биология 10–11 класс. Общая биология. Базовый уровень. – 6-е изд., доп. – Дрофа, 2010. – 384 с.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
Домашнее задание
Если вы нашли ошибку или неработающую ссылку, пожалуйста, сообщите нам – сделайте свой вклад в развитие проекта. 

После проникновения происходит обратная транскрипция. Синтезированная ДНК – копия генома встраивается в геном клетки и использует клеточный механизм транскрипции

Параретровирусы
В капсиде в качестве генома содержится ДНК. ДНК сразу идет в ядро.Встраивается в геном клетки-хозяина с помощью интегразы.
ДНК - вирусы
Особенности жизненного цикла:
Ø Репликация и транскрипция происходит в ядре клетки (искл.: поксовирусы, асфавирусы).
Ø Для репликации вирусной ДНК необходима Ori – короткая нуклеотидная последовательность в вирусном геноме, к которым специфично присоединяются клеточные и вирусные факторы.
Ø Проблема недорепликации 5’-концов.

1)
2) Схема Кернса

3) Схема катящегося кольца
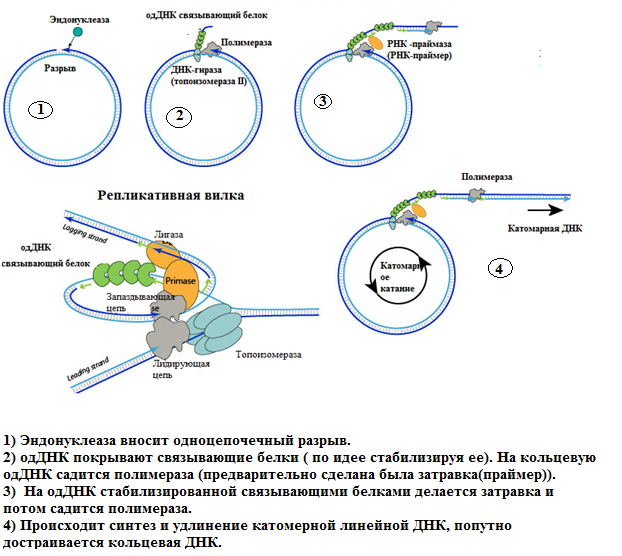
4) Самозатравочный механизм
Геном представлен линейной онДНК, оба конца которой имеют самокомплементарные (инвертированные повторы) последовательности, формирующие шпилечные структуры. Репликация вирусной ДНК осуществляется по самозатравочному механизму и осуществляется полимеразным комплексом из числа ранних вирусных белков: сначала эндонуклеаза вносит разрыв в цепи ДНК вблизи инвертированногоповтора с одного или двух концов (см. рис. 1.2.20, Б), после чего происходит расплетение концевой шпильки и синтез комплементарной цепи с использованием двунитевого участка в качестве затравки (см. рис. 1.2.20, В,Г), затем – отжиг концевых инвертированных повторов, которые используются как затравки для последующего синтеза комплементарных цепей ДНК (см. рис. 1.2.20, Д), в результате чего формируется либо пара геномов, либо конкатемер удвоенного вирусного генома (см. рис. 1.2.20, Е), и в последнем случае необходимо внесение двух эндонуклеазных разрывов цепи (см. рис. 1.2.20, Ж).

5) Аденовирусная репликация с использованием белков затравки


3. Тактические приёмы, используемые вирусами при экспрессии геномов. Сдвиг рамки считывания, протечка при сканировании, внутренняя инициация трансляции, рибосомальный пропуск, рибосомальное шунтирование.
Сдвиг рамки считывания – тип мутации в последовательности ДНК, для которого характерна вставка или делеция нуклеотидов, в количестве не кратном трем. В результате происходит сдвиг рамки считывания при транскрипции мРНК. Следует отличать от однонуклеотидного полиморфизма, в котором происходит замена одного нуклеотида на другой.
Внутренняя инициация трансляции (IRES) – регуляторная структура мРНК, задействованная в КЭП-независимом механизме инициации трансляции, при котором рибосома связывается с мРНК в области этой структуры в 5'-НТО недалеко от сайта инициации трансляции.
Рибосомальный пропуск – если после глицина идет пролин, происходит разрыв полипептида, при том что синтез полипептида продолжается. Вследствие этого, будут нарушены функции белка (или они изменятся) или же он станет нефункциональным.

Дата добавления: 2018-06-01 ; просмотров: 613 ;
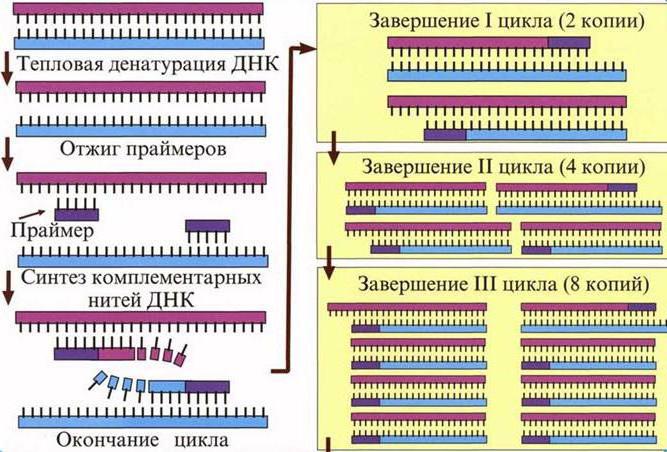
1. Репликация (от ДНК к ДНК)
2. Транскрипция (от ДНК к РНК)(
3. Трансляция (от РНК к белку)
4. Обратная транскрипция (от РНК к кДНК)
Долгое время считалось, что передача информации от РНК к ДНК невозможна, однако, впоследствии выяснилось, что это не так. Некоторые вирусы способны встраивать информацию со своей вирусной РНК в ДНК генома клетки-хозяина. Возможность "обратного" направления информации в настоящее время все шире используется в различных целях, от исследовательских до терапевтических. Так называемые энзимы- реверс-транскриптазы- способны осуществлять синтез кДНК на матрице РНК. О происходящих в клетках млекопитающих (эукариот) процессах передачи информации известно достаточно много, но далеко не все, и изложение хотя бы известных на данный момент времени сведений потребовалось бы слишком много места. Поэтому далее будут изложены лишь самые основы протекающих в клетках простейших организмов (прокариот) этапов передачи наследственной информации.
В процессе копирования информации происходит синтез дочерних молекул ДНК на основе информации, "записанной" в родительской молекуле ДНК. Ясно, что дочерние молекулы должны представлять собой точные копии родительской.
Репликация может осуществляться тремя способами:
а) консервативным;
б) полуконсервативным;
в) дисперсивным.
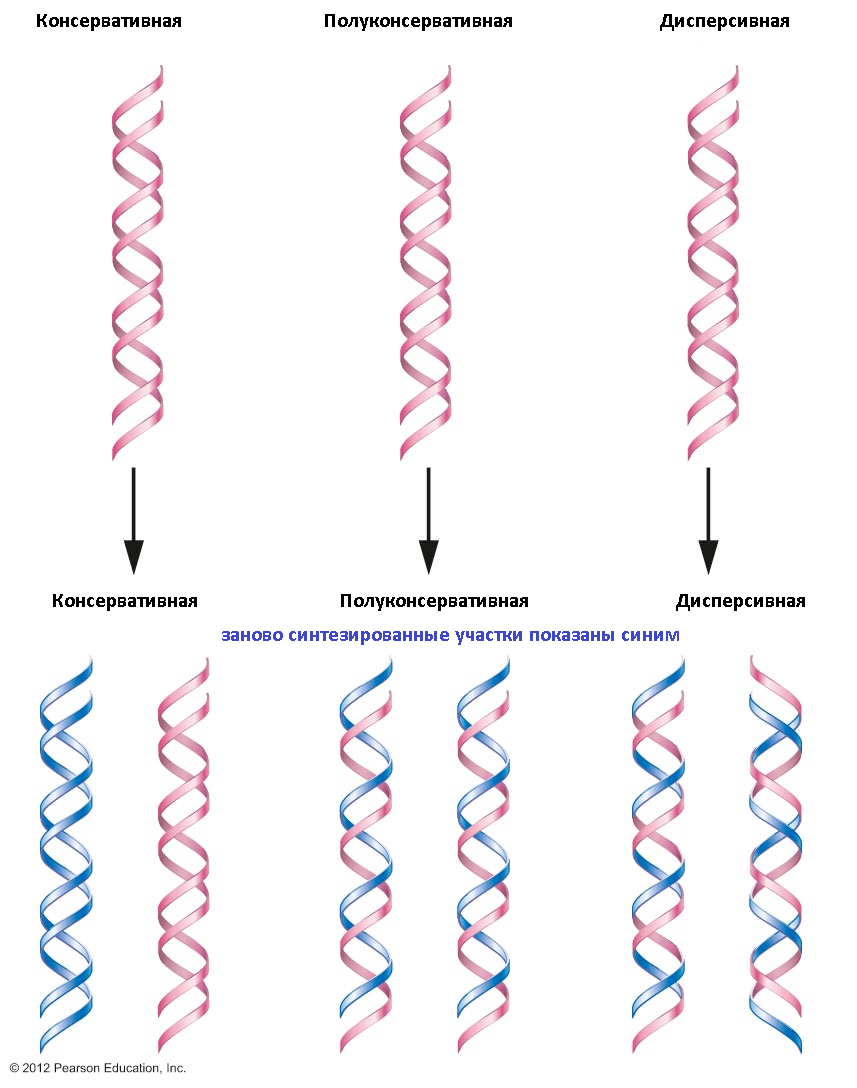
При консервативной репликации вновь синтезированные цепи ДНК находятся в дочерней молекуле. При полукон сервативной репликации полученные молекулы состоят из родительской и вновь синтезированной цепей. Дисперсивный способ репликации означает наличие перемежающихся родительских и вновь синтезированных участков на каждой из цепей образованных молекул ДНК. Для животных организмов и человека ХАРАКТЕРЕН только ПОЛУКОНСЕРВАТИВНЫЙ путь РЕПЛИКАЦИИ ДНК.
В процессе репликации участвует целый ряд энзимов (ферментов) с определенными функциями. Только синтезирующих ферментов в клетках прокариот насчитывается три. Их называют ДНК- полимеразами I, II и III. Сведения о функциональных особенностях ДНК-полимераз приведены в таблице.
| Проявляемая функция (активность) | |
| Полимеразная 5'-3' | |
| Экзонуклеазная 3'-5' | |
| Экзонуклеазная 5'-3' | |
| молекул в клетке | |
| производительность (нуклеотидов в мин, 37 С, на 1 молекулу Pol) |
Фрагмент Кленова- результат частичного протеолиза ДНК-полимеразы I E. Coli субтилизином. Основная функция полимеразы III- синтез цепи, полимеразы I- синтез и исправление ошибочно вставленных нуклеотидов. Полимераза II осуществляет особые, спе циализированные функции. Репликация начинается с расплетания цепей ДНК специальными расплетающими белками, которые называют ГЕЛИКАЗАМИ (или Rep-протеином). Геликазы используют энергию АТФ в процессе расплетания цепей. Скорость расплетания составляет около 6000 мин-1. Для того, чтобы расплетенные цепи не могли вновь соединиться, имеются специальные SSB-белки (single-strand binding proteins), которые присоединяются к комплементарным цепям, удерживая их от ассоциации. По мере продвижения репликационной вилки SSB-протеины передвигаются по цепи, диссоциируя с одного места и присоединяясь на другом. Этот процесс не требует затрат энергии АТФ. После освобождения достаточного места начинается синтез праймера- затравки, необходимой для работы ДНК-полимеразы. Наличие затравки является необходимым условием функционирования ДНК-полимераз (как и наличие комплементарной цепи). В качестве затравки на каждой из разделенных цепей синтезируются маленькие отрезки молекул РНК при помощи фермента ПРИМАЗЫ. Синтез новой цепи ДНК осуществляется всегда в направлении 5'-3' , поэтому если по одной матричной цепи возможен непрерывный синтез, то по комплементарной ей цепи синтез осуществляется только участками. Эти участки синтеза называют фрагментами Оказаки. Когда синтез на одном из фрагментов Оказаки достигает праймера другого фрагмента, РНК-овый праймер удаляется имеющейся у полимераз 5'-3' экзонуклеазной активностью и достраивается дезоксирибонуклеотидами. После этого сахарофосфатный остов между фрагментами сшивается ковалентной связью при помощи фермента ДНК-лигазы. Частота возникновения ошибок при репликации и транскрипции НЕ ПРЕВЫШАЕТ 10 -8 -10 -9 , то есть возможна лишь одна ошибка на сотни миллионов нуклеотидов. Такая точность не может быть обеспечена одним только лишь правилом комплементарности нуклеотидов (обеспечивающим точность 1:10000-1:100000). Репликационный аппарат имеет собственные механизмы "поддержания точности" копирования генетической информации. Этими функциями обладают все ДНК-полимеразы. Модель структуры и функциональных участков (на примере ДНК-полимеразы I) показана на рисунке. Она имеет три зоны активности- полимеризующую в направлении 5'-3', и экозонуклеазные в направлениях 5'-3' и 3'-5'. Области активности разделены пространственно. Вперед (по ходу продвижения полимеразы по матричной цепи ДНК) обращена зона 5'-3' экзонуклеазной активности. Она служит для удаления попадающихся на пути РНК-овых праймеров (затравок). Далее идет собственно синтетическая зона и наконец, зона с экзонуклеазной активностью в направлении 3'-5'. С этой зоной связана так называемая PROOF-READING активность (способность узнавать неправильно встроенные нуклеотиды) и исправлять их вырезанием ряда уже встроенных нуклеотидов. Для этого молекула ДНК-полимеразы смещается (не отсоединяясь от ДНК-овой матрицы) к месту синтеза и последовательно вырезает нуклеотиды, после чего возобновляется нормальный синтез. Воздействие на организм неблагоприятных факторов (химические соединения, ультрафиолет и др.) приводит к постоянному накоплению ошибок в геноме, которые, в конечном итоге, вызывают появление патологии, в частности, невыясненный до сих пор механизм раковых заболеваний. Пока лишь существуют только предположения о том, что причиной раковых заболеваний являются дефекты в носителях информации- ДНК. Транскрипция- синтез молекул РНК на основании информации, записанной в ДНК. Осуществляется в ядрах при участии ДНК-зависимых РНК-полимераз, существующих в типах I, II и III (в порядке выхода в гель-хроматографии). В процессе транскрипции копируется не вся информация с ДНК, а только выборочная, часто отрезками. Сигналом для присоединения полимеразы служат так называемые промотеры , в районе которого (35 нуклеотидных пар до и 10 пар после него) и присоединяется РНК-полимераза. Происходит разделение цепей ДНК и начинается синтез молекулы РНК в направлении 5'-3', только на одной из цепей. При этом по месту тиминовых нуклеотидов комплементарной цепи встают уридиловые нуклеотиды. Весь комплекс передвигается по молекуле ДНК, пока не будет закончен синтез требуемого участка РНК. ДНК с "отсканированной" информацией репарирует, ассоциируя в двунитевые молекулы. Возбудитель туберкулеза Micobacterium tuberculosis (точнее, его РНК-полимераза) весьма чувствителен к антибиотику РИФАМПИЦИНУ, в то время как человеческая РНК-полимераза к нему мало чувствительна. На этом свойстве рифампицина основано его использование в терапии туберкулеза. Молекулы РНК очень часто претерпевают посттранскрипционную модификацию, заключающуюся в удалении участков построенной цепи. Наглядно это можно проследить на примере синтеза молекулы транспортной РНК: Читайте также:
|


