Вируса бешенства в культуре клеток
Методы выявления антигенов. При бешенстве для экспресс-диагностики можно использовать методы флуоресцирующих антител (МФА), реакции преципитации (РП) в агаровом геле, методы иммуноферментного анализа (ИФА), полимеразной цепной реакции (ПЦР). Для прижизненной диагностики бешенства у человека требуется несколько тестов.
Определение антител к антигенам вируса бешенства. Выявление антител в сыворотке крови или в цереброспинальной жидкости — важный метод диагностики. Серологическое исследование рабиес-специфических антител проводится в сыворотке крови для определения пред- и постэкспозиционной вакцинации и определения времени бустерной иммунизации с целью повышения иммунного ответа.
Выделение вируса. Для выделения и идентификации вируса используют метод биопробы на белых мышах. Исследуемый материал суспендируют в физиологическом растворе, содержащем антибиотики и эмбриональную сыворотку крупного рогатого скота. Суспензия вводится интрацеребрально белым мышам массой 5–6 г. Для доказательства развития инфекции за мышами ежедневно наблюдают до 30-го дня после инокуляции. Мыши, у которых за этот период развивается заболевание, немедленно подвергаются эвтаназии, и ткани мозга исследуются методом прямой МФА.
Преимущество данного подхода состоит в возможности определить малые количества вируса бешенства в материале. Недостаток метода — необходимость многодневного (7–18 суток) ожидания между инокуляцией и проявлением первых признаков заболевания. Для сокращения инкубационного периода применяют мышей-сосунков. Для экспресс-диагностики можно использовать мышей в возрасте менее 3 дней: у мышей, забитых через 3 дня, уже выявляется антиген вируса в мозге, который можно выявить методом МФА.
Такой метод выделения вируса практикуется в качестве подтверждающего диагностического теста при отрицательных результатах по выявлению антигена и телец Бабеша – Негри и в случае укуса человека подозрительным на бешенство животным. Он обеспечивает надлежащую чувствительность и специфичность, т. е. расценивается на уровне диагностической значимости метода прямой иммунофлуоресценции. Кроме того, этот метод является основным для идентификации вариантов вируса и перспективен для разработки диагностических реагентов.
Выделение и идентификация вируса на культуре клеток. Основным недостатком выделения вируса при инфицировании лабораторных животных является длительность метода. Избежать этого можно при использовании культур клеток. Обычно для этих целей используют культуру клеток нейробластомы мышей, если нужно исследовать ткани головного мозга. Мозг суспендируют в культуральной питательной среде, суспензию наносят на монослой культуры клеток и инкубируют от одного до нескольких дней.
Чувствительность данной культуры к вирусу можно повысить обработкой ее ДЕАЕ декстраном. Монослой клеток затем отмывают, фиксируют на холоде ацетоном или смесью формалина с метанолом и исследуют методом иммунофлюоресценции. Если животное было инфицировано вирусом бешенства, то в монослое культуры клеток выявляются цитоплазматические включения антигена вируса бешенства.
Показано, что на клетках мышиной нейробластомы линии Na C1 300 в сочетании с МФА антиген вируса бешенства можно выявить через 2 дня. Чувствительность метода сравнима с методом изоляции вируса на мышах.
Хотя вирус бешенства обладает облигатной нейропатогенностью in vivo, он способен инфицировать широкий круг клеток-хозяев in vitro, что можно использовать для исследования других тканей и органов на наличие вируса бешенства. Установлено, что вирус бешенства размножается в клетках ВНК-21 и Vero, в первичных клетках куриных эмбрионов или почек хомяка. Показано, что адсорбция вируса и внедрение его в клетку происходят в течение 7 часов. Через 24–48 часов внутри клетки образуются новые вирусные частицы, через 72 часов происходит почкование их из клеточной оболочки в межклеточное пространство.
Для экспресс-диагностики бешенства могут быть использованы:
а) метод МФА — для выявления антигена вируса бешенства в отпечатках роговицы или заднего отдела шеи больного, содержащего луковицы волос;
б) метод ПЦР — для выявления РНК вируса в биоптатах тканей, слюне, спинномозговой или слезной жидкости;
в) метод ИФА — для выявления специфических антител (антигена) у больных с типичным или атипичным течением.
г) метод биопробы — для выделения вируса на ранних этапах заболевания или для выявления антител в крови или спинномозговой жидкости на поздних стадиях заболевания. Для экспресс-диагностики используется комплексный метод (биопроба + МФА), заключающийся в заражении исследуемым материалом 2-дневных новорожденных мышей и исследования их мозга на 3–4-е сутки в МФА.
Выбор методов прижизненной диагностики в значительной мере зависит от стадии болезни: метод, основанный на выявлении антигенов, как правило, обладает высокой чувствительностью в конце инкубационного периода, в течение первых нескольких дней заболевания, в то время как вируснейтрализующие антитела обычно появляются в спинномозговой жидкости и сыворотке крови после 7-10 дней от начала болезни.
Реакция иммунофлюоресценции. Метод основан на использовании антител, связанных с красителем, например, флюоресцеинизотиоцианатом. РИФ широко применяется для выявления вирусных антигенов в материале больных и для быстрой диагностики.
Метод обладает наиболее высокой степенью чувствительности, он положен в основу экспресс-диагностики и позволяет обнаруживать вирусные антигены в течение нескольких часов
Основные достоинство МФА: быстрота выполнения, высокая специфичность (100%). Затрачиваемое время на диагностику заболевания с его помощью — менее одного дня. Применяются прямой и непрямой варианты МФА.
Прямая иммунофлуоресценция остается наиболее предпочитаемым методом диагностики бешенства. Предметные стекла, содержащие мазки-отпечатки тканей мозга, или стекла с монослоем культуры тканей фиксируют в ацетоне в течение 1–4 часов. Затем препараты высушивают и обрабатывают флуоресцирующими поликлональными антинуклеокапсидными антителами (иммунофлуоресцентный реагент).
Этот реагент представляет собой конъюгат, приготовленный из специфических поликлональных антител IgG класса к нуклеокапсидному антигену вируса и флуоресцеина изоцианата (ФИТЦ). Специфические антитела получают путем гипериммунизации животных (кроликов, хомяков или лошадей) смесью эпитопов нуклеокапсида вируса.
В настоящее время для этих целей все шире используют мышиные моноклональные антитела к нуклеокапсиду вируса бешенства. После 30-минутной инкубации при 37° С диагностические препараты многократно отмывают физиологическим раствором и дистиллированной водой.
Антитела, меченные ФИТЦ, фиксируются только в местах локализации вирусных нуклеопротеидных антигенов. Затем препараты высушивают на воздухе и исследуют методом световой микроскопии, используя в качестве источника света ксеноновую лампу и соответствующий фильтр.
При непрямом варианте антиген сначала соединяют с неокрашенной специфической иммунной сывороткой. Затем на образовавшиеся нефлуоресцирующие комплексы антиген-антитело воздействуют меченой флуорохромом иммунной сывороткой, содержащей антитела к белкам специфической сыворотки. Непрямой вариант МФА наряду с выявлением антигена позволяет количественно определять антитела в исследуемой сыворотке путем соответствующего ее разведения.
Меченые ФИТЦ образования в клетках разных тканей выявляются в виде желто-зеленого флуоресцентного окрашивания на темном фоне (в виде округлой или овальной формы внутрицитоплазматических включений).
Иммуноферментный анализ. Метод основан на принципе сорбции белков на твердой фазе с последующим образованием комплексов антиген-антитело, выявляемых субстрат-индикаторным раствором. Добавляемый в лунки антиген специфически связывается с антителами. На слой антигена наносят исследуемые сыворотки в нужных разведениях. При наличии в них специфических антител последние связываются с антигеном. Для выявления связывания на слой антител наносят иммуноглобулин против глобулинов сыворотки людей, коньюгированный с пероксидазой хрена. Количество сорбирующего коньюгата пропорционально количеству связавшихся с антигеном антител сывороток людей. Это можно определить, используя индикаторный раствор (ортофенилилендиамин + перекись водорода), компоненты которого в результате действия пероксидазы коньюгата окрашивают жидкость в коричнево-желтый цвет. При обследовании неясных случаев применение ИФА дополнительно к методам РП или РСК позволяет увеличить достоверность лабораторной диагностики бешенства, благодаря большой чувствительности этого метода. Метод позволяет обнаруживать инфекционные и дефектные частицы.
Для определения антирабических антител в процессе вакцинации можно применять непрямой метод ИФА, используя в качестве антигена очищенный вирус, а для определения антител класса IgG в человеческой сыворотке — А-белок стафилококка, связанный с пероксидазой хрена. Результаты ИФА сравнимы с полученными в тестах вирусной нейтрализации на мышах. Метод позволяет выявлять присутствие IgМ в начале процесса иммунизации.
Иммуноферментные методы — весьма перспективны для выявления нуклеокапсидного антигена вируса при посмертной диагностике в тканях головного мозга. В их числе, например, быстрый иммуноферментный метод диагностики бешенства, основанный на приготовлении плашек сенсибилизированных антителами IgG изотипа к нуклеокапсиду первого серотипа, разведенных в карбонатном буфере.
Материал для исследования гомогенезируют в буфере или культуральной среде, осветляют центрифугированием, вносят в лунки и инкубируют в плашках. Фиксированный специфическими антителами нуклеокапсидный антиген идентифицируют добавлением пероксидазного конъюгата с антинуклеокапсидными противорабическими антителами иной видоспецифичности и хромогенного субстрата. Чувствительность метода составляет 0,8–1,0 нг/мл.
Этим методом можно выявлять антигены вирусов различных серотипов. Применение конъюгатов нуклеокапсидспецифичных антител, меченых биотином, повышает чувствительность метода до 0,1–0,2 нг/мл.
Методом ИФА успешно выявляется антиген нуклеокапсида [139], но материал, даже разложившийся, не должен фиксироваться формалином.
Метод полимеразной цепной реакции. Для экспресс-диагностики вируса бешенства и идентификации лиссавирусов наиболее удобен метод полимеразной цепной реакции (ПЦР). Метод ПЦР — самый надежный и быстрый для выделения вирионной РНК из любых проб, содержащих вирус в низкой концентрации. С его помощью можно создать много копий РНК вируса. Этот метод используется для подтверждения результатов МФА и для определения вируса в слюне, луковицах волос заднего отдела шеи и головы.
ПЦР основана на принципе естественной репликации ДНК. Суть метода заключается в многократном повторении циклов синтеза (амплификации) вирусоспецифической последовательности ДНК с помощью термостабильной Taq ДНК-полимеразы и двух специфических затравок, так называемых праймеров.
Каждый цикл состоит из трех стадий с различным температурным режимом. В каждом цикле удваивается число копий синтезируемого участка. Вновь синтезированные фрагменты ДНК служат в качестве матрицы для синтеза новых нитей в следующем цикле амплификации, что позволяет за 25–35 циклов наработать достаточное число копий выбранного участка ДНК для ее определения, как правило, с помощью электрофореза в агарозном геле.
Особенно высокая чувствительность ПЦР при использовании праймеров, комплементарных N-гену, когда удается выявлять РНК вируса в пробах, содержащих вирус в титре 10 МЛД50. Методом ПЦР можно выявлять РНК вируса даже в разложившемся патологическом материале.
В настоящее время разработаны и широко используются на практике подтверждающие (конфирматорные) тесты, такие как ПЦР в обратно-транскриптазном исполнении (ОТ-ПЦР). Метод ОТ-ПЦР — высокочувствительный и наиболее эффективный. РНК экстрагируется из тканей инфицированного вирусом органа, транскрибируется в кДНК, которая затем амплифицируется методом ПЦР. Для постановки ОТ-ПЦР необходимы праймеры, полученные к консервативным областям генома вируса бешенства. Обычно используются гены, кодирующие нуклеопротеин или N-белок.
Метод ПЦР высокоспецифичен и очень чувствителен. Является одним из наиболее точных тестов детекции рабического антигена, позволяет диагностировать бешенство даже при наличии в материале хотя бы одного вириона. В основе теста лежит комплементарное достраивание РНК-матрицы, осуществляемое in vitro с помощью фермента РНК-полимеразы. В последние годы ПЦР находит все более широкое применение для диагностики и мониторинга вирусных инфекций. Однако методика проведения сложна, дорогостояща и пока недостаточно унифицирована для рутинного применения.
Цитологические методы в настоящее время имеют ограниченное диагностическое значение, но при ряде инфекций по-прежнему должны применяться. Исследуются материалы аутопсии, биопсии, мазки, которые после соответствующей обработки окрашиваются и анализируются под микроскопом. При бешенстве — это выявление включений в цитоплазме клеток (тельца Бабеша – Негри).
Результативность методов диагностики бешенства может варьировать в зависимости от ряда факторов (стадии болезни, сроков забора материала, качества полученных проб, условий их хранения, опытности персонала, качества реактивов и др.). Если положительный результат подтверждает бешенство, то отрицательный не всегда свидетельствует об отсутствии болезни. Поэтому при бешенстве эксперты ВОЗ рекомендуют использовать несколько тестов, особенно МФА в сочетании с биопробой на новорожденных (2–3 дневных) белых мышах.
Меры личной профилактики
Все работы с материалом, предположительно содержащим вирус бешенства, равно как и с животными, подозрительными на бешенство, должны проводиться с соблюдением мер личной безопасности. Медицинские работники и ветеринарные врачи должны работать в халатах, перчатках, масках.
По окончанию работы боксы обрабатывают 3% раствором перекиси водорода.
Средства индивидуальной защиты обеззараживают кипячением или автоклавированием. Рабочую поверхность стола и руки обеззараживают дезраствором (0,5% раствор хлорамина).
Новой эрой в рабиологии, как и в вирусологии вообще, можно считать внедрение в практику методики однослойных клеточных культур. Следует отметить, что для облигатного нейротропного вируса, каким является возбудитель бешенства, клетки внутренних органов не представляют оптимальной среды. При первичном внесении вируса бешенства, например, в культуру клеток почки практически не наблюдается накопления вируса.
Выяснилось, что для размножения вируса бешенства в культуре клеток экстраневрального происхождения необходима предварительная его адаптация, причем адаптация штаммов высоконейротропного фиксированного вируса требует больших усилий, чем штаммов уличного вируса. Циркулирующие в природе штаммы уличного вируса, по-видимому, имеют неодинаковые способности для адаптации к клеточным культурам. Кроме того, предварительно адаптированные к каким-либо экстраневральным клеточным культурам штаммы вируса имеют широкий клеточный диапазон активности: они легко и быстро могут быть адаптированы к различным клеточным системам.
Для адаптации штаммов фиксированного вируса могут быть рекомендованы следующие приемы: чередующиеся пассажи (in vivo, in vitro), методика диализных пробирок и смеси клеток (cell mixing technique), а также добавление в среду поликатионов (DEAE-декстрана, протамина сульфата) или облучение клеток ультрафиолетовыми лучами. Методика диализных пробирок благодаря постоянной смене поддерживающей среды позволила сохранять зараженные клетки в течение долгого времени.
Е. М. Михайловскому в нашей лаборатории удалось адаптировать к культуре первичных клеток почки сирийского хомяка (ПСХ) несколько штаммов уличного вируса бешенства путем постоянной смены среды и сохранения зараженных клеток до 76 дней. Таким образом был выведен культуральный вариант уличного вируса бешенства (штамм Мочалин), который к настоящему времени в нашей лаборатории прошел 130 пассажей, накапливается в культуре ткани до 10-7 lg LD50/0,03 мл при интрацеребральном титровании на мышах, вызывает острую инфекцию (Р. Ш. Ильясова).
Hronowski с соавт. аналогичным путем штамм уличного вируса (R-205) адаптировали к культуре первичных клеток почки собаки.
В настоящее время известно несколько штаммов фиксированного вируса бешенства, адаптированных к культуре ткани (SAD, CVS-11, ERA, Внуково-32, Внуково-37, Flury, Pasteur, Pitman-Moore). Штамм CVS был адаптирован к культуре первичных клеток ПСХ путем чередующихся пассажей и прошел 112 серийных пассажей (Kissling, Rees). Штамм SAD также был адаптирован к культуре первичных клеток ПСХ в диализных пробирках в результате 25 чередующихся пассажей (Fenje).
Штаммы Flury HEP, Pitman-Moore адаптированы к культуре перевиваемых диплоидных клеток легких эмбриона человека (IIDCS, штамм WI-38) путем пассажей в смеси клеток (Wiktor е. а.). Depoux осуществил 66 серийных пассажей штамма Pasteur в культуре первичных клеток подчелюстных желез щенка собаки.
Значительно большее число публикаций относится к размножению в культуре первичных клеточных культур штаммов вируса бешенства, предварительно адаптированных к культуре ткани. Следует упомянуть об успешном размножении штамма SAD в культуре первичных клеток почки эмбриона поросенка (Abelseth), в культуре первичных клеток почки эмбриона овцы (Selimov, Aksenova), в культуре первичных клеток почки щенка собаки, кролика, морской свинки (Т. Л. Аксенова и др.), штамма Pasteur в культуре клеток лимфатических узлов, околоушной слюнной железы щенка (Depoux), штаммов Flury LEP, HEP в культуре первичных клеток куриного эмбриона (Л. И. Калинина, М. А. Селимов, Р. К. Сафаров).
При сравнительном изучении чувствительности к вирусу бешенства различных клеточных систем (первичные клетки ПСХ, почки щенка, морской спинки, теленка, ягненка, обезьяны, кролика, кошки, человека) более чувствительными оказались клетки ПСХ (Kissling, Rees, Аксенова и др., Е. М. Михайловский). Первичные клетки куриного эмбриона чувствительны к штаммам Flury LEP, HEP, глубокоадаптированным к организму куриного эмбриона, и менее чувствительны к классическим штаммам фиксированного вируса. Первичные клетки ПСХ по своей чувствительности, по-видимому, уступают лишь первичным глиальным клеткам из мозга эмбрионов различных животных.
Из перевиваемых клеточных линий высокочувствительными к вирусу бешенства считаются культура эпендимы мышей (ЕрО) и перевиваемые клетки почки эмбриона сирийского хомяка (ВНК-21, клон 13). Последние нашли самое широкое применение в исследовательской работе, так как титры вируса в этой культуре достигают 10-7/0,03 мл при интра-церебральном титровании на мышах, тогда как в самой чувствительной культуре первичных клеток ПСХ вирус обычно имеет титры 10-4,5 и 10-6,5 lg LD50/0,03 мл. Для выращивания вируса бешенства применены различные перевиваемые клетки.
Atanasiu соавт., Fernandes с соавт. выращивали штаммы CVS, Pasteur, Flury, Nishigara в культуре перевиваемых клеток ВНК-21 или ER эндотелия кролика, Т. А. Аксенова с соавт., Р. К. Сафаров — штаммы SAD, Flury в культуре перевиваемых клеток легких, почки, кишечника эмбриона человека или овцы. Clark сообщил об успешном размножении штаммов фиксированного вируса бешенства в культуре перевиваемых клеток холоднокровных пресмыкающихся.
08 октября 2018
- 3720
- 3,1
- 0
- 4
Даже домашние животные могут быть переносчиками бешенства

Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.
Стоит начать с истории
Первые упоминания о болезни от укуса собак, весьма напоминающей бешенство, встречаются на клинописных глиняных табличках Древней Месопотамии в третьем тысячелетии до н.э. [1].
Древнегреческий философ Демокрит описал бешенство собак в V веке до н.э., то же сделал и Аристотель, однако он считал, что человек бешенством не болеет. Корнелий Цельс, древнеримский ученый, в I веке н.э. все же заметил аналогичное заболевание у людей и назвал его водобоязнью [2].
Начиная с XIII века у нас появляются сведения о крупных эпизоотиях бешенства на территории Европы. Вероятно, они вспыхивали и на других континентах, так как это заболевание в современном мире распространено практически повсеместно.
Эпизоотия — эпидемия среди животных.
И если вы думаете, что это все было давно, и сейчас вирус не представляет никакой опасности, вы крупно ошибаетесь: согласно данным ВОЗ 2007 года, он ежегодно уносил жизни 55 тысяч человек по всему миру [3]. Это около 151 смерти в день! Такой постоянно высокий показатель говорит о человеческой уязвимости, эпизоотии вспыхивают каждый год, что ставит под опасность жизнь каждого человека. На данный момент случаи заражения бешенством носят регулярный характер в более чем 150 странах мира, в том числе и в России [4] (рис. 1 и 2).
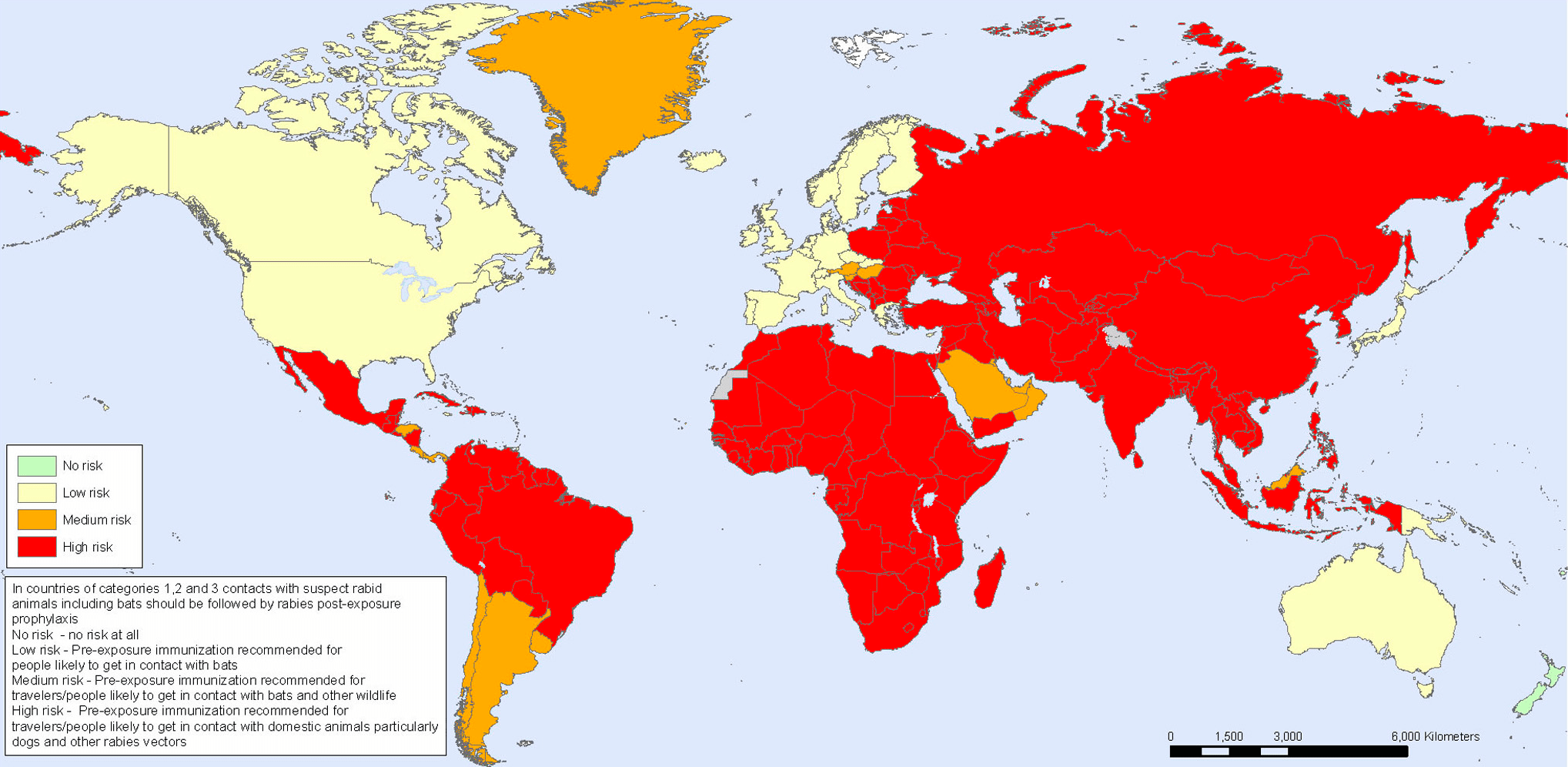
Рисунок 1. Оценка риска заражения бешенством в мире
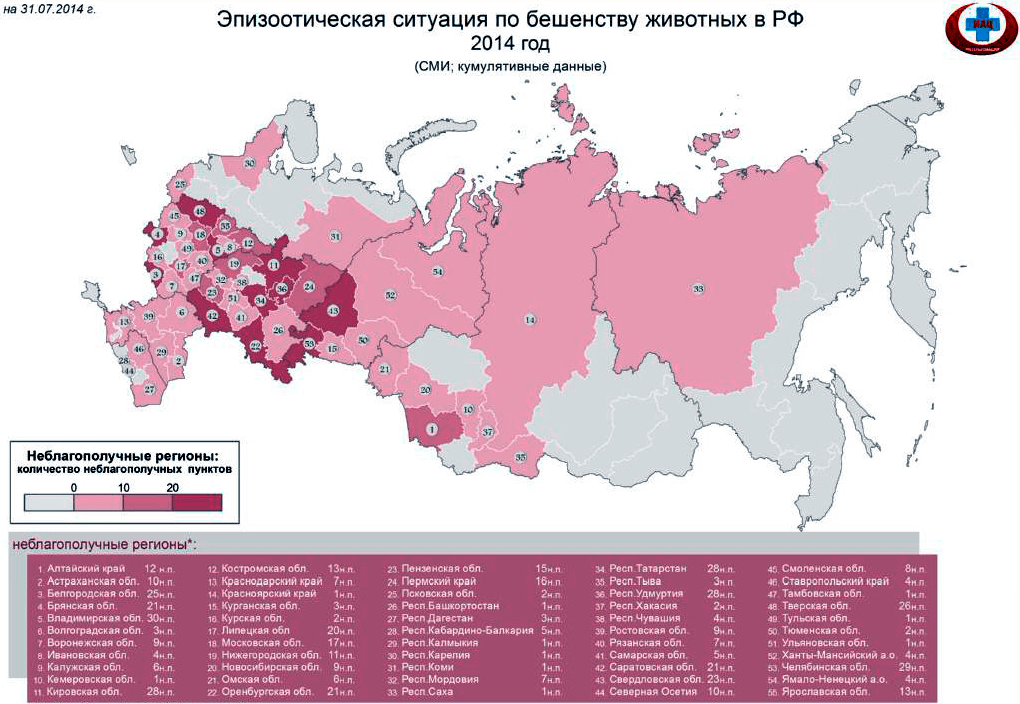
Рисунок 2. Неблагополучные по бешенству регионы России, данные 2014 года подпись
Давайте знакомиться, Neuroiyctes rabid
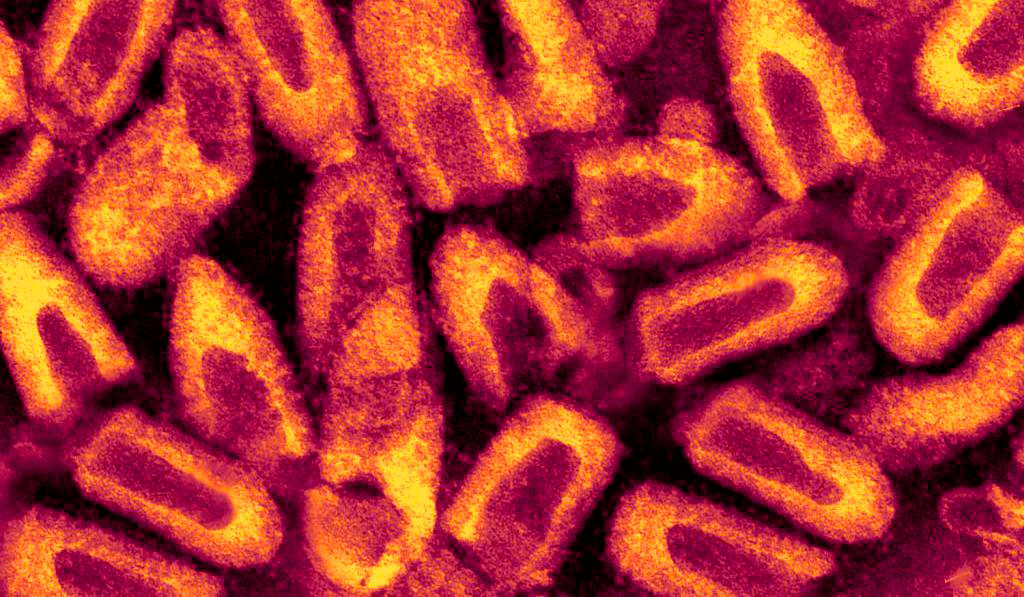
Смертоносная пуля длиной 180 нм и шириной 75–80 нм [6] имеет двухслойную липидную оболочку, которая довольно сильно по строению напоминает привычную нам мембрану клеток. На своей поверхности вирион имеет шипы длиной 10 нм и шириной 3 нм. Упорядоченное расположение шипов на мембране обеспечивает особый гликопротеид, далее мы будет к нему возвращаться еще несколько раз, запомните его, товарищи.
Вирион — полноценная вирусная частица, находящаяся вне клетки-хозяина.
Под прочной оболочкой внутри вируса залегает одна молекула РНК, свернутая в спираль, она мало похожа на привычные нам РНК клеток и вообще не способна к инфицированию. Но она имеет важное значение для жизни хитрого вируса, поскольку несет в себе минус-цепь РНК или, как её еще называют, рибонуклеопротеид (РНП), который послужит матрицей для синтеза вирусной РНК (вРНК) по правилу комплементарности, как только попадет в клетку-хозяина.
РНК вируса бешенства довольно небольшая и содержит всего 5 генов, кодирующих необходимые белки. Чтобы лучше понимать, что необходимо Neuroiyctes rabid для существования, нам вместе с тобой, уважаемый читатель, стоит лучше разобраться в этом вопросе.
Итак, мы знаем, что у цепи РНК есть два конца: 5′ (место присоединения остатка фосфорной кислоты) и 3′ (место присоединения рибозы).
Начиная с 3′ гены вируса бешенства расположены так:
- Ген нуклеокапсидного белка N, окружающего цепь РНК.
- Ген белка NSV — одного из компонентов вирусной транскриптазы, входящего в состав капсида.
- Ген, кодирующий матриксный белок M, выстилающий липидную мембрану с внутренней стороны.
- Ген белка G — внешнего гликопротеида вирусного суперкапсида (оболочки, покрывающей капсид с внешней стороны и содержащей шипы), который отвечает за адсорбцию и внедрение вируса в клетку, обладает антигенными и иммуногенными свойствами (антитела именно к этому гликопротеиду нейтрализуют вирус бешенства).
- Ген белка L — высокомолекулярного компонента вирусной транскриптазы [5] (рис.4).
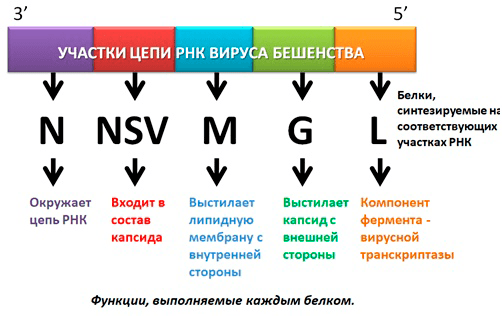
Рисунок 4. Схематичное изображение РНК вируса бешенства, белки, синтезируемые на определенных участках, и их функции
рисунок автора статьи
Когда все необходимые белки синтезируются в клетке-хозяине, то белки G и M будут располагаться с двух сторон от оболочки вируса, а N, NSV и L прилегать к минус-цепи РНК (рис. 5).
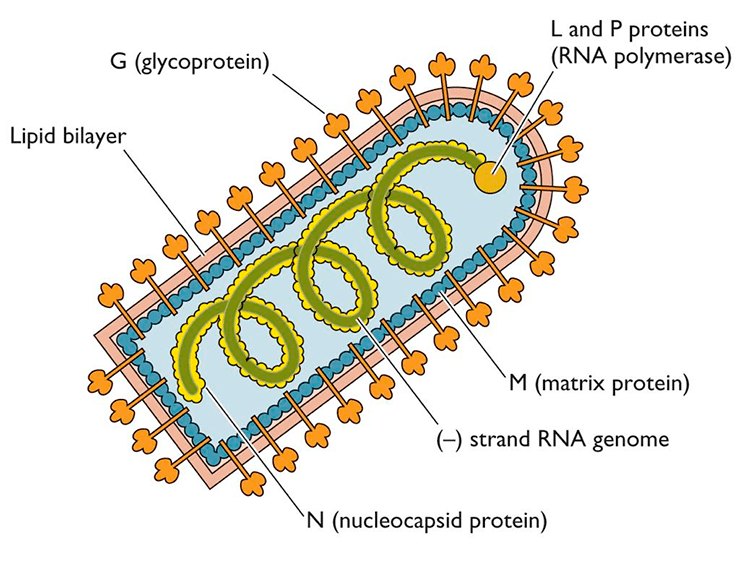
Рисунок 5. Схематичное строение вируса бешенства
На самом деле различают несколько диких и один культивированный штаммы вируса бешенства. Первые циркулируют в природе, имеют длительный инкубационный период, чаще образуют специфические тельца, локализуются в нервных клетках, слюнных железах и роговице глаза. К ним относят [7]:
- вирус классического бешенства — RABV;
- вирус рукокрылых Лагос — LBV;
- вирус Дювенхейдж — DUVV;
- лиссавирусы европейских рукокрылых EBLV-1 и EBLV-2;
- лиссавирус австралийских рукокрылых — ABLV;
- вирус Мокола — MOKV.
Культивированный (фиксированный) вирус впервые выделил Луи Пастер в 1885 году путем длительного заражения лабораторных кроликов дикой формой вируса, которая мутировала и приобрела определенные, выгодные для нас, качества. Например, она опасна только для лабораторных животных, на которых ее выводили, имеет очень короткий инкубационный период, не образует специфических телец и поражает только ЦНС. Организм человека она не убивает, но заставляет иммунную систему вырабатывать антитела, которые могут защитить и от других, более опасных, штаммов вируса бешенства. Стоит ли говорить, что люди с радостью стали использовать взвесь мозга больных животных в качестве вакцины и успешно практиковали такой метод до сравнительно недавнего времени [5].
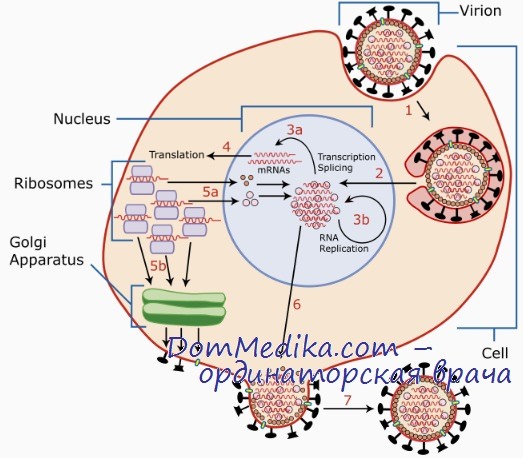
Чтобы создать подобные себе копии, вирусу бешенства, как и любому другому клеточному паразиту, для начала нужно попасть в организм хозяина и найти интересующую его клетку. Мы уже знаем, что излюбленным местом для его размножения является нервная ткань, в особенности — ЦНС. После попадания с зараженной слюной в ткани, шипастый негодяй проводит в мышечной ткани нового хозяина до нескольких дней, затем адсорбируется на нервные окончания с помощью уже известного гликопротеида G и проникает в нервную клетку путем эндоцитоза (рис. 6).
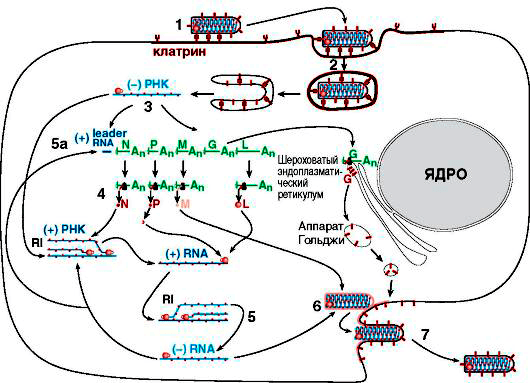
Рисунок 6. Схематичное изображение жизненного цикла вируса бешенства. RNA = РНК.
Дальнейшая скорость протекания жизненного цикла вируса зависит от места попадания в организм: чем дальше от ЦНС, тем дольше вирус будет распространяться по аксонам, ведь скорость его передвижения составляет примерно 3 мм/ч.
Проникнув в клетку, вирус бешенства сливается с мембраной лизосомы, и его внутреннее содержимое высвобождается. Затем в ход идет вирионная транскриптаза, которая обусловливает считывание информации с минус-РНК, и синтез на ней, как на матрице, вРНК. Далее все идет по стандартной схеме биосинтеза белка: к кодонам вРНК по правилу комплементарности пристраиваются антикодоны тРНК, последние перемещаются к рибосомам, где в дальнейшем синтезируются вирусспецифические белки, с которыми мы уже знакомы. вРНК связывается с N, L и NSV в нуклеокапсид, который подходит к назначенному месту, где уже в плазмалемму (клеточную мембрану) клетки-хозяина успешно встроились M и G. Затем генетическая информация и прилежащие белки обволакиваются мембраной, и путем эндоцитоза в области дендритов (отростков нервных клеток) выходят новые вирионы.
Кроме того, вирус бешенства может блокировать биосинтез нормальных белков клетки [5] и повышать экспрессию и выделение цитокинов (клеточных медиаторов) в близлежащих, незараженных клетках, что, вероятно, способствует развитию энцефалита [9].
Когда меры предосторожности не сработали
Я искренне надеюсь, что вам никогда в жизни не понадобится несколько следующих абзацев, но с моей стороны было бы преступно упустить это.
Итак, если вас все же покусал или облизал зверь (рис. 6), лучше не надеяться на лучшее, а экстренно применять необходимые меры. Для начала хорошенько промойте место укуса водой с мылом, а затем прижгите спиртовым раствором йода. Если вы вдруг врач-эпидемиолог, спешащий на работу, или обычный смертный, в руках у которого почему-то есть антирабический иммуноглобулин, то это как раз то время, когда стоит его применить по назначению. Сходить к врачу все равно придется, но шансы на выживание у вас резко возрастут.
Если вы хотите, чтобы больше никто не пострадал (а я уверена, что хотите), то вызовите бравую бригаду СББЖ (станции по борьбе с болезнями животных), они усыпят животное и доставят его в лабораторию целиком или только голову, иногда могут достать головной мозг и законсервировать его 50-процентным глицерином, если поездка обещает быть достаточно долгой. Трупный материал упаковывают в плотный полиэтиленовый мешок, а мозг в банку с пробкой, которую к тому же заливают парафином, а потом все это дополнительно помещают в водонепроницаемую тару, чтобы полностью себя обезопасить.
На СББЖ материал с подозрением на бешенство без очереди и всякого промедления исследуют смелые ветеринары, ведь в данном случае речь может идти о сохранении жизни укушенного человека. Работая с, вероятно, зараженным мозгом, надевают две пары перчаток, защитные очки на глаза и шесть марлевых повязок, прикрывающих нос и рот, все манипуляции проводят в стерильных условиях [10]. Представляете, как все серьезно?
Скорость течения болезни может сильно варьировать: инкубационный период длится от 10 до 90 дней и более, но обычно около месяца. Быстрее всего он проходит при попадании вируса в области лица и головы, причем для этого не обязательно, чтобы вас за щечки покусала собака с пеной у рта, ведь проникновение вируса в организм возможно не только через повреждение кожных покровов, но и через слизистые оболочки.
Как только вирус попал в рану или на слизистую, он не спешит оттуда уходить и только через 1–4 дня проникает в нервную ткань. Конечно, ему не терпится скорее попасть в ЦНС и вызвать смертельный энцефалит, но ведь тело хозяина имеет еще парочку пригодных мест, интересующих вирус бешенства, а именно: слюнные железы и роговица глаза. Проникновение в первые из перечисленных имеет принципиальное значение для передачи вируса новым хозяевам.
В развитии заболевания выделяют три стадии: начальную (она идет сразу после инкубационного периода), возбуждения и параличей [11], [12]. В любом случае, не советую вам ждать ни одну из них. Когда появятся симптомы, будет уже слишком поздно, ведь излечение возможно только во время инкубационного периода. Впрочем, существует гипотеза, согласно которой бешенство можно вылечить путем ингибирования пептидов вируса непосредственно в зараженном организме [13], так что, вероятно, через несколько лет данная проблема будет решена, но пока что будем читать и бояться.
1. Начальная стадия.
Появляются беспокойство и страх, тошнота, головокружение, зуд и покраснение в области укуса. Длится от 1 до 3 дней.
2. Стадия возбуждения.
Возбуждение, судороги гортани и глотки, водобоязнь, агрессивность, галлюцинации. Именно в этот период появляются наиболее привычные симптомы бешенства. Из-за невозможности глотать слюну, она взбивается в пену и валит изо рта. Есть даже предположение, что водобоязнь провоцирует животное разбрасывать слюну, так как даже вид жидкости вызывает болезненные спазмы глотки. Домашние животные, которые обычно не отходят от дома дальше, чем на один километр, беспокойно бегают, превращаются в бродяг и стремятся напасть на все, что движется (или даже не движется), что, конечно, способствует распространению заболевания. Дикие животные теряют страх перед человеческими поселениями и выходят из леса, чаще всего, кусая домашних животных, реже — человека. Иногда может наблюдаться, наоборот, излишняя ласковость зараженных животных, их стремление поскорее облизать вас, что на самом деле еще более опасно, так как вызывает меньше подозрений.
3. Стадия параличей.
Через 5–7 дней после начала появления симптомов смерть наступает от паралича дыхательной или сердечной мускулатуры, так как нервная система перестает посылать им сигналы о необходимых сокращениях.
Современные же вакцины имеют ряд неоспоримых преимуществ [14]:
- Их выращивают не в живых существах, а в культурах клеток эмбрионов птиц, что делает процесс создания вакцины более контролируемым и гуманным.
- Они более безопасны, так как почти не вызывают побочных эффектов.
- Они экономичнее. Объем для успешной вакцинации нужен меньший, а хранить такие вакцины можно дольше.
Сплошные плюсы! Более того, в настоящее время используют препарат, состоящий не из цельных вирусных частиц, а из гликопротеина вируса бешенства (того самого G), который обладает высокой иммуногенностью. В этом случае количество необходимых инъекций снижается до шести, а в некоторых случаях даже до трех. Активный иммунитет к бешенству достигается последовательностью инъекций ослабленного вируса и может не снижаться от одного года до трех лет [3].
Если вирус попал в область головы и шеи, то, как я уже говорила, он развивается очень быстро, поэтому людям вводят готовый специфический иммуноглобулин, который создает пассивный иммунитет, что несколько продлевает инкубационный период и несколько отдаляет момент гибели зараженного. Антирабический иммуноглобулин получают из 10-процентной сыворотки крови зараженных бешенством лошадей [15].
Просто о сложном. Лабораторная диагностика
В лаборатории СББЖ проводится четырехступенчатый анализ материалов, которые были добыты от того животного, которое на вас напало. Принято придерживаться данной последовательности методов лабораторной диагностики:
1. Гистологический метод для обнаружения телец Бабеша—Негри.
В зараженных клетках можно обнаружить специфические включения, так называемые тельца Бабеша—Негри, которые могут быть размером до 25 мкм, а значит, они хорошо видны в световой микроскоп. Их точная функция до сих пор не ясна.
Из головного мозга животного с левой и правой сторон берут материал на гистологические срезы или мазки. Вирус бешенства локализуется в определенных частях головного мозга, таких как Аммонов рог (гиппокамп), мозжечок, кора полушарий и продолговатый мозг (рис. 7). Суммарно получается восемь гистопрепаратов. Мазки или срезы подвергаются окраске по Селлерсу (тельца получаются розово-красного цвета (рис. 8)) или Муромцеву (окраска телец фиолетовая с темно-синими включениями (рис. 9)).
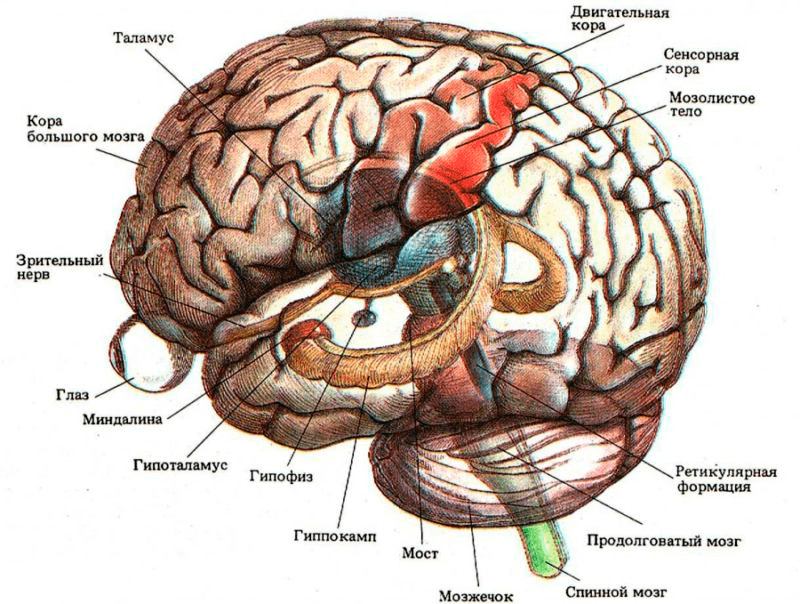
Рисунок 7. Места локализации телец Бабеша—Негри в головном мозге: гиппокамп, продолговатый мозг, мозжечок, кора полушарий
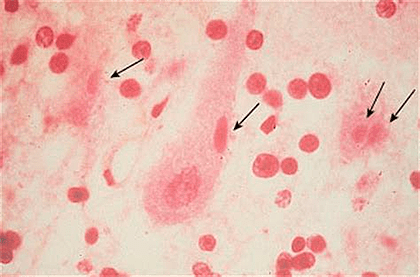
Рисунок 8. Тельца Бабеша—Негри насыщенного розового цвета, окраска по Селлерсу
Читайте также:


