Взаимодействие клеточных и гуморальных механизмов защиты при формировании противовирусного иммунитета
Механизмы иммунитета – это процессы формирования защитной реакции против внедрения в организм чужеродных агентов. От правильности их протекания зависит здоровье и жизнеспособность организма. Бывают специфические и неспецифические механизмы иммунитета. Специфические – это те, которые работают против конкретного антигена, обеспечивая защиту от него длительное время, иногда на протяжении всей жизни. Неспецифические механизмы иммунитета можно назвать в некотором роде универсальными, поскольку они реагируют на проникновение в организм любых чужеродных агентов, а также обеспечивают первоначальную эффективную защиту до тех пор, пока не включатся антиген-специфические реакции.
Клеточный и гуморальный иммунитет
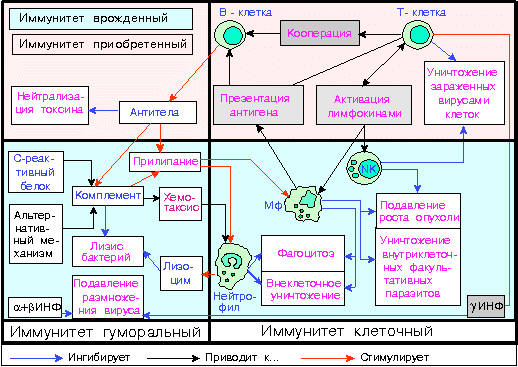
Исторически, в процессе изучения иммунной системы, сложилось разделение на клеточный и гуморальный иммунитет. Клеточный иммунитет обеспечивается лимфоцитами и фагоцитами и протекает без участия антител, которые относятся к гуморальным механизмам. Этот тип иммунитета осуществляет защиту от инфекций и опухолей. Основа клеточного иммунитета – это лимфоциты, которые образуются в костном мозге, а затем перемещаются для окончательного созревания в тимус, или вилочковую железу. По этой причине их называют тимус-зависимыми, или Т-лимфоцитами. В течение своей жизни лимфоцитам много раз приходится покидать лимфоидные органы и поступать в кровь, а затем возвращаться обратно. Благодаря такой мобильности эти клетки могут появляться в местах воспаления достаточно быстро. Т-лимфоциты бывают трех видов, каждый из которых выполняет свою важную функцию. Т-киллеры – это клетки, которые могут уничтожать антигены. Т-хэлперы первыми узнают о том, что в организм вторгся враг и реагируют на это выработкой особых ферментов, которые вызывают размножение и созревание Т-киллеров и В-клеток. И, наконец, Т-супрессоры нужны для того, чтобы подавлять активность иммунного ответа, когда в нем исчезает необходимость. Это очень важно для того, чтобы остановить развитие аутоиммунных реакций. Вообще, оказывается, что поставить четкую границу, разделяющую клеточный и гуморальный иммунитет, нельзя. В образовании антигенов участвуют клетки, а некоторые реакции клеточного иммунитета невозможны без антител.
Гуморальный иммунитет строится на образовании антител к каждому антигену, попадающему в организм человека. Он представлен различными белками, присутствующими в крови и других биологических жидкостях. К ним относятся интерфероны, способные делать клетки невосприимчивыми к воздействию вирусов; С-реактивный белок крови, который запускает систему комплемента; лизоцим – это фермент, который повреждает стенки чужеродных микроорганизмов, растворяя их. Названные белки относятся к неспецифическому гуморальному иммунитету. Но есть также специфический, который представлен интерлейкинами, а также специфическими антителами и другими образованиями.
Как видим, клеточный и гуморальный иммунитет тесно связаны между собой, и сбой в одном звене неизбежно потянет за собой проблемы в работе другого.
Противовирусный и инфекционный иммунитет
Инфекционный иммунитет может еще по-другому называться нестерильным. Его суть состоит в том, что человек не может повторно заразиться болезнью, возбудитель которой уже есть в организме. Он может быть врожденным либо приобретенным, а приобретенный, в свою очередь, активным или пассивным. Инфекционный иммунитет существует лишь до тех пор, пока в крови находится антиген и антитела к нему, то есть в течение болезни. Когда этот период заканчивается, данная защита перестает действовать и человек снова может заразиться тем, чем недавно переболел. Инфекционный иммунитет может быть кратковременным, длительным или пожизненным. Так, например, кратковременный обеспечивается во время болезни гриппом, длительный может быть при брюшном тифе, а пожизненный приобретается после кори, краснухи, ветрянки и прочих болезней.
Противовирусный иммунитет на первом этапе обеспечивается механическими барьерами – кожными покровами, слизистыми оболочками. Повреждение их, или сухость слизистых облегчают проникновение вируса в организм. После того, как враг попал, куда стремился и начал повреждать клетки, огромное значение играет выработка интерферонов, которые обеспечивают их невосприимчивость к действию вируса. Далее противовирусный иммунитет действует благодаря зову гибнущих клеток. Погибая, они выделяют цитокины, которые являются признаком воспаления. На этот зов сбегаются лейкоциты, которые и формируют очаг воспаления. Примерно на 4-й день болезни начинают вырабатываться антитела, которые, в конце-концов и победят вирус. Им на помощь приходят также макрофаги – клетки, обеспечивающие фагоцитоз, уничтожение и переваривание вражеских клеток. Противовирусный иммунитет – это очень сложный процесс, в котором участвует множество ресурсов иммунной системы.
К сожалению, иммунные реакции не всегда срабатывают так, как об этом пишут в учебниках по биологии. Часто какой-либо процесс может быть нарушен, что приводит к осложнениям и проблемам. Когда снижен иммунный ответ, нужны средства, поднимающие иммунитет. Они могут быть природными, либо купленными в аптеке, главное – это эффективность и безопасность. В активизации иммунной защиты нуждаются люди разных возрастов, включая стариков и детей, а эти категории населения особенно нуждаются в мягком и безопасном подходе к лечению. Многие современные средства, поднимающие иммунитет, не отвечают этому требованию. Они вызывают побочные эффекты, привыкание, синдром отмены, что, в конце концов, ставит под вопрос целесообразность их приема. Конечно же, медицинское обследование и назначение лечащего врача – это основание для того, чтобы принимать средства, поднимающие иммунитет. Самолечение недопустимо.
Данный препарат – лучшее, что есть на сегодняшний день для восстановления иммунной системы. Он хорош и для профилактики, и для лечения, и в период восстановления. Даже младенцы, беременные женщины и пожилые люди могут его принимать, не опасаясь побочных эффектов или привыкания, а это серьезный показатель безопасности.
Вирусы запускают противовирусный иммунитет – клеточный Т-лифоциты (цитотоксические СД8)
Также при поподании вирусов выделяется интерферон, продуцируется клетками в которые попал вирус, это противовирусный белок который защищает клетку от попадания в нее другого вируса.
Интерферон относится к важным защитным белкам иммунной системы. Открыт при изучении интерференции вирусов, т. е.
явления, когда животные или культуры клеток, инфицированные одним вирусом, становились нечувствительными к заражению другим вирусом. Оказалось, что интерференция обусловлена образующимся при этом белком, обладающим защитным противовирусным свойством. Этот белок назвали интерфероном.
Интерферон представляет собой семейство белков-гликопротеидов, которые синтезируются клетками иммунной системы и соединительной ткани
Выработка интерферона резко возрастает при инфицировании вирусами, а также при воздействии индукторов интерферона, например РНК, ДНК, сложных полимеров. Такие индукторы интерферона получили название интерфероногенов.
Помимо противовирусного действия интерферон обладает противоопухолевой защитой, так как задерживает пролиферацию (размножение) опухолевых клеток, а также иммуномодулирующей активностью, стимулируя фагоцитоз, естественные киллеры, регулируя антителообразование В-клетками, активируя экспрессию главного комплекса гистосовместимости.
Механизм действия интерферона сложен. Интерферон непосредственно на вирус вне клетки не действует, а связывается со специальными рецепторами клеток и оказывает влияние на процесс репродукции вируса внутри клетки на стадии синтеза белков.
Применение интерферона. Действие интерферона тем эффективнее, чем раньше он начинает синтезироваться или поступать в организм извне. Поэтому его используют с профилактической целью при многих вирусных инфекциях, например гриппе, а также с лечебной целью при хронических вирусных инфекциях, таких как парентеральные гепатиты (В, С, D), герпес, рассеянный склероз и др
Особенности противовирусного иммунитета, гуморальные и патофизиологические механизмы. Ингибиторы, природа и свойства, Имунная система организма человка. Иммунокомпетентные клетки, их основные функции. Понятие о межклеточной кооперации и ее роли в иммуногенезе.
Структура иммунной системы. Иммунная система представлена лимфоидной тканью. Это специализированная, анатомически обособленная ткань, разбросанная по всему организму в виде различных лимфоидных образований. К лимфоидной ткани относятся вилочковая, или зобная, железа, костный мозг, селезенка, лимфатические узлы (групповые лимфатические фолликулы, или пейеровы бляшки, миндалины, подмышечные, паховые и другие лимфатические образования, разбросанные по всему организму), а также циркулирующие в крови лимфоциты. Лимфоидная ткань состоит из ретикулярных клеток, составляющих остов ткани, и лимфоцитов, находящихся между этими клетками. Основными функциональными клетками иммунной системы являются лимфоциты, подразделяющиеся на Т- и В-лимфоциты и их субпопуляции. Общее число лимфоцитов в человеческом организме достигает 10 12 , а общая масса лимфоидной ткани составляет примерно 1—2 % от массы тела.
Лимфоидные органы делят на центральные (первичные) и периферические (вторичные).
Кооперация иммунокомпетентных клеток. Иммунная реакция организма может иметь различный характер, но всегда начинается с захвата антигена макрофагами крови и тканей или же со связывания со стромой лимфоидных органов. Нередко антиген адсорбируется также на клетках паренхиматозных органов. В макрофагах он может полностью разрушаться, но чаше подвергается лишь частичной деградации. В частности, большинство антигенов в лизосомах фагоцитов в печение часа подвергается ограниченной денатурации и протеолизу. Оставшиеся от них пептиды (как правило, два-три остатка аминокислот) комплексируются с экспрессированными на внешней мембране макрофагов молекулами МНС.
Макрофаги и все другие вспомогательные клетки, несущие на внешней мембране антигены, называются антигенпрезентирующими, именно благодаря им Т- и В-лимфоциты, выполняя функцию презентации, позволяют быстро распознавать антиген.
Иммунокомпетентные клетки - клетки, способные специфически распознавать антиген и отвечать на него иммунной реакцией. Такими клетками являются Т- и В-Л, которые под влиянием чужеродных агентов дифференцируются в сенсибилизированный лимфоцит и плазматическую клетку.
Т-лимфоциты –это сложная по составу группа клеток, которая происходит от полипотентной стволовой клетки костного мозга, а созревает и дифференцируется в тимусе из предшественников. Т-лимфоциты разделяются на две субпопуляции: иммунорегуляторы и эффекторы. Задачу регуляции иммунного ответа выполняют Т-хелперы. Эффекторную функцияю осуществляют Т-киллеры и естественные киллеры. В орагнизме Т-лимфоциты обеспечивают клеточные формы иммунного ответа, определяют силу и продолжительность иммунной реакции.
B-лимфоциты –преимущественно эффекторные иммунокомпетентные клетки. Зрелые В-лимфоциты и их потомки – плазматические клетки являются антителопродуцентами. Их основными продуктами являются иммуноглобулины. В-лимфоциты участвуют в формировании гуморального иммунитета, В-клеточной иммунологической памяти и гиперчувствительности немедленного типа.
Макрофаги - клетки соединительной ткани, способные к активному захвату и перевариванию бактерий, остатков клеток и других чужеродных для организма частиц.
2.15 Антигены: определение, основные свойства. Антигены бактериальной клетки.
Антиген –это биополимер органической природы, генетически чужеродный для макроорганизма, который при попадании в последний распознаётся его иммунной системой и вызывает иммунные реакции, направленные на его устранение.
Антигены обладают рядом характерных свойств: антигенностью, специфичностью и иммуногенностью.
Иммуногенность — потенциальная способность антигена вызывать по отношению к себе в макроорганизме специфическую защитную реакцию. Степень иммуногенности зависит от ряда факторов, которые можно объединить в три группы: 1. Молекулярные особенности антигена; 2. Клиренс антигена в организме; 3. Реактивность макроорганизма.
К первой группе факторов отнесены природа, химический состав, молекулярный вес, структура и некоторые другие характеристики.
Иммуногенность в значительной степени зависит от природы антигена. Важна также оптическая изомерия аминокислот, составляющих молекулу белка. Большое значение имеет размер и молекулярная масса антигена. На степень иммуногенности также оказывает влияние пространственная структура антигена. Оказалась также существенной стерическая стабильность молекулы антигена. Еще одним важным условием иммуногенности является растворимость антигена.
Вторая группа факторов связана с динамикой поступления антигена в организм и его выведения. Так, хорошо известна зависимость иммуногенности антигена от способа его введения. На иммунный ответ влияет количество поступающего антигена: чем его больше, тем более выражен иммунный ответ.
Третья группа объединяет факторы, определяющие зависимость иммуногенности от состояния макроорганизма. В этой связи на первый план выступают наследственные факторы.
Специфичностьюназывают способность антигена индуцировать иммунный ответ к строго определенному эпитопу. Это свойство обусловлено особенностями формирования иммунного ответа — необходима комплементарность рецепторного аппарата иммунокомпетентных клеток к конкретной антигенной детерминанте. Поэтому специфичность антигена во многом определяется свойствами составляющих его эпитопов. Однако при этом следует учитывать условность границ эпитопов, их структурное разнообразие и гетерогенность клонов антигенреактивных лимфоцитовой специфичности. В результате этого организм на антигенное раздражение всегда отвечает поликлональными иммунным ответом.
Антигены бактериальной клетки.В структуре бактериальной клетки различают жгутиковые, соматические, капсульные и некоторые другие антигены. Жгутиковые, или Н-антигены,локализуются в локомоторном аппарате бактерий — их жгутиках. Они представляют собой эпитопы сократительного белка флагеллина. При нагревании флагеллин денатурирует, и Н-антиген теряет свою специфичность. Фенол не действует на этот антиген.
Соматический, или О-антиген,связан с клеточной стенкой бактерий. Его основу составляют ЛПС. О-антиген проявляет термостабильные свойства — он не разрушается при длительном кипячении. Однако соматический антиген подвержен действию альдегидов (например, формалина) и спиртов, которые нарушают его структуру.
Капсулъные, или К-антигены,располагаются на поверхности клеточной стенки. Встречаются у бактерий, образующих капсулу. Как правило, К-антигены состоят из кислых полисахаридов (уроновые кислоты). В то же время у бациллы сибирской язвы этот антиген построен из полипептидных цепей. По чувствительности к нагреванию различают три типа К-антигена: А, В, и L. Наибольшая термостабильность характерна для типа А, он не денатурирует даже при длительном кипячении. Тип В выдерживает непродолжительное нагревание (около 1 часа) до 60 "С. Тип L быстро разрушается при этой температуре. Поэтому частичное удаление К-антигена возможно путем длительного кипячения бактериальной культуры.
На поверхности возбудителя брюшного тифа и других энтеробактерий, которые обладают высокой вирулентностью, можно обнаружить особый вариант капсульного антигена. Он получил название антигена вирулентности, или Vi-антигена.Обнаружение этого антигена или специфичных к нему антител имеет большое диагностическое значение.
Антигенными свойствами обладают также бактериальные белковые токсины, ферменты и некоторые другие белки, которые секретируются бактериями в окружающую среду (например, туберкулин). При взаимодействии со специфическими антителами токсины, ферменты и другие биологически активные молекулы бактериального происхождения теряют свою активность. Столбнячный, дифтерийный и ботулинический токсины относятся к числу сильных полноценных антигенов, поэтому их используют для получения анатоксинов для вакцинации людей.
В антигенном составе некоторых бактерий выделяется группа антигенов с сильно выраженной иммуногенностью, чья биологическая активность играет ключевую роль в формировании патогенности возбудителя. Связывание таких антигенов специфическими антителами практически полностью инактивирует вирулентные свойства микроорганизма и обеспечивает иммунитет к нему. Описываемые антигены получили название протективных. Впервые протективный антиген был обнаружен в гнойном отделяемом карбункула, вызванного бациллой сибирской язвы. Это вещество является субъединицей белкового токсина, которая ответственна за активацию других, собственно вирулентных субъединиц — так называемого отечного и летального факторов
2.16 Иммуноглобулины, структура и функции.
Природа иммуноглобулинов.В ответ на введение антигена иммунная система вырабатывает антитела — белки, способные специфически соединяться с антигеном, вызвавшим их образование, и таким образом участвовать в иммунологических реакциях. Относятся антитела к γ-глобулинам, т. е. наименее подвижной в электрическом поле фракции белков сыворотки крови. В организме γ-глобулины вырабатываются особыми клетками — плазмоцитами. γ-глобулины, несущие функции антител, получили название иммуноглобулинов и обозначаются символом Ig. Следовательно, антитела — это иммуноглобулины, вырабатываемые в ответ на введение антигена и способные специфически взаимодействовать с этим же антигеном.
Структура антител.Белки иммуноглобулинов по химическому составу относятся к гликопротеидам, так как состоят из протеина и Сахаров; построены из 18 аминокислот. Имеют видовые отличия, связанные главным образом с набором аминокислот. Их молекулы имеют цилиндрическую форму, они видны в электронном микроскопе. До 80 % иммуноглобулинов имеют константу седиментации 7S; устойчивы к слабым кислотам, щелочам, нагреванию до 60 °С. Выделить иммуноглобулины из сыворотки крови можно физическими и химическими методами (электрофорез, изоэлектрическое осаждение спиртом и кислотами, высаливание, аффинная хроматография и др.). Эти методы используют в производстве при приготовлении иммунобиологических препаратов.
Иммуноглобулины по структуре, антигенным и иммунобиологическим свойствам разделяются на пять классов: IgM, IgG, IgA, IgE, IgD. Иммуноглобулины М, G, А имеют подклассы. Например, IgG имеет четыре подкласса (IgG,, IgG2, IgG3, IgG4). Все классы и подклассы различаются по аминокислотной последовательности.
Молекулы иммуноглобулинов всех пяти классов состоят из полипептидных цепей: двух одинаковых тяжелых цепей Н и двух одинаковых легких цепей — L, соединенных между собой дисульфидными мостиками. Соответственно каждому классу иммуноглобулинов, т.е. М, G, A, E, D, различают пять типов тяжелых цепей: μ (мю), γ (гамма), α (альфа), ε (эпсилон) и Δ (дельта), различающихся по антигенности. Легкие цепи всех пяти классов являются общими и бывают двух типов: κ (каппа) и λ (ламбда); L-цепи иммуноглобулинов различных классов могут вступать в соединение (рекомбинироваться) как с гомологичными, так и с гетерологичными Н-цепями. Однако в одной и той же молекуле могут быть только идентичные L-цепи (κ или λ). Как в Н-, так и в L-цепях имеется вариабельная — V область, в которой последовательность аминокислот непостоянна, и константная — С область с постоянным набором аминокислот. В легких и тяжелых цепях различают NH2- и СООН-концевые группы.
При обработке γ -глобулина меркаптоэтанолом разрушаются дисульфидные связи и молекула иммуноглобулина распадается на отдельные цепи полипептидов. При воздействии протеолитическим ферментом папаином иммуноглобулин расщепляется на три фрагмента: два не кристаллизующихся, содержащих детерминантные группы к антигену и названных Fab-фрагментами I и II и один кристаллизующий Fc-фрагмент. FabI- и FabII-фрагменты сходны по свойствам и аминокислотному составу и отличаются от Fc-фрагмента; Fab-и Fc-фрагменты являются компактными образованиями, соединенными между собой гибкими участками Н-цепи, благодаря чему молекулы иммуноглобулина имеют гибкую структуру.
Как Н-цепи, так и L-цепи имеют отдельные, линейно связанные компактные участки, названные доменами; в Н-цепи их по 4, а в L-цепи — по 2.
Активные центры, или детерминанты, которые формируются в V-областях, занимают примерно 2 % поверхности молекулы иммуноглобулина. В каждой молекуле имеются две детерминанты, относящиеся к гипервариабельным участкам Н-и L-цепей, т. е. каждая молекула иммуноглобулина может связать две молекулы антигена. Поэтому антитела являются двухвалентными.
Типовой структурой молекулы иммуноглобулина является IgG. Остальные классы иммуноглобулинов отличаются от IgG дополнительными элементами организации их молекулы.
В ответ на введение любого антигена могут вырабатываться антитела всех пяти классов. Обычно вначале вырабатывается IgM, затем IgG, остальные — несколько позже.
При отсутствии Т-клеток организм-хозяин весьма восприимчив к атакам вирусов. Так, у бестимусных мышей (мыши nude — голые, или бесшерстные) с врожденным отсутствием зрелых Т-клеток вирус простого герпеса (HSV, от herpes simplex virus), введенный в кожу, вызывает распространяющееся поражение и в конце концов, проникая в центральную нервную систему, гибель животных. Чтобы защитить этих мышей, достаточно вскоре после заражения перенести им HSV-специфичные Т-клетки. Важное значение Т- и В-клеток, противодействующих вирусным инфекциям, будет рассмотрено ниже.
Антитела и комплемент способны ограничить распространение вируса и предотвратить повторную инфекцию
Антитела могут нейтрализовать инфекционность вирусов. Если вирусу удается преодолеть барьеры врожденного иммунитета, он вызывает развитие адаптивного (специфического) иммунного ответа с появлением цитотоксических Т-клеток, хелперных Т-клеток и противовирусных антител. Антитела служат главным препятствием для распространения вируса в другие клетки и ткани, особенно для проникновения его в кровоток. В лимфоидной ткани слизистых оболочек образуются преимущественно антитела класса IgA, предотвращающие повторную инфекцию.
Антитела могут быть направлены против любого вирусного антигена, синтезируемого в инфицированной клетке, однако сдерживание инфекции обеспечивают только те из антител, которые специфичны к гликопротеинам, экспрессированным на оболочке вирусов иди на мембране инфицированных клеток. Механизмы гуморального противовирусного иммунитета могут быть различными. Так, способ устранения инфекционности вирусных частиц зависит от их локализации - внеклеточной или внутриклеточной (рис. 16.5). О действии in vivo защитных механизмов, перечисленных на рис. 16.5, свидетельствует то, что инъекция моноклональных вирус-нейтрализующих антител весьма эффективно угнетает репродукцию вирусов. Присутствие в кровотоке нейтрализующих вирус антител - это и важный фактор предотвращения повторной инфекции.
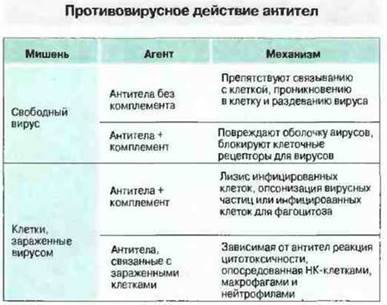
Рис. 16.5. Антитела нейтрализуют свободные вирусные частицы или участвуют в разрушении инфицированных вирусами клеток.
Комплемент участвует в нейтрализации внеклеточных вирусов некоторых видов. Комплемент также способен повреждать оболочку вируса - осуществлять виролиз. Некоторые вирусы непосредственно вызывают активацию комплемента по классическому или альтернативному пути. Тем не менее комплемент не рассматривают как главный фактор защиты против вирусов, поскольку при недостаточности компонентов системы комплемента не отмечено предрасположенности к тяжелым вирусным инфекциям у человека.
Антитела мобилизуют комплемент и/или эффекторные клетки для разрушения инфицированных вирусами клеток организма. Действие антител, помимо нейтрализации внеклеточных вирусов, состоит в том, что они вызывают разрушение инфицированных вирусами клеток, активируя систему комплемента. В результате его активации происходит сборка лизирующего мембрану комплекса и лизис зараженных клеток (см. гл. 4). Комплемент-зависимый цитолиз возможен лишь при высокой плотности экспрессии вирусных антигенов па клеточной мембране (примерно 5 х 10 6 на клетку). В противоположность этому, для лизиса по механизму АЗКЦ необходимо присутствие на поверхности клетки-мишени лишь 10 3 молекул IgG — такое количество обеспечивает связывание с ней НК-клеток. Эти клетки связываются с нагруженной антителами мишенью через FcγRIII (CD16) и быстро разрушают ее посредством перфоринов (см. гл. 10). Насколько важен in vivo каждый из этих механизмов, пока трудно понять. Лучшее доказательство в пользу АЗКЦ получено на мышах при изучении защитного эффекта противовирусных моноклональных антител; не проявляя нейтрализующей активности in vitro, они оказались способны защитить С5-дефицитных животных при введении им высокой дозы вируса. (Эта линия мышей была использована для того, чтобы исключить антивирусный эффект терминальных компонентов системы комплемента.)
Т-клетки участвуют в формировании и действии противовирусного иммунитета несколькими путями
В иммунитете к вирусным инфекциям Т-клетки выполняют разнообразные функции. Образование антител в ответ на большинство антигенов зависит от тимуса, поскольку для переключения изотипа и созревания аффинности необходимо участие Т-клеток CD4 + . Кроме того, эти клетки помогают в индукции цитотоксических Т-клеток CD8 + , а также в привлечении макрофагов в очаг вирусной инфекции и в их активации.
Цитотоксические Т-клетки CD8 + . Это главная Т-клеточная система для осуществления в организме противовирусного иммунологического надзора, и действует она весьма эффективно и избирательно. Цитотоксические Т-клетки CD8 + , рестриктированные по антигенам МНС класса I, скапливаются в очагах размножения вирусов и разрушают инфицированные ими клетки. Данный механизм иммунологического надзора, по-видимому, весьма важен, так как фактически все клетки тела экспрессируют молекулы МНС класса I.
Процессинг и презентация вирусных белков. Вероятно, любой вирусный белок может быть процессирован в цитоплазме АПК с образованием пептидов, которые затем транспортируются к эндоплазматическому ретикулуму и ассоциируют с молекулами МНС класса I. Для организма-хозяина это создает определенные преимущества, так как белки вируса, экспрессируемые клеткой в начале цикла его размножения, становятся доступными для Т-клеточного распознавания задолго до появления нового поколения вирусных частиц. Например, Т-клеточный иммунитет к цитомегаловирусной инфекции у мыши специфичен в отношении наиболее раннего вирусного белка рр89. Его протективный эпитоп определен как пептид L b , состоящий из девяти аминокислотных остатков и презентируемый молекулой МНС класса I. Иммунизация мышеи рекомбинантным вирусом коровьей оспы, несущим ген рр89, полностью защищает их от инфекции CMV. Делеция участка ДНК, кодирующего нано-пептид L d , лишает белок рр89, экспрессируемый вирусом коровьей оспы, протективной активности.
Важность Т-клеточных механизмов в противовирусном иммунитете in vivo установлена различными способами:
• путем адоптивного переноса антигенспецифичных субпопуляций или клонов Т-клеток зараженным животным для проверки на способность устранения вируса;
• на животных, лишенных Т-клеток CD4 + или CD8 + путем введения специфических моноклональных антител, и
• на мышах, избирательно лишенных эмбриональных генов CD4, CD8 и β2-микроглобулина методом генного нокаута.
Как установлено, мыши, лишенные методом генного нокаута определенных субпопуляций лимфоцитов, сохраняют способность к иммунному ответу на вирусную инфекцию. Можно рассматривать это как хорошую иллюстрацию многократного функционального дублирования, вероятно свойственного иммунной системе. Например, Т-клетки CD4 + в отсутствие Т-клеток CD8 + могут компенсировать иммунологическую недостаточность и устранять инфекцию.
Т-клетки CD4 + способны выполнять важные эффекторные функции в иммунном ответе на вирусную инфекцию. В иммунном ответе на инфекцию эпителиальных покровов, вызванную вирусом простого герпеса I типа (HSV-I), главной эффекторной клеточной популяцией служат Т-клетки CD4 + . Они, как и в реакциях гиперчувствительности замедленного типа (см. гл. 26), мобилизуют и привлекают макрофаги, и эго ускоряет ликвидацию вируса. Макрофаги служат важными участниками этого процесса (рис. 16.6). В качестве ключевых цитокинов в ответе на герпесвирусную инфекцию действует ИФγ, необходимый для активации моноцитов, и фактор некроза опухолей (ФИО), оказывающий ряд противовирусных эффектов, сходных с эффектами ИФγ, но осуществляемых иными путями.

Рис. 16.6. При кожной герпесвирусной (HSV) инфекции в качестве защитных факторов действуют Т-клетки СD4 + , макрофаги и ИФγ. Т-клетки CD4 + получали от мышей, зараженных HSV за 8 сут до опыта, и переносили сингенным мышам, вскоре после этого зараженным HSV внутрикожно. Одной группе этих мышей вводили антитела к CR3 (чтобы блокировать миграцию макрофагов в место заражения), другой - антитела к ИФγ (чтобы блокировать активацию макрофагов), остальные животные служили контролем. Мышей дополнительной контрольной группы заражали, но не переносили им Т-клетки CD4 + . Через 5 сут после заражения определяли количество оставшегося инфекционного вируса. Результаты показывают, что протективный эффект Т-клеток CD4 + реализуется при участии макрофагов и ИФγ.
Цитотоксические Т-клетки CD4 + . При заражении вирусом кори в организме образуются цитотоксические Т-клетки CD4 + , которые распознают и лизируют инфицированные вирусом клетки-мишени, экспрессирующие молекулы МНС класса II. Это указывает, что процессинг и презентация антигенов вируса кори происходят обычным способом — путем фагоцитоза и расщепления (см. гл. 9). Однако существует, предположительно, и другой, еще неизвестный механизм, посредством которого белки или пептиды вируса кори перемещаются из цитозоля в везикулы класса II.
Защитные противовирусные механизмы обобщенно представлены на рис. 16.7, а динамика их индукции — на рис. 16.8.

Рис. 16.7. Проникновению вирусов в клетки слизистой оболочки препятствуют антитела IgA. После первоначального инфицирования вирус может поражать и другие ткани, распространяясь с кровью. Интерфероны, образующиеся как факторы врожденного (ИФα и ИФβ) и приобретенного (ИФγ) иммунитета, делают близлежащие клетки устойчивыми к инфицированию распространяющимся вирусом. Антитела нужны для устранения свободных вирусных частиц, а Т- и НК-клетки — для разрушения инфицированных вирусом клеток-мишеней. (АЗКЦ - антителозависимая клеточноопосредованная цитотоксичность.)

Рис. 16.8. Динамика обнаружения факторов иммунитета при ответе на типичную вирусную инфекцию. После заражения вирусом (например, гриппа или герпеса) в крови и в инфицированных тканях раньше всего выявляются НК-клетки и интерферон. Затем в регионарных лимфоузлах или селезенке обнаруживаются активированные цитотоксические Т-клетки (Тц). После этого в сыворотке начинают определяться нейтрализующие вирус антитела. Активированные цитотоксические Т-клетки исчезают уже на второй или третьей неделе, но им на смену появляются Т-клетки иммунологической памяти, способные сохраняться многие годы.
Биологическая библиотека - материалы для студентов, учителей, учеников и их родителей.
Наш сайт не претендует на авторство размещенных материалов. Мы только конвертируем в удобный формат материалы, которые находятся в открытом доступе и присланные нашими посетителями.
Если вы являетесь обладателем авторского права на любой размещенный у нас материал и намерены удалить его или получить ссылки на место коммерческого размещения материалов, обратитесь для согласования к администратору сайта.
Разрешается копировать материалы с обязательной гипертекстовой ссылкой на сайт, будьте благодарными мы затратили много усилий чтобы привести информацию в удобный вид.
Читайте также:


