Эозинофильный фасциит что это такое
Эозинофильный фасциит – идиопатическое, фиброзное расстройство с гистологическими признаками фасциального фиброза. Эозинофильный фасциит – острое болезненное расстройство, которое проявляется в виде сильного опухания конечностей с развитием кожного фиброза. Контрактуры суставов, артриты, невропатии и дерматомиозит также могут проявляться у некоторых лиц с эозинофильным фасцитом. Многие исследователи считают эозинофильный фасциит вариантом другого кожного заболевания - морфеа, а другие считают его совсем отдельным заболеванием.
Эозинофильный фасциит. Эпидемиология
Эозинофильный фасциит — редкое расстройство, точная распространенность неизвестна
Эозинофильный фасциит. Причины
Этиология эозинофильного фасциита неизвестна, но некоторые исследователи связывают это расстройство с аберрантным иммунным ответом. Кроме того, токсичные, экологические факторы, некоторые препарата, также могут быть причиной развития эозинофильного фасциита у некоторых лиц.
У некоторых людей с эозинофильным фасциитом также были обнаружены Borrelia burgdorferi, которые могут быть возможным возбудителем фасциита. Тем не менее, исследователям так и не удалось указать на связь между эозинофильным фасциитом и инфекцией Borrelia. Borrelia можно определить путем прямого микроскопического исследования образцов тканей или с помощью полимеразной цепной реакции. Положительный ответ от проведения этих тестов может подтолкнуть клинициста к правильной диагностике эозинофильного фасциита.
В пробирке, анализ фибробластов из полученных на биопсии фасций может указать на повышенное производство мРНК коллагена типов I, III, и IV, по сравнению со смежными дермальными фибробластами. Кроме того, фасциальные фибробласты могут вырабатывать трансформирующий фактор роста бета-I и фактор роста соединительной ткани, которые могут быть основной причиной фиброза. Дегрануляции эозинофилов могут привести к активации фибробластов.
Дальнейшее изучение эозинофильного фасциита может указать на повышенные уровни трансформирующего фактора роста-бета и интерлейкина 5, которые можно нормализовать кортикостероидной терапией. Другие исследования показывает, что фасциальные воспалительные инфильтраты в основном состоят из CD8 + Т-лимфоцитов, макрофагов, эозинофилов, что свидетельствует о возможной цитотоксической иммунной реакции в ответ на наличие возможных инфекционных агентов или факторов из окружающей среды.
И совсем недавно, при проведении других исследований были обнаружены повышенные сывороточные уровни супероксиддисмутазы марганца и тканевого ингибитора металлопротеиназы (ТIMP-1). Уровни TIMP-1 в сыворотке могут также служить в качестве маркера тяжести заболевания.
Эозинофильный фасциит. Фото

Гипопигментация, уплотненя на правой ноге

Уплотнение, склероз и гипопигментация

На фото проявления 2-х недельного эозинофильного фасциита. Эритема, алопеция и уплотнения

Эритема, отек, алопеция и уплотнения

Полный склероз и уплотнения с пятнистой эритемой
Эозинофильный фасциит. Симптомы и проявления
Эозинофильный фасциит имеет внезапное и болезненное начало развития, с последующим отеком ног и с образованием эритематозных площадей. Это расстройства прогрессирует быстро, в течение от нескольких недель до месяцев, у пациентов может развиться жесткость и уплотнение кожи, в результате чего могут развиться характерные контрактуры в сгибательных областях с нарушением подвижности суставов. Предплечья, ноги, бедра и туловище страдают чаще всего (в порядке убывания по частоте). Целых 50% пациентов сообщают о том, что именно тяжелая физическая тренировка непосредственно предшествует началу болезни. Недомогание, слабость и лихорадка часто присутствуют у большинства пациентов. В одном из исследований, проведенном в 2008 году, исследователи выяснили, что усталость была наиболее распространенным симптомом. Боль и зуд также являются частыми жалобами, но они не так распространены как усталость. Из всех опрошенных пациентов, 62% имели сразу усталость, боль и зуд. Явный артрит встречается у 40% больных.
Клиническая картина эозинофильного фасциита проходит через 3 этапа. Некоторые этапы могут присутствовать одновременно и в разных участках тела. Первый этап представляет собой симметричную, диффузную эритематозную болезненность конечностей, с последующим переходом в отечную стадию, при которой развиваются специфические ямочки. Последний этап включает в себя развитие ряби на коже с участками гипопигментации, уплотнений и упругости.
В пострадавших областях, кожа и подкожные ткани сильно связаны друг с другом, у таких пациентов кожа будет тяжело оттягиваться. Хотя конечности страдают чаще всего (88%), у некоторых пациентов может также пострадать туловище.
- Контрактуры в локтях, запястье, лодыжках, коленях, плечах могут быть обнаружены у 55-75% больных.
- Кистевой туннельный синдром присутствует у 20% больных.
- Воспалительный артрит присутствует у целых 40% пациентов.
- Субклинический миозит присутствует у меньшинства пациентов.
- В отличие от склеродермии, явление Рейно, аномальные капилляры ногтевого валика и склеродактилия отсутствуют.
Эозинофильный фасциит. Диагностика
- При проведении полного анализа крови можно обнаружить эозинофилияю у 80-90% больных. Кроме того, панцитопения, анемия, тромбоцитопения также могут возникнуть на фоне эозинофильного фасциита.
- Скорость оседания эритроцитов повышается у 60-80% больных эозинофильным фасциитом.
- Уровни иммуноглобулинов завышены, как правило, это касается поликлонального иммуноглобулина G.
- Уровни ферментов мышц иногда повышены, особенно альдолазы.
- Результат анализа на антиядерные антитела иногда положительный.
- Результат анализа на ревматоидный фактор иногда положительный.
При наличии клинических показаний, МРТ может показывать сигнал высокой интенсивности в фасциях. По мнению некоторых исследователей, эти данные могут быть использованы в определении места биопсии, а также для мониторинга ответа на терапию.
- При наличии клинических показаний может быть применена электромиограмма.
- Биопсия
Наиболее глубокие изменения, связанные с эозинофильным фасциитом, происходят в поверхностных фасциях, которые могут стать заметно утолщенными, фиброзными и склеротическими. На ранних стадиях, фибриноидный некроз или миксоидная дегенерация могут быть обнаруженны. Фиброз распространяется в перегородках из подкожного жира, который завлекает жир в пересекающиеся фиброзные полосы. Фиброзный процесс также может распространиться в нижние слои дермы и в мускулатуру. В мышцах могут быть обнаруженны точечные некротические процессы и вырождение тканей.
Воспалительный инфильтрат, как правило, состоит из лимфоцитов, гистиоцитов, плазматических клеток и эозинофилов. Воспалительный инфильтрат можно обнаружить в низких слоях дермы, в перегородках и в мышцах.
Эозинофильный фасциит. Лечение
Многие случаи эозинофильного фасциита реагируют на кортикостероиды (88%, из них 25% достигает полного ответа), хотя в некоторых случаях может произойти спонтанное излечение. Полное восстановление может занять до 1-3 лет. Лучший ответ достигается при введении высоких доз кортикостероидов, особенно если терапия иницируется на ранних этапах болезни.
В литературе также были обнаружены сообщения, что некоторые лица вообще не отвечали на кортикостероидную терапию и таким людям назначались дополнительные терапии.
Такие дополнительные лекарства включают гидроксихлорохин, колхицин, циметидин, циклоспорин, азатиоприн, метотрексат. Также, уже сегодня доступны новые препараты, которые можно использовать в качестве добавок к кортикостероидам или в качестве монотерапевтических средств. Эти препараты включают инфликсимаб, циклофосфамид, дапсона, ретиноидоподобный UVA1 и псорален плюс UVA (PUVA).
В одном из исследований, в которых принимали участия три человека с стероид-устойчивым эозинофильным фасциитом, все пациенты показали улучшение в уплотнении кожи и в тяжести контрактур суставов после применения инфликсимаба в дозе 3 мг/кг (на протяжении 8 недель).
Хирургическая декомпрессия кистевого туннельного синдрома может потребоваться для некоторых пациентов с эозинофильным фасциитом.
Эозинофильный фасциит. Осложнения
Апластическая анемия и другие формы миелодисплазий могут осложнить эозинофильный фасциит. Некоторые исследователи выступают за анализ костного мозга у всех больных эозинофильным фасциитом. Другие недавние исследования указывают на связь между эозинофильным фасциитом и множественной миеломой, истинной полицитемией, периферической Т-клеточной лимфомой, иммуноглобулиновой нефропатией, и идиопатической гиперкальциемией.
Эозинофильный фасциит. Прогноз
Конечная стадия фиброзного процесса приводит к развитию существенных проблем из-за склероза кожи и контрактур суставов. Кроме того, артрит, невропатии, дерматомиозит также могут присутствовать у некоторых пациентов. У 10% пациентов может развиться миелодисплазия, например апластическая анемия, которая предвещает плохой прогноз. Однако, в некоторых случаях возможно спонтанное выздоровление, а если оно и не произойдет, то лечение кортикостероидами или другими, уже описанными агентами, сможет привести к восстановлению.
В целом, прогноз для пациентов с эозинофильным фасциитом хороший. Большинство пациентов могут ожидать на частичное или полное выздоровление.
Фасциит — воспалительное заболевание соединительной ткани, окружающей мышцы, нервы и сосуды (фасции). Эозинофильный фасциит (синдром Шульмана) является одной из форм этой патологии и относится к диффузным заболеваниям соединительной ткани. Полное название синдрома — диффузный эозинофильный фасциит. В отличие от других заболеваний этой категории он ограничивается проявлениями на руках и ногах больного.
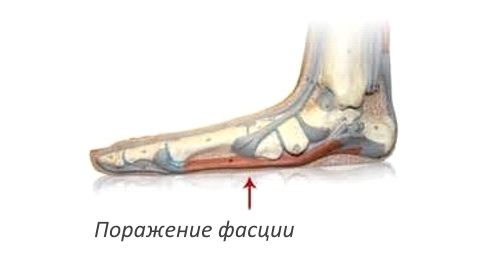
До середины 70-х годов ХХ века не существовало отдельного описания этой патологии, пока ревматолог Л.Шульман не охарактеризовал его в качестве нового синдрома. Точных данных о распространении этого заболевания нет, но оно считается редким. Подробных описаний течения болезни существует немногим более сотни. Отмечается поражение лиц мужского пола, женщины болеют примерно в 2 раза реже.
Симптомы заболевания
Симптоматика эозинофильного фасциита нечеткая. Многие его клинические проявления свойственны и другим болезням, а начало чаще всего бывает похоже на склеродермию. Отдельный набор симптомов, присущий лишь синдрому Шульмана, трудно выделить. Пациенты жалуются на весьма сильные боли, отеки и развитие кожного фиброза с разрастанием рубцовых поражений. Менее распространены боли в суставах и кистевой туннельный синдром, у некоторых больных возникают контрактуры суставов, артриты и невропатии.

Эозинофильному фасцииту свойственно внезапное начало с быстрым развитием, сопровождающимся интенсивным болевым синдромом. Первым обычно появляется ощущение стягивания кожи, образуются участки уплотнений, поверхность в этих местах становится блестящей, внешний вид пораженного участка иногда похож на апельсиновую корку. Такие симптомы вначале локализуются на голенях и предплечьях. В течение нескольких недель нарастает отечность ног, затем возникает эрозия кожных покровов, аналогичная проявлениям волчанки. Часто нарушается подвижность суставов (преимущественно пальцев ног и рук).
Уплотнения могут распространиться на плечи и бедра, крайне редко достигают шеи, живота или лица. При этом кожа в очагах из-за многочисленных бугорков порой напоминает рябь на воде. Волосяной покров на охваченных поражением участках становится скудным и может исчезнуть совсем. На фото видны характерные признаки проявлений.

Несмотря на боли в суставах и мышцах, клиническое обследование обычно не выявляет признаков артрита или миозита, суставы не изменены. Также не отмечается ни поражений внутренних органов, ни нарушений трофики тканей. Преобладающей зоной проявлений являются конечности (88% случаев), но заболевание может охватить и туловище.
Постановка диагноза
Главным диагностическим признаком синдрома Шульмана является значительный рост числа эозинофилов в крови (до 45%), именно этот показатель отмечен в названии патологии. Также фиксируется завышенный уровень гамма-глобулинов (чаще всего за счет иммуноглобулина типа G). У половины больных повышается скорость оседания эритроцитов (СОЭ), этот показатель может достигать 50 мм/ч, но чаще бывает в диапазоне 20–30 мм/ч, иногда отмечается повышение С-реактивного белка (СРБ) и ревматоидного фактора.
При обследовании на МРТ можно обнаружить сигнал высокой интенсивности в фасциях. Эти данные играют роль при определении места биопсии и для мониторинга эффективности терапии. Важное значение при биопсии имеет забор максимального слоя пораженных тканей: эпителия, подкожной клетчатки, фасции, мышцы.
Гистология полученного биоматериала показывает значительные патологии, связанные с болезнью. Отмечаются изменения в поверхностных фасциях, толщина которых существенно увеличена, а структура характеризуется фиброзами и склеротическими поражениями. Фиброзный процесс из подкожного жира может распространиться в мышечные волокна и нижние слои кожи, там обнаруживаются очаговые некротические и дегенеративные явления. Воспалительный инфильтрат находится в слоях дермы, перегородках и мышцах, преимущественно он состоит из лимфоцитов, эозинофилов, гистиоцитов и клеток плазмы.
Малая распространенность синдрома Шульмана и, как следствие, малая изученность этой патологии может приводить к диагностическим ошибкам. Врачи принимают симптомы диффузного фасциита за проявления склеродермии, ревматоидного артрита (либо других аутоиммунных болезней), миозита, тендовагинита и др. По оценкам некоторых специалистов, степень ошибочных диагнозов достигает 80%.
Причины заболевания
Этиология и патогенез заболевания пока исследованы не так хорошо, чтобы уверенно говорить о причинах, но уже собрана достаточная база для определения провоцирующих факторов:
- переохлаждение;
- чрезмерные физические нагрузки, избыточные спортивные тренировки;
- травмы;
- последствия острой инфекции или аллергического состояния;
- воздействие токсинов;
- стрессы на фоне подверженности психосоматическим явлениям;
- генетическая предрасположенность.

Иммунные нарушения имеют серьезную значимость в механизмах развития этого синдрома. Об этом говорит как существенное повышение глобулинов класса G, так и тот факт, что воспалительные явления в глубоких фасциях и близлежащих тканях чаще всего имеют иммунную природу. В последнее время появились убедительные гипотезы, основанные на различных аспектах аномального иммунного ответа организма на патогенные факторы, но процесс изучения еще далек от завершения.
Лечение эозинофильного фасциита
Лечение всех диффузных заболеваний соединительной ткани (ДЗСТ) является длительным комплексным процессом. Эозинофильный фасциит требует такого же подхода. Важно начать лечение как можно раньше, но в связи с проблемами диагностики начало адекватной терапии бывает запоздалым. В истории медицинских наблюдений описаны случаи самопроизвольного излечения больных, но надеяться на подобный исход не стоит.

Среди препаратов, показанных при лечении синдрома Шульмана, на первом месте находятся глюкокортикостероиды, из которых более часто применяется Преднизолон. Поскольку лечение осуществляется только специалистом, он определяет точную дозировку, длительность курса и режим терапии. Обычно суточная доза препарата составляет 20–30 мг, но может быть повышена в 2 раза. На ранних этапах болезни эффективность высоких доз кортикостероидов оказывается максимальной. Продолжительность курса преднизолона зависит от тяжести заболевания и обычно проходит в 2 этапа:
- до наступления первых признаков снижения активной фазы болезни дозировка поддерживается неизменной;
- после отмечаемого пациентом и врачом уменьшения интенсивности симптомов и улучшения состояния дозировка значительно уменьшается.
Длительность поддерживающей стероидной терапии может превышать несколько месяцев и даже лет. Применение препаратов группы НПВС (таких, как Анальгин, Ибупрофен, Диклофенак, Мовалис и др.) обычно неоправданно ввиду малой эффективности.
Восприимчивость больных к терапии Преднизолоном весьма высока (до 90%), но в случае отсутствия прогресса при лечении медикаментозное воздействие расширяют за счет цитостатиков, чаще всего из этой группы применяют Азатиоприн. Это мощное средство, оказывающее не только цитостатическое, но и иммуносупресивное воздействие, а подавление иммунной реакции организма имеет важное значение в лечении всех заболеваний группы ДЗСТ.
Длительность курса приема Азатиоприна может составлять несколько месяцев. Иногда применяются Инфликсимаб, Циклофосфамид, Дапсон и другие препараты. В медицинских источниках описано лечение 3 пациентов с эозинофильным фасциитом, у которых наблюдалось стойкое отсутствие отклика на терапию кортикостероидами. У всех больных зафиксировано уменьшение размеров и количества уплотнений кожи и существенное снижение тяжести контрактур суставов после применения Инфликсимаба в течение 2 месяцев.
Диффузный фасциит может быть осложнен некоторыми патологиями, среди которых:
- различные формы миелодисплазии (например, апластическая анемия);
- множественная миелома;
- идиопатическая гиперкальциемия и другие.
Некоторые из них способны развиваться под влиянием фасциита.
Обычно лечение ограничивается консервативными методами. Но описаны случаи, когда требовалось хирургическое вмешательство. Операция помогает снять декомпрессию при кистевом туннельном синдроме, иногда сопутствующем болезни.
Следует понимать, что из-за малой распространенности синдрома Шульмана лечение в каждом случае сопровождается подробным описанием процесса и публикацией результатов, это важно для медицинского сообщества. Подобные описания имеют научную ценность, они служат базой для дальнейшего использования в медицинской практике врачей всего мира.
Фиброзный процесс, склероз кожи, контрактуры суставов, артриты, дерматомиозиты и другие проявления диффузного фасциита приводят к значительному осложнению жизни больного, поэтому лечение даже теми медикаментами, которые имеют ряд серьезных побочных эффектов, должно проводиться без промедления. Терапия кортикостероидами и другими препаратами может привести к восстановлению нормальной жизни. Прогноз для больных диффузным фасциитом в целом благоприятный, частичное или полное выздоровление в результате лечения наступает практически всегда.
Диффузный эозинофильный фасциит (ДЭФ) — относительно редкое системное заболевание соединительной ткани с преимущественным поражением глубокой фасции (воспаление с исходом в фиброз), подкожной клетчатки и подлежащих мышц и дермы, сопровождающееся эозинофилией и гипергаммаглобулинемией.
Как самостоятельная нозологическая форма заболевание выделено в 1974 г. L. Е. Shulman из склеродермической группы болезней. ДЭФ развивается преимущественно в возрасте 25-60 лет, хотя возможно возникновение заболевания в детском и пожилом возрасте. Мужчины болеют в 2 раза чаще, чем женщины.
Этиология и патогенез
Этиология и патогенез заболевания изучены недостаточно. Среди провоцирующих факторов, способствующих развитию ДЭФ, отмечают чрезмерную или необычную для больного физическую нагрузку (физическое перенапряжение), в частности поднятие тяжестей, спортивные перетренировки. Из других предшествующих факторов следует отметить переохлаждение, травмы, операции, нервно-психическое перенапряжение и стрессы. Предполагается также роль генетической предрасположенности. В патогенезе ДЭФ центральное место занимают иммунные нарушения, что подтверждается наличием гипергаммаглобулинемии, повышением содержания иммуноглобулинов, особенно иммуноглобулина G, циркулирующих иммунных комплексов и развитием иммунного воспаления в глубокой фасции и близлежащих тканях.
Заболевание обычно начинается остро с возникновения характерных изменений в течение первого месяца (и даже недели), хотя возможно и постепенное начало с медленным прогрессированием заболевания. Начало болезни может совпадать с физическим перенапряжением.
Пораженные ткани отечны и напряжены. Несмотря на то, что кожные покровы над ними не вовлечены в процесс, кожа в этих участках выглядит сморщенной. При эозинофильном фасциите нередко развиваются сгибательные контрактуры локтевых и коленных суставов, редко — пальцев кистей. У части больных отмечаются полиартралгии.
Диагностика
Из лабораторных показателей диагностическим признаком болезни считается эозинофилия (до 50%). Периферическая и тканевая эозинофилия выявляется обычно в раннем периоде заболевания, а в дальнейшем может уменьшиться или полностью исчезнуть, особенно при назначении ГКС. Могут также наблюдаться: увеличение СОЭ, наличие СРБ, гиперα2- и γ-глобулинемия, повышение содержания в сыворотке крови серомукоида, фибриногена, церулоплазмина, иммуноглобулинов G и М, ЦИК, повышение титра антинуклеарных и ревматоидного факторов. Это отражает воспалительную и иммунологическую активность заболевания.
При морфологическом исследовании патологические изменения обнаруживаются преимущественно в фасциях и прилежащих тканях. В раннем периоде ДЭФ утолщенная и отечная фасция содержит набухшие коллагеновые волокна, инфильтрирована лимфоплазмоцитарными клетками, гистиоцитами и эозинофилами. Аналогичная инфильтрация выявляется в подкожной клетчатке, нижних слоях дермы и участках мышцы, прилегающих к фасции. В поздних стадиях наблюдается преобладание склероза и гиалиноза в фасции и прилегающих тканях, уменьшение или исчезновение клеточной инфильтрации и экссудативных процессов.
Диагноз ДЭФ основывается в первую очередь на сочетании характерных клинических (уплотнение тканей преимущественно в области предплечий и голеней с нарушением объема движений и развитием сгибательных контрактур) и лабораторных (эозинофилия, гипергаммаглобулинемии) признаков болезни. При постановке диагноза следует также учитывать связь с предшествующим физическим перенапряжением, преимущественное поражение мужчин и острое начало заболевания. Диагноз ДЭФ должен быть подтвержден морфологическим исследованием биоптатов фасции и прилежащих тканей.
Лечение ДЭФ должно быть длительным и систематическим. Терапия более эффективна в раннем периоде болезни. Прежде всего назначаются кортикостероиды, главным образом преднизолон в начальной дозе 20-40 мг в сутки. После достижения клинического эффекта доза постепенно снижается до поддерживающей — 5-10 мг в сутки. В такой дозе преднизолон может применяться в течение многих месяцев и даже лет. Лечение стероидами может комбинироваться с НПВП (мелоксикам, диклофенак и др.) и аминохинолиновыми производными. При неэффективности гормонотерапии дополнительно назначаются иммуносупрессоры, преимущественно азатиоприн по 150 мг в сутки в течение нескольких месяцев.
Показано применение при ДЭФ антифиброзных средств, в частности тиоловых соединений и димексида.
Д-пеницилламин назначается по 450-600 мг в сутки, унитиол вводится внутримышечно ежедневно по 5-10 мл 5% раствора в течение 30-40 дней или методом суперэлектрофореза с димексидом (20-25 ежедневных сеансов на курс лечения). Используются также аппликации 50% раствора димексида.
Определенный клинический эффект оказывает используемая в последние годы карбогемосорбция. При невысокой активности патологического процесса проводится массаж и лечебная физкультура.
- Что такое Диффузный (эозинофильный) фасциит
- Что провоцирует Диффузный (эозинофильный) фасциит
- Симптомы Диффузного (эозинофильного) фасциита
- Диагностика Диффузного (эозинофильного) фасциита
- Лечение Диффузного (эозинофильного) фасциита
- Профилактика Диффузного (эозинофильного) фасциита
- К каким докторам следует обращаться если у Вас Диффузный (эозинофильный) фасциит
Что такое Диффузный (эозинофильный) фасциит
Диффузный (эозинофильный) фасциитД(Э)Ф-системное заболевание соединительной ткани с преимущественным поражением глубокой фасции (воспаление с исходом в фиброз), подкожной клетчатки и подлежащих мышц и дермы, сопровождающееся эозинофилией и гипергаммаглобулинемией. ЭФ был выделен в 1975 г. L. Е. Shulman из системной склеродермии как склеродер моподобный синдром.
- Эпидемиология
Д(Э)Ф не изучен изза относительной редкости заболевания. Очевидно широкое распространение заболевания, поскольку по данным литературы известно более 100 наблюдений за больными из различных стран мира. В нашей стране первое описание ЭФ относится к 1978 г., всего описано 15 случаев. Среди заболевших ЭФ преобладают мужчины среднего возраста, но болеют дети и пожилые люди.
- Патоморфология
Изучена достаточно хорошо благодаря исследованию биоптата кожи, подлежащих тканей и мышц. Эпидермис и верхние слои дермы обычно нормальные, иногда утолщены, отечны. В глубоких слоях дермы и в подкожной клетчатке по соединительнотканным прослойкам обнаруживаются периваскулярные гистиоцитарные инфильтраты с включением отдельных эозинофилов и развитием фиброза. Особенно значительные изменения обнаруживаются в фасции - она утолщена во много раз по сравнению с нормой, инфильтрирована большим количеством лимфоцитов и гистиоцитов с примесью плазматических клеток и эозинофилов. В фасции определяются фибрино идные изменения коллагеновых волокон вплоть до фибриноид ного некроза. В последующем в фасции развивается фиброз. Соединительнотканные прослойки с выраженными признаками воспалительной инфильтрации; иногда наблюдаются признаки повреждения мышечных волокон. В поздних стадиях болезни, при преобладании процессов склероза в пораженных тканях, дифференциальная диагностика с ССД затруднена.
Этиология и патогенез заболевания изучены недостаточно. В качестве провоцирующих факторов фигурируют чрезмерное охлаждение, физическое перенапряжение, например, ношение тяжестей, спортивные перетренировки, травмы. Реже Д(Э)Ф развивается после острой инфекции или аллергической реакции. Возможно, играет роль генетическое предрасположение. Например, М. Thibierge отмечает в семьях больных случаи очаговой склеродермии, РА, сахарного диабета.
Среди механизмов развития Д(Э)Ф значительное внимание уделяется иммунным нарушениям, что проявляется гипергамма глобулинемией и повышением содержания иммуноглобулинов, особенно IgG, циркулирующих иммунных комплексов и развитием иммунного по своей сути воспаления в глубокой фасции и близлежащих тканях. S. J. Wasserman и соавт. предложили оригинальную гипотезу патогенеза ЭФ, в соответствии с которой начальным звеном является антигенная альтерация наиболее пораженных при болезни тканей, включая мышцы, в результате чрезмерной физической нагрузки или другой причины с поступлением в очаг поражения эозинофилов, возможно, обусловленным лимфокинной и иммунокомплексной или специфической эозинофильной активностью. Привлеченные в пораженные ткани фагоциты стимулируют развитие воспаления и фиброза, представляющих основные клинические проявления болезни. Интересна также концепция G. Solomon и соавт., в основу которой положено преимущественное нарушение клеточного иммунитета, вовлечение субпопуляции Тлимфоцитов, обладающих Н2рецепторами. Авторы получили удовлетворительный эффект от применения циметидина, являющегося антагонистом Н2рецепторов. Следовательно, вопросы этиологии патогенеза ЭФ еще не решены, однако особенностью болезни является избыточная эозинофилотаксическая активность, определяющаяся у большинства больных, а также нарушение функции Тсупрес соров. Различные взаимоотношения основных патогенетических процессов определяют клинические особенности течения Д(Э)Ф.
Клиническая картина характериуется уплотнением мягких тканей верхних и нижних конечностей с нарушением их двигательной активности, вплоть до развития сгибательных контрактур в различных суставах, преимущественно пальцев рук.
Один из наиболее ранних признаков болезни - появление чувства стягивания кожи в области верхних и (или) нижних конечностей, ощущение набухания и плотности, реже зуда. Почти одновременно отмечается ограничение движений в руках, слабость в ногах при подъеме по лестнице. Характерно развитие уплотнения мягких тканей предплечий и (или) голеней, распространяющегося на плечи и бедра, появляющегося на протяжении нескольких месяцев или даже дней. Крайне редко умеренное уплотнение обнаруживается на шее, лице, животе или на туловище. Уплотнения, как правило, неболезненны, хотя изредка больные жалуются на умеренные спонтанные боли в этих участках.
Суставы не изменены, артриты не выявляются, но у ряда больных могут наблюдаться полиартралгии как проявление общей активности болезни. Значительно чаще больные жалуются на полимиалгию и мышечную слабость, хотя клинически признаки миозита не обнаруживаются.
Поражений внутренних органов, сосудистых расстройств, включая синдром Рейно, какихлибо нарушений трофики не отмечается, что и отличает ЭФ от ССД. Может быть непостоянный субфебрилитет.
Среди лабораторных показателей диагностическое значение имеет эозинофилия до 10-44 %, сопровождающаяся гипергам маглобулинемией. У 50 % больных увеличена СОЭ до 20- 30 мм/ч, реже до 50 мм/ч, отмечается повышение СРБ. В острой стадии болезни повышается содержание серомукоида, фибриногена, церулоплазмина у /з больных, но незначительно.
Изменения гуморального иммунитета нехарактерны. Чаще повышается количество IgG, реже выявляются ЦИК и крайне редко АНФ.
Диагностическое значение имеет биопсия всего комплекса пораженных при Д(Э)Ф тканей: кожи, подкожной клетчатки, фасции, мышцы. При этом характерны патоморфологические изменения в фасции - значительное утолщение с признаками воспаления и фиброза.
Однако в связи с недостаточной квалификацией врачи нередко ошибочно ставят неправильный диагноз (ССД, дермато миозит или фибромиозит, тендовагинит, РА и др.). По данным Н. Г. Гусевой и соавт., только 2 из 10 больных были направлены в клинику с правильным диагнозом Д(Э)Ф. Таким образом, в первую очередь Д(Э)Ф следует дифференцировать с ССД и склеродермоподобными синдромами.
ССД отличается от Д(Э)Ф наличием синдрома Рейно, плотным отеком пальцев рук и кистей, дилатацией пищевода, поражением легких по типу базального пневмофиброза и развитием других висцеритов. В то же время нужно иметь в виду возможность сочетания ССД и Д(Э)Ф.
Склеродерма Бушке отличается от Д(Э)Ф развитием плотного отека верхней части туловища и проксимальных отделов конечностей, отсутствием характерных для ЭФ морфологических изменений фасции в области поражения.
Отсутствие миозита, дерматита и артрита позволяет отличить Д(Э)Ф от дерматомиозита и РА. Для тендовагинита характерно локальное несимметричное поражение того или иного сухожилия, в то время как при ЭФ процесс всегда симметричный с присущими ему внешними изменениями тканей и эозинофи лией.
Наличие плотного симметричного отека и характерного био птата позволяет отличить ЭФ от гиперэозинофилии различного происхождения.
Лекарственные средства эффективны в раннем периоде болезни, однако нередко постепенное развитие процесса приводит к несвоевременному распознаванию и запоздалому лечению. Как и при других заболеваниях из группы ДБСТ, при ЭФ необходимо длительное, нередко многолетнее, комплексное лечение.
Поскольку на первое место в клинической картине болезни выступают признаки воспалительной активности, наиболее показаны ГКС, главным образом преднизолон по 20-30 мг/сут, реже больше (60-70 мг/сут). В подавляющих дозах преднизолон назначают до снижения активности процесса, уменьшения субъективных и объективных признаков болезни. В дальнейшем дозу преднизолона постепенно снижают до поддерживающей, которую нередко приходится назначать в течение многих месяцев и даже лет (до 8 лет, по данным Н. Г. Гусевой и соавт.
Терапия НПВП обычно неэффективна.
При неэффективности лечения ГКС дополнительно назначают цитостатики, преимущественно азатиоприн по 150 мг/сут в течение нескольких месяцев, а при развитии фиброза - Dпени цилламин до 450-600 мг/сут. Длительность приема препаратов определяется наличием воспалительных, иммунных или фиброзных изменений.
В качестве местной противовоспалительной и антифиброзирующей терапии в комплексе лечения включаются курсы аппликаций ДМСО (50 %), фонофореза трилона Б на пораженные области. При снижении активности процесса проводятся ЛФК, курсы массажа.
При торпидном течении болезни и неэффективности терапии, по данным Н. Г. Гусевой и соавт., рекомендуется гемо сорбция. Возможно, что экстракорпоральная терапия показана и в более ранние сроки болезни в связи с повышением активности эозинофилотаксического фактора.
По данным S. Herson и соавт., на ранних стадиях болезни следует назначать преднизолон по 0,35-0,6 мг/кг в сочетании с циметидином в дозе до 1000 мг/сут в качестве бло катора Н2рецепторов.
Таким образом, эффективность лечения зависит от сроков его начала. При раннем распознавании и систематическом лечении почти у всех больных к концу 1го года развивается значительное улучшение состояния или клиническая ремиссия. Однако при позднем распознавании и развитии фиброза результаты лечения намного хуже.
Первичная профилактика не разработана. Вторичная профилактика обострении связана с систематичностью проводимой комплексной терапии.
Читайте также:


