Иммунотерапия при ревматоидном артрите
За последние два десятилетия было сделано много улучшений в лечении ревматоидного артрита (РА). Исследователи теперь считают, что иммунотерапия при ревматоидном артрите является одним из лучших способов предотвращения прогрессирования заболевания. Иммунотерапия и ее несколько форматов существенно останавливают реакцию иммунной системы пациента на атакующую здоровую суставную ткань.
Не позволяя иммунной системе вызывать воспаление, иммунотерапия помогает пациентам с ревматоидным артритом испытывать больший период не активности или ремиссии. При меньшем числе активных состояний симптомов заболевания, пациенты с РА могут продолжать жить высокого качества жизни и испытывать меньшую хроническую боль. Методы диагностики РА.

Что такое иммунотерапия при ревматоидном артрите
При РА иммунная система организма активируется, чтобы атаковать здоровую суставную ткань. Эти приступы вызывают воспаление и вызывают хроническую боль и другие тяжелые симптомы. Стремясь остановить аутоиммунные атаки у пациентов с РА, исследователи разработали методы иммунотерапии, которые защищают организм от собственных атак, прерывая аутоиммунные реакции.
Иммунотерапевтические процедуры, называемые модификаторами биологического ответа, являются одними из наиболее эффективных лекарств, используемых для профилактики иммунных приступов у пациентов с ревматоидным артритом. Они являются частью типа лекарств, называемых анти — ревматическими препаратами, модифицирующими болезнь, и часто используются как можно раньше на курсе болезни.
Исследования показали, что чем раньше может начаться агрессивное лечение иммунотерапией, тем лучше будет перспектива для пациента. Лечение иммунотерапией может предотвратить прогрессирование заболевания до такой степени, когда потребуется хирургическая операция, и на карту поставлена мобильность. Медикаментозное лечение.
Ревматоидная артритная иммунотерапия или биологическая терапия работает путем лечения или восстановления иммунной системы организма, чтобы она могла бороться с инфекцией или болезнью. Препараты иммунотерапии принимают части иммунной системы и лечат участников аутоиммунного заболевания.
Во многих иммунотерапиях применяются модификаторы биологического ответа, которые являются естественными веществами, продуцируемыми организмом в ответ на инфекцию и заболевание. Лабораторная технология может производить эти модификаторы биологического ответа и вводить их в большем количестве пациентам, борющимся с такими заболеваниями, как ревматоидный артрит.
Биологические препараты могут вступать в силу в разные промежутки времени. Некоторые биологические препараты начинают работать быстро, в то время как другие могут занять недели или даже месяцы. Время отклика полностью зависит от конкретного пациента. В зависимости от времени ответа врачи могут назначать другие препараты в сочетании с биологическими препаратами для уменьшения воспаления и облегчения боли.

Модификаторы биологического ответа, часто используются, когда у пациентов возникают проблемы с традиционными базовыми противоревматическими препаратами (БПРП). Традиционные БПРП могут работать не так, как ожидалось, для всех пациентов и иногда вызывать побочные эффекты.
Некоторые из проблем, с которыми сталкиваются пациенты с традиционными БПРП, включают:
- Серьезные побочные эффекты, такие как проблемы с печенью.Базисные противоревматические препараты.
- Низкий допуск для БПРП, таких, как метотрексат.
- Только метотрексат недостаточно эффективен и будет сильнее в сочетании с биологией.
- Опасения по поводу воздействия метотрексата и другими базисными препаратами может воздействовать на беременность.
Поскольку биологические исследования представляют собой новый класс иммунотерапии ревматоидного артрита, часто пациентам назначают как можно скорее традиционные БПРП, а затем проводят биологические процедуры.
Большинство препаратов для лечения ревматоидного артрита назначают пациентам путем инъекции. Инъекции производятся либо под кожу, либо непосредственно в вену.
Есть несколько новых вариантов терапии ревматоидного артрита, которые можно принимать перорально. Этот препарат иммунотерапии известен как ингибитор JAK, который нацелен на специфический путь фермента в иммунной системе, чтобы препятствовать аутоиммунным атакам.
В настоящее время существует множество различных биологических препаратов. Каждый из них модифицирует иммунную систему пациента в какой-то степени, чтобы прекратить атаки на суставную ткань. Вот некоторые из форматов препаратов для лечения РА и как они действуют:
- Анти-ФНО (фактор некроза опухоли).
- Ингибиторы активации Т-клеток (Т-лимфоциты).
- Ингибиторы JAK (Janus kinase).
- В — клеточные ингибиторы.
- Ингибиторы интерлейкина.
Вот некоторые из доступных биологических препаратов для пациентов с ревматоидным артритом, а также их фирменные наименования:
- Тоцилизумаб.
- Этанерцепт.
- Адалимумаб.
- Анакина.
- Инфликсимаб.
- Ритуксимаб.
- Голимумаб.
- Тофацитиниб.Эфирные масла при ревматоидном артрите.
Часто пациенты будут иметь положительные результаты при приеме определенного вида биологических препаратов только для того, чтобы остановить. В этом случае может потребоваться перейти на другую форму препарата для лечения ревматоидного артрита. Это может быть довольно распространенным явлением и является частью процесса поиска соответствующей стратегии лечения.
Доказано, что иммунотерапия, подобная модификаторам биологического ответа, очень эффективна при лечении многих пациентов с ревматоидным артритом.
Вот некоторые из положительных ожидаемых результатов использования модификаторов биологического ответа для лечения РА:
- Замедление прогрессирования повреждения суставов.
- Остановить дальнейший совместный ущерб.
- Достижение ремиссии.
- Уменьшить боль и жесткость.
- Избегайте болезненных и рискованных операций по замене суставов.
Важно знать, что, как и любые БПРП, Иммунотерапия при ревматоидном артрите, такая как биологические, ослабляет иммунную систему. Это оставляет пациента восприимчивым к инфекциям, поэтому важно осознавать любые признаки болезни, такие как лихорадка, озноб, тошнота и мышечные боли. Поскольку биологические препараты обычно вводят путем инъекций, также возможно, чтобы у пациентов развилось раздражение кожи в месте инъекции.
Побочные эффекты зависят в основном от конкретного пациента, а также от форм биологических препаратов. В то время как побочные эффекты могут быть неудобством во многих случаях, наиболее важным аспектом лечения ревматоидного артрита является то, чтобы контролировать болезнь и защищать общее самочувствие пациента.
Благодаря своим цитостатическим свойствам иммунодепрессанты дают неспецифический антивоспалительный эффект за счет тормозящего действия на клеточную (пролиферативную) фазу воспаления. В отличие от прежних представлений, подавление воспалительного процесса происходит неодновременно с явной иммунодепрессией, а иногда достоверных признаков последней по общепринятым иммунологическим показателям вообще не наблюдается.
Мы не рекомендуем назначать без особых показаний (неэффективность всех остальных препаратов) ранее очень популярный иммунодепрессант хлорбутин (лейкеран), на фоне лечения которым в наших наблюдениях у 4 больных развились злокачественные опухоли. Ряд авторов считают, однако, что в подобных случаях речь может идти лишь о случайных совпадениях. Метотрексат, считающийся в настоящее время лучшим иммунодепрессантом, назначают преимущественно в малых дозах, что почти полностью устранило проблему его побочных эффектов. Применяют обычно по 7,5 мг в неделю: в течение любых двух последовательных дней 3 раза по 2,5 мг с интервалом между приемами по 12 ч.
Азатиоприн назначают по 150 мг/сут, хлорбутин—по 6—8 мг/сут. Первые признаки клинического эффекта наступают обычно через 3—4 нед. Через 2— 3 мес при хорошей переносимости этих лекарств больных переводят на поддерживающее лечение, которое может продолжаться длительно (при необходимости и терапевтическом эффекте до 2—3 лет). Поддерживающие суточные дозы азатиоприна составляют 100—75—50 мг, хлорбутина — 2 мг. Метотресат обычно назначают в неизменной дозе (7,5 мг в неделю), при полной ремиссии или сомнениях в переносимости эта доза может быть уменьшена до 5 мг. Эффективность каждого из этих препаратов при РА приблизительно равна эффекту препаратов золота.
Переносимость их, как правило, хорошая (лучше, чем большинства остальных базисных средств). Однако иммунодепрессанты назначают реже в связи с традиционными представлениями об опасности аплазии, кроветворения, а также подавления противоинфекционного и особенно противоопухолевого иммунитета. В действительности же используемые при РА дозы иммунодепрессантов лишь у небольшого числа больных вызывают умеренное угнетение кроветворения (нейтропения, реже тромбоцитопения и анемия), нарушение менструального цикла и сперматогенеза, тошноту, кожный зуд.
Азатиоприн у некоторых больных вызывает холестатическую желтуху. Активирование инфекций встречается редко. Вероятность риска онкологических осложнений при лечении больных РА азатиоприном пока неясна. Метотрексат считается единственным иммунодепрессантом, не оказывающим потенциального канцерогенного действия.
Значительно реже используется при РА такой иммунодепрессант, как циклофосфамид. Это объясняется тем, что серьезные побочные влияния свойственны ему чаще (помимо осложнений, характерных для всей группы иммунодепрессантов, он способен вызвать обратимое облысение и такое осложнение, как геморрагический цистит). Однако собственно лечебный эффект этого препарата при РА, по-видимому, выше, чем эффект метотрексата, хлорбутина и азатиоприна, т. е. его можно использовать в более резистентных случаях болезни. Начальная суточная доза циклофосфамида составляет 100—150 мг, поддерживающая — 75—50— 25 мг и даже 25 мг через день.
Среди новых иммунодепрессантов заслуживает внимания циклоспорин А, хорошо зарекомендовавший себя в трансплантологии. Он представляет собой грибковый метаболит, обладающий выраженным тормозящим влиянием на пролиферацию и функцию Т-лимфоцитов, особенно хелперов. Предполагается, в частности, что препарат угнетает образование рецепторов для интерлейкина2 и блокирует рецепторы для пролактина.
При РА циклоспорин применялся у ограниченного числа больных в суточной дозе 2,5—10 мг/кг, отмечено отчетливое клиническое улучшение, в том числе в двойном слепом исследовании [van Rijthoven A. et al., 1986]. В то же время наблюдались серьезные побочные эффекты: снижение функции почек с нарастанием уровня креатинина, артериальная гипертония, желудочно-кишечные расстройства, гиперплазия десен, парестезии, тремор, гипертрихоз, повышение уровня печеночных ферментов. Побочное действие препятствует более широкому применению циклоспорина в ревматологии. Наиболее перспективны малые дозы: 2,5—3 мг/кг в день.
В последние годы в литературе появились положительные отзывы об отечественном иммунодепрессивном препарате проспидине. Однако отсутствие проверочных исследований пока не позволяет судить о его действительном месте в лечении больных РА.
При появлении инфекционных или гематологических осложнений (в частности, снижение абсолютного числа нейтрофилов ниже 2·10 9 /л) иммунодепрессанты необходимо отменить. Их можно назначать вновь после полного исчезновения осложнений, но в уменьшенной дозе (50% от исходной). Противопоказания к их назначению — выраженные цитопении, паренхиматозные поражения печени, сопутствующие инфекции, беременность.
Таким образом, в настоящее время препараты золота и иммунодепрессанты (особенно метотрексат) являются бесспорно, наиболее эффективными длительно действующими препаратами для лечения больных РА, значительно превосходя в этом отношении остальные базисные средства. В результате их назначения ремиссии развиваются не только значительно чаще, но оказываются более длительными и полными, что позволяет отказаться в эти периоды от приема остальных лекарственных препаратов (включая преднизолон и НПВП).
В применении базисных препаратов осложняющим обстоятельством является длительный период, требующийся для установления их эффективности либо неэффективности (до нескольких месяцев). Относительно более коротким этот период оказывается для и^мунодепрессантов. Для конкретного больного не существует надежных показателей, по которым до начала лечения можно надежно предсказать эффект терапии.
Тем не менее на основании обобщенных данных о сравнительной эффективности базисных препаратов представляется целесообразной следующая схема их использования. При отсутствии явных противопоказаний (изменения в анализах мочи и т. д.) следует начинать терапию с препаратов золота. В случае их неэффективности, что становится ясным через 3—4 мес, или непереносимости назначают D-пеницилламин.
Если возможности всех перечисленных базисных средств оказались исчерпанными и активность болезни не подавляется противовоспалительными препаратами, то при отсутствии противопоказаний следует начать терапию одним из иммунодепрессантов. Представляется наиболее рациональным первым применить метотрексат (исходя из возможности применения малых доз, их хорошей переносимости и отсутствия канцерогенное), а при необходимости его замены из-за малого эффекта или побочного действия назначать другие иммунодепрессанты в следующем порядке: азатиоприн, циклофосфамид, хлорбутин.
Подбор адекватного базисного средства может у отдельных больных потребовать весьма много времени. В этот период, особенно если он затягивается, чрезвычайно важно подавить активность процесса и устранить болевой синдром с помощью НПВП, средств местной терапии (см. ниже) и при необходимости — кортикостероидов.
Применение кортикостероидов при РА следует максимально ограничить в связи с частым развитием стероидозависимости и возможностью серьезных осложнений. Не случайно существует афоризм об обратной пропорциональности квалификации ревматолога и частрты назначения им стероидных препаратов при РА. Тем не менее у некоторых больных воспалительный процесс бывает настолько ярким, что негормональные противовоспалительные препараты оказываются явно неэффективными и не уменьшают боли в суставах, экссудативные изменения, лихорадку (динамика лабораторных показателей в первый период терапии имеет гораздо меньшее значение).
Необходимо подчеркнуть, что существует своеобразная категория больных РА, у которых практически полностью неэффективны любые нестероидные препараты (даже в сочетании и при использовании больших доз), но быстрое и яркое клиническое улучшение достигается при назначении даже малых доз преднизолона. Возможно, что это связано с некоторыми качественными особенностями воспалительного процесса. В таких случаях приходится назначать стероидные препараты—лучше всего преднизолон в суточной дозе 10—15 мг с последующим медленным снижением дозы (после достижения эффекта) на ¼ —1/8 таблетки каждые 5—7 дней.
При редко встречающихся особенно тяжелых гиперпиретических и суставно-висцеральных формах РА дозу преднизолона иногда необходимо повысить до 25—30 мг/сут; в подобных случаях отменить его бывает очень трудно. Следует учитывать, что уменьшить дозу и тем более отменить гормональные препараты надежно удается лишь в тот период, когда проявляется эффект длительно действующих антиревматоидных средств (т. е. через несколько месяцев приема последних).
В большинстве случаев присоединение небольшой дозы преднизолона к оказавшемуся неэффективным НПВП не сопровождается отменой последнего. В период развития ремиссии или яркого улучшения на фоне лечения базисными препаратами вначале делается попытка снизить дозу преднизолона (до его отмены) и лишь затем, если эта попытка удалась, начать уменьшать дозу нестероидных средств с тем, чтобы при наиболее благоприятных результатах оставить в терапии только поддерживающие дозы базисного препарата.

В современной медицине, несмотря на все прогрессивные достижения, остается большое количество заболеваний, имеющих недостаточно изученные причины и сложные многоступенчатые механизмы развития, формирующие разнообразную клиническую картину с поражением тканей и органов, что обуславливает сложности в лечении. Например, системные заболевания соединительной ткани. К этой группе заболеваний относится ревматоидный артрит, отличительной чертой которого является эрозионно-деструктивное поражение суставов, преимущественно мелких. Причина его до сих пор не установлена, в механизме развития основная роль принадлежит атаке иммунитета на собственные ткани организма.
Продолжаются исследования причин и механизмов развития указанной патологии, поиск новых, более эффективных и безопасных методик лечения, особенно комплексного.
Содержание статьи
Ревматоидный артрит суставов: симптомы и лечение
Ревматоидный артрит характеризуется прогрессирующим разрушением суставов, которые на поздних стадиях заболевания приобретают необратимый характер. Типичные признаки патологии:
- наличие эрозивно-деструктивных элементов в области суставных поверхностей;
- разрушение мелких суставов;
- симметричное поражение;
- развитие воспаления в области стоп и кистей;
- деформации, препятствующие нормальному функционированию суставов.
Помимо типичных суставных поражений характерны также и нарушения со стороны других тканей и систем, включающие наличие серозитов (воспалительный процесс в области оболочек сердца, брюшины, плевральной оболочки), формирование воспалительных узелков под кожей, поражение сосудов в виде васкулитов, увеличение лимфоузлов (лимфаденопатии) и периферические поражения нервных окончаний (нейропатии).
Методы лечения ревматоидного артрита определяет врач-ревматолог, специализирующийся на аутоиммунных, воспалительных заболеваний. Он проводит полноценную диагностику: внешний осмотр с анализом всех жалоб и их подробной фиксацией в карте, проведение целого ряда лабораторных анализов и инструментальных исследований (включая данные УЗИ, рентгенографии и иных дополнительных процедур).
Медицинская коррекция базируется на длительных курсах лекарственных препаратов в сочетании с физиотерапией и немедикаментозными методиками, диетической коррекцией и, в некоторых случаях, с оперативным вмешательством. Проводятся курсы противорецидивной терапии и реабилитации, при этом чем раньше будут назначены препараты и рекомендованы методы лекарственного воздействия, тем более благоприятным будет прогноз. В запущенных случаях заболевание грозит стойкой инвалидностью.
Чаще подобная проблема возникает у взрослых, для детей типична своеобразная форма отклонения в виде ЮРА (ювенильной), с особенностями клинической симптоматики, диагностики и терапевтических подходов.

Причины и диагностика патологии
Точные причины заболевания на сегодняшний день не установлены, хотя имеются теории о природе его развития. По мнению большинства исследователей, имеют место наследственная предрасположенность, перенесенные инфекции и действие провоцирующих факторов. Отмечено, что некоторые микроорганизмы (ретровирусы, вирусы герпеса, цитомегаловирус, Эпштейн-Барр, краснухи, а также микоплазмы) способствуют развитию воспалительных процессов в суставах. В результате перенесённой инфекции и неправильной работы иммунитета происходит запуск аутоиммунных реакций — агрессии собственного иммунитета против соединительной ткани суставов и других частей тела, что приводит к разрастанию соединительной ткани и разрушению хрящевых структур и их необратимой деформацией. Процесс приводит к контрактурам — ограничениям в движениях и необратимым деформациям суставов, подвывихам и нарушению их функциональной активности.
В результатах лабораторных исследований обнаруживается увеличение СОЭ, щелочной фосфатазы и специфических показателей системных заболеваний – ревматоидного фактора, сиаловых кислот и серомукоида. При рентгенологическом исследовании появляются специфические симптомы поражения суставов.
Ревматоидный артрит: лечение в домашних условиях или стационарно?
Помещение пациента в стационар, когда возникают подозрения на развитие болезни или при уже установленном диагнозе, показано в следующих случаях:
- при необходимости подтверждения или опровержения диагноза, для уточнения особенностей течения, оценки прогноза в отношении дальнейшей жизни и трудоспособности, решения вопроса с инвалидностью;
- подбор базисной противовоспалительной терапии (БПВТ) препаратами на начальном этапе и затем на протяжении болезни;
- при резком обострении и развитии осложнений;
- когда имеют место тяжелые и системные проявления с вовлечением нервной системы и серозных оболочек;
- при формировании сопутствующих осложнений, признаков септического артрита или других, в том числе связанных с приемом лекарств.
Во всех остальных случаях допускается лечение в домашних условиях при строгом условии постоянного контроля врача с регулярным прохождением обследований.

Как избавиться от ревматоидного артрита: принципы терапии
Основу составляет комплексный подход и сочетание приема лекарств с немедикаментозными методиками, диетой, физионагрузками и реабилитационными мероприятиями. При необходимости к консультированию и разработке схемы терапии привлекается врач-ортопед, невролог, кардиолог, психотерапевт. При незначительной деформации суставов пациентам можно продолжать привычную деятельность с ограничением физических нагрузок и стрессов, при условии профилактики инфекционных заболеваний и отказа от вредных привычек.
Не менее важное условие для уменьшении симптомов, особенно в области нижних конечностей – это контроль за массой тела, что уменьшает нагрузки на пораженные суставные поверхности и кости, снижает риск остеопороза, переломов и деформаций. Правильно подобранная диета с высоким содержанием полиненасыщенных жирных кислот, качественных животных и растительных белков помогает в уменьшении интенсивности воспаления и стимулирует восстановление хрящевых тканей.
Врач подробно рассказывает пациенту как уменьшить проявление болезни за счет изменений физической активности, посредством занятий лечебной физкультурой и применения физиотерапевтических методик. В стадии минимальных проявлений или в период ремиссии показано санаторно-курортное оздоровление.
Стандарт лечения ревматоидного артрита
В последние время наблюдается ощутимый прогресс в понимании основных механизмов формирования, патологию рассматривают как хроническое воспалительное заболевание иммунной природы, при котором наиболее эффективна терапия в начальный период. Сегодня разработан новый стандарт, включающий применение целого ряда препаратов различного действия:
- нестероидные противовоспалительные средства (НПВС);
- гормональные (глюкокортикостероиды, или ГКС);
- биологические;
- синтетические средства для купирования иммунных и воспалительных реакций.
Основа улучшения самочувствия – это базисная противовоспалительная терапия (БПВТ), которую важно начать в первые месяцы развития, причем прием лекарственных средств должен быть регулярным (перорально, инъекционно), с постоянным изменением схемы при малой эффективности. Исчезновение или уменьшение клинических симптомов и признаков воспаления по лабораторным данным свидетельствует о результативности проводимых мер. Применение БПВТ должно осуществляться с учетом возможных побочных эффектов.
Как вылечить ревматоидный артрит
В острой стадии или при обострении хронической патологии необходима медикаментозная коррекция, но как проходит лечение, определяет исключительно лечащий врач. Применяются стероидные средства, препараты фактора некроза опухоли (ФНО), нестероидные противовоспалительные средства (НПВС).
На первом этапе проводят подавление острых процессов, с последующим переходом на поддерживающую терапию в период затухания симптомов и ремиссии. Нестероидные лекарства применяются наиболее активно, обычно это группа неселективных ингибиторов ЦОГ (циклооксигеназа — фермент, ответственный за синтез веществ, способствующих развитию воспаления). Эффект при их приеме развивается быстро, после 3-5 суток приема, но сами лекарства обладают целым рядом побочных эффектов, ограничивающих их длительное применение и выбор для некоторых категорий пациентов. Активно применяют селективные ингибиторы ЦОГ, обладающие меньшим списком побочных эффектов, они относятся к средствам нового поколения, лучше переносятся и более эффективны.
Лечение ревматоидного артрита подразумевает также лекарства группы глюкокортикоидов. Они быстро и сильно подавляют иммунные и воспалительные реакции, влияют на обменные процессы и применимы при неэффективности нестероидных противовоспалительных лекарств. ГКС уменьшают воспаление в области суставов и снижают вероятность поражения внутренних органов, но также имеют внушительный список побочных эффектов и противопоказаний, в связи с чем их употребление строго контролируется и подбирается очень тщательно и индивидуально. При пульс-терапии, в комбинации с цитостатическими средствами применяются только на базе стационара. Домашний неконтролируемый прием этих препаратов запрещен, они могут быть опасными в плане серьезных осложнений.

Препараты нового поколения для лечения ревматоидного артрита
На сегодняшний день для борьбы с данной патологией широко применяются препараты нового ряда – биологическая терапия. Специфические соединения, относящиеся к группе ингибиторов ФНО (факторы некроза опухоли), не позволяют разворачиваться клинической картине иммунного воспаления. Средства относительно недавно применяются, показали хорошие результаты, но значительно влияют на иммунитет, подавляя его на фоне длительного приема. Их назначают в сложных случаях, когда заболевание устойчиво к привычным средствам. Биопрепараты обладают одним существенным недостатком — высокой стоимостью, что ограничивает их широкое применение.
Местная терапия
Практикуется и наружный способ применения медикаментов, с этими целями назначаются лекарства для местного нанесения – гели, мази, кремы, пластыри с противовоспалительными компонентами. Основной эффект заключается в локальном воздействии на ткани сустава и околосуставные поверхности, лекарства используются с целью уменьшения боли и отека. Однако они обладают низкой эффективностью по сравнению с лекарствами, которые принимаются внутрь (таблетки), и рекомендуются только в комплексной терапии.
Часто наружные средства имеют многокомпонентный состав, могут содержать НПВС, гепарин (для улучшения микроциркуляции и проницаемости сосудов), местные анестетики (для уменьшения болезненности сустава).
Как лечиться от ревматоидного артрита при помощи физиотерапии
По мере стихания острого процесса всегда встает вопрос о том, что делать далее, в стадию затухания воспаления и при выходе в ремиссии. На этапе дополнительной коррекции, в том числе и в домашних условиях, показаны физионагрузки. Процедуры способствуют снижению болевых ощущений, устранению скованности по утрам, расширяют физическую активность пациента.
Применяются методики воздействия гальваническими токами и магнитными полями на область пораженных поверхностей, аппликации парафина или озокерита. Не менее эффективны и методики дозированного облучения инфракрасными лучами или ультразвуком определенной частоты.
Магнитотерапия при заболеваниях суставов оказывает наиболее выраженное положительное действие:
- уменьшает боли и отеки в области суставов;
- повышает объем движений;
- устраняет утреннюю скованность;
- позволяет уменьшить лекарственную нагрузку на организм, так как снижает необходимость приема препаратов с обезболивающим эффектом.
Хотя данные методики обладают достаточной активностью, они не могут применяться как единственное средство при решении вопроса как вылечить ревматоидный артрит и без назначения врача. Физиотерапия показана как дополнительная методика на фоне базисного лечения.
Задать вопрос врачу
- 4970
- 4,1
- 0
- 5
Моноклональные антитела — новая надежда в лечении ревматических заболеваний.
![]()
Анна Огородник
![]()
Антон Чугунов![]()
Андрей Панов




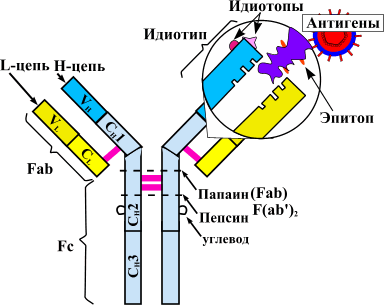
Теорию аутоиммунитета сформулировал еще столетие назад немецкий исследователь Пауль Эрлих. За последующие годы описано множество аутоиммунных заболеваний. К ним относятся ревматоидный артрит, системная красная волчанка (СКВ), системная склеродермия, миопатии, васкулиты и прочие патологии .
Болезни, ассоциированные с аутоиммунным компонентом, — серьезная проблема современного общества . Их распространенность в мировой популяции составляет примерно 5%. Заболевания быстро переходят в хроническую форму, из-за чего снижается качество жизни пациентов. Аутоиммунные патологии часто приводят к инвалидизации больных [1], [4].
Несмотря на многолетний поиск новых путей фармакотерапии, современная медицина не может предложить способов лечения, непосредственно влияющих на причину возникновения аутоиммунитета. Врачи способны лишь замедлить прогрессирование патологии и снизить выраженность клиники — провести патогенетическое и симптоматическое лечение. Для этого разработана базисная терапия, которая применяется уже многие годы. Однако не всегда проверенные препараты работают так, как надо.
Почему необходимо искать новые способы лечения?
Для лечения аутоиммунных заболеваний используют широкий арсенал противоревматических лекарств. Классическая терапия включает нестероидные противовоспалительные средства, глюкокортикоиды, цитостатики. В зависимости от особенностей развития заболевания подбирают препараты из той или иной группы [4].
- Большие иммунодепрессанты:
- глюкокортикоиды (преднизолон, дексаметазон);
- антибиотики (циклоспорин, такролимус);
- антиметаболиты (метотрексат, азатиоприн, меркаптопурин);
- цитостатики (циклофосфан).
- Малые иммунодепрессанты:
- плаквенил, хингамин;
- купренил;
- препараты золота (ауронофин);
- гепарин;
- нестероидные противовоспалительные средства.
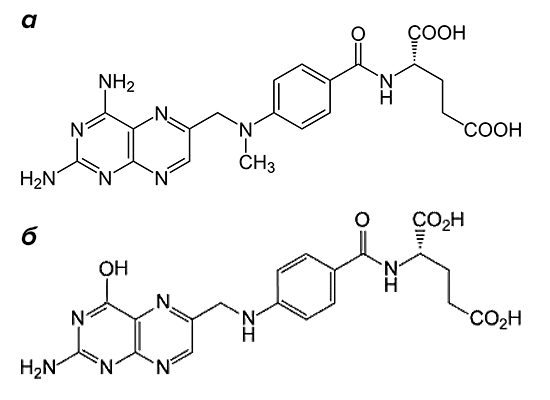
Рисунок 2. Структурные формулы метотрексата и фолиевой кислоты. Препарат (а) по строению похож на фолиевую кислоту (б). Он состоит из птеридиновых групп и парааминобензойной кислоты. Действующий компонент метотрексата отличается от структуры фолата отсутствием гидроксильной группы (–OH) и наличием дополнительного метильного радикала (–CH3).
По механизму действия метотрексат относится к антиметаболитам. Препараты этой группы тормозят физиологические реакции в организме, связываясь с ферментами и выключая их активность. Вещество, которое в норме участвует в реакции, уже не может попасть в биохимический круговорот из-за повышенной конкуренции с компонентами лекарства. Основной мишенью для действия метотрексата является фермент, расщепляющий фолиевую кислоту, — дигидрофолатредуктаза (ДГФ). Этот белок воздействует на поступающий в организм фолат, переводя его в активную форму. При этом образуется тетрагидрофолиевая кислота. Она участвуют в синтезе строительного материала для ДНК — пуриновых оснований и тимидилата.
Метотрексат вклинивается в цепочку реакций благодаря структурному сходству с молекулой фолиевой кислоты (рис. 2). Конкуренция за фермент приводит к тому, что содержание активного фолата в ткани значительно снижается. Нет строительного материала — нет и новых молекул ДНК, без которых клетки не могут размножаться. Повышенной чувствительностью к воздействию лекарства обладают те ткани, структурные элементы которых постоянно делятся. К ним относятся и компоненты костного мозга, из которых формируются будущие иммунные клетки.
Еще один важный момент в работе метотрексата связан с активностью его полиглутамированных метаболитов. Эти молекулы формируются после активации препарата непосредственно в клетках человеческого организма. Они ингибируют другие ферменты, которые взаимодействуют с фолиевой кислотой. В эту группу входят тимидилсинтетаза и АИКАР-трансамилаза. Активность производных метотрексата запускает процесс выработки аденозина. Он оказывает мощное противовоспалительное действие, благодаря чему снижается выраженность симптомов ревматоидного артрита [7].
Метотрексат удобно использовать — он легко дозируется и может назначаться длительными курсами. Кроме того, важное преимущество этого препарата — низкая цена, в сравнении с современными лекарствами импортных фармкомпаний [8]. Несмотря на все достоинства, лечение метотрексатом не всегда приводит к снижению активности заболевания. У многих пациентов использование препарата неэффективно даже в комбинации с другими классическими средствами [5]. Это подтверждается при анализе статистики. Исследования показали, что при проведении лечения метотрексатом и комбинациями базисных препаратов только половина пациентов достигла ремиссии [9], [10].
Несостоятельность классической терапии заставляет ученых искать новые способы лечения ревматоидного артрита. Стоит отметить, что, несмотря на новые разработки, борьбу с заболеванием все же начинают с назначения метотрексата и его аналогов. Дополнительные препараты используют только при высокой активности аутоиммунного процесса. У таких пациентов применение одного лекарства часто бывает неэффективно [7]. В зависимости от особенностей течения патологии подбирают подходящую схему терапии (рис. 3).
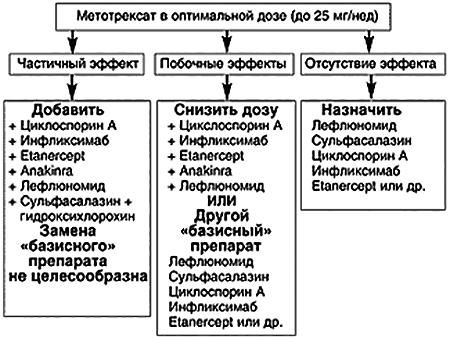
Рисунок 3. Тактика ведения пациента с ревматоидным артритом при неэффективности использования метотрексата.
Неэффективность препаратов базисной терапии встречается не только при ревматоидном артрите, но и при других заболеваниях аутоиммунного происхождения (системной красной волчанке, склеродермии, болезни Бехтерева). Это мотивирует специалистов-ревматологов разрабатывать другие лекарства и подбирать новые схемы терапии.
Генно-инженерные препараты: дополнение к базисной терапии
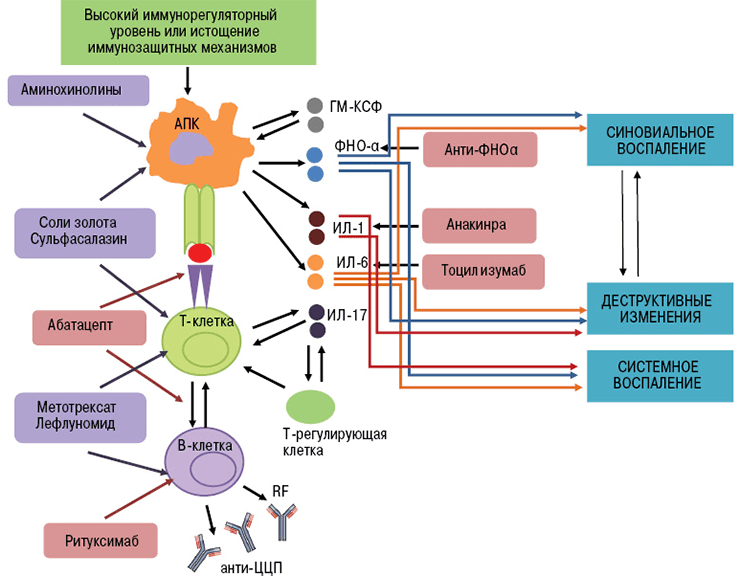
По-новому взглянуть на лечение аутоиммунных заболеваний позволила разработка терапевтических моноклональных антител [11]. Принципиально новый класс препаратов получен благодаря достижениям генной инженерии. Для понимания механизма действия этих лекарств стоит вспомнить о том, как работают иммунные клетки в норме и при патологии [1], [12].
При аутоиммунных заболеваниях можно подавлять сразу весь сложный механизм иммунитета, что и делают препараты классической терапии. Но это оставляет человека без защиты от вражеских агентов — бактериальных инфекций, вирусов и прочих патогенов. Поэтому предпочтительнее сохранить активность иммунной системы в целом, избавив человека от аутоагрессии определенных ее компонентов. Именно так работают новые препараты — моноклональные антитела.
- Ингибиторы ФНО (фактора некроза опухолей) — инфликсимаб, этанерцепт, цертолизумаб, голимумаб, адалимумаб.
- Блокаторы интерлейкиновых рецепторов — тоцилизумаб (ИЛ-6R), канакинумаб (ИЛ-1R), секукинумаб (ИЛ-17R).
- Анти-В-клеточные антитела (антитела к мембранным молекулам CD20) — ритуксимаб, белимумаб [17].
- Анти-Т-клеточные антитела (антитела к молекулам CD80 и CD86) — абатацепт [18].
Ингибиторы фактора некроза опухолей — это первые моноклональные антитела, внедренные в ревматологическую практику. В эту группу входят инфликсимаб, этанерцепт, цертолизумаб, голимумаб, адалимумаб.
Фактор некроза опухолей (ФНО) — это провоспалительный цитокин (вещество, которое стимулирует развитие воспалительной реакции). В норме при его выделении происходит пролиферация клеток сосудов, активация макрофагов, лизис опухолевых агентов. Эти эффекты играют важную роль в защите организма от патогенов. Воспаление можно считать ответной реакцией на воздействие повреждающих факторов.
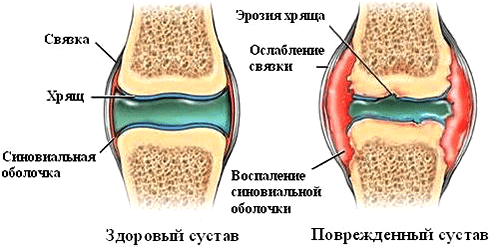
Рисунок 5. Патологические изменения в суставе при ревматоидном артрите. Аутоиммунный процесс вызывает появление эрозий, синовит (воспаление синовиальной оболочки), разрушение суставного хряща.
Такое строение связано с механизмом получения препарата. Первоначально синтезируют антитело к фактору некроза опухолей в организме мыши. Полученный иммуноглобулин специфичен к ФНО и уже может его обезвреживать, но полностью чужеродные белки вводить в организм пациентов, конечно, нельзя. Это вызовет активную иммунную реакцию — выработку антител уже против терапевтических агентов. Поэтому домены мышиного иммуноглобулина заменяют сходными участками человеческих белков. Антитела, имеющие фрагменты разного происхождения, называются химерными. Фактически, они берут лучшие качества своих предшественников. Мышиная часть обеспечивает высокую чувствительность к ФНО, а человеческие фрагменты снижают иммуногенность — вероятность развития иммунного ответа.
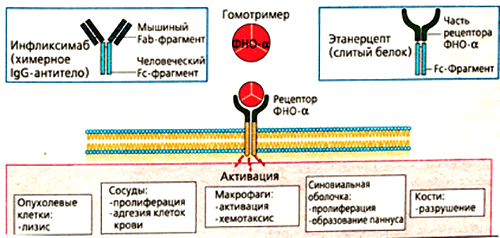
Рисунок 6. Основные эффекты ФНО и блокирующие его моноклональные антитела (инфликсимаб и этанерцепт). Мишенями для моноклональных антител являются свободная и мембраноассоциированная формы фактора некроза опухолей. Лекарства препятствуют связыванию цитокина с рецептором, благодаря чему снижается активность ревматоидного артрита.
В развитии аутоиммунного воспаления важную роль играют интерлейкины, которые, как и ФНО, относятся к провоспалительным цитокинам (рис. 7). Основными представителями этой группы являются ИЛ-6, ИЛ-1, ИЛ-17. Функция интерлейкинов — это контроль процессов дифференцировки, пролиферации и гибели (апоптоза) иммунных клеток, который осуществляется через соответствующие гены-мишени [20].
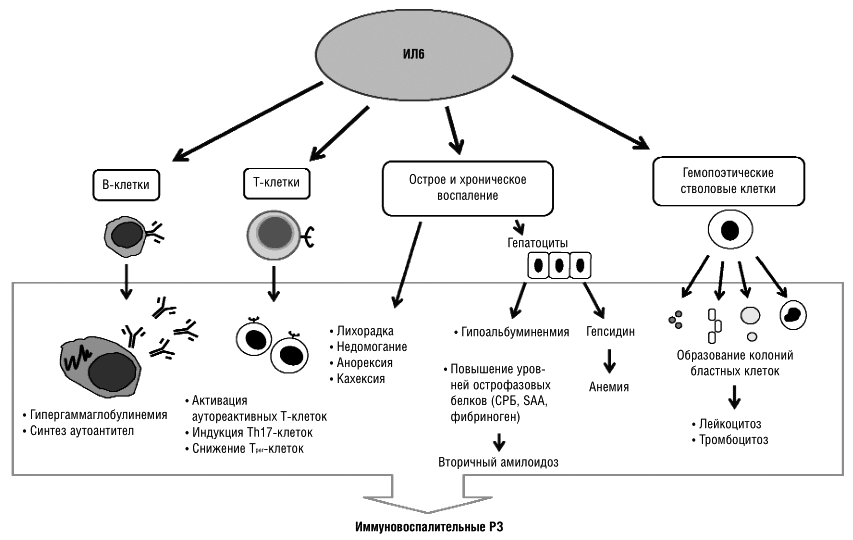
Рисунок 7. Механизм действия интерлейкинов при аутоиммунном воспалении (на примере ИЛ-6). Цитокин влияет на T- и B-лимфоциты, гемопоэтические клетки, гепатоциты. Он стимулирует выработку аутоантител В-клетками, а также формирование аутореактивных Т-клонов, которые непосредственно участвуют в аутоиммунном процессе. Влияние на костный мозг заключается в стимуляции выработки новых клеток крови — повышается число лейкоцитов и тромбоцитов. Воспаление сопровождается ответной реакцией клеток печени, появлением характерных симптомов аутоиммунного заболевания.
Тоцилизумаб — это препарат, который блокирует работу ИЛ-6. Рецептор этого вещества состоит из двух компонентов — мембранного ИЛ-6R (α-цепь) и гликопротеина g130 (β-цепь). Мембранная часть рецептора связывается с ИЛ-6, образуя устойчивый комплекс. Вместе они активируют компонент g130, вызывая изменение его структуры (гомодимеризацию). Образуется рецепторный комплекс из двух молекул g130, который в свою очередь активирует JAK1-киназу. Этот фермент запускает каскад реакций в клетке, который приводит к появлению биологического эффекта цитокина — развитию воспаления. В некоторых случаях ИЛ-6 связывает не мембранная, а растворимая форма α-цепи (рис. 8). Механизм действия рецептора при этом не меняется [21].
В основе работы тоцилизумаба лежит конкуретное ингибирование. Сигнальные молекулы активно связываются с моноклональным антителом. Вакантное место занято — интерлейкин не может образовать комплекс с рецептором, а значит, он не способен активировать процесс воспаления.
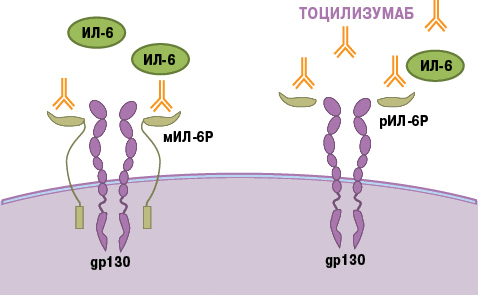
Рисунок 8. Механизм действия тоцилизумаба. Препарат связывает растворимые и мембранные рецепторы ИЛ-6, блокируя передачу сигналов.
Тоцилизумаб считается одним из самых безопасных препаратов, входящих в группу моноклональных антител. Это позволяет применять его при ювенильном идиопатическом артрите, который возникает в возрасте до 16 лет. Дети особенно остро реагируют на токсические воздействия, поэтому препараты, которые используют при их лечении, должны иметь минимальное число побочных реакций. Применение тоцилизумаба позволяет достигнуть необходимого эффекта лечения, не вызвав тяжелых осложнений.
Препараты из группы анти-B-клеточной терапии (ритуксимаб и белимумаб) блокируют активность В-лимфоцитов путем связывания их мембранных молекул CD20. Эти вещества есть только у определенных категорий В-клеток. Они специфичны для пре-В-лимфоцитов и зрелых В-лимфоцитов. CD20 нет у стволовых элементов и про-В-клеток, из которых будут образовываться новые лимфоцитарные элементы. Мембранные молекулы данного типа не содержатся и у плазматических клеток, которые вырабатывают иммуноглобулины [22].
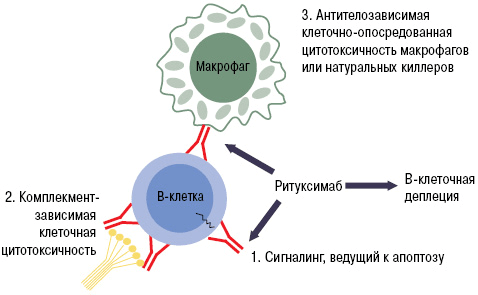
Рисунок 9. Механизм работы ритуксимаба. Fab-фрагмент моноклонального антитела связывается с CD20 на поверхности B-лимфоцита. Это запускает лизис клетки, который может осуществляться несколькими путями: через систему комплемента, программу апоптоза или агрессию натуральных киллеров и макрофагов.
Блокировка действия Т-лимфоцитов возможна благодаря особенностям их активации. Чтобы Т-лимфоцит вступил в аутоиммунный процесс и связался с антигеном, он должен получить два сигнала от антигенпрезентирующих клеток (АПК). Первый сигнал обеспечивает распознавание специфического аутоантигена Т-клеточными рецепторами. Второй сигнал — это неспецифический процесс связывания мембранных молекул CD80 и CD86 на поверхности АПК с рецептором CD28 лимфоцита. Сочетание этих взаимодействий вызывает активацию Т-клеток, которые в свою очередь стимулируют выработку провоспалительных цитокинов. Это и есть основной вклад Т-лимфоцитов в аутоиммунный процесс.
Знания о механизме активации Т-клеток использовали при разработке моноклональных антител. Основной представитель анти-Т-клеточных агентов — это абатацепт. Препарат представляет собой белок, состоящий из двух частей. Специфическая часть образована молекулой CTLA-4 (антиген 4 цитотоксических лимфоцитов). Неспецифическая область — это Fc-фрагмент человеческого иммуноглобулина G1 [23].
Воздействие абатацепта направлено как раз на неспецифический (костимулирующий) сигнал. Компонент CTLA-4 связывает белки CD80 и CD86 на поверхности антигенпрезентирующих клеток. Рецептор лимфоцита CD28 уже не может взаимодействовать с ними, из-за чего активация Т-клетки не завершается (рис. 10).
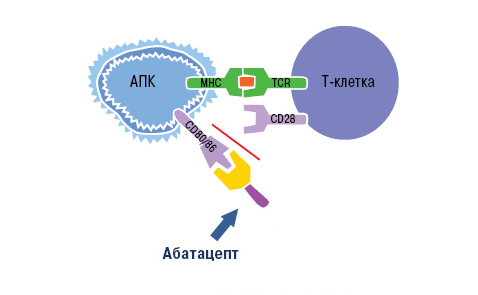
Рисунок 10. Механизм действия абатацепта. Абатацепт модулирует иммунный ответ через связывание с CD80/CD86 на антигенпрезентирующих клетках. Это препятствует связыванию CD80/CD86 с CD28 T-клеток, то есть активация Т-клеток отменяется через блокировку костимуляции.
Не всё так просто: возможные проблемы при использовании моноклональных антител
Например, одна пачка метотрексата стоит примерно 200 рублей. Цена упаковки инфликсимаба — около 43 тыс. рублей. Разница очевидна. За год лечения метотрексатом даже в максимальной дозировке пациент потратит на лекарство 1–2 тыс. рублей (в зависимости от фирмы-производителя, схемы лечения и стоимости препарата в местных аптеках). Цена годовой терапии инфликсимабом составляет примерно 700 тыс. рублей. Понятно, что самостоятельно обеспечить себя этим лекарством сможет только очень ограниченная группа пациентов.
Использование биологических препаратов допустимо в тех случаях, когда к базисным средствам у пациента развивается непереносимость. Больные испытывают тяжелое побочное воздействие лекарства, которое еще сильнее ухудшает их состояние. Применение препаратов с другим механизмом действия, в том числе и моноклональных антител, позволяет минимизировать побочные эффекты [18].
Другая сложность, с которой можно столкнуться при использовании биологических препаратов, — это побочные реакции. Параллельно с накоплением данных об эффективности использования лекарств выявляют все новые нежелательные эффекты от их применения. Большая часть таких реакций связана с процессом иммуносупрессии. Подавляя активность иммунных клеток, моноклональные антитела снижают защитную функцию организма. В первую очередь страдают противоинфекционный и противоопухолевый иммунитеты [18], [24].
Парадоксально, но применение новых лекарств против аутоиммунитета может вызвать острые аутоиммунные реакции. Все биологические препараты представляют собой белковые молекулы, которые в той или иной степени чужеродны для организма. Поэтому при проникновении терапевтических агентов в тело больного иммунитет может распознать их как антигены. Появляется активный иммунный ответ — вырабатываются антитела уже против компонентов препарата.
Несмотря на все возможные сложности, моноклональные антитела прочно вошли в регистр лекарств, применяющихся в ревматологии. Перспектива использования биологических препаратов и их место в ревматологии будет зависеть от результатов многолетних исследований, которые еще предстоит провести. Но даже сейчас можно сказать, что разработка терапевтических моноклональных антител является важным шагом на пути к победе над аутоиммунным воспалением.
Читайте также:





