Инфекционные заболевания лабораторных животных
Наиболее распространенными заразными заболеваниями лабораторных животных являются пастереллез, паратиф (сальмонеллез), туляремия, инфекционная пневмония, псевдотуберкулез и кокцидиоз.
Пастереллез. Заболевают кролики, морские свинки, мыши и крысы. Свинки болеют чаще в острой форме, а остальные виды — преимущественно в подострой или хронической форме.
Клиника при острой форме: слабость, повышение температуры, нервные явления, понос. Смерть обычно через 12—48 часов. В скрытие: кровоизлияния (часто точечные) во всех паренхиматозных органах и на слизистой оболочке гортани и трахеи.
При подострой и хронической форме: учащенное, затрудненное, свистящее дыхание, насморк, кашель, чихание. Болезнь затягивается до двух и более недель. Вскрытие: катаральный или гнойно-катаральный ринит, бронхопневмония (иногда крупозная), серозно-фибринозный плеврит.
Диагноз подтверждается бактериологическим исследованием. Профилактика: выделение бактерионосителей и проведение санитарных мероприятий.
Паратиф поражает чаще всего крыс и мышей, но возможна передача инфекции морским свинкам и кроликам. Главные разносчики инфекции—животные-бактерионосители. Заболевание протекает в виде септицемии (острая форма) с клиникой поноса (фекальные массы желтовато-зеленоватого цвета), отказа от корма и общего угнетения. Смерть наступает обычно через 24—48 часов. При хроническом течении клинические признаки выражены неясно: апатия, уменьшение аппетита, взъерошенность шерсти, понос, у самок часто аборты.
Картина вскрытия при острой форме — увеличение селезенки и мезентериальных лимфатических узлов; слизистая кишечника воспалена, с наличием кровоизлияний и мелких просовидных узелков; при хронической форме изменения те же, содержимое кишечника слизистое, пенистое, желтоватого цвета. Диагноз устанавливают бактериологическим исследованием.
Профилактика: выявление бактерионосителей путем реакции агглютинации (титр 1:200 и выше считается положительной реакцией); карантин в течение 20 суток для вновь поступающих животных, соблюдение зоогигиенических и ветеринарно-санитарных правил.
Туляремия. Заболевают крысы, мыши, реже кролики и морские свинки. При вскрытии обнаруживается увеличение лимфатических желез и селезенки с образованием некротических узелков. Такие же изменения находят в печени и в легких, а также подкожные гнойники (особенно у кроликов). Для постановки диагноза необходимо бактериологическое исследование. Профилактика: приобретение животных из заведомо благополучных хозяйств, обязательный карантин при поступлении животных, периодические ветеринарные осмотры. Больных животных немедленно убивают. Дезинфекция.
Псевдотуберкулез. Чаще заболевают кролики и морские свинки. Возбудитель—палочка псевдотуберкулеза грызунов. Клиника не характерна: угнетенное состояние, отказ от корма, постепенное исхудание, иногда опухание лимфатических узлов, поносы, параличи. Продолжительность заболевания от нескольких дней до 5—6 недель; смерть от истощения. Вскрытие: поражение паренхиматозных органов, кишечника, иногда мышц, в виде мелких узелков, имеющих лучистую форму серо-белого цвета. Увеличение лимфатических узлов, преимущественно, брюшной полости. Диагноз ставят на основании патолого-анатомической картины и результатов бактериологического исследования. Меры борьбы: убой больных животных, карантинирование подозреваемых в заражении, дезинфекция.
Кокцидиоз. Чаще всего поражаются кролики. Различают кишечную, печеночную и смешанную формы. Заболевание протекает остро и хронически (последнее чаще у взрослых кроликов, острое — у молодняка). Заражение происходит через корм и воду, загрязненную фекалиями, содержащими зрелые ооцисты кокцидий.
Кролики — постоянные носители и выделители кокцидий, которые, выделяясь в виде ооцист с калом, через 2—3 дня созревают и становятся способными к заражению животных.
Клиника: при острой форме — истощение, вздутие живота, понос, кроликов—потеря аппетита, прогрессирующее исхудание, периодическое появление жидкого кала.
При вскрытии — катар слизистой кишечника или наличие в печени белых узелков величиной от булавочной головки до горошины. Диагноз — на основании микроскопического обнаружения ооцист кокцидий. Меры борьбы и профилактика: лечение, создание благоприятных условий содержания животных, сухость в клетках, полноценное кормление, ежедневная чистка клеток, инвентаря, периодическая их дезинфекция, биотермическое обезвреживание навоза.
Лабораторные животные могут поражаться спирохетозом (кролики), септикопиэмией, энтеротоксемией, листериозом, рядом глистных инвазий, грибками и накожными паразитами (чесотка, парша, стригущий лишай и др.).
Радюк Екатерина Васильевна – врач-лаборант ИВЦ МВА
Инфекционные заболевания весьма часто встречаются в ветеринарной практике. Для владельца животного важно вовремя обратить внимание на симптомы недомогания питомца. Для большинства инфекционных заболеваний эти симптомы неспецифичны: угнетение, отказ от корма, повышенная температура тела, рвота, понос; при некоторых заболеваниях встречается хромота и опухание суставов; возможно изменение цвета мочи.
Для ветеринарного врача, к которому приводят заболевшее животное, важно составить список дифференциальных диагнозов и исключить (или подтвердить) их специальными методами диагностики. Однако стоит помнить, что выбор диагностического метода будет зависеть от вида возбудителя, его локализации и стадии заболевания. Методика, применимая для диагностики одной инфекции, совершенно неприемлема для диагностики другой.
В данной статье представлен обзор основных методов диагностики инфекционных заболеваний, которыми располагает современная ветеринарная медицина.
Возбудители многих заболеваний, как правило, достаточно требовательны к питательным средам и достаточно сложны для культивирования invitro. Не для всех возбудителей определены условия культивирования. В некоторых случаях используют синтетические или полусинтетические среды – однако при этом рост возбудителей очень медленный (до нескольких месяцев) и всегда присутствует значительный риск грибковой или бактериальной контаминации, несмотря строгое соблюдение асептики. Кроме того, проведение работ по культивированию возможно только в специализированных микробиологических лабораториях. Поэтому в ветеринарии данный метод не нашел широкого применения при диагностике инфекционных заболеваний; работы, связанные с культивированием возбудителей, проводятся, как правило, только в специальных исследовательских институтах с целью их более детального изучения и разработки диагностических тест-систем.
2. Световая микроскопия
1) Микроскопия фиксированных окрашенных препаратов
Является наиболее доступным и потому распространенным методом диагностики инфекционных (особенно трансмиссивных) заболеваний в ветеринарной медицине. Основан на выявлении возбудителя в клиническом материале по характерной морфологии. Однако, несмотря на свою простоту и доступность, у этого метода есть свои недостатки.
Во-первых, у метода световой микроскопии достаточно ограниченная чувствительность. При незначительном количестве возбудителей в материале результат микроскопии может быть отрицательным.
Во-вторых, необходимо тщательное приготовление и окраска мазков для минимизации возможных артефактов.
В-третьих, лаборанту или врачу, интерпретирующему мазок, требуется достаточный опыт и хорошее знание морфологии как клеток тканей, так и возбудителей и умение отличать последних от возможных рефракционных артефактов или преципитатов красителя. И, в-четвертых, точное определение вида возбудителя при использовании только световой микроскопии возможно далеко не всегда. Поэтому световую микроскопию стараются дополнять другими методами диагностики, основанными на обнаружении специфических антител либо генетического материала возбудителя.
2)Темнопольная микроскопия
Вид оптической микроскопии, в которой контраст изображения увеличивают за счет регистрации только света, рассеянного изучаемым образцом. Как правило, используется для обнаружения спирохет - боррелий и лептоспир. Из-за необходимости наличия специального оборудования в рутинной ветеринарной практике применяется редко. Кроме того, с помощью темнопольной микроскопии невозможно определить видовую принадлежность возбудителя и его патогенность.
3. Полимеразная цепная реакция (ПЦР)
Полимеразная цепная реакция (ПЦР) – это метод ферментативного получения ампликонов (большого количества копий) исследуемых фрагментов ДНК путем повторных циклов репликации и денатурации (разделения цепи ДНК на отдельные нити); при этом происходит копирование только исследуемого участка ДНК (при условии его присутствия в данном образце), поскольку только этот участок соответствует заданным условиям.
Метод ПЦР идеально подходит для обнаружения микроорганизмов, трудно визуализирующихся, медленно растущих или сложных в культивировании. ПЦР является наиболее предпочтительным методом для диагностики заболевания в острый период. Основным лимитирующим фактором при использовании ПЦР является содержание в исследуемой пробе достаточного количества материала (нуклеиновой кислоты возбудителя). Для многих возбудителей известно, что их количество в крови меняется с течением времени; таким образом, в какой-то момент времени ПЦР может показать ложноотрицательный результат у инфицированного пациента. Таким образом, для врача крайне важно знать тропность возбудителя к тканям организма и отправлять на исследование тот материал, в котором вероятность обнаружения возбудителя наиболее высока (например, мочу – при диагностике лептоспироза, плаценту или пунктат семенников при подозрении на бруцеллез, синовиальную жидкость - при исследовании на боррелиоз).
4. Серологические методы диагностики
Данные методы основаны на выявлении у животных специфических антител. Заражение инфекционным агентом, если оно происходит впервые, в течение недели вызывает у животного умеренный рост иммуноглобулинов класса М (IgM) и постепенное увеличение иммуноглобулинов класса G (IgG), которое достигает пика через 14 дней. Определение уровня антител у животных с остро начинающимся заболеванием (таким как бабезиоз) дает мало полезной диагностической информации. Для диагностики хронических заболеваний (например, моноцитарного эрлихиоза) измерение уровня антител будет более полезным.
Продукция антител у каждого животного может сильно варьироваться; этот процесс зависит от возраста, иммунного статуса и генетической принадлежности. Лучший способ оценки степени сероконверсии заключается в исследовании парных сывороток, взятых с интервалом в 2-3 недели. Растущий титр антител указывают на недавнюю и, следовательно, клинически значимую инфекцию, особенно если это подтверждается соответствующими клиническими признаками. Альтернативным методом определения недавней инфекции является измерение уровня IgM, однако в ветеринарной практике данный метод практически не используется.
1) Твердофазный иммуноферментный анализ (ИФА, ELISA)
Принцип метода заключается в том, один их специфических реагентов (антиген) иммобилизуют на твердой фазе. Затем последовательно добавляют другие специфические реагенты, проводя после инкубации каждого из них промывку с целью удаления несвязавшихся компонентов. Один из специфических реагентов, так называемый конъюгат, содержит ферментную метку. Для визуализации результата в конце реакции добавляют хромогеновый субстрат. Через определенный промежуток времени реакцию останавливают и проводят считывание на спектрофотометре.
Для определения титра антител в сыворотке готовят несколько последовательных разведений; титр антител определяется как обратный последнему видимому разведению (к примеру, если последнее разведение было 1:2000, то титр антител составит 2000). Метод твердофазного ИФА является наиболее предпочтительным для определения наличия антител к возбудителям, антигены которых легкодоступны (т.е. это либо легко культивируемые микроорганизмы, либо те, для которых получены рекомбинантные антигены). Кроме того, он может использоваться и для выявления антигенов возбудителя – например при диагностике инвазии Dirofilariaimmitisили вируса лейкемии кошек.
Для использования полноценного твердофазного иммуноферментного анализа необходимо наличие специального лабораторного оборудования. Однако существует экспресс-модификация ИФА (SNAP, IDEXX Laboratories), где антиген/антитела иммобилизированы не на плашке, а на мембранном фильтре. Эти тесты широко используются в клиниках для диагностики трансмиссивных заболеваний (лейшманиоза, дирофиляриоза, анаплазмоза, эрлихиоза и боррелиоза). Однако они не дают возможность зафиксировать рост или снижение титра антител, а также определить их принадлежность к M или G классу.
2) Метод флюоресцирующих антител (МФА, IFA)
В случае, когда культивирование микроорганизма сопряжено с техническими сложностями либо небезопасно, применяют метод иммунофлюоресценции. При этом может быть обнаружен как сам организм в зараженных клетках и тканях пациента (прямой МФА) либо наличие в сыворотке специфичных антител (непрямой МФА). В непрямом МФА зараженные клетки (как правило, культурального происхождения) зафиксированы на предметных стеклах либо планшетках. Сама процедура исследования схожа с таковой в ИФА. Однако в конъюгате вместо фермента здесь используется специальный краситель, дающий при определенной длине волны флюоресцентное свечение, которое можно видеть в специальный микроскоп. Количество антител также определяется по последнему разведению, давшему положительный результат.
Прямой МФА считается менее чувствительным; используется в тех случаях, когда число зараженных клеток невелико (например, для выявления в мазках крови морул Anaplasmaphagocytophilum).
3) Иммуноблот (вестерн-блот)
Таким образом, в статье были рассмотрены основные методы, применяемые сегодня для диагностики инфекционных заболеваний животных. Особое внимание хотелось бы уделить тому, что не существует какого-либо универсального метода для диагностики того или иного заболевания. Поэтому от врача при постановке диагноза требуется комплексный подход; необходимо учитывать анамнез, длительность заболевания, клинические признаки и данные общих лабораторных исследований.
Кроме того, необходимо умение правильно интерпретировать результаты – ведь даже обнаружение антител (особенно класса G) к тому или иному возбудителю не говорит о том, что именно этот этиологический агент является причиной нынешнего состояния животного. Только грамотное применение и интерпретация специальных методов исследования (не только при диагностике трансмиссивных заболеваний) в сочетании с клинической картиной дает возможность правильно поставить диагноз и назначить адекватное лечение.
12.3. Способы заражения лабораторных животных
В зависимости от цели исследования используют различные способы заражения: внутрикожный, подкожный, внутримышечный, внутрибрюшинный, внутривенный, пероральный или интраназальный. При перечисленных способах, за исключением перорального и интраназального, заражение осуществляется с помощью шприца.
Взвесь микробной культуры, эмульсию из зараженных органов или кровь больного осторожно набирают в шприц, после чего конец иглы закрывают кусочком ваты, смоченным 5,0 % раствором хлорамина или спиртом. Повернув шприц иглой кверху, осторожно выпускают из него пузырьки воздуха и вводят содержимое шприца животному.
Внутрикожный способ заражения. При этом способе применяют тонкие (№ 18–20) острые иглы с небольшим скосом. Кожу в месте введения материала растягивают I и II пальцами левой руки, правой рукой вводят иглу под очень острым углом, почти касаясь кожи. Конец иглы должен быть виден через эпидермис: при введении материала эпидермис приподнимается в виде четко ограниченного бугорка, кожа над ним становится прозрачной и пористой, вследствие чего ее сравнивают иногда с лимонной корочкой. Материал вводят в объеме до 0,1 мл обычно в кожу спины или живота.
Подкожный способ заражения. Кожу в месте введения материала приподнимают I и II пальцами левой руки. Иглу шприца вкалывают в основание образовавшейся складки. Проколов кожу и пройдя вглубь на несколько миллиметров, иглу отклоняют вправо или влево и затем медленно вводят материал, содержащийся в шприце. Изменять направление иглы под кожей рекомендуется для того, чтобы введенное вещество не выступало через прокол кожи наружу. Затем складку кожи опускают, на место укола накладывают ватный тампон, смоченный спиртом или спиртовым раствором, а иглу быстро вынимают. Наиболее удобными местами для подкожного введения материала у кроликов и морских свинок являются область спины и боковые поверхности несколько ниже подмышечных впадин, у крыс и мышей – область спины, крестца и затылка. Количество жидкости, вводимой подкожно, не должно превышать 30 мл для кроликов, 15 мл – для морских свинок, 10 мл – для крыс и 1 мл – для мышей.
Внутримышечный способ заражения. Выбирают участок тела с наиболее развитым мышечным слоем. У кроликов, морских свинок, крыс и мышей таким местом является наружная верхняя треть бедра задней лапы. Захватывают I и II пальцами левой руки толстую мышечную складку и вводят иглу почти под прямым углом в глубь мышц. Объем жидкости, допустимый для внутримышечного введения, составляет для кроликов 8 мл, для морских свинок – 5 мл, для крыс – 3 мл, для мышей – 0,5 мл.
Внутрибрюшинный способ заражения. Помощник держит животное вниз головой. В этом положении кишечник смещается в сторону диафрагмы, что в значительной мере уменьшает возможность его повреждения в момент прокола. У животных (за исключением мышей) в нижней трети живота, несколько отступя от средней линии, делают скальпелем или остроконечными ножницами надсечку кожи длиной 2–3 мм и через нее вводят притуплённую иглу, держа шприц перпендикулярно брюшной стенке. Преодолевая сопротивление, очень осторожно, буравящими движениями иглу продвигают вглубь. Чувство "провала", исчезновение ощущения сопротивления на пути говорят о проникновении иглы в брюшную полость. После этого иглу переводят в вертикальное положение и вводят содержащийся в шприце материал в полость брюшины. Внутри-брюшинно можно вводить до 30 мл жидкости кроликам, до 10мл – морским свинкам, до 5 мл – крысам, до 2 мл – мышам.
Внутривенное заражение кроликов. Кроликов заражают в краевую вену уха. Вдоль наружного края уха выщипывают шерсть, затем это место слегка пощелкивают кончиками пальцев, чтобы вызвать гиперемию сосудов, и протирают ватой, смоченной в 70 % спирте. После явного набухания вены под ухо подводят II палец левой руки. Прокол вены следует делать ближе к верхушке уха, так как при частых уколах возможна облитерация сосуда в этом месте, но проксимальный участок вены остается неповрежденным. Чтобы удостовериться, правильно ли введена игла, сначала вводят небольшое количество материала. При нахождении иглы в полости вены материал вводится свободно, в противном же случае жидкость из шприца вытекает с трудом, а на ухе в месте введения образуется вздутие. Если игла не попала в вену, ее вынимают и вводят повторно в другое место ближе к основанию уха. По окончании введения нижний участок вены слегка придавливают, а к месту укола прикладывают кусочек стерильной ваты, смоченной спиртом или спиртовым раствором йода, после чего из вены извлекают иглу. Внутривенно кроликам можно вводить до 20 мл жидкости.
Внутривенное заражение крыс и мышей. Крыс и мышей заражают в боковую вену хвоста. Непосредственно перед введением материала хвост животного, чтобы вызвать гиперемию сосудов, погружают в сосуд с водой, подогретой до 50°С, смазывают ксилолом или толуолом. После того как сосуды заметно набухают, корень хвоста сдавливают пальцами. Для введения материала лучше всего пользоваться туберкулиновыми иглами, очень тонкими и короткими, с косым срезом. При введении иглы в вену шприц держат под острым углом, почти параллельно оси хвоста. Иглу поворачивают отверстием наружу. Корень хвоста освобождают от сдавливания. Как и в предыдущем случае, нахождение иглы в вене определяют по легкости введения материала и отсутствию заметного уплотнения в месте, где находится игла. Взрослым белым крысам допускается вводить до 6 мл жидкости, мышам – до 0,5 мл.
Заражение через пищеварительный тракт. Заразить животное через рот можно двумя способами. Материал, предназначенный для заражения, примешивают к корму или питью животного. Такой способ является наиболее простым и естественным, однако в лабораторной практике применение его ограничено, поскольку количество материала, попадающее в организм заражаемого животного, не подлежит точному учету.
В связи с этим значительно чаще материал, предназначенный для заражения, вводят животному шприцем, игла которого имеет незначительный изгиб и утолщение на конце в виде оливы. Наличие изгиба допускает введение иглы в пищевод животного. Диаметр иглы для мышей должен быть не более 1 мм, для крыс – 1–1,5 мм, длина – соответственно 35–45 и 70–75 мм.
Крыс и мышей фиксируют перед заражением в вертикальном положении: одной рукой помощник держит животное за складку кожи на затылке, около ушей, другой – за корень хвоста. Животным открывают рот браншами пинцета, вставляя их между нижней и верхней челюстями. Иглу, введенную в рот, продвигают по задней стенке глотки на глубину 1 см у мышей и 2–2,5 см у крыс. На указанной глубине игле придают вертикальное положение. Процесс введения иглы, как правило, затруднений не представляет, конец ее проникает непосредственно в желудок или в нижний отдел пищевода. Количество материала, вводимого за один раз в желудок мышей, должно быть не более 1 мл, взрослых крыс – не более 3,5 мл (рис. 12.7).
А.Е.Попова (1972) при пероральном введении жидкостей мелким лабораторным животным предложила пользоваться вместо металлического зонда с оливой полихлорвиниловой трубкой, представляющей собой наружную оболочку одного про вода многожильного телефонного кабеля, из которого удален проводник. Длина трубки 15–17 см, наружный диаметр 1– 1,5 мм, внутренний просвет 0,5–0,7 мм.
Рис. 12.8. Заражение кролика per os.
В отличие от металлического зонда, часто попадающего в дыхательные пути и вызывающего гибель животных от асфиксии, а при глубоком введении повреждающего стенку желудка и пищевода, эластический зонд при незначительном усилии легко проникает из полости рта в пищевод и желудок животного, не требуя строгого ограничения глубины введения, так как даже при излишне глубоком введении стенки желудка не повреждаются.
Вводимая жидкость дозируется с помощью шприца, на сосок которого надевают эластичный зонд.
Морских свинок и кроликов перед заражением peros фиксируют в нормальном для животного положении. Удобнее всего завернуть их в полотенце и посадить к помощнику на колени.
Зараженный материал вводят через эластичный зонд. Для этой цели обычно выбирают катетер из наиболее мягкой и эластичной резины длиной 7,5–8 см и толщиной не более 0,3–0,5 см. Перед введением зонда в рот животному вставляют роторасширитель, или, как его называют, "зевник", который представляет собой дощечку с круглым отверстием в середине. Ширина дощечки для кролика равна 2 см, для морской свинки – 1 см. Через отверстие вставленного в рот "зевника" осторожно вводят в пищевод зонд, смазанный вазелином или глицерином. Для того чтобы облегчить введение зонда, животному вливают пипеткой в рот несколько капель воды, вызывая глотательные движения, во время которых зонд легко, без внешнего воздействия продвигается в глубь пищевода. Наружный конец введенного зонда присоединяют к шприцу, наполненному материалом, который вводят в желудок медленно в количестве 2,5–3,5 мл морским свинкам и 3,5–5 мл кроликам (рис. 12.8).
Заражение через дыхательные пути (интраназальное заражение). Животному, фиксированному на доске, прикладывают к носу кусочек ваты, смоченной эфиром или хлороформом. К заражению приступают после того, как у животного появится состояние легкого наркоза. Зараженный материал с помощью шприца вводят в нос небольшими каплями на глубину 1–1,5 мм мышам, 2–3 мм крысам, 4 мм кроликам и морским свинкам. Чтобы не поранить слизистые оболочки, для введения материала берут абсолютно тупую иглу.
Микроскопия (световая, люминесцентная)
Микроскопия (люминесцентная, световая, электронная)
Выделение вируса биопроба
Гематологический
Примечание. Для каждой болезни существует перечень показателей, по которым диагноз считают установленным.
Благодаря правильному и своевременному диагнозу удается обеспечить эффективность оздоровительных мероприятий, т. е. быстро купировать возникший эпизоотический очаг и предупредить дальнейшее распространение болезни.
Эпизоотологический метод. Представляет собой систему изучения проявлений эпизоотического процесса. Для характеристики последнего необходимо собрать точную информацию о восприимчивых видах, источнике и резервуаре возбудителя болезни, механизме его передачи, воротах инфекции, интенсивности проявления эпизоотического процесса, сезонности, предрасполагающих факторах, заболеваемости, смертности, летальности. Кроме того, особое внимание обращают на факторы, определяющие пути дальнейшего распространения заболевания — выполнение противоэпизоотических мероприятий и условия внешней среды.
Чтобы охарактеризовать эпизоотическое состояние хозяйства, сопоставляют и оценивают обобщенные эпизоотологические показатели, получаемые путем статистической обработки данных первичного учета заболеваний и профилактических мероприятий.
Клинический метод. При клиническом исследовании животных, подозреваемых в заболевании инфекционной болезнью, необходимо всегда строго соблюдать правила работы, предусмотренные соответствующей инструкцией.
Клиническое исследование рекомендуют начинать с измерения температуры тела животного. Далее осматривают животное в нефиксированном состоянии: обращают внимание на положение тела реакцию на различные раздражители, прием корма и воды, характер фекалий, особенности дефекации и мочеиспускания. Затем приступают к исследованию отдельных систем и органов по схеме, общепринятой в клинической диагностике болезней.
Клинические признаки инфекционной болезни зависят от многих факторов: вида и локализации возбудителя, течения, формы проявления и стадии болезни, резистентности организма и других причин. Во всех случаях клинические признаки одной и той же инфекционной болезни у животных даже одного вида сильно варьируют.
Патоморфологический метод. Включает в себя патологоанатомический и гистологический методы исследований. Патологоанатомический метод считают важным, но не всегда окончательным методом диагностики. Например, если при вскрытии трупа животного (птицы) отмечают характерные изменения — туберкулы, то сразу же диагностируют туберкулез, при обнаружении в селезенке свиньи краевых геморрагических инфарктов — чуму, кровоизлияний на границе мышечного и железистого желудка у кур — болезнь Ньюкасла и т. д.
Порядок патологоанатомического исследования: оценивают состояние трупа, кожи и слизистых оболочек, затем исследуют лимфатическую систему, серозные покровы, мышцы и суставы, органы дыхания, сердце и кровеносные сосуды, печень, селезенку, почки, глотку, пищевод, желудок, тонкий кишечник, толстый кишечник, мочевой пузырь, органы воспроизводства, головной и спинной мозг.
Однако во многих случаях наряду с патологоанатомическим применяют и метод лабораторных исследований (гистологических, бактериологических и др.). С помощью гистологического метода устанавливают точный диагноз при таких болезнях, как - бешенство (тельца Бабеша—Негри), ринопневмония (внутриядерные включения типа Коудри), оспа (тельца-включения).
Бактериологический метод. Это ценный метод диагностики инфекционных болезней. Для бактериологического исследования от больных или павших животных необходимо правильно взять патологический материал и грамотно оформить сопроводительный документ. Поступивший биоматериал обрабатывают в зависимости от предполагаемой болезни, делают мазки-отпечатки, красят их соответствующими методами, выделяют чистую культуру посевом на питательные (элективные) среды, заражают чувствительных лабораторных животных биоматериалом или выделенной чистой культурой (табл.1).
1. Бактериологический метод диагностики некоторых инфекционных болезней
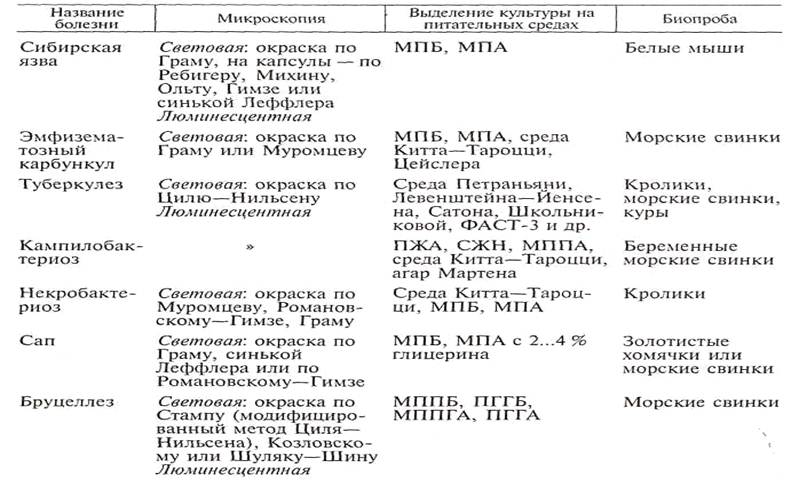
На основании обнаружения патогенных микроорганизмов в поступившем материале устанавливают этиологический диагноз.
Вирусологический метод. Для вирусологического исследования в лабораторию направляют патологический материал от больных животных, взятый в период проявления у них клинических признаков (температурная реакция, угнетение, воспалительные процессы в верхних дыхательных путях, сопровождающиеся серозными или слизистыми истечениями из носовой полости, диарея, образование везикул, афт, иногда аборты), или вынужденно убитых (павших) животных, взятый не позднее чем через 2 ч после их гибели. Вирусологический метод диагностики включает в себя: обнаружение возбудителя в патологическом материале различными методами (электронная, люминесцентная или световая микроскопия, заражение культуры клеток, лабораторных животных и т. д.), выделение и идентификацию вируса в различных серологических реакциях, биопробу.
Гематологический метод. В лабораторию для гематологического исследования отправляют кровь, которую берут с соблюдением правил асептики из яремной вены в пробирки с антикоагулянтом— 10 %-м раствором трилона Б, гепарина, цитрата натрия из расчета 0,02 мл раствора на 1 мл крови.
Гематологический метод используют как вспомогательный, а при некоторых инфекционных болезнях (лейкоз крупного рогатого скота, инфекционная анемия лошадей) — в качестве основного метода диагностики. При лейкозе крупного рогатого скота диагноз основан на обнаружении в периферической крови повышения содержания лейкоцитов основного лимфоидного ряда в 1-10-3 мл крови, а при инфекционной анемии лошадей — на основании снижения содержания эритроцитов в 1 • 103 мл крови, гемоглобина и замедленной скорости оседания эритроцитов (СОЭ).
Иммунологический метод. Включает в себя серологическую диагностику — в лаборатории исследуют сыворотки крови для обнаружения антител и аллергическую пробу, с помощью которой в хозяйствах выявляют животных, больных туберкулезом, паратуберкулезом, бруцеллезом, сапом, реже — сибирской язвой, листериозом, туляремией.
Читайте также:


