Инфекция в сосудистой хирургии затевахин
Изобретение относится к медицине, а именно к сосудистой хирургии. Осуществляют повторную артериальную васкуляризацию конечности при помощи глубоких магистральных вен. В качестве шунта используют сопутствующие артериям бесклапанные подвздошные и общую бедренную вены, которые не выделяют из своего естественного ложа. Способ позволяет повысить эффективность лечения больных с нагноениями синтетических сосудистых протезов. 2 ил.
Изобретение относится к медицине, а именно к сосудистой хирургии, и может быть использовано при лечении больных с инфекцией сосудистых протезов, имплантированных в аортоподвздошно-бедренную позицию.
Несмотря на значительный успех реконструктивной сосудистой хирургии артериальных окклюзий с использованием синтетических протезов нерешенной проблемой остается лечение их инфекций. Так летальность при нагноении аортобедренных трансплантатов достигает 33-58%, а частота ампутаций 79% (Hick R.C.J., Greenhaigh R.M. The pathogenesis of Vascular Graft infection. Eur.J. Surg.& Endovascular Surg. 1997; 14:5-10).
Известные способы лечения инфекций сосудистых протезов, заключающиеся в удалении бактериально обсеменного синтететического материала и обходной или экстраанатомической реваскуляризации конечности, приводят у многих больных к неудовлетворительным результатам, при этом уровень смертности составляет от 20 до 25%, а частота ампутаций - от 10 до 15% (Невельстин А., Лакруа X., Суй Р. Аутореконструкции in situ при инфекции аортальных протезов: значение глубоких вен нижних конечностей. Ангиология и сосудистая хирургия, 1997, №3, с. 98-106). Основной причиной неудач при данном виде операций является отсутствие адекватного пластического материала и повторная имплантация больным с генерализованной инфекцией сосудистого протеза. Как следствие, нередко наблюдается его нагноение с развитием гнойно-септической интоксикации или арозивного кровотечения из анастомозов (Затевахин И.И., Комраков В.Е. Инфекция в сосудистой хирургии. - М., 1998, с.146 - 153). Использование в качестве пластического материала большой подкожной вены ноги из-за ее малого диаметра не всегда возможно, особенно в аортобедренной позиции (Танрыбердиев М.О., Ниязтуваков Х.А., Велбаев М.Т. Протезирование инфицированного участка бедренной артерии сегментом поверхностной бедренной вены при арозивном кровотечении. Вестник хирургии, 1997, №3, т. 156, с.80). В связи с чем предложено применять глубокие бедренные вены в качестве заместительного материала при реконструкции артерий (Зотов С.П., Фокин А.А, Важенин А.В, Вербовецкий Л.П. Использование поверхностной бедренной вены в реконструктивно-восстановительной хирургии сосудов. Грудная и сердечно-сосудистая хирургия, 1993, №5, с.72-75).
Наиболее близким по положительному результату (прототип) является способ повторного аортобедренного протезирования после удаления инфицированного синтетического сосудистого протеза при помощи глубоких вен нижних конечностей (Невельстин А., Лакруа X., Суй Р. Аутореконструкции in situ при инфекции аортальных протезов: значение глубоких вен нижних конечностей. Ангиология и сосудистая хирургия, 1997, №3, С. 98-106). В известном способе в качестве пластического материала используется аутовенозный трансплантат из поверхностной бедренной вены. Последнюю выделяют из линейного разреза по медиальной поверхности бедра, тотчас ниже устья глубокой вены бедра и до уровня подколенной вены, в зависимости от требуемой длины шунта. После удаления инфицированного синтетического сосудистого протеза осуществляют решунтирование артерий путем помещения забранной аутовены в ложе удаленного синтетического протеза. При этом для двусторонних реконструкций используют собственно-бедренные вены обеих нижних конечностей.
Недостатки прототипа: во-первых, высокая дополнительная травма больного, возникающая при протяженном выделении бедренной вены, что в условиях ангиогенного сепсиса является дополнительным отягощающим фактором; во-вторых, проведение аутовенозного шунта через инфицированное ложе ранее имплантированного протеза повышает риск инфекции вновь наложенных сосудистых анастомозов, и в-третьих, значительное число коллатеральных ветвей, подвергнутых перевязке при мобилизации магистральной вены ноги, способствуют формированию выраженной регионарной венозной гипертензии.
Положительным результатом заявляемого способа является повышение эффективности лечения больных с нагноениями синтетических сосудистых протезов.
Положительный результат достигается тем, что в качестве шунта используют сопутствующие артериям, рядом лежащие бесклапанные подвздошные и общую бедренную вены, которые не выделяют из своего естественного ложа.
Способ осуществляют следующим образом.
Под общим обезболиванием, после обработки операционного поля антисептиком выделяют проксимальный и дистальный анастомозы инфицированного синтетического сосудистого протеза с подвздошной и бедренной артерией. После предварительного пережатия артерий снимают анастомозы и удаляют инфицированный сосудистый протез. Затем выделяют рядом лежащую общую или наружную подвздошную вену на участке, необходимом только для формирования центрального анастомоза. Проксимальный отрезок вены перевязывают, а дистальный - пережимают сосудистым зажимом, после чего вену пересекают. Коллатеральные вены, впадающие в месте предполагаемого анастомоза в магистральную вену, перевязывают и пересекают. Далее формируют соустье между проходимой подвздошной артерией и мобилизованной на этом уровне - подвздошной веной. Следующим этапом выделяют общую бедренную вену, на уровне предполагаемого дистального анастомоза. Проводят ее мобилизацию с перевязкой дистального участка и пересекают на уровне предполагаемого артериовенозного анастомоза. Боковые ветви, впадающие на этом уровне в бедренную вену, перевязывают и пересекают. Катетером Фогерти и сосудистой петлей осуществляют ревизию включаемого в артериальный кровоток венозного сегмента на предмет наличия в нем клапанов. В случае их выявления, над клапаном делают надрез вены и проводят иссечение его створок с последующим атравматическим швом стенки вены. Формируют дистальный анастомоз магистральной вены и артерии с последующим запуском артериального кровотока в конечность по магистральной вене, выполняющей в данном случае роль артериального сосудистого протеза. Ложе инфицированного протеза дренируют. Операционные раны зашивают.
Клиническое наблюдение: Больной: Ю., 48 лет (история болезни №4335) поступил в отделение сосудистой хирургии 6.09.01 с жалобами на постоянные боли в пальцах левой стопы, ограничение их подвижности и снижение чувствительности. Из анамнеза считает себя больным в течение 8 месяцев, когда впервые отметил перемежающую хромоту в левой нижней конечности. Консервативное лечение по месту жительства имело кратковременный успех, и в связи с прогрессированием заболевания госпитализирован для обследования и лечения в клинику.
При поступлении общее состояние больного удовлетворительное. При исследовании объективного статуса существенных отклонений от нормы не выявлено. Локально: отмечается бледность кожных покровов левой стопы и голени, некоторое снижение чувствительности и объема активных движений в голеностопном суставе. Пульсация магистральных артерий на правой нижней конечности определяется на всех уровнях, а на левой - только на общей бедренной артерии.
В результате клинического обследования выставлен диагноз: облитерирующий атеросклероз, слева - стеноз подвздошных артерий, окклюзия собственно-бедренной артерии, 3 степень артериальной ишемии. При дуплекс-сканировании и аортоартериографии отмечается пролонгированный стеноз наружной подвздошной артерии до 55%, окклюзия собственно-бедренной артерии от устья глубокой артерии бедра до подколенной артерии. Артерии правой нижней конечности без гемодинамически-значимых стенозов и участков окклюзии.
В связи с критической ишемией конечности, обусловленной пролонгированным стенозом наружной подвздошной артерии и окклюзией собственно-бедренной артерии слева, больному решено выполнить подвздошно-бедренное шунтирование с поясничной симпатэктомией.
Оперирован 14.07.2001. Под эндотрахеальным наркозом, вертикальным разрезом в паховой области выделена левая общая бедренная артерия (ОБА), ее бифуркация, начальные участки глубокой артерии бедра (ГБА) и собственно-бедренной артерии (СБА). По задней стенке ОБА с переходом на устье ГБА и СБА имеется плотный белый тромб, суживающий устье ГБА и окклюзирующий собственно-бедренную артерию. Проведена продольная артериотомия и тромбинтимэктомия из ОБА и устья ГБА до получения хорошего ретроградного кровотока. Восстановить проходимость собственно-бедренной артерии не удалось, и для создания более оптимального дистального анастомоза осуществлена ее перевязка и пересечение тотчас ниже бифуркации ОБА. Параректальным доступом слева послойно вскрыта забрюшинная клетчатка и выделена бифуркация общей подвздошной артерии (ОПА). При ревизии наружная подвздошная артерия с кальцинированными продолженными бляшками, суживающими ее просвет до 50-60%. Выполнить из нее эндартерэктомию не представляется возможным. Наружная подвздошная артерия (НПА) отсечена от бифуркации ОПА. Далее сформирован центральный анастомоз между бифуркацией ОПА и синтетическим сосудистым протезом диаметром 8 мм атравматической нитью 3-00. Протез проведен на бедро и сформирован его дистальный анастомоз с устьем глубокой артерии бедра нитью пролен 5-00. Запущен кровоток по шунту, гемостаз раны. Поясничная симпатэктомия 3 ганглия слева. Дренирование забрюшинной клетчатки и паховой раны двумя активными дренажами. Послойно швы на раны, повязки.
На вторые сутки после операции у больного появилась и стала нарастать клиника флеботромбоза конечности. Дополнительно к лечению были назначены гепарин и дезагреганты. Через трое суток удалены дренажи из забрюшинного пространства и ложа протеза. Через 13 суток после повторной операции больной в удовлетворительном состоянии с зажившими ранами, функционирующим подвздошно-глубокобедренным аутовенозным шунтом и компенсированной ишемией конечности выписан из клиники. При этом окружность голени на оперированной конечности превышает противоположную на 4 см, а бедро на 2 см. Контрольное дуплекс-сканирование: подвздошно-бедренный аутовенозный шунт проходим, отмечаются признаки тромбоза глубокой и собственно-бедренной вены. Внутренняя и общая подвздошные вены проходимы. Плечелодыжечный индекс на правой ноге -1,07; на левой - 0,53.
Повторно обследован через 40 дней после выписки из стационара (история болезни №5870). Из жалоб отмечает перемежающую хромоту через 400-500 метров, увеличение окружности бедра и голени до 2 см после ортостатических нагрузок. Локально: левая стопа и голень с умеренным цианозом и усилением подкожной венозной сети. Превышение окружности оперированной конечности над здоровой на уровне бедра 2 см, а голени 2,5 см. Пульсация артерий на правой нижней конечности определяется на всех уровнях, а слева только в паховой области. При дуплекс-сканировании и последующей артериографии (Фиг.1) и флебографии (Фиг.2) наружная подвздошная и общая бедренная вены в качестве артериального шунта свободно проходимы, их диаметр 10 мм, анастомозы без признаков стеноза. В собственно-бедренной вене признаки тромбоза с реканализацией. На уровне выключенных общей бедренной и наружной подвздошных вен отмечается контрастирование коллатералей, которые впадают в общую подвздошную вену.
Контрольный осмотр через 10 месяцев: локальный статус прежний. Признаков воспаления в области послеоперационных рубцов нет. При дуплекс-сканировании аутовена в артериальной позиции проходима, ее диаметр тотчас ниже центрального анастомоза 12 мм. Дистальный анастомоз без особенностей.
Предлагаемый способ решунтирования артериальной крови при нагноении и удалении синтететического сосудистого протеза отличается от прототипа тем, что в качестве сосуда для повторной артериальной васкуляризации, при нагноении синтетического артериального протеза используют сопутствующие выключенным артериям бесклапанные магистральные вены соответствующего диаметра. При этом нет дополнительной травмы больного, так как данное оперативное вмешательство проводят в пределах операционной раны, через которую осуществляют удаление инфицированного трансплантата. Для повторного проведения трансплантата не используют инфицированный канал синтетического протеза, а артериальный кровоток переключают на рядом лежащие вены, которые не выделяются из своего естественного ложа. И, наконец, выключение из венозного кровотока подвздошных вен не приводит к существенной регионарной гипертензии, так как венозное кровобращение таза представлено хорошо развитой коллатеральной сетью сосудов.
Способ сосудистого шунтирования после удаления инфицированного синтетического сосудистого протеза, включающий повторную артериальную васкуляризацию конечности при помощи глубоких магистральных вен, отличающийся тем, что в качестве шунта используют сопутствующие артериям бесклапанные подвздошные и общую бедренную вены, которые не выделяют из своего естественного ложа.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
РГМУ имени Н.И. Пирогова
Х ронические облитерирующие заболевания аорты и артерий нижних конечностей (обусловленные в большинстве случаев атеросклерозом) составляют более 20% от всех видов сердечно-сосудистой патологии, что соответствует 2–3% от общей численности населения [1]. Так, в эдинбургском исследовании (1990) [2] пациенты с перемежающейся хромотой составили 4,5% в возрастной группе от 55 до 74 лет, а асимптомные поражения отмечены в 8% случаев. Показательно, что лечащие врачи только 30–50% пациентов знали о наличии у последних перемежающейся хромоты [3].
Главной особенностью данной патологии является неуклонно прогрессирующее течение, характеризующееся нарастанием выраженности перемежающейся хромоты и переходом ее в постоянный болевой синдром или гангрену, которая возникает у 15–20% больных [4]. Периоперационная летальность при ампутациях ниже колена составляет 5–10%, выше колена – 15–20%. Летальность в течение первых двух лет после ампутации колеблется в пределах 25–30%, а через 5 лет – 50–75%. При этом после ампутации голени на протезе через 2 года ходят лишь 69,4% больных, а бедра – всего 30,3%.
Летальность после реконструктивных операций, ранее составлявшая 2–13% [5], в настоящее время в ведущих клиниках России не превышает 1,2% [6]. Оценивая необходимое количество операций больным с облитерирующими заболеваниями аорты и артерий нижних конечностей, можно как пример привести США, где в 1995 г. выполнено 400 000 госпитализаций по поводу заболеваний периферических артерий. Было выполнено 50 000 баллонных ангиопластик, 110 000 шунтирований, 69000 ампутаций. При этом расходы при первичной ампутации в развитых странах, таких как Великобритания, превышали вдвое расходы при успешной реваскуляризации [7].
По данным Л.А. Бокерия и соавт. [8], на 1998 г. потребность в реконструктивных операциях на артериальной системе в России составляет 930 на 1 млн населения, ежегодно выполняется не более 22% от необходимого количества.
Патоморфология и патогенез
Термин “атеросклероз” происходит от греческих слов “athtre” – пшеничная кашица и “sclerosis” – твердый. Несмотря на то что патоморфология атеросклероза изучается более 140 лет, начиная с первых работ Р. Вирхова (1856), характер и особенности процессов, происходящих в стенке сосудов при этом заболевании, остаются до конца не ясными. Даже наблюдаемые при микроскопическом исследовании клеточные и внеклеточные изменения в стенке сосуда в области формирования атеросклеротической бляшки трактуются по-разному. При формировании атеросклероза основные изменения происходят в эндотелии и гладких мышечных клетках субэндотелиального слоя интимы.
Различают 4 вида атеросклеротических изменений сосудов:
1. Жировые пятна или полоски, представляющие собой участки бледно-желтого цвета, содержащие липиды, не возвышающиеся над поверхностью интимы. Это наиболее ранние проявления атеросклероза.
2. Фиброзные бляшки – овальные или округлые образования, содержащие липиды, возвышающиеся над поверхностью интимы, нередко сливающиеся в сплошные бугристые поля.
3. Фиброзные бляшки с различного рода осложнениями: изъязвлением, кровоизлиянием, наложением тромботических масс.
4. Кальциноз – отложение в фиброзных бляшках солей кальция.
Наиболее значительные атеросклеротические изменения чаще всего локализуются в местах наибольшего гемодинамического или механического воздействия на стенку сосуда: зонах бифуркации, местах отхождения магистральных артерий от аорты и в извитых участках артерии.
По данным J.S.A. Fuchs [9], к ведущим факторам риска развития атеросклероза относятся артериальная гипертензия, гиперхолестеринемия и курение. В меньшей степени влияют ожирение, сахарный диабет, гипертриглицеридемия, сидячий образ жизни, стресс и наследственность.
Современные методы диагностики
Современные методы диагностики расстройств периферического артериального кровообращения отличаются широтой диапазона – одни используются для уточнения клинического диагноза, характера и степени поражения сосудов, другие – для оценки эффективности проводимого лечения либо динамического наблюдения за больным. С целью изучения гемодинамики в нижних конечностях и топической диагностики поражений артериального русла используют следующие инструментальные методы исследования: ультразвуковая допплер-сфигмоманометрия, тредмил-тест, ультразвуковое ангиосканирование, в том числе дуплексное, и рентгеноконтрастная аортоартериография. Кроме этого, необходимо определять показатели липидного обмена, свертывающей системы и реологических свойств крови.
Как первый этап, всем пациентам с подозрением на окклюзионно-стенотическое поражение аорты или артерий нижних конечностей выполняется ультразвуковая допплерография с измерением лодыжечно-плечевого индекса.
Этот индекс составляет отношение максимального давления на одной из берцовых артерий к давлению на плечевой артерии. Снижение этого показателя менее 0,9 требует более пристального внимания к пациенту. В этой связи одним из наиболее перспективных в настоящее время представляется комбинированное использование ультразвуковой допплерометрии и стандартного тредмил-теста [10]. К неинвазивным методам исследования также относится ультразвуковое ангиосканирование, благодаря которому можно с большой долей достоверности определить степень стенотического поражения. В последнее время дуплексное ультразвуковое ангиосканирование в алгоритме диагностической программы занимает одно из ведущих мест вследствие неинвазивности и безопасности, а также высокой чувствительности и специфичности. По данным дуплексного сканирования определяется не только структура атеросклеротической бляшки, но и оценивается гемодинамическая степень стеноза, что имеет принципиальное значение. Рентгеноконтрастное ангиографическое исследование в настоящее время остается основным методом диагностики облитерирующих заболеваний сосудистого русла. С помощью этого метода возможно точно определить локализацию, протяженность, степень и характер стеноза, множественность окклюзионных поражений магистральных артерий нижних конечностей, оценить состояние коллатерального русла, прогнозировать характер и объем реконструктивной операции, а также осуществлять контроль за эффективностью лечения и хирургического вмешательства. В арсенале ангиологов и сосудистых хирургов имеются также такие методы диагностики, как лазерная допплер-флоуметрия, транскутанное мониторирование О2, фотоплетизмография, радиоизотопное исследование, компьютерная томография и ядерно-магнитный резонанс.
Терминология и клиническая классификация
В клинической практике для обозначения заболеваний брюшной аорты, приводящих к ее сужению или окклюзии, часто употребляют термин “синдром Лериша”, который обобщает картину поражения бифуркации брюшной аорты и подвздошных артерий.
Основными особенностями клинического течения этого поражения являются высокая перемежающаяся хромота (боль в конечности при ходьбе), двустороннее отсутствие пульса на артериях и импотенция.
Примерно у 30% пациентов с хронической артериальной недостаточностью нижних конечностей атеросклеротический окклюзирующий процесс локализуется в брюшном отделе аорты, у 70% больных – в артериях бедренно-подколенного сегмента.
Тактические вопросы в выборе того или иного метода лечения при атеросклеротическом поражении аорты и артерий конечности основываются на выраженности хронического ишемического синдрома, который классифицируется по 4 стадиям заболевания. Преобладающей системой оценки являются классификация R. Fontaine и А.В. Покровского.
При 1-й стадии заболевания боль в нижних конечностях появляется только при большой физической нагрузке, она не связана с проходимой пациентом дистанцией.
Для 2-й стадии характерно появление лимитирующей боли при ходьбе (лимитирующая перемежающаяся хромота). С тактических позиций эту стадию подразделяют на 2А (проходимая дистанция без боли более 200 м) и 2Б (появление болей при ходьбе на расстояние менее 200 м).
Боль в конечности в состоянии покоя характеризует 3-ю стадию, появление язвенно-некротических изменений – 4-ю стадию заболевания.
Хирургическая тактика и определение степени операционного риска
Принципиальной общепризнанной позицией в выборе метода лечения в соответствии с данной классификацией считается необходимость восстановления магистрального кровотока с применением реконструктивных операций, начиная со стадии 2Б.
При решении вопроса об оперативном лечении необходимо учитывать мультифокальный характер атеросклеротического поражения и наличие сопутствующей патологии, отягощающей состояние больных. По нашим данным, около 70% пациентов страдают ишемической болезнью сердца, у каждого 4-го выявляют постинфарктный кардиосклероз и хроническую недостаточность мозгового кровообращения, у половины больных имеется гипертоническая болезнь в сочетании с хроническими заболеваниями легких. У 35% - заболевания желудочно-кишечного тракта и у каждого 7-го - сахарный диабет.
Исходя из всего вышеизложенного, лечение больных атеросклерозом должно быть комплексным, направленным как на восстановление кровообращения в аорте и магистральных артериях конечности, так и на коррекцию сопутствующей патологии. Основная цель – восстановление крообращения – должна достигаться с минимальной травмой для больного.
Принципы консервативного лечения
Одним из главных направлений консервативного лечения является улучшение реологических свойств крови. И это не случайно, так как у больных имеются выраженные отклонения реологических характеристик: повышение уровня фибриногена в плазме, увеличение времени агрегации тромбоцитов, вязкости крови и плазмы, уменьшение фибринолитической активности крови и изменение показателей тромбоэластограммы в сторону гиперкоагуляции.
Среди лекарственных средств, используемых для консервативной терапии, выделяется несколько групп.
1. Спазмолитики: периферические миолитики (папаверин, дротаверин, бенциклан), препараты блокирующие a-адренорецепторы или преганглионарную передачу импульса (кофеин, празозин), центральные холиномиолитики (толперизон, баклофен), вещества с разносторонним действием (абана).
2. Дезагреганты: пентоксифиллин, ацетилсалициловая кислота, ксантинола никотинат, тиклопидин, реополиглюкин.
3. Антиатеросклеротические средства: препараты, блокирующие всасывание холестерина из кишечника (холестирамин), тормозящие биосинтез и перенос холестерина и триглицеридов (производные фиброевой кислоты – клофибрат, ципрофибрат) и статины (ловастатин, симвастатин), другие средства (никотиновая кислота).
4. Препараты метаболического действия: солкосерил, актовегин и др.
5. Ангиопротекторы: пирикарбат и др.
Особо хочется подчеркнуть, что важное место в общем арсенале лечебных мероприятий у больных с облитерирующими заболеваниями аорты и артерий нижних конечностей занимает дозированная ходьба – терренкур, которая способствует развитию коллатерального кровообращения.
Сугубо консервативное лечение показано больным с хронической артериальной недостаточностью 1-й стадии и 2А, у пациентов со стадией 2Б и критической ишемией с развитием язвенно-некротических поражений встает вопрос о необходимости восстановления магистрального кровообращения. Благодаря возможностям современных технологий в последние годы появилось много работ по применению баллонной ангиопластики у пациентов с различной локализацией окклюзионно-стенотических поражений артерий таза и нижних конечностей.
Однако не во всех случаях удается применить баллонную пластику вследствие окклюзии аорты или распространенных окклюзий артерий. Попытки реканализации в этих случаях опасны развитием тромбоза магистральных артерий (нередко с тромбозом периферического русла), что неминуемо ведет к ампутации конечности в 60% случаев, а нередко и к летальным исходам.
Виды реконструктивных хирургических вмешательств
При высокой окклюзии аорты, двустороннем поражении артерий конечностей в зависимости от тяжести состояния больного выполняют операции от аортобедренного бифуркационного или линейного шунтирования до подмышечно- или подключично-бедренного бифуркационного шунтирования. Если критическая ишемия имеется только с одной стороны, то при поражении подвздошной и бедренной артерии на контралатеральной конечности выполняется одностороннее перекрестное подвздошно-бедренное, подмышечно- или подключично-бедренное шунтирование.
На современном этапе реконструктивные операции занимают ведущее место в лечении этих больных. Количество таких операций постоянно увеличивается, значительно расширяется их объем, что дает возможность сохранить конечность даже при тяжелых формах хронической артериальной недостаточности. Для рассасывания келлоидных рубцов, возникающих после операции, эффективен препарат Контрактубекс, обладающий фибринолитическим, антитромботическим и кератолитическим действием.
Между тем выполнение полноценной реконструкции нередко вступает в противоречие с возможностями больного перенести оперативное вмешательство. Операции в этих случаях должны быть минимальными по травматичности и продолжительности, так как у подавляющего большинства этого контингента больных имеются тяжелые сопутствующие заболевания, резко ограничивающие функциональные резервные возможности организма [11]. Использование метода комбинированных операций, включающих баллонную ангиопластику в сочетании с открытой операцией под перидуральным или местным обезболиванием, позволяет значительно сократить объем вмешательства и отказаться от сложной хирургической реконструкции на нескольких сегментах.
Больной З., 68 лет, поступил с жалобами на ноющие боли в правой голени и стопе в покое, перемежающуюся хромоту через 30 м.
Ультразвуковая допплерография: значительное снижение магистрального кровотока по правой общей бедренной артерии, коллатеральный кровоток на подколенных и тибиальных артериях.
Лодыжечно-плечевой индекс слева 0,59, справа 0,35.
Аортоартериография: критический стеноз общей подвздошной артерии (ОПА) справа; стеноз глубокой бедренной артерии (ГБА) справа; окклюзия обеих поверхностных бедренных артерий (ПБА), сегментарная окклюзия правой подколенной артерии на протяжении 5 см (рис. 1).
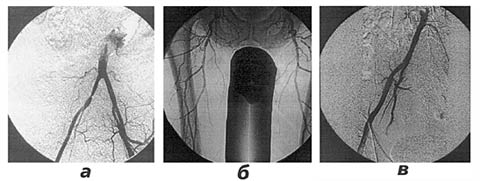
Рис. 1. Ангиограммы больного З.:
а - стеноз ОПА справа;
б - стеноз ГБА справа, окклюзия обеих ПБА;
в - после баллонной ангиопластики (отсутствие зоны стеноза правой ОПА).
Атеросклеротическое поражение артерий (история болезни).
Сопутствующие заболевания: ишемическая болезнь сердца, атеросклеротический кардиосклероз, стенокардия напряжения, хронический бронхит, пневмосклероз, эмфизема легких.
ишемическая болезнь сердца, атеросклеротический кардиосклероз, стенокардия напряжения, хронический бронхит, пневмосклероз, эмфизема легких.
Первым этапом выполнена баллонная ангиопластика ОПА справа, вторым – под перидуральной анестезией – боковая пластика ГБА справа (рис. 2).
Рис. 2. Схема этапов оперативного лечения больного З.:
а - до операции;
б - баллонная ангиопластика правой ОПА;
в - состояние после пластики ГБА и баллонной ангиопластики ОПА справа.
В результате отмечена положительная динамика: лодыжечно-плечевой индекс справа увеличился до 0,71 (исходно 0,35). В удовлетворительном состоянии больной выписан на амбулаторное лечение.
1. Покровский А.В., Кошкин В.М., Кириченко А.А. и др. Вазапростан (простагландин Е1) в лечении тяжелых стадий артериальной недостаточности нижних конечностей. Пособие для врачей. М., 1999; 16.
2. Fowkes F.G., Housley E., Cawood E.H. et al. Edinburgh artery study: prevalence оf asymptomatic and symptomatic peripheral arterial disease in the general population. Int J Epidimiol 1991; 20: 384–92.
3. Бураковский А.И., Бокерия Л.А. Сердечно-сосудистая хирургия. М., 1989; 750.
4. Dormandy J., Mahir M., Ascady G. et al. Fate of the patient with chronic leg ischaemia. J. Cardiovasc Surg 1989; 30: 50–7.
5. Stoffers HEJH. Kaiser V. and Knottnerus J.A. Prevalence in the general practice. In: Fowkes FGR, ed. Epidemiology of peripheral vascular disease. London: Springer Verlag. 1992; 109–13.
6. Спиридонов А.А., Фитилева Е.Б., Аракелян В.С. Пути снижения летальности при хирургическом лечении хронической ишемии нижних конечностей. Ж. Анналы хирургии. 1996; 1: 62–6.
7. Биэд Дж.Д. Ампутация или реконструкция при критической ишемии. Ж. Ангитология и сосудистая хирургия 1998; 1 (4): 72–82.
8. Бокерия Л.А., Гудкова Р.Г. Хирургия сердца и сосудов в Российской федерации. М., 1998; 43.
9. Fuchs JSA. Atherogenesis and the medical management of Atherosclerosis. In: Rutherford RB, ed. Vascular surgery. Philadelphia: W.B. Saunders Company. 1996; 1: 222–35.
10. Затевахин И.И., Цициашвили М.Ш., Юдин Р.Ю. Тредмил в диагностике и лечении хронической артериальной недостаточности. М., 1999; 87.
Облитерирующие поражения аорты и магистральних сосудов, занимая доминирующее место в структуре сосудистых заболеваний, не имеют тенденции к уменьшению. По данным различних авторов, несмотря на разработку эффективных антиатеросклеротических и противоваспалительних препаратов, пока еще не удается приостановить прогресирование процесса при указанных системных заболеваниях, которые являются основной причиной развития нарушения кровообращения и ампутации конечности. В зависимости от уровня поражения артериального русла различние авторы выделяют две группы пациентов с хронической ишемией: проксимальную, когда уровень локализуется в артериях выше паховой складки, и дистальную- поражение артерий ниже инфраингвинального сегмента. На долю последней группы приходится до 50-75% больних. Реконструктивные хирургические методы лечения дают возможность сохранить конечность при критической ишемии нижних конечностей у 45-55% пациентов в течении 5-8 лет после операции [1,2,3.]. Прямая реваскуляризация избавляет от угрозы ампутации и симптомов инвалидизирующей перемежающей хромоты, улучшает качество жизни больных.Эффективность операций зависит от состояния путей, как притока, так и оттока, а также от использованного пластического материала. Результаты восстановительных сосудистых операций впечетляют, однако проблема послеоперационных осложнений продолжает оставаться актуальной. Принято выделить ранние и поздние послеоперационные осложнения. К ранним послеоперационным осложнениям относятся тромбозы, возникшие в первые 6 месяцев после операции. В совокупности причины ранних и поздних послеоперационных осложнений (тромбозы, ложные аневризмы анастомозов) делятся на основные и сопуствующие. К основным причинам относятся хирургические погрешности (технические погрешности в выполнении анастомозов, избыток или натяжение шунта, его перекрут) и несостоятельность дистального русла. К сопуствующим – нарушения свертывающей сис-темы крови и общие гемодинамические нарушения. Проблема стенотических реокклюзий после оперативных вмешательств на аорте и артериях нижних конечностей в настоящее время представляется одной из наиболее значимых в сосудистой хирургии. Некоторые авторы оценивают частоту рестенотического поражения в пределах 40-60% от общего числа вмешательств, что служить причиной повторных операций. Неудачи восстановительных и реконструктивных операций на артериях в отдаленном периоде во многом обусловлены рестенотическом процессом с последующим тромбозом зоны анастомозов. В механизме формирования реокклюзий основная роль принадлежит развитию атеросклероза. Так по данным Ю.Э. Восканяна и соавт. (2002), наиболее высокий риск реокклюзии на поздних сроках был отмечен при наличии атероматозного утолщения, кальциноза, дезоблитера-ции артериальной стенки в области дистального и, в меньшей степени, проксималного анастомозов. Ведущая роль в развитии рестеноза в зоне операции, по оценкам различных авторов, принадлежит дисфункции эндотелия, пролиферации гладкомишечных клеток, воспалительным реакциям сосудистой стенки [4,5].
Говоря о причинах развития осложнений после реконструктивных операций на аорте и магистральних артериях, большинство авторов отмечают, что прогресирование основного процесса - ведущий фактор их развития. Динамическое наблюдение за оперированными больными показалo, что в разные сроки после сосудистых операций, в ряде случаев развиваются специфические осложнения, которые приводят к рецидиву ишемии или ставят под угрозу жизнеспособность конечности и даже, жизнь больного.
Наибольшее количество местных осложнений после реконструктивных вмешатеьств на магистральних артериях составляют тромбозы, по данным различных авторов, от 60 до 90% всех поздних осложнений [6,7]. Частота тромботических осложнений после аорто-бедренной реконструкций колебляется от 42 до 59% в зависимости от длительности наблюдения за пациентами [8,9].
Иногда тромбозы возникают на фоне уже имеющихся стенозов анастомозов, которые авторы считают вторым по частоте осложнением артериальных реконструкций после тромбозов.
Частота появления стенозов анастомозов, варьирует в широком диапазоне и колеблется от 1,5 до 21%.
Ложные аневризмы, образующиеся после реконструктивных операций на магистральных артериях, относят к группе поздних послеоперационных осложнений. Наиболее часто они обнаруживаются в течении первых 5 лет после операции. Обычно они наблюдаются после операции шунтирования или протезирования по поводу атеросклеротических поражений в аорто-бедренном сегменте ( АБС).
Ложные аневризмы преимущественно (60-70%) локализуются в зоне дистального анастомоза протеза с бедренной артерией, когда восстановление кровотока в нижную конечность проводилось через систему глубокой бедренной артерии (ГБА) или реконструкция сочеталась с эндартерэктомией.
Морфологические исследования показывают, что образование ложных аневризм, как правило сопровождается прогрессированием атеросклеротического процесса в зоне проведенной реконструкции. Наиболее частыми осложнениями ложных аневризм являются разрыв с внутренным кровотечением и образованием массивных гематом, тромбоз аневризмы и соответствующей бранши протеза, эмболия дистального русла, инфицирование аневризмы и протеза [10]. Развитие ложных аневризм дистальних анастомозов колебляется в пределах от 3,2 до 13%.
Ложние аневризмы проксимального анастомоза встречаются реже, частота их варьирует от 2,7 до 4,9%. Сроки возникновения ложных аневризм различны и колеблются от 6 месяцев до 20 лет после операции [11,12,13]. Ложние аневризмы дистальных анастомозов являются причиной около 6% всех поздних тромботических осложнений.
При несомненных успехах сосудистой хирургии остается актуальной проблема послеоперационных инфекционных осложнений. В любой области хирургии эти осложнения могут быть причиной неудач оперативного лечения и летального исхода,однако для такой дорогостоящей и высокоспецифичной области, как сердечно-сосудистая хирургия, проблема инфекции имеет особо важное медицинское и экономическое значение.
Как показывает анализ литературы, общая летальность при инфекции сосудистых протезов достигает 34-90%, а количество ампутаций 20-40% [14, 15,16]. Наиболее употребимым термином для определения гнойних осложнений после имплантации искуственных материалов по мнению некоторых авторов [17,18] является термин “парапротезная инфекция” (ППИ), понимая под ним патологическое состояние, обусловленное персистированием микроорганизмов на поверхности ксеноматериала и проявляющееся реакцией острого или хронического воспаления окружающих тканей.
Особенностями инфекционного процесса вокруг синтетического мате-риала являются склонность к хронизации воспаления, толерантность к проводимому консервативному лечению и отсуствие тенденции к самостоя-тельному купированию воспаления.
Значительную роль в патогенезе ППИ играют структура и поверхность имплантата. Известно что протезы из PTFE демонстрируют лучшую резистентност к инфекции, чем плетеные.
Частота бактеремии при нагноении вокруг протезов Gore-Tex составила 18,8%, а при наличии плетеных протезов (Север, Bard) - 29,2% [19,20].
Ведущим путем первичного инфицирования протезов является интраоперационное обсеменение во время имплантации. Нарушение жестких правил асептики приводит к попаданию микроорганизмов в рану с рук хирургов, в результате нарушения стерильности протеза. Источниками инфекции могут служить кожа, лимфатические узлы, патологически измененная артериальная стенка. Вторичное инфицирование протеза происходит на фоне таких после-операционных осложнений, как поверхностное нагноение раны, краевой некроз кожи, пара-протезная гематома, скопление серозной жидкости или лимфорея. Вторичное инфицирование обьединяет все случаи распостранения воспалительного процесса с окружающих тканей на протез.
Классификации инфекционных осложнений посвящены работы ряда зарубежных авторов.
Согласно классификации гнойние осложнения подразделяются на: нагноение в пределах кожи, распостранение в подкожние ткани, инфекция протеза и сосуда.
Bunt (1983) делит инфекцию сосудистых трансплантатов на четыре категории-инфекция трансплантата, трансплантат-тонкокишечный пролежень, трансплантат тонкокишечний свищ, аортальний сепсис [21].
Нагноение послеоперационных ран обусловлено ослаблением адаптационных возможностей организма, снижением регенерационной способности тканей и их устойчивости к инфекции, наличием хронических трофических расстройств у значительной части пациентов в связи с длительним анамнезом заболевания. Частота таких осложнений варьирует от 4 до 21%, а после операции у больних с IV стадией артериальной недостаточности процент гнойно-септических осложнений колеблется от 56,9 до 64,7% и не зависит от общесистемной антибиотикопрофилактики [22,23]. Частота инфекционных осложнений достигает 85% у больних с хронической критической ишемией нижних конечностей, почти у 20% больных с глубоким нагноением ран развивается аррозивное кровотечение.
В основе профилактики этих осложнений лежит бережное отношение к тканям, тщательний гемостаз, уменьшение времени операции, дренированые раны, приненение бактериорезис тентных пластических материалов при реконструктивних операциях [24,25].
Хирургические вмешательства при разрывах аневризм брюшной аорты отмечаются более высокой частотой инфицирования аортальних трансплантатов. Частота инфицирования протеза после экстренных операциий по поводу разрывов аневризм составила 7,5% по сравнению с 1,6% после планового протезирования аорты. Oтдельним фактором риска инфицирования аортального протеза являются бактерии ложа аневризмы, которые могут загрязнать протез во время операции [26].
При обследовании больных с тромбозами и гнойными осложнениями после рекоструктивных операций по поводу окклюзионных поражений аорты и магистральных артерий применяют весь комплекс современных методов исследования сосудистой системы.
Ультразвуковая доплерография у ранне оперированных на артериях больных –приоретная методика скрининговой амбулаторной диагностики ранних изменений кровотока в реконструированных артериях и шунтах. Выявление значительных изменений кровотока служит показанием для более тщательного обследования больного с помощью более информативных методов исследования.
Дуплексное сканирование позволяет обнаружить развитие рестеноза, определить локализацию и протяженность поражения, проследить редукцию просвета сосудистых анастомозов. В совокупности, комплексное ультразву-ковое обследование позволяет обьективно судить о функциональном состоянии сосудистых протезов и в соотвествии с обнаруженними изменениями определять хирургическую тактику [27].
Компьютерная томография оказывается особенно полезной в диагностике ложных аневризм анастомозов сосудистых протезов с аортой или подвздошными артериями. При этом на томо-граммах получается изображение аневризмы в виде тени округлой формы с неровными контурами, расположенной кпереди от позвоночника. Компьютерная томография информативна также при диагностике инфицирования сосудистых протезов. Одним из признаков инфицирования протеза при томографии служит скопление вокруг него жидкости или газовых пузырьков [28].
Морфологические методы-большое значение в понимании процессов, происходящих в эксплантатах и оперированных артериях, принадлежит морфологическим исследованиям, так как только с их помощью можно установить причины развития прежде всего, тромбозов эксплантатов.
Лимфатические осложнения после реконструктивных операций на артериях нижних конечностей составляют от 2 до 8%. Послеоперационная лимфорея подразделяется в следующие стадии: острая (первые 7 суток после операции), подострая (до 3 недель) и хроническая с формированием собственно лимфоцеле, основным отличием которой является наличие лим-фатической полости с соединительнотканной капсулой.
Причиной развития таких осложнений являются повреждение лим-фоузлов во время выделения артерий. Усовершествование оперативной техники при доступе в 1/3 бедра (латеральный подход к бедренным артериям, тщательное лигирование лимфоузлов в зоне доступа) достоверно не снижают их частоту [29].
Для лечения лимфореи предложены самые разнообразные методики – иммобилизация, давящие повязки, повторные пункции содержимого полости, дренирование, склеротерапия, рентгенотерапия. Несмотря на это, в совокупности эти методики не только не востановливают нормальний лимфодренаж, но и приводят к развитию вторичного лимфоотека.
А необходимость как можно более быстрого купирования лимфореи не вызывает сомнений в силу большого риска возникновения инфекционных осложнений со стороны артериальной реконструкции, что реально увеличивает риск потери конечности. Наиболее часто используемым вариантом вмешательства в данной ситуации, это ревизия раны с лигированием лимфатических коллекторов.
Читайте также:


