Инфекция вызванная burkholderia pyrrocinia dsm10685 что вызывает
 |
| Burkholderia cepacia |
В род Burkholderia входят такие клинически важные инфекционные агенты, как:
- Burkholderia cepacia, патоген лёгочных инфекций у больных муковисцидозом, а также патоген ряда овощей. Может вызывать больничную и внебольничную пневмонию, инфекции мочевых путей, менингит, перитонит, ожоговую и послеоперационную раневую инфекцию, сепсис и эндокардит (у инъекционных наркоманов).
- Burkholderia mallei, возбудитель сапа, болезни лошадей и других однокопытных животных, а также человека
- Burkholderia pseudomallei, возбудитель мелиодоза

В своём релизе от 27.10.2017 года FDA сообщает, что в 2016 году в 12 штатах США зарегистрировано 63 подтверждённых и 45 вероятных случаев серьёзных инфекций, вызванных Burkholderia cepacia, причиной которых являлись загрязнённые этой бактерией препараты, производимые фирмой PharmaTech LLC, Davie, штат Флорида, в основном жидкий препарат докузата натрия Rugby Diocto, предназначенный для орального приёма. В 2017 году произошла повторная вспышка, причиной которой явился препарат Rugby Diocto, загрязнённый Burkholderia cepaci, поразившая, по крайней мере 8 пациентов в штатах Мэриланд и Калифорния. Исследование 2016 года обнаружили Burkholderia cepacia в системе водоснабжения, используемой для производства Rugby Diocto.
FDA предупреждает, что докузат натрия, производимый PharmaTech LLC, может продаваться под разными торговыми марками, в частности Rugby, Leader, Major, Centurion и Mid Valley.
Род Burkholderia входит в семейство Burkholderiaceae, порядок Burkholderiales, класс Betaproteobacteria, тип протеобактерии (Proteobacteria), царство Бактерии.
В род Burkholderia включены:
- Burkholderia cepacia complex, в состав которого входят следующие виды бактерий: B. alpina, B. ambifaria, B. anthina, B. arboris, B. cenocepacia, B. cepacia, B. cf. cepacia, B. contaminans, B. diffusa, B. dolosa, B. lata, B. latens, B. metallica, B. multivorans, B. paludis, B. pseudomultivorans, B. pyrrocinia, B. seminalis, B. stabilis, B. symbiont of Pleurotus ostreatus, B. territorii, B. ubonensis, B. vietnamiensis, [Pseudomonas] mesoacidophila
- pseudomallei group, в состав которой входят виды: B. humptydooensis, B. mallei, B. oklahomensis, B. pseudomallei, B. thailandensis, [Pseudomonas] jianii
- виды: B. arationis, B. arvi, B. australis, B. calidae, B. catudaia, B. concitans, B. dabaoshanensis, B. fortuita, B. gladioli, B. glebae, B. glumae, B. hypogeia, B. jirisanensis, B. novacaledonica, B. pedi, B. peredens, B. plantarii, B. ptereochthonis, B. rinojensis, B. singaporensis, B. symbiont of Asellus aquaticus, B. symbiont of Cavelerius saccharivorus, B. temeraria, B. turbans, B. ultramafica
Целый ряд видов, входящих в состав рода Burkholderia, реклассифицированы в виды родов Caballeronia и Paraburkholderia, входящих в то же семейство Burkholderiaceae:
- Burkholderia acidipaludis (старое наименование) —>Paraburkholderia acidipaludis (новое наименование)
- Burkholderia aspalathi —> Paraburkholderia aspalathi
- Burkholderia bannensis —> Paraburkholderia bannensis
- Burkholderia bryophila —> Paraburkholderia bryophila
- Burkholderia caledonica —> Paraburkholderia caledonica
- Burkholderia caribensis —> Paraburkholderia caribensis
- Burkholderia caryophylli —> Paraburkholderia caryophylli
- Burkholderia choica —> Caballeronia choica
- Burkholderia denitrificans —> Paraburkholderia denitrificans
- Burkholderia diazotrophica —> Paraburkholderia diazotrophica
- Burkholderia dilworthii —> Paraburkholderia dilworthii
- Burkholderia endofungorum —> Paraburkholderia endofungorum
- Burkholderia ferrariae —> Paraburkholderia ferrariae
- Burkholderia fungorum —> Paraburkholderia fungorum
- Burkholderia ginsengisoli —> Paraburkholderia ginsengisoli
- Burkholderia glathei —> Caballeronia glathei
- Burkholderia graminis —> Paraburkholderia graminis
- Burkholderia grimmiae —> Caballeronia grimmiae
- Burkholderia heleia —> Paraburkholderia heleia
- Burkholderia hospita —> Paraburkholderia hospita
- Burkholderia humi —> Caballeronia humi
- Burkholderia kururiensis —> Paraburkholderia kururiensis
- Burkholderia megapolitana —> Paraburkholderia megapolitana
- Burkholderia mimosarum —> Paraburkholderia mimosarum
- Burkholderia nodosa —> Paraburkholderia nodosa
- Burkholderia oxyphila —> Paraburkholderia oxyphila
- Burkholderia phenazinium —> Paraburkholderia phenazinium
- Burkholderia phenoliruptrix —> Paraburkholderia phenoliruptrix
- Burkholderia phymatum —> Paraburkholderia phymatum
- Burkholderia phytofirmans —> Paraburkholderia phytofirmans
- Burkholderia rhizoxinica —> Paraburkholderia rhizoxinica
- Burkholderia rhynchosiae —> Paraburkholderia rhynchosiae
- Burkholderia sabiae —> Paraburkholderia sabiae
- Burkholderia sacchari —> Paraburkholderia sacchari
- Burkholderia sartisoli —> Paraburkholderia sartisoli
- Burkholderia sediminicola —> Paraburkholderia sediminicola
- Burkholderia silvatlantica —> Paraburkholderia silvatlantica
- Burkholderia soli —> Paraburkholderia soli
- Burkholderia sordidicola —> Caballeronia sordidicola
- Burkholderia sprentiae —> Paraburkholderia sprentiae
- Burkholderia symbiotica —> Paraburkholderia symbiotica
- Burkholderia telluris —> Caballeronia telluris
- Burkholderia terrae —> Paraburkholderia terrae
- Burkholderia terrestris —> Caballeronia terrestris
- Burkholderia terricola —> Paraburkholderia terricola
- Burkholderia tropica —> Paraburkholderia tropica
- Burkholderia tuberum —> Paraburkholderia tuberum
- Burkholderia udeis —> Caballeronia udeis
- Burkholderia unamae —> Paraburkholderia unamae
- Burkholderia xenovorans —> Paraburkholderia xenovorans
- Burkholderia zhejiangensis —> Caballeronia zhejiangensis
Этиология. Род Proteus семейства Enterobacteriaceae включает грамотрицательные бактерии, не ферментирующие лактозу и характеризующиеся активной подвижностью и ползучим распространяющимся ростом на поверхности плотных питательных сред. Микроорганизмы, которые ранее были классифицированы и отнесены к роду Proteus, после недавно проведенного детального изучения ДНК получили новые названия. Р. morganii был классифицирован как Morganella morganii, тогда как некоторые биогруппы В. rettgeri были реклассифицированы как Providencia stuartii и Providencia rettgeri. P. mirabilis и Р. vulgaris сохранили свою номенклатуру. Р. mirabilis вызывает 75—90% инфекций человека и отличается от других упомянутых микроорганизмов тем, что не обладает способностью образовывать индол. Все четыре вида расщепляют мочевину с образованием аммония. Некоторые штаммы Р. vulgaris имеют общий антиген с определенными риккетсиями, за счет которого объясняется появление антител к протеям (реакция Вейля — Феликса) при тифе, японской речной лихорадке (цуцугамуши) и лихорадке Скалистых гор. Микроорганизмы, объединяемые в группу Providencia, очень тесно примыкают к представителям рода протеев, отличаясь от них только некоторыми биохимическими свойствами.
Эпидемиология и патогенез. Эти микроорганизмы в норме обнаруживаются в почве, воде и сточных водах и входят в состав нормальной флоры кишечника. Иногда им приписывают этиологическую роль при диареях детей раннего возраста, но это не получило достаточных подтверждений. Их часто обнаруживают в посеве из отделяемого поверхностных ран, дренированных полостей среднего уха и из мокроты, особенно у больных, получавших антибиотики. В подобных условиях они замещают более чувствительную флору, погибающую под действием этих препаратов.
Проявления. Указанные микроорганизмы редко служат причиной первичного поражения. Обычно они вызывают заболевание в участках, ранее инфицированных другими возбудителями: на коже, в ушах, сосцевидном отростке, синусах, глазах, брюшной полости, костях, мочевом тракте, мозговых оболочках, легких, кровяном русле.
Кожные инфекции. Эти микроорганизмы присутствуют в отделяемом хирургических ран, особенно после антимикробной терапии, но никогда не присоединяются к нормальной раневой микрофлоре, если происходит нормальное заживление, ткани жизнеспособны и нет инородных тел. Часто в ассоциации с другими грамотрицательными бактериями или стафилакокками они могут инфицировать ожоговые поверхности, варикозные раны, язвы, образующиеся при пролежнях.
Инфекции уха и сосцевидного синуса. Воспаление среднего уха и мастоидит, особенно вызванные Р. mirabilis, могут привести к обширной деструкции среднего уха и сосцевидного синуса. Зловонные выделения, холестеатома и грануляционная ткань составляют хронический фокус инфекции в среднем и внутреннем ухе и в сосцевидном отростке, в результате чего развивается глухота. В качестве случайного осложнения возможно развитие паралича лицевого нерва. Основная опасность этих инфекций заключается в возможности их распространения в полость черепа, что ведет к тромбозу бокового синуса, менингиту, абсцессу мозга и бактериемии.
Инфекции глаз. Эти микроорганизмы могут вызывать язвы роговицы, обычно возникающие в результате травмы глаз, заканчивающиеся панофтальмитом и деструкцией глазного яблока.
Перитонит. Будучи составной частью нормальной микрофлоры кишечника, представители этих родов могут выделяться из брюшной полости после перфорации внутренних органов или инфаркта кишечника.
Инфекции мочевого тракта. Эти микроорганизмы служат основной причиной инфекционных поражений мочевого тракта, особенно у больных с хронической бактериурией, многие из которых страдают обструктивной уропатией, имеют в анамнезе сведения об инструментальном вмешательстве на мочевом пузыре и повторных курсах химиотерапии. Их часто выделяют от больных с калькулезными поражениями почек или мочевого пузыря, сопровождающимися бактериурией. Это можно объяснить уреазной активностью этих микроорганизмов, обусловливающей щелочную реакцию мочи и обеспечивающей благоприятную среду для формирования аммонийно-магниево-фосфатных камней.
Бактериемия. Внедрение в кровоток—это наиболее серьезное проявление инфекции, вызванной представителями родов Proteus, Morganella и Providencia. В 75% случаев входными воротами инфекции служит мочевой тракт; в остальных случаях первичным фокусом являются желчные протоки, желудочно-кишечный тракт, уши, синусы, кожа. Развитию бактериемии часто предшествуют такие процедуры, как цистоскопия, катетеризация мочеточника, трансуретральная резекция предстательной железы или другие оперативные вмешательства. Клинические признаки, симптомы и лабораторные показатели сепсиса — повышение температуры тела, озноб, шок, метастатические абсцессы, лейкоцитоз и иногда тромбоцитопения — сходны с аналогичными признаками бактериемии, вызванной кишечной палочкой, клебсиеллами или другими грамотрицательными бактериями.
Диагностика. Диагноз инфекции, вызванной Proteus, Morganella или Providencia, зависит от результатов культурального выделения этих микроорганизмов из крови, мочи или экссудата и их идентификации с помощью соответствующих биохимических тестов. Особенно важно отделить Р. mirabilis, индол-отрицательный вид, от индол-положительных микроорганизмов, так как Р. mirabilis чувствителен к действию пенициллина и многих других антибиотиков. Представители рода протеев часто обнаруживаются в ассоциации с другими возбудителями. Особое внимание было обращено на выделение микроорганизмов, не относящихся к Р. mirabilis или Р. vulgaris, но растущих на тех же питательных средах, чтобы они не были замаскированы ползучим ростом протея. Распространенный ползучий характер роста этих бактерий затрудняет также интерпретацию результатов определения их лекарственной чувствительности.
Лечение. Большинство штаммов Р. mirabilis чувствительны к пенициллину в высоких концентрациях (10 ЕД в 1 мл или больше), к ампициллину, карбенициллина динатриевой соли, гентамицину, тобрамицину или амикацину, а также к цефалоспориновым антибиотикам. Бактериурия, вызванная Р. mirabilis, может быть быстро ликвидирована с помощью любого из перечисленных антибиотиков. Наиболее эффективен при этой форме инфекции ампициллин в дозе 0,5 г каждые 4—6 ч. При тяжелой инфекции лечение следует проводить парентерально: от 6 до 12 г ампициллина или 20000000 ЕД пенициллина G в-сочетании с тобрамицином или гентамицином в дробных дозах по 5 мг/кг в сутки, если не повреждена функция почек. Существуют некоторые данные, что при инфекциях, вызванных
P. mirabilis, аминогликозиды обладают синергическим действием с ампициллином и пенициллином G. В связи с наличием большого числа более эффективных препаратов при инфекциях, обусловленных Р. mirabilis, нет необходимости применять левомицетин. Все штаммы Р. mirabilis устойчивы к тетрациклину. Большинство же штаммов, не относящихся к Р. mirabilis, чувствительны только к аминогликозидам и цефалоспоринам третьего поколения. Карбенициллин, тикарциллин и новые уреидопенициллины эффективны в отношении штаммов, выделенных из клинического материала. В идеале терапия должна основываться на результатах определения лекарственной чувствительности in vitro, а при отсутствии их — на знании характерных образцов. Так же как и в отношении других инфекций, вызванных грамотрицательными микроорганизмами, соответствующее внимание должно быть уделено дренированию гноя, поддержанию баланса жидкости и электролитов и при наличии эндотоксического шока — лечению циркуляторного коллапса.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
[youtube.player]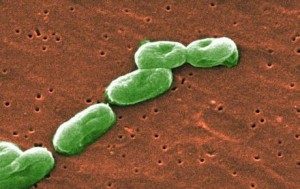
Что такое Burkholderia cepacia
Burkholderia cepacia комплекс (B. cepacia) состоит из нескольких видов граммотрицательных аэробных палочек.
В природе бактерия встречается в почве, воде и на растениях и живет преимущественно во влажной среде при температуре 30 — 35 градусов по Цельсию. Впервые бактерия была обнаружена в 1949 году Вальтером Буркхолдером в Корнельском университете в гниющем луке. В 1950-х годах стали появляться сообщения о развитии инфекций, вызванных B. Cepacia у пациентов, которым проводилась установка венозных и мочевыводящих катетеров. В 1970-х годах впервые было сообщено о заражении больных МВ B. Cepacia.
С этого времени началось быстрое распространение инфекции в различных европейских центрах МВ, что потребовало введения жестких ограничений на социальные и внутрибольничные контакты больных МВ с различной бактериальной флорой. В настоящее время инфицирование пациентов с МВ B. Cepacia во многих клиниках является противопоказанием к пересадке легких из за значительно более худшего прогноза выживаемости. Однако некоторые клиники в мире, тем не менее, принимают таких пациентов.
В 1992 году были выделены 9 основных вариантов Burkholderia
| Вид | Genomovar |
| Burkholderia cepacia | I |
| Burkholderia multivorans | II |
| Burkholderia cenocepacia | III |
| Burkholderia stabilis | IV |
| Burkholderia vietnamiensis | V |
| Burkholderia dolosa | VI |
| Burkholderia ambifaria | VII |
| Burkholderia anthina | VIII |
| Burkholderia pyrrocinia | IX |
С тех пор дополнительно изучено до 60 вариантов Burkholderia, большинство из которых клинического значения не имеют.
Как влияет инфицирование B.
cepacia на течение муковисцидоза
В настоящее время выделяют 3 типа реакций больного на заражение, зависимых от штамма В. сepacia, а именно:
1. отсутствие явных изменений в респираторном тракте, стабильное течение заболевания;
2. быстрое ухудшение респираторной функции с лихорадкой, потерей массы тела с развитием Cepacia-синдрома (сопровождающегося высокой лихорадкой, бактериемией, прогрессирующим ухудшением показателей функции внешнего дыхания);
3. фульминантное ухудшение респираторного статуса.
Считается, что наиболее тяжелые последствия в виде развития Cepacia-синдрома может вызвать заражение видами Burkholderia cenocepacia и Burkholderia multivorans. Burkholderia dolosa вызывает весьма быстрое ухудшение легочной функции.
Геном Burkholderia cepacia устроен так, что микроорганизм крайне быстро мутирует, вырабатывая все новые механизмы защиты от антибиотиков. Именно такая высокая способность защиты создает серьезную опасность заражения больных МВ этой палочкой.
Каковы способы заражения B. cepacia? Меры профилактики
Пациенты с МВ могут заразиться B. cepacia от других пациентов, заражение происходит воздушно-капельным путем, при рукопожатии и других близких контактах, а также косвенно, при использовании общих санузлов и предметов обихода. В сухой внешней среде бактерия выживает до 2 часов, во влажной – более суток.
Медицинская практика показывает, что большинство людей с B. cepacia заразились при случайном контакте с уже инфицированными пациентами при участии в общественных мероприятиях, в больницах.
В центрах помощи больным МВ, в больницах необходима строгая изоляция пациентов, как на амбулаторном приеме, так и при нахождении в стационаре, соблюдение гигиены рук и помещений, использование разного респираторного оборудования.
Большое внимание больным МВ следует уделить стерилизации небулайзеров и правильному их хранению. В ряде исследований показано, что в неблайзерах можно обнаружить до 15 видов различых бактерий, в том числе и B. cepacia, которые быстро вырабатывают устойчивость к антибиотикам, вдыхаемым через небулайзер.
Симптомы и диагностика
Симптомы при заражении B. Cepacia такие же, как симптомы любого воспаления у людей с МВ: лихорадка, кашель, заложенность носа, одышка, свистящее дыхание. Единственный способ диагностики – посев мокроты на специальных средах.
Больные МВ с колонизацией B. cepacia, должны быть еще более ответственными и выполнять абсолютно все рекомендации специалистов из центра МВ. Бронхолитики, муколитики, хорошее питание, очистка дыхательных путей, предотвращение простудных заболеваний, своевременная плановая антибиотикотерапия должны применяться постоянно.
К сожалению, бактерия очень устойчива к антибиотикам, но некоторые комбинации лекарств способны успешно сдерживать рост этих бактерий.
Разработаны схемы лечения инфекции при первичном высеве, хронической инфекции вне обострения, и при обострении. Важно регулярно проводить посевы мокроты на чувствительность к антибиотикам и своевременно корректировать антибиотикотерапию.
Схемы лечения Burkholderia cepacia
(Семыкин С.Ю. (Отделение медицинской генетики Российской детской клинической больницы,) Постников С.С.(Кафедра клинической фармакологии РГМУ) Поликарпова С.В (ГКБ № 15)
| Клиническая ситуация | Лечение |
| Первый высев B. Cepacia complex (B. multivorans | Цефтазидим 300 мг/кг + меропенем 120 мг/кг + тобрамицин 12 мг/кг в/в – 14 дней ингаляции тобрамицина (Брамитоб, TOBI) 300 мг х 2 р.д. – 3 месяца |
| Хроническая колонизация B. Cepacia complex | Бисептол 12-20 мг/кг по триметоприму per os Хлорамфеникол 25 мг/кг х 4 р.д. Per os Доксициклин (старше 12 лет) 100-200 мг х 1 р.д. Per os Ингаляции амилорида (1 мг/мл в 4,5 мл 0,12% NaCl) и тобрамицина (Брамитоб, TOBI) х 3 раза в день -1-6 месяцев |
| обострение хронической инфекции | Цефтазидим 300 мг/кг + меропенем 120 мг/кг + бисептол 12-20 мг/кг по триметоприму в/в – 3 недели |
Перспективные научные исследования
Инфицирование пациентов с МВ B. Cepacia является большой проблемой во всем мире. В среднем количество инфицированных пациентов составляет около 2-3%, но сильно варьирует в разных странах и в разных центрах МВ. В России за период 2003-2009 годы количество инфицированных B. Cepaci пациентов возросло с 2% до 8%. (Семыкин С.Ю., Постников С.С., Поликарпова С.В.)
Научные разработки ведутся, как в области поиска новых антибиотиков, так и в области поиска путей преодоления антиботикорезистентности бактерий. Кратко отметим несколько исследований, опубликованных недавно.
[youtube.player]
В Кемеровской области завершена проверка по факту заражения 20 детей с муковисцидозом смертельной для них бактерией — цепацией. Этот микроорганизм сокращает жизнь больных в разы. Роспотребнадзор не обнаружил в местной больнице ни следов инфекции, ни связи между госпитализацией маленьких пациентов и их массовым инфицированием. Чиновники уверяют, что цепацию дети могли подхватить где угодно. Однако эксперты утверждают, что после ремонта и дезинфекции стационара искать там цепацию было бесполезно, а система оказания помощи детям с муковисцидозом в России организована так, что массовое заражение может в любой момент произойти в любом регионе.
Муковисцидоз — неизлечимое генетическое заболевание, связанное с поражением желез внешней секреции. Это самая распространенная болезнь среди так называемых орфанных (редких). В России ею страдают более 3 тыс. человек. Раньше такие пациенты практически не доживали до совершеннолетия. Современные методы позволяют продлевать больным жизнь на десятилетия, но таких пациентов надо беречь. У больных муковисцидозом людей есть своя смертельно опасная бактерия — цепация (Burkhodelia cepacia). Безвредный для здорового человека микроорганизм очень хорошо себя чувствует в легких больного муковисцидозом, где скапливается мокрота, приводит к ухудшению состояния и даже смерти.
Типичная проблема
— К сожалению, наши лечебные учреждения не адаптированы к нуждам такой категории пациентов, — пояснила Елена Кондратьева. — Это повсеместная проблема. Такая ситуация, как в Кемерово, может сложиться и в других местах. Наша цель — сделать так, чтобы больше этого не повторилось.
Долгий путь бактерии
Вопрос о том, как инфекция оказалась в областной больнице, остается открытым. Местные чиновники говорят, что заразиться больные дети могли где угодно.
В письме, разосланном в августе в регионы, указывается именно штамм 709 — как эпидемически значимый. Интересен и список адресатов. Это главные специалисты по детству и главные пульмонологи региональных минздравов. И одно федеральное учреждение — РДКБ Минздрава России.
Зампредседателя комиссии Общественной палаты РФ по социальной политике Екатерина Курбангалеева, которая первая в Москве забила тревогу в связи с кемеровской ситуацией, обратилась к руководителям Росздравнадзора и Роспотребнадзора с просьбой провести проверку во всех медучреждениях, где в последние годы лечились инфицированные кемеровские дети. Это в первую очередь педиатрическое отделение РДКБ и областная кемеровская больница. По мнению члена ОП, это позволит избежать кривотолков, а главное — принять меры по ликвидации источника заражения там, где он будет выявлен.
Она считает результаты проверки местного Роспотребнадзора недостаточными.
Вспышка из прошлого
Родителям больных муковисцидозом детей, перешагнувших 10-летний возраст, название штамма 709 может сказать о многом. В 2008 году бактерией этого типа заразились почти все, кого тогда госпитализировали в РДКБ. Местные медики долго не признавали проблему, однако в итоге замять скандал не удалось.
Председатель московской областной ассоциации больных муковисцидозом Ольга Алекина вспоминает, как в 2008-м ей надо было пролечить в стационаре 14-летнего сына Алексея. Уже тогда среди родителей ходили тревожные слухи, и класть мальчика в РДКБ она не решилась, ограничившись амбулаторным лечением. Сейчас Алексею 23, заражения цепацией он избежал.
До ремонта, вспоминает Ольга Алекина, в отделении жил грибок, был один туалет на всех. Помещение перестроили, сделали палаты на двух человек, организовали цепационное отделение.
— Отделение педиатрии разделено на два отсека, — рассказал Петр Шумилов. — Отдельно отгорожены стеклянной перегородкой боксы, где находятся дети с цепацией. Они просто так не гуляют по другим палатам, а находятся в своих боксах. Когда доктора заходят в цепационное отделение, они меняют халат, обрабатывают перед выходом руки.
Петр Шумилов заверил, что у пациентов с цепацией и без нее разное оборудование, заражение больных через поверхности исключено. В то же время он признал, что между двумя категориями пациентов возможны контакты.
— Это же не тюрьма. И это дети. Чтобы пройти в отсек с цепацией, пациент должен пройти через отделение, — отметил замглавврача.
Особая проблема — в том, что вновь поступившие дети направляются в общее отделение, если только в их истории болезни не указано наличие цепации. Анализы у них берут, но результаты приходят только через неделю. Получается, что, если региональная лаборатория проглядела бактерию, ребенок, у которого она есть, несколько дней контактирует с незараженными.
По мнению Петра Шумилова, ответить на вопрос, где впервые появился штамм 709, без серьезного бактериологического расследования вряд ли возможно. Инфицированные пациенты приезжают из регионов в РДКБ, из Москвы разъезжаются по регионам. Без создания системы раздельного лечения разных категорий больных этот вопрос не решить. Причем это касается не только цепации и больных муковисцидозом. Аналогичная проблема и у пациентов со многими другими сложными диагнозами.
Специалисты по муковисцидозу сходятся во мнении, что таких больных надо лечить амбулаторно и не госпитализировать без особой необходимости. Это позволило бы минимизировать контакты между пациентами. Тем более что такова мировая практика. Однако в России она не распространена. Осложняет положение то, что госпитализация лучше оплачивается учреждениям, чем амбулаторное лечение. Прием у врача стоит 320 рублей. Госпитализация больного с муковисцидозом по квоте на высокотехнологичную медицинскую помощь (ВМП) обходится в 140 тыс. рублей, по системе ОМС — от 80 до 180 тыс. в зависимости от региона.
[youtube.player]
Burkholderia cepacia представляет собой палочковидную бактерию, которая передается от пациента к пациенту. Таким образом, пациенты МВ-носители сепации могут заразить других пациентов с МВ.
1. Характеристика Буркхолдерия сепация
Burkholderia (B.) cepacia представляет собой палочковидную бактерию длиной 1,6-3,2 мкм (для сравнения: один волосок имеет толщину около 100 мкм). Он был обнаружен в 1949 году Уолтером Х. Буркхолдером и до 1992 года считался Pseudomonas (см. Часть 1: Pseudomonas aeruginosa).
Возбудитель B. cepacia очень адаптируется. Обладая нитевидными клеточными процессами, он присоединяется в дыхательных путях к компонентам слизи и к клеткам слизистой оболочки. B. cepacia образует биопленки, которые защищают ее от антибиотиков. Патогенные микроорганизмы устойчивы ко многим различным антибиотикам. Им даже удается выжить в легких или иммунных клетках.
В 1997 году уже было известно пять геномоваров, позже стало десять. Тем временем все геномовары были официально переименованы в их собственные бактериальные разновидности. Комплекс Burkholderia cepacia в настоящее время включает не менее 17 различных видов.
Важными для муковисцидоза являются B. cenocepacia (ранее Genomovar III), B. dolosa (ранее Genomovar VI) и B. multivorans (ранее Genomovar II). Эти бактерии различаются тем, насколько они опасны, и насколько серьезные осложнения они вызывают.
Есть ли другие виды буркхолдерий?
Есть много других видов Burkholderia, которые не имеют ничего общего с комплексом Burkholderia cepacia. Это, например, B. gladioli и B. pseudomallei. Хотя B. gladioli при муковисцидозе также играют определенную роль.
Burkholderia pseudomallei встречается в тропических регионах Юго-Восточной Азии и в Австралии в основном в сезон дождей (см. Часть 6: Редкие патогены). Это может вызвать опасную для жизни инфекцию легких под названием мелиоидоз. Многие врачи предостерегают больных муковисцидозом от соответствующих поездок.
2. Путь заражения
Откуда берутся бактерии?
Как бактерии попадают в организм?
Бактерии B. cepacia передаются от пациента к пациенту. Это означает, что инфицированные пациенты с муковисцидозом могут инфицировать других пациентов. Респираторные выделения и мокрота играют важную роль, поскольку они содержат большое количество бактерий Burkholderia.
Во многих случаях возбудитель также поглощается из источников окружающей среды, таких как почва или гнилой лук. Также климатические условия, возможно, играют определенную роль, потому что в Австралии было больше B. cepacia, когда было много дождей.
3. Осложнения и болезни
Насколько распространена сепация при муковисцидозе?
В целом, только несколько пациентов из амбулаторных клиник по муковисцидозу в Германии инфицированы сепацией; их доля всегда была ниже 5% в последние годы.
Также известно, что разные виды сепации встречаются по-разному в разных странах и что их распределение со временем также меняется. Например, B. cenocepacia была менее распространена в некоторых странах после введения строгих правил гигиены (см. Ниже). В Германии преобладают Б. multivorans и Б. cenocepacia.
Какие осложнения и расстройства вызывает комплекс B. cepacia?
Патогенные микроорганизмы опасны для людей со слабым иммунитетом, например, страдающим гранулематозом с полиангиитом. При этом заболевании функция белых кровяных клеток настолько нарушена, что они больше не способны адекватно уничтожать вторгающиеся патогены. У этих пациентов сепация вызывают опасную для жизни пневмонию.
Иммунная система отдельных пациентов по-разному реагирует на возбудителя. Хотя у некоторых пациентов с B. cepacia, они не развиваются. Когда инфекция, вызванная B. cenocepacia, становится хронической, наиболее распространенным эффектом является несколько более быстрое прогрессирование заболевания легких, как это наблюдается например при инфекции Pseudomonas aeruginosa.
У пациентов с муковисцидозом B. cenocepacia (Genomovar III) и B. multivorans (Genomovar II) вызывают самые большие осложнения. Наблюдалось значительное сокращение выживаемости, чем у неинфицированных пациентов. Даже после трансплантации легкого часто наблюдали более плохое течение, когда пациенты с МВ были инфицированы комплексом B. cepacia. Перед трансплантацией имеет смысл провести детальное исследование бактерий у пациентов с сепацией.
4. Диагностика
Как выявить бактерии?
Взятие мазка из зева или образца мокроты является одним из обычных обследований во время ежеквартального амбулаторного посещения центра МВ. Целью является поиск комплекса Burkholderia cepacia с использованием специальных питательных сред. Затем проверяется, какие антибиотики эффективны против патогенов (тест на резистентность).
Поскольку доступны более мощные аналитические методы, идентификация бактерий Burkholderia для микробиологической лаборатории больше не является такой сложной, как раньше. В Ганновере и Мюнхене две консультационные лаборатории по бактериологии муковисцидоза позволяют провести детальный анализ отправленных образцов мокроты.
5. Лечение
Каким правилам должны следовать люди, живущие с Burkholderia cepacia?
Эти бактерии могут передаваться от пациента к пациенту. Поэтому гигиенические меры чрезвычайно важны для предотвращения перекрестного инфицирования. Амбулаторные клиники МВ разработали для этой цели специальные правила гигиены.
При посещении машины скорой помощи МВ или в больнице инфицированный пациент должен тщательно дезинфицировать руки. Ношение маски рекомендуется. Следует соблюдать осторожность, чтобы отделить пациентов с сепацией от других пациентов с МВ. Они получают специальные назначения для консультации, используют отдельный вход в здание и проходят лечение в определенной консультационной комнате.
Во время пребывания в больнице носители сепации обычно находятся в отдельной палате. Персонал и посетители надевают в комнате специальную защитную одежду, одноразовые перчатки и хирургическую маску.
Если люди с сепацией приходят к врачу или обращаются к физиотерапевтам или другим медицинским работникам, они должны информировать врача о своем носительстве.
Сообщество МВ просит пациентов с проблемными микробами, такими как сепация, добровольно воздерживаться от участия в мероприятиях и семинарах. В обычных социальных контактах, в повседневной жизни или в школе никаких специальных мер не требуется.
Какие антибиотики подходят для лечения?
Если сепация была впервые высеяна у пациента, результаты будут перепроверены. Нередко бактерии снова исчезают сами собой. Лечение антибиотиками необходимо в любом случае, если состояние легких резко ухудшается. Тогда говорят об обострении.
Лечение сепации нелегко, потому что бактерии устойчивы ко многим антибиотикам, которые обычно используются при муковисцидозе. Тем не менее, есть несколько хороших эффективных антибиотиков, которые можно использовать. Их выбор производится после теста на чувствительность (антибиограмма).
Обычно внутривенная комбинированная терапия (инфузионная терапия) проводится с двумя различными антибиотиками. Эффективные агенты обычно включают меропенем в комбинации с цефтазидимом, амикацином или миноциклином. Котримоксазол и тетрациклины также действуют против сепации. Некоторые эксперты также рекомендуют высокие дозы ингаляционного тобрамицина в качестве партнера по комбинации.
Бактерии комплекса B. cepacia по своей природе устойчивы к колистину. Если пациент инфицирован только сепацией, а не другими бактериями, он не должен использовать этот антибиотик для ежедневного ингалирования.
Исследователи в настоящее время разрабатывают новые антибиотики, в которых препарат помещается в крошечные жировые капли (липосомы). Такие препараты могли бы лучше проникать в клетки сепации и, возможно, работать лучше.
Насколько успешно лечение антибиотиками?
Большинство пациентов хорошо реагируют на лечение. Если инфекция Burkholderia cepacia существует в течение длительного времени, бактерии действительно подавляются лечением антибиотиками, но не уничтожаются. Следовательно, сепация все еще будет встречается в мокроте после лечения.
6. Защита от инфекции
Как защитить себя от заражения?
Важным потенциальным источником инфекции являются другие пациенты с муковисцидозом, инфицированные сепацией. Поэтому, отделяют пациентов с сепацией от других пациентов с муковисцидозом, например разделяя по часам консультаций и специальным кабинетам.
Кроме того, амбулаторные клиники по поводу муковисцидоза установили правила гигиены в больницах, которые должны соблюдаться как персоналом, так и пациентами и родителями. Особенно важную роль играет тщательное мытье и дезинфекция рук. Насколько успешны эти гигиенические меры, показывает исследование из Манчестера. Там частота выявления сепации у взрослых была снижена с 16% до 3%.
Во влажных помещениях с нормальной домашней обстановкой сепация встречается редко. Даже свежие фрукты и овощи, как правило, не являются источником опасности, с другой стороны, гнилой лук может стать источником Burkholderia cepacia, поэтому его следует избегать.
Можете ли вы сделать прививку против сепации?
До сих пор нет вакцины против комплекса B. cepacia. Усилия исследователей пока не увенчались успехом, в том числе потому, что слишком мало известно об иммунном ответе организма.
Находятся ли другие люди в группе риска, если они находятся в контакте с пациентами с сепацией?
У пациентов с МВ носителей комплекса B. cepacia нет особого риска для здоровых членов семьи, друзей или одноклассников.
[youtube.player]Читайте также:


