Лечили от инфекции рак
Больные, находящиеся на лечении по поводу злокачественных новообразований, за счет измененного иммунного статуса подвержены простудным заболеваниям, которые в свою очередь еще больше истощают защитные силы организма и затрудняют терапию основного диагноза
Острые респираторные вирусные инфекции (ОРВИ), в том числе и грипп, составляющие основную долю инфекционной патологии населения всех возрастов, представляют существенную угрозу пациентам из групп риска: пожилым, беременным, детям младшего возраста и пациентам с хроническими заболеваниями, в том числе онкологическими.
Больные, находящиеся на лечении по поводу злокачественных новообразований, за счет измененного иммунного статуса подвержены простудным заболеваниям, которые в свою очередь еще больше истощают защитные силы организма и затрудняют терапию основного диагноза.
При ОРВИ на фоне онкологического процесса лечащий врач сталкивается со следующими трудностями:
- Длительность ОРВИ у иммунокомпрометированных пациентов может достигать нескольких недель, в течение которых состояние больных значительно ухудшается, и не только по иммунным показателям.
- Инфекционный процесс заставляет откладывать очередной курс химиотерапии, что сильно сказывается на прогнозе.
- Назначение противовирусной терапии может вызвать осложнения, а в частности лекарственную гепатотоксичность, так как ее эффект накладывается на гепатотоксичное действие фармакотерапии злокачественного заболевания 1 .
Таким образом, можно сказать, что необходимость в профилактике и терапии ОРВИ у онкологических пациентов неоспорима, но последнее упомянутое обстоятельство резко ограничивает выбор конкретного средства.
Вирус-специфические препараты римантадин, занамивир и осельтамивир доказали свою эффективность, которая распространяется однако только на вирус гриппа. Кроме того, эти средства имеют ряд противопоказаний, которые зачастую делают невозможным их применение у онкологических пациентов.
В случае назначения средств, действующих на определенные вирусные белки, следует учитывать также проблему резистентности, которую вырабатывают к ним вирусы 2 . Так, появились данные о повышении до 18% частоты устойчивости вирусов гриппа А (H3N2) к осельтамивиру среди детей, получавших данный препарат для лечения гриппа 3 .
В связи с вышесказанным сегодня как никогда высока потребность в противовирусных препаратах, действующих не на инфекционный агент, а на иммунные защитные механизмы.
Оптимальное противовирусное средство, которое может быть рекомендовано для онкологической практики, должно:
- не вызывать резистентности, вероятно вследствие отличного механизма действия;
- быть безопасным, в частности при длительном применении;
- иметь минимальный риск побочных эффектов при лекарственном взаимодействии.
Указанным критериям в полной мере соответствуют иммуномодулирующие средства, благодаря чему интерес к ним клиницистов-онкологов в последние годы резко возрос.
Иммуномодуляторы – это лекарственные средства, которые обладают иммунотропной активностью и в терапевтических дозах восстанавливают эффективную иммунную защиту. Растущая опухоль вызывает существенные изменения в иммунном ответе, а проводимая химио- и лучевая терапия, а также любые оперативные вмешательства вызывают или усугубляют иммунную недостаточность 4 . Поэтому использование иммуномодуляторов, в частности для лечения сопутствующих инфекций, является оправданным.
Главной особенностью релиз-активных препаратов является способность воздействовать на биологически активные молекулы мишени (эндогенные регуляторы), модифицируя их физико-химические свойства. Эффект проявляется не только на молекулярном, но и на клеточном, органном, системном и организменном уровнях.
Так, прием Эргоферона усиливает функциональную активность макрофагов, натуральных киллеров и ИФН при помощи релиз-активных антител к ИФН-γ и CD4+. На этапе цитотоксических клеточных реакций CD8+ и CD4+ Т-лимфоцитов Эргоферон поддерживает противовирусный иммунитет при участии компонента релиз-активных антител к CD4+. На более поздних этапах релиз-активные антитела к CD4+ через стимуляцию рецепторов CD4 Тх2 поддерживают гуморальный противовирусный иммунитет.
Третий компонент Эргоферона – релиз-активные антитела к гистамину – обеспечивает противовоспалительный и антигистаминный эффекты, которые проявляются уменьшением длительности и выраженности катаральных симптомов и аллергических реакций, сопутствующих инфекционному процессу 7 . Это является важным преимуществом Эргоферона перед другими противовирусными препаратами, так как позволяет снизить потребление других средств и нивелировать риск лекарственного взаимодействия при параллельно проводящейся противоопухолевой терапии.
Эргоферон применяется в клинической практике с 2011 года, и его эффективность была доказана в ходе рандомизированных клинических исследований. На данный момент завершено 3 клинических исследования и продолжаются еще 4.
Исследований по лечению ОРВИ именно у онкологических больных не проводилось. Однако в клинической практике накоплен опыт назначения Эргоферона госпитализированным больным с солидными опухолями (Шаповалова Ю.С). Учитывая актуальность проблемы отсрочек курсов химиотерапии и продления сроков госпитализации, в 2012 г. был разработан внутрибольничный протокол лечения ОРВИ у госпитализированных пациентов с солидными злокачественными новообразованиями. В него включены следующие противовирусные препараты: для лечения гриппа – ингибиторы нейраминидазы занамивир и осельтамивир, а также римантадин, умифеновир и Эргоферон; для лечения ОРВИ – умифеновир и Эргоферон. Эргоферон применялся в виде монотерапии (37 пациентов) или в комбинации с римантадином (14 пациентов) в течение первых 48 часов от начала проявления симптомов заболевания. Все пациенты выздоровели через 5-9 дней лечения; нежелательных реакций, связанных с изучаемой терапией, отмечено не было. Учитывая благоприятный профиль переносимости Эргоферона и отсутствие гепатотоксичности, его применение может быть востребовано для лечения ОРВИ у пациентов онкологического профиля, в том числе находящихся в процессе химиотерапии.
Следует также отметить, что согласно экспериментам использование релиз-активных антител к ИФН-γ не приводит к гиперпродукции ИФН-γ. Этот факт немаловажен в свете недавних исследований, показавших, что ИФН-γ в больших дозах может приводить к увеличению метастазирования в легкие и резистентности клеток меланомы к терапии 11 .
Учитывая безопасность Эргоферона, доказанную в исследованиях высокого методологического качества, можно сделать вывод, что препарат стоит рекомендовать для лечения ОРВИ у пациентов со злокачественными новообразованиями 12 .
Как доказали результаты экспериментальных и клинических исследований Эргоферон является перспективным противовирусным препаратом с принципиально новым механизмом и мишенями воздействия, и он может помочь решить проблему лечения больных в условиях изменчивости антигенных свойств вирусов и исходно скомпрометированного иммунного статуса. Комплексный препарат, сочетающий противовирусное, иммуномодулирующее, противовоспалительное и антигистаминное действие, оказывает выраженный терапевтический эффект при ОРВИ у пациентов с онкологической патологией. Препарат имеет благоприятный профиль безопасности, и его назначение позволяет снизить лекарственную нагрузку и риск лекарственного взаимодействия с противоопухолевыми препаратами.
1 Шаповалова Ю.С. Клинико-фармакологическое обоснование и опыт применения инновационного релиз-активного препарата в лечении острых респираторных вирусных инфекций. Справочник поликлинического врача. 2015;2:38-42.
2 Heaton NS et al. Genome-wide mutagenesis of influenza virus reveals unique plasticity of the hemagglutinin and NS1 proteins. Proc Natl Acad Sci USA 2013; 25.
3 Антимикробная терапия по Джею Сэнфорду. Под ред. Д.Гилберта, Р.Меллеринга мл., Дж.Элиопулоса и др. М.: ГРАНАТ, 2013.
4 Артамонова Е.В. Модификаторы биологических реакций (иммуномодуляторы, интерфероны, интерлейкины) в терапии злокачественных опухолей. Эффективная фармакотерапия. 2014; 14: 8-21.
5 Сыроешкин А.В., Никифорова М.В., Колдина А.М., Горнак А.А., Тарабрина И.В. Лекарственные препараты на основе релиз-активных антител. Справочник поликлинического врача. 2018 (3):15-20
6 Эпштейн О.И. Сверхмалые дозы (история одного исследования). М.: Изд-во РАМН, 2008.
7 Жавберт Е.С., Дугина Ю.Л., Эпштейн О.И. Противовоспалительные и противоаллергические свойства антител к гистамину в релиз-активной форме: обзор экспериментальных и клинических исследований. Детские инфекции. 2014; 1: 40-3.
8 Архивъ внутренней медицины. 2013; 14 (6): 46.
9 Шиловский И.П., Корнилаева Г. В., Хаитов М.Р. Новые возможности в терапии респираторно-синцитиальной вирусной инфекции: данные доклинического исследования препарата Эргоферон. Иммунология. 2012; 33 (3): 144-8.
11 Taniguchi K, Petersson M, Höglund P et al. Interferon gamma induces lung colonization by intravenously inoculated B16 melanoma cells in parallel with enhanced expression of class I major histocompatibility complex antigens. Proc Natl Acad Sci USA 1987; 84 (10): 3405-9.
12 Артамонова Е.В. Модификаторы биологических реакций (иммуномодуляторы, интерфероны, интерлейкины) в терапии злокачественных опухолей. Эффективная фармакотерапия. 2014; 14: 8-21.
Инфекции — главные причины смерти при раке. Они не только часто встречаются, но нередко имеют более тяжелое течение, чем у других пациентов, менее подверженных действию терапии, и иногда вызываются организмами, которые не патогенны для здоровых людей. Такая восприимчивость является следствием подавления защитных механизмов больного, вызванного опухолью и ее лечением.
Кожа и слизистые оболочки служат барьером для инфекции. Опухолевая инфильтрация и местная лучевая радиотерапия могут привести к повреждению лимфатических или венозных сосудов, что приводит к увеличению восприимчивости к локальной инфекции. Воспроизводство эпителиальных клеток в желудочно-кишечном тракте подавляется химиотерапией, из-за чего повреждается и изъязвляется слизистая, что позволяет организмам из кишечника попасть в систему воротной вены.
Кожа повреждается внутривенными иглами и канюлями, особенно туннельными подкожными каналами. Это частые источники инфекции, которые вызываются такими кожными организмами, как Staphylococcus epidermidis. В носоглоточной полости возникают инфекции, вызванные Candida albicans.
Рак при запущенной стадии иногда связан с ухудшением функций и нейтрофилов, и моноцитов. Было описано подавление хемотаксической, фагоцитарной и бактерицидной активностей.
Ослабленная замедленная гиперчувствительность довольно распространена при запущенной болезни Ходжкина, но менее часта в других случаях злокачественных опухолей. Лимфопения неизменно вызывается действием алкилирующих агентов и массивной радиотерапией. Клеточный иммунитет особенно важен при защите организма хозяина от грибов, вирусов, туберкулеза и простейших.
Интенсивная цитотоксическая химиотерапия ведет к ухудшению образования антител к бактериальным и вирусным антигенам.
Циркулирующие бактерии удаляются фагоцитарными клетками, находящимися в синусах ретикулоэндотелиальной системы, особенно в печени и селезенке. Для этой чистки важны антитела и белки системы комплемента. Спленэкто-мия увеличивает риск серьезной бактериальной инфекции, особенно пневмококковый сепсис в детском возрасте и в меньшей степени во взрослом.
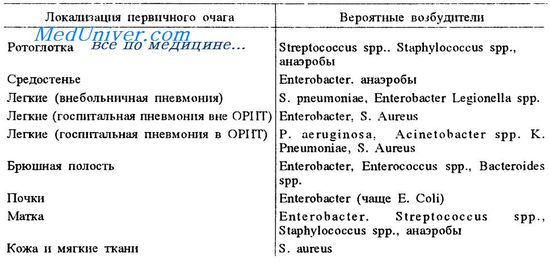
Бактериемия и септицемия у больных раком
Инфекции кровяного русла довольно часты у пациентов с гранулоцитопенией. Патогенами часто являются грамотрицательные бактерии (Escherichia coli, Pseudomonas aeruginosa), стафилококки и стрептококки. Увеличивается частота инфекций, вызванных грамположительными бактериями, особенно Staphylococcus epidermidis. Пациенты с тунельными подкожными каналами особенно подвержены поражениям этим организмом.
Жар у пациента с нейтропенией при раке — показатель присутствия бактерий в крови и под кожей. Если существует очевидный источник инфекции, например инфицированный порт для инфузий, следует взять культуру бактерий и удалить канюлю. Лечение не следует откладываеть для пациента с нейтропенией. Пациенты с лихорадочной нейтропенией с относительно низким риском развития серьезных осложнений относятся к тем, кого лечат короткими циклами химиотерапии для солидных опухолей.
Эти пациенты должны быть госпитализированы. Недавние исследования показали, что пероральный прием амоксициллина-клавуланата комбинированный с пероральным приемом ципрофлоксацина так же эффективен, как и внутривенная химиотерапия в этой группе (70% пациентов). Пациенты с высоким риском (с неконтролируемым раком или на стационарном лечении интенсивной терапией) лечатся внутривенными антибиотиками, в том числе b-лактамом и аминогликозидом или цефтазидимом.
Респираторные инфекции у больных раком
У пациента с серьезным подавлением иммунитета довольно часто возникает жар с легочным инфильтратом. Главные причины этого даны в таблице.
Осложнения в постановке диагноза могут быть значительны, поскольку тесты слюнных и кровеносных культур иногда отрицательны, а более инвазивные процедуры, такие как трансбронхиальная биопсия, невозможны из-за тромбоцитопении или общего состояния пациента.
Существуют некоторые клинические особенности, которые помогают при постановке диагноза. Кавитация наиболее часто сопровождает поражения анаэробными бактериями, стафилококками и микобактериями. Инфекции Pneumocystis вызывают заметную одышку, а на рентгенограмме грудной клетки видны билатеральные инфильтраты, обычно состоящие из хилуса. Болезнь, однако, может протекать вяло и вызвать долевое уплотнение. Цитомегаловирусные инфекции встречаются главным образом у пациентов с серьезным подавлением иммунитета, в частности в течение аллогенной ВМТ. Болезнь может также вызывать миокардит, невропатию или офтальмию.
Легочные инфильтраты обычно билатеральны. Инфекции Candida вызывают широкое разнообразие изменений в рентгенограмме. Инфекции Aspergillus обычно быстро прогрессируют. Тесты культур крови обычно отрицательны, а инфильтраты возможны в одном или двух легких.
При затруднениях в постановке диагноза можно следовать следующей схеме.
У пациентов без нейтропении или тромбоцитопении исследовать посевы крови, слюны, бронхоскопические промывания и трансбронхиальную биопсию там, где это возможно. Если кровяные и слюнные культуры отрицательны, лечить антибиотиками широкого антибактериального спектра действия (обычно в комбинации с аминогликозидом, пенициллином и метронидазолом или аналогичными соединениями). Если возможной причиной инфекции является Pneumocystis, следует давать высокие дозы котримоксазола. Если ответа нет, рассмотрите ацикловир для вируса простого герпеса и противогрибковую терапию с амфотерицином или кетоконазолом. Ацикловир не эффективен против цитомегаловирусов.
Если кровяные или слюнные тесты положительны, лечите соответствующе, но если ответа нет, рассмотрите смешанные инфекции.
Пациентам с нейтропенией или тромбоцитопенией проводят бронхоскопию, но биопсия не всегда возможна, и лечение продолжают без дальнейшего диагностического исследования. До и после бронхоскопии иногда необходимы антибиотики и переливание тромбоцитов.

Инфекции мочевыводящих путей у больных раком
Инфекции часты у пациентов с затрудненным мочеиспусканием. Затруднения могут быть вызваны опухолью или ослаблением мочевого пузыря у пациентов с компрессией спинного мозга и его корешков. Диагноз ставится после исследования уринокультуры, и лечение осуществляется антибиотиками и снятием осложнений, если это возможно.
Желудочно-кишечные инфекции у больных раком
Молочница ротовой полости (инфекция, вызываемая Candida albicans) — частое осложнение химиотерапии. Она особенно распространена у пациентов с подавленным иммунитетом, у пациентов, принимающих стероиды и тех, кого лечат антибиотиками с широким спектром действия. Рот и глотка становятся очень болезненными, а белые пятна грибков видны на эри-темной основе. У плохо питающихся пациентов инфекция может проникать глубже и распространяться по пищеводу, желудку и кишечнику. Обычно эффективен пероральный прием нистатина, амфотерицина или миконазола.
Проявление вируса простого герпеса на губах часто проблематично для пациентов с лейкопенией, и повреждения могут быть довольно обширными. В данном случае необходимо местное применение ацикловира для пациентов с подавленным иммунитетом или систематический прием ацикловира при более серьезных инфекциях.
Инфекции, вызванные Candida в пищеводе, необходимо лечить пероральным приемом суспензии нистатина, но если такое лечение неэффективно, то необходимо применение кетоко-назола или короткий курс амфотерицина. Кишечные инфекции, возникающие при поражении Candida, должны лечиться амфотерицином.
Перианальные инфекции распространены среди пациентов с нейтропенией. Всегда необходимо применять профилактические меры совместно с тщательной гигиеной промежности и смягчителями стула для предотвращения запора и анальных трещин. Распространяющиеся перинеальные (паховые) инфекции могут угрожать жизни пациента, и требуется срочное лечение внутривенными антибиотиками, действующими против грамотрицательных и анаэробных бацилл.
Менингит у больных раком
Инфекции центральной нервной системы (ЦНС) довольно редки, но у пациентов с лимфомой или лейкемией иногда развивается менингит из-за Cryptococcus neoformans. Начало заболевания индивидуально у каждого и сопровождается головной болью. Микроорганизм обнаруживают при окрашивании India ink спинномозговой жидкости (CSF).
Выявление антигенов Cryptococcus в крови и CSF возможно у большинства пациентов. Состояние многих пациентов улучшается при приеме амфотерицина, некоторые вылечиваются.
Кожные инфекции у больных раком
В отличие от инфекции, представленной на портах для вливания, наиболее частое кожное заболевание — опоясывающий лишай (varicella zoster). Возникает из-за реактивации вируса varicella zoster в ганглии дорсального корешка, вызывает кожную пузырчатую сыпь, которая особенно серьезна у людей с подорванным иммунитетом, может распространяться как ветряная оспа и вызывать фатальную пневмонию. Пациентов следует лечить ацикловиром как можно быстрее.

В наши дни, онкологические болезни являются самыми серьёзными расстройствами здоровья. В развитых странах, рак является второй причиной смертельности после сердечно-сосудистых заболеваний.
Рак, как болезнь, характеризуется хаотичным и непрерывным развитием анормальных клеток от одной клетки, которая стала раковой.
Раковые клетки больше не отвечают правилам и сигналам организма, что нарушает его баланс.
В отсутствии лечения, опухоль расширяется и разрушает другие здоровые соседние ткани и распространяется к другим органам (метастазы). В такой ситуации, считается, что рак перешёл в генерализованную форму.
Поиск новых видов лечения болезни продолжается. Уже сейчас такие новые методы лечения как иммунотерапия и генная терапия помогают усовершенствовать классические виды лечения рака (химиотерапия, радиотерапия, гормональная терапия, хирургия) что позволит увеличивать шансы против онкологических расстройств.
Лечение рака в большинстве случаев не состоит только из одной терапии.
Как правило, в арсенале у онколога присутствуют такие виды лечения:
- химиотерапия;
- иммунотерапия;
- хирургия;
- гормональная терапия;
- радиотерапия.
Для локального лечения используются радиотерапия и хирургия.
Гормональная терапия и химиотерапия используются для предотвращения или лечения генерализированного рака. Их эффекты замечаются на уровне всего организма.
Конечно же, выбор типа лечения зависит и от вида рака, но также и от общего состояния и возраста больного. Наличие некоторых других болезней может исключить определенные виды лечения.

Локальное лечение рака
Хирургическое вмешательство может быть необходимо в начале болезни для того чтобы подтвердить диагноз.
С её помощью можно изучить раковые повреждения и их экспансии.
В случае локального рака, хирургическое вмешательство позволяет полное или частичное удаление пораженного органа или опухоли.
Этот метод лечения онкологических заболеваний использует радиации, которые делают изменения на уровне тканей, через которых проходят лучи. В результате раковые клетки разрушаются моментально или постепенно.
Проблема в том, что радиация может воздействовать на соседние здоровые ткани. По этой причине использование облучения ограничено.
Тип использованной радиации и её дозировка зависит от вида рака.
Общее лечение рака
Химиотерапия рака включает различные лекарственные препараты, которые, как правило, вводятся внутривенно. Таким образом, активные химические вещества распространяются по всему организму.
Побочный эффект химиотерапии в том что она не только вызывает разрушение раковых клеток, но и влияет на состояние здоровых клеток. Особенно вредной является химиотерапия для клеток, которые очень быстро обновляются, такие как клетки костного мозга.
Гормональное лечение онкологических заболеваний зависимых от гормонов (рак молочной железы и рак предстательной железы) состоит в ограничении раковых клеток в гормонах, благодаря которым они размножаются.
Эти гормоны дают раковым клеткам сигнал для размножения, позволяя опухоли развиваться.
Устраняя место синтеза этих гормонов (яичники, яички) или блокируя сигнала о размножении, уменьшается скорость развития опухоли.
Иммунотерапия состоит в применении веществ, которые стимулируют клетки иммунной системы для разрушения раковых клеток.
Пока что применение этого вида лечения остается ограниченным к определенным видам рака.
Генная терапия использует гены в качестве лекарства. Если быть конкретнее то заменяются гены, которые ответственны за появление и развитие рака в обычной ситуации.
Но пока что эта терапия находится на уровне разработки.
Как вовремя выявить онкологическое заболевание?
Механизмы возникновения и появления анормальных раковых клеток — многочисленные и сложные. Они отличаются как во времени, так и для каждой формы болезни.
Благодаря прогрессам в области медицины, эти механизмы становится более понятными, что улучшает методы профилактики и диагностики, а также делает лечение более эффективным.

Профилактика онкологических заболеваний зависит в первую очередь от каждого человека. 80 % всех видов рака возникают напрямую из-за образа жизни и поведения пациента.
Какие меры принять чтобы снизить вероятность рака?
Каждый человек может снизить риск на себя, избегая таких способствующих факторов:
- курение;
- злоупотребление спиртными напитками;
- неправильное питание;
- длительное и повторное подвергание к солнечной радиации.
Такие факторы как наследственность и окружающая среда влияют очень мало на развитие онкологических заболеваний.
Как повысить шансы успешного лечения онкологических заболеваний?
В любом случае, следует обратить внимание на первые признаки заболевания, которые и являются сигналами. Точная диагностика болезни заключается в консультации врача и проведение некоторых обследований, которые позволяют выявить предраковые нарушения, а также опухоли в начальных стадиях.
Таким образом, у пациента возрастают шансы на успешное лечение.
Более подробное описание рака позволило больным лучше понять причины, симптомы и эволюцию болезни, что помогло ранее выявить болезнь.
Главная > Консультации > Детский врач > Существуют ли инфекции, способные спровоцировать рак? Онкогенные инфекции
В настоящее время доказано, что от 15 до 20% новообразований человека имеют вирусное происхождение.
Вирусами называют мельчайшие организмы, большую часть из которых нереально разглядеть, даже используя обыкновенный микроскоп. Они состоят из небольшого количества ДНК и РНК генов, которые находятся в белковой капсуле. Эти вирусы проникают в живые клетки, где впоследствии начинают размножаться. Бывают также вирусы вызывающие рак, которые могут помещать свою ДНК в клетки, в скором времени спровоцировав появление онкологических заболеваний. Характерной чертой онкогенных вирусов является то, что они могут стимулировать клетки размножаться с необычно высокой скоростью, что может привести к повреждению генетического материала в этих клетках. Дополнительные факторы, такие как курение или воздействие определенных канцерогенов, могут вызывать окончательное превращение нормальных клеток в раковые. Эти воздействия (дополнительные факторы), наряду с индивидуальными генетическими особенностями каждого человека, могут объяснить, почему у некоторых людей с онкогенными инфекциями развивается рак, а у других нет.
К онковирусам относятся инфекции, которые провоцируют появление раковых заболеваний, а также вирусы, которые способствуют развитию воспалительных процессов, носящих хронический характер.
По заключению экспертов Международного Агентства по Изучению Рака (МАИР) прямым канцерогенным действием на человека обладают следующие вирусы:
- вирусы гепатита В и С, вызывающие рак печени;
- определенные типы папилломавирусов человека, являющиеся причинным агентом рака шейки матки, некоторых опухолей ано-генитальной области и других локализаций;
- вирус Эпштейна-Барр, принимающий участие в возникновении целого ряда злокачественных новообразований;
- герпесвирус человека 8-го типа, играющий важную роль в возникновении саркомы Капоши, первичной выпотной лимфомы, болезни Кастлемана и некоторых других патологических состояний;
- вирус Т-клеточного лейкоза человека, являющийся этиологическим агентом Т-клеточного лейкоза взрослых, перHIVной выпотной лимфомы (Primary Effusion Lymphoma, PEL), а также тропического спастического парапареза (TSP) и ряда других неонкологических заболеваний;
- вирус иммунодефицита человека (ВИЧ), не обладающий трансформирующими генами, но создающего необходимые условия (иммунодефицит) для возникновения рака.
Все они включены в санитарные правила и нуждаются в кратких комментариях.
В настоящее время существует глобальная эпидемия вируса гепатита В (HBV): на планете инфицировано этим вирусом более 350 млн. человек. Каждый год от инфекции HВV умирает 2 млн. человек, из них более 300 тыс. от рака печени. Вирусом гепатита С в мире инфицировано более 170 млн. человек, и их число ежегодно увеличивается на 3–4 млн. По данным экспертов, вирус гепатита С ежегодно становится причиной смерти 250–350 тыс. человек от цирроза, печеночной недостаточности и гепатоцеллюлярной карциномы. Из общего числа случаев рака печени (гепатокарцином) более половины связано с инфицированием HBV, четверть — с инфицированием HCV и 22% случаев — с другими причинами.
Инфицированность населения HBV колеблется от низкой, не превышающей 2% в США и странах Западной Европы, до высокой в странах Африки и Юго-Восточной Азии, приближающейся к 10%. Россия по уровню инфицированности населения HBV занимает промежуточное положение. В окружающих Россию странах (Средняя Азия, Закавказье, Молдавия) инфицированность населения по данным ВОЗ достигает 8%.
Пути заражения вирусом гепатита В (HBV): перинатальный (от матери к плоду), парентеральный (главным образом с кровью или другими биологическим жидкостями больного человека, попадающими непосредственно в кровь инфицируемого, особенно при употреблении инъекционных наркотиков) и половым путем. Заразиться можно в местах, где собираются лица, употребляющие инъекционные наркотики, в салонах пирсинга и татуажа, парикмахерских (маникюр, педикюр — при совместном пользовании общими бритвами и маникюрными принадлежностями). Половой контакт с партнером носителем инфекции в 30% случаев заканчивается инфицированием партнера. Велика вероятность заразиться вирусом, если человек имеет много половых партнеров. У инфицированной HBV матери может родиться инфицированный ребенок. Заражение происходит при родах или нарушении целостности плаценты в ходе беременности. Вирус гепатита B обнаруживается в слюне, слезах, моче и кале инфицированных лиц. Риск заражения, хотя и незначительный, существует при попадании их на поврежденную кожу и слизистые оболочки другого человека. С пищей, при разговоре, т. е. контактно-бытовым путем гепатит В не передается.
Пути заражения вируса гепатита С (HCV): в основном такие же как при HBV. Половой путь передачи гепатита С мало актуален (не более 3–5%), однако значение его возрастает при наличии большого количества партнеров, случайных связей. От инфицированной матери плоду вирус гепатита С передается редко, не более, чем в 5% случаев и только в процессе родов при прохождении родовых путей. Не отмечена передача вируса с молоком матери и контактно-бытовым путем.
Профилактика. Исходя из вирусной природы указанных заболеваний, вакцинация является наиболее эффективным способом предотвращения распространения инфекции, возникновения острого и хронического гепатита, а, следовательно, и рака печени. В 1980 г. приготовлена вакцина против вируса гепатита В. Согласно рекомендациям, принятым в 1999 г. в США и практикуемым в России, вакцина рекомендована для лиц от 0 до 19 лет. В настоящее время во многих странах мира, включая Россию, введена обязательная вакцинация против гепатита В (HBV) среди новорожденных, детей раннего возраста, подростков и лиц из групп риска. С целью профилактики распространения HBV и рака печени проводится тестирование всех беременных и доноров крови на поверхностный антиген вируса (HbsAg) и антитела к нему (HBs).
Вирусы папилломы человека (HPV) принадлежат к группе Papillomavirus и являются вирусами, которые поражают клетки эпителия эктодермального происхождения (кожа, слизистые половых органов, ротовой полости).
В настоящее время известно более 100 типов HPV, которые могут вызывать бородавки на различных частях тела, но лишь немногие из них связывают с различными злокачественными новообразованиями. Некоторые штаммы вируса папилломы распространяются половым путем и вызывают остроконечные бородавки. Передаваемые половым путем вирусы папилломы связаны с развитием рака шейки матки, полового члена и анального прохода (последние встречаются не так часто). К группе высокого онкогенного риска относят наиболее распространенные в Европе и в России 16-й и 18-й типы вируса (HPV 16 и HPV 18), а также менее распространенные 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 типы, ответственные, соответственно, за возникновение 65–75% и 18–20% случаев рака шейки матки (РШМ). Раннее обнаружение и лечение может уменьшить риск рака шейки матки, поэтому врачи советуют женщинам с выявленными вирусами папиломы периодически проводить тест мазок Папаниколау. Вирус папилломы человека является довольно распространенными венерическим заболеваниям с несколькими миллионами новых случаев инфицирования, диагностируемых каждый год.
Пути заражения. Передача инфекции осуществляется половым путем, возможны перинатальный (от матери к плоду) и оральный пути заражения. Большинство лиц обоего пола инфицируется вирусом в первые годы половой жизни. В последние 20–30 лет уровень инфицированности существенно возрос. У 90% женщин HPV инфекция протекает без явных клинических проявлений и вирус исчезает самостоятельно через год после инфицирования под влиянием иммунной системы организма. В трети случаев вирусную ДНК можно выявить более чем через год и в 10% — более чем через два года. Инфекция данным вирусом очень распространена среди здоровых женщин. К 50-летнему возрасту ею переболевает 8 женщин из 10.
Факторами риска для развития рака шейки матки служат раннее начало половой жизни, частая смена партнеров, сопутствующие урогенитальные инфекции (например, хламидийная или герпетическая), снижение клеточного иммунитета, гормональные воздействия (аборт, беременность, прием гормональных контрацептивов и др.), курение, неправильное питание (дефицит фолиевой кислоты), а также индивидуальные генетические особенности.
Вирус Эпштейн-Барра широко известен как вирус, который вызывает инфекционный мононуклеоз. Вирусом Эпштейн-Барра инфицировано практически всё население планеты. В развивающихся странах почти у каждого ребенка к пятилетнему возрасту выявляются антитела к этому вирусу. В развитых странах инфицированность несколько меньше: в США антитела выявляются у 50% выпускников средних школ, к сорока годам антитела к этому вирусу появляются у 90% населения. 15–25% взрослых являются выделителями вируса.
Данный вирус передается через контакт с жидкостью полости рта и носа инфицированного человека. Дети редко имеют выраженные симптомы вируса Эпштейн-Барра, но даже если они есть, симптомы, как правило, являются такими же, как при широко распространенных вирусных инфекциях. Вирус Эпштейн-Барра после заражения остается в организме, главным образом в лимфоцитах, всю остальную части жизни человека. Он находится в состоянии покоя в течение большей части времени, иногда проявляя себя, но не причиняя никакого реального вреда. При ослаблении организма и снижении защитных сил иммунной системы — вирус может активироваться и вызывать более агрессивные воздействия. Вирус Эпштейн-Барра ассоциируется, в первую очередь с развитием лимфобластомы, болезни Ходжкина, лимфомы носоглотки и лимфомы Беркитта, редкой формой рака, возникающего в лимфатических узлах. Кроме лимфобластомы, следует назвать такие вызываемые вирусом доброкачественные и злокачественные новообразования, как волосатоклеточная лейкоплакия полости рта, рак носоглотки и др., возникающие на фоне иммунодефицита организма различного происхождения.
Пути заражения. Основной путь передачи вируса — воздушно-капельный, но наиболее часто передача вируса происходит при непосредственных контактах слизистой рта (поцелуях). Заражение возможно и через содержащие вирус пищевые продукты, а также бытовым путём через руки и предметы обихода, при переливании крови и других парентеральных вмешательствах. Зафиксирован также половой путь передачи.
Ко-факторы. Поскольку у большинства лиц, инфицированных EBV, какой-либо патологии не возникает, то для ее появления, включая злокачественные новообразования, очевидно, необходимо воздействие на организм дополнительных факторов. Среди известных следует назвать паразитарные инфекции типа малярии; массивную инфекцию EBV в. раннем детском возрасте; ослабление иммунной системы; хроническое недоедание, а также использование в пищу продуктов, обладающих коканцерогенным действием; влияние любых факторов, вызывающих хромосомные мутации. Таким образом, можно сделать вывод, что инфицирование EBV является важным, но недостаточным условием для возникновения ассоциированных с ним онкологических заболеваний, чтобы возникла опухоль, необходимо действие ряда дополнительных факторов.
Открытый в 1994 г. герпесвирус саркомы Капоши в семействе герпесвирусов обозначен под номером 8 (HHV-8). В настоящее время считается доказанной его этиологическая роль в возникновении довольно редко встречающихся заболеваний, а именно саркомы Капоши (СК), выпотной В-клеточной лимфомы полостей тела (PEL) и болезни Кастлемана.
Распространенность HHV-8. Инфицированность населения HHV-8 в различных географических регионах существенно отличается и варьирует от долей процента в США и большинстве стран Западной Европы до 8–10% в странах Средиземноморья (Греция, Италия). Самый высокий процент серопозитивных лиц обнаружен в странах Восточной, Центральной и Западной Африки — странах, эндемичных для СК, где уровень инфицированности населения этим вирусом достигал 50–70%. В России уровень инфицированности HHV-8 среди доноров крови находится в пределах 4%.
Пути заражения. Основной путь передачи HHV-8 — половой, но также со слюной (при поцелуе), и с кровью (редко).
Профилактика. Учитывая половой путь передачи вируса основной профилактической мерой является практика безопасного секса, лечение хронического уропростатита у больных с выявленным HHV-8 в эякуляте и/или секрете предстательной железы, применение противовирусных препаратов в группах риска (больные, нуждающиеся в трансплантации органов и ВИЧ-инфицированные).
Профилактическая анти-вирусная (противоопухолевая) вакцина не создана, над ее изготовлением ведется работа.
Вирус Т-клеточного лейкоза человека (HTLV-1) — это онкогенный ретровирус, являющийся этиологическим фактором Т-клеточного лейкоза/лимфомы взрослых, протекающей чрезвычайно агрессивно со средней продолжительностью жизни около 6 месяцев, и нейро-дегенеративного заболевания под названием HTLV-1-ассоциированная миелопатия или тропического спастического парапареза. В регионах с высокой инфицированностью данным вирусом диагностируются также ассоциированные с вирусом увеиты, артриты, базедова болезнь, инсулинзависимый диабет, синдром Цезаря и др.
Распространенность. Спорадические случаи HTLV-1 инфекции встречаются во многих странах мира, включая Россию. Эндемичными же для этой инфекции являются некоторые регионы Японии, Южной Америки, Африки и часть стран Карибского бассейна.
Пути заражения. Существуют 3 основных пути передачи инфекции от инфицированных лиц: а) с молоком матери; б) при половом контакте главным образом через сперму; и в) с переливаемой кровью при гемотрансфузиях.
Ко-факторы. У большинства лиц, инфицированных HTLV-1, какой-либо патологии не возникает. После заражения вирусом ATL регистрируют не более чем у 1–5% вирусоносителей даже в эндемических для этого заболевания регионах и после длительного латентного периода, длящегося порой десятилетиями. Факторами, способствующими развитию ATL, являются паразитарные инфекции типа эписторхоза, использование иммунодепрессантов любого происхождения, ВИЧ-инфекция и др.
Профилактика. Для профилактики инфекции рекомендованы: отмена кормления грудным молоком младенцев инфицированными матерями; предохраняемый секс и контроль на присутствие HTLV-1 донорской крови не только в регионах с высоким уровнем распространения HTLV-1 среди населения, но и в других, т. к. переливание инфицированной вирусом крови, может способствовать его распространению и появлению заболеваний, связанных с HTLV-1 там, где они сейчас отсутствуют.
Этот вирус был открыт в 1983 г. и его ассоциация с синдромом приобретенного иммунодефицита (СПИД) доказана в 1984 г. Как уже упоминалось ранее, ВИЧ не обладает трансформирующим геном (онкогеном). Инфицированные им клетки (главным образом СD4+ Т-клетки и макрофаги) не подвергаются усиленной пролиферации (делению), а разрушаются, вызывая у инфицированного лица нарастающую степень иммунодефицита, и создавая тем самым условия, необходимые для возникновения опухоли. Доказано, что у больных СПИД`ом примерно 50% новообразований ассоциировано с Эпштейн-Барр вирусом или герпес вирусом саркомы Капоши (HHV-8). Чаще всего у таких больных диагностируют саркому Капоши либо одну из разновидностей не-ходжкинских лимфом. Характеристика этих новообразований, механизмы канцерогенеза, а также методы профилактики и лечения даны в предыдущих разделах, их можно найти также в многочисленных отечественных и зарубежных публикациях.
Несмотря на различную организацию онкогенных вирусов человека, неодинаковый спектр их клеток-мишеней, они обладают рядом общих биологических свойств, а именно:
- вирусы лишь инициируют патологический процесс, усиливая пролиферацию (разрастание ткани организма путём размножения клеток делением) и генетическую нестабильность инфицированных ими клеток;
- у инфицированных онкогенными вирусами лиц возникновение опухоли, как правило, событие нечастое: один случай новообразования возникает среди сотен, иногда тысяч инфицированных;
- продолжительность латентного периода от инфицирования до возникновения опухоли составляет иногда десятилетия;
- у большинства инфицированных лиц возникновение опухоли не является обязательным, но они могут составить группу риска, с более высокой возможностью ее возникновения;
- для злокачественной трансформации инфицированных клеток в организме человека необходимы дополнительные факторы и условия, приводящие к возникновению опухоли.
Профилактика активации вирусов и развития рака
- отказ от курения;
- коррекция питания и образа жизни;
- сокращение воздействия канцерогенных веществ;
- повышение защитной функции организма;
- определение и терапия заболеваний, находящихся в предраковой стадии;
- наблюдение групп высокого риска появления онкологий;
- диагностика рака на ранних стадиях.
Можно ли заразиться раком от больного человека, либо от носителя вируса?
То, что окружающие в безопасности рядом с онкобольными людьми, уже неоднократно доказано и подтверждено проведенными опытами. В 19 веке французским хирургом был выделен экстракт рака молочной железы. Затем он ввел его себе, и еще нескольким людям, участвовавшим в опыте добровольно, этот экстракт под кожу. В месте, куда была проведена инъекция, начались острые воспалительные процессы, которые прошли спустя несколько дней. Опыт в скором времени был проведен еще раз и результаты оказались те же.
Современные ученые также проводили исследования, которые подтвердили, что заразиться раком от другого человека невозможно. Медицинские работники провели анализ 350 тысяч процедур переливания крови, проводимые в течение 35 лет. У трех процентов доноров был обнаружен рак, однако ни один из людей, которым переливали кровь онкобольных, не был заражен.
Еще один важный вывод после проведенных медицинских исследований — генетика на появление раковых образований влияет гораздо больше, чем вирусы и другие факторы. Это значит, что попавший в организм онковирус имеет в развитии рака практически нулевую значимость, тогда как сбой в генетическом коде — ключевую.
Выводы
Вирусы, вызывающие рак — очень опасны для жизни и здоровья человека. Их профилактика и своевременная диагностика поможет максимально снизить риск появления серьезных последствий. При появлении каких-либо признаков вирусной инфекции необходимо срочно обратиться к компетентному специалисту и сдать анализы, которые помогут их выявить и вовремя принять необходимые меры.
Читайте также:


