Лекарства угнетающие костный мозг
Ниже описаны лекарственные средства, вызывающие аплазию, и в первую очередь те из них, которые обычно назначают пожилым больным.
Антибактериальные средства
Левомицетин. Этот препарат оказывает двоякое действие на костный мозг. Чаще всего он вызывает обратимое дозозависимое подавление костного мозга с преимущественным поражением эритроидных клеток, а иногда также тромбоцитов и гранулоцитов. Реже развивается необратимая, поздно возникающая аплазия костного мозга, захватывающая все три клеточных ростка и сопровождающаяся высокой смертностью.
Знание об опасности этих осложнений стало причиной резкого сокращения перорального и парентерального применения левомицетина. Однако случаи аплазии отмечались и после местного использования левомицетина в виде аэрозоля или применения его в составе глазных мазей [Rosenthal, Blackman, 1965; Abrams et al., 1980; Del Qiacco et al., 1981]. Несмотря на то что ни один из пациентов не относился к числу пожилых, эти наблюдения подчеркивают необходимость осторожного применения таких местных препаратов. Неясно, как при местном применении развивается системный эффект. Можно предположить, что он является следствием всасывания веществ через конъюнктиву или попадания его через слезный проток в желудочно-кишечный тракт.
Сульфаниламиды, пенициллины и метронидазол. Эти препараты иногда вызывают аплазию, в том числе у лиц пожилого возраста (White et al., 1980].
Лекарства, применяемые для лечения ревматических болезней
Бутадион и оксифенбутазон. McCarthy, Chalmers (1964), проанализировав связь бутадиона с аплазией костного мозга, установили, что большинство случаев приходится на женщин старше 60 лет. Эти больные, как правило, не принимали других препаратов, способных вызвать аплазию. Позднее Fowler (1967) пришел к заключению, что бутадион и оксифенбутазон у молодых пациентов чаще всего вызывают агранулоцитоз, а у пожилых — апластическую анемию. Смертность резко увеличивается с возрастом, симптомы поражения развиваются через несколько месяцев от начала лечения. Inman (1977) проанализировал истории болезни 269 пациентов, в свидетельствах о смерти которых лекарственные препараты, как причина аплазии или агранулоцитоза, не упоминались. Он обнаружил, что 83 летальных исхода (31%), по всей вероятности, были обусловлены приемом лекарств, причем в 128 случаях смерть была вызвана бутадионом и в 11 — оксифенбутазоном. И в этих случаях смертность резко увеличивалась с возрастом, особенно среди пожилых женщин. Избыточную смертность именно в этой возрастной группе автор не связывает ни с большим употреблением лекарств, ни с тем фактом, что женщины живут дольше мужчин.
Препараты золота. Взаимосвязь между аплазией костного мозга и приемом препаратов золота была изучена Кау (1973, 1976). У большинства пациентов угнетение костного мозга развивалось после приема 450 мг золота, но в некоторых случаях достаточно было и меньшей дозы. Эозинофилия, традиционно рассматриваемая как тревожный симптом, была обнаружена лишь в немногих случаях. Это может частично объясняться тем, что у таких больных лейкоцитарную формулу подсчитывали нерегулярно. Кау пришла к выводу, что аплазия — серьезное, но редкое осложнение терапии препаратами золота, и что лучшими способами его предотвращения являются регулярный полный анализ крови и уменьшение дозы препаратов при достижении клинической ремиссии.
D-Пеницилламин. При длительном применении он может вызывать уменьшение числа эритроцитов, нейтрофилов и тромбоцитов [Dixon et al., 1975]. Кау (1979) при описании 10 больных с панцитопенией, обусловленной пеницилламином, отметила, что доза препарата варьировалась от 250 до 1000 мг/сут, составляя в среднем 615 мг/сут. Длительность лечения равнялась 3—60 мес, в среднем — 10 мес. Возраст пациентов колебался от 35 до 68 лет. Мнения о роли пеницилламина в развитии аплазии у лиц,ранее получавших препараты золота, противоречивы. Smith, Swinburn (1980) на основании личного опыта считают, что у пациентов, ранее перенесших побочные реакции на препараты золота, частота неблагоприятных реакций на пеницилламин не увеличивается, и что риск развития таких реакций не возрастает при начале терапии пеницилламином в течение 6 мес после прекращения лечения препаратами золота. Однако Кеап и соавт. (1980) полагают, что вероятность развития реакций на пеницилламин выше у пациентов, перенесших ранее реакции на препараты золота.
К числу других противовоспалительных средств, с которыми может быть связано развитие аплазии, относятся индометацин [Canada, Burka, 1968], сулиндак [Bennett et al., 1980; Miller, 1980;, Sanz et al., 1980] и фенпрофен [Ashraf et al, 1982].
Цитотоксические средства
Эти лекарства, в полном соответствии со своей природой, подавляют функции костного мозга, поэтому их обычно назначают в виде прерывистых курсов. Данная группа лекарств включает алкилирующие вещества, такие как циклофосфан, миелосан и мельфан; антиметаболиты, например метотрексат и меркаптопурин; алкалоиды барвинка, в том числе винкристин и винбластин.
Противосудорожные препараты
Производные гидантоина могут вызывать аплазию. Huguley и соавт. (1966) отметили, что, по данным регистра Американской медицинской ассоциации, из 50 случаев аплазии, связанных с приемом противосудорожных средств, 45 вызваны дифенином и метилфенилэтилгидантоином. Gabriel и соавт. (1966) описали 16 случаев аплазии, вызванных производными гидантоина. Возраст больных составлял 9—48 лет, большинство из них были мужчины. По данным тех же авторов, к аналогичной возрастной группе относились и больные с аплазией, вызванной производными оксазолидина.
Связь карбамазепина с аплазией проанализировали Hart, Easton (1981). Они пришли к заключению, что частота таких случаев составляет менее 1 : 50 000. Продолжительность терапии до развития аплазии варьировалась от 4 до 330 дней. Возраст пациента и общая доза препарата не относились к числу важных причинных факторов, определяющих развитие аплазии. Авторы считают, что рутинный лабораторный контроль за состоянием пациентов не оправдан.
Антидепрессанты
Антитиреоидные средства
Тиоурацил из-за связанных с ним токсических эффектов, включающих аплазию, в настоящее время используется мало. Карбимазол менее токсичен, однако и он иногда вызывает аплазию у пожилых больных.
Другие лекарства
Пероральные антидиабетические препараты, такие как хлорпропамид [Harris, 1971; Gill et al., 1980] и бутамид [Huguley et al., 1966], изредка могут быть причиной аплазии у пациентов среднего возраста. Аплазия, вызванная хлорпропамидом, развивается в течение 1 мес от начала лечения или спустя 6 мес — 7 лет. Циметидин обычно вызывает агранулоцитоз, однако описан случай апластической анемии у женщины 49 лет, которая принимала этот препарат наряду с большим числом других лекарств, включая парацетамол, который сам по себе может вызывать аплазию [Tonkonow, Hoffman, 1980].
Прогноз
Прогноз у больных апластической анемией неблагоприятный. Около половины из них умирают в течение 6 мес от кровотечений или присоединившейся инфекции. Однако больные могут жить достаточно долго, если число нейтрофилов сохранится на уровне 0,5-10 9 /л. Степень снижения клеточности и прогноз плохо коррелируют между собой. Изредка у больных апластической анемией развивается лейкоз или пароксизмальная ночная гемоглобинурия.
Лечение
Лечение апластической анемии преследует четыре цели. Во-первых, по возможности прием любого потенциально токсичного препарата следует прекратить, однако, к сожалению, картина крови после его отмены может и не улучшиться. Во-вторых, в связи с анемией могут потребоваться переливания крови. В-третьих, любую инфекцию необходимо активно лечить; нужен самый тщательный уход за кожей и полостью рта. В-четвертых, иногда с помощью стимуляции анаболическими стероидами удается нормализовать функции костного мозга. Для борьбы с кровоточивостью полезным может оказаться применение кортикостероидов. Трансплантацию костного мозга пожилым больным в настоящее время не проводят.
АГРАНУЛОЦИТОЗ
Агранулоцитоз — одна из наиболее распространенных гематологических медикаментозных реакций, которая поражает преимущественно пожилых лиц [Arneborn, Palmblad, 1978; Bottiger et al., 1979]. По данным одних исследований, представители обоего пола поражаются с равной частотой, по другим сведениям, среди заболевших преобладают мужчины. Смертность весьма высока, умирают примерно 7з больных, как правило — от инфекции.
Клинические проявления
Агранулоцитоз может начинаться остро или подостро с функциональных нарушений и (или) с инфекции. Иногда симптомы возникают через несколько дней после приема последней дозы того препарата, которым больной пользовался на протяжении длительного времени, а иногда — почти сразу после начала лечения новым средством. Например, первые симптомы при приеме препаратов фенотиазинового ряда появляются через 20— 40 дней. Агранулоцитоз, обусловленный бутадионом, возникает примерно через 3 мес после начала приема этого вещества, причем ему часто предшествует сыпь [Mauer, 1955]. У больных отмечаются лихорадка, тошнота, потливость, острые и тупые боли во всем теле, выраженная слабость. Типичен экссудативный фарингит, вслед за которым могут возникнуть язвы полости рта, пищевода, тонкой и толстой кишки, влагалища и кожи. В тяжелых случаях присоединяется септицемия.
Последнее изменение этой страницы: 2016-08-01; Нарушение авторского права страницы
Апластическая анемия, обусловливаемая химическими и физическими агентами характеризуется прямым отношением количества воздействующего на костный мозг токсического вещества и интенсивности развиваемой им гипоплазии (Мунтяну, Rohr); наличием — в клинической картине — отдельных признаков поражения участков паренхимы органов большого значения, таких как печень, почки, центральная нервная система, что реже наблюдается при остальных видах апластической анемии.
К токсическим веществам, оказывающим большое влияние на костный мозг и очень хорошо изученным, относятся бензол, хлорамфеникол и ряд других медикаментов.
Ниже приведены вещества, определяющие гипоплазию костного мозга и оценка представляющего ими риска.
Физические и химические факторы, обусловливающие развитие апластической анемии:
А. Факторы, наличие которых в определенном количестве, в любом случае способствуют развитию аплазии костного мозга, в том числе, ионизирующие излучения, соединения иприта (азотный иприт и пр.), цитостатические медикаменты (антиметаболиты, антифолиевые препараты), бензол, его соединения.
Б. Факторы, вызывающие лишь случайно костномозговую аплазию, в том числе:
1. Противомикробные:
Мышьякобензолы
Хлорамфеникол
Сульфамид
Стрептомицин
2. Противосудорожные:
Мезантоин
Триметадион
3. Антитиреоидные: Метилтиоурацил
4. Антигистаминные: Фенерган
5. Инсектициды: ДДТ
6. Различные факторы:
Соли золота
Фенилбутазон
Нитрофенол
Мепробамат
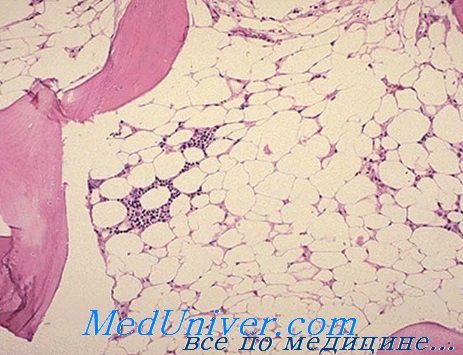
Бензол и его соединения как причина апластической анемии. Несчастные случаи, вызываемые бензолом, начали обнаруживаться в начале нашего века, в связи с промышленным применением этого вещества в качестве органического растворителя (Robr). В принципе бензол угнетает костный мозг, что означает приостановление синтеза РНК в уже дифференцированных элементах.
Видимо бензол не угнетает колонии клеток-штамм, в чем следует искать объяснение полной обратимости нарушений в случаях непродолжитекьности токсического воздействия (Nomiyama).
Влияние на костный мозг тесно связано с количеством воздействующего на больного вещества. Исходно отмечается раздражение костного мозга и общая, в частности эритроидная, гиперплазия, сопровождающаяся лейкоцитозом, нейтрофилией и отклонением влево в периферической крови; затем, постепенно, развивается костномозговая гипоплазия с обширными участками жирного преобразования, наличием редких миелоидных элементов, выраженной реакцией лимфатической или плазмоцитной ткани, а в отдельных случаях моноцитной реакцией, которую часто нелегко различить от лейкемического поцесса (Мунтяну).
После развития костномозговой гипоплазии имеются лишь немногие шансы на его восстановление. Вот почему внимание направлено на предупреждение заболевания путем ограничения концентрации бензола в атмосферном воздухе соответствующих заводов, максимально до 34 частей на 1 млн. и выявление первых признаков поражения костного мозга с помощью наблюдения за развитием эритроцитного макроцитоза у рабочих данных предприятий (Мунтяну).
Однако бензол оказывает и ряд других влияний на костный мозг, в том числе обусловливает: выраженную гиперплазию эритроидного ряда и приостановление деления (мегалобластоз), картину, называемую бензоловой эритропатией, имеющей большое сходство с острой эритемией; хронический миелосклероз с миелоидной метаплазией; гипоплазию лимфатической тнани, равно как и острую лейкемию (Rohr, Wintrobe).
Хлорамфеникол это антибиотик, вызвавший большой энтузиазм в 1948 г. когда был проверен его чрезвычайный эффект при заболеваниях брюшным тифом, а затем и отдельными риккетсиозами. Но в дальнейшем широкое применение препарата в борьбе с инфекцией грамм-отрицательными возбудителями начало выявлять его вредные последствия, поскольку он способствует развитию весьма тяжелой необратимой костномозговой аплазии.
В клинике риск развития аплазии после лечения хлорамфениколом составляет 1/10 тыс.—1/20 тыс. Однако по иным статистическим данным, например Объединения американских врачей, хлорамфеникол составил причину развития 44% всех заболеваний панцитопенией в США (Williams).
Формула хлорамфеникола включает бензоловое ядро с боковой цепью дихлорацетамида (Мунтяну). В связи с этим создалось мнение о том, что токсический эффект следует отнести за счет бензолового ядра. За справедливость такого предположения говорит и тот факт, что, подобно бензолу, медикамент поражает исходно эритроидный ряд, приостанавливая созревание, блокируя включение железа в гем с последующим ростом показателей сывороточного железа, костномозговых сидеробластов и развитием ретикулоцитопении.
Дальнейшие исследования выявили одновременное по существу поражение всех рядов крови, при этом первым морфологическим признаком поражения костного мозга оказалось появление вакуолей в костномозговых клетках, которые лучше выражены в эритробластах (Мунтяну, Ward).
Эти данные совпадают с результатами экспериментальных наблюдений, по которым медикамент угнетает синтез белков в клетках костного мозга в результате соревнования с ARNm (Ward), а также и синтез РНК (Williams).
В дальнейшем были обнаружены довольно тяжелые осложнения спустя некоторое время после прекращения лечения этим медикаментом. В связи с этим была выдвинута гипотеза о возможных, вызываемых им изменениях в геноме клеток-штамм, результатом чего являются необратимые сдвиги механизма деления последних, развитие необратимой костномозговой аплазии и острой лейкемии (Mukherji) или ночной пароксизмальной гемоглобинурии (Дачие и Левис).
В клинической практике целесообразно помнить, что этот медикамент вызывает тяжелые, смертельные аплазии и его применение следует ограничивать заболеваниями, вызываемыми строго чувствительными к нему возбудителями.
Прочие химические агенты, приводящие к апластической анемии. К категории иных химических факторов, обусловливающих костномозговую аплазию относятся ДДТ, сульфонамиды, противосудорожные средства, равно как и соединения золота. Также доказано, что атебрин создает чрезмерную чувствительность и тем самым способствует развитию костномозговой аплазии.
Утверждается, что, по началу, токсический агент поражает (вызывает мутацию) клетки-штамм (Dacie и Lewis). Выживающие при этом клетки-штамм порождают аномальные популяции: эритроцитов — чувствительных к комплементу, гранулоцитов — лишенных лейкоцитной щелочной фосфатазы и тромбоцитов с недостатком ферментов.
Апластическая анемия отмечена и при беременности (Evans), гипопитуитаризме, почечной недостаточности и пр.

Апластическая анемия – это состояние, при котором организм перестает вырабатывать достаточное количество новых кровяных телец.
Апластическая анемия вызывает у больных слабость и утомляемость, а также делает их очень подверженными инфекциям и кровотечениям.
Апластическая анемия, редкое и серьезное состояние, может возникнуть в любом возрасте.
Апластическая анемия может развиться внезапно, но может прогрессировать медленно, месяцами ухудшая состояние больного. Современное лечение апластической анемии включает переливания крови, лекарственные препараты и трансплантацию костного мозга.
Причины апластической анемии
Факторы, которые временно или необратимо нарушают кроветворную функцию костного мозга, включают:
• Радиоактивное облучение. Человек может стать жертвой радиации как в результате аварий на атомных объектах, так и в результате медицинского облучения – например, при лечении рака.
• Химиотерапия при раке. Воздействие многих химиотерапевтических препаратов плохо сказывается не только на раковых клетках, но и на других интенсивно делящихся клетках организма.
• Токсичные вещества. Воздействие токсинов из окружающей среды, таких как инсектициды, пестициды, лабораторные реактивы, может пагубно повлиять на костный мозг. При этом больному иногда становится лучше, если воздействие химикатов прекратится.
• Некоторые лекарства. Препараты для лечения ревматоидного артрита, некоторые антибиотики могут вызывать апластическую анемию. Данный побочный эффект обязательно должен быть указан в инструкции к препарату.
• Аутоиммунные заболевания. Это большая группа заболеваний, при которых иммунная система организма ошибочно атакует клетки хозяина. Жертвами иммунитета могут стать и клетки костного мозга.
• Вирусная инфекция. Некоторые вирусы играют роль в развитии апластической анемии. Последние исследования позволяют причислить к таким опасным организмам вирус Эпштейна-Барр, цитомегаловирус (ЦМВ), парвовирус В19 и вирус иммунодефицита человека (ВИЧ).
• Беременность. Апластическая анемия, которая возникает при беременности, может быть связана с аутоиммунной проблемой – иммунная система беременной иногда ошибочно атакует костный мозг.
• Неизвестные факторы. Во многих случаях врачи не могут установить точную причину апластической анемии. Тогда говорят о так называемой идиопатической апластической анемии.
Апластическую анемию не стоит путать с миелодиспластическим синдромом.
Апластическая анемия связана с некоторыми другими заболеваниями. У части больных с апластической анемией имеется другая редкая болезнь – пароксизмальная ночная гемоглобинурия. Эта болезнь характеризуется слишком быстрым разрушением эритроцитов.
Анемия Фанкони – это редкая, наследственная болезнь, которая приводит к апластической анемии. Дети с болезнью Фанкони могут иметь различные врожденные дефекты, такие как недоразвитие конечностей. Болезнь диагностируется при помощи генетического анализа.
Апластическая анемия встречается редко.
Факторы риска включают:
• Лучевая или химиотерапия рака в прошлом.
• Воздействие токсичных веществ на производстве и в быту.
• Использование рецептурных препаратов, таких как хлорамфеникол (Левомицетин) и некоторые средства против ревматоидного артрита.
• Некоторые заболевания кроветворной системы.
• Тяжелые инфекционные заболевания.
• Аутоиммунные процессы.
• Беременность (редко).
Симптомы апластической анемии
Признаки болезни появляются в результате снижения количества тех или иных кровяных телец.
Признаки апластической анемии могут быть следующими:
• Слабость.
• Одышка при напряжении.
• Быстрое или нерегулярное сердцебиение.
• Бледность кожных покровов.
• Частые и тяжелые инфекции.
• Склонность к появлению синяков.
• Кровотечения из десен и носа.
• Длительные кровотечения после порезов.
• Кожная сыпь.
• Головокружение.
• Головные боли.
Апластическая анемия может прогрессировать медленно, неделями и месяцами. Болезнь может быть короткой и проходящей, а может стать хронической. Апластическая анемия требует серьезного отношения, потому что в тяжелых случаях она заканчивается фатально.
Диагностика апластической анемии
Для диагностики этого заболевания врач может назначить следующее:
• Анализы крови. В крови здорового человека уровень эритроцитов, лейкоцитов и тромбоцитов находится в определенных пределах. Эти пределы могут варьировать в зависимости от возраста, пола, расы и других особенностей организма. Но если в анализах обнаружится очень низкий уровень всех трех классов клеток крови, то врач заподозрит апластическую анемию.
• Биопсия костного мозга. Для подтверждения диагноза больному придется пройти болезненную, но необходимую процедуру биопсии. Во время биопсии врач введет специальную иглу в одну из костей и возьмет образец костного мозга. Клетки костного мозга изучат под микроскопом, чтобы увидеть признаки апластической анемии или других заболеваний. При апластической анемии костный мозг будет содержать мало кровяных клеток.
После того, как подтвердится апластическая анемия, врачи назначат дополнительные обследования, чтобы выяснить причину болезни. Это может быть длительный и сложный процесс.
Лечение апластической анемии
Лечение апластической анемии в легких случаях может состоять в простом наблюдении за пациентом. При более тяжелой форме болезни могут применяться переливания крови, трансплантация костного мозга и специальные препараты, которые стимулируют кроветворение. Тяжелая апластическая анемия угрожает жизни человека и требует обязательной госпитализации.
При низком уровне тромбоцитов или эритроцитов больным переливают донорскую кровь. Это не вылечит апластическую анемию, но поможет контролировать ее симптомы, восполняя кровяные клетки, которые не вырабатывает больной костный мозг. Для переливания могут использовать отдельную массу, состоящую из эритроцитов или тромбоцитов – в зависимости от потребностей больного.
Обычно нет ограничения количества переливаний для одного больного. Но у такой процедуры могут быть осложнения. Переливаемые кровяные тельца содержат железо, которое высвобождается при их разрушении и накапливается в теле. При многократном переливании в организме откладываются большие запасы железа, которые повреждают жизненно важные органы, если не назначить специальные препараты для его выведения.
Другое осложнение заключается в том, что организм может вырабатывать антитела к переливаемым клетках. А это сделает лечение менее эффективным.
Если донор найден, то костный мозг больного сначала истощают высокими дозами радиации или химиотерапией. Далее здоровые стволовые клетки донора фильтруют из его крови, после чего вводят их в кровоток больного. Клетки сами мигрируют в полости костей и начинают там вырабатывать кровяные тельца, как это предусмотрено природой. Но вся процедура очень сложная, дорогостоящая и требует длительного пребывания в больнице. После трансплантации больной должен получать лекарства для профилактики отторжения донорских клеток.
Трансплантация влечет за собой риски. Есть вероятность, что организм начнет отторгать трансплантат. Эта реакция может быть фатальной для реципиента. Кроме того, не каждому больному удается найти донора, который совместим по всем параметрам.
Больные с аутоиммунными заболеваниями, которые повредили костный мозг, нуждаются в лечении иммуносупрессорами – препаратами, подавляющими иммунитет.
Препарат циклоспорин (Генграф, Неорал) и антитимоцитарный глобулин (Тимоглобулин) могут использоваться в качестве примера. Эти лекарства подавляют активность иммунных клеток, которые атакуют костный мозг. Лечение помогает восстановить костный мозг и повысить уровень клеток крови. Два названных выше препарата нередко используют в комбинации.
Кортикостероидные гормоны, такие как метилпреднизолон (Солу-Медрол, Медрол, Метипред), также назначают для подавления иммунитета, иногда наряду с другими лекарствами.
Иммуносупрессоры могут быть очень эффективными при апластической анемии. Обратной стороной медали является то, что подавление иммунитета приводит к риску инфекций. Кроме того, есть возможность, что после отмены лекарств апластическая анемия вернется.
Некоторые препараты помогают усилить кроветворение в костном мозге. Среди них колониестимулирующие факторы, такие как сарграмостин (Лейкин), филграстим (Нейпоген), пегфилграстим (Нейласта) и эпоэтин-альфа (Прокрит, Эпоген). Эти препараты разработаны относительно недавно, их получение является очень дорогим и трудоемким процессом, поэтому стоимость препаратов для среднестатистического больного просто фантастическая. Колониестимулирующие факторы нередко назначают наряду с иммуносупрессорами.
Апластическая анемия сопровождается понижением уровня лейкоцитов и ослаблением иммунной защиты организма. Это делает организм больного очень восприимчивым к различным бактериальным, вирусным и грибковым инфекциям.
Апластическая анемия, вызванная радиацией или химиотерапией рака, обычно улучшается после отмены лечения. То же самое касается многих лекарств и токсинов, которые поражают костный мозг.
Беременные женщины с апластической анемией получают переливания крови, потому что другие способы лечения нанесут непоправимый вред ребенку. У многих беременных апластическая анемия проходит сама по себе вскоре после родов. Если этого не произошло, требуется дальнейшее лечение.
Советы для больных апластической анемией:
• Отдыхайте, когда вам это нужно. Анемия может вызвать утомляемость и одышку, даже при незначительной нагрузке. Делайте перерывы в работе, если вы устали, берегите свои силы.
• Избегайте контактных видов спорта. Из-за высокого риска кровотечений, связанных с тромбоцитопенией, контактный спорт может вызвать проблемы. Незначительный порез, синяк, падение – и кровь будет трудно остановить.
• Защитите себя от микробов. Вы можете уменьшить риск инфекций, если будете чаще мыть руки, избегать больных людей и соблюдать правила гигиены. При первых незначительных признаках инфекции немедленно обращайтесь к врачу.
Профилактика болезни
Константин Моканов: магистр фармации и профессиональный медицинский переводчик
Российским исследователям впервые удалось использовать стволовые клетки для адресной доставки онкопрепаратов. Их применение для лечения рака вызывало у ученых опасения, так как они способны стимулировать рост опухолей. Однако оказалось, что так происходит не всегда. Специалисты берут клетки костного мозга пациента и загружают в них специальные капсулы, в которых содержится токсичное вещество. Попадая в пораженные раком ткани, капсула под воздействием лазера высвобождает токсин, который убивает и саму клетку, и опухоль. Такая терапия уже показала свою эффективность на модели меланомы.

Клеточный курьер
В современной онкомедицине существует острая проблема: эффективность большинства лекарств зависит от вводимой дозы противоопухолевого препарата — чем она выше, тем эффективнее терапия. Однако рано или поздно наступает предел, когда воздействие лекарства еще недостаточно эффективно, а используемая дозировка подходит к критической отметке и становится токсичной для организма в целом. Чтобы преодолеть этот барьер, необходимо рационально использовать препарат, доставляя его направленно в очаг заболевания.
Кроме того, при стандартном подходе большая доза вводимого токсичного противоопухолевого лекарства распространяется по всему организму вместе с кровотоком. Это может создать очередной барьер на пути доставки лекарства в зону интереса: зачастую опухоли представляют собой достаточно плотные образования, а значит, кровоток в них затруднен. Таким образом, при стандартном введении противоопухолевый препарат не всегда может свободно накапливаться в достаточном количестве в области новообразований.

Чувство света

Чтобы решить эту задачу, исследователи разработали субмикронные полые носители на основе полимеров и диоксида кремния — полиэлектролитные капсулы (субмикрокапсулы). После того как лекарства были размещены в оболочке, стволовые клетки модифицировали и загрузили капсулы внутрь них.
— Разработанные капсулы светочувствительны, то есть они способны разрушаться под действием инфракрасного излучения и дистанционно высвобождать лекарство, — отметил Олексий Пельтек.
Светочувствительность позволяет высвобождать препарат в нужное время и в нужном месте. Таким образом, ученые разработали умную систему для доставки противоопухолевых лекарств непосредственно в область злокачественных новообразований. Исследователи предполагают, что капсулы можно будет вводить пациенту инъекционно в сосуды, окружающие опухоль.
Стволовые клетки, полученные из мышц человека
Исследования на клетках показали, что на раскрытие и высвобождение действующего вещества таким микроносителям необходимо три дня. По истечении этого срока на область локализации опухоли предлагают воздействовать инфракрасным излучением. Стволовые клетки также могут применяться для борьбы с метастазами. Но так как выяснить, где именно они находятся, сложно, разработчики предлагают использовать для этой цели носители, которые высвобождают лекарство без облучения. Работа над их разработкой уже ведется.

Эффективность адресной доставки полученных систем была протестирована на первичных клетках меланомы — модели опухолевых сфероидов, которые были выделены из тканей реальных онкопациентов.
— Упаковка лекарств в микрокапсулы, загрузка таких носителей в стволовые клетки и высвобождение под действием света в опухоли действительно отчасти решает задачу адресной доставки. Более того, таким способом стволовые клетки доставят свой смертельный груз не только в первичный очаг, но и во все метастазы в организме, — отметил ученый.
— Разработка требует клинических испытаний, которые занимают не один год. Но двигаться в этом направлении нужно. Основная проблема лечения опухолевых заболеваний — это похожесть здоровых и опухолевых клеток, — пояснил ученый. — Поэтому об эффективности нового способа доставки можно будет говорить только после длительных исследований.
Ученые ИТМО также отмечают, что, несмотря на первые успехи, для внедрения разработанных систем умной доставки в клиническую практику необходимо пройти сложный путь доклинических и клинических исследований, которые требуют времени и финансовых вложений.
Следующим шагом ученых ИТМО станут эксперименты на модельных животных.
Читайте также:



