Микробиологической диагностики гемофильной инфекции
Гемофильные бактерии – это гетерогенная группа мелких грамотрицательных бактерий, не образующих спор, не обладающих подвижностью и требующих для культивирования сложные питательные среды, обычно содержащие кровь или ее компоненты.
БАКТЕРИИ РОДА HAEMOPHILUS
Гемофильные бактерии рода Haemophilus – облигатные паразиты; нуждаются в факторах роста X и (или) V, которые содержатся в эритроцитах. Фактор X представляет собой гемин-комплекс ионов железа и протопорфирина IX, термостабилен, сохраняется после автоклавирования.
Фактор V – никотинамидадениндинуклеотид (НАД) – термолабильный коэнзим, содержится в тканях растений, животных, вырабатывается многими бактериями. Поскольку фактор V разрушается при стерилизации, его заменяют в среде добавлением картофеля или дрожжей.
Некоторые виды гемофильных бактерий могут расти в присутствии одного из факторов, другие нуждаются в обоих (табл.1).
В род Haemophilus включаются 16 видов. Для человека патогенны два вида: H.influenzae – возбудитель воспалительных процессов дыхательных путей, и H.ducreyi – возбудитель мягкого шанкра.
Гемофильные бактерии. Биологическая характеристика
HAEMOPHILUS INFLUENZAE
Гемофильная палочка была впервые выделена Р.Кох в начале 80-х гг XIX века. Позднее схожий микроорганизм выделил М.И.Афанасьев (1891) и Р.Пфейффер (1892) из гнойного отделяемого и ткани легкого больного, умершего во время пандемии гриппа. Длительное время его считали возбудителем гриппа (influenza), что объясняет происхождение видового названия.
Haemophilus influenzae (палочка Афанасьева – Пфейффера) вызывает респираторные заболевания, менингит, эндокардит, абсцессы, артриты и т.д.
Гемофильная палочка. Биологические свойства. Haemophilus influenzae – мелкие короткие палочки (коккобациллы). Очень полиморфны, могут образовывать нити. В мазках располагаются одиночно, иногда короткими цепочками. Неподвижны, не образуют спор, имеют отчетливо выраженную капсулу.
Бактерии медленно окрашиваются анилиновыми красителями: фуксином Пфейффера прокрашиваются в течение 5-15 минут.
H.influenzae по специфичности капсульного антигена делят на 6 сероваров: a, b, c, d, e, f. От больных людей чаще выделяется серовар b. Кроме капсульного антигена у возбудителя инфлюэнцы имеется соматический антиген, в составе которого обнаружены термостабильный и термолабильный протеины.
Экзотоксинов H.influenzae не продуцирует, её вирулентность связана с эндотоксином, выделяющимся при разрушении бактериальных клеток. Инвазивность и подавление фагоцитоза обусловлены наличием капсулы.
В окружающей среде возбудитель малоустойчив, быстро погибает под действием прямых солнечных и ультрафиолетовых лучей, дезинфицирующих веществ в обычных рабочих концентрациях. При 60°С погибает в течение 5-10 минут.
Гемофильная палочка. Патогенез и клиника. Неинкапсулированные бактерии являются частью нормальной микрофлоры дыхательных путей человека. Инкапсулированные формы H.influenzae, особенно типа b, вызывают гнойные инфекции дыхательных путей (синуситы, ларинготрахеиты, эпиглоттиты, отиты), а у маленьких детей менингиты.
В большинстве случаев возбудитель локализуется в носоглотке и передается воздушно-капельным путем. С помощью пилей бактерии прикрепляются к клеткам эпителия слизистой оболочки верхних дыхательных путей. В последующем они проникают в подслизистую оболочку, вызывая развитие воспалительной реакции. Штаммы, обладающие высокой вирулентностью, способны проникать в лимфо- и кровоток.
Характер клинических проявлений зависит от локализации воспалительного процесса.
Острый эпиглоттит – тяжелое, потенциально смертельное заболевание у детей, вызываемое H.influenzae типа b. Заболевание начинается остро и внезапно. Характерный признак – увеличенный, гиперимированный и отечный надгортанник. Распространенное осложнение – нарастающая асфиксия, в результате чего нередко возникает необходимость в трахеостомии.
Менингит – наиболее тяжелое заболевание, вызываемое H.influenzae типа b. Развивается как следствие распространения возбудителя по лимфатическим сосудам. Нередко у детей после выздоровления остаются стойкие неврологические изменения. Частые последствия менингита – умственная отсталость, гидроцефалия, слепота. Летальность при нелеченном менингите, вызванном H.influenzae, может достигать 90%.
H. influenzae может вызывать назофарингит, часто с лихорадкой. Инфекция может распространяться и вовлекать в процесс придаточные пазухи или среднее ухо. H.influenzae типа b является наиболее частым возбудителем воспалительных заболеваний среднего уха.
Гемофильная палочка. Иммунитет. Существует связь между содержанием антител к капсульным антигенам H.influenzae и риском развития менингита. Чем выше уровень антител, тем меньше вероятность возникновения зааболевания. Новорожденные относительно невосприимчивы за счет материнских антител
Гемофильная палочка. Лабораторная диагностика. Микробиологический диагноз основан на выделении чистой культуры возбудителя и бактериоскопическом исследовании патологического материала, полученного от больных.
Гемофильная палочка. Эпидемиология. Инфекции, вызванные H.influenzae, регистрируют только у человека. Среди здоровых людей уровень носительства гемофильных палочек достигает 90%. Заболевания, вызываемые H.influenzae, регистрируют повсеместно, а в ряде стран они эндемичны. Наиболее восприимчивая группа – дети в возрасте от 3 месяцев до 6 лет. Основной путь передачи – воздушно-капельный.
Гемофильная палочка. Лечение и профилактика. Инфекции, вызванные H.influenzae типа b, обычно лечат ампициллином или хлорамфениколом. В настоящее время существуют штаммы H.influenzae, устойчивые к обоим препаратам.
Детям, находившимся в контакте с больным, назначают рифампицин, обеспечивающий хороший защитный эффект.
HAEMOPHILUS DUCREYI
Haemophilus ducreyi – возбудитель мягкого шанкра (в англоязычной литературе шанкроид) – венерического заболевания.
В мазках, окрашенных по Граму, H.ducreyi имеют вид палочек овоидной формы, расположенных параллельными цепочками (“железнодорожные пути”), группами или парами. Неподвижны, не образуют спор.
H.ducreyi – факультативный анаэроб. Для роста требует X (но не V) фактор. На кровяном агаре образует мелкие серовато-желтые колонии, напоминающие колонии стрептококков; через 3-4 суток образуют небольшую зону гемолиза.
Длительное время заболевание считали “экзотическим”, например, в отечественной практике регистрировали лишь завозные, “портовые” случаи заболевания. В последние годы многие дерматовенерологи отмечают увеличение заболеваемости мягким шанкром.
Уже через 12-18 часов на месте внедрения возбудителя образуется красное пятно, которое через 2-5 дней превращается в изъязвляющуюся папулу. Образовавшаяся язва мягкая на ощупь и болезненная (что отличает ее от твердого шанкра при сифилисе), с тонкими, подрытыми краями. Дно язвы покрыто желтоватым налетом и обильно кровоточит. В течение 3 недель язва увеличивается от размеров зерна чечевицы до 2 см. Шанкры могут быть множественными и сливаться в гигантские ползучие язвы. В 40% случаев наблюдается нагноение региональных лимфатических узлов. При неосложненном течении заживления язвы происходит через 1-2 месяца.
Гемофильная палочка. Лабораторная диагностика. Основана на обнаружении возбудителя в содержимом язвы (результаты исследования следует соотносить с данными анамнеза, так как мягкий шанкр передается только половым путем). Мазки окрашивают по Граму, фуксином Циля или метиленовым синим. К выделению культуры прибегают редко. После 8 дня болезни можно применить аллергическую пробу с внутрикожной инъекцией вакцины Haemophilus ducreyi (положительна в 90-98% случаев). Дифференциальная диагностика проводится с первичным сифилисом, генитальным герпесом и венерической лимфогранулемой. Нередки случаи одновременного заражения мягким шанкром и сифилисом.
Для лечения традиционно используют сульфаниламиды, пенициллин, стрептомицин и тетрациклин.
Возбудитель гемофильной инфекции- Haemophilus influenzae, способен вызывать гнойный менингит, острое воспаление верхних дыхательных путей, бронхит, пневмонию, эмпиему, конъюнктивит, отит и другие оппортунистические заболевания. Уровень носительства гемофильной палочки среди здоровых лиц высокий (до 90 %). Гемофильная инфекция у детей в возрасте до 3 лет протекает исключительно тяжело, особенно в случае возникновения острого эпиглоттита (воспаления надгортанника).
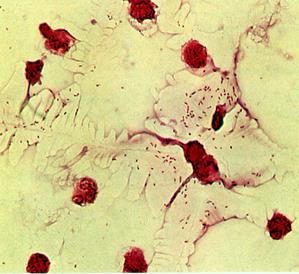
Бактериоскопический методможет быть использован при исследовании спинномозговой жидкости при подозрении на гнойный менингит (рис.18а).


а б
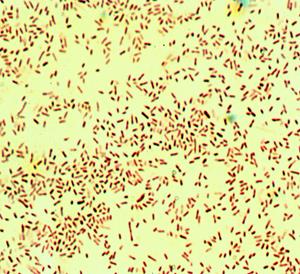
Рис. 18. Гемофильная палочка - Haemophilus influenzae. а –мазок из спинно-мозговой жидкости, б - мазок из чистой культуры.Окраска по Граму. мелкие грамотрицательные палочки. х900
Серозную и спинномозговую жидкости центрифугируют, осадок засевают бактериальной петлей на шоколадный агар (МПА с 5% дефибринированной крови человека, лошади или кролика выдерживают 2-3 минуты при температуре 80 0 С, повторно добавляют 5% крови и вновь выдерживают при той же температуре 2-3 минуты) или среду Филдса (МПА с добавлением пептического перевара крови лошади или барана). Параллельно делают посев на обычный МПА, на котором гемофильная палочка не растет.
Колонии Haemophilus influenzae мелкие, прозрачные или полупрозрачные, вырастают через 18-24 часа; в мазках из этих колоний обнаруживаются мелкие капсулообразующие или капсулонеобразующие грамотрицательные палочки (рис. 17б). Оставшуюся часть колонии пересевают на скошенный шоколадный МПА для выделения чистой культуры. Идентификацию гемофильных бактерий проводят на основании изучения биохимических (каталазная, оксидазная активность, ферментация углеводов, гемолитическая активность, питательные потребности) и антигенных (постановка РА на стекле с групповыми сыворотками а,b,с, d, e, f к капсульному антигену) свойств.
Для идентификации Haemophilus influenzae применяют также тест сателлитных колоний, для чего на поверхность шоколадного МПА наносят исследуемую культуру и в некоторые участки среды - штамм Staphylococcus aureus. Гемофильная палочка вырастает в виде мелких сателлитных колоний, окружающих колонии S. aureus, так как стафилококк, гемолизируя кровь, высвобождает X и Vфакторы – стимуляторы роста Haemophilus influenzae.
Каталазу гемофильной палочки определяют по пенообразованию в капле 10% перекиси водорода на предметном стекле при внесении в нее исследуемой культуры. Оксидазу выявляют путем нанесения на диск фильтровальной бумаги, диаметром 5-7 см , 2-3 капель 1% раствора тетраметилпарафенилендиамина и исследуемой культуры, в результате чего через
10-15 сек. появляется фиолетовое окрашивание. Уреазу определяют общепринятым методом по разложению мочевины с образованием щелочных продуктов в присутствии индикатора фенолового красного; при наличии уреазы среда приобретает ярко-малиновый цвет. Порфириновый тествыявляет способность Н. influenceк синтезу Δ-аминолевуленовой кислоты (АЛК) - потребности в факторе X. При внесении АЛК в среду только АЛК-независимые гемофильные бактерии синтезируют и секретируют порфобилиноген и порфирины (промежуточные соединения биосинтеза гема), тогда как АЛК-зависимые гемофильные палочки, нуждающиеся в факторе X, не способны к образованию указанных продуктов. Исследуемые бактерии засевают на шоколадный МПА, наносят на поверхность среды диски, пропитанные АЛК, и после 24-часовой выращивания в термостате при 37 0 С облучают УФ-лучами. При наличии Х-независимых микроорганизмов наблюдают кирпично-красную флюоресценцию.
Для специфической профилактики гемофильной инфекции в России лицензирована полисахаридная вакцина, конъюгированная со столбнячным анатоксином (вакцина Act-HIB) фирмы Пастер Мерье Коннот, которая не содержит консервантов и антибиотиков.

Возбудитель гемофильной инфекции- Haemophilus influenzae, способен вызывать гнойный менингит, острое воспаление верхних дыхательных путей, бронхит, пневмонию, эмпиему, конъюнктивит, отит и другие оппортунистические заболевания. Уровень носительства гемофильной палочки среди здоровых лиц высокий (до 90 %). Гемофильная инфекция у детей в возрасте до 3 лет протекает исключительно тяжело, особенно в случае возникновения острого эпиглоттита (воспаления надгортанника).
Бактериоскопический методможет быть использован при исследовании спинномозговой жидкости при подозрении на гнойный менингит (рис.18а).
а б
Рис. 18. Гемофильная палочка - Haemophilus influenzae. а –мазок из спинно-мозговой жидкости, б - мазок из чистой культуры.Окраска по Граму. мелкие грамотрицательные палочки. х900
Серозную и спинномозговую жидкости центрифугируют, осадок засевают бактериальной петлей на шоколадный агар (МПА с 5% дефибринированной крови человека, лошади или кролика выдерживают 2-3 минуты при температуре 80 0 С, повторно добавляют 5% крови и вновь выдерживают при той же температуре 2-3 минуты) или среду Филдса (МПА с добавлением пептического перевара крови лошади или барана). Параллельно делают посев на обычный МПА, на котором гемофильная палочка не растет.
Колонии Haemophilus influenzae мелкие, прозрачные или полупрозрачные, вырастают через 18-24 часа; в мазках из этих колоний обнаруживаются мелкие капсулообразующие или капсулонеобразующие грамотрицательные палочки (рис. 17б). Оставшуюся часть колонии пересевают на скошенный шоколадный МПА для выделения чистой культуры. Идентификацию гемофильных бактерий проводят на основании изучения биохимических (каталазная, оксидазная активность, ферментация углеводов, гемолитическая активность, питательные потребности) и антигенных (постановка РА на стекле с групповыми сыворотками а,b,с, d, e, f к капсульному антигену) свойств.
Для идентификации Haemophilus influenzae применяют также тест сателлитных колоний, для чего на поверхность шоколадного МПА наносят исследуемую культуру и в некоторые участки среды - штамм Staphylococcus aureus. Гемофильная палочка вырастает в виде мелких сателлитных колоний, окружающих колонии S. aureus, так как стафилококк, гемолизируя кровь, высвобождает X и Vфакторы – стимуляторы роста Haemophilus influenzae.
Каталазу гемофильной палочки определяют по пенообразованию в капле 10% перекиси водорода на предметном стекле при внесении в нее исследуемой культуры. Оксидазу выявляют путем нанесения на диск фильтровальной бумаги, диаметром 5-7 см , 2-3 капель 1% раствора тетраметилпарафенилендиамина и исследуемой культуры, в результате чего через
10-15 сек. появляется фиолетовое окрашивание. Уреазу определяют общепринятым методом по разложению мочевины с образованием щелочных продуктов в присутствии индикатора фенолового красного; при наличии уреазы среда приобретает ярко-малиновый цвет. Порфириновый тествыявляет способность Н. influenceк синтезу Δ-аминолевуленовой кислоты (АЛК) - потребности в факторе X. При внесении АЛК в среду только АЛК-независимые гемофильные бактерии синтезируют и секретируют порфобилиноген и порфирины (промежуточные соединения биосинтеза гема), тогда как АЛК-зависимые гемофильные палочки, нуждающиеся в факторе X, не способны к образованию указанных продуктов. Исследуемые бактерии засевают на шоколадный МПА, наносят на поверхность среды диски, пропитанные АЛК, и после 24-часовой выращивания в термостате при 37 0 С облучают УФ-лучами. При наличии Х-независимых микроорганизмов наблюдают кирпично-красную флюоресценцию.
Для специфической профилактики гемофильной инфекции в России лицензирована полисахаридная вакцина, конъюгированная со столбнячным анатоксином (вакцина Act-HIB) фирмы Пастер Мерье Коннот, которая не содержит консервантов и антибиотиков.
Не нашли то, что искали? Воспользуйтесь поиском:
Для подтверждения этиологии заболевания и определения чувствительности выделенного возбудителя к антимикробным препаратам обязательно микробиологическое исследование. Оно состоит из следующих основных этапов:
1) получение и транспортировка клинического материала;
2) предварительное исследование: микроскопия клинического материала;
3) выделение чистой культуры при исследовании спинномозговой жидкости, крови и другого клинического материала;
4) идентификация выделенной культуры.
а) Получение и транспортировка клинического материала. В связи с тем, что гемофильная палочка вызывает широкий спектр инфекций, для микробиологического исследования может направляться различный клинический материал. Наибольшую диагностическую ценность представляют исследования стерильных в норме биологических жидкостей: крови, плевральной, перикардиальной, синовиальной, спинно-мозговой жидкостей (СМЖ). Для доказательства этиологической роли Н. influenzae в инфекции НДП необходимо предупреждение контаминации клинического материала микрофлорой ВДП.
б) Предварительное исследование: микроскопия клинического материала. Предварительным этапом, предшествующим непосредственному выделению бактерий, является исследование мазков клинического материала, окрашенных по Граму и/или метиленовым синим. 11ри окраске по Граму бактерии рода Haemophilus представляют собой мелкие, бледно окрашенные сафранином или фуксином грамотрицательные палочки, обладающие полиморфизмом, иногда образующие длинные нити. При окраске метиленовым синим гемофилыгые палочки имеют синий цвет на серо-голубом фоне. Отрицательный результат микроскопии не исключает возможности гемофильной инфекции, гак как в клиническом материале может присутствовать недостаточное количество микробов. Поэтому обязательно культуральное бактериологическое исследование, которое остается золотым стандартом микробиологической диагностики.
При исследовании материалов, содержащих микробные ассоциации (мокрота, материал из среднего уха, пазух носа), следует провести микроскопическое исследование мазка. Критерием пригодности мокроты для посева является наличие более 25 сегментоядерных лейкоцитов и не более 10 эпителиальных клеток в поле зрения при просмотре 20 полей зрения мазка, окрашенного по Граму (при увеличении х100).
- капсульные штаммы образуют слизистые круглые сочные колонии сероватого цвета в диаметре до 2 мм, дающие радужную окраску в проходящем свете (иридиирующие);
- штаммы со слабовыраженной капсулой дают полупрозрачные круглые гладкие неиридиирующие колонии;
- бескапсульные штаммы образуют мелкие непрозрачные неиридиирующие колонии с неровными краями.
Дальнейший анализ проводится в соответствии со схемой, приведенной ниже, в которой этап накопления биомассы и приготовления мазка соответствует второму дню микробиологического исследования.
Третий день. Определение каталазной активности. Определение цитохромоксидазной активности. Посев на чашку для определения потребности в факторах X и V (или с тест-стрипами). Определение β-галактозидазной активности (предварительный учет). Определение чувствительности к ампициллину и другим антибактериальным препаратам на среде НТМ. Выявление β-лактамазы (тест с нитроцефином).
Четвертый день. Учет потребности в факторах X и V. Учет р-галактозидазной активности.
Ответ о наличии Н. influenzae или другого вида Haemophilus выдается при идентификации капсульного типа Н. influenzae с учетом результатов чувствительности к ампициллину и другим антибактериальным препаратам.
При необходимости биотипирования выделенного штамма производятся постановка пробы на индолообразование, определение наличия уреазы, определение наличия орнитиндекарбоксилазы..
Пятый день. Учет результатов биотипирования Н. influenzae.
3. Определение чувствительности к антибиотикам. Потенциальной активностью в отношении Н. influenzae обладают следующие антибиотики: аминопенициллины, ингибиторозащищенные пенициллины, цефалоспорины II—IV поколений, тетрациклины, фторхинолоны и др. В соответствии с международными и национальными рекомендациями, для выявления ампициллинорезистентности у гемофильной палочки в лабораторной практике достаточно определить чувствительность к ампициллину дискодиффузионным методом и провести тест на продукцию β-лактамаз с нитроцефином. Эти два теста позволяют подразделить штаммы Н. influenzae на ампициллиночувствительные, β-лактамазопродуцирующие ампициллинорезистентные (чувствительные к ингибиторозащищенным пенициллинам и цефалоспоринам II—IV поколений) и БЛНАР-штаммы, которые следует расценивать как резистентные к ингибиторозащищенным пенициллинам и некоторым цефалоспоринам.
Чашки с посевами и нанесенными на них дисками с антибиотиками инкубируют в течение 16-18 ч при 35°С в атмосфере с 5-7% CO2. Определяют чувствительность к ампициллину, амоксициллин/клавулонату, хлорамфениколу, тетрациклину, ципрофлоксацину или левофлоксацину, цефогаксиму или цефтриаксону, меропенему, ко-тримоксазолу, азитромицину.
Редактор: Искандер Милевски. Дата публикации: 24.1.2020
Род Haemophilusсем Pasteurellaceaeвключает 16видов, патогенны два: Н.influenzae (возбудитель воспалений дыхательных путей) и Н.ducrey (возбудитель мягкого шанкра). Другие – обитают в полости рта, носоглотке как сапрофиты.
Гр– неподвижные палочки, не образуют спор. Аэробы или факультативные анаэробы. Для размножения требуют в пит средах факторов, присутствующих в крови [гемина и (или) НАД].
ГЕМОФИЛЫ ИНФЛЮЭНЦЫ Н. influenzae
Расщепляют глюкозу, ксилозу, рибозу. По способности образовывать индол, продуцировать уреазу и орнитин-декарбоксилазу различают 6биоваров (I—VI),а по АГ специфичности ПС капсульного вещества –6сероваров (а,b, с, d, e, f).Штаммы серовара bпродуцируют бактериоцины.
Патогенность– капсульный ПС, обладающим антифагоцитарными свойствами, и эндотоксин.
Экология и распространение.Биотоп Н. influenzae– слизистая оболочка ВДП. В окружающей среде быстро погибают (t°С, УФ, высушивания), чувствительны к дезинфектантам.
ИСТОЧНИК – человек. ПЕРЕДАЧА осуществляется воздушно-капельным путем. Но чаще возникают как вторичные инфекции при снижении общей резистентности организма.
Патогенез.Вызывают 2типа заболеваний:
а) острые, гнойно-воспалительные процессы (менингит у детей, пневмонии у взрослых),является ПЕРВИЧНЫМ возбудителем (обычно это капсульные штаммы биовара I);
б) хронические, является возбудителем ВТОРИЧНОЙ или СМЕШАННОЙ инфекции (в ассоциации с пневмококком, стафилококками, аденовирусами). Обычно это некапсульные штаммы биоваров IIи III.
Иммунитет изучен недостаточно.
Лабораторная диагностика.Из материала (мокрота, слизь из носа, гной и др.) выделяют культуру, дифференцируют ее от сходных гемофильных бактерий.
Профилактика и лечение.Специфическая профилактика не разработана. Для лечения применяют АБ + сульфаниламиды.
ГЕМОФИЛЫ МЯГКОГО ШАНКРА Н. ducreyi
Морфология.Гр– неподвижные палочки, не образуют спор. Аэробы или факультативные анаэробы. В мазках из гноя располагаются группами или цепочками.
Экология и распространение.Мягкий шанкр –венерическая болезнь. ИСТОЧНИКОМ является больной человек. В России не регистрируется.
14. Спид–индикаторные инфекции. Микробиологическая диагностика спид–индикаторных заболеваний паразитарной и грибковой природы.
15. Иерсинии. Микробиологическая диагностика псевдотуберкулёза и кишечного иерсиниоза.
Род Yersinia содержит 7 видов, чаще всего вызывают заболевания Y.pestis (чумы) и Y. pseudotuberculosis и Y. enterocolitica.
Y.pestis (чумы) – неподвижна при 25°С, не расщепляет рамнозу, сорбозу, инозит и др, не расщепляет мочевину.
Y. pseudotuberculosis – расщепляет рамнозу до КИСЛОТЫ.
Y. enterocolitica – расщепляет рамнозы до КИСЛОТЫ.
ИЕРСИНИИ ЧУМЫ Y. pestis
В жидких пит средах образуют пленку на поверхности и спускающиеся вниз нити, похожие на сталактиты, и хлопьевидный осадок.
БХ активность – расщепляют ряд углеводов (фруктозу, галактозу и др.) с образованием кислоты. Протеолитическая активность выражена слабо – желатину не разжижают, молоко не свертывают.
АГ.Содержат комплекс АГ, среди которых есть общие с представителями семейства Enterobacteriaceae и эритроцитами людей 0-группы. Антигенная специфичность связана с капсульным веществом. F1 поверхностный белковый термолабильный АГ используется в РНГА как диагностикум в серологических исследованиях при чуме. V- и W-АГ обладают антифагоцитарной активностью. Другие АГ из 10 известных изучены недостаточно.
Экология и распространение.Основные хозяева в природе – грызуны. Чума – зоонозное природно-очаговое заболевание. Очаги различаются носителями возбудителя и биологическими свойствами иерсиний, распространенных в определенной зоне. По БХ свойствам и местом распространения различают 3 биовара: v.antiqua (Центральная Азия и Африка), v.medievalis (Азия) , orientalis (повсеместно).
ПУТИ заражения – трансмиссивный (переносчики – блохи), контактный и алиментарный. Больные легочной формой чумы заражают аэрогенным путем.
В окружающей среде длительно сохранять жизнеспособность, хорошо переносят ↓t°С. Чувствительны к УФ, высушиванию, ↑t°С, дезинфектантам.
Патогенез. Клинические проявления зависят от входных ворот инфекции. Различают кожно-бубонную, первично- и вторично-септическую, первично- и вторично-легочную формы чумы. Недостаточная барьерная функция регионарных лимфоузлов + незавершенный фагоцитоз + усиленное размножениепервично-септической формы чумы. Вторично-септическая форма развивается на фоне бубонной или легочной.
Иммунитетпрочный продолжительный иммунитет. Основная роль принадлежит фагоцитирующим клеткам.
Диагностика.Работа с материалами проводится в спец режимных лабораториях. МАТЕРИАЛ (гной из бубонов, отделяемое язвы, мокрота и др.) бактериоскопируют, подвергают ИФА, засевают на пит среды и проводят биопробу на морских свинках.
Выделенные чистые культуры идентифицируют по морфологическим, культуральным, биохимическим, антигенным свойствам, чувствительности к чумному бактериофагу. Дифференцируют от других видов иерсинии.
В материалах из загнивших трупов возможно выявить чумной АГ реакцией термопреципитации.
Профилактика и лечение.Наблюдение за поголовьем грызунов → дератизация и дезинсекция. Иммунизация живой (штамм EV) или химической чумной вакциной. В России применяется живая сухая вакцина. После однократного подкожного или накожного введения создается относительно стойкий иммунитет на 6 мес. При опасности заражения – профилактика стрептомицином, при лечении – АБ + противочумной Ig.
ИЕРСИНИИ ПСЕВДОТУБЕРКУЛЕЗА Y. pseudotuberculosis
Заболевания – гастроэнтерит, лимфаденит, полиартрит, илеит и др.
Морфология.Коккобактерии, не образуют спор, гр–, имеют жгутики и капсулу. Факультативные анаэробы. Хорошо размножаются на простых пит средах. Способны размножаться приt°=0-30°С
АГ.Н- и О-АГ. По О-АГ различают 10 сероваров. Заболевания вызывают чаще всего серовары I, III и IV.
Экология и распространение.Распространены во многих странах. ИСТОЧНИК – грызуны. ЗАРАЖЕНИЕ – алиментарным путем, при употреблении продуктов, загрязненных фекалиями и мочой животных. Способность размножаться при ↓t° приводит к массивному накоплению их в продуктах, хранящихся в холодильнике.
Патогенез.Попадают в ЖКТ, проникают в слизистую кишечника, в подслизистом слое образуются множественные гранулемы и геморрагии → симптомы гастроэнтерита. Попадание в лимфатические узлы → лимфаденит. В эпигастральной области усиливаются боли, появляются симптомы раздражения брюшины, в илеоцекальном углу определяется инфильтрат. Возможна бактериемия, которая сопровождается сыпью, артралгией и др.
Иммунитетне изучен. АТ появляются, но не обладают протективными свойствами.
Диагностика–бактериологическим и серологическим методами. Возбудителя выделяют из испражнений, мокроты и др материалов, дифференцируют от других иерсиний и сходных бактерий иных родов. ИФА – для выявления возбудителя в материалах и индикации в окружающей среде. В серодиагностике используют РА и РНГА.
Профилактика и лечение.Специфическая профилактика не разработана. Лечение – АБ.
КИШЕЧНЫЙ ИЕРСИНИОЗ Y. Enterocolitica.
Морфология.Гр– подвижные палочки, не образуют спор и капсул. Культивируются на простых пит средах. Различают 5 биоваров, 2 из которых патогенны.
АГ.По О-АГ распределены на 30 сероваров. (у человека чаще всего – серовары 03 и 09).
Патогенность.Факультативные внутрипаразиты. Имеют инвазивные свойства и цитотоксины, вирулентные штаммы устойчивы к фагоцитозу и действию сыворотки. Эти свойства кодируют плазмиды. Маркеры вирулентности –кальцийзависимость и аутоагглютинация.
Экология и распространение.Широко распространены. В открытых водоемах они не только выживают, но и размножаются. Устойчивы к ↓t° (размножаются в условиях холодильника). ИСТОЧНИК – Ж!! и люди (больные и носители). ПУТЬ заражения – алиментарный. Заболевания регистрируются в виде вспышек или спорадических случаев.
Патогенез.Заражение реализуется от бессимптомного носительства и легких форм до тяжелых и генерализованных, септических (чаще у пожилых лиц с хроническими заболеваниями (цирроз печени, диабет)).
В течение болезни накапливаются АТ. Титр их в РА бывает не выше 1:800. Роль в формировании иммунитета неясна.
Диагностика– бактериологическим и серологическим методами. Из материала (испражнения больного, смыв из носоглотки, кровь, моча) выделяют культуру, идентифицируют, определяют серовар. Серодиагностика – РА, РНГА, с помощью иммунофлуоресцентного анализа.
Профилактика и лечение.Специфическая профилактика не разработана. Лечение АБ и сульфаниламидами.
Читайте также:


