Морфологическая характеристика системной красной волчанки
Большая медицинская энциклопедия
Авторы: Л. В. Кактурский, В. А. Насонова, А. И. Струков, А. С. Тиганов, Л. Я. Трофимова.
Системная красная волчанка, будучи представителем группы коллагеновых болезней, характеризуется генерализованным распространением патологического процесса, охватывающего все органы и системы, что обусловливает клинико-анатомический полиморфизм заболевания. Генерализация вызвана циркуляцией в крови иммунных комплексов, повреждающих сосуды микроциркуляторного русла, следствием чего является системная прогрессирующая дезорганизация соединительной ткани.
Иммунопатологические реакции подтверждаются усилением функции органов иммуногенеза, преципитацией в стенках сосудов и в поражённых тканях иммунных комплексов с появлением иммунокомпетентных клеток . Повреждение сосудов микроциркуляции проявляется распространёнными васкулитами деструктивного или пролиферативного характера . В эндотелии капилляров при электронно-микроскопическом исследовании выявляются своеобразные тубулярные образования, похожие на рибонуклеопротеид парамиксовируса и, возможно, играющие этиологическая роль.
Специфику тканевых реакций при системной красной волчанке обусловливают признаки патологии клеточных ядер:
- базофилия фибриноида,
- кариорексис,
- гематоксилиновые тельца,
- LE клетки,
- центральный хроматолиз.
Базофилия фибриноида обусловлена примесью кислых продуктов ядерного распада. Гематоксилиновые тельца, описанные в 1932 году Л. Гроссом, представляют собой набухшие ядра погибших клеток с лизированным хроматином. LE-клетки, или клетки красной волчанки, – это зрелые нейтрофилы, цитоплазма которых почти целиком заполнена фагоцитированным ядром погибшего лейкоцита. Собственное ядро при этом оттеснено к периферии. Их можно встретить в синусах лимфатических узлов, в мазках-отпечатках из воспалительного экссудата, например, из пневмонических фокусов. Центральный хроматолиз проявляется вымыванием хроматина из центра клеточных ядер с просветлением последних.
Наиболее характерные изменения при системной красной волчанке отмечаются в почках, сердце, селезёнке. Поражение почек характеризуется развитием волчаночного гломерулонефрита, при микроскопическом исследовании проявляющегося в двух формах:
- с характерными признаками системной красной волчанки;
- без характерных признаков системной красной волчанки (В. В. Серов , 1974).
К характерным признакам относятся:
В основе развития волчаночного гломерулонефрита лежит повреждение почечных клубочков иммунными комплексами. При иммунофлуоресцентной микроскопии в клубочках обнаруживается свечение иммуноглобулинов, комплемента, фибрина. При электронно-микроскопическом исследовании выявляются эквиваленты иммунных комплексов в виде депозитов. При локализации последних на субэпителиальной поверхности базальной мембраны отмечается повреждение отростков подоцитов, образование шиповидных выростов мембраны, что обозначают как мембранозная трансформация.
В клинике при этом часто отмечается нефротический синдром. Пролиферативная реакция, по мнению В. В. Серова, высказанному в работах 1974 года, связана с размножением мезангиальных клеток. В исходе волчаночного нефрита развивается вторичное сморщивание почек.
Возможно развитие волчаночного пневмонита, протекающего по типу интерстициальной пневмонии с васкулитами и клеточной инфильтрацией интерстициальной ткани. Поражение лёгких может быть связано с присоединением вторичной инфекции.
Волчаночный процесс может поражать печень. При этом в портальных трактах наблюдают лимфоплазмоцитарную инфильтрацию, дистрофию гепатоцитов.
С васкулитами связано поражение нервной системы при системной красной волчанке.
Висцеральные поражения часто сочетаются с поражением опорно-двигательного аппарата и кожи. При высокой активности заболевания в скелетных мышцах определяется картина острого очагового миозита. В суставах может развиваться картина острого синовита с преобладанием экссудативных реакций и обычно без последующих деформирующих процессов.
При микроскопическом исследовании кожи поражённых и внешне непоражённых участков у 70-80% больных обнаруживаются васкулиты, чаще пролиферативные. Иммунофлуоресцентное исследование выявляет свечение иммуноглобулинов на базальной мембране в области дермо-эпидермального стыка.
Осложнения и проявления системной красной волчанки, ведущие к смерти больных:
- почечная недостаточность,
- очагово-сливная пневмония,
- васкулиты,
- анемия,
- сепсис,
- инфаркты головного мозга, сердца.
Эти заболевания имеют яркие морфологические признаки. На морфологическую картину системной красной волчанки накладывает отпечаток кортикостероидная терапия, следствием которой являются угнетение реакции органов иммуногенеза, атрофия надпочечников, остеопороз, ареактивные язвы желудочно-кишечного тракта, признаки синдрома Иценко-Кушинга, иногда – вспышка туберкулёза, сепсиса. Активное лечение вызвало лекарственный патоморфоз заболевания, характеризующийся преобладанием хронических форм болезни над острыми, возрастанием удельного веса пролиферативных процессов, склеротических изменений, снижением частоты кариорексиса, гематоксилиновых телец, эндокардита Либмана-Сакса.
Для прижизненной морфологической диагностики исследуют материал биопсии почек, кожи, скелетных мышц с обязательным применением иммунофлуоресцентных методов.
При системной красной волчанке очевидна роль нарушений гуморального звена иммунитета с развитием органонеспецифических аутоиммунных реакций, что проявляется гиперфункцией В-лимфоцитов и широким спектром циркулирующих аутоантител – к цельным ядрам клеток и отдельным ингредиентам ядра (ДНК, нуклеопротеид), а также лизосомам, митохондриям, кардиолипидам (ложноположительная реакция Вассермана), свёртывающим факторам крови, эритроцитам, тромбоцитам, лейкоцитам, агрегированному γ-глобулину и др. Эти антитела, являясь антителами – свидетелями происшедшего повреждения, способны формировать циркулирующие иммунные комплексы, которые откладываются на базальных мембранах почек, кожи и др., вызывают их повреждение с развитием воспалительной реакции.
Таков иммунокомплексный механизм развития люпус-нефрита, васкулитов и др. Наличие комплекса ДНК – антитело к этой ДНК и комплемента доказано выделением из ткани почки антител к ДНК, а сами иммунные комплексы обнаружены методом иммунофлуоресценции .
Накоплено много фактов, указывающих, что имеет место дисбаланс гуморального и клеточного звеньев иммунитета. Последнее проявляется различными реакциями гиперчувствительности замедленного типа, снижением содержания Т-лимфоцитов.
Наличие в отдельных семьях системной и дискоидной красной волчанки, различных аутоиммунных болезней, фотосенсибилизации и непереносимости лекарственных препаратов, обнаружение широкого диапазона циркулирующих аутоантител у членов этих семей позволяют думать о роли генетического предрасположения в развитии болезни, однако конкретные механизмы этого предрасположения ещё не известны.
Экспериментальные модели системной красной волчанки – болезнь новозеландских мышей (NZB, NZW и их гибридов NZB/NZW F1) и собак особых генетических линий (canine lupus) – подтверждают высказанные выше положения, поскольку эти модели, безусловно, характеризуются генетическим предрасположением, дисбалансом в гуморальном и клеточном звеньях иммунитета и вертикальной передачей онкорнавируса С у новозеландских мышей.
См. также: Аутоаллергические болезни, Коллагеновые болезни.
Большая медицинская энциклопедия 1979 г.
 |
Последнее обновление страницы: 17.11.2014 Обратная связь Карта сайта

Классификация. Современные методы коррекции морщин, применяемые в косметологии.
Морфологические изменения при системной красной волчанки (СКВ) крайне вариабельны. Для диагностики СКВ необходимо учитывать всю совокупность клинических, серологических и морфологических критериев. Распространенность проявлений СКВ приведена в таблице ниже. Наиболее характерные повреждения возникают в результате отложения иммунных комплексов в кровеносных сосудах, почках, соединительной ткани и коже.
а) Острый некротизирующий васкулит, вовлекающий капилляры, небольшие артерии и артериолы, может присутствовать в любой ткани. Артериит характеризуется фибриноидными отложениями в сосудистой стенке. На хронических стадиях стенки сосудов утолщаются и окклюзируются, их просвет сужается.
б) Почки. Волчаночный гломерулонефрит (люпус-нефрит) поражает до 50% больных СКВ. Основной механизм поражения — это отложение иммунных комплексов в клубочках, базальной мембране тубулярных либо перитубулярных капилляров или более крупных кровеносных сосудов. Другой механизм поражения — тромбоз капилляров клубочков, артериол или артерий, часто в ассоциации с антифосфолипидными антителами.
Все из описанных далее поражений клубочков являются результатом отложения иммунных комплексов, регулярно присутствующих в мезангии или вдоль всей базальной мембраны, а иногда во всем клубочке. Иммунные комплексы состоят из ДНК и антител к ДНК, но в их формировании могут участвовать и другие антигены, в частности гистоны.
Поражение вызывают как преформированные иммунные комплексы, так и формирующиеся in situ, однако причина широкого спектра гистопатологических изменений (и клинических проявлений) при волчаночном гломерулонефрите остается невыясненной.
Морфологическая классификация волчаночного гломерулонефрита оказалась клинически полезной. Различают пять форм: минимальную мезангиальную (класс I); мезангиальную пролиферативную (класс II); локальную пролиферативную (класс III); диффузную пролиферативную (класс IV); мембранозную (класс V). Ни одна из этих форм не является специфической для волчанки.
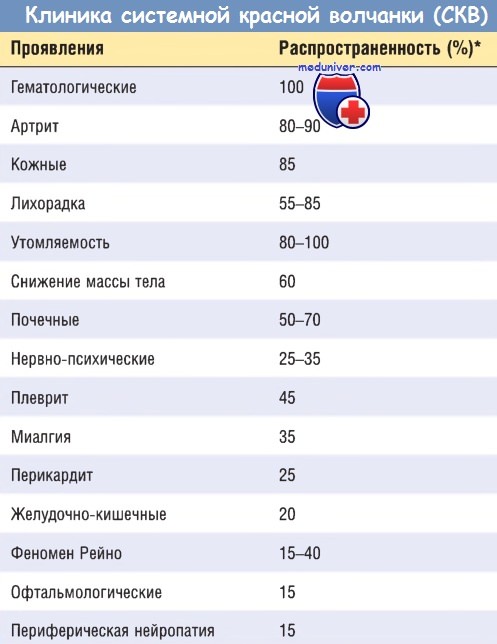
- Мезангиальный волчаночный гломерулонефрит развивается у 10-25% пациентов и характеризуется пролиферацией мезангиальных клеток и отложением иммунных комплексов без вовлечения гломерулярных капилляров. Увеличение мезангиального матрикса или числа мезангиальных клеток либо отсутствует (класс I), либо выражено слабо или умеренно (класс II).
Всегда присутствуют гранулярные мезангиальные отложения Ig и компонентов системы комплемента. Волчаночный нефрит классов III—V обычно развивается уже на фоне определенных мезангиальных изменений.
- Локальный пролиферативный волчаночный гломерулонефрит (класс III) диагностируют у 20-35% пациентов, и его отличительный признак — поражение менее 50% всех клубочков. Повреждения могут быть сегментарными (когда поражена лишь часть клубочка) или тотальными (в процесс вовлечен весь клубочек). В поврежденных клубочках обнаруживаются серповидные образования, фибриноидный некроз, пролиферация эндотелиальных и мезангиальных клеток, инфильтрирующие лейкоциты и эозинофильные отложения или внутрикапиллярные тромбы.
Эти изменения часто коррелируют с гематурией и протеинурией. У некоторых пациентов процесс может перейти в диффузный пролиферативный волчаночный гломерулонефрит. Активные (или пролиферативные) воспалительные поражения могут либо быть полностью излечимы, либо привести к хроническому общему или сегментарному рубцеванию.
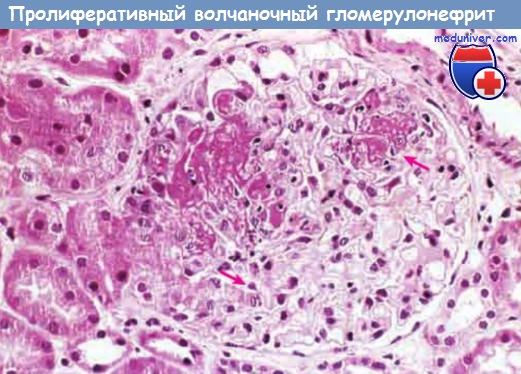
Локальный пролиферативный волчаночный гломерулонефрит.
В клубочке присутствуют два очага некротического поражения (стрелки).
- Диффузный пролиферативный волчаночный гломерулонефрит (класс IV). Это наиболее тяжелая форма волчаночного гломерулонефрита, возникающая у 3560% пациентов. Патологические изменения клубочков могут быть идентичными тем, которые наблюдаются при локальном пролиферативном волчаночном гломерулонефрите (класс III), включая пролиферацию эндотелиальных, мезангиальных и иногда эпителиальных клеток, с образующимися позднее клеточными полулуниями, заполняющими капсулу Боумена. Часто поражен весь клубочек, однако возможны и сегментарные повреждения.
Острые поражения или хронические рубцовые изменения клубочков при локальном или диффузном волчаночном гломерулонефрите часто неотличимы друг от друга; единственное различие состоит в объеме вовлечения клубочков ( 50% для класса IV). У пациентов с диффузным пролиферативным волча-ночным гломерулонефритом обычно появляются симптомы заболевания, обнаруживаются гематурия и про-теинурия. Нередко возникают также гипертензия и почечная недостаточность — от умеренной до тяжелой.
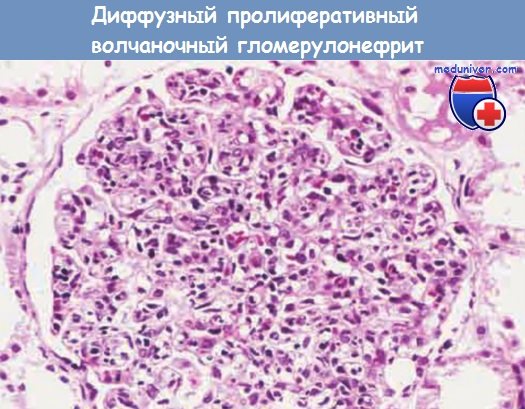
Диффузный пролиферативный волчаночный гломерулонефрит.
Обратите внимание на заметную насыщенность клубочка клетками.
- Мембранозный волчаночный гломерулонефрит (класс V) характеризуется диффузным утолщением стенки капилляров, подобно идиопатическому мембранозному волчаночному гломерулонефриту. Это поражение возникает у 10-15% пациентов с волчаночным гломерулонефритом и обычно сопровождается тяжелой протеинурией или нефротическим синдромом; оно может встречаться одновременно с локальным или диффузным пролиферативным волчаночным гломерулонефритом.
С помощью иммунофлуоресцентного метода определяются гранулярные отложения иммунных комплексов. Электронная микроскопия показывает присутствие электронно-плотных отложений, которые представляют собой иммунные комплексы мезангиальной, внутримембранной, субэпителиальной или субэндотелиальной локализации. Количество мезангиальных отложений варьирует во всех классах. При мембранозном волчаночном гломерулонефрите отложения преимущественно субэпителиальные (между базальной мембраной и висцеральными эпителиальными клетками).
У пациентов с волчаночным гломерулонефритом часто наблюдаются изменения интерстиция и канальцев. В редких случаях тубулоинтерстициальные поражения могут быть доминирующим признаком. У многих пациентов с волчаночным гломерулонефритом в базальной мембране тубулярных и перитубулярных капилляров присутствуют дискретные иммунные комплексы, подобные таковым в клубочках.
б) Кожа. У 50% пациентов наблюдаются характерные эритематозные высыпания на лице в виде бабочки в области скуловых дуг, спинки носа и щек. Подобная сыпь также может появиться на конечностях и туловище. Встречаются уртикария, буллы, макулопапулезные поражения и изъязвления. Солнечный свет инициирует или ускоряет развитие эритемы. При гистологическом исследовании в области поражений обнаруживается сосудистая дегенерация базального слоя эпидермиса. В дерме наблюдаются отек различной степени и периваскулярное воспаление, возможен выраженный васкулит с фибриноидным некрозом.
При иммунофлуоресцентной микроскопии видны отложения Ig и компонентов системы комплемента вдоль дермально-эпидермального соединения, которые могут быть и в неповрежденной коже. Эти находки не являются диагностически значимыми для СКВ, поскольку иногда встречаются при системном склерозе и дерматомиозите.
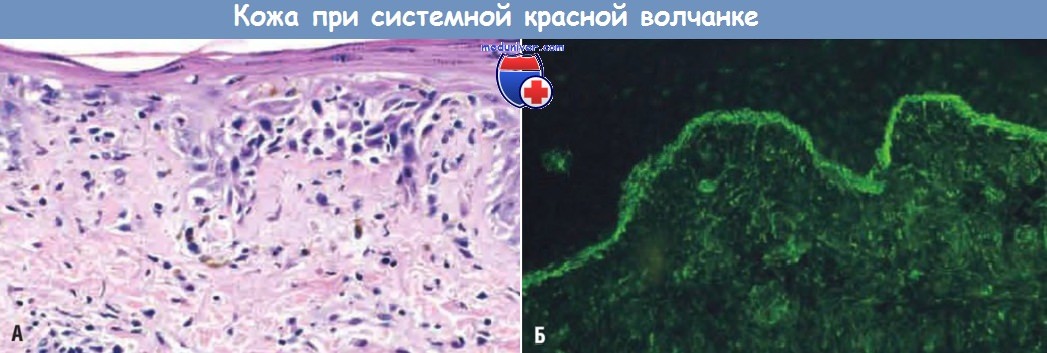
Системная красная волчанка, поражение кожи.
(А) На срезе, окрашенном гематоксилином и эозином, видны влажная дегенерация базального слоя эпидермиса и отек в области дермально-эпидермального соединения.
(Б) Иммунофлуоресцентная микрофотография (окрашивание на IgG), выявившая отложения Ig вдоль дермально-эпидермального соединения.
в) Суставы. Поражение суставов обычно ограничивается неэрозивным синовитом с небольшими деформациями в отличие от ревматоидного артрита.
г) Центральная нервная система. Патологическая основа симптомов со стороны ЦНС не выяснена окончательно, но определенную роль играют антитела к белкам синаптической мембраны. Нервно-психические симптомы СКВ часто приписывают острому васкулиту, однако при гистологическом исследовании выраженный васкулит обнаруживают редко. Вместо этого иногда наблюдается невоспалительная окклюзия мелких сосудов вследствие пролиферации интимы, что может быть связано с повреждением эндотелия антифосфолипидными антителами.
д) Перикардит и поражение других серозных оболочек. Воспаление серозных оболочек может быть острым, подострым и хроническим. Во время острой фазы мезотелиальные поверхности иногда покрываются фибринозным экссудатом. Позднее они утолщаются, мутнеют и покрываются грубой фиброзной тканью, которая может вызвать частичную или полную облитерацию серозной полости.
е) Сердечно-сосудистая система. Вовлечение сердечнососудистой системы при СКВ может проявляться поражениями любого слоя сердца. Симптоматическое или бессимптомное поражение перикарда наблюдается у 50% пациентов. Реже встречаются миокардит или инфильтрация мононуклеарными клетками; при этом развивается тахикардия в состоянии покоя и наблюдаются изменения на электрокардиограмме. Поражения клапанов, в первую очередь митрального и аортального, проявляются диффузным утолщением створок, которое может быть ассоциировано с нарушением функции, например стенозом и/или регургитацией.
Поражение эндокарда клапанов (так называемый эндокардит Либмана-Сакса) раньше, до широкого применения стероидов, наблюдалось часто. Этот небактериальный эндокардит проявляется формированием одиночных или множественных вегетаций (бородавчатых депозитов) на любом клапане сердца, на той или другой его стороне отдельно. При инфекционном эндокардите вегетации значительно крупнее, а при ревматическом заболевании сердца — мельче, а по локализации ограничены линией смыкания створок клапанов.
Все больше пациентов имеют клинические признаки заболевания коронарных сосудов (стенокардии, инфаркта миокарда) вследствие коронарного атеросклероза. Это осложнение чаще наблюдают у молодых пациентов с длительным заболеванием, особенно после терапии кортикостероидами. Патогенез ускоренного коронарного атеросклероза неясен, вероятно, заболевание относится к многофакторным. Традиционные факторы риска, включая гипертензию, ожирение и гиперлипидемию, чаще встречаются у пациентов с СКВ по сравнению с контрольной популяцией. Кроме того, повредить эндотелий и ускорить развитие атеросклероза способны иммунные комплексы и антифосфолипидные антитела.

Поражение митрального клапана (эндокардит Либмана-Сакса) при красной волчанке.
Вегетации, расположенные по краям утолщенной створки клапана, показаны стрелками.
з) Легкие. Плеврит и плевральный выпот — наиболее частые проявления поражения легких (50%). Реже встречаются альвеолярный отек и геморрагии. В некоторых случаях наблюдаются хронический и интерстициальный фиброз и вторичная легочная гипертензия.
Ни один из этих признаков не является патогномоничным для СКВ.
и) Другие органы и ткани. Присутствие KB-клеток, или гематоксилиновых телец, в костном мозге или других органах весьма показательно для СКВ. Лимфатические узлы могут быть увеличены, их фолликулы гиперпла-зированы, и возможен даже некротизирующий лимфаденит.
[youtube.player]Эпидемиологические исследования последних лет показали, что СКВ встречается чаще, чем предполагалось ранее, заболевает в разных регионах ежегодно 1 человек из 400—2000. По данным J. Klippel и J. Decker (1987), выявляют 50—70 вновь заболевших в год на 1 млн населения, а распространенность составляет примерно 500 больных на 1 млн населения. Возможно, обнаруживаемая большая частота СКВ отчасти объясняется улучшением диагностики заболевания, внедрением в практику более совершенных иммунологических методов исследования.
Соотношение мужчин и женщин, заболевших СКВ, составляет, по данным разных исследовании, от 1:8 до 1:10, однако среди детей соотношение мальчиков и девочек составляет 1:3. В период между 13 и 30 годами почти 90% заболевших женского пола. Американские авторы отмечают увеличение частоты СКВ среди лиц черной расы, пуэрториканцев, китайцев.
Этиология, патогенез, классификация
Этиология cистемной красной волчанки остается неясной, так как конкретный этиологический фактор, вызывающий болезнь, не установлен. Имеется ряд косвенных подтверждений пусковой роли РНК-содержащих и так называемых медленных вирусов (ретровирусов) в развитии патологического процесса. Установлено, например, что ведущая роль в развитии СКВ у мышей и собак принадлежит вирусам.
Косвенным доказательством роли хронической вирусной инфекции при СКВ является образование множества антител к ДНК и РНК-содержащим вирусам, присутствие парамиксовирусных цитоплазматических включений, обнаруженных с помощью электронной микроскопии, так называемых тубулоретикулярных структур в сосудах эндотелия и внутри лимфоцитов, выявление включений типа С-онкорнавируса в биоптате почек и кожи.
Дополнительным доказательством возможного вирусного воздействия служит наличие лимфоцитотоксических антител у некоторых родственников, членов семьи больных cистемной красной волчанкой, обслуживающего медицинского персонала. Однако попытки выделить вирус из тканей, включая плаценту рожениц, больных СКВ, не увенчались успехом, несмотря на применение методов гибридизации, кокультивации и др. В последние годы вновь поставлен вопрос о роли вируса при СКВ в связи с обнаружением сходства иммунных нарушений при cистемной красной волчанке и СПИД.
Объединяют обе болезни такие признаки, как лимфоцитопения, снижение количества Т-хелперов и цитотоксичности, нарушение функции моноцитов и активация В-лимфоцитарного синтеза, повышение уровня циркулирующих иммунных комплексов, b2-микроглобулина, кислотолабильного интерферона, антител к фосфолипидам и др. Вместе с тем в возникновении СКВ имеют значение генетические, эндокринные факторы, а также факторы окружающей среды.
Влияние генетического фактора на развитие СКВ подтверждается эпидемиологическими исследованиями. Показано не только увеличение частоты cистемной красной волчанки в семьях больных с этим заболеванием, но и повышение частоты других болезней соединительной ткани, а также различных иммунных нарушений у родственников. Более того, такие изменения, как гипергаммаглобулинемия, выявление антинуклеарных и лимфоцитотоксических антител, ложноположительные тесты на сифилис встречаются обычно у клинически асимптомных лиц первой степени родства.
Значение генетического фактора проявляется в большей частоте развития СКВ у монозиготных близнецов (69%) по сравнению с дизиготными (3%). В генетических исследованиях особенно существенны два момента: 1) повышенный риск развития СКВ у имеющих ложноположительную реакцию Вассермана; 2) частое развитие cистемной красной волчанки при наследственном дефиците комплемента, особенно его компонентов С1, С2, С4. Что касается исследования HLA-антигенов, то к настоящему времени достоверно показано, что при СКВ чаще, чем в популяции, встречаются HLA-B8, DR2, DR3, а также селективные В-клеточные аллоантигены.
Наличие DR3, как правило, ассоциируется с анти-Ro (SSA) антителами, а DR2 — с дефицитом компонентов комплемента С2 и С4. Достоверное возрастание частоты DR2 и DR3 при СКВ позволяет предполагать, что по крайней мере один из генов, обусловливающий риск возникновения cистемной красной волчанки, фиксирован на 6-й хромосоме, где располагается главный комплекс гистосовместимости. Важно отметить, что связь HLA-антигенов и риска возникновения СКВ варьирует в зависимости от групп больных СКВ, проживающих в различных регионах.
Так, в двух континентальных Европейских клиниках положительная связь cистемной красной волчанки обнаружена с DR3 и не выявлена с DR2, тогда как в Великобритании выше частота DR2, а не DR3. Такие различия, возможно, объясняются значительным изменением популяционных связей, характеризующих разные кавказские этнические подгруппы. Например, доминирующий кавказский гаплотип HLAA3B7DR2 изначально является нордическо-северорусским, тогда как индивидуумы с HLAA1B8DR3 исходно являются североиндоевропейскими.
Среди японцев, например, четкой связи люпусриска с какой-либо из laDR аллелей не выявлено. Таким образом, согласно последним исследованиям, риск заболевания СКВ обусловливается по крайней мере четырьмя независимыми сегрегирующими генами, часть из которых непосредственно связана с определенными иммунными функциями. Генетическая гетерогенность, возможно, обусловливает и клинический полиморфизм СКВ.
Значение гормонального фактора в развитии cистемной красной волчанки привлекает внимание уже с самого начала изучения этого заболевания хотя бы потому, что женщины заболевают значительно чаще, чем мужчины. Известно отрицательное влияние эстрогенов на течение СКВ, что проявляется значительным ухудшением состояния больных в период беременности и непосредственно после родов. У женщин с СКВ повышена эстрогенная активность, а у мужчин обнаружено снижение содержания тестостерона и относительное повышение уровня эстрадиола.
Возрастание частоты развития cистемной красной волчанки у больных с синдромом Клайнфелтера (наследственный гипогонадизм) подтверждает положение о протективной роли андрогенов в отношении СКВ. Изучение спонтанной волчанки у новозеландских мышей показало более раннее начало и тяжелое течение нефрита у мужских особей. Развитие нефрита у них ассоциировалось с переключением синтеза IgM-антител к ДНК на синтез нефритогенных IgG-антиДНК-антител.
Причем синтез IgG-антител у женских особей задерживался введением андрогенов, а мужских — усиливался при их кастрации. A. Steinberg и соавт. (1978) наблюдали значительное улучшение течения нефрита у мышей при лечении антагонистами эстрогена. Показано, что эстрогены подавляют ответ лимфоцитов на фитогемагглютинин и конконавалин Ainvitro.
Эстрадиол усиливает В-клеточную дифференциацию при митогенной стимуляции лимфоцитов, тогда как тестостерон не обладает таким свойством. Известно, что эстрогены подавляют функциональную активность Т-супрессоров у человека и мышей, а также редуцируют естественную киллерную активность лимфоцитов. О связи половых гормонов с иммунокомпетентными органами свидетельствует факт атрофии вилочковой железы у животных при применении гонадотропных гормонов и индуцирование ее гиперплазии при орхиэктомии.
Из факторов окружающей среды, способствующих возникновению СКВ, следует особо отметить: ультрафиолетовое облучение, воздействие бактериальной и уже упомянутой вирусной инфекции, различных лекарственных препаратов. Полагают, что эти факторы оказывают влияние через различные звенья иммунной системы. Например, в эксперименте показано значительное изменение антигенности ДНК под воздействием ультрафиолетового облучения, когда начинают возникать антитела к ДНК. Подобное действие оказывают и бактериальные липополисахариды (потенциальные поликлональные активаторы В-клеток), вызывая образование циркулирующих иммунных комплексов и антител к одно и двуспиральной ДНК.
Таким образом, несмотря на активное изучение cистемной красной волчанки в течение последних десятилетий, не выявлено определенного агента, вызывающего это заболевание, и основной концепцией остается полиэтиологическая, когда любой из факторов начинает действовать под влиянием неблагоприятных условий.
Многочисленными исследованиями установлено, что СКВ — это в основном иммунокомплексное заболевание, для которого характерна неконтролируемая продукция антител, образующих иммунные комплексы, обусловливающие различные признаки болезни, особенно поражение почек и ЦНС. Что касается развития патологических процессов, то пересмотр патогенеза СКВ в последние годы показал немногочисленность постоянных дефектов иммунного ответа и отсутствие их универсальности.
Совершенно очевидно, что в основе патологического процесса лежит дисфункция как Т-, так и В-лимфоцитов, нарушение процессов их взаимодействия. Многочисленными исследованиями подтверждено значительное снижение абсолютного числа Т-лимфоцитов при cистемной красной волчанке, что очевидно по реакциям на различные митогены, а также кожным пробам. Роль различных аутоантител в этом дефекте требует дальнейшего уточнения, однако полагают, что лимфоцитотоксические антитела могут принимать участие в истощении определенных подгрупп лимфоцитов, например селективно удалять субпопуляцию Т-супрессоров.
При более глубоком изучении функции лимфоцитов выявлено снижение естественной киллерной активности (ЕКА) лимфоцитов при СКВ в среднем в 2 раза по сравнению со здоровыми лицами. Изменение количества и функции Т и В-клеток взаимосвязано. J. Kallenberg и соавт. (1982) показали, что обострению СКВ всегда сопутствует большое количество активированных поликлональных В-лимфоцитов. Циркуляция множества антител и аутоантител обусловлена, как полагают в последнее время, именно гиперактивностью В-клеток, продуцирующих эти антитела.
Установлено, что у больных cистемной красной волчанкой в крови и костном мозге возрастает число клеток, секретирующих различные иммуноглобулины, причем при активной СКВ в 10 раз больше клеток, спонтанно секретирующих IgG и IgA, чем у здоровых лиц и больных в неактивную фазу болезни. Исследования Института ревматологии АМН СССР подтвердили корреляцию выраженности нарушений в числе и функции Т и В-клеток с клинически высокой активностью болезни и серологическими изменениями.
Так, при наличии нефрита и других тяжелых висцеритов выявлены более глубокая Т-лимфопения, уменьшение числа В-лимфоцитов с рецептором СЗЬ и увеличение с рецептором C3d, что совпадало с повышением уровня иммунобластов и повышенной бласттрансформацией в ответ на стимуляцию ДНК. При этом в сыворотке крови отмечены высокие титры антинуклеарного фактора и антител к ДНК, криопротеины, гипокомплементемия,
Таким образом, неконтролируемая продукция антител происходит как из-за спонтанной гиперреактивности В-клеток, так и вследствие гиперфункции Т-хелперов на фоне дисфункции Т-супрессоров.
Среди множества антител при СКВ основная роль принадлежит антителам к ДНК, образующим с антигенами циркулирующие иммунные комплексы, которые повреждают органы и ткани. Именно ДНК-содержащие иммунные комплексы выявляют в элюатах из гломерул при активном люпус-нефрите. Более того, показано, что только особые, высокоавидные антитела играют роль в образовании нефритогенных иммунных комплексов. Реже при cистемной красной волчанке обнаруживают иммунные комплексы, содержащие антитела к РНК, Roантигену, однако патогенность этих иммунных комплексов недоказана.
Иногда иммунные комплексы содержат РФ, сконцентрированный в криопротеинах, антирибосомальные и/или антилимфоцитарные антитела. В эксперименте у мышей со спонтанным люпус-нефритом выделены особые иммунные комплексы, содержащие гликопротеин (ГП)70 и антитела к нему. Сывороточный ГП70 подобен по структуре протеину оболочки ретровируса, синтезируется клетками печени и является острофазовым реактантом.
Циркулирующие иммунные комплексы откладываются в субэндотелиальном слое базальной мембраны сосудов многих органов. Место фиксации депозитов (кожа, почки, хориоидальное сплетение, серозные оболочки) определяется такими параметрами антигена или антитела, как размер, заряд, молекулярная конфигурация, класс иммуноглобулинов, комплементфиксирующие свойства. Так, исследованиями последних лет показано, что только определенные антитела к ДНК способны вызвать нефрит, связываясь с негативно заряженной базальной мембраной гломерул. Более того, число нефритогенных антител настолько ограничено, что позволяет выделить антитела — идиотипы.
Отложившиеся в тканях иммунные комплексы вызывают воспалительную реакцию, активируя комплемент, миграцию нейтрофилов, высвобождая кинины, простагландины и. другие повреждающие вещества. Причина, объясняющая, почему образующиеся в норме иммунные комплексы становятся при СКВ повреждающими, не совсем ясна. Вероятно, имеет значение несколько факторов: избыток поступающего антигена и образование клона агрессивных антител на фоне дефекта кооперации Т- и В-клеток, появления слишком большого количества циркулирующих иммунных комплексов, от которых ретикулоэндотелиальная система не успевает очистить организм, а также генетическая предрасположенность.
Многие положения о патогенезе СКВ в целом разъясняются и подтверждаются при исследовании спонтанной модели нефрита у инбредных линий мышей. Мышиная модель нефрита позволяет детальнее изучить различные стороны патогенеза cистемной красной волчанки, в том числе те, которые невозможно изучить у человека. В частности, в эксперименте изучаются не только периферические лимфоциты, но и лимфоциты из основного лимфоидного органа. Кроме того, у животных можно провести гистоморфологические исследования на любом этапе болезни, а быстрая генерация мышей позволяет обеспечить большое число инбредных животных, необходимое для генетических и иммунологических исследований.
Близость механизма развития СКВ у аутоиммунных животных и у людей ассоциируется некоторыми общими этиологическими факторами.
Таким образом, схематическипатогенез СКВ можно представить как воздействие генетических, гормональных и иммунорегуляторных факторов окружающей среды на продукцию антител В-лимфоцитами. Некоторые антитела могут оказывать прямое повреждающее действие на ткани, тогда как другие действуют через иммунорегуляцию Т-клеток, образование иммунных комплексов и активацию комплемента с образованием продуктов его распада, повреждающих ткани.
Классификация cистемной красной волчанки, используемая в нашей стране, разработана В. А. Насоновой (1967, 1989). Она основана на определении варианта течения болезни в зависимости от характера ее начала (острое, подострое или хроническое) и степени активности болезни в соответствии с выраженностью клинических симптомов и уровня лабораторных показателей (I — минимальная, II — умеренная, III — высокая).
При остром течении болезни, помимо высокой температуры тела, уже в ближайшие месяцы развивается полисиндромная картина с вовлечением в процесс жизненно важных органов и систем. Подострое течение характеризуется волнообразностью симптомов (лихорадки, артрита, полисерозита, поражения кожи), которые на протяжении 1—1,5 лет проходят самостоятельно без лечения, однако в последующем поражаются, как правило, почки и/или ЦНС.
При хроническом течении на протяжении многих лет заболевание протекает моноолигосимптомно, среди симптомов могут быть артрит, нарушение свертывающей системы крови, нерезко выраженная протеинурия, судорожные подергивания, эпилептиформные припадки.
Сигидин Я.А., Гусева Н.Г., Иванова М.М.
Читайте также:


