Основными предрасполагающими факторами развития инфекционного эндокардита являются
Инфекционный эндокардит— микробное поражение внутрисердечного эндотелия,
приводящее к структурным изменениям эндокарда (прежде всего клапанного), крупных сосудов (аорта,
артериовенозные шунты, открытый артериальный проток) и инородных внутрисердечных образований
(искусственные клапаны сердца). Результатом подобных изменений становится нарушение
внутрисердечной гемодинамики с появлением соответствующей клинической симптоматики.
Заболевание регистрируется во всех странах мира и в различных климатогеографических зонах.
Заболеваемость, по данным разных авторов, составляет от 1.7 до 11,6 случаев на 100000 населения в год.
Среди госпитализированных пациентов на долю инфекционного эндокардита приходится 0,17-0,26%.
Мужчины заболевают в 1,5-3 раза чаще женщины, а в возрастной популяции старше 60 лет это
соотношение достигает 8:1. Средний возраст заболевших составляет 43-50 лет. В последнее время
отмечается четкая тенденция к нарастанию частоты заболевания у лиц пожилого и старческого возраста.
другой стороны, в этой группе пациентов значительно чаще отмечаются факторы, предрасполагающие к
развитию данного заболевания.
Как и при любом другом инфекционном заболевании, этиологическим факторомэндокардита
являются разнообразные микроорганизмы. До начала массового применения антибиотиков чаще всего
инфекционный эндокардит вызывался зеленящим стрептококком (Streptococcus viridans), на долю которых
приходилось до 90% случаев заболевания. Но во второй половине XX века в этиологии эндокардита
произошли существенные изменения, выразившиеся в расширении спектра микроорганизмов, могущих
быть его причиной. Это связано с широким внедрением в клиническую практику антибиотиков,
нарастанием числа инвазивных диагностических и лечебных манипуляций, интенсивным развитием
кардиохирургии. С другой стороны, распространение инъекционной наркомании способствовало росту
числа больных с эндокардитом.
В связи с тем, что инфекционный эндокардит может вызываться практически любым видом
бактерий, в настоящее выделяют три формы заболевания, отличающиеся по своей этиологии.
Инфекционный эндокардит естественных клапанов. Возбудителем его в 55% случаев
являются стрептококки. Как и ранее около 70% этой формы вызывается зеленящим стрептококком
(Streptococcus viridans), 20% - бычьим стрептококком (Streptococcus bovis) и около 5% другими видами
стрептококка. В 30% случаев инфекционный эндокардит вызывается стафилококками. В основном это
золотистый стафилококк (Staphylococcus aureus), который приводит к эндокардиту в 5-10 раз чаще, чем
коагулазонегативный Staphylococcus epidermidis. Примерно в 6% случаев встречаются энтерококки
(Enterococcus faecium, Enterococcus faecalis). У ряда больных причиной поражения клапанов являются
бактерии группы НАСЕК (#aemophilus spp., ^ctinobacillus spp., Cardiobacterim spp., fikeneila spp, Alngella
spp.). Из других микроорганизмов следует выделить пневмококки, грибы, спирохеты, риккетсии.
Инфекционный эндокардит протезированных клапанов. Возбудителями заболевания в 30-
50% случаев являются стафилококки, причем чаще Staphylococcus epidermidis, чем Staphylococcus aureus. У
15% больных обнаруживаются грамотрицательные бактерии, у 10% - грибы (в основном рода Candida).
При поздних эндокардитах, возникающих через два месяца после операции, могут высеваться
Инфекционный эндокардит у инъекционных наркоманов. Егопричиной служат
Staphylococcus aureus (более 50%), стрептококки и энтерококки (около 20%), грибы (6%). В ряде случаев
развивается псевдомонадный эндокардит (Pseudomonas aeruginosa). Довольно часто обнаруживается
Из вышеотмеченного видно, что в большинстве случаев, микроорганизмы, служащие причиной
развития инфекционного эндокардита, относятся к условнопатогенным. Поэтому одного лишь
инфицирования и бактериемии для поражения клапанов сердца недостаточно. Необходимо наличие
предрасполагающих условий, способствующих формированию инфекционного эндокардита. Их можно
разделить на две основные группы.
Во-первых, это различные состояния, сопровождающиеся изменениями внутрисердечной
Во-вторых, факторы, предрасполагающие к развитию бактериемии, не связанные с
поражением сердца и сосудов.
В соответствии с характером гемодинамических нарушений можно выделить три группы риска
развития инфекционного эндокардита.
Пациенты с высоким риском:
- протезированные клапаны сердца (самый высокий риск!).
- инфекционный эндокардит в анамнезе;
- синие комбинированные врожденные пороки сердца (единственный желудочек сердца,
декстрапозиция магистральных артерий, тетрада Фалло);
- открытый артериальный проток;
- двустворчатый аортальный клапан со стенозом или с недостаточностью;
- ревматические аортальные пороки;
- митральная недостаточность, в том числе в сочетании со стенозом;
- дефекты межжелудочковой перегородки;
- остаточные явления после операции на сердце (клапанные стенозы и недостаточность,
внутрисердечный сброс крови);
- искусственные аортолегочные шунты (кондуиты). Пациенты с умеренным риском:
- пролапс митрального клапана с митральной регургитацией или утолщением створок;
- митральный стеноз без недостаточности;
- пороки трехстворчатого клапана;
- стеноз клапана легочной артерии;
- двустворчатый аортальный клапан без гемодинамических нарушений;
- обызвествление аортального клапана, митрального кольца;
- первые полгода после операции на сердце по поводу порока без остаточных явлений.
Пациенты с таким риском:
- пролапс митрального клапана без митральной регургитации и утолщения створок;
- незначительная клапанная регургитация в отсутствие органического заболевания сердца;
- изолированный дефект межпредсердной перегородки типа ostium secundum;
- атеросклероз аорты, коронарных артерий;
- состояние спустя полгода и более после операции на сердце по поводу порока без
- имплантированные электрокардиостимуляторы и дефибрилляторы;
- состояние после аортокоронарного шунтирования;
- перенесенная болезнь Кавасаки или ревматизм без поражения клапанов.
К группе повышенного риска развития бактериемии относят, прежде всего, инъекционных
наркоманов. При этом инфицирование самого раствора наркотика редко бывает причиной заболевания,
чаще возбудитель проникает с кожи при ее проколе.
Другая категория - лица пожилого и старческого возраста. У них чаще встречаются
инфицированные кожные язвы, необходимость медицинских манипуляций на мочевыводящих путях и
толстом кишечнике, длительно стоящие катетеры ценгральных вен. Примерно в 1/3 случаев инфекционный
эндокардиту пожилых имеет нозокомиальный (госпитальный) генез.
Отдельно следует выделить группы больных получающих программный гемодиализ, а также
страдающих сахарным диабетом.
Патогенез инфекционного эндокардита представляет собой последовательную цепь событий,
начиная с формирования асептического пристеночного тромба в месте повреждения эндокарда и кончая
воспалительной бактериальной деструкцией клапана в результате присоединения инфекции и
формированием порока сердца.
Предпосылкой заболевания служит повреждение эндокарда турбулентным током крови у лиц,
имеющих факторы риска. В результате адгезии тромбоцитов и последующего отложения фибрина
образуются стерильные вегетации, представляющие по своей сути пристеночные тромбы. Излюбленным
местом их появления являются области высокого давления в левых отделах сердца, а также
физиологические сужения в местах нахождения клапанов сердца. При наличии аномалий, таких как
дефекты межжелудочковой перегородки, двустворчатый аортальный клапан, риск повреждения эндокарда
увеличивается. Экспериментальные исследования показали, что повреждение эндокарда является
непременным условием развития инфекционного эндокардита, так как на интактном эндокарде агрегации
тромбоцитов не происходит.
Вторым непременным условием возникновения заболевания следует считать наличие в крови
бактерий, способных заселять эндокард. При наличии в бактериальной оболочке поверхностных
полисахаридов и белков из класса адгезинов облегчается связывание бактерий с образовавшимися на
поврежденном эндокарде стерильными тромбами.
В итоге развивается классический воспалительный процесс, приводящий к деструкции
клапанов с формированием порока сердца.
Ранним морфологическимпроявлением инфекционного эндокардита является появление
характерных вегетации, содержащих тромбоциты, фибрин, клетки воспаления и эритроциты. Впоследствии
возможно наступление деструкция эндокарда, изъязвления и абсцедирования.
В соответствие с МКБ-10 инфекционный эндокардит относится к рубрике 133. Из этой
классификацииисключается эндокардит ревматической природы.
133 — Острый и подострый эндокардит.
133.0 — Острый и подострый инфекционный эндокардит.
133.9 — Острый эндокардит неуточненный.
В соответствии со старыми классификациями выделяли острый, подострый и хронический
инфекционный (бактериальный) эндокардит.
Современные классификации предусматривают бактериологическую: клиническую,
активностную и морфологическую характеристику.
При положительных результатах бактериологических, иммунологических, морфологических
методов в диагнозе обязательно должна отмечаться этиологическая характеристика заболевания. Если же с
помощью всех доступных методов определить вид возбудителя не удается, то в диагнозе следует
Эндокардит считается активным при наличии положительных результатах посева,
сопровождающихся лихорадкой, а также признаками активности, подтвержденными морфологически во
время операции. В остальных случаях эндокардит считается неактивным.
Если эрадикация не была проведена в полном объеме, возможно развитие возвратного
инфекционного эндокардита с появлением характерных признаков активности.
Клиническая симптоматикаразвивается в течение первых двух недель после эпизода,
вызвавшего бактериемию. Заболевание начинается с недомогания и лихорадки. Последняя может быть
незначительной, однако при высоковирулентных возбудителях заболевание начинается остро с подъема
температуры до 39°С и выше. Характерны артралгии, боли в мышцах и пояснице.
отмечаются петехиальные высыпания на коже, конъюктивах, слизистой полости рта. Отмечаются пятна
Рота - овальные кровоизлияния в сетчатку с белой точкой в центре и пятна Джейнуэя - мелкие
геморрагические пятна на ладонях и стопах, слегка напоминающие узелки. При длительном течении
Аускультативно отмечается шум в сердце, свидетельствующий о формировании порока сердца.
При пальпации и перкуссии живота можно выявить увеличение селезенки.
Тяжелое течение заболевания характеризуется тромбоэмболиче-скими осложнениями,
формированием септических аневризм.
Дополнительные методыпредусматривают, прежде всего, проведение бактериологического
исследования крови, которое дает положительные результаты в 95% случаев. Посевы проводятся двукратно
через 12 часов. В тех случаях, когда антибиотикотерапия не может быть отсрочена, заборы крови
осуществляют с интервалом 30-60 минут из разных вен в течение 3-6 часов, предшествующих началу
лечения. Результаты считаются положительными при наличии бактерий в двух посевах, взятых с 12-
часовым интервалом, или в большинстве посевов, взятых трех- или четырехкратно.
Из других лабораторных данных характерно ускорение СОЭ, нормо - или гипохромная анемия.
Лейкоцитоз и изменения в лейкоцитарной формуле в основном определяются при остром эндокардите. В
анализе мочи выявляются протеинурия и микрогематурия.
Из инструментальных методов ведущим диагностическим исследованием является
эхокардиография. Следует определить характер и размеры вегетации, их локализацию, наличие и
выраженность регургитации. На ранних стадиях информативность трансторакальной ЭхоКГ может быть
низкой. (45% положительных результатов). В то же время применение чреспищеводного датчика позволяет
повысить чувствительность метода до 90-93%.
Суммируя все вышесказанное можно определить следующие диагностические критерии
инфекционного эндокардита, предложенные Durack D. et al (1994):
- положительные результаты гемокультуры с выделением типичных возбудителей;
- эхокардиографические признаки ИЭ (вегетации, абсцессы, вновь появившаяся
околоклапанная или клапанная регурги-тация).
- предрасполагающие к ИЭ поражения сердца или инъекционная наркомания;
- повышение температуры > 38°с;
- сосудистые изменения (эмболии крупных артерий, инфаркты легких, внутричерепные
кровоизлияния, субконъюктиваль-ные кровоизлияния, пятна Джсйнуэя);
- иммунологические изменения (гломерулонефриты, узелки Ослера, пятна Рота,
- выделение возбудителя, не удовлетворяющее основному критерию или серологические
признаки инфицирования типичным возбудителем;
- эхокардиографические признаки эндокардита, не удовлетворяющие основному критерию.
Несомненный инфекционный эндокардит выявляется при наличии двух основных критериев
или одного основного и трех дополнительных, или же при наличии пяти дополнительных критериев.
Диагноз вероятного ИЭ ставится при наличии одного основного и одного дополнительного
критерия, или только трех дополнительных.
Диагноз считается отвергнутым при отсутствии достаточного числа критериев для
исчезновении симптомов болезни при краткосрочной (менее четырех дней) антибиотикотерапии.
Примеры формулировки диагноза
1. Стрептококковый инфекционный эндокардит. Активная фаза. Сочетанный аортальный
порок сердца (стеноз устья аорты, недостаточность аортальных клапанов). Хроническая сердечная
недостаточность. Стадия ПА. ФКЗ.
2. Инфекционный эндокардит неуточненной этиологии с комбинированным митрально-
аортальным пороком сердца (недостаточность митрального клапана, стеноз устья аорты). Неактивная фаза.
Хроническая сердечная недостаточность. Стадия I. ФКЗ. Дифференциальная диагностика проводится во
лихорадки, причину которой не удается быстро установить, так как типичная клиническая
картина с формированием клапанного порока может развиваться не с первых дней заболевания.
Прежде всего, это поражения сердца ревматической природы. В случае, если речь идет об
острой ревматической лихорадке, диагноз, как правило, не вызывает затруднений в связи с наличием
типичных диагностических критериев ревматизма (см. Часть I, стр. 128).
Большую трудность представляет выявление вторичного инфекционного эндокардита на фоне
уже имеющегося порока сердца. В этом случае важную роль играет сбор анамнеза, тщательное
отслеживание аускультативной симптоматики, наличие других клинических признаков эндокардита.
Решающим в диагностике следует считать отсутствие эффекта от НПВС и положительные результаты
исследования на гемокультуру.
Поражение клапанов сердца часто сопровождает системные заболевания соединительной
ткани, такие как системная красная волчанка, узелковый полиартериит, антифосфолипидный синдром,
неспецифический аортоарериит (болезнь Такаясу),
Лихорадка неясного генеза может встречаться при злокачественных новообразованиях,
особенно у лиц пожилого возраста, обострении не диагностированного ранее хронического пиелонефрита.
Лечениеинфекционного эндокардита направлено в первую очередь на эрадикацию
бактериальной флоры, вызвавшей заболевание. Следует сказать, что. несмотря на наличие в настоящее
время достаточно широкого спектра антибактериальных препаратов, терапия данной категории больных
по-прежнему остается трудной задачей.
Основным принципом терапии инфекционного эндокардита является как можно более раннее
начало антибиотикотералии. При этом срок лечения составляет 4-6 недель. Выбор препарата определяется
результатами посева, но в большинстве случаев следует использовать бактерицидные препараты. Чаще
всего применяют пе-нициллины, цефалоспорины и ванкомицин. При определении дозы антибиотика
оценивают минимальные подавляющую и бактерицидную концентрации.
До получения результатов посева у больных с иодострым инфекционным эндокардитом
непротезированных клапанов назначают антибиотики, эффективные в отношении энтерококков, так как
последние более устойчивы по сравнению со стрептококками (ампициллин 12 г/сутки, иногда в сочетании с
гентамицином 3 мг/кг/сугки).
Терапию острого инфекционного эндокардита начинают с эффективного в отношении
золотистого стафилококка ванкомицина (30 мг/кг/сутки). У инъекционных наркоманов добавляю! гентами-
цин в стандартных дозировках.
При наличии результатов гсмокультуры выбор препарата уточняют. Поскольку основным
микроорганизмом, вызывающим поражение клапанов у пациентов, не являющихся наркоманами, является
чувствительный к пенициллшгу зеленящий С1рептококк (МПК≤0,1 мкг/мл), то терапию начинают
назначением бензилпенициллина в дозе 16-20 млн. ед/сутки, цефтриаксона в суточной дозе 2 г. Добавление
гентамицина в суточной дозе 3 мг/кг/сутки потенцирует эффект. При аллергии к этим препаратом лечение
начинают с ванкомицина.
В случае умеренной чувствительности стрептококков к пенициллину (МПК≥0,1 мкг/мл, но
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
[youtube.player]Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубеж
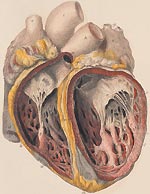
Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубежом. По данным различных авторов, сегодня выросла заболеваемость в пожилом и старческом возрасте, а также среди лиц в возрасте до 30 лет, использующих внутривенное введение наркотиков [1, 2].
Известно, что ИЭ представляет собой заболевание инфекционной природы с первичной локализацией возбудителя на клапанах сердца, пристеночном эндокарде, протекающее с проявлениями системной инфекции, сосудистыми осложнениями и иммунной реакцией [3, 4, 5].
В данной работе обобщен опыт диагностики и ведения больных ИЭ на базе общетерапевтического отделения Александровской больницы Санкт-Петербурга за период 1998–2003 гг. Диагностика заболевания осуществлялась в соответствии с критериями Duke [8]. Диагноз ИЭ оценивался как достоверный при наличии двух главных критериев, а именно:
- при выделении типичного для ИЭ возбудителя при посевах крови больного;
- при определении эхокардиографических признаков поражения эндокарда - подвижные вегетации на клапанах сердца, абсцессов в области протеза клапана; образования внутрисердечных фистул и др., в сочетании с тремя или/и пятью вспомогательными критериями, к которым относились сосудистые осложнения (эмболии крупных артерий, септические инфаркты легких, внутричерепные кровоизлияния и др.), иммунологические феномены (гломерулонефрит, узелки Ослера, геморрагический васкулит и др.), а также фебрильная лихорадка, гепато-спленомегалия и другие проявления системной инфекции.
Нами было проведено обследование 105 больных ИЭ, из них у 80 человек в возрасте от 18 до 30 лет (первая группа) основным фактором риска заболевания являлась инъекционная наркомания.
Во второй группе больных (25 чел.) основными предрасполагающими факторами развития ИЭ были врожденные и приобретенные пороки сердца, а также протезированные клапаны.
У лиц старшей возрастной группы дополнительным фактором риска являлись дегенеративно-дистрофические изменения клапанов сердца.
Взаимосвязь характера поражения клапанов сердца и факторов риска ИЭ представлена в таблице 1.
По данным эхокардиографического исследования, у 100% больных первой группы были выявлены подвижные вегетации на створках трикуспидального клапана (ТК), что сопровождалось формированием его недостаточности I—III степени.
Во второй группе больных ИЭ отмечалось поражение левых камер сердца с образованием вегетаций на створках аортального и митрального клапанов. Изолированное поражение митрального клапана наблюдалось у двух человек с ревматическим пороком сердца (митральный стеноз), у одной больной с врожденным дефектом межжелудочковой перегородки и в единственном случае обструктивной формы гипертрофической кардиомиопатии.
Среди лиц пожилого и старческого возраста у девяти человек (36%) определялось изолированное поражение аортального клапана в отсутствии признаков аортального стеноза. Наряду с этим, у пяти больных (20%) в возрасте от 72 до 87 лет ИЭ развился на фоне аортального порока атеросклеротического генеза, причем у всех пятерых было выявлено сочетанное поражение аортального и митрального клапанов. Дегенеративно-дистрофические изменения других клапанов сердца определялись у 100% больных старшей возрастной группы.
Образование вегетаций на створках аортального клапана наблюдалось у двух больных с третичной формой сифилиса на фоне имеющегося аортального порока, связанного со специфическим процессом в аорте.
В двух случаях мы наблюдали развитие эндокардита протезированных клапанов.
При сопоставлении результатов посевов крови в двух группах больных определялись существенные различия как в частоте выделения микробной флоры, так и в видовом составе возбудителей эндокардита. По нашим данным, возбудителем ИЭ у больных-наркоманов в 71,3% наблюдений (57 чел.) являлся золотистый стафилококк, тогда как во второй группе, наряду с кокковой флорой, чаще обнаруживались грамотрицательные микроорганизмы (28%). Отрицательные результаты посевов крови значительно реже наблюдались в первой, чем во второй, группе больных ИЭ: 18,7% и 56% — соответственно. Данные относительно этиологической структуры ИЭ в обследуемых группах больных представлены в таблице 2.
Клиническое течение и характер осложнений инфекционного эндокардита во многом зависят от локализации клапанных вегетаций — в правых или левых камерах сердца, а также степени вирулентности возбудителя заболевания.
Течение ИЭ у больных-наркоманов отличалось особой тяжестью и полисиндромностью. Причиной госпитализации у большинства больных были острые осложнения основного заболевания. Значительная часть больных поступала в реанимационное отделение стационара с клиническими симптомами одно- или двухсторонней многофокусной пневмонии, причиной которой являлась септическая тромбоэмболия ветвей легочной артерии (72% больных). Течение пневмонии сопровождалось тяжелой дыхательной недостаточностью, нередко с развитием респираторного дистресс-синдрома (РДСВ) и очагами деструкции в легких (12%). Проявления вторичной нефропатии, которые обнаруживались у 100% больных в первой группе, иногда ошибочно трактовались как обострение хронического гломеруло- или пиелонефрита, мочекаменной болезни, что служило поводом для госпитализации этих больных в урологическое и нефрологическое отделения.
Во второй группе больных основной причиной госпитализации была длительная фебрильная лихорадка в сочетании с анемией и гепатолиенальным синдромом. Наряду с этим, у пяти человек (20%) поводом для госпитализации послужила прогрессирующая сердечная недостаточность.
Основные клинические синдромы, наблюдаемые у больных ИЭ первой и второй групп, представлены в таблице 3.
По нашим наблюдениям, характерной особенностью клинического течения ИЭ у больных-наркоманов являлась высокая частота септической ТЭЛА с формированием множественных очагов инфильтрации в легких. У многих больных легочные тромбоэмболии носили рецидивирующий характер (31,3% больных) и нередко осложнялись развитием деструктивных очагов в легких.
Образование вегетаций у 100% больных первой группы сопровождалось недостаточностью трехстворчатого клапана I—III степени с формированием потоков регургитации. Вместе с тем, у большинства пациентов не определялось тяжелых нарушений центральной гемодинамики, связанных с дисфункцией ТК. В данной группе больных характерной клинической особенностью был обратимый характер нарушений гемодинамики на фоне проводимой терапии. Острая сердечная недостаточность с дилятацией полостей сердца и снижением фракции выброса до 40% и ниже наблюдалась у 28 больных (35,3%) в связи с присоединением острого миокардита или на фоне сочетанного поражения клапанов сердца.
Вторичная нефропатия являлась одним из самых распространенных синдромов в первой группе больных ИЭ. Острая почечная недостаточность наблюдалась у 16 больных, причем у 10 из них она носила обратимый характер и была связана с острым ДВС-синдромом, а также с острой сердечной недостаточностью с отеками. Инфекционно-токсическая нефропатия регистрировалась в 73,8% наблюдений и сопровождалась мочевым синдромом — гематурией, протеинурией, лейкоцитурией — при достаточном уровне клубочковой фильтрации.
Характерной особенностью ИЭ во второй группе было подострое течение заболевания с длительным периодом лихорадки на догоспитальном этапе, причем в пожилом и старческом возрасте лихорадка носила субфебрильный характер с редкими подъемами температуры до фебрильных цифр.
Большинство больных подострым инфекционным эндокардитом (ПИЭ) поступали в стационар в стадии развернутой клинической картины заболевания с клиническими признаками тромбоэмболии сосудов большого круга кровообращения. В данной группе больных наиболее распространенными следует признать такие осложнения, как церебральные эмболии с развитием ишемических и геморрагических инсультов, эмболии почечных сосудов с болевым синдромом и гематурией, а также формирование острых очаговых изменений в миокарде, связанных с эмболией коронарных сосудов или прикрытием устьев коронарных артерий вегетациями [9].
Септические тромбоэмболии церебральных сосудов нередко сопровождались развитием гнойного менингоэнцефалита с летальным исходом. Вместе с тем, при посевах крови у 56% больных второй группы не получено роста микробной флоры. Обращает на себя внимание тот факт, что септицемия у больных с положительными результатами посевов крови в 28% наблюдений была обусловлена грамотрицательной микрофлорой. В этой категории больных источником бактериемии являлись очаги хронической инфекции в мочеполовой системе, а у двух больных (по данным аутопсии) был выявлен двухсторонний апостематозный нефрит.
У значительного числа больных ПИЭ (62%) определялись признаки острой недостаточности кровообращения с застойными хрипами в легких, легочной гипертензией, увеличением полостей сердца и периферическими отеками.
В этой группе больных чаще, чем в первой, наблюдалась преренальная азотемия и ОПН, связанные с развитием острой недостаточности кровообращения.
Острый диффузный миокардит, типичными проявлениями которого были различные нарушения ритма, диагностирован у 27% больных второй группы.
Анемия со снижением уровня гемоглобина до 80 г/л и менее выявлена у 100% больных второй группы. Значительное увеличение СОЭ (более 45 мм/ч) наблюдалось у 85,8% больных подострым ИЭ.
Кожные изменения в виде геморрагических высыпаний, пурпуры Шенлейн-Геноха, а также другие проявления иммунного воспаления в обеих группах больных встречались нечасто — 6,3 и 4% в первой и второй группах, соответственно.
Консервативная терапия больных ИЭ проводилось с использованием антибиотиков широкого спектра действия в сочетании со средствами дезинтоксикационной, антикоагулянтной и метаболической терапии. В составе антибактериальной терапии больные получали цефалоспорины III-IV поколений в комбинации с аминогликозидами и метронидазолом. Из группы цефалоспоринов назначались: цефтриаксон (лонгацеф) 2 г в сутки внутривенно (в/в), или цефотаксим (тальцеф) 2 г в сутки в/в, или цефепим (максипим) 2 г в сутки в/в в сочетании с аминогликозидами (амикацин в суточной дозе 1,5 г в/в) и метронидазолом по 1,5-2 г в сутки в/в. В случае, если такая терапия оказывалась неэффективной или существовали противопоказания к вышеперечисленным препаратам, применялись антибиотики группы линкозаминов: клиндамицин 1,2 г в сутки в/в или линкомицин 3 г в сутки в/в в сочетании со фторхинолонами (ципрофлоксацин 400 мг в сутки в/в). В условиях отделения реанимации в течение пяти–семи дней проводилась терапия имипинемом (тиенамом) в дозе 2—4 г в сутки в/в или рифампицином в суточной дозе 0,45—0,6 г в/в. Средняя продолжительность курса антибиотикотерапии в обследуемой группе больных составила 28 + 3,5 дней.
Дезинтоксикационная терапия включала в себя внутривенные инфузии реополиглюкина, гемодеза, поляризующих смесей в сочетании с петлевыми диуретиками. Объем вводимой жидкости составлял в среднем 2-2,5 л в сутки. В течение всего периода инфузионной терапии осуществлялся контроль за функциональным состоянием почек, электролитным составом крови, суточным диурезом. В условиях отделения реанимации у всех больных осуществлялся мониторинг ЦВД. Инфузионная терапия проводилась в течение всего острого периода заболевания до купирования проявлений интоксикационного синдрома. Средняя продолжительность курса составила 22 + 4,5 дня.
Развитие легочной эмболии, особенно в сочетании с признаками острого ДВС-синдрома в стадии гиперкоагуляции, служило основанием для назначения антикоагулянтной терапии. Начальная доза гепарина составляла 10 тыс. ЕД внутривенно, струйно, за-тем — по 1000 ЕД в час внутривенно, капельно с переходом на подкожное введение до 30 тыс. ЕД в сутки. Введение гепарина осуществлялось под контролем показателей коагулограммы и времени свертывания крови. Одновременно проводились внутривенные трансфузии свежезамороженной плазмы по 300 мл в сутки с добавлением 2500–5000 ЕД гепарина. Анемия тяжелой степени (Нb менее 80 г/л, Ht ≤25) корригировалась переливаниями эритроцитарной массы (пять–семь доз). При наличии гипопротеинемии использовалось введение растворов аминокислот, альбумина или нативной плазмы. Выявление клинических и рентгенологических признаков отека легких на фоне рецидивирующего течения септической ТЭЛА служило показанием для назначения кортикостероидов (преднизолон от 120 до 200 мг в сутки внутривенно капельно). Терапия антикоагулянтами прямого действия в сочетании с трансфузиями криоплазмы проводилась до стойкого улучшения показателей гемостаза. Критериями нормокоагуляции являлись уровень фибриногена в плазме 3-4 г/л, отсутствие тромбоцитопении, нормализация ВСК, АЧТВ, тромбинового времени, а также отрицательные паракоагуляционные тесты. По нашим данным, купирование проявлений острого ДВС-синдрома на стадии гиперкоагуляции у 75% больных отмечалось на седьмой–десятый день от начала комплексной терапии.
У части больных формировалась резистентность к проводимой антибактериальной терапии, которая характеризовалась нарастанием интоксикации, фебрильной лихорадкой, прогрессирующей анемией, а также высевами из крови возбудителя ИЭ – золотистого стафилококка — в 65% наблюдений. При рентгенологическом обследовании данной категории больных с большой частотой определялись очаги деструкции легочной ткани, а у трех больных гнойный выпот в плевральной полости.
Длительное применение антибиотиков широкого спектра действия у 70,3% больных (38 чел.) сопровождалось развитием побочных эффектов антибактериальной терапии. Кандидоз полости рта глотки, пищевода, а также кишечный дисбактериоз III-IV стадии был выявлен у 36 больных (66,7%). Применение антибиотиков с гепатотоксическими свойствами (цефалоспорины, линкозамины, метронидазол) у двух больных (3,7%) с хроническим гепатитом С и В приводило к прогрессированию печеночной недостаточности, которая сопровождалась высокой ферментемией (АЛТ 1500 ЕД, АСТ 1000 ЕД) и желтухой.
Развитие застойной сердечной недостаточности с появлением акроцианоза, влажных хрипов в базальных отделах легких, периферических отеков в сочетании с кардиомегалией и падением фракции выброса до 50—45% наблюдалось у пяти больных (9,3%) на фоне массивной инфузионной терапии.
Длительная антикоагулянтная терапия в 20,4% (11 чел.) наблюдений сопровождалась повышением толерантности плазмы к гепарину, что клинически выражалось в развитии периферических флеботромбозов, в то время как гепарининдуцированной тромбоцитопении в обследуемой группе больных мы не наблюдали.
Положительные результаты консервативной терапии были получены у 70,2% больных (56 чел.) с поражением ТК и лишь у 32% пациентов (6 чел.) из второй группы. Исходом ИЭ в обеих группах больных являлось формирование недостаточности клапанов сердца.
Госпитальная летальность при ИЭ у наркозависимых лиц составила 29,4% (24 чел.), тогда как у больных с поражением левых камер сердца (вторая группа) уровень смертности составил 68% (19 чел.).
По данным аутопсии, основными причинами смерти больных ИЭ были:
- септикопиемия с формированием гнойных очагов в печени, почках селезенке, головном мозге с развитием полиорганной недостаточности (46,2%);
- сердечная недостаточность на фоне полипозно-язвенного эндокардита с разрушением клапанов сердца, а также острый миокардит с дилятацией полостей сердца (39,4%);
- вторичная нефропатия с развитием почечной недостаточности, отеком легких, отеком головного мозга (14,4%).
Таким образом, характерные особенности ИЭ у лиц с наркотической зависимостью — это острое течение заболевания с поражением правых камер сердца и рецидивами септической ТЭЛА. Возбудителем ИЭ у инъекционных наркоманов в 71,3% является высоковирулентный золотистый стафилококк. Формирование недостаточности трехстворчатого клапана I—III степени стало самым распределенным осложнением ИЭ у наркоманов. При этом у большинства больных не наблюдается тяжелых нарушений центральной гемодинамики, приводящих к развитию острой недостаточности кровообращения.
Подострый ИЭ у больных с предрасполагающими заболеваниями сердца, а также у лиц пожилого и старческого возраста протекает с преимущественным поражением левых камер сердца, причем в старшей возрастной группе преобладает моноклапанное поражение. Наличие сопутствующей патологии у лиц старше 60 лет маскирует течение основного заболевания, чем и обусловлены поздняя диагностика и высокая смертность больных. Для затяжного течения ИЭ характерна низкая высеваемость возбудителя, по сравнению с острыми формами заболевания. Развитие тромбоэмболий сосудов большого круга кровообращения является характерной клинической особенностью подострого ИЭ.
Положительный эффект от проводимой консервативной терапии наблюдается у большинства больных ИЭ с поражением ТК, тогда как при подостром эндокардите левых камер сердца консервативная терапия является малоэффективной у большинства больных.
Госпитальная летальность в обеих группах больных обусловлена диссеминацией возбудителя с формированием гнойных очагов и полиорганной недостаточностью, а также развитием острой недостаточности кровообращения и вторичной нефропатии.
- Буткевич О. М., Виноградова Т. Л. Инфекционный эндокардит. - М., 1997.
- Симоненко В. Б., Колесников С. А. Инфекционный эндокардит: современное течение, диагностика, принципы лечения и профилактики. - Клин. мед., 1999. - 3. - С. 44-49.
- Тазина С. Я., Гуревич М. А. Современный инфекционный эндокардит. - Клин. мед.,1999. - 12. - С. 19-23.
- Bansal R. C. Infective endocarditis. Med Clin North America 1995; 79 (5): 1205-1239.
- Bayer A. S., Bolger A. F., Taubert K. A. et al. Diagnosis and management of infective endocarditis and its complications. Circulation 1998; 98: 2936-2948.
- McKinsey D. S., Ratts T. E., Bisno A. I. Underlying cardiac lesions in adults with infective endocarditis. The changing spectrum. Amer J Med 1987; 82: 681-688.
- Lamas C. C. Eykyn S. J. Suggested modifications to the Duke criteria for the clinical diagnosis of native valve and prosthetic valve endocarditis: analysis of 118 pathologically proven cases. Clin Infect Dis 1997; 25: 713-719.
- Durack D. T., Lukes A. S., Bright D. K. et al. New criteria for diagnosis of Infective Endocarditis Utilization of Specific Echocardiographic Finding. Amer J Med 1994; 96: 200-209.
- Тюрин В. П., Дубинина С. В. Инфекционный эндокардит у лиц пожилого и старческого возраста. - Клин. мед., 2000. - 4. - С. 53-56.
В. И. Уланова
В. И. Мазуров, доктор медицинских наук, профессор
Медицинская академия последипломного образования, Санкт-Петербург
Читайте также:


