Поражение сердца при нервно мышечных заболеваниях
Многие нервно-мышечные заболевания сопровождаются поражением миокарда. Среди них наиболее распространенными являются прогрессирующие мышечные дистрофии (ПМД), в частности ПМД Дюшенна. Атрофический процесс при ПМД поражает и скелетные, и сердечную мышцы. Это связано с тем, что в этиологии и патогенезе заболеваний сердечной и скелетной мышц много общего, ведь, несмотря на существующие различия, эти мышцы обладают сходством в молекулярной, анатомической структуре и физиологии [3]. При ПМД Дюшенна 84-96% больных страдают патологией со стороны сердечно-сосудистой системы [1, 2]. Дилатационная кардиомиопатия (ДКМП), желудочковые аритмии, фибрилляция предсердий, нарушения атриовентрикулярной и внутрижелудочковой проводимости, а также внезапная сердечная смерть – хорошо известные проявления мышечной дистрофии Дюшенна.
ПМД Дюшенна – наследственное рецессивное Х-сцепленное заболевание, с распространенностью 1 случай на 3600-6000 мальчиков, рожденных живыми, возникающее в результате мутации в гене дистрофина и характеризующееся поражением проксимальных групп мышц, кардиологическими, ортопедическими и респираторными осложнениями (рис. 1). Другими словами, это наследственное заболевание, которое возникает в результате дефектов гена (делеция, дупликация или точечная мутация гена), кодирующего белок дистрофин. Дистрофин, в свою очередь, локализован в плазматической мембране скелетных мышечных волокон и кардиомиоцитов. ПМД Дюшенна является наиболее тяжелой формой с манифестацией в возрасте 2-5 лет и прогрессирующим злокачественным течением: формированием вялых парезов, параличей и мышечных контрактур, что приводит в будущем к обездвиженности.

Ввиду того что ПМД Дюшенна связана с мутациями в гене, который находится на Х-хромосоме, этим заболеванием страдают только мальчики. Описания данной патологии у девочек крайне редки.
Основным симптомом является мышечная слабость, которая в первую очередь связана с атрофией скелетных мышц.
Облигатным признаком развернутой стадии ПМД Дюшенна является гипертрофическая, или дилатационная, кардиомиопатия, которая сопровождается нарушениями ритма сердца, расширением его границ, явлениями сердечной недостаточности (СН). Кардиомиопатия – наиболее частая причина летального исхода при ПМД Дюшенна [4, 5]. К летальности приводит также дыхательная недостаточность, которая провоцируется интеркуррентными инфекциями или аспирацией. Больные погибают на втором-третьем десятилетии жизни.
При биохимическом анализе крови выявляют повышение активности печеночных ферментов (АлАТ, АсАТ) и значительное – в сотни и тысячи раз – повышение активности креатинфосфокиназы. Это отражает процесс разрушения мышечной ткани.
Основным методом для подтверждения диагноза является ДНК-диагностика, довольно сложная и дорогая. В некоторых странах обсуждается возможность проведения массового скрининга на данное заболевание.
Поэтому при постановке диагноза мы стараемся использовать дополнительные методы. Один из них – электромиография (ЭМГ). Этот метод позволяет подтвердить тот факт, что в основе заболевания лежит первично-мышечный тип изменений, а периферическая нервная система при этом совершенно интактна [6]. ЭМГ-исследование на сегодняшний день является одним из основных методов в оценке структурно-функционального состояния мышц и диагностике нервно-мышечных заболеваний. ЭМГ используют для дифференциальной диагностики между первичными (мышечными) и вторичными (невральными) мышечными дистрофиями.
ЭМГ (стимуляционная) – это комплекс методов оценки функционального состояния нервно-мышечной системы, основанный на регистрации и анализе биоэлектрической активности мышц и периферических нервов. К основным заболеваниям, при которых ЭМГ-диагностика является наиболее информативной и часто используемой, относятся первично-мышечная патология (ПМД, полимиозит, миозит), невральная патология (радикулопатии, плексопатии, невропатии (травматические; компрессионно-ишемические; полиневропатии – воспалительные, наследственные, дисметаболические, токсические), заболевания периферического двигательного мотонейрона (полиомиелит, боковой амиотрофический склероз).
Электронейромиография (ЭНМГ) как диагностический метод включает в себя две основные методики – стимуляционную и игольчатую. В основе стимуляционной ЭНМГ (рис. 2) лежит регистрация сумарного ответа мышцы или нерва в ответ на стимуляцию импульсом электрического тока. Методы стимуляционной ЭНМГ позволяют исследовать проводящую функцию моторных и сенсорных аксонов периферических нервов, а также функциональное состояние нервно-мышечной передачи. Также сюда относят исследование поздних ответов, таких как F-волна (данный метод позволяет выявить поражение нейромоторного аппарата на ранней субклинической стадии заболевания) и Н-рефлекс (является аналогом ахиллового рефлекса, посредством которого можно оценить порог возбудимости мотонейронов поясничного утолщения). С помощью игольчатой ЭМГ (рис. 3) определяют функциональное состояние мышцы, наличие или отсутствие текущего процесса в ней, степень и выраженность денервации, выраженность и эффективность реиннервации. В основе этого метода лежит определение параметров потенциалов двигательных единиц (ПДЕ), которое включает анализ длительности, фазности и амплитуды, а также анализ спонтанной активности ДЕ и мышечных волокон.

В диагностике ПМД Дюшенна стимуляционная ЭНМГ особой роли не играет. При исследовании проводящей функции моторных нервов выявляется снижение амплитуды М-ответа, соответствующее снижению силы мышцы и выраженности атрофии; остальные параметры остаются в норме до поздней стадии заболевания. Более информативной является игольчатая ЭМГ. Она и служит основным методом исследования при подозрении на ПМД. Выполнение данной методики позволяет выявить первично-мышечный тип изменений потенциалов ДЕ (уменьшение длительности и снижение амплитуды ПДЕ) и спонтанную активность мышечных волокон (в виде потенциалов острых волн – ПОВ, потенциалов фибрилляции – ПФ), указывающих на степень активности процесса в каждой конкретной мышце. Спонтанная активность, регистрируемая при ПМД, всегда значительно выражена, что отличает ПМД от других наследственных первично-мышечных заболеваний. Она наблюдается в самых начальных стадиях заболевания, когда наряду с ПФ выявляются ПОВ и разряды высокой частоты [6].
Несмотря на то что проблема вовлечения сердца в патологический процесс при миодистрофии Дюшенна активно изучается с 1980-х гг. [21, 22], до сих пор уровень выявляемости сердечно-сосудистых нарушений и профилактика тяжелых осложнений на ранних стадиях остаются очень низкими. Причиной летального исхода при большинстве форм ПМД является вовлечение в патологический процесс сердечной мышцы [23, 24].
Все это обусловливает необходимость дальнейшей разработки вопросов ранней диагностики кардиологических нарушений при различных формах ПМД с целью определения тактики лечения, профилактики развития тяжелых сердечно-сосудистых нарушений, улучшения качества и продолжительности жизни больных.
Нарушения со стороны сердца проявляются в виде ишемических и метаболических изменений миокарда, перегрузки левого желудочка (ЛЖ), нарушений проводимости и сердечного ритма (в виде внутрисердечных блокад и аритмий), а также развития внезапной сердечной смерти. Структурные изменения сердца с дилатацией ЛЖ или гипертрофией встречаются при миотонической дистрофии приблизительно у 20% больных, систолическая дисфункция ЛЖ отмечается в 14% случаев [7, 8], но клинически очевидная СН встречается редко – всего у 2% больных. Кардиомиопатия у детей с миодистрофией Дюшенна развивается на фоне гипо- и адинамии, поэтому не проявляется СН I и IIA стадии и не провоцирует жизнеугрожающих нарушений ритма и проводимости сердца, что приводит к поздней диагностике.
На основании анализа данных многих исследований можно с уверенностью сказать, что пациенты с миодистрофией Дюшенна должны в обязательном порядке проходить кардиологическое обследование и обследование дыхательной системы на ранних этапах заболевания.
Скрининг для выявления сердечной патологии необходимо проводить всем детям с нервно-мышечными заболеваниями, при которых существует риск вовлечения в патологический процесс сердца. Рекомендации относительно времени и частоты проведения первичного и последующих обследований были разработаны Американской академией педиатров совместно с экспертами в данной предметной области и основываются на времени начала и клиническом течении поражения сердца при отдельных нервно-мышечных заболеваниях. Скрининг должен включать тщательный сбор анамнеза, физикальное обследование на предмет признаков и симптомов СН или аритмии [9]. Иногда установить наличие клинически значимой СН у пациентов с генерализованной мышечной слабостью бывает трудно вследствие присутствия симптомов, которые могут имитировать признаки СН. Необходимо фиксировать такие общие жалобы, как одышка, слабость, утомляемость, нарушение сна, снижение аппетита, потеря массы тела, поскольку они в том числе могут являться и симптомами недостаточности кровообращения. Головокружение или синкопальные состояния, ощущение перебоев в работе сердца, чувство учащенного сердцебиения могут быть признаками нарушения ритма сердца.
При постановке диагноза в скрининг при выявлении патологии со стороны сердца необходимо включать проведение инструментальных и лабораторных исследований.
Электрокардиография (ЭКГ) – важный инструмент скрининга для выявления нарушений ритма и проводимости сердца, гипертрофии или дилатации желудочков [10]. Проведение эхокардиографии считается золотым стандартом диагностики структурно-функциональных нарушений миокарда и способствует выявлению патологии сердца на доклиническом этапе [11].
Очень часто – в зависимости от уровня поражения сердца – требуется выполнение дополнительного обследования. При заболеваниях, сопровождающихся выраженными нарушениями ритма, рекомендуется проведение суточного мониторирования ЭКГ. Кроме того, для оценки степени фиброза миокарда, воспалительных изменений, патологии перикарда у пациентов могут применяться такие неинвазивные методы диагностики, как магнитно-резонансная или компьютерная томография сердца с контрастированием [12, 13].
Лечение больных с нарушениями ритма и проводимости сердца включает антиаритмическую терапию, имплантацию искусственного водителя ритма (электрокардиостимулятора), кардиовертера-дефибриллятора. Больные с ремоделированием миокарда, нарушениями систолической и/или диастолической функции миокарда и хронической СН (ХСН) должны получать лечение в соответствии с рекомендациям по терапии ХСН [14]. В настоящее время рассматривается вопрос о начале превентивной терапии патологии сердечно-сосудистой системы больных с нервно-мышечными болезнями в детском возрасте. Согласно данным Педиатрического реестра кардиомиопатии шестилетняя выживаемость у пациентов с мышечной дистрофией Дюшенна после установления диагноза ДКМП составляет 58%, а уровень выживаемости без трансплантации сердца – 55% [15]. Данные 10-летнего наблюдения указывают на более низкий уровень смертности среди пациентов, которым согласно рандомизированному отбору были изначально назначены ингибиторы ангиотензинпревращающего фермента (ИАПФ) [16]. Увеличение выживаемости по сравнению с данными литературы отмечено в исследованиях у пациентов с ПМД Дюшенна, получавших комбинированную терапию ИАПФ и β-блокаторами. Также у части пациентов выявлена нормализация функции и размеров ЛЖ [17].
На сегодняшний день не существует специфического лечения мышечной дистрофии. Все лечение симптоматическое и направлено на поддержание жизненно важных систем и функций организма. В то же время за рубежом уже зарегистрирован препарат, стимулирующий выработку дистрофина. Также запатентована методика пересадки костного мозга от отца к сыну, что, к сожалению, не восстанавливает утраченные способности мышц, однако предотвращает дальнейшее их разрушение.
Полный текст:
- Аннотация
- Об авторе
- Список литературы
- Cited By
Многие нервно-мышечные заболевания часто сочетаются с поражением миокарда. Среди наиболее распространенных из них – группа мышечных дистрофий. Дилатационная кардиомиопатия, желудочковые аритмии, фибрилляции предсердий, нарушения атриовентрикулярной и внутрижелудочковой проводимости, а также внезапная сердечная смерть – хорошо известные симптомы при мышечной дистрофии Дюшенна, миотонической дистрофии 1-го и 2-го типов, мышечной дистрофии Эмери–Дрейфуса и различных вариантах поясно-конечностных мышечных дистрофий. Выявление кардиальной патологии у данных групп пациентов возможно с помощью электрокардиографии, эхокардиографии и магнитно-резонансной томографии сердца, которые рекомендованы в рамках скринингового обследования и раннего кардиопротективного лечения.
1. Barp A., Bello L., Politano L. et al. Genetic modifiers of Duchenne muscular dystrophy and dilated cardiomyopathy. PLoS One 2015;10(10):1–14.
2. Ferlini A., Sewry C., Melis M.A. et al. X-linked dilated cardiomyopathy and the dystrophin gene. Neuromuscul Disord 1999;9:339–46.
3. Jefferies J.L., Eidem B.W., Belmont J.W. et al. Genetic predictors and remodeling of dilated cardiomyopathy in muscular dystrophy. Circulation 2005;112:2799–804.
4. Manzur A.Y., Muntoni F. Diagnosis and new treatments in muscular dystrophies. J Neurol Neurosurg Psychiatry 2009;80: 706–14.
5. Lodi R., Hart P.E., Rajagopalan B. et al. Antioxidant treatment improves in vivo cardiac and skeletal muscle bioenergetics in patients with Friedreich’s ataxia. Ann Neurol 2001;49(5):590–6.
6. Holaska J.M. Emerin and the nuclear lamina in muscle and cardiac disease. Circ Res 2008;103:16–23.
7. English K.M., Gibbs J.L. Cardiac monitoring and treatment for children and adolescents with neuromuscular disorders. Dev Med Child Neurol 2006;48:231–5.
8. Babuty D., Fauchier L., Tena-Carbi D. et al. It is possible to identify infrahissian cardiac conduction abnormalities in myotonic dystrophy by non-invasive methods? Heartt 1999;82:634–7.
9. Bhakta D., Lowe M.R., Groh W.J. Prevalence of structural cardiac abnormalities in patients with myotonic dystrophy type I. Am Heart J 2004;147:224–7.
10. Melacini P., Buja G., Fasoli G. et al. The natural history of cardiac involvement in myotonic dystrophy: an eight-year followup in 17 patients. Clin Cardiol 1988; 11:231–8.
11. Stollberger C., Winkler-Dworak M., Blazek G., Finsterer J. Association of electrocardiographic abnormalities with cardiac findings and neuromuscular disorders in left ventricular hypertrabeculation/non-compaction. Cardiology 2007;107:374–9.
12. Mertens L., Ganame J., Claus P. et al. Early regional myocardial dysfunction in young patients with Duchenne muscular dystrophy. J Am Soc Echocardiogr 2008;21:1049–54.
13. Silva M.C., Meira Z.M., Gurgel Giannetti J. et al. Myocardial delayed enhancement by magnetic resonance imaging in patients with muscular dystrophy. J Am Coll Cardiol 2007;49:1874–9.
14. Kazanegra R., Cheng V., Garcia A. et al. A rapid test for B-type natriuretic peptide correlates with falling wedge pressures in patients treated for decompensated heart failure: a pilot study J Card Fail 2001;7(1):21–9.
15. Remme W.J., Swedberg K. Guidelines for the diagnosis and treatment of chronic heart fealure. Task force for the diagnosis and treatment of chronic heart fealure, European Society of cardiology. Eur Heart J 2001;22(17):1527–60.
16. Verhaert D., Richards K., Rafael-Fortney J.A. Cardiac involvement in patients with muscular dystrophies. Magnetic imaging phenotype and genotypic considerations. Circ Cardiovasc Imaging 2011;4(1):67–76.
17. Архипова Е.Н., Родионова Т.В., Басаргина Е.Н. и др. Закономерности изменения содержания NT-proBNP в крови и их диагностическая значимость у детей с хронической сердечной недостаточностью. Вопросы диагностики в педиатрии. 2012;4(3):11–6. [Аrkhipovа Е.N., Rodionovа Т.V., Basargina Е.N. et al. Common factors of the change of NT-proBNP content in blood and its diagnostic value at children with chronic cardiac failure. Voprosy diagnostiki v pediatrii = Diagnostic Issues in Pediatrics 2012;4(3):11–6. (In Russ.)].
18. Ishikawa K. Cardiac involvement in progressive muscular dystrophy of the Duchenne type. Jpn Heart J 1997;38:163–80.
19. Thrush P.T., Allen H.D., Viollet L., Mendell J.R. Re-examination of the electrocardiogram in boys with Duchenne muscular dystrophy and correlation with its dilated cardiomyopathy. Am J Cardiol 2009;103:262–5.
20. Kirchmann C., Kececioglu D., Korinthenberg R., Dittrich S. Echocardiographic and electrocardiographic findings of cardiomyopathy in Duchenne and Becker-Kiener muscular dystrophies. Pediatr Cardiol 2005;26:66–72.
21. Klitzner T.S., Beekman R., Galioto F.M. et al. Cardiovascular health supervision for individuals affected by Duchenne or Becker muscular dystrophy. Pediatrics 2005;116: 1569–73.
22. Muntoni F. Cardiac complications of childhood myopathies. J Child Neurol 2003;18:191–202.
23. Bunse M., Bit-Avragim N., Riefflin A. et al. Cardiac energetics correlates to myocardial hypertrophy in Friedreich’s ataxia. Ann Neurol 2003;53(1):121–3.
24. Finsterer J., Stollberger C. Neuromuscular disorders associated with apical hypertrophic cardiomyopathy. Acta Cardiol 2009;64:85–9.
25. Басаргина Е.Н., Архипова Е.Н., Жарова О.П. Типичные ошибки при лечении хронической сердечной недостаточности со сниженной систолической функцией у детей. Фарматека 2014;(1): 55–62. [Basargina E.N., Arkhipova E.N., Zharova O.P. Typical errors in the treatment of chronic cardiac failure with diminished systolic function in children. Farmateka = Pharmatec 2014;(1):55–62. (In Russ.)].
26. Connuck D.M., Sleeper L.A., Colan S.D. et al. Characteristics and outcomes of cardiomyopathy in children with Duchenne or Becker muscular dystrophy: a comparative study from the Pediatric Cardiomyopathy Registry. Am Heart J 2008;155:998–1005.
27. Duboc D., Meune C., Pierre B. et al. Perindopril preventive treatment on mortality in Duchenne muscular dystrophy: 10 years’ followup. Am Heart J 2007;154: 596–602.
28. Rhodes J., Margossian R., Darras B.T. et al. Safety and efficacy of carvedilol therapy for patients with dilated cardiomyopathy secondary to muscular dystrophy. Pediatr Cardiol 2008;29:343–51.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Нервно-мышечными заболеваниями (НМЗ) является группа патологий, которые передаются на генетическом уровне от родителей детям. Нарушаются мышечные функции, снижается двигательная активность. Появляются характерные клинические симптомы.
Патологические процессы развиваются на фоне нарушений функций нервно-мышечных соединений, при поражении мышц и спинномозговых нейронов, нервов. Правильно подобранная терапия не поможет полностью вылечить человека, но позволит улучшить качество его жизни.
Этиология и неврология
Нервно-мышечные заболевания нарушают нормальную синаптическую передачу импульсов с нервных окончаний к мышечным волокнам. В основе каждого типа патологических изменений лежат аутоиммунные процессы.
Большая группа заболеваний характеризуется не только поражением мышечной ткани, но и периферических нервов, передних рогов спинного мозга. Среди часто диагностируемых патологий выделяют миопатию, миотонию, миастению.
Классификация
Нервно-мышечные заболевания различают по следующим видам:
Описание
Нервно-мышечные заболевания передаются по наследству, чаще появляются у людей, в семье которых были родственники с таким диагнозом.
Приобретенные патологические процессы развиваются в результате гормональных или метаболических нарушений в организме человека. Наблюдается сбой в функционировании иммунной системы. Она вырабатывает клетки, которые атакуют свой организм. Аутоиммунные заболевания приводят к появлению слабости в мышцах.
Нервно-мышечные патологии, сопровождающиеся дистрофическими процессами, поражают следующие области тела человека:
- мышцы;
- нервно-мышечные окончания;
- двигательные нейроны;
- периферические нервы.
При миопатии у человека высоки шансы стать инвалидом в результате утраты подвижности. Все виды нервно-мышечных заболеваний без своевременной терапии влекут за собой последствия. Это может быть не только инвалидность, но и смерть человека.
Стадии и степени
Нервно-мышечные заболевания протекают по стадиям. Определить этап развития патологических процессов поможет врач невролог при помощи медицинской диагностики.
| Название | Описание |
| I стадия | Двигательные нарушения слабо выраженные. |
| II стадия | У больного присутствуют ярко выраженные клинические признаки и наблюдаются серьезные двигательные изменения. |
| III стадия | Пациент не может самостоятельно передвигаться. |
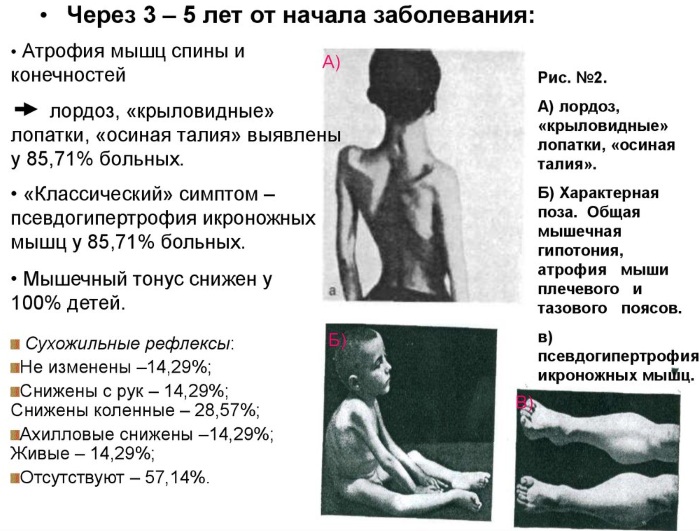
Нервно-мышечные заболевания миопатия Дюшенна на 2 этапе
Клиническая картина зависит от скорости развития патологических процессов и степени тяжести заболевания. Установить точный диагноз поможет врач невролог.
Симптомы
Основной признак нервно-мышечных заболеваний – это слабость мускулатуры. Клиническая картина зависит от области поражения (плечевой пояс, бедра, таз, нижние конечности).
В большинстве случаев у пациентов диагностируют следующие симптомы:
- снижается мышечный объем;
- наблюдаются болезненные спазмы;
- непроизвольно сокращаются мышцы;
- пораженные ткани немеют;
- снижаются сухожильные рефлексы;
- больной ощущает покалывание;
- двоится в глазах (диплопия);
- нарушаются глотательные и дыхательные рефлексы.
При нервно-мышечных заболеваниях опускаются веки, мышечная слабость проявляется симметрично и постепенно прогрессирует. В большинстве случаев при развивающейся мышечной дистрофии слабость возникает в области тазового и плечевого пояса. То же самое касается проксимальных отделов конечностей.
Иногда невральная амиотрофия сопровождается парестезией, нарушением глубокой или поверхностной чувствительности. Клинические признаки нервно-мышечных заболеваний проявляются постепенно. По мере прогрессирования патологических процессов человек теряет способности самостоятельно обслуживать себя. То же самое касается передвижения.
Причины появления
Нервно-мышечные заболевания в большинстве случаев возникают по причине аутоиммунных патологий.
Провоцирующим фактором также являются следующие обстоятельства:
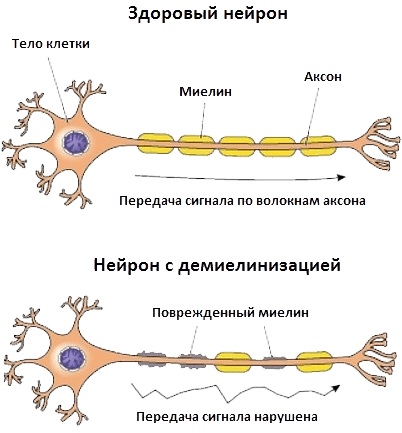
- наследственный фактор;
- поражение периферических нервов и мотонейронов спинного мозга;
- сбои в функционировании нервно-мышечных соединений;
- отравление организма различными веществами;
- врожденный сбой метаболизма;
- патологические изменения в мышцах.
Нервно-мышечные заболевания также развиваются на фоне нарушений работы двигательного нейрона в области ствола головного мозга.
Определить причину и поставить точный диагноз поможет врач невролог. Учитывая состояние пациента, степень развития патологических процессов и индивидуальные особенности человеческого организма, специалист подберет эффективное лечение.
Диагностика
Медицинское обследование позволит врачу установить точный диагноз. Тестирование специалист назначает пациенту, учитывая его жалобы и симптоматику.
Для диагностики нервно-мышечных заболеваний назначаются следующие методы обследования:
Описание

Исследованием состояния сердечной мышцы занимается кардиолог. Специалист назначает не только кардиограмму, но и ультразвуковое исследование (УЗИ) сердца.
Когда необходимо обратиться к врачу
К врачу необходимо обратиться сразу, при появлении первых признаков нарушений в работе мышц. Но если в семье есть родственники с нервно-мышечными заболеваниями, необходимо пройти полное медицинское обследование и понять, насколько высока вероятность появления патологических процессов по наследственной линии.
Диагностикой и лечением занимается врач невролог. Специалист проведет осмотр и подберет максимально информативные методы исследования.
Профилактика
Нервно-мышечные заболевания в большинстве случаев развиваются по причине наследственного фактора. Предупредить патологические изменения невозможно. Женщине во время планирования беременности рекомендуется проходить медицинские обследования, особенно если в семье есть родственники с таким диагнозом.
Диагностические мероприятия также назначаются в период вынашивания малыша на ранних сроках. При высокой вероятности развития нервно-мышечных заболеваний специальная медицинская комиссия советует будущей матери прервать беременность.
Методы лечения
Терапия нервно-мышечных заболеваний осуществляется комплексными методами. Пациентам назначают медицинские препараты, лечебную физкультуру. При отсутствии серьезных противопоказаний, можно использовать рецепты знахарей и целителей. Основная цель терапии – это поддержать мышечные силы и замедлить атрофирующие процессы.
Медикаменты подбирает врач невролог, учитывая результаты медицинской диагностики, степень развития патологических процессов и индивидуальные особенности организма человека.
Самостоятельно не рекомендуется принимать лекарства, поскольку многие препараты вызывают побочные эффекты.
При нервно-мышечных заболеваниях врач назначает следующие медикаменты:
Применение
Лекарства позволяют устранить дефицит энергии и белка, положительно влияют на вещественные обмены в мышечных тканях. Дополнительно назначаются витаминные комплексы.
Нервно-мышечные заболевания можно лечить рецептами знахарей и целителей, но в качестве вспомогательной терапии. Народные средства улучшают качество жизни пациента и общее его состояние. Используемые средства следует обсуждать с лечащим врачом неврологом.
| Название | Рецепт | Применение |
| Овес | Зерна хорошо промыть и залить водой (500 мл). Полученную массу ставят на огонь, доводят до кипения и греют 30 мин. Дальше оставляют на 2 часа, процеживают и принимают по схеме. | Готовое средство рекомендуется принимать внутрь перед едой 4 раза в сутки. Курс терапии продолжается 3 месяца. Затем необходимо сделать перерыв на 30 дней и продолжить терапию. |
| Репчатый лук | Продукт очистить и смешать 200 г с сахаром (200 г), добавить воды (0,5 л). Полученную массу поставить на медленный огонь и греть 1,5 часа. Остудить и добавить 2 ст.л. натурального меда. | Готовое средство рекомендуется принимать по 2 ч.л. 3 раза в сутки. |
| Чеснок | Очистить и измельчить 3 головки чеснока. Добавить 4 лимона, предварительно измельченные. Все компоненты залить медом (1 л) и льняным маслом (200 г). | Полученное средство следует принимать по 1 ч.л. 3 раза в день. |
При нервно-мышечных заболеваниях полезно проводить контрастные ванны для нижних конечностей. После водных процедур ноги рекомендуется укутывать теплым одеялом.
Комплексная терапия нервно-мышечных заболеваний позволяет замедлить их развитие, продлевает период ремиссии и улучшает качество жизни пациента.
Вместе с традиционным и народным лечением больным назначаются следующие методы терапии:

| Название | Описание |
| Физиотерапевтические процедуры | Лечение улучшает проводимость нервных импульсов в мышечных тканях, способствует их питанию. Усиливается кровообращение и вещественный обмен. |
| Массаж | Точечное воздействие помогает повысить тонус мышц. Для достижения лечебного эффекта необходимо провести несколько сеансов на протяжении года. |
| Лечебная физкультура | Гимнастика проводится в специализированном комплексе под наблюдением специалиста. |
Сохранить самостоятельное передвижение пациента позволяют специальные ортопедические приспособления. Лечебная физкультура в виде активных и пассивных движений улучшает состояние больного.
Упражнения следует выполнять регулярно, соблюдая умеренные нагрузки. При нервно-мышечных заболеваниях также рекомендуется плавать. В воде легче выполнять физические упражнения без нагрузки на позвоночник.
Возможные осложнения
Негативные последствия патологических процессов появляются в результате поражения различных внутренних органов и систем организма человека:
Описание
Прогрессирующие патологические процессы также могут спровоцировать искривление позвоночника (кифоз, сколиоз). Больным необходимо носить специальные корсеты. В тяжелых ситуациях или на запущенных стадиях развития нервно-мышечных заболеваний пациенту показано оперативное вмешательство. Решение принимает врач невролог, учитывая состояние человека и индивидуальные особенности его организма.
При нервно-мышечных заболеваниях нарушается двигательная функция, слабеют мышцы. Симптомы постепенно усиливаются на фоне прогрессирующих дистрофических процессов.
Пациенту необходимо пройти полное обследование для постановки диагноза и специально подобранное лечение. Лекарства, средства народной медицины, физиотерапевтические процедуры помогут лишь облегчить жизнь пациенту, но полностью избавить от генетической патологии не смогут.
Оформление статьи: Владимир Великий
Видео о нервно-мышечных заболеваниях
Телесеминар о нервно-мышечных заболеваниях:
Читайте также:


