Профилактика и лечение остеопороза фармакология
Oстеопороз (ОП) представляет собой метаболическое заболевание скелета, протекающее длительно и поражающее значительную часть населения, особенно старших возрастных групп. ОП характеризуется снижением массы кости в единице объема и нарушением микроархит

Oстеопороз (ОП) представляет собой метаболическое заболевание скелета, протекающее длительно и поражающее значительную часть населения, особенно старших возрастных групп. ОП характеризуется снижением массы кости в единице объема и нарушением микроархитектоники костной ткани, что повышает риск переломов костей. Распространенность этого заболевания, охватывающая, по данным разных авторов, от 2 до 10% населения, значительно увеличивается с возрастом. Согласно классификации ОП (1997), принятой на заседании президиума Российской Ассоциации по остеопорозу, различают первичный и вторичный ОП. К первичному относят постменопаузальный и сенильный остеопорозы, которые составляют 85% всех случаев ОП, а также ювенильный и идиопатический. Вторичные формы ОП включают в себя остеопатии, связанные с различными заболеваниями (синдромом Кушинга, тиреотоксикозом, гипогонадизмом, ревматоидным артритом и т. д.) или с приемом лекарств (глюкокортикоидов, противосудорожных средств, тиреоидных гормонов и др.). В основе патогенеза любого варианта ОП лежит дисбаланс процессов костного ремоделирования — костеобразования и костной резорбции: преобладает либо ускоренная резорбция, либо сниженное костеобразование, в некоторых случаях наблюдается замедление обеих составляющих костного обмена.
Фармакотерапия ОП предполагает решение следующих задач:
- замедление или прекращение потери массы кости;
- улучшение качества кости и повышение ее прочности;
- нормализация нарушенных процессов костного ремоделирования;
- предотвращение переломов костей;
- улучшение состояния пациента, расширение его двигательной активности, максимальное восстановление способности к самообслуживанию при клинически выраженном ОП. Однако главным критерием эффективности терапии ОП тем или иным препаратом является возможность предотвращения переломов костей, доказанная в ходе двойных слепых плацебоконтролируемых исследований длительностью не менее трех лет, в которых приняли участие не менее 1000 пациентов.
Все средства патогенетической терапии и профилактики ОП в соответствии с преобладающим механизмом действия можно условно разделить на три группы (табл.1):
- преимущественно угнетающие костную резорбцию;
- стимулирующие костеобразование;
- многопланового действия.
Идеальный препарат для лечения ОП должен восстанавливать значительные потери массы кости, предупреждая тем самым переломы костей, положительно влиять как на трабекулярные, так и на кортикальные костные структуры, обладать минимальной токсичностью и при этом действовать только на костную ткань. Важнейшая задача терапии ОП — возможность предотвращения переломов костей, что и является на сегодняшний день основным критерием эффективности того или иного препарата. С позиции концепции качества кости и доказанности снижения частоты переломов костей под влиянием лечения антиостеопоротические препараты можно разделить на две большие группы:
- препараты с доказанной способностью предотвращать новые переломы костей (эстрогены, СМЭР, кальцитонины, бисфосфонаты и при сенильном ОП — препараты витамина D с солями кальция);
- препараты, для которых данная способность не доказана и необходимы дополнительные клинические исследования, посвященные влиянию этих лекарственных средств на частоту переломов (к ним относятся остальные из перечисленных в табл.1 препараты).
Эстрогены (изолированно или в сочетании с гестагенами). Наряду с замедлением костных потерь, уменьшением частоты переломов и снижением показателей резорбции костной ткани заместительная гормональная терапия (ЗГТ) уменьшает проявления урогенитальных расстройств в менопаузе и снижает риск сердечно-сосудистых заболеваний. Кроме того, в последнее время появились данные, свидетельствующие об уменьшении риска развития болезни Альцгеймера на фоне терапии ЗГТ. Женщинам в ранней и средневременной постменопаузе показаны двухфазные препараты. Для терапии и профилактики сенильного ОП женщинам старше 60 лет целесообразно применять (при отсутствии противопоказаний) монофазные (двухкомпонентные) препараты (в том числе ливиал — синтетический стероид с эстрогенными, гестагенными и андрогенными свойствами клиогест), а женщинам с удаленной маткой можно назначать монофазные эстрогенные препараты, в том числе и для наружного применения (пластыри, гели) — эстрофем, климара, дивигель.
Эффект от лечения эстрогенами сохраняется до тех пор, пока продолжается терапия. При прекращении лечения на любом сроке длительной терапии вновь повышаются маркеры костного обмена и потери костной массы возобновляются.
Широкое применение ЗГТ, особенно в пожилом возрасте, ограничено рядом противопоказаний: нарушение функции печени, склонность к тромбообразованию и тромбофлебитам, наличие гиперпластических процессов в матке и молочных железах. Основным недостатком терапии эстрогенами при постменопаузальном ОП является возможность их повреждающего действия на репродуктивные ткани — матку и молочные железы. Включение прогестинов в схему ЗГТ уменьшает риск возникновения этого осложнения, кроме того, в этих случаях рак выявляется на ранней стадии и такие формы имеют хороший прогноз. Риск рака молочных желез невысок при терапии длительностью менее 5 лет, но возрастает на 30-50% при длительном лечении эстрогенами (10-15 лет).
Селективные модуляторы эстрогенных рецепторов (СМЭР) — препараты, являющиеся агонистами эстрогенных рецепторов в отношении таких мишеней, как костная ткань, уровень липидов (через стимуляцию печеночных рецепторов липидов низкой плотности эстрогенным рецептором), и антагонистами эстрогенных рецепторов (и/или минимальными, клинически незначимыми агонистами) по отношению к матке и молочным железам. В настоящее время изучается роль этих препаратов в профилактике и лечении ОП и, возможно, сердечно-сосудистых заболеваний у женщин в менопаузе. К ним относятся: ралоксифен, лазофоксифен, кеоксифен, дролоксифен. В ходе многоцентровых исследований обнаружено, что ралоксифен (СМЭР 2-го поколения) в дозе 60 мг повышает МПКТ в позвоночнике и проксимальных отделах бедренной кости на 2,4%, уменьшает концентрацию холестерина и липопротеидов низкой плотности, не влияя при этом на уровень триглицеридов, снижает риск переломов тел позвонков на 44% в течение 3 лет по сравнению с плацебо (исследование MORE с участием более 7000 пациентов), но не влияет на риск переломов шейки бедра.
Кальцитонины. История применения кальцитонинов для лечения ОП насчитывает около 30 лет. Наибольшее распространение во всем мире (в том числе в Европе и России) получил кальцитонин лосося — миакальцик. Основной механизм действия кальцитонина при ОП — торможение костной резорбции за счет первичного угнетения остеокластической активности и уменьшения количества остеокластов. Исследования убедительно продемонстрировали его быстрый и выраженный анальгетический эффект, обусловленный повышением уровня b-эндорфинов в крови, а также воздействием препарата на метаболизм серотонина и моноаминов в ЦНС. Большинство рандомизированных исследований эффективности кальцитонина, применяющегося для лечения или профилактики постменопаузального и сенильного ОП, показали, что использование инъекционной (100 МЕ/сут) или интраназальной (200 МЕ/сут) формы в течение 1-5 лет приводит к увеличению МПКТ в поясничных позвонках на 1-3% исходного уровня. В настоящее время при длительном лечении предпочтение отдается интраназальной лекарственной форме, что связано с удобством применения (введение 1 раз в день) и хорошей переносимостью. У пациентов с сенильным ОП препараты кальцитонина прежде всего показаны при тяжелых формах ОП с выраженным болевым синдромом как в режиме непрерывного применения, так и при курсовом лечении (2 месяца ежедневно, 2 месяца перерыв) в течение 2-5 лет с обязательным приемом солей кальция, а в ряде случаев и витамина D.
Бисфосфонаты. Бисфосфонаты являются мощными ингибиторами костной резорбции. Разработано несколько поколений бисфосфонатов с разной антирезорбтивной активностью и модифицированными свойствами, зависящими от химической структуры. По степени антирезорбтивной активности бисфосфонаты можно расположить следующим образом (в порядке увеличения активности): этидронат, тилудронат, клодронат, памидронат, алендронат, ризедронат, ибандронат, золедронат. При этом активность золедроната выше, чем у этидроната, в 10 000 раз.
Необходимо отметить, что бисфосфонаты длительно (постоянно) накапливаются в костной ткани и непрерывное лечение большими дозами бисфосфонатов 1-го поколения (этидронат) может вызвать нарушения минерализации вновь образованной кости и ухудшение ее качества. Наиболее полно изучен алендронат, повышающий МПКТ в поясничном отделе позвоночника в зависимости от дозы (5-20 мг) на 6-10 %, в шейке бедра на 4-6% по сравнению с плацебо, а также снижающий риск возникновения новых переломов тел позвонков (на 48%) и переломов другой локализации. Необходимо подчеркнуть, что при лечении алендронатом часто наблюдаются осложнения со стороны желудочно-кишечного тракта (эрозивно-язвенный эзофагит, обострение гастрита или язвенной болезни). Следует помнить и о возможности развития гипокальциемии, что требует дополнительного назначения солей кальция и витамина D.
Препараты, стимулирующие костеобразование, в настоящее время применяются ограниченно. Некоторые из них считаются перспективными, так как для интенсивного прироста утерянной массы кости необходимо формирование новой кости.
Соли фтора, которые начали использоваться для терапии ОП более 35 лет назад, воздействуют на предшественников остеобластов, усиливая синтез ДНК (подтверждено гистологическими исследованиями биоптатов подвздошной кости). Проспективные исследования показали, что фториды (натрия или двунатриевая соль монофторфосфата — оссин, кореберон, тридин, флюокальцик) обеспечивают очень большой прирост МПКТ в трабекулярной костной ткани. При этом низкие или умеренные дозы (15-25 мг иона фтора) действуют эффективнее и реже вызывают побочные реакции, кроме того, терапия не сопровождается нарушениями минерализации костной ткани. Однако, несмотря на существенный прирост МПКТ, факт снижения риска переломов костей при применении фторидов до настоящего времени не доказан. Кроме того, открытым остается вопрос, почему часть пациентов с постменопаузальным ОП не реагирует на терапию фторидами.
Анаболические стероиды. Эти препараты, дольше остальных применяющиеся в лечении ОП, по химической структуре относятся к натуральным андрогенам, отличаясь от них мощным анаболическим воздействием на белковый синтез и значительно меньшим андрогенным эффектом. Важнейшим результатом воздействия анаболических стероидов на костные клетки можно назвать дозозависимое увеличение клеточной пролиферации и повышение активности щелочной фосфатазы, продуцируемой остеобластами. К настоящему времени анаболические стероиды потеряли значение для монотерапии ОП из-за значительного количества побочных эффектов, возникающих при длительном непрерывном применении, особенно у женщин. Однако их с успехом используют пожилые больные с низкой массой тела и мышечной слабостью, при стероидном ОП и ОП у мужчин в комплексной терапии ОП. Предпочтительны инъекционные препараты пролонгированного действия (нандролона деканоат или ретаболил), назначаемые прерывистыми курсами.
Паратиреоидный гормон (ПТГ) является главным регулятором кальциевого обмена, и большинство врачей признают за ним только это свойство, в то время как в последние 20 лет ученым удалось убедительно доказать факт анаболического воздействия ПТГ в режиме малых доз на костную ткань. Результаты небольших открытых исследований по применению ПТГ при ОП у женщин и мужчин показали выраженное увеличение МПКТ в позвоночнике (по данным компьютерной томографии до 30-98%, по результатам двойной фотонной абсорбциометрии — до 12-15%) и отсутствие эффекта в отношении костей с преобладанием кортикальных костных структур. В последние годы вновь возрос интерес к использованию фрагментов ПТГ как для монотерапии ОП, так и в комбинации с другими препаратами (активными метаболитами витамина D, эстрогенами, кальцитонином) в целях дополнительного воздействия на кортикальную кость. Обнадеживающие результаты получены в ходе исследования F. Cosman и соавторами, продемонстрировавшего увеличение МПКТ в позвоночнике на 13%, в проксимальных отделах бедренной кости на 2,7%, во всем теле на 7,8% за 3 года лечения ПТГ в комбинации с ЗГТ. Побочные явления в результате терапии препаратами ПТГ возникают редко. В настоящее время применяется инъекционная лекарственная форма, испытывается ПТГ в виде назального спрея и разрабатываются препараты ПТГ в виде накожного пластыря.
В лечении и профилактике сенильного ОП лидирующие позиции занимают соли кальция и препараты витамина D. Добавки витамина D (800 ЕД холекальциферола или эргокальциферола в день) достаточно эффективны в профилактике переломов шейки бедра у старых женщин, проживающих в домах престарелых. Многие авторы считают, что с лечебными целями при различных видах ОП более целесообразно применение активных метаболитов витамина D. Теоретически это обусловлено наличием мальабсорбции кальция и дефицитом рецепторов к витамину D при многих формах ОП, а также большей доступностью активных метаболитов для тканей-мишеней. Важным свойством активных метаболитов помимо улучшения абсорбции кальция в кишечнике и активации процессов костного ремоделирования является способность подавлять повышенный уровень ПТГ (особенно при сенильном ОП, остеопоромаляции и почечной остеодистрофии) и усиливать нервно-мышечную проводимость, уменьшая проявления миопатии. Необходимо отметить, что длительная терапия активными метаболитами витамина D (альфакальцидолом и кальцитриолом) за 2 года дает прирост массы кости в среднем на 2-3% в позвонках и до 2,5% в периферических костях. В некоторых работах отмечено снижение частоты новых переломов костей (почти на 70%) у больных сенильным ОП, особенно после второго года лечения. Для лечения и профилактики сенильного ОП целесообразно назначение 0,75-1,0 мкг альфакальцидола (Альфа-Д3-Тева) на длительное время, при этом необходим контроль уровня кальция и креатинина один раз в 2-3 месяца. Частота побочных реакций на фоне терапии активными метаболитами витамина D остается низкой. В последние годы опубликованы работы о взаимном усилении эффекта при сочетанной терапии альфакальцидолом (Альфа-Д3-Тева) и эстрогенами, бисфосфонатами, фторидами.
По современным представлениям, дефицит кальция и витамина D может приводить к развитию широкого спектра заболеваний, из которых наиболее опасен ОП. Установлено, что соли кальция играют важную роль в первичной и вторичной профилактике ОП и необходимы в комплексном лечении ОП с большинством антиостеопоротических препаратов. Сейчас проведено 20 проспективных рандомизированных исследований, метаанализ которых показал, что потери МПКТ у лиц, получавших адекватное количество кальция, существенно ниже 1% в год, тогда как у тех, кто не получал добавки кальция, они превышают 1% в год и достоверно выше, чем у предыдущей группы. Особенно велика роль солей кальция в терапии и профилактике сенильного ОП. Большинство исследователей согласны с разработанными Национальным Институтом Здоровья США и опубликованными в 1994 г. рекомендациями по оптимальному потреблению кальция, в соответствии с которыми для женщин в постменопаузе и лиц обоего пола старше 65 лет целесообразно суточное потребление кальция в дозе 1500 мг. При потреблении с пищей менее 1000 мг кальция необходимы его добавки в виде солей кальция.
Как видно из табл. 2, меньше всего кальция в широко распространенном в России глюконате кальция: при назначении 500 мг кальция в день требуется принять 11 таблеток по 0,5 г. Наибольшее количество кальция содержится в карбонате кальция. Анализ результатов контролируемых исследований показал, что лечение препаратами кальция в сочетании с витамином D, особенно у пожилых и старых людей, может привести к снижению частоты переломов костей на 25-70%. Этот эффект особенно выражен у лиц с низким потреблением кальция с пищей (менее 700 мг в день). Кроме того, витамин D (примерно 400-500 ЕД) и кальций (не менее 1000 мг в день) рекомендуется принимать всем больным, получающим глюкокортикоиды.
В настоящее время не вызывает сомнения тот факт, что альфакальцидол (Альфа-Д3-Тева) является универсальным средством терапии и профилактики остеопороза и остеомаляции как в виде монотерапии, так и в комбинации с другими остеотропными препаратами. Анализ данных литературы, посвященной терапии альфакальцидолом у пациентов с различными формами остеопороза, выявил необходимость индивидуального подбора доз препарата в зависимости от вида остеопатий и исходных биохимических, рентгенологических и денситометрических показателей. Для лечения и профилактики ОП целесообразно назначение 0,75-1,0 мкг альфакальцидола (Альфа-Д3-Тева) на длительное время под контролем уровня кальция. Многочисленные исследования показали высокую безопасность длительной терапии альфакальцидолом с низкой частотой возникновения побочных эффектов. При индивидуальном подборе доз гиперкальциемия, легко устраняющаяся при снижении дозировки, отмечена только у 2 пациентов из 200.
Остеопороз - состояние, возникающее при нарушении фосфорно - кальциевого обмена и характеризующееся хрупкостью и повышенной ломкостью волос, ногтей, костей. Причин этого состояния много, и в зависимости от них строится классификация средств, применяемых при остеопорозе.
Классификация средств, применяемых при остеопорозе.
1) Препараты гормонов: кальцитонин, эстрадиол.
2) Препараты витаминов: кальцитриол.
3) Препараты кальция: кальция карбонат.
4) Препараты разных групп: этидронат, стронция ранелат, золедроновая кислота.
Характеристику препаратов гормонов и витамином см. самостоятельно в предыдущих лекциях.
Кальция карбонат выпускается в таблетках и порошках по 0,5. Назначается перорально, 3 раза в день. Действие и применение см. самостоятельно в предыдущих лекциях. Наиболее широкое применение при остеопорозе кальция карбоната из всех других препаратов кальция обусловлено его наименьшим местнораздражающим действием и относительно менее неприятным вкусом.
Этидронат плохо всасывается в ЖКТ, для повышения биодоступности рекомендуется прием препарата натощак. Для профилактики местнораздражающего действия и возникновения тошноты и рвоты рекомендуется препарат обильно запивать. При распределении препарат хорошо накапливается в костном матриксе, поглощается остеокластами. T ½ составляет около 6 часов. Экскретируется с мочой в неизмененном виде.
В организме больного, накапливается в остеокластах, превращается в них в аномальный аналог АТФ, тем самым нарушая жизнеспособность и функции этих клеток.
О.Э. 1) Уменьшает количество остеокластов.
2) Тормозит процесс резорбции костной ткани.
2) Подавляет процессы остеопороза, тем самым стимулируя процессы оссификации.
П.П. 1) Комплексная терапия больных с явлениями остеопороза, в т.ч. в постклимактерический период.
2) Комплексная терапия больных с болезнью Педжета.
3) Комплексная терапия больных с парнеопластической гипер - Са 2+ - емией.
П.Э. Тошнота, рвота, диарея, индивидуальная непереносимость, препарат может стимулировать процессы остеомалиции (иногда это свойство используется при процессах оссификации мягких тканей).
Стронция ранелат (бивалос) - выпускается в дозированном порошоке, в саше по 2,0.
Биодоступность при всасывании препарата в ЖКТ составляет 25%. Совместный прием препаратов ионов Са 2+ и пищи эту биодоступность понижают. Поступая в кровь после абсорбции, препарат на 25% связывается с белками плазмы. Распределяясь, лекарство хорошо накапливается в костной ткани. Экскретируется препарат как с мочой, так и с калом. T ½ достигает 60 часов.
В организме больного стронция ранелат стимулирует процессы репликации предшественников остеобластов и синтез коллагена. Одновременно происходит угнетение дифференцировки остеокластов, понижается их резорбтивное влияние на костную ткань. В результате происходит стимуляция процессов оссогенеза.
О.Э. 1) Увеличивается количество остеобластов.
2) Стимулируется синтез коллагена.
3) Уменьшается число остеокластов и тормозится процесс резорбции костной ткани.
4) Стимулируются процессы оссификации.
П.П. 1) Комплексная терапия больных с явлениями остеопороза, в т. ч. в у женщин в постклимактерический период.
2) Комплексная терапия больных остеопорозом мужчин.
П.Э. Тошнота, рвота, диарея; понижение памяти, головная боль; дерматит; миопатия; боль в костях, суставах; индивидуальная непереносимость.
Золедроновая кислота (золерикс, резорба, акласта) - выпускается в 0,08% растворе во флаконах по 5 или 6,5 мл.
Назначается в/в капельно 1 раз в день по особым схемам. Хорошо всасывается, в крови на 22% связывается с белками плазмы. Преимущественно накапливается в костной ткани, до 60% введенной дозы. Препарат практически не метаболизируется в организме, большая часть в неизмененом виде экскретируется с мочой, и не более 3% - с калом. T ½ в среднем сотавляет около 1 часа.
Механизм действия препарата до сих пор недостаточно ясен. Тем не менее, при его применении возникают следующие эффекты.
О.Э. 1) Блокирует активность остеокластов, усиливает процессы их апоптоза.
2) Тормозит процесс резорбции костной ткани.
3) Уменьшает выход ионов Са 2+ из костей под воздействием факторов, высвобождающихся из костных опухолей.
П.П. 1) Комплексная терапия больных с явлениями гипер - Са 2+ - емии.
2) Комплексная терапия больных с множественной миеломой, костными метастазами солидных опухолей.
П.Э. Тошнота, рвота, запор; возбуждение ЦНС; одышка, понижение АД; угнетение кроветворения, учащение инфекций МВП, анемия; боль в костях, мышцах; гипофосфат -, кали -, магниемия; нефротоксичность; лихорадка, конъюнктивит, индивидуальная непереносимость, возможна прогрессия сопутствующих опухолей.
Кальций и витамин D имеют ключевое значение для поддержания здоровья костной ткани. Однако на протяжении последнего десятилетия их эффективность в профилактике остеопороза (ОП) вызывает споры, учитывая неоднозначность результатов контролируемых клинических исследований. Более того, высказываются опасения по поводу безопасности кальция для сердечно-сосудистой системы. Тем не менее, результаты нескольких метаанализов клинических исследований показали, что применение препаратов кальция ± витамина D у людей пожилого возраста, прежде всего женщин, задерживает снижение минеральной плотности костной ткани и вызывает уменьшение риска переломов. Убедительных данных в пользу увеличения риска сердечно-сосудистых исходов на фоне приема кальцийсодержащих препаратов также не получено. Препараты кальция и витамина D не заменяют бисфосфонаты и другие антиостеопоротические препараты у пациентов с ОП, однако лечение ОП необходимо всегда проводить на фоне адекватного потребления кальция и витамина D с пищей или в виде пищевых добавок. Назначение комбинированных препаратов, содержащих кальций и витамин D, необходимо также пациентам, получающим глюкокортикостероиды, даже в низких дозах, в течение более 3 мес, для профилактики стероидного ОП.
Остеопороз (ОП) – это самое распространенное заболевание костной ткани, характеризующееся снижением костной массы, ухудшением микроархитектуры и повышением хрупкости костей, которые приводят к увеличению риска переломов. В 2010 году в странах Европейского Союза расчетное число пациентов с ОП составляло 27,5 млн человек, в том числе 22 млн женщин [1], а в США – 10,2 млн [2]. При этом число людей со сниженной костной массой в несколько раз выше и, например, в США достигает 43,4 млн. По данным российского эпидемиологического исследования, ОП имеется примерно у каждой третьей женщины и каждого четвертого мужчины в возрасте 50 лет и старше [3]. Ожидается, что в Европе ежегодное число остеопоротических переломов (ОПП) увеличится с 3,5 млн в 2010 году до 4,5 млн в 2025 году, или на 28% [2]. Ежегодные затраты, связанные с ОП, в странах Европейского Союза в 2010 году составили 37 млрд евро, а в России прямые медицинские и немедицинские затраты на лечение ОПП за 1 год могут приближаться к 25 млрд руб. [4].
Важную роль в патогенезе ОП играет недостаточное потребление кальция и витамина D с пищей, поэтому на протяжении многих лет комбинированные препараты, содержащие эти и другие минералы, широко используют как для профилактики, так и лечения (в комбинации с бисфосфонатами или другими средствами) ОП. Дефицит кальция может препятствовать достижению адекватной пиковой костной массы у подростков и способствовать ее снижению у людей пожилого возраста.
Актуальность проблемы дефицита кальция была недавно подтверждена результатами крупного исследования, которое проводилось под эгидой Международного фонда остеопороза (IOF) [5]. В соответствии с рекомендациями IOF 2014 г. мужчины в возрасте от 50 до 70 лет должны потреблять 1000 г кальция в сутки, а женщины в возрасте старше 50 лет и мужчины в возрасте старше 70 лет – 1200 мг/сут [6]. По данным проведенного анализа, в 74 странах мира среднее потребление кальция с пищей варьировалось от 175 до 1233 мг/сут. Однако во многих странах Азии оно не превышало 500 мг/cут, а в большинстве стран Африки и Южной Америки составляло от 400 до 700 мг/сут. Среднее потребление кальция с пищей превышало 1000 мг/сут только в странах Северной Европы, а в России составило около 780 мг/сут. Во многих странах пониженное потребление кальция с пищей отмечалось преимущественно у женщин и людей пожилого возраста, для которых адекватное поступление этого минерала имеет особое значение. По данным других исследований, в нашей стране дефицит потребления кальция с пищей определялся у 60-90% россиян [7,8]. В рекомендациях Российской ассоциации по ОП указано, что в среднем российские женщины в возрасте 50 лет и старше потребляют менее 700 мг кальция в сутки, поэтому большинство из них нуждаются в увеличении потребления молочных продуктов или добавлении препаратов, содержащих как минимум 500 мг кальция, чтобы обеспечить рекомендуемое его потребление в 1200 мг/сут [9].
Сходные данные были получены и при анализе распространенности дефицита витамина D в популяции. J. Hilger и соавт. проанализировали 195 исследований, проводившихся в 54 странах более чем у 168000 участников [10]. Средние сывороточные уровни 25-гидроксивитамина D в популяции варьировались в широких пределах, однако в 37% исследований они были ниже 50 нмоль/л, что указывало на дефицит витамина. Результаты эпидемиологических исследований свидетельствуют о том, что частота недостаточности витамина D в популяции достигает 50%, а выраженный дефицит витамина наблюдается у 1 млрд человек [11]. Факторы, способствующие развитию дефицита витамина D, включают в себя недостаточное его потребление с пищей, преимущественное пребывание в закрытых помещениях, загрязнение окружающей среды, которое ограничивает воздействие на человека солнечного света, необходимого для активации синтеза витамина D из 7-дигидрохолестерина в эпидермисе.
Минеральная плотность костной ткани
Результаты некоторых исследований свидетельствуют о том, что минеральная плотность костной ткани (МПКТ) зависит от потребления кальция с пищей. Например, в Корее подобная ассоциация была изучена более чем у 4600 мужчин и женщин в возрасте старше 50 лет, распределенных на группы в зависимости от потребления кальция и сывороточной концентрации 25-гидроксивитамина D [12]. Недостаточное потребление кальция ассоциировалось с более низкой МПКТ в области шейки бедра как при более низкой, так и более высокой сывороточной концентрации 25-гидроксивитамина D. Полученные данные свидетельствовали о том, что более высокие сывороточные уровни витамина D не позволяют компенсировать дефицит потребления кальция с пищей.
J. Wu и соавт. оценивали эффективность кальция в профилактике снижения МПКТ на основании метаанализа 17 контролируемых клинических исследований у 2537 женщин постменопаузального возраста [13]. Результаты моделирования показали, что возраст и количество кальция, поступающего с пищей, были ключевыми факторами, влиявшими на изменение МПКТ. У женщин в возрасте 50, 60, 70 и 80 лет, потребляющих 1200 мг кальция в сутки в течение 2 лет, можно ожидать увеличения МПКТ на 1,33%, 1,94%, 2,60% и 3,27%, соответственно, в то время как при потреблении кальция в дозе 700, 1200, 1300 и 2000 мг/сут в течение того же срока у женщины в возрасте 60 лет степень увеличения МПКТ может составить 1,62%, 1,94%, 1,97% и 2,13%, соответственно. Таким образом, адекватное суточное потребление кальция составило 1200 мг/сут, так как дальнейшее его увеличение не приводило к существенному дополнительному эффекту на МПКТ у женщин постменопаузального возраста.
У женщин быстрое снижение МПКТ начинается за 1 год до последней менструации и продолжается в течение примерно 2 лет после наступления менопаузы, после чего скорость снижения МПКТ замедляется [14]. В течение указанного 3-летнего периода средняя скорость снижения МПКТ в области поясничных позвонков и шейки бедра составляет 2,5% и 1,8% в год, соответственно [15]. За 5 лет степень снижения МПКТ достигает 10%, а увеличение потребления кальция позволяет нивелировать или по крайней мере уменьшить этот эффект.
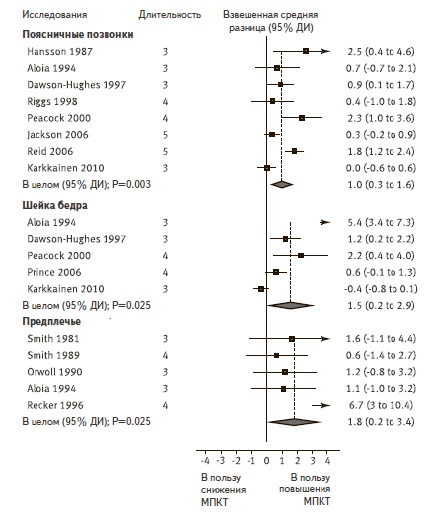
Рис. 1. Результатымета-анализаклиническихисследований, в которых изучалось влияние кальция и витамина DнаМПКТ
V. Tai и соавт. провели мета-анализ 59 рандомизированных контролируемых исследований, в которых изучалось влияние кальция (±витамина D) на МПКТ у лиц в возрасте старше 50 лет (подавляющее большинство участников исследований составили женщины) (рис. 1) [16]. В 15 исследованиях (n=1533) оценивали результаты потребления кальция с пищей, а в 51 исследовании (n=12257) изучали кальцийсодержащие препараты. Увеличение потребления кальция с пищей привело к увеличению МПКТ в области бедренной кости и всего скелета на 0,6-1,0% через 1 год и МПКТ в области бедренной кости, поясничных позвонков, шейки бедра и всего скелета на 0,7-1,8% через 2 года. Существенных изменений МПКТ в области предплечья выявлено не было. Применение препаратов кальция ассоциировалось с увеличением МПКТ в области бедренной кости, шейки бедра, поясничных позвонков, предплечья и всего скелета на 0,7-1,8% через 1, 2 и 2,5 года (рис. 1). Степень увеличения МПКТ в более поздние сроки была сопоставимой с таковой в течение первого года. Монотерапия препаратами кальция и препаратами, содержащими кальций и витамин D, оказывала сопоставимое влияние на МПКТ. Это согласуется с результатами мета-анализов, которые свидетельствуют о том, что витамин D сам по себе не вызывает увеличения МПКТ [17,18].
Таким образом, адекватное потребление кальция с пищей ассоциируется с более высокой МПКТ в области шейки бедра, а увеличение потребления кальция с пищей или применение кальцийсодержащих препаратов у женщин в период перименопаузы вызывает умеренное увеличение МПКТ в области различных костей и всего скелета.
Риск падений
Непосредственной причиной переломов у людей как без ОП, так и с ОП являются падения, частота которых увеличивается с возрастом. Витамин D и кальций принимают участие в регуляции мышечной функции, поэтому была высказана гипотеза о том, что их применение может способствовать улучшению силы мышц и снижению риска падений. В нескольких исследованиях было показано, что низкие сывороточные концентрации 25-гидроксивитамина D, особенно менее 20 нг/мл (50 нмоль/л), ассоциируются с увеличением риска падений [19,20].
K. Stockton и соавт. при мета-анализе 17 рандомизированных контролируемых исследований (n=5072) не выявили увеличения силы мышц при применении витамина D у взрослых с сывороточной концентрацией 25гидроксивитамина D >25 нмоль/л [21]. В то же время в других исследованиях у пациентов с концентрацией 25гидроксивитамина D
Профилактика переломов
Эффективность препаратов кальция и витамина D в профилактике ОПП изучались в многочисленных исследованиях, в которые включали людей пожилого возраста, преимущественно женщин. В самом крупном рандомизированном контролируемом исследовании (WHI) приняли участие 36282 американки в возрасте от 50 до 79 лет, которые получали кальция карбонат, содержащий 1000 мг элементарного кальция, + витамин D в дозе 400 МЕ/сут или плацебо [28]. Примерно 10% из них перенесли переломы в возрасте старше 55 лет. Длительность наблюдения составляла 7 лет. В конце периода наблюдения МПКТ бедренной кости в основной группе была на 1,06% выше, чем в контрольной (р
Нежелательные эффекты кальция и витамина D
На протяжении последнего десятилетия продолжаются споры по поводу возможных нежелательных эффектов применения кальция, в частности повышения риска сердечно-сосудистых исходов [52]. Еще в 2008 году в 5-летнем рандомизированном клиническом исследовании Auckland Calcium Study было выявлено увеличение риска инфаркта миокарда у пожилых женщин, получавших препарат кальция, по сравнению с таковым в группе плацебо [53]. Сходные данные были получены в нескольких мета-анализах. Например, M. Bolland и соавт. при анализе рандомизированных контролируемых исследований препаратов кальция показали, что применение кальция и витамина D ассоциировалось с увеличением риска инфаркта миокарда на 25% и суммарного риска инфаркта миокарда и инсульта на 15% [54]. Увеличение риска сердечно-сосудистых исходов при лечении препаратами кальция было отмечено также в когортных исследованиях, проводившихся в Швеции и Финляндии [55,56]. В основе неблагоприятного эффекта кальция на сердечно-сосудистую систему может лежать преходящая гиперкальциемия, способствующая развитию кальциноза сосудов.
Однако увеличение риска сердечно-сосудистых исходов под действием кальция не было подтверждено в других крупных исследованиях и мета-анализах. Например, в исследовании WHI не было отмечено увеличения риска инфаркта миокарда, коронарной болезни сердца, инсульта или любых сердечно-сосудистых исходов у женщин, получавших кальций и витамин D, как во всей выборке, так и в выборке пациенток, которые не получали подобные препараты до исследования [29]. Следует отметить, что в этом исследовании лечение препаратом кальция и витамином D ассоциировалось с увеличением риска образования камней в почках, хотя частота нефролитиаза в основной и контрольной группах составила всего 0,35% и 0,30%, соответственно. Неблагоприятный эффект кальция на риск сердечно-сосудистых осложнений не был установлен и в мета-анализе, проводившемся под эгидой Амери кан ского национального фонда остеопороза [57]. На основании полученных данных Национальный фонд остеопороза и Американское общество профилактической кардиологии опубликовали совместное заявление, в котором указано, что применение кальция ± витамина D с пищей или в виде пищевых добавок не сопровождается увеличением риска сердечно-сосудистых или цереброваскулярных осложнений и смерти от любых причин у здоровых взрослых людей, а потребление кальция в дозе не более 2000-2500 мг/сут можно считать безопасным для сердечно-сосудистой системы [58].
Заключение
Адекватное потребление кальция и витамина D с пищей или в виде пищевых добавок является основой профилактики ОП. В клинических исследованиях длительное применение препаратов кальция и витамина D у женщин постменопаузального возраста задерживало снижение МПКТ и вызывало снижение риска переломов. Последний эффект был более выраженным при высокой приверженности к лечению. Препараты кальция и витамина D не могут служить альтернативой бисфосфонатам и другим антиостеопоротическим средствам у пациентов с ОП, однако лечение ОП необходимо проводить на фоне адекватного потребления кальция с пищей или в виде пищевых добавок. ОП часто осложняет лечение ГКС, которые по-прежнему широко используют для лечения различных иммуновоспалительных заболеваний. Снижение МПКТ наблюдается даже при относительно непродолжительном применении этих препаратов в небольших дозах. В связи с этим все больные, получающие ГКС в дозе ≥2,5 мг/сут в пересчете на преднизолон в течение по крайней мере 3 мес, нуждаются в адекватном потреблении кальция и витамина D c целью профилактики стероидного ОП. Результаты клинических исследований и мета-анализов не позволяют сделать вывод о том, что применение кальция ассоциируется с увеличением риска сердечно-сосудистых исходов у здоровых людей.
Читайте также:


