Врожденные инфекции у новорожденных реферат
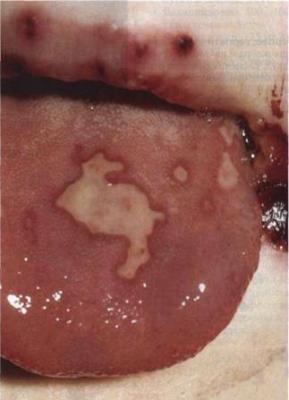
Герпетическая инфекция – самая распространенная вирусная инфекция человека, существующая в организме преимущественно в латентной форме и проявляющаяся на фоне иммунодефицитных состояний поражениями кожи, слизистых оболочек, глаз, печени и ЦНС. Это наиболее часто диагностируемая инфекция среди врожденных и неонатальных болезней.
Актуальность. Инфицированность взрослого населения вирусами простого герпеса достигает 90-95%. За последние годы во всем мире констатируют увеличение количества случаев заболевания герпетической инфекцией новорожденных. Смертность от неонатального герпеса достигает 50-70%. Здоровыми остаются только 15%, многие дети в последующем страдают тяжелыми неврологическими заболеваниями.
Этиология. Вирус простого герпеса входит в семейство герпес-вирусов, подразделяется на вирус простого герпеса 1 типа – лабиальный и вирус простого герпеса 2 типа — генитальный. Наиболее опасен для плода генитальный герпес.
Вирус простого герпеса состоит из трех основных компонентов: нуклеотида, капсида и липидосодержащей оболочки. Геном представлен линейной двухнитчатой ДНК.
Эпидемиология. Естественным хозяином вируса простого герпеса является человек. Пути передачи инфекции:
- половой (является основным для вируса простого герпеса 2 типа);
- контактный (при прохождении плода через родовые пути матери во время родов частота инфицирования составляет 40-50%, заболеваемость – 20%, смертность – 40%);
-вертикальный (риск трансмиссии при первичной инфекции беременной составляет 50%, при первом клиническом проявлении непервичной инфекции – до 33%, при рецидиве герпетической инфекции– до 3%);
Наиболее часто плоду заболевание передается во время родов от матери, у которой инфицированы родовые пути и, нередко, имеется хроническая инфекция мочевых путей. Входными воротами могут быть травмированные кожные покровы, слизистые губ, ротовой полости, носа, конъюнктивы и гениталий. Вертикальная передача инфекции от матери к плоду может происходить через поврежденную и даже неповрежденную плаценту. Заражение сопровождается репликацией вируса на месте инвазии. Далее он способен распространяться неврогенно, лимфо- и гематогенно. Излюбленной локализацией являются сенсорные ганглии, где инфекция может длительно сохраняться.
Клиническая картина. Симптомы. Проявления врожденной герпесной инфекции зависят от сроков заражения. Установлена достоверная связь герпесной инфекции с пороками развития желудочно-кишечного тракта, сердца, мочеполовой системы, скелета, врожденных рубцовых деформаций кожи. Вирус герпеса может вызывать органическое поражение ЦНС (микро- и гидроцефалию, ДЦП, эпилепсию), цирроз печени, неонатальныйгепатит, тяжелые поражения глаз, легких, кожи и слизистых. Инкубационный период колеблется от 2-х до 30 дней. Выделяют 3 клинических формы герпесной инфекции у новорожденных:
1) Локализованная форма с поражением кожи и слизистых полости рта, глаз – встречается у 20-40 % больных. Характеризуется наличием единичных или множественных везикулярных элементов на различных участках тела при отсутствии признаков системной воспалительной реакции. Пузырьки размером 1,5-2 мм на фоне эритемы и отека. Чаще всего они появляются на 5-14-й дни жизни. При их вскрытии образуются эрозии с гладким дном. На месте эрозий может быть нестойкая пигментация, процесс заживления длится примерно 10-14 дней. Возможно развитие герпетических кератоконъюнктивита, хориоретинита, эрозий роговицы, увеита, эписклерита или иридоциклита. В ряде случаев наблюдается специфический неврит зрительного нерва. При отсутствии специфического лечения у 50-70% новорожденных локализованная кожная форма может привести к генерализации процесса или к поражению центральной нервной системы.
2) Генерализованная форма составляет от 20 до 50% случаев неонатального герпеса. Начало болезни чаще на 5-11-й день жизни, однако возможно и более раннее проявление в первые 24-48 часов жизни. Клинические симптомы неспецифичны и напоминают неонатальный сепсис: вялость, срыгивания, повышение или снижение температуры тела, выраженное нарушение микроциркуляции, апноэ, цианоз, одышка, иногда признаки пневмонии. Характерным является вовлечение в патологический процесс печени и надпочечников. Наблюдаются увеличение селезенки, гипогликемия, гипербилирубинемия, ДВС-синдром, признаки инфекционно-токсического шока. У 50-60% больных отмечаются симптомы герпетического менингоэнцефалита. Специфические высыпания на коже и слизистых появляются на 2-8-ой дни от начала заболевания, однако, у 20% новорожденных с генерализованной формой ГИ кожных элементов не обнаруживают.
3) Герпетические поражения центральной нервной системы (энцефалит, менингоэнцефалит) составляют около 30% случаев. Развитие клинических симптомов заболевания в большинстве случаев наблюдается на 2-3-й неделе жизни (12-17-й дни жизни). Заболевание начинается с подъема температуры тела, вялости, чередующейся с эпизодами повышения возбудимости, тремора, снижения аппетита, вслед за которыми быстро развиваются плохо купирующиеся фокальные или генерализованные судороги. Ликвор вначале может быть не изменен, затем обнаруживается увеличение содержания белка и цитоз лимфоцитарного или смешанного характера. У 40-60 % больных отсутствуют специфические герпетические высыпания на коже и слизистых. При антенатальном заражении возможно рождение детей с микроцефалией, гидроцефалией, наличием внутричерепных кальцификатов.
Диагностика герпесной инфекции:
• Особое значение имеет оценка специфического анамнеза матери (хроническая соматическая патология, эрозия шейки матки, сальпингоофорит, кольпит, самопроизвольные аборты, неразвивающаяся беременность, антенатальная гибель плода, герпетические высыпания на коже и слизистых у матери во время данной беременности).
• Клинический осмотр больного: у детей, родившихся от матерей с острой или рецидивирующей герпесной инфекции, осмотр кожи и слизистых оболочек необходимо проводить с особой тщательностью с целью раннего выявления герпетических элементов.
• При возникновении у новорожденного судорог неясной этиологии показано проведение люмбальной пункции. При герпетическом менингоэнцефалите в ликворе отмечаются высокая концентрация белка и лимфоцитоз/ моноцитоз.
• При возникновении у новорожденного клиники сепсиса, при котором не удается добиться эффекта от целенаправленной антибактерильной терапии, необходимо проводить лабораторные исследования на герпесную инфекцию.
• Дополнительные клинико-лабораторные и клинико-инструментальные исследования (клинический и биохимический анализы крови и мочи, нейросонография, компьютерная томография головного мозга, по показаниям – ЭЭГ, коагулограмма, компьютерная томография, рентгенограмма органов грудной клетки) позволяют оценить состояние отдельных органов, систем и степень их вовлечения в патологический процесс.
• Герпетическая этиология заболевания должна быть подтверждена специальными лабораторными методами:
- цитологическая диагностика, основанная на исследовании под микроскопом тканевых препаратов, окрашенных по методу Райт-Гимза, Папаниколау;
- содержимое везикул можно исследовать прямым иммунофлюоресцентным методом для обнаружения антигена вируса простого герпеса;
- обнаружение генома вируса в крови и ликворе методом полимеразной цепной реакции (чувствительность метода – 95%, специфичность – 90-100%, время анализа – 1-2 дня);
• Патоморфология плаценты. Макроскопически оболочки плаценты желтоватые, мутные. При гистологическом исследовании выявляется базальный децидуит. Типичные герпетические клетки имеют крупные размеры, в ядре – базофильные включения, окруженные ободком просветления. Цитоплазма клеток вначале слабо базофильна, затем резко ацидофильна. Во всех поврежденных ворсинах происходит активация фиксированных макрофагов (клеток Гофбауэра-Кащенко). В базальной пластинке обнаруживаются кровоизлияния, отложения фибрина и образование тромбов, множественные очаги некроза и кальциноза.
Среди растительных препаратов, обладающих заметным противовирусным действием, в лечении герпетической инфекции чаще других используются производные солодки и зверобоя. Этисредства применяются в основном местно. Так, эпиген, производимый на основе солей глицирризиновой кислоты, заметно сокращает сроки заживления кожно-слизистых поражений.
При генерализованной форме инфекции в условиях иммунодефицитного состояния в комплексной терапии новорожденных, в том числе недоношенных детей, могут быть использованы полиспецифические внутривенные иммуноглобулины (Октагам, Интраглобин, Сандоглобин, Пентаглобин) и иммуноглобулины с высоким титром антител к вирусу простого герпеса. Неотъемлемой частью патогенетической терапии герпесной инфекции является также использование препаратов интерферонового ряда: Виферон-1 в свечах (доза 150 000 МЕ 1 раз в сутки per rectum в течение 5 дней). Поддержание жизненно важных функций организма ребенка при генерализованной форме неонатального герпеса проводится в соответствии с общими принципами интенсивной терапии. Важное место в лечении герпетического менингоэнцефалита занимает адекватная противосудорожная терапия. Прекращать вскармливать ребенка грудным молоком не имеет смысла, так как даже при первичной инфекции у матери проникновение ВПГ в молоко маловероятно. Исключение составляют случаи, когда у матери герпетические высыпания располагаются на груди.
Профилактика герпесной инфекции.
1) Выявление беременных высокого риска:
а) тщательный сбор анамнеза с целью выявления эпизодов генитального герпеса;
б) тщательное клиническое обследование родовых путей, промежности и вульвы в процессе наблюдения в женских консультациях и перед началом родов; в) вирусологическое подтверждение герпесподобных генитальных поражений у всех женщин, планирующих беременность.
2) Ведение беременности и родов должно основываться на клинических принципах и анамнезе:
а) у женщин с первичным клиническим эпизодом герпесной инфекции менее чем за 6 недель до родов, необходимо плановое кесарево сечение;
б) если эпизод имел место более, чем за 6 недель до родов, возможно родоразрешение через естественные родовые пути; для снижения риска обострения заболевания к моменту родов целесообразно применение ацикловира с 36 недель беременности;
в) диссеминированная и тяжелая первичная материнская инфекция требуют терапии ацикловиром вне зависимости от срока беременности;
г) при наличии генитального герпеса у матери и родов естественным путем новорожденные подлежат обследованию и проведению профилактической терапии ацикловиром. При получении отрицательного результата лабораторного обследования на герпесную инфекцию и отсутствии клинических проявлений заболевания противовирусная терапия прекращается.
Исходы неонатальной герпесной инфекции. При раннем назначении антивирусной терапии летальность при генерализованных формах инфекции составляет менее 50%, тогда как при отсутствии специфического лечения – 90%; при менингоэнцефалитах – 14%. Частота неврологических осложнений колеблется от 10 до 43%; рецидивы кожных проявлений в первые 6 месяцев жизни наблюдаются у 46% детей.
реферат Болезни новорожденных
Сепсис.
Сепсис новорожденных - генерализованная форма гнойно-воспалительной инфекции, вызванной условно-патогенной бактериальной микрофлорой, патогенез которой связан с дисфункцией иммунной системы (преимущественно фагоцитарной) с развитием неадекватной системной воспалительной реакции (СВР) в ответ на первичный септический очаг.
Частота заболеваемости варьирует среди доношенных детей от 0,6 до 2 на 1000 новорожденных, а среди недоношенных от 33 до 71 на 1000 (данные на 1980 год в Болгарии, в настоящее время ситуация по заболеваемости сепсисом значительно серьезнее). Это обусловлено прежде всего пониженной общей и местной сопротивляемостью организма новорожденных по отношению к инфекции - физиологической неполноценностью защитных реакций, незначительной фагоцитарной способностью со слабой реакцией лимфатических узлов к локализации инфекции, состоянием барьерных функций организма: ретикуло-эндотелиальной системы, печени, выделительной системы, нервной трофики, незрелостью регуляторных и иннервационных механизмов. Организм новорожденного не локализирует, а генерализирует воспалительные процессы. Основное значение имеет функциональное состояние центральной нервной системы. Более половины случаев сепсиса наблюдается среди новорожденных. Сепсис не является строго определенной нозологической единицей, а представляет собой общее заболевание организма, вызванное бактериемией или бактериотоксемией. Сепсис у новорожденных рассматривают как инфекцию при измененной реактивности организма под влиянием его сенсибилизации к микробам и токсинам, исходящим из местного гнойного очага. Для развития сепсиса у новорожденного важное значение имеет то обстоятельство, что ребенок не получает от матери иммунных тел против септических инфекций. Это иммунная недостаточность, характерная для сепсиса у новорожденных и недоношенных детей. Она, фактически, и определяет клиническую картину.
Возбудителями сепсиса у новорожденных чаще всего являются гемолитические стрептококки и стафилококки, реже пневмококки, грамотрицательные стрептококки группы В, о которых меньше всего думают, Bact. coli, сальмонеллы и др. Для развития заболевания имеют значение не столько микроорганизмы и массивность инфекции, сколько реакция макроорганизма.
Заражение может произойти: 1) внутриутробно, 2) во время родов и 3) после рождения. Внутриутробное заражение происходит через плаценту. Любое инфекционное заболевание у беременной, сопровождающееся температурой, представляет опасность для ребенка. При внутриутробном заражении наступающие у ребенка поражения являются не столько результатом воздействия бактериальной инфекции, сколько их токсинов. Здоровая плацента служит барьером для корпускулярных элементов, но через нее легко проходят растворимые токсины, гематогенным путем попадающие в плод, наступает токсемия, которая может быть причиной гибели плода еще в утробе матери. В таких случаях кожа и слизистые погибшего плода мацерированы с петехиальной сыпью, в полостях тела кровянистые и серозные транссудаты, жировая дегенерация печени. Воротами для внутриутробной инфекции чаще всего служат легкие при аспирации околоплодных вод.
Во время родов заражение может произойти при аспирации или глотании плодом в околоплодных вод или инфицированных материи из родовых путей. Во время родов заражение может произойти и через..пупок.
После рождения заражение новорожденного может произойти через воздух, нечистые руки обслуживающего персонала, нечистое белье, молоко матери, если она больна сепсисом. Послеродовые заболевания матери способствуют развитию септических заболеваний у новорожденного. Входными воротами для инфекции могут служить мельчайшие раны и царапины кожи и слизистых, дыхательные пути, пищеварительный тракт, половые органы у девочек, конъюнктивы. Для развития у новорожденных энтерогенного сепсиса имеет большое значение функциональная недоразвитость и повышенная проницаемость кишечника, физиологическая гиперемия его слизистых и раздражение пищей. Но в большинстве случаев входными воротами все-таки является пупок, точнее пупочная рана и культя пупочного канатика. Даже и при криптогенном сепсисе нередко существует нераспознанная инфекция пупка, особенно пупочных кровеносных сосудов. Скворцов считает, что пупочный сепсис может появиться и позднее - в конце первого месяца.
Стафилококковый сепсис может начать свое распространение с инфицирования пупка, иногда - с пиодермии; в некоторых случаях ворота инфекции не удается обнаружить. В большинстве случаев заболевание начинается на второй неделе жизни. Признаками сепсиса являются: остановка кривой веса, плохое общее состояние, метеоризм, сероватый цвет кожи, иногда - желтуха,кровотечения, увеличение печени и селезенки. Сепсис у новорожденных не всегда сопровождается высокой температурой и лейкоцитозом. Стафилококковый сепсис часто начинается с омфалита и тромбофлебита пупочных сосудов. Стафилококковая инфекция может вызвать также остеомиелит, пневмонию, эмпиему и менингит.
Общие признаки коли-сепсиса аналогичны описанным выше признакам стафилококкового сепсиса. Входными воротами инфекции является кишечник. Заболевание часто вызывает только общие симптомы, и локализацию инфекции обнаружить не удается. Довольно типичным локальным проявлением служит менингит. Коли-менингит является самым частым видом бактериальных менингитов у новорожденных. Тот факт, что непатогенные бактерии, являющиеся элементом нормальной флоры кишечника (при искусственном вскармливании), могут стать причиной сепсиса или менингита в первые 10-14 дней жизни, объясняется отчасти отсутствием иммуноглобулина М. Диагностировать менингит у новорожденного - задача нелегкая. Обычно отмечается выбухание родничка, иногда менингит начинается с появления судорог, другие признаки могут появиться позже. При малейшем подозрении следует произвести люмбальную пункцию.
Симптомы сепсиса очень разнообразны. Строго определенных симптомов не существует. Они зависят от характера инфекции, от реактивной способности организма и от поражения отдельных органов и систем. Начальные признаки: анорексия, отказ от груди, падение веса, беспокойство, тяжелое общее состояние. Температурная кривая не характерна. Температура у новорожденных может быть и нормальной, а у недоношенных детей даже и субнормальной. В ряде случаев она повышена и носит ремиттирующий или интермиттирующий характер. Ребенок быстро слабеет, становится вялым и безучастным к окружающей среде. Цвет кожи приобретает характерный для сепсиса у новорожденных серовато-желтый оттенок, а позднее появляется и ясно выраженная желтушность (однако кожа бледнее, чем при icterus gravis). Желтуха, появляющаяся на второй неделе после рождения, всегда подозрительна в отношении сепсиса. Септициемия - одна из основных причин гемолитической желтухи, является серьезным признаком. С развитием болезни к этим симптомам присоединяются и другие: срыгивания, рвоты, поносы, на коже появляется разнообразная сыпь (эритемная, скарлатино-кореподобная, как при крапивнице и др.), быстро исчезающие отеки (oedema fugas), склередема и склерема преимущественно у недоношенных детей, а также кровоизлияния в кожу, кровотечения из пупочной раны, Носоглотки, мочевых путей, рвоты кровью, мелена, кровотечения из влагалища и пр. Существуют и симптомы со стороны нервной системы: апатия, беспокойство, иногда потеря сознания, судороги, симптомы менингита или энцефалита. Селезенка и печень, как правило, увеличиваются. По данным периферической крови отмечается ясно выраженная гипохромная анемия и в большинстве случаев лейкоцитоз, с полинуклеозом, сдвигом лейкоцитарной формулы влево и часто с токсическими грануляциями. В большинстве случаев находят и юные формы. Количество моноцитов обыкновенно увеличено. Лейкопения с гранулоцитопенией являются плохими признаками. Характерна тромбопения. В порядке исключения наблюдается токсическое поражение костного мозга с агранулоцитозом и панмиелофтизмом. СОЭ всегда ускорена. Гемокультура не всегда положительна. В моче выявляется альбумин, а в осадке - гиалиновые и гранулированные цилиндры, почти всегда эритроциты и лейкоциты, а иногда и сами возбудители. Заболевание протекает или быстро и смертоносно с тяжелыми общими явлениями без метастазов, с прогрессирующей слабостью сердечной деятельности и тяжелыми изменениями в паренхиматозных органах, или с локализированными гнойными метастазами в самых различных органах при неясно выраженных общих явлениях. В таких случаях наблюдаются остеомиелиты, гнойные воспаления суставов, кожные абсцессы и гнойные воспаления целого ряда внутренних органов, абсцессы легких, гнойные плевриты, перикардиты, перитониты, менингиты и пр. При перитоните живот вздувается, брюшная стенка становится напряженной, появляется внезапная неукротимая рвота, понос и быстро развивающееся обезвоживание. При поражении мозговых оболочек, помимо общих симптомов, родничок сильно напряжен, взгляд ребенка устремлен в одну точку (смотрит вдаль), появляются судороги.
Сепсис у недоношенных детей протекает более вяло, подостро, с явлениями постепенно нарастающего истощения без каких-либо определенных симптомов.
Диагноз вообще труден. Неопределенные общие симптомы в начале заболевания нередко неправильно истолковывают и таким образом упускают ценное время для раннего начала лечения. Каждый новорожденный, внезапно проявляющий нежелание сосать и отказывающийся от груди, с бледным, серовато-желтым цветом кожи, всегда подозрителен в отношении сепсиса.
При тяжелых общих явлениях без увеличения селезенки и без гнойных метастазов диагноз труден. Сепсис часто принимают за кровоизлияния в мозг, icterus gravis или пневмонию. При icterus gravis желтуха ранняя, появляется еще в первый день, ясно выражена, в то время как при сепсисе желтуха поздняя и менее выражена. Признаки кровоизлияний в мозг появляются еще в первый или на второй день жизни, а при сепсисе симптомы заболевания появляются позднее - в конце первой и в начале второй недели. Наличие тяжелых общих явлений, различных высыпаний на коже, а также кровоизлияний в кожу и другие органы облегчают диагноз. Для уточнения диагноза при сепсисе важное значение имеет лейкоцитоз с полинуклеозом и сдвигом лейкоцитарной формулы влево, токсические грануляции и тромбопения. Исследование гемокультуры подтверждает диагноз, но не всегда абсолютно.
Прогноз плохой, но не безнадежный. Чем позднее начато лечение, тем меньше надежды на выздоровление. Токсическое поражение печени, сопровождающееся желтухой, гипопротромбинемические кровоизлияния и пр. являются прогностически неблагоприятными признаками. Имеет значение общее состояние ребенка и его резистентность, особенно у недоношенных детей, среди которых смертность в 4 раза выше, чем среди доношенных.
Профилактика
1. Предупреждение острых инфекционных заболеваний, сопровождающихся температурой у всех беременных женщин в последние месяцы беременности, а также энергичное лечение воспалительных процессов.
2. Соблюдение всех санитарно- гигиенических правил по отношению к роженице и обеспечение асептических родов. В настоящее время сепсис у новорожденных встречается сравнительно редко.
3. Асептическая обработка пупка при рождении и правильный уход за культей пупочного канатика.
4. Соблюдение асептики при первом туалете новорожденного (стерильные пеленки, стерильное растительное масло для смазывания кожи). Постоянная связь акушера с педиатром.
5. Правильный уход за носом и полостью рта новорожденного. Избегать всякого протирания и травмы слизистой рта.
6. Уход за грудными железами кормящей матери и правильное проведение кормления.
7. Изоляция больных детей и детей от больных матерей.
8. Своевременное и энергичное лечение малейших гнойных изменений кожи новорожденного.
9. При септических заболеваниях у матери ребенка отнимают от груди и кормят сцеженным материнским молоком.
10. Систематическая проверка медицинского персонала на бациллоносительство патогенных микробов в полости рта и испражнениях. Не допускать на работу в родильные дома и отделения для новорожденных лиц, больных гриппом или какими-либо гнойными инфекциями. При приеме новорожденного в отделение интенсивного ухода следует брать мазки с кожи, из носа, пупочной культи, ануса.
11. Обслуживающий персонал должен носить плотные марлевые маски и перед каждой манипуляцией добросовестно мыть руки с мылом и дезинфицировать.
12. Палаты для новорожденных должны быть просторными и светлыми и регулярно облучаться кварцевой лампой.
Лечение сепсиса новорожденных.
Лечение при сепсисе у новорожденных надо продолжать до полного исчезновения всех симптомов активной инфекции, до нормализации картины крови и признаков прибавления в весе.
При стафилококковом сепсисе назначают метициллин по 150-200 мг на кг веса в сутки. Очень хорошие результаты дает и Oxacillin по 100-150 мг на кг веса в сутки. При наличии грам-отрицательной инфекции назначают ампициллин и гентамицин. При колисепсисе назначают гентамицин по 4- 5 мг на кг веса в две равные дозы, внутримышечно в продолжение 7-10 дней и Colimycin по 30-50 мг на кг веса. При протеус-инфекции используют ампициллин в известных дозах и Tobramycin по 4-7 мг на кг веса в две равные дозы внутримышечно. Пенициллин по 300 000-500 000 Е на кг веса в сутки оказывает очень хорошее действие при сепсисе, вызванном гемолитическими стрептококками. Это лечение при сепсисе можно комбинировать с преднизоном. При септическом шоке лучше вводить его внутривенно. Для борьбы с дегидратацией назначают внутривенное капельное вливание физиологического раствора с глюкозой. Ацидоз корригируют бикарбонатом натрия. При наличии менингита немедленно делают люмбальную пункцию и назначают лечение, указанное в разделе о гнойном менингите. При сепсисе у новорожденных благоприятное действие оказывают переливания крови небольшими дозами - по 20-30 мл через 3-4 дня, плазмы и Gammavenin. При кровоизлияниях назначают большие дозы витамина С (200-500 мг), витамина К - 3 мг. Можно назначить внутримышечно и 5 мл глюконата кальция. Остеомиелиты и нагноения суставов следует лечить, по возможности, консервативно, большими дозами антибиотиков. В таких случаях возможность выздоровления более реальна и стойкие поражения наблюдаются реже, чем после хирургического вмешательства. При сердечно-сосудистой недостаточности назначают кофеин, строфантин. Правильный уход и обеспечение новорожденного материнским молоком имеют особенно важное значение.
Гемолитическая болезнь новорожденных (ГБН)
Гемолитическая болезнь новорожденных (ГБН) – довольно частая причина желтухи у младенца. Развивается болезнь по причине конфликта иммунной системы из-за несовместимости крови женщины и ребенка. У женщины, в крови которой резус-отрицательной, наступает беременность от резус-положительного мужчины и будущий малыш унаследует резус-положительную кровь папы, то в крови матери постепенно увеличивается число резус-антител. В этих случаях факторы крови малыша являются антигенами (чужеродными для иммунной системы женщины). Иммунная система беременной женщины вырабатывает антитела на чужеродные клетки, которые проходят через плаценту к ребенку и оказывают повреждающее воздействие. Если антитела разбивают эритроциты ребенка, то возникает гемолиз. И поэтому, у новорожденного малыша с первых часов жизни появляется желтуха.
Появление желтухи связано с повышенным числом в крови желчного пигмента, называемого билирубинона
ГБН также развивается и при несовместимости группы крови родителей, когда младенец унаследует группу крови отца; в этих случаях у женщины группа I (0), а у малыша II (А) или III (В). При конфликте крови женщины и младенца по резус-фактору ГБН наблюдается у новорожденных, которые появились от 2 и последующих беременностей, в этом случае число резус-антител в организме женщины нарастает медленно. Если во время беременности женщине проводили переливание крови или ввод внутримышечно не учитывая резус-фактор, то ГБН может развиться и у младенца, который появился на свет от первой беременности. В среднем из 1000 новорожденных ГБН развивается у 2-5 младенцев.
| Чем опасна гемолитическая болезнь новорожденных |
| летальным исходом малыша |
| повреждениями почечной и печеночной структур |
| развитием хронической формы апластическо й анемии |
Формы гемолитической болезни у новорожденных
Отечная форма гемолитической болезни новорожденных достаточно тяжелая форма, характеризующаяся общим отеком при появлении малыша, скапливанием жидкости в брюшной и плевральной полостях, а также в сердечной сумке, резкой бледностью с желтизной, увеличением селезенки и печени. В анализах крови проявляется резкая анемия, значительное число нормо- и эритробластов. Сочетание гипопротеинемии и резкой анемии содействует развитию сердечной недостаточности, приводящей к смерти (немедленной после появления или внутриутробной).
«Проблема инфекций у новорожденных включает такие аспекты, как иммунитет у новорожденных, особенности эпидемиологии инфекционных болезней у этого контингента, источники инфекции, их диагностика, лечение и профилактика в родильных домах.
ИММУННАЯ НЕДОСТАТОЧНОСТЬ У НОВОРОЖДЕННЫХ
Для плода и новорожденного характерно иммунодефицитное состояние, сопровождающееся повышенной (по сравнению с детьми старшего возраста и взрослыми) восприимчивостью к инфекции, т. е. у плода и новорожденного снижена функциональная способность всех важных компонентов иммунной системы.
Механические барьеры для инфекции
Показано, что кожа и слизистые оболочки новорожденных более проницаемы для экзогенных антигенов, чем соответствующие образования у больных старшего возраста. До гестационного возраста 26 нед. наблюдается недоразвитие рогового слоя кожи. Этот обычный барьер для экзогенных антигенов имеет толщину лишь несколько клеток, и при этом он слабо кератинизирован. Harpin, Rutter, обследовавшие 70 новорожденньк в гестационном возрасте от 25 до 41 нед, показали, что аппликация на кожу такого активного альфа-антагониста, как фенилэфрин, не вызывала никакого побледнения кожи и потери воды у грудных детей, если их гестационный возраст превышал 37 нед. В то же время указанные явления были резко выражены в таких же условиях у недоношенных новорожденных детей в гестационном возрасте менее 32 нед. После 2 нед жизни, независимо от гестационного возраста, кожа созревает и происходит развитие рогового слоя. Незрелый барьер для инфекции—это вполне реальный путь проникновения бактерий в организм новорожденного, особенно недоношенного.
Функция фагоцитов
В ходе изучения поглотительной функции ПМЯЛ новорожденных были получены убедительные данные о нормальных фагоцитарных свойствах этих клеток в присутствии сывороток взрослых людей. Однако если концентрация указанных сывороток была ниже 3%, то ПМЯЛ новорожденных фагоцитировали инородные субстанции менее активно, чем ПМЯЛ взрослых. Таким образом, неполноценность фагоцитоза у новорожденных, по-видимому, связана с сывороточным фактором.
Что касается внутриклеточной деструкции поглощенных микроорганизмов полиморфно-ядерными лейкоцитами грудных детей (в том числе недоношенных), то, согласно результатам многочисленных исследований, этот процесс остается на нормальном уровне. Mills и сотр. выявили факт снижения хемолюминисценции ПМЯЛ у новорожденных и пришли к выводу, что для этих клеток характерны ослабленная окислительная метаболическая реакция и сниженная бактерицидная активность. Другие авторы обнаружили колебания в бактерицидной активности ПМЯЛ недоношенных грудных детей и повышенную бактерицидную активность ПМЯЛ у больных младенцев. Эти данные свидетельствуют о том, что у здоровых новорожденных детей процесс внутриклеточного поглощения большинства микроорганизмов полиморфно-ядерными лейкоцитами происходит так же эффективно, как у взрослых.
Иммуноглобулины
IgM—это первый класс иммуноглобулинов, который синтезируется плодом, начиная с 30-й недели внутриутробного развития, однако нормальная продукция IgM наступает под стимулирующим влиянием флоры, колонизирующей желудочно-кишечный тракт. К IgM относится основная часть антител, синтезируемых в течение первых нескольких месяцев жизни новорожденного. К 1-му году жизни уровень IgM составляет приблизительно 80% от соответствующего уровня у взрослых. Обнаруживаемые иногда повышенные уровни IgM у новорожденных указывают на то, что у плода была усиленная антигенная стимуляция, вероятнее всего, связанная с внутриматочной инфекцией.
Материнский IgG передается плоду до второго триместра беременности лишь в незначительных количествах. К моменту родов уровни IgG у плода, как правило, выше соответствующих уровней IgG у матери. Этот факт связан с активным транспортом IgG в течение третьего триместра беременности. Активный синтез IgG начинается на 6-м месяце внеутробной
жизни и к концу 1-го года жизни уровень IgG достигает только 60% соответствующего показателя у взрослых. После быстрого исчезновения материнского IgG новорожденный в возрасте от 3 до б мес. по существу остается в состоянии гипогаммаглобулинемии.
Грудной ребенок, родившийся от матери, имеющей высокие концентрации антител против определенных антигенов (например, корн или краснухи), защищен от этих инфекций. Если у матери низкие уровни иммунных антител, а ее собственный иммунитет основан лишь на кратковременной анамнестической реакции (например, на предшествующей иммунизации против столбняка или дифтерии), то ребенок будет обладать только частичным или слабо выраженным иммунитетом. Матери, ранее перенесшие заболевания, при которых вырабатывались защитные антитела класса IgG (например, против Salmonella или Escherichia coli), не передают состояние иммунитета новорожденным, так как IgM не проходит через плаценту.
Комплемент
При проведении ряда исследований было выявлено ослабление классического цикла активации комплемента у новорожденных, однако наиболее выраженным снижением характеризовался альтернативный цикл. Наиболее существенным дефектом в системе комплемента является резко сниженная опсонизирующая активность по сравнению с соответствующим показателем у взрослых. Gerdes и сотр., изучавшие фибронектин — важный опсонизирующий гликопротеин, способный стимулировать клиренс бактерий ретикулоэндотелиальной системы, показали, что у новорожденных концентрация данного протеина составляет приблизительно 50% по сравнению с нормальным уровнем у взрослых. К 2-месячному возрасту уровень фибронектина в сыворотке крови грудных детей достигает показателя, характерного для взрослых.
Показано, что ретикулоэндотелиальная система (особенно селезенка) у новорожденных отличается пониженной способностью к удалению экзогенных антигенов из русла циркулирующей крови. Holyrode и сотр. использовали в своей работе феномен депонирования эритроцитов в качестве меры выраженности асплении (в том числе функциональной). Авторы показали, что у здоровых взрослых показатель депонирования эритроцитов составляет 2,6%, у грудных детей, родившихся в срок, — 24%, а у недоношенных младенцев— 47,2%. Последний из этих показателей приблизительно соответствует уровням депонирования эритроцитов, наблюдающимся у взрослых при посттравматической спленэктомии или аутоспленэктомии (т.е. выключении функции селезенки вследствие нарушения притока крови).
Последнее изменение этой страницы: 2017-01-18; Нарушение авторского права страницы
Читайте также:
- Зачатие ребенка если родители с инфекцией
- Герпетическая ангина инфекционные болезни
- Свечи при кишечной инфекции для детей кипферон
- Нет инфекций но есть эрозия
- В мазке крови больного с приступами лихорадки наблюдались эритроциты


