Кампилобактер и хеликобактер разница
К роду Campylobacter относятся аэробные или микроаэрофильные подвижные вибриоидные грамотрицательные бактерии. Род Campylobacter включает 13 видов. В 1991г. из него в качестве самостоятельного вычленен род Helicobacter (2 вида — Н.pylori и H.mustelae, последний выделен от хорьков).
Кампилобактериоз— инфекционное заболевание, характеризующееся острым началом, лихорадкой, поражением желудочно-кишечного тракта. Исследования, проведенные в последние годы, показали, что в ряде стран кампилобактерии являются возбудителями острых кишечных заболеваний не реже (а иногда и чаще), чем сальмонеллы, шигеллы и ротавирусы, и вызывают — в зависимости от сезона и особенностей региона — от 3 до 15% ОКЗ.
В инфекционной патологии человека и животных важнейшую роль играют виды C.jejuni, C.coli, C.lari, вызывающие ОКЗ сходного клинического течения (кампилобактериозы). На основании способности к росту при относительно высокой температуре инкубации (42 °С) они объединены в группу термофильных кампилобактерии. Среди прочих мезофильных видов кампилобактерии, предпочитающих умеренную температуру инкубации (37 °С), известную роль в патологии человека играет С.fetus, зачастую являющийся возбудителем артритов, менингитов, васкулитов; виды C.concisus и C.sputorum расцениваются как комменсалы полости рта, возможно, играющие роль в патогенезе пародонтита, а виды C.fennelliae, C.cinaedi и C.hyointestinalis встречаются в толстом кишечнике человека при иммуно-дефицитах той или иной природы. Helicobacter pylori расценивается как этиотропный агент, ассоциирующийся с язвенно-эрозивными поражениями желудка и двенадцатиперстной кишки.
Кампилобактерии являются хемоорганотрофами. Будучи термофилами, способны к росту при 37—44 °С, но не при 25 "С. Большинство кампилобактерии являются микроаэрофилами и капнофилами, т. е. требуют для культивирования пониженного содержания кислорода и повышенного — углекислого газа. Оптимальная атмосфера для культивирования патогенных видов кампилобактерии имеет следующий состав: О2 — 5%, СО2 — 10%, азот — 85%. Некоторые кампилобактерии при выращивании
могут проявлять себя как облигатные анаэробы. Энергию кампилобактерий освобождают из аминокислот и трикарбоновых кислот, но не из углеводов, к окислению и ферментации которых не способны.
Для культивирования кампилобактерий чаще используют специальные питательные среды, в основу которых положены среды для выделения бруцелл. Однако в эти среды необходимо добавлять вещества, повышающие аэротолерантность кампилобактерий и снижающие окислительно-восстановительный потенциал среды (кровь, тиогликолат натрия, метабисульфит натрия, пируват натрия, сульфат закисного железа). Обычно используют мясные, печеночные, кровяные среды, часто в них добавляют антибиотики (новобиоцин, циклогексамид, бацитрацин, триметоприм) для подавления сопутствующей микрофлоры. На питательных средах рост кампилобактерий наблюдается обычно через 2-4 сут. На жидких питательных средах наблюдается диффузное помутнение с трудноразбиваемым выраженным осадком. На полужидких средах они вырастают в виде диффузного мутного кольца толщиной 1-4мм под поверхностью среды. Если кампилобактерий растут в условиях строгого анаэробиоза, отмечается помутнение всей среды.
На плотных средах с кровью кампилобактерии образуют два типа колоний: а) округлые неправильной формы, с ровными краями, диаметром 2-8мм, бесцветные или светло-серые, прозрачные, гомогенные (напоминают капли воды), при длительном культивировании могут приобретать серебристо-матовый оттенок; б) колонии правильной округлой формы, с ровными краями и диаметром 1-2мм, с блестящей выпуклой поверхностью, прозрачные, гомогенные, в старых колониях центр более плотный, чем периферия, и может образовываться желтоватый пигмент. Консистенция колоний невязкая, зона гемолиза отсутствует.
Кампилобактерии оксидазоположительны, желатин и мочевину не гидролизуют, реакции с метиловым красным и Фогеса-Проскауэра отрицательны. Они продуцируют цитохромоксидазу, не растут на среде Ресселя; по способности образовывать каталазу делятся на 2 группы: каталазопозитивные (С.fetus, C.jejuni, C.coli, H.pylori) и каталазонегативные (C.sputorum и C.concisus). Различные их виды могут или не могут: образовывать сероводород, расти в присутствии 1% и 3,5% NaCl, бриллиантового зеленого, налидиксовой кислоты, цефалотина, гидролизовать гиппурат натрия, образовывать пигмент желтого цвета. На основании изучения этих свойств строится межвидовая дифференциация (табл. 3).
| Свойства некоторых видов родов Campylobacter и Helicobacter | ||||||||||
| Вид | Окси- даза | Ката- лаза | Подвиж- ность | Рост при 26°С | Рост при 37°С | Рост при 42°С | Гиппу- рат Na | Цефа- дотин | Уре- аза | Рост на среде Ресселя, на простой среде |
| С. fetus | + | + | + | + | + | - | - | ч | - | - |
| C.jejuni | + | + | + | - | + | + | + | У | - | - |
| C.coll | + | + | + | - | + | + | - | У | - | - |
| C.lari | + | + | + | - | + | + | - | У | - | - |
| H.pylori | •f | + | + | - | + | ? | - | Ч | + | - |
Примечание + — положительный признак, - — отрицательный признак; > — непостоянный признак, У — устойчив, Ч — чувствителен
H.pylori — лофотрих или монотрих, иногда в популяции присутствуют обе формы На агаровых средах малоподвижен или неподвижен. Растет на средах для кампилобактерий, но предпочтение отдает шоколадному агару, образуя на нем колонии диаметром 0,5-1,Омм. На 10%-ном кровяном агаре отмечается слабый гемолиз. Для роста требуются микроаэрофильные условия или атмосфера, обогащенная С02. В аэробных или анаэробных условиях не растет.
H.pylori оксидазо- и каталазопозитивен; сероводород не образует, гиппурат не гидролизует, имеет уреазу. Устойчив к хлориду трифенилтетразолия в концентрации 0,4—1,0 мг/мл; устойчив к 0,1%-ному раствору селенита натрия, в меньшей степени — к 1%-ному глицину.
Кампилобактерий обладают сложным комплексом термостабильных и термолабильных факторов патогенности. Клеточная стенка содержит эндотоксин, действие которого напоминает действие эндо-
токсина сальмонелл и иерсиний. Некоторые штаммы способны продуцировать энтеротоксин, действие которого напоминает действие холерогена, а также присущий только кампилобактериям цитотоксин уникального строения, воздействие которого на слизистую оболочку толстой кишки человека приводит к изменениям дизентериеподобного характера.
При комнатной и, в особенности, при пониженной температурах резистентность кампилобактерий к действию факторов внешней среды весьма высока — в пищевых продуктах, водопроводной и сточных водах, молоке, моче, испражнениях они могут сохранять жизнеспособность в течение 1-5 нед Кампилобактерий очень чувствительны к нагреванию свыше 50 °С, действию прямого солнечного и ультрафиолетового света и воздуха, высыханию, низким и высоким значениям рН среды, чувствительны к действию дезинфицирующих веществ в рабочих концентрациях
Эпидемиология. Кампилобактерийи (особенно термофильные) обнаруживаются у всех видов диких и домашних животных и птиц, многие из которых являются их естественными резервуарами (крупный и мелкий рогатый скот, куры, скворцы, воробьи, попугаи и др ) Основным резервуаром кампилобактерий следует считать сельскохозяйственных животных, дополнительными — больных людей и домашних животных, диких городских птиц и грызунов Основной путь передачи инфекции — пищевой (сырое молоко, битая птица, говядина, свинина), дополнительные — водный (речная и морская вода, загрязненные испражнениями животных) и бытовой (грубые нарушения санитарно-гигиенических норм при уходе за больными людьми и животными, а также при кулинарной обработке мясных продуктов) Кампилобактериозу свойственна выраженная летняя сезонность с почти полным отсутствием заболеваемости в зимние месяцы Чаще заболевание регистрируется в виде спорадических случаев, изредка — в виде более или менее крупных вспышек После перенесенного заболевания у людей, не леченных антибиотиками, бактерии с испражнениями выделяются достаточно допго в течение 2-5 нед, а иногда — до 10 недель.
Патогенез и клиника. У людей кампилобактериоз протекает в основном в виде энтеритов и энтероколитов, хотя описаны заболевания и другой локализации: септицемия, эндокардит, перикардит, менингит, поражения внекишечной локализации чаще отмечаются у людей старшего возраста или у больных со сниженной резистентностью организма
Инкубационный период 1-10 дней, чаще 1-5 дней Начало заболевания чаще острое, реже — подострое Обычно наблюдается умеренно выраженная интоксикация и диарея (до 10-20 раз в сутки), боли в нижней части живота В половине случаев отмечается наличие крови в испражнениях реже' — обезвоживание Чаще возникает и тяжелее протекает заболевание у детей в возрасте от 1 до 3 ле г Патогенез и степень тяжести находятся в прямой зависимости от факторов патогенности, имеющихся у данного штамма кампилобактерий, а также от количества бактерий, попавших в организм
У больных с язвенной болезнью желудка или двенадцатиперстной кишки и с хроническими гастритами из биоптатов слизистой оболочки стабильно выделяется Н pylon (в 60-90% случаев), что позволяет предположить ведущее значение данного возбудителя в возникновении этих заболевании
Иммунитет. Кампилобактери высокоиммуногенны Антитела появляются в крови в ранние сроки заболевания и в достаточно высоких титрах Титр до 1 5000 бывает уже на 5-й день заболевания достигнув максимума, титры антител в течение длительного времени медленно снижаются и через месяц могут быть еще достаточно высокими
Основной метод диагностики — бактериологический. Материал для посева — испражнения и ти содержимое прямой кишки, иногда — кровь, а также вода, молоко, другие пищевые продукты смывы с предметов и т д Посевы делают на специальные питательные среды, создают микроаэрофильные условия и инкубируют при 37 °С и 42 °С После получения типичных колоний культуру идентифицируют по совокупности признаков
Серологический метод исследования играет весьма важную роль при широкомасштабных эпидемиологических исследованиях, но в диагностике кампилобактериозов его роль невелика. Реакция агглютинации ставится с аутоштаммами, можно с живой музейной культурой, но с формалинизированной культурой результаты получаются более четкими. Наиболее чувствительными являются РИФ и ИФМ. Могут также использоваться РСК, латекс-агглютинация, иммуноэлектрофорез, РПГА. Каждая из этих реакций имеет определенные достоинства, но тем не менее не позволяет достаточно надежно диагностировать кампилобактериозы.
Специфическая профилактика и лечение.Специфическая профилактика не разработана; другие профилактические мероприятия включают строгое соблюдение ветеринарно-санитарных и санитарно-гигиенических норм переработки, транспортировки, хранения пищевых продуктов, правил личной гигиены, защиту водоемов от загрязнения сточными водами (особенно животноводческих хозяйств).
Для лечения кампилобактериозов используют антибиотики, наиболее эффективны гентамицин, эритромицин, менее эффективны канамицин, левомицетин, полусинтетические пенициллины.
Наиболее эффективным препаратом для лечения хронического гастрита и язвенной болезни желудка или двенадцатиперстной кишки является Де-Нол (коллоидный субцитрат висмута), который сочетают с трихополом (метронидазолом) и ампициллином для усиления терапевтического действия Де-Нол — специфический этиотропный препарат, избирательно действующий только на Н..pylori.
1. Пяткін К. Д., Кривошеїн Ю.С. Мікробіологія. - К : Высшая школа, 1992. - 432 с.
Тимаков В.Д., Левашев В.С., Борисов Л.Б. Микробиология. - М : Медицина, 1983. - 312 с.
2. Борисов Л.Б., Козьмин-Соколов Б.Н., Фрейдлин И.С. Руководство к лабораторным занятиям по медицинской микробиологии, вирусологии и иммунологии / под ред. Борисова Л.Б. – Г. : Медицина, 1993. – 232 с.
3. Медицинская микробиология, вирусология и иммунология: Учебник под ред. А.А.Воробьева. – М.: Медицинское информационное агентство, 2004. - 691 с.
4. Медицинская микробиология, вирусология, иммунология /ред. Л.Б.Борисов, А.М.Смирнова. - М: Медицина, 1994. - 528 c.
Сайт СТУДОПЕДИЯ проводит ОПРОС! Прими участие :) - нам важно ваше мнение.
Кампилобактериоз — острое инфекционное зоонозное заболевание, характеризующееся синдромом общей интоксикации, преимущественным поражением желудочно-кишечного тракта и возможностью генерализации патологического процесса.
Царство Procaryotae, отдел Gracilicutes, семейство Spirillaceae.
Виды: C.jejuni, C.lari, C.coli, С. fetus
Род Helicobacter, вид: H.pylori
С. jejuni, С. coli, С. lari — термофилы (температурный оптимум 42 °С).
С. fetus — мезофил (температурный оптимум 37 °С).
Биологические и культуральные свойства
Хемоорганотрофы. Термофилы, способны к росту при 37-44 °С, но не при 25 °С. Микроаэрофилы и капнофилы, т.е. требуют для культивирования пониженного содержания кислорода и повышенного — углекислого газа. Оптимальная атмосфера для культивирования патогенных видов кампилобактерии имеет следующий состав: О2 — 5%, СО2 — 10%, азот — 85%. Энергию кампилобактерии получают из аминокислот и трикарбоновых кислот, но не из углеводов, к окислению и ферментации которых не способны.
Кампилобактерий оксидазоположительны, каталазоположительны. Не гидролизуют желатин и мочевину.
Для культивирования кампилобактерий используют коммерческие питательные среды на основе железо-эритритного агара. В среды добавлены вещества, снижающие окислительно-восстановительный потенциал, и антибиотики.
Кампилобактерии имеют общие антигены с возбудителями бруцеллеза и иерсиниоза.
Кампилобактерии имеют энтеротоксин (вызывает диарею) и цитотоксин, повреждающий слизистую оболочку толстой кишки.
Зооноз. Основным резервуаром кампилобактерий и источником инфекции для человека служат животные и птицы, преимущественно домашние и сельскохозяйственные (кролики, свиньи, коровы, козы, овцы, утки, могут быть собаки и кошки).
Передача кампилобактерий от человека к человеку происходит редко, в случаях заражения детей раннего возраста от взрослых.
Механизм передачи фекально-оральный, путь — пищевой.
Заражение происходит при употреблении в пищу инфицированных мясных и молочных продуктов без достаточной термической обработки, а также овощей и фруктов. Возможен водный путь передачи инфекции.
Географическое распространение кампилобактериоза очень широко, он встречается на всех континентах, что связано с интенсификацией животноводства, возросшей международной торговлей животными, кормами, продуктами животного происхождения, ростом урбанизации.
Патогенез и клиника
Возбудитель попадает в организм человека через рот с инфицированными продуктами и водой. В желудочно-кишечном тракте, преимущественно в тонкой (тощей) кишке и реже в толстой, в месте входных ворот инфекции возникают воспалительные изменения слизистой оболочки.
При большой инфицирующей дозе и сниженной резистентности макроорганизма развивается бактериемия с диссеминацией возбудителя в различные органы и ткани.
Кампилобактериоз протекает в основном в виде энтеритов и энтероколитов, Возможны заболевания внекишечной локализации: септицемия, эндокардит, перикардит, менингит.
Методы лабораторной диагностики
Лабораторная диагностика включает бактериологический и серологический методы исследований.
Бактериологический метод. Материалом для исследования — фекалии, кровь, мокрота, гной, спинномозговая жидкость, объекты внешней среды (пищевые продукты, вода).
Материал засевают на одну из селективных питательных сред, посевы выращивают 72 ч при 37-42 °С в смеси 85 % азота, 10% углекислого газа и 5 % кислорода.
На жидких питательных средах кампилобактер через 48-72 ч инкубации образует равномерное помутнение с выраженным осадком, на полужидких растет в виде дисков, расположенных на глубине 1-2 мм от поверхности питательной среды. На селективных плотных питательных средах обнаруживаются два типа колоний. Колонии первого типа негемолитические, сероватые, плоские, блестящие, прозрачные, влажные, как бы растекающиеся, похожие на капли водяных паров. Колонии второго типа также негемолитические, более плотные и оформленные, чем колонии первого типа, выпуклые.
Из подозрительных на кампилобактерии колоний готовят мазки, окрашивают по Граму. Обнаружение при микроскопировании мазков грамотрицательных изогнутых или спиралевидных палочек является основанием для пересева на кровяной агар с антибиотиками с целью выделения чистой культуры.
Родовая принадлежность выделенной чистой культуры кампилобактера определяется по результатам изучения морфологических свойств, на основании положительных результатов тестов на способность к продукции цитохромоксидазы и каталазы. Видовая принадлежность — по результатам тестов на способность к быстрому гидролизу гиппурата натрия и резистентности к налидиксовой кислоте.
Серологический метод исследования играет важную роль при эпидемиологических исследованиях. Используют РИФ, иммуноферментный анализ (ИФА), иммуноэлектрофорез, реакцию агглютинации (РА), непрямой гемагглютинации (РНГА), микроагглютинации, латекс-агглютинации.
Антибиотикотерапия. Наиболее эффективными средствами этиотропной терапии являются эритромицин и гентамицин.
Helicobacter pylori расценивается как возбудитель язвенной болезни желудка и двенадцатиперстной кишки. Н. pylori несколько крупнее других видов кампилобактерий. H. pylori — лофотрих или монотрих. Для роста требуются микроаэрофильные условия или атмосфера, обогащенная СО2. В аэробных или анаэробных условиях не растет.
H. pylori оксидазо- и каталазопозитивен; сероводород не образует, имеет уреазу.
Факторами вирулентности H. pylori служат: подвижность; уреаза (нейтрализует HCl и повреждает эпителиоциты); протеиновый цитотоксин, вызывающий вакуолизацию эпителиальных клеток и повреждающий межклеточные мостики; липополисахарид; протеиназа; липаза; каталаза.
| | | следующая лекция ==> | |
| ТРЕПОНЕМЫ | | | Лекция 21 |
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Род Campylobacter (Campyla - изогнутые) относится к группе аэробных или микроаэрофильных подвижных спирально изогнутых грамотрицательных бактерий. Наибольшее значение в патологии человека имеет С. jejunii. Реже встречаются С. fetus и С. coli. Ранее отнесенный к данному роду С. pylori выделен в род Helicobacter.
Морфология и физиология.Тонкие вибриоидные клетки, имеющие один или более витков спирали. Споры не образуют. Подвижные, совершают характерное винтовое движение с помощью одиночных жгутиков, расположенных на одном или обоих частях клетки. Хемоорганотрофы не требовательны к питательному субстрату, не сбраживают углеводы. Для получения энергии используют аминокислоты, а не углеводы. Оксидазоположительные и уреазоотрицательные. Пигментов не образуют.
Антигены.Кампилобактеры содержат О-, К- и Н-антигены. В настоящее время выделено свыше 50 О-серогрупп кампилобактеров.
Патогеность и патогенез.К факторам вирулентности относят жгутики и муциназу, способствующие проникновению в слизистую оболочку тонкой кишки. Обладают умеренной пенетрационной активностью. Их токсичность связана с секрецией энтеротоксинов (функциональные блокаторы), нарушающими водно-солевой обмен через образование цАМФ, аналогично энтеротоксинам Е. coli и V. cholerae. При разрушении кампилобактеров освобождается эндотоксин. Описаны цитотоксины, вызывающие гибель чувствительных клеток. После колонизации участка тонкой кишки они могут проникнуть в кровяное русло, вызывая генерализованную инфекцию, чаще у иммунодефицитных лиц. В патогенезе кампилобактериозных энтеритов преобладают явления диареи или дизентериеподобных состояний. При этом С. jejunii и С. fetus вызывают энтериты у людей. С. jejunii встречается также при абортах овец. С.fetus чаще встречается у пожилых людей с иммунодефицитами, а также при некишечных формах кампилобактериоза, вызывая поражение паренхиматозных органов и даже сепсис.
Иммунитет. гуморальный иммунный ответ.
Морфология и физиология.H.pylori представляют собой мелкие грамотрицательные палочки, лофотрихи, микроаэрофилы. Растут на сложных питательных средах. Продуцируют каталазу и оксидазу, которые используют для идентификации этих бактерий.
Патогенность и патогенез.К факторам вирулентности хеликобактеров относят их способность к движению и участие в проникновении в слизистую оболочку. Фермент уреаза при разрушении мочевины до аммиака и СO2 приводит к образованию газовой оболочки, защищающей от кишечного сока. Хеликобактеры продуцируют фосфолипазы, разрушающие фосфолипиды. Их токсичность связана с цитотоксином, действующим на эпителиальные клетки, токсином, нарушающим межклеточные контакты, и с ЛПС. Кроме того, на поверхности клеток образуются белки теплового шока, которые рассматривают как реакцию на стресс. Это приводит к аутоиммунному воспалению и образованию язв в желудке и двенадцатиперстной кишке. Н. pylori выделяются в 80% случаев язвенных гастритов.
Экология и эпидемиология.Является представителем нормальной микрофлоры животных. Пути передачи человеку окончательно не выяснены. По-видимому, люди заражаются алиментарным путем.
Кампилобактериозы и геликобактериозы
Инфекционные заболевания, которые вызывают бактерии рода Campylobacter, получили общее название кампилобактериозы. Они имеют острое течение, сопровождающиеся лихорадкой, поражением желудка и кишечника и с каждым годом встречаются все чаще. Среди 13 видов кампилобактерий главнейшими являются: Campylobacter jejuni, C.coli. В 1991 p. выделен отдельный вид Helicobacter pylori. Его стабильно обнаруживают у больных язвой желудка, гастрит и дуоденит. Этим заболеванием дали общее название геликобактериоза.Кроме энтеритов и энтероколитов, этих частых кампилобактериоз, значительно реже встречаются септицемии, эндокардиты, перикардиты, менингиты, поражения мочеполовой системы. У беременных женщин возможны аборты, преждевременные роды, инфицирование новорожденных во время родов.В связи с тем, что клиническая картина этих заболеваний не имеет характерных симптомов и подобная вызванных другими бактериями, лабораторные исследования приобретают важное значение. Для диагностики широко используют микроскопический, бактериологический и несколько меньше серологический методы.Материалом для исследования служит кровь, ликвор, стул или содержимое прямой кишки, взятый с помощью ректальных тампонов, плацентарная и околоплодной жидкости, содержимое абсцессов, биоптаты слизистой оболочки желудка и 12-перстной кишки. Исследуют также воду, молоко, другие продукты питания, смывы с предметов и т.п..
Бактериоскопический метод используется для быстрой идентификации кампило-и геликобактерий. Тонкие мазки из фекалий и других клинических материалов фиксируют на огне, окрашивают фуксином Пфейфера течение 10-20 с и промывают водой. Поскольку для окраски других бактерий требуется 3-5 мин, то в течение 10-20 сек успевают зафарбуватись только кампилобактерии. Особенно четко их типовые формы обнаруживают при окраске кристаллическим фиолетовым. Под обычным световым микроскопом они выглядят как тонкие, спирально изогнутые бактерии, имеющие один полный завиток, С-и S-образную форму или напоминают крылья чайки. Helicobacter pylori имеет несколько большие размеры. Можно также использовать фазово-контрастную микроскопию суспензии стула в бульоне для культивирования бруцелл или жидкой среде Мюллера-Хинтон (МПБ с крахмалом и казеином). При этом выявляют не только типичные особенности морфологии кампилобактерий, но и очень характерную их подвижность.
Спиралеобразная форма бактерии, от которой, собственно, и произошло родовое название Helicobacter, как полагают, связана с приобретением этим микроорганизмом в ходе эволюции способности проникать в слизистую оболочку желудка и двенадцатиперстной кишки, и с тем, что такая форма облегчает её движение в слизистом геле, покрывающем слизистую оболочку желудка. [2]
История открытия
В 1875 году немецкие учёные обнаружили спиралевидную бактерию в слизистой оболочке желудка человека. Эта бактерия не росла в культуре (на известных в то время искусственных питательных средах), и это случайное открытие было в конце концов забыто. [3]
В 1893 году итальянский исследователь Джулио Биззоцеро описал похожую спиралевидную бактерию, живущую в кислом содержимом желудка собак. [4]
Бактерия была вновь открыта в 1979 году австралийским патологом Робином Уорреном, который затем провёл дальнейшие исследования её вместе с Барри Маршаллом, начиная с 1981 года. Уоррену и Маршаллу удалось выделить и изолировать этот микроорганизм из проб слизистой оболочки желудка человека. Они также были первыми, кому удалось культивировать этот микроорганизм на искусственных питательных средах. [6] В оригинальной публикации [7] Уоррен и Маршалл высказали предположение, что большинство язв желудка и гастритов у человека вызываются инфицированием микроорганизмом Helicobacter pylori, а не стрессом или острой пищей, как предполагалось ранее. [8]
Медицинское и научное сообщество медленно и неохотно признавали патогенетическую роль этой бактерии в развитии язв желудка и двенадцатиперстной кишки и гастритов, вследствие распространённого в то время убеждения, что никакой микроорганизм не в состоянии выжить сколько-нибудь длительное время в кислом содержимом желудка. Признание научным сообществом этиологической роли этого микроба в развитии заболеваний желудка начало постепенно приходить лишь после того, как были проведены дополнительные исследования. Один из наиболее убедительных экспериментов в этой области был поставлен Барри Маршаллом: он сознательно выпил содержимое чашки Петри с культурой бактерии H. pylori, после чего у него развился гастрит. [9] Бактерия была обнаружена в слизистой его желудка, тем самым были выполнены три из четырёх постулатов Коха. Четвёртый постулат был выполнен, когда на второй эндоскопии, спустя 10 дней после преднамеренного заражения, были обнаружены признаки гастрита и присутствие H. pylori. Затем Маршалл сумел продемонстрировать, что он в состоянии излечить свой хеликобактерный гастрит с помощью 14-дневного курса лечения солями висмута и метронидазолом. [9] Маршалл и Уоррен затем пошли дальше и сумели показать, что антибиотики эффективны в лечении многих, если не большинства, случаев гастрита и язв желудка и двенадцатиперстной кишки. [9]
В 1994 году Американский Национальный Институт Здравоохранения опубликовал экспертное мнение, в котором утверждалось, что большинство рецидивирующих язв желудка и гастритов с повышенной кислотностью вызываются инфицированием микробом H. pylori, и рекомендовал включать антибиотики в терапевтические режимы при лечении язвенной болезни желудка, а также гастритов с повышенной кислотностью. [10] Постепенно накапливались данные также о том, что язвы двенадцатиперстной кишки и дуодениты также ассоциированы с инфицированием H. pylori. [11] [12]
В 2005 году первооткрыватели медицинского значения бактерии Робин Уоррен и Барри Маршалл были удостоены Нобелевской премии по медицине. [13]
До того, как стала понятна роль инфекции Helicobacter pylori в развитии язвенной болезни желудка и двенадцатиперстной кишки и гастритов, язвы и гастриты обычно лечили лекарствами, которые нейтрализуют кислоту (антациды) или снижают её продукцию в желудке (ингибиторы протонного насоса, блокаторы H2-гистаминовых рецепторов, М-холинолитики и др.). Хотя такое лечение в ряде случаев бывало эффективным, язвы и гастриты весьма часто рецидивировали после прекращения лечения. Весьма часто используемым препаратом для лечения гастритов и язвенной болезни желудка и двенадцатиперстной кишки был висмута субсалицилат (пепто-бисмол). Он часто был эффективен, но вышел из употребления, поскольку его механизм действия оставался непонятным. Сегодня стало понятно, что эффект пепто-бисмола был обусловлен тем, что соли висмута действуют на Helicobacter pylori как антибиотик. На сегодняшний день большинство случаев язв желудка и двенадцатиперстной кишки, гастритов и дуоденитов с доказанной лабораторными тестами хеликобактерной этиологией, особенно в развитых странах, лечат антибиотиками, эффективными против Helicobacter pylori. [14]
Хотя H. pylori остаётся наиболее медицински значимой бактерией, способной обитать в желудке человека, у других млекопитающих и некоторых птиц были найдены другие представители рода Helicobacter. Некоторые из них способны заражать и человека. Виды рода Helicobacter были также обнаружены в печени некоторых млекопитающих, причём они способны вызывать поражения и заболевания печени. [15]
Систематика
Многие виды рода Helicobacter являются патогенными для человека и животных и обитают в ротовой полости, желудке, различных отделов кишечника человека и животных (патогенными для человека и животных кроме H. pylori являются также виды H. nemestrinae, H. acinonychis, H. felis, H. bizzozeronii и H. salomonis)). [18] Наибольший уровень сходства по результатом ДНК-ДНК гибридизации отмечен между видами H. pylori и H. mustelae. [18]
Виды рода Helicobacter являются единственными известными на сегодняшний день микроорганизмами, способными длительно выживать в чрезвычайно кислом содержимом желудка и даже колонизировать его слизистую. [19]
Разработано много методов определения как внутривидовой дифференциации штамов H. pylori, так и для дифференцировки от других видов рода Helicobacter, такие как биотипические, и серологические методы, методы определения уреазной активности и токсинообразования, так и молекулярные — белковый электрофорез клеточного лизата, метод определения полиморфизма длин рестрикционных фрагментов (ПДРФ), полимеразная цепная реакция (ПЦР), секвенирование 16S рибосомальной РНК [18] Показан высокий уровень внутривидового полиморфизма штаммов H. pylori по сравнению с крайне близким видом H. mustelae, проявляющим высокий уровень консерватизма. Полиморфизм заключается в однонуклеотидных заменами, а также крупных внутригеномных перестройках, и высоких частотах трансформации. [18]
Типовые штаммы H. pylori: ATCC 43504, DSM 4867, JCM 7653, LMG 7539, NCTC 11637. [18]
Строение
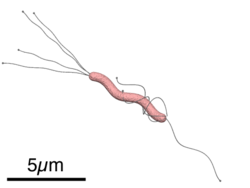
Helicobacter pylori — спиралевидная грамотрицательная бактерия, около 3 мкм в длину, диаметром около 0,5 мкм. Она обладает 4-6 жгутиками и способностью чрезвычайно быстро двигаться даже в густой слизи или агаре. Она микроаэрофильна, то есть требует для своего развития наличия кислорода, но в значительно меньших концентрациях, чем содержащиеся в атмосфере.
Бактерия содержит гидрогеназу, которая может использоваться для получения энергии путём окисления молекулярного водорода, продуцируемого другими кишечными бактериями. [20] Бактерия также вырабатывает оксидазу, каталазу и уреазу.
Helicobacter pylori обладает способностью формировать биоплёнки (англ.) , способствующие невосприимчивости бактерии к антибиотикотерапии и защищающие клетки бактерий от иммунного ответа хозяина. [21] Предполагают, что это увеличивает её выживаемость в кислой и агрессивной среде желудка.
Кокковидные клетки отличаются деталями строения клеточной стенки (преобладанием N-ацетил-D-глюкозаминил-β(1,4)-N-ацетилмурамил-L-Ала-D-Глю мотива в пептидогликане клеточной стенки (GM-дипептида)), изменение строения клеточной стенки приводит к неузнаванию бактерии иммунной системой хозяина (бактериальная мимикрия). [23]
Геном
Известно несколько штаммов Helicobacter pylori, и геном двух из них полностью секвенирован. [24] [25] [26]
Ген cagA кодирует один из важнейших белков вирулентности H. pylori. Штаммы, имеющие ген cagA ассоциированны со способностью вызывать тяжёлые формы язвы желудка. Ген cagA кодирует белок длинной 1186 аминокислотных остатка. Белок cagA транспортируется внутрь клеток, где он нарушает нормальное функционирование цитоскелета. Остров патогенности Cag состоит из примерно 30 генов, кодирующих сложную систему секреции типа IV. [27] . После адгезии H.pylori к клеткам эпителия желудка, cagA впрыскивается в клетку посредством системы секреции типа IV. Белок cagA фосфолирируется тирозиновыми протеинкиназами клетки и взаимодействует с фосфатазой Src, изменяя морфологию клеток. [28] Вирулентные штаммы H. pylori способны активировать рецептор эпидермального фактора роста (epidermal growth factor receptor, EGFR), мембранный белок с тирозинкиназным доменом. Активация EGFR H. pylori ассоциирована с изменённой сигнальной трансдукцией и изменением профиля экспрессии генов клетки хозяина, что может влиять на течение патологического процесса. [29]
Показана синергетичность действия генов babA2, cagA, и s1 vacA при патологическом процессе, вовлечённом в метаплазии кишечника. [30] Продукты генов cagA и babA2 идентифицируются иммуногистохимически, гистологически и при помощи in situ гибридизации при метаплазии кишечника и злокачественных новообразованиях желудка, ассоциированных с хеликобактерной инфекцией и могут служить возможными диагностическими маркерами. [31]
Также идентифицированы некоторые гены, ассоциированные со способностью к колонизации эпителия желудка, такие как flg, flh, tlp (отвечают за наличие жгутиков и хемотаксис), ureA, nixA, amiE (гены, отвечающие за синтез уреазы и продукцию аммиака), fur, pfr, fecA, frpB (гены, отвечающие за метаболизм железа), sod, hptG (ответ на стресс), и algA, rfaJ, lpxB (гены, отвечающие за биосинтез липополисахарида и экзополисахарида). [32] Показана роль в реакциях Helicobacter pylori на внешние раздражители продукта гена tlpD, предположительно кодирующего сенсорный белок. [33]
Факторы вирулентности
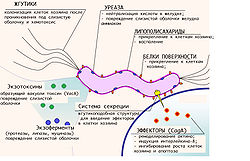
Способность H. pylori колонизировать слизистую желудка и вызывать гастрит либо язву желудка зависит не только от состояния иммунитета организма хозяина, но и от индивидуальных особенностей конкретного штамма бактерии. [34]
Одним из важных факторов вирулентности хеликобактер является наличие у неё жгутиков, благодаря которым обеспечивается быстрое движение микроорганизма в слое густой слизи, защищающей слизистую желудка от воздействия кислоты, её хемотаксис в места скопления других бактерий этого вида и быстрая колонизация слизистой.
Липополисахариды и белки наружной оболочки бактерии обладают свойством адгезии к наружной оболочке мембран клеток слизистой желудка. Кроме того, липополисахариды наружной оболочки H. pylori вызывают иммунный ответ организма хозяина и развитие воспаления слизистой.
Секретируемые бактерией во внешнюю среду литические ферменты — муциназа, протеаза, липаза — вызывают деполимеризацию и растворение защитной слизи (состоящей в основном из муцина) и повреждение слизистой желудка.
Очень важную роль в вирулентности бактерии и в её способности выживать в кислом содержимом желудка играет секреция бактерией уреазы — фермента, расщепляющего мочевину с образованием аммиака. Аммиак нейтрализует соляную кислоту желудка и обеспечивает бактерии локальное поддержание комфортного для неё pH (около 6-7).
Продукция хеликобактером различных экзотоксинов, в частности, вакуолизирующего экзотоксина (продукта гена vacA), также вызывает вакуолизацию, повреждение и гибель клеток слизистой желудка.
Штаммы H. pylori, выделенные от больных с язвой желудка или двенадцатиперстной кишки, как правило, проявляют большую биохимическую агрессивность, чем штаммы, выделенные от больных с гастритом, а штаммы, выделенные от больных с гастритом, обычно более агрессивны и вирулентны, чем штаммы, выделенные от бессимптомных носителей. [34] В частности, штаммы, выделенные от больных с язвенной болезнью, чаще бывают cagA-положительными (то есть продуцирующими cagA эффекторные белки). Штаммы, выделенные от больных с гастритом, чаще продуцируют экзотоксин vacA, чем штаммы, выделенные от бессимптомных носителей. [37] [38]
Патогенетические механизмы
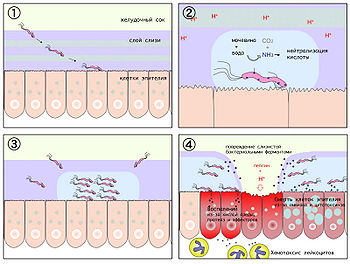
На начальном этапе после попадания в желудок H. pylori, быстро двигаясь при помощи жгутиков, преодолевает защитный слой слизи и колонизирует слизистую оболочку желудка. Закрепившись на поверхности слизистой, бактерия начинает вырабатывать уреазу, благодаря чему в слизистой оболочке и слое защитной слизи поблизости от растущей колонии растёт концентрация аммиака и повышается pH. По механизму отрицательной обратной связи это вызывает повышение секреции гастрина клетками слизистой желудка и компенсаторное повышение секреции соляной кислоты и пепсина, с одновременным снижением секреции бикарбонатов.
Муциназа, протеаза и липаза, вырабатываемые бактерией, вызывают деполимеризацию и растворение защитной слизи желудка, в результате чего соляная кислота и пепсин получают непосредственный доступ к оголённой слизистой желудка и начинают её разъедать, вызывая химический ожог, воспаление и изъязвление слизистой оболочки.
Диагностика инфекции
Диагностика геликобактерной инфекции обычно производится путём опроса больного на наличие диспептических жалоб и симптомов, и затем выполнения тестов, которые могут помочь подтвердить или опровергнуть факт наличия хеликобактерной инфекции.
Неинвазивные (не требующие эндоскопии) тесты на наличие хеликобактерной инфекции включают в себя определение титра антител в крови к антигенам H. pylori, определение наличия антигенов H. pylori в кале, а также уреазный дыхательный тест, состоящий в том, что пациент выпивает раствор меченой 14C- или 13C-углеродом мочевины, которую бактерия расщепляет с образованием меченой, соответственно, 14 C- или 13 C- двуокиси углерода, которая затем может быть обнаружена в выдыхаемом воздухе при помощи масс-спектрометрии.
Существуют также уреазные дыхательные тесты, основанные на определении концентрации аммиака в выдыхаемом воздухе. [42] Данные методы предполагают приём пациентом мочевины нормального изотопного состава и последующее измерение концентрации аммиака с помощью газоанализатора. К достоинствам метода можно отнести невысокую стоимость обследования, скорость получения результатов, высокую чувствительность (96 %), значительно меньшую стоимость оборудования по сравнению с масс-спектрографами.
Ни один из методов диагностики хеликобактерной инфекции не является полностью достоверным и защищённым от диагностических ошибок и неудач. В частности, результативность биопсии в диагностике хеликобактерной инфекции зависит от места взятия биоптата, поэтому при эндоскопическом исследовании обязательно взятие биоптатов из разных мест слизистой желудка. Тесты на наличие антител к антигенам хеликобактера имеют чувствительность всего лишь от 76 % до 84 %. Некоторые лекарства могут повлиять на активность уреазы, продуцируемой хеликобактером, в результате чего при исследовании уреазной активности при помощи меченой мочевины могут получиться ложноотрицательные результаты.
Хеликобактер был выделен из кала, слюны и зубного налёта инфицированных пациентов, что объясняет возможные пути передачи инфекции — фекально-оральный или орально-оральный (например, при поцелуях, пользовании общей посудой, общими столовыми приборами, общей зубной щёткой или анилингусе). Возможно (и весьма часто встречается) заражение хеликобактером в учреждениях общественного питания. Иногда возможно заражение через инфицированные эндоскопы при проведении диагностической гастроскопии.
Считается, что в отсутствие лечения хеликобактерная инфекция, однажды колонизировав слизистую желудка, может существовать в течение всей жизни человека несмотря на иммуный ответ хозяина. [44] [45] Однако у пожилых людей, а также у больных с давно существующим гастритом, хеликобактерная инфекция, вероятно, может самостоятельно исчезать, поскольку с возрастом или с давностью заболевания гастритом слизистая желудка становится всё более атрофичной, истончённой и менее пригодной для колонизации хеликобактером, менее благоприятной для обитания микроба. Вместе с тем, атрофический гастрит у пожилых, или гастрит, перешедший в стадию атрофического гастрита после многих лет болезни, поддаётся лечению гораздо труднее, чем хеликобактерные гастриты.
Процент острых хеликобактерных инфекций, которые переходят в хроническую персистирующую форму, точно не известен, однако в нескольких исследованиях, в которых изучалось естественное течение болезни без лечения в человеческих популяциях, сообщалось о возможности спонтанного самоизлечения (спонтанной элиминации микроба-возбудителя). [46] [47]
Лечение Helicobacter pylori-ассоциированных заболеваний
У пациентов с язвой желудка, язвой двенадцатиперстной кишки и гастритом с доказанной хеликобактерной этиологией стандартным протоколом лечения является эрадикация Helicobacter pylori, то есть лечебный режим, направленный на полное уничтожение этого микроба в желудке с целью обеспечить условия для заживления язвы.
Отмечены случаи непродуктивности антибиотикотерапии хеликобактерной инфекции, связанные как с антибиотикорезистентностью, так и с наличием зон в желудочно-кишечном тракте, в которых бактерии защищены от действия антибиотиков. [52] Отмеченно появление полирезистентных к антибиотикам изолятов H. pylori [53] , в том числе и кларитромицин-резистентных штаммов. [54] Также отмечены случаи появления хинолон-резистентных штаммов H. pylori. [55]
Также ведутся исследования по поиску и синтезу более эффективных и менее токсичных препаратов, направленных на эрадикацию H. pylori, показана эффективность in vitro препарата TG44 [56] , препарат NE-2001 в опытах in vitro проявлял высокую селективность по отношению к H. pylori [57] Показана эффективность пероральной вакцинации клеточным лизатом H. pylori на мышиной модели. [58]
Читайте также: