Микротестсистема для биохимической идентификации коринебактерий дифтерии

по применению набора реагентов
«Микротестсистема для биохимической идентификации коринебактерий
1.1. Набор реагентов предназначен для биохимической идентификации коринебактерий дифтерии, выделенных в ходе бактериологического исследования.
1.2. Выпускается по 10 контейнеров во вкладыше. Один вкладыш с контейнерами в пачке. По 25 пачек в ящике.
2. ХАРАКТЕРИСТИКА НАБОРА
2.1. Принцип метода
Биохимическая идентификация коринебактерий дифтерии осуществляется микробиологическим методом.
Принцип метода – визуальное обнаружение исходного цвета субстратов при посеве исследуемых образцов.
2.2. Состав набора
Набор реагентов представляет собой контейнер из прозрачного полистирола с 12 изолированными пронумерованными ячейками с 4 субстратно-индикаторными средами (по три ячейки на каждую среду) в виде осадка (пленки) на дне ячеек контейнера.
Среда № 1 (тест на утилизацию глюкозы):
пептон ферментативный сухой для бактериологических целей 2,0
спирт поливиниловый 1,0
феноловый красный 0,01
натрия хлорид 3,0
трис (оксиметил)-аминометан 1,0
Среда № 2 (тест на утилизацию сахарозы):
феноловый красный 0,01
спирт поливиниловый 1,0
пептон ферментативный сухой для бактериологических целей 2,0
натрия хлорид 3,0
трис (оксиметил)-аминометан 1,0
Среда № 3 (тест на утилизацию крахмала):
пептон ферментативный сухой для бактериологических целей 2,0
спирт поливиниловый 1,0
феноловый красный 0,01
натрия хлорид 3,0
трис (оксиметил)-аминометан 1,0
Среда № 4 (тест на наличие уреазы):
пептон ферментативный сухой для бактериологических целей 1,0
спирт поливиниловый 1,0
феноловый красный 0,01
калий фосфорнокислый однозамещенный 0,2
натрия хлорид 0,5
3.АНАЛИТИЧЕСКАЯ И ДИАГНОСТИЧЕСКАЯ
Идентификация культур, выделенных из нативных образцов, выращенные за 18-20 ч на плотной питательной среде при температуре (37±1) °С.
4. МЕРЫ ПРЕДОСТОРОЖНОСТИ
5. ОБОРУДОВАНИЕ И РЕАГЕНТЫ
-
Термостат, обеспечивающий температуру (37±1) °С Пробирки стеклянные Чашки Петри Вода дистиллированная Спиртовка 0,9 % раствор натрия хлорида
6. АНАЛИЗИРУЕМЫЕ ПРОБЫ
Объекты исследований в санитарной и клинической микробиологии.
7. ПРОВЕДЕНИЕ АНАЛИЗА
Идентификацию культур, выделяемых в ходе бактериологического исследования, производят со скошенного 20-% сывороточного агара. Через 18-20 ч при температуре (37±1) °С.
Если выделенная культура микроорганизма находилась какое-либо время на хранении при температуре (22±2) °С или в холодильнике при температуре (6±2) °С, производят предварительный посев ее на питательный бульон.
Посевы инкубируют в течение (3±1) ч при температуре (37±1) °С и осуществляют посев культуры на скошенный питательный агар, который инкубируют в течение 18-24 ч при температуре (37±1) °С.
Затем делают смыв культуры с поверхности скошенного агара 5 мл стерильной дистиллированной воды в обоих рассмотренных случаях посевов.
Извлекают контейнер из пачки.
Регистрируют на бумажной полоске на стенке контейнера номер засеваемого штамма.
Снимают полиэтиленовую ленту (не полностью) и располагают контейнер в чашке Петри.
Стерильной градуированной пипеткой вместимостью 1 мл 2-го класса точности вносят по 0,1 мл микробной суспензии во все ячейки контейнера.
Для создания анаэробных условий заполняют ячейки для выявления ферментации глюкозы, маннита, наличие уреазы и аргининдегидролазы (ячейки № 1,3,11,12) стерильным расплавленным парафином до верха.
Контейнер плотно закрывают той же полиэтиленовой лентой с липким слоем.
Выдерживают контейнер в термостате при температуре (37+1) °С в течение 18-24 ч.
8. РЕГИСТРАЦИЯ И УЧЕТ РЕЗУЛЬТАТОВ
Учет результатов проводят визуально в соответствии с таблицей 1.
Цветовой указатель субстратно-индикаторных сред
В современных условиях для изучения биохимической активности микроорганизмов, наряду с классическими варинтами “пестрого ряда”, применяют системы индикаторных бумажек (СИБ) и наборы мультимикротестов (ММТ).
Система индикаторных бумажек (СИБ) позволяет выявлять самые разнообразные ферменты бактерий. Это бумажные диски, пропитанные различными субстратами (индикатором, углеводами, аминокислотами, цитратом, ацетатом, малонатом и др. веществами). Утилизация вещества приводит к изменению рН среды, изменению цвета индикатора. Имеются наборы, которые содержат от десяти до тридцати тест-бумажек. Их можно непосредственно вносить в пробирки со взвесью бактерий либо предварительно поместить в лунки пластиковых планшетов, куда будут внесены исследуемые бактерии и уже через 3-4 часа инкубации в термостате можно судить о разложении реактивов по изменению цвета диска. Так, на практике применяют наборы Minitek Enterobacteriaceae lll и Minitek Neisseria для дифференциальной диагностики энтеробактерий (четырнадцать субстратов) и нейссерий (четыре субстрата), позволяющие получить результаты через 4 ч инкубации при 37 °С. Например, СИБы для идентификации вибрионов, энтеробактерий (Россия).
Микро-тест-системы для биохимической идентификации культур. В настоящее время, кроме классических биохимических тестов, для идентификации выделенных культур микробов применяют микро-тест-системы, которые повышают точность результатов за счет стандартизации и увеличения количества тестов (от 15 до 30), менее трудоемки и, следовательно, сокращают время исследования. Наборы мультитестов – это пластиковые планшеты, в лунки которых помещены различные субстраты и индикаторы. Стандартную взвесь исследуемой культуры вносят в лунки и инкубируют при 37°.
Тест-системы делятся на 2 группы в зависимости от содержания субстрата:
1. Системы, в которых субстрат и индикатор находится в питательной среде;
2. Системы, где субстрат и индикатор содержатся в носителе-шаблоне, например в бумажных дисках или полимерном шаблоне-носителе.
Инкубация тест-систем проводится в обычных термостатах или в специальных термостатируемых устройствах, входящих в комплект автоматизированных систем, где учет результатов и их интерпретация осуществляется автоматически с помощью компьютера (“Vitek”, BioMerieux, Франция).
Для тест-систем второй группы изучаемую культуру выращивают в жидких питательных средах, в которые помещают шаблон-носитель, содержащий субстрат и индикатор к изучаемому ферменту. Примером такой тест-системы является Micro-ID (Organon Teknika, США).
При необходимости ускоренной идентификации (когда лаборатории работают в круглосуточном режиме) можно использовать коммерческие рапид-системы, в которых тесты основаны не на изменении рН, а на использовании хромогенных или флюорогенных субстратов. Рапид-системы позволяют получить результаты после 4-6 часов инкубации. Примерами коммерческих рапид-систем являются API Rapid 20Е (BioMerieux, Франция), RapiD NF Plus и RapiD ANA П (IDS. США), а также RapID NH для идентификации нейссерий и гемофилов, RapID Е для энтеробактерий и др., позволяющие получить результаты не позднее 4-8 ч.
При идентификации выделенной культуры микроба определяют, чаще всего, ее видовую принадлежность, но иногда достаточно определить род или принадлежность к определенной группе. Учет результатов проводят визуально или с использованием специальных считывающих устройств - ридеров, которые повышают достоверность результатов и снижают субъективизм оценки. Каждый положительный результат оценивается знаком "+", а отрицательный - знаком. В некоторых случаях перед учетом результата теста в лунку необходимо добавить специальные проявляющие реактивы.
III. План практической работы
1. Изучить схему идентификации чистых культур бактерий
2. Изучить макроскопически и микроскопически чистоту выделенной культуры, зарисовать
3. Выполнить посевы для определения гликолитических и протеолитических свойств выделенной чистой культуры бактерий
4. Учесть результаты определения гликолитических (на средах Гисса) и протеолитических (на МПБ с индикаторными бумажками) свойств выделенных чистых культур бактерий
6. Дать заключение о видовой принадлежности выделенных чистых культур бактерий (используя дифференциально-диагностическую таблицу)
7. Решить ситуационные задачи
IV. Примеры ситуационных задач
Ситуационная задача № 1
Больной Р, 35 лет, поступил в инфекционное отделение городской больницы № 1 с гнойной ангиной, предположительно стафилококковой этиологии. Какая питательная среда должна быть использована в этом случае, обоснуйте свой выбор.
- Среда Эндо
- ЖСА
- Является дифференциально-диагностической средой и позволяет изучить биохимические свойства микроорганизмов
- Является элективной питательной средой и позволяет выявить наличие лецитиназы
Ситуационная задача № 2
Больная К, 42 лет, поступила в инфекционное отделение городской больницы № 2 с подозрением на дизентерию. После выделения чистой культуры предполагаемого инфекционного агента необходимо провести биохимическую идентификацию возбудителя, для этого необходимо использовать:
- Среду Эндо
- Среды Гисса
- МПБ или пептонную воду
- Среду Левенштейна-Йенсена,
которые позволяют изучить:
- антигенные свойства выделенной чистой культуры
- сахаролитические (гликолитические) свойства выделенной чистой культуры
- протеолитические свойства выделенной чистой культуры
- фибринолитические свойства выделенной чистой культуры
Теоретические вопросы для рубежного контроля знаний
1. Состав и требования, предъявляемые к питательным средам
2. Классификация питательных сред
3. Асептики и антисептика
4. Дезинфекция, методы и контроль эффективности дезинфекции
5. Стерилизация, методы, аппаратура и режимы стерилизации
6. Методы определения эффективности стерилизации
7. Вид, штамм, колония, чистая культура микроорганизмов
8. Методы выделения чистых культур микроорганизмов
9. Бактериологический метод диагностики инфекционных заболеваний. Цель и последовательность выполнения 1 этапа бактериологического метода выделения аэробов
10. Техника посева микроорганизмов на жидкие и плотные питательные среды
11. Особенности культивирования анаэробных микроорганизмов. Аппаратура и оборудование, используемая для культивирования анаэробных бактерий
12. Метаболизм микроорганизмов
13. Ферментные системы микроорганизмов
14. Классификация бактерий по типу питания. Источники углерода, азота, макро- и микроэлементов, ростовых факторов для микробов
15. Механизмы питания бактерий
16. Классификация микроорганизмов в зависимости от источника энергии
17. Классификация бактерий по типу дыхания - биологического окисления
18. Брожение и его виды
19. Условия культивирования бактерий
20. Рост и размножение бактерий. Фазы размножения бактерий.
21. Бактериологический метод исследования. Проведение 2 этапа бактериологического метода выделения аэробов. Культуральные свойства бактерий
22. Проведение III этапа бактериологического метода выделения чистых культур микроорганизмов. Схема идентификации микроорганизмов
23. Определение чистоты выделенной культуры
24. Использование ферментативной активности бактерий для идентификации микроорганизмов
25. Методы определения гликолитической активности микроорганизмов
26. Методы определения протеолитической активности бактерий
27. Определение окислительно-восстановительных ферментов бактерий
28. Системы для биохимической идентификации бактерий
Дата добавления: 2019-09-13 ; просмотров: 113 ;
| Стоимость услуги: | 820 руб.* Заказать |
Внимание! Для хранения и транспортировки биологического материала лаборатория CMD предоставляет специальные расходные материалы: коллектор без транспортной среды и коллектор транспортный с жидкой средой Эймса (зонд-тампон для отбора из узких полостей или зонд-тампон стандартный). Перед обращением к врачу их необходимо получить в ближайшем офисе.
Условия подготовки определяются лечащим врачом.
Взятие материала рекомендуется проводить:
- до начала антибактериальной терапии или не ранее чем через две недели после ее окончания;
- для ротоглотки. Натощак или через 4 часа после еды (не полоскать рот и не пить);
- для носовых ходов. если полость носа заполнена слизью, перед процедурой рекомендуется провести высмаркивание.
Внимание! При взятии биоматериала обязательно используются оба коллектора для каждой локализации. Предварительно на коллекторе указать локализацию.
Доставка в лабораторию в день взятия биоматериала при Т=+2+25 °С в коллекторе. Замораживание образцов недопустимо!
Метод исследования: Микробиологический.
Corynebacterium diphtheriae (палочки Леффлера) – возбудители дифтерии, характеризующейся фибринозным воспалением в месте входных ворот инфекции и токсическим поражением преимущественно сердечно-сосудистой и нервной систем. Наиболее частая форма – дифтерия ротоглотки (дифтерийная ангина), а при локализации воспаления на гортани или трахее может развиться дифтерийный круп. Основной путь передачи воздушно-капельный. Заражение происходит от больных или бактерионосителей.
Культуральные исследования выполняются с применением высококачественных транспортных и питательных сред ведущих мировых производителей. Идентификацию выделенных микроорганизмов проводят классическим бактериологическим методом с использованием современных тест-систем и определением токсигенности возбудителя.
ПОКАЗАНИЯ К ИССЛЕДОВАНИЮ:
- Обследование лиц с подозрением на дифтерию;
- Обследование контактных лиц;
- Оценка эффективности антибактериальной терапии.
ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВ:
Результат бактериологического исследования, в случае обнаружения возбудителя дифтерии (Corynebacterium diphtheriae) предоставляется в качественном формате.
Интерпретация проводится врачом с учетом клинических проявлений.
" ["serv_cost"]=> string(3) "820" ["cito_price"]=> NULL ["parent"]=> string(3) "542" [10]=> string(1) "1" ["limit"]=> NULL ["bmats"]=> array(3) < [0]=>array(3) < ["cito"]=>string(1) "N" ["own_bmat"]=> string(2) "12" ["name"]=> string(52) "Мазок/отделяемое ротоглотки" > [1]=> array(3) < ["cito"]=>string(1) "N" ["own_bmat"]=> string(2) "12" ["name"]=> string(52) "Мазок/отделяемое носоглотки" > [2]=> array(3) < ["cito"]=>string(1) "N" ["own_bmat"]=> string(2) "12" ["name"]=> string(57) "Мазок/отделяемое носовых ходов" > > >
| Тип | В офисе |
|---|---|
| Мазок/отделяемое ротоглотки | |
| Мазок/отделяемое носоглотки | |
| Мазок/отделяемое носовых ходов |
Внимание! Для хранения и транспортировки биологического материала лаборатория CMD предоставляет специальные расходные материалы: коллектор без транспортной среды и коллектор транспортный с жидкой средой Эймса (зонд-тампон для отбора из узких полостей или зонд-тампон стандартный). Перед обращением к врачу их необходимо получить в ближайшем офисе.
Условия подготовки определяются лечащим врачом.
Взятие материала рекомендуется проводить:
- до начала антибактериальной терапии или не ранее чем через две недели после ее окончания;
- для ротоглотки. Натощак или через 4 часа после еды (не полоскать рот и не пить);
- для носовых ходов. если полость носа заполнена слизью, перед процедурой рекомендуется провести высмаркивание.
Внимание! При взятии биоматериала обязательно используются оба коллектора для каждой локализации. Предварительно на коллекторе указать локализацию.
Доставка в лабораторию в день взятия биоматериала при Т=+2+25 °С в коллекторе. Замораживание образцов недопустимо!
Метод исследования: Микробиологический.
Corynebacterium diphtheriae (палочки Леффлера) – возбудители дифтерии, характеризующейся фибринозным воспалением в месте входных ворот инфекции и токсическим поражением преимущественно сердечно-сосудистой и нервной систем. Наиболее частая форма – дифтерия ротоглотки (дифтерийная ангина), а при локализации воспаления на гортани или трахее может развиться дифтерийный круп. Основной путь передачи воздушно-капельный. Заражение происходит от больных или бактерионосителей.
Культуральные исследования выполняются с применением высококачественных транспортных и питательных сред ведущих мировых производителей. Идентификацию выделенных микроорганизмов проводят классическим бактериологическим методом с использованием современных тест-систем и определением токсигенности возбудителя.
ПОКАЗАНИЯ К ИССЛЕДОВАНИЮ:
- Обследование лиц с подозрением на дифтерию;
- Обследование контактных лиц;
- Оценка эффективности антибактериальной терапии.
ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВ:
Результат бактериологического исследования, в случае обнаружения возбудителя дифтерии (Corynebacterium diphtheriae) предоставляется в качественном формате.
Интерпретация проводится врачом с учетом клинических проявлений.
Продолжая использовать наш сайт, вы даете согласие на обработку файлов cookie, пользовательских данных (сведения о местоположении; тип и версия ОС; тип и версия Браузера; тип устройства и разрешение его экрана; источник откуда пришел на сайт пользователь; с какого сайта или по какой рекламе; язык ОС и Браузера; какие страницы открывает и на какие кнопки нажимает пользователь; ip-адрес) в целях функционирования сайта, проведения ретаргетинга и проведения статистических исследований и обзоров. Если вы не хотите, чтобы ваши данные обрабатывались, покиньте сайт.
Copyright ФБУН Центральный НИИ Эпидемиологии Роспотребнадзора, 1998 - 2020

! Продолжая использовать наш сайт, вы даете согласие на обработку файлов cookie, пользовательских данных (сведения о местоположении; тип и версия ОС; тип и версия Браузера; тип устройства и разрешение его экрана; источник откуда пришел на сайт пользователь; с какого сайта или по какой рекламе; язык ОС и Браузера; какие страницы открывает и на какие кнопки нажимает пользователь; ip-адрес) в целях функционирования сайта, проведения ретаргетинга и проведения статистических исследований и обзоров. Если вы не хотите, чтобы ваши данные обрабатывались, покиньте сайт.
В современных условиях для изучения биохимической активности микроорганизмов, наряду с классическими варинтами “пестрого ряда”, применяют системы индикаторных бумажек (СИБ) и наборы мультимикротестов (ММТ).
Система индикаторных бумажек (СИБ) позволяет выявлять самые разнообразные ферменты бактерий. Это бумажные диски, пропитанные различными субстратами (индикатором, углеводами, аминокислотами, цитратом, ацетатом, малонатом и др. веществами). Утилизация вещества приводит к изменению рН среды, изменению цвета индикатора. Имеются наборы, которые содержат от десяти до тридцати тест-бумажек. Их можно непосредственно вносить в пробирки со взвесью бактерий либо предварительно поместить в лунки пластиковых планшетов, куда будут внесены исследуемые бактерии и уже через 3-4 часа инкубации в термостате можно судить о разложении реактивов по изменению цвета диска. Так, на практике применяют наборы Minitek Enterobacteriaceae lll и Minitek Neisseria для дифференциальной диагностики энтеробактерий (четырнадцать субстратов) и нейссерий (четыре субстрата), позволяющие получить результаты через 4 ч инкубации при 37 °С. Например, СИБы для идентификации вибрионов, энтеробактерий (Россия).
Микро-тест-системы для биохимической идентификации культур.В настоящее время, кроме классических биохимических тестов, для идентификации выделенных культур микробов применяют микро-тест-системы, которые повышают точность результатов за счет стандартизации и увеличения количества тестов (от 15 до 30), менее трудоемки и, следовательно, сокращают время исследования. Наборы мультитестов — это пластиковые планшеты, в лунки которых помещены различные субстраты и индикаторы. Стандартную взвесь исследуемой культуры вносят в лунки и инкубируют при 37°.
Тест-системы делятся на 2 группы в зависимости от содержания субстрата:
1. Системы, в которых субстрат и индикатор находится в питательной среде;
2. Системы, где субстрат и индикатор содержатся в носителе-шаблоне, например в бумажных дисках или полимерном шаблоне-носителе.
Инкубация тест-систем проводится в обычных термостатах или в специальных термостатируемых устройствах, входящих в комплект автоматизированных систем, где учет результатов и их интерпретация осуществляется автоматически с помощью компьютера (“Vitek”, BioMerieux, Франция).
Для тест-систем второй группы изучаемую культуру выращивают в жидких питательных средах, в которые помещают шаблон-носитель, содержащий субстрат и индикатор к изучаемому ферменту. Примером такой тест-системы является Micro-ID (Organon Teknika, США).
При необходимости ускоренной идентификации (когда лаборатории работают в круглосуточном режиме) можно использовать коммерческие рапид-системы, в которых тесты основаны не на изменении рН, а на использовании хромогенных или флюорогенных субстратов. Рапид-системы позволяют получить результаты после 4-6 часов инкубации. Примерами коммерческих рапид-систем являются API Rapid 20Е (BioMerieux, Франция), RapiD NF Plus и RapiD ANA П (IDS. США), а также RapID NH для идентификации нейссерий и гемофилов, RapID Е для энтеробактерий и др., позволяющие получить результаты не позднее 4-8 ч.
При идентификации выделенной культуры микроба определяют, чаще всего, ее видовую принадлежность, но иногда достаточно определить род или принадлежность к определенной группе. Учет результатов проводят визуально или с использованием специальных считывающих устройств — ридеров, которые повышают достоверность результатов и снижают субъективизм оценки. Каждый положительный результат оценивается знаком "+", а отрицательный — знаком. В некоторых случаях перед учетом результата теста в лунку необходимо добавить специальные проявляющие реактивы.
III. План практической работы
1. Изучить схему идентификации чистых культур бактерий
2. Изучить макроскопически и микроскопически чистоту выделенной культуры, зарисовать
3. Выполнить посевы для определения гликолитических и протеолитических свойств выделенной чистой культуры бактерий
4. Учесть результаты определения гликолитических (на средах Гисса) и протеолитических (на МПБ с индикаторными бумажками) свойств выделенных чистых культур бактерий
6. Дать заключение о видовой принадлежности выделенных чистых культур бактерий (используя дифференциально-диагностическую таблицу)
7. Решить ситуационные задачи
IV. Примеры ситуационных задач
Ситуационная задача № 1
Больной Р, 35 лет, поступил в инфекционное отделение городской больницы № 1 с гнойной ангиной, предположительно стафилококковой этиологии. Какая питательная среда должна быть использована в этом случае, обоснуйте свой выбор.
- Среда Эндо
- ЖСА
- Является дифференциально-диагностической средой и позволяет изучить биохимические свойства микроорганизмов
- Является элективной питательной средой и позволяет выявить наличие лецитиназы
Ситуационная задача № 2
Больная К, 42 лет, поступила в инфекционное отделение городской больницы № 2 с подозрением на дизентерию. После выделения чистой культуры предполагаемого инфекционного агента необходимо провести биохимическую идентификацию возбудителя, для этого необходимо использовать:
- Среду Эндо
- Среды Гисса
- МПБ или пептонную воду
- Среду Левенштейна-Йенсена,
которые позволяют изучить:
- антигенные свойства выделенной чистой культуры
- сахаролитические (гликолитические) свойства выделенной чистой культуры
- протеолитические свойства выделенной чистой культуры
- фибринолитические свойства выделенной чистой культуры
Теоретические вопросы для рубежного контроля знаний
1. Состав и требования, предъявляемые к питательным средам
2. Классификация питательных сред
3. Асептики и антисептика
4. Дезинфекция, методы и контроль эффективности дезинфекции
5. Стерилизация, методы, аппаратура и режимы стерилизации
6. Методы определения эффективности стерилизации
7. Вид, штамм, колония, чистая культура микроорганизмов
8. Методы выделения чистых культур микроорганизмов
9. Бактериологический метод диагностики инфекционных заболеваний. Цель и последовательность выполнения 1 этапа бактериологического метода выделения аэробов
10. Техника посева микроорганизмов на жидкие и плотные питательные среды
11. Особенности культивирования анаэробных микроорганизмов. Аппаратура и оборудование, используемая для культивирования анаэробных бактерий
12. Метаболизм микроорганизмов
13. Ферментные системы микроорганизмов
14. Классификация бактерий по типу питания. Источники углерода, азота, макро- и микроэлементов, ростовых факторов для микробов
15. Механизмы питания бактерий
16. Классификация микроорганизмов в зависимости от источника энергии
17. Классификация бактерий по типу дыхания — биологического окисления
18. Брожение и его виды
19. Условия культивирования бактерий
20. Рост и размножение бактерий. Фазы размножения бактерий.
21. Бактериологический метод исследования. Проведение 2 этапа бактериологического метода выделения аэробов. Культуральные свойства бактерий
22. Проведение III этапа бактериологического метода выделения чистых культур микроорганизмов. Схема идентификации микроорганизмов
23. Определение чистоты выделенной культуры
24. Использование ферментативной активности бактерий для идентификации микроорганизмов
25. Методы определения гликолитической активности микроорганизмов
26. Методы определения протеолитической активности бактерий
27. Определение окислительно-восстановительных ферментов бактерий
28. Системы для биохимической идентификации бактерий
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
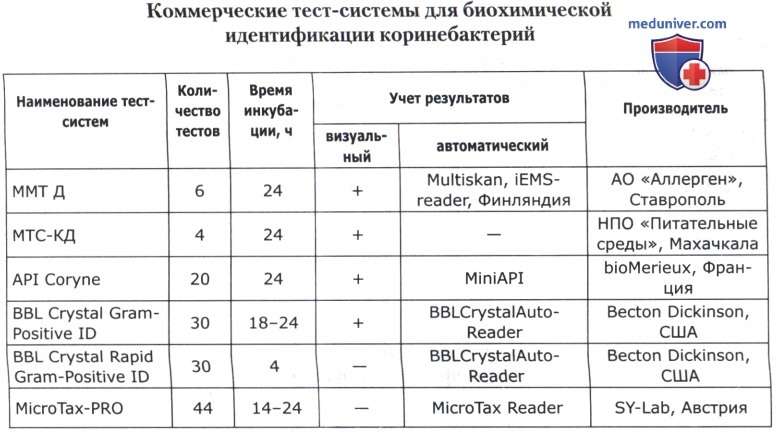
Дифференциация и идентификация возбудителей - определение родовой, видовой и типовой принадлежности микроорганизмов — наиболее ответственная часть микробиологического исследования. Оно осуществляется на основании изучения целого комплекса свойств: морфологических, тинкториальных, культуральных, ферментативных и антигенных.
Все расширяющийся спектр возбудителей гнойно-воспалительных заболеваний требует изучения их по многим биохимическим показателям. Применяемые в настоящее время традиционные методы проведения микробиологического исследования не могут обеспечить необходимого его уровня в связи с трудоемкостью процесса приготовления дифференциально-диагностических сред, их многообразием, сложностью приобретения и дороговизной многих компонентов, отсутствием необходимой стандартности, большим расходом лабораторной посуды и т. д. Кроме того, продолжительность исследования в течение 4-7 дней практически обесценивает его значимость для конкретного больного.
Разработанные и внедренные в широкую практику коммерческие микротест-системы имеют несомненные преимущества перед традиционными методами исследования. Преимущества эти состоят в следующем:
— возможность одномоментного проведения широкого ряда биохимических реакций, что позволяет осуществить идентификацию, как правило, в один этап;
— значительное расширение спектра идентифицируемых микроорганизмов;
— сокращение продолжительности исследования, материальных и трудовых затрат;
— получение стандартных воспроизводимых результатов;
— математическая обработка данных;
— использование автоматизации при оценке результатов биохимических реакций.
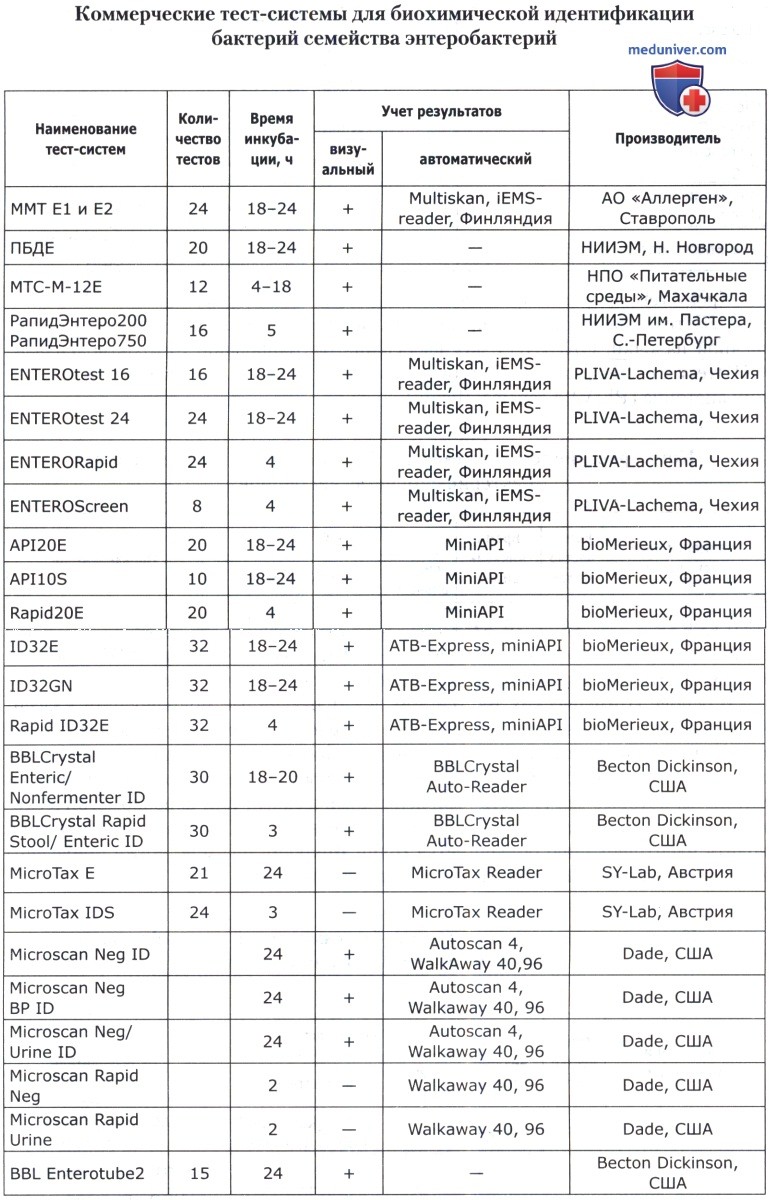
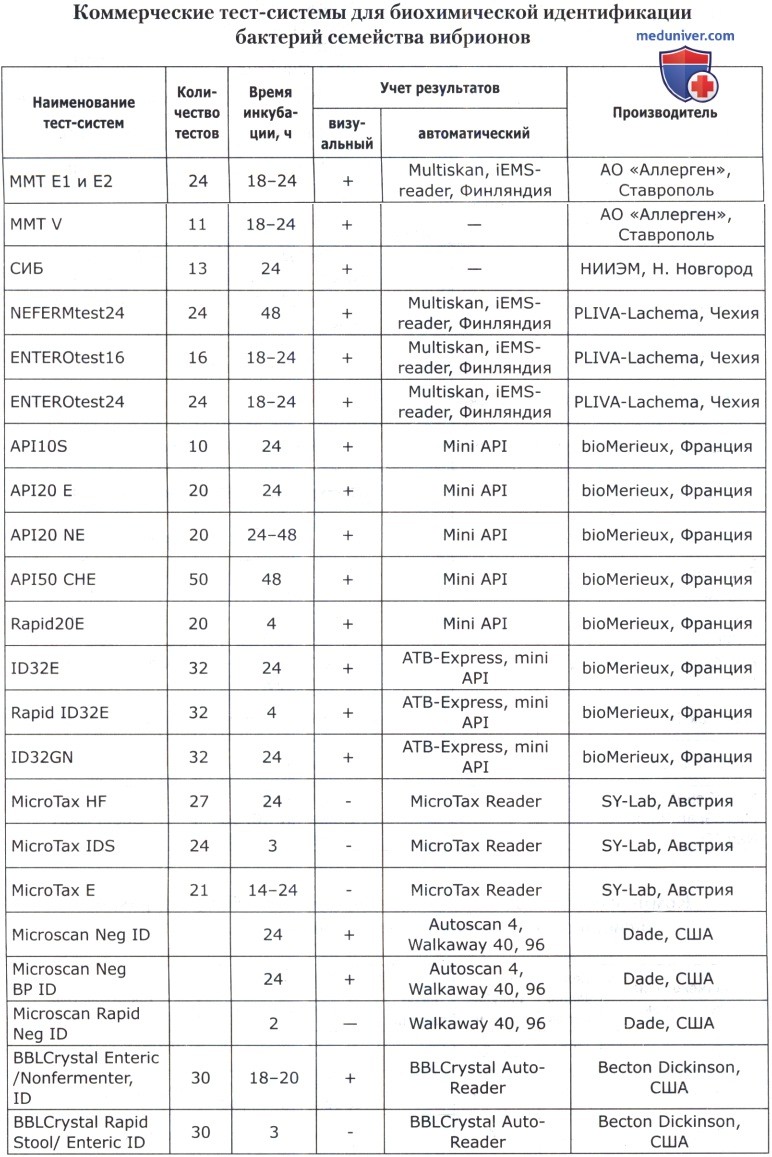
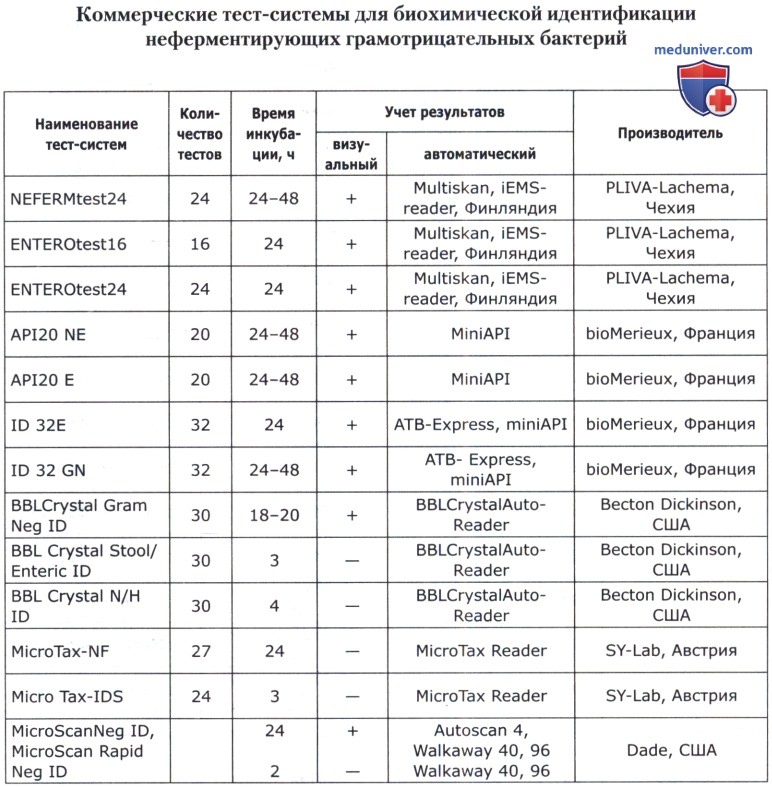
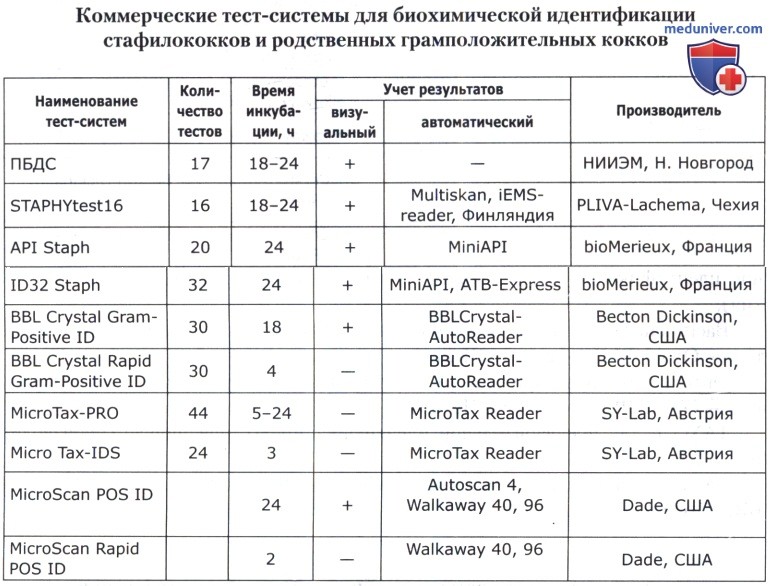
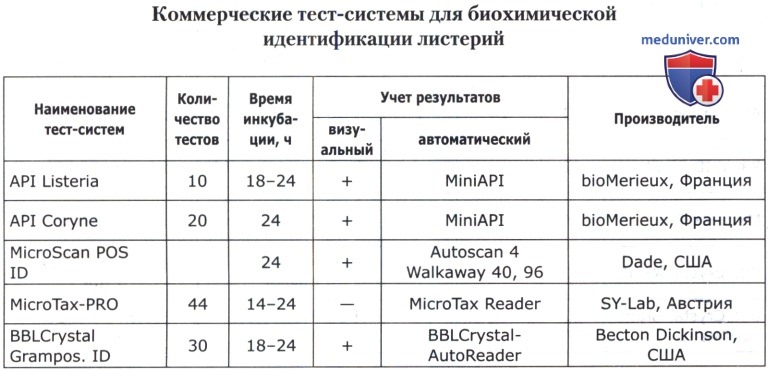
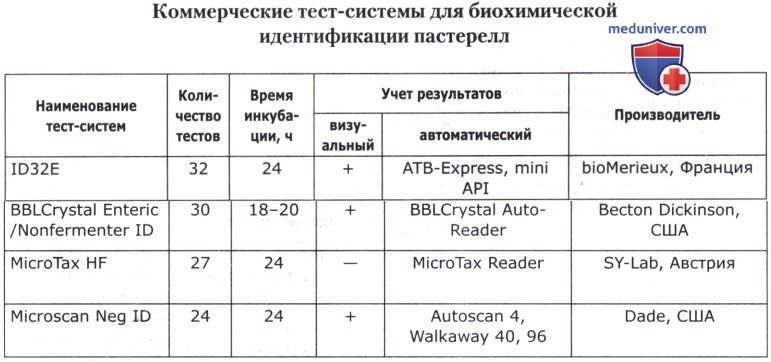
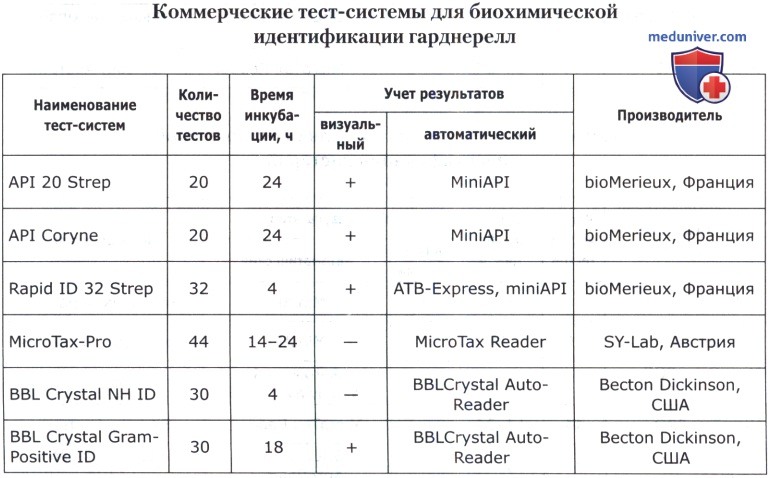
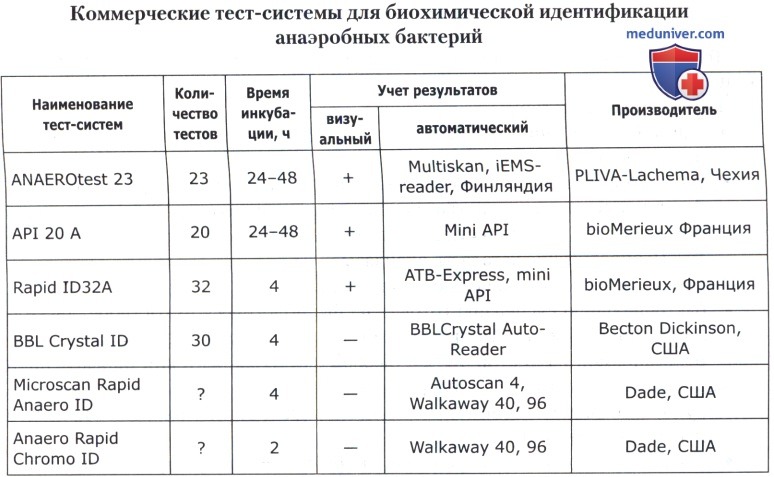
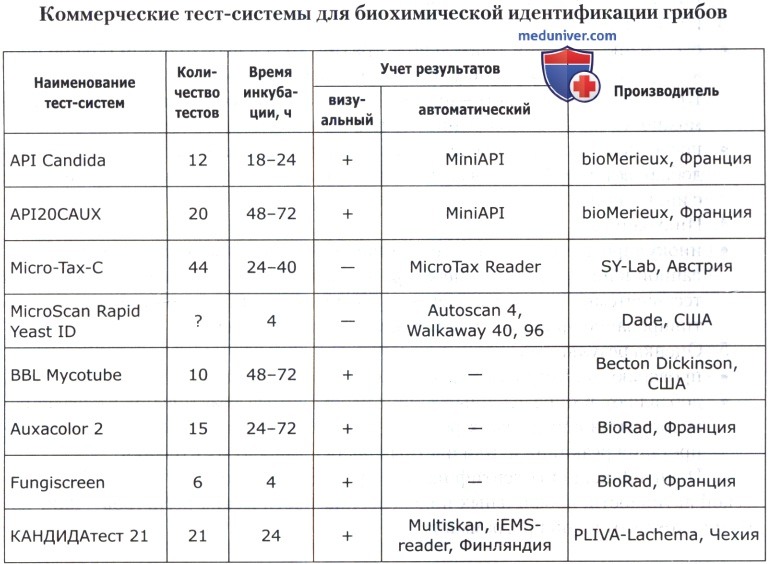
В основе коммерческих тест-систем лежат различные модификации классического метода, включающего тесты для определения ферментации, ассимиляции, оксидации, деградации, гидролиза различных биосубстратов. В некоторые из них для ускорения процесса идентификации добавляют хроматогены или флюорохроматогены, которые могут быть выявлены химическими или флюорометрическими методами при помощи приборов. Коммерческие тест-системы позволяют проводить идентификацию большинства групп микроорганизмов. Ниже приведены тест-системы, наиболее известные в нашей стране.
Кроме того, широкое применение имеют диагностические полоски САЛМтест и КОЛИтест для ускоренной предварительной идентификации сальмонелл и кишечной палочки, ОКСИтест для выявления бактериальной цитохромоксидазы, ОНП тест для обнаружения бета-галактозидазы, ВПтест для определения продукции ацетоина (PLIVA-Lachema, Чехия).
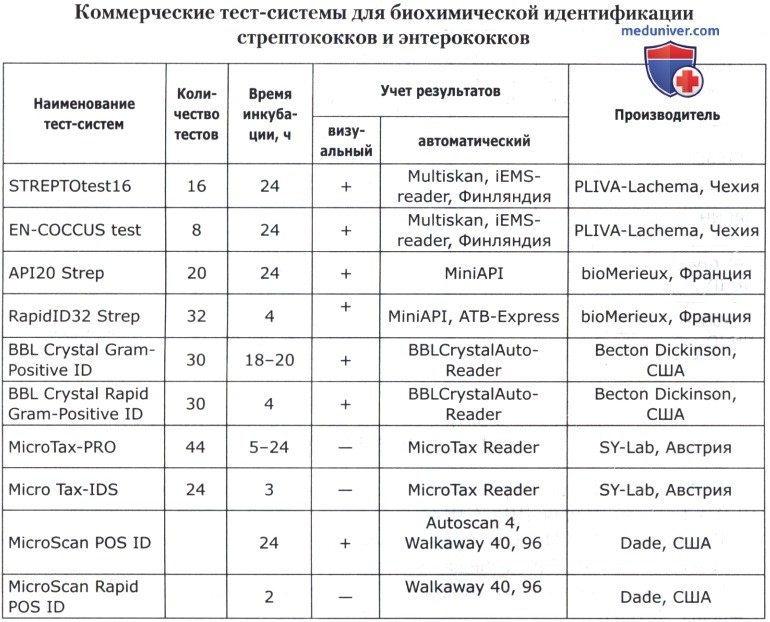
а) Диагностические полоски и диски для идентификации стрептококков и энтерококков. PYRtest для дифференциации энтерококков и стрептококков, предварительной идентификации Str. pyogenes (производители — Oxoid; PLIVA-Lachema, Чехия);
Bacitracin S для предварительной идентификации Str. pyogenes (производители — Oxoid; PLIVA-Lachema, Чехия);
Оптохин для предварительной идентификации Str. pneumoniae (производители — Oxoid; PLIVA-Lachema, Чехия);
ТАХО Р для предварительной идентификации Str. pneumoniae (производитель - BBL, США);
ТАХО А для предварительной идентификации Str. pyogenes (производитель — BBL, США).
б) Диагностические диски:
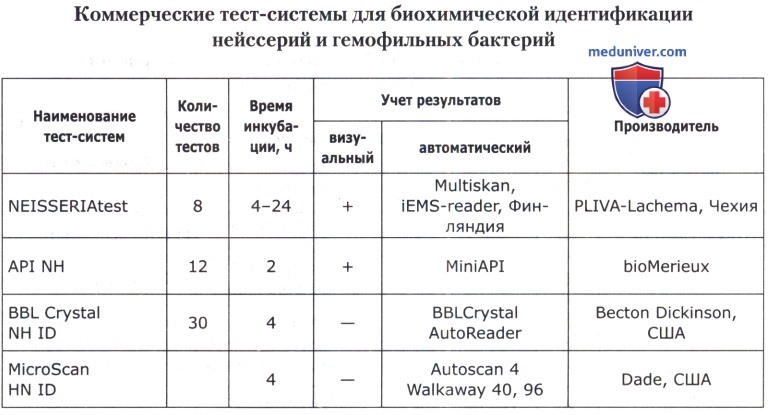
X, V, X+V для дифференциации гемофильных бактерий (производители — PLIVA-Lachema, Чехия; BBL, США);
Bacitracin 10 ED для селективной изоляции гемофильных бактерий (производитель — PLIVA-Lachema, Чехия);
V+K для селективной изоляции N. meningitidis (производитель — PLIVA-Lachema, Чехия).
в) Общие правила работы с микротест-системами. Техника работы с микротест-системами проста и состоит из следующих этапов:
1. Выделение культуры:
• при идентификации микроорганизмов необходимо работать только с чистой культурой;
• по результатам первичного посева и данным микроскопии проводится дифференциация культур на грамположительные и грамотрицательные кокки и палочки для выбора тест-системы; при необходимости ставятся экспресс-тесты: определение каталазы, оксидазы.
2. Приготовление бактериальной суспензии:
• бактериальную суспензию готовят на физиологическом растворе, дистиллированной воде или суспензионной среде для определенных групп микроорганизмов из чистой 18-24-часовой культуры бактерий определенной степени мутности, по стандарту Мак-Фарланда. Тщательно гомогенизируют суспензию. Слишком густая или жидкая суспензия может привести к ложным результатам;
• параллельно делают контрольный высев суспензии культуры на кровяной агар для проверки чистоты культуры, ее ростовых свойств и/или для постановки дополнительных тестов.
3. Инокуляция:
• суспензию бактерий тщательно встряхивают и в необходимом объеме ино-кулируют в каждую лунку или ячейку в зависимости от вида тест-систем. При работе с планшетными тест-системами необходимо исключить возможность заражения соседних лунок;
• после инокуляции в определенные лунки для создания анаэробных условий добавляют стерильное вазелиновое (парафиновое) масло в соответствии с инструкцией.
4. Инкубация:
• инокулированные тест-системы инкубируют в термостате при рекомендованной в инструкции температуре в течение 2-48 ч, в зависимости от вида тест-системы. В ряде случаев для ускорения роста микроорганизмов культивирование проводят со встряхиванием тест-систем.
Расчет профиля. Результаты биохимических реакций переводят в цифровой код — профиль. Для этого все тесты в биохимическом ряду разбивают на триады, в каждой из которых положительным результатам дают числовые значения: 1 тест — 1, 2 тест — 2, 3 тест — 4, все отрицательные результаты — 0. Суммируют числовые значения в триадах. Полученный числовой код соответствует профилю исследуемого микроорганизма. Например:

Полученный профиль 361 соответствует таксону Klebsiella pneumoniae.
Аналогично рассчитанный профиль используется для идентификации при помощи книг кодов (регистров). При этом для каждого таксона определяются два следующих показателя:
а) процент идентификации (%id.) —показывает, насколько полученный профиль соответствует идентифицируемому микробу по сравнению с другими таксонами, включенными в банк данных (%id. — критерий отличия микроба от других таксонов);
б) Т-индекс (Tin) — показывает соответствие профиля большинству типичных реакций данного таксона; значение этого показателя варьирует от 0 до 1 и обратно, пропорционально количеству атипичных тестов.
Книги кодов позволяют проводить достоверную идентификацию и в случае выявления 1-2 нетипичных для исследуемого вида результатов.
Контроль качества. Качество тест-систем контролируют при помощи референтных бактериальных культур, перечень последних приводится в инструкциях к тест-системам.
Наиболее частые причины неудач при идентификации:
• смешанная культура
• использование суспензий с недостаточной мутностью или в недостаточном объеме
• перекрестная контаминация суспензий в расположенных рядом лунках
• соответствующие лунки не заполнены парафиновым маслом
• попадание реактивов в соседние лунки (ячейки)
• не точно соблюдена методика постановки теста
• отсутствие анаэробной атмосферы при культивации анаэробных бактерий
• возможно выделение штамма с нетипичными свойствами или его данные не заложены в таблицы.
При получении несовпадающих результатов при работе с тест-системами разных производителей, в сомнительных случаях и при получении заключения о выделении редко встречающихся видов микроорганизмов для окончательной верификации культуры необходима проверка ее либо в референтных лабораториях, либо проведение повторной идентификации классическим методом с использованием традиционно приготовленных дифференциально-диагностических сред в комплексе с оценкой морфологических, тинкториальных, культуральных и других свойств.

Накопленный опыт работы с коммерческими тест-системами показал:
— уникальность тест-систем, включающих различные спектры биохимических тестов для одних и тех же групп микроорганизмов;
— возможность различного проявления одних и тех же ферментативных реакций при культивировании одних и тех же культур в различных тест-системах;
— необходимость использования для контроля качества работы тест-систем музейных штаммов, рекомендованных фирмой производителем;
— в банках к тест-системам встречаются различные наименования одних и тех же таксонов, что необходимо учитывать при проведении идентификации.
Редактор: Искандер Милевски. Дата публикации: 4.09.2019
Читайте также:
- Спинальная анестезия при сепсисе
- Когда в россии было последнее заболевание дифтерией
- В нижегородской области бруцеллез
- Что при лепре с глазами
- Пропущено прививка от пневмококковой


