Ацетальдегид алкоголя. Окисление ацетальдегида алкоголя
Добавил пользователь Евгений Кузнецов Обновлено: 08.01.2026
Маркер связан с особенностями метаболизма алкоголя. Исследуется для выявления генетической предрасположенности к алкоголизму, ассоциированной со скоростью окисления этанола до ацетальдегида в организме и степенью алкогольного отравления.
Метод исследования
Полиморфизм длин рестрикционных фрагментов.
Какой биоматериал можно использовать для исследования?
Венозную кровь, буккальный (щечный) эпителий.
Как правильно подготовиться к исследованию?
Специальной подготовки не требуется.
Название гена - ADH1C
OMIM - *103730
Локализация гена на хромосоме - 4q23
Функция гена
Ген ADH1С кодирует гамма-субъединицу белка алкогольдегидрогеназы (ADH). Белок ADH – фермент, участвующий в метаболизме этанола, окисляет его до ацетальдегида. У взрослых людей он наиболее активен в печени и почках.
Генетический маркер A1048G
Участок ДНК гена ADH1С, в котором происходит замена аденина (А) на гуанин (G) в позиции 1048, обозначается как генетический маркер A1048G. Следовательно, изменяются и биохимические свойства фермента, в котором аминокислота изолейцин замещается на валин.
A1048G – обозначение замены азотистого основания аденина на гуанин в позиции 1048 последовательности гена.
Ile349Val – обозначение замены аминокислоты изолейцина на валин в белке в позиции 349.
Возможные генотипы
- А/А или *1/*1
- А/G или *1/*2
- G/G или *2/*2
Встречаемость в популяции
Встречаемость минорного (G или *2) аллеля в европейской популяции составляет 42 %.
Общая информация об исследовании
В метаболизме алкоголя участвуют два основных фермента. Сначала под действием фермента алкогольдегидрогеназы этанол превращается в ацетальдегид, а далее ацетальдегид при помощи фермента альдегиддегидрогеназы в ацетат. Работа этих ферментов, скорость их метаболизма обусловлены генетически и зависят от разных вариантов генов, кодирующих эти ферменты.
Этанол (этиловый спирт) является достаточно токсичным соединением, и алкоголь наносит вред здоровью, хотя ряд исследований позволяет предположить пользу умеренного потребления, например, красного вина. Как выяснили ученые, все зависит от особенностей метаболизма алкоголя в организме человека.
Белок алкогольдегидрогеназа (ADH) состоит из альфа-, бета- и гамма-субъединиц, каждая из которых кодируется соответственным геном. Ген алкогольдегидрогеназы ADH1С локализован на 4-й хромосоме и кодирует гамма-субъединицу алкогольдегидрогеназы.
На активность фермента может очень сильно влиять замена одного основания в кодирующей его последовательности ДНК. В процессе эволюции образовались два варианта данного гена. Основной вариант обозначается как *1 (или А), а вариант гена, произошедший в результате мутации, – как *2 (или G). Вследствие такой замены очень сильно меняется активность фермента ADH.
Активность фермента у лиц, имеющих генотип *2/*2, по сравнению с людьми, несущими основные варианты гена *1/*1, снижена.
Выявление данного генетического маркера может во многом объяснить различия в реакции на алкоголь у разных людей.
У некоторых после употребления даже небольшого количества алкоголя проявляются признаки его непереносимости, такие как покраснение лица, тахикардия, тошнота, мышечная слабость и др. Такое врождённое свойство сохраняется на всю жизнь и связано с особенностями метаболизма. При этом этанол достаточно быстро превращается в ацетальдегид и спирт удаляется из крови (присутствуют аллели ADH1B*2 и ADH1C*1). Но ацетальдегид, в свою очередь, расщепляется очень медленно и циркулирует в крови в высоких концентрациях. Именно его длительное присутствие и вызывает неприятные симптомы и плохое самочувствие у человека сразу после принятого алкоголя. Такой вариант метаболизма считается в какой-то мере защитой от алкоголизма. Но при постоянном употреблении алкоголя существует повышенный риск развития рака печени, пищевода, так как ацетальдегид является канцерогеном. Такой тип обмена спиртов встречается преимущественно в азиатской популяции.
У большинства европейцев все происходит наоборот: первый этап окисления идет медленно (аллели ADH1B*1 и ADH1C*2), и этанол длительно не выводится из организма, а второй этап (превращение до нетоксичных продуктов – ацетата) – быстро. При таком варианте работы ферментов риск развития алкогольной зависимости выше. Соответственно, и риск развития заболеваний вследствие токсического действия этанола значительно возрастает. У регулярно принимающих алкоголь людей нередко развивается алкогольный гепатит, затем цирроз. Также существенно повышается риск сердечно-сосудистых заболеваний, таких как атеросклероз и ишемическая болезнь сердца. Увеличивается вероятность развития панкреатита.
Интерпретация результатов
Оценка генотипа по маркеру:
*1/*1 – нормальная (быстрая) активность фермента;
*1/*2 - повышенная активность фермента;
*2/*2 - низкая активность фермента.
Результаты исследования должны интерпретироваться врачом в комплексе с другими генетическими, анамнестическими, клиническими и лабораторными данными.
Диагностическая значимость
Для выявления характера работы фермента алкогольдегидрогеназы необходимо также оценивать маркер, локализованный в гене ADH1В.
Важные замечания
Для данного маркера не существует понятия "норма" и "патология", т. к. исследуется полиморфизм гена.
Пьяные мыши потеряли координацию из-за окисления спирта в мозжечке
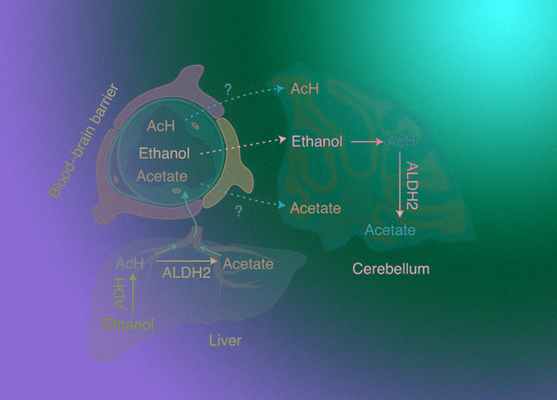
Американские исследователи показали на мышах, что моторные нарушения после приема алкоголя могут быть обусловлены его окислением до ацетата прямо в мозге, а не в печени, как считалось ранее. В частности, активность фермента ацетальдегиддегидрогеназы была обнаружена в мозжечке, который и отвечает за координацию. Статья опубликована в журнале Nature Metabolism.
Распад этанола в организме млекопитающих происходит в два этапа — окисление до ацетальдегида с участием фермента алькогольдегидрогеназы (ADH), а затем окисление последнего до ацетата (остатка уксусной кислоты). Вторую реакцию осуществляет ацетальдегиддегидрогеназа (ALD). Разные варианты гена ALD2 у людей, в частности, определяют индивидуальную реакцию на алкоголь.
Согласно устоявшейся концепции, метаболизм этанола преимущественно происходит в печени, откуда продукты распада попадают в мозг. В то время как ацетальдегид считался наиболее токсичным продуктом метаболизма этанола, конечный продукт распада — ацетат, считался безопасным. Последние исследования, однако, показывают, что у мышей ацетат также вовлечен в формирование алкогольной интоксикации, причем эти эффекты сопряжены со вспомогательными клетками мозга (астроцитами).
Нейробиологи из Института алкоголизма Национальных институтов здоровья США под руководством Ли Чжана (Li Zhang) обнаружили, что поведенческие эффекты, оказываемые этанолом на мышей, вероятно обусловлены действием фермента, кодируемого ALD2, прямо в мозжечке, а не в печени.
Сравнивая разные отделы мозга при помощи количественного анализа РНК и самого фермента, ученые показали, что экспрессия гена ALD2 наиболее выражена в мозжечке, и наименее выражена в префронтальной коре. Этот результат был получен in vitro для 11 срезов мышиного мозга и трех образцов человеческого. Колокализация с маркерами, экспрессируемыми астроцитами показала, что в мозжечке ацетальдегиддегидрогеназу продуцируют именно эти клетки. В экспериментах in vivo на мышах небольшое количество этанола (грамм на килограмм веса), которое давали животным, вызывало появление ацетата в мозжечке, но при этом у мышей с локально выключенным геном ALD2 в мозге количество ацетата было сильно снижено. Такого снижения не наблюдалось у мышей с дефицитом фермента в печени.
В поисках механизма влияния ацетата на мозг нейробиологи обнаружили, что потребление этанола вызывает у мышей ALD2-зависимое повышение концентрации одного из ключевых нейромедиаторов нервной системы — гамма-аминомасляной кислоты (ГАМК). Этот всплеск, в свою очередь, приводит к так называемому ГАМК-зависимому тоническому ингибированию, результатом которого становятся нарушения моторных функций и поведения животных. Эту гипотезу ученые подтвердили результатами поведенческих экспериментов с дефицитными по ALD2 в мозге мышами — они были менее подвержены потере координации после употребления алкоголя, чем контрольные мыши.
Ацетальдегид алкоголя. Окисление ацетальдегида алкоголя
Ацетальдегид алкоголя. Окисление ацетальдегида алкоголя
Небольшое количество ацетальдегида, образовавшегося при окислении алкоголя, превращается в бета-оксимасляную кислоту (К. Isselbacher и N. Greenberg, 1964), основная же часть продолжает окисляться до ацетилкоэнзима А (ацетил-Co А) прямым путем (С. Lieber и С. Davidson, 1962) или через стадию образования уксусной кислоты, количество которой в плазме закономерно нарастает после приема алкоголя (F. Lundquist с соавт., 1962; О. Lindeneg с соавт., 1964).
Реакция окисления ацетальдегида катализируется альдегиддегидрогеназой снова с участием НАД в качестве акцептора водорода и восстановлением его в НАДН (W. Westerfeld и М. Schulman, 1959; М. Victor и R. Adams, 1962). Ацетатная часть молекулы образовавшегося таким путем ацетил-Co А так же, как ацетил-Co А, продуцированный другими источниками, частично вовлекается в цикл Сцент—Дьерди—Кребса и окисляется в двуокись углерода и воду, частично же определяется в молекулах жирных кислот и в холестерине (М. Wakabayashi с соавт., 1961).
НАДН, образовавшийся в результате обмена алкоголя, подобно НАДН, продуцируемому при окислении других веществ, реоксидируется большей частью при помощи так называемой большой системы окисления НАДН, или флавопротеин-цитохромной системы, локализующейся в митохондриях.
В цитоплазматической же части печеночной клетки окисление алкоголя в ацетальдегид сопровождается одновременным восстановлением пировиноградной кислоты в молочную (W. Westerfeld и М. Schulman, 1959) при помощи НАДН, который действует как интермедиарный переносчик водорода. Часть водорода, образующегося при окислении алкоголя, используется в процессе синтеза жирных кислот, снова с участием НАДН в качестве промежуточного переносчика водорода.
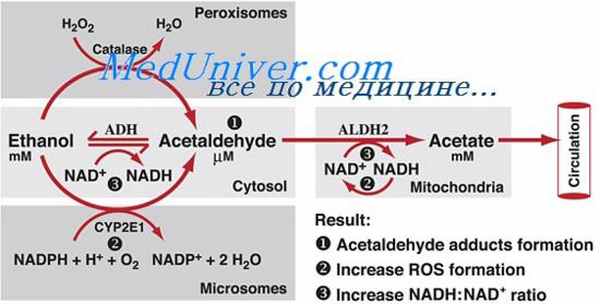
Таким образом, алкоголь стимулирует синтез жирных кислот в печени (С. Rouiller, 1964). Жирные кислоты откладываются в химически относительно инертной форме (в виде нейтральных жиров), и аккумуляция их не угнетает темп реакций, протекающих одновременно с окислением алкоголя.
НАДН образуется из НАД также при окислении других субстанций, помимо алкоголя, главным образом при оксидации глюкозы. Однако НАД реагирует с этанолом активнее, чем с изокалорическим количеством глюкозы. Это связано, по-видимому, с более высоким, чем у глюкозы, водород/углеродным соотношением этилового спирта, а также с тем, что в противоположность глюкозе внепеченочный метаболизм алкоголя невелик (С. Lutwak—Mann, 1938; A. Wereat и J. Perloff, 1973).
Поэтому, хотя такие продукты окисления алкоголя, как ацетил-Co А и НАДН, образуются при различных метаболических реакциях и из различных субстратов, выраженное изменение соотношения НАДН/НАД в сторону увеличения весьма характерно для метаболизма алкоголя в печени.
Опыты с использованием алкоголя, меченного С14, показали, что изменение соотношения НАДН/НАД сопровождается увеличением инкорпорации ацетата-С14 в жирные кислоты; в то же время количество ацетата-С14, поступающего в цикл лимонной кислоты, уменьшается (М. Wakabayashi с соавт., 1961).
Установленное при хронической алкогольной интоксикации нарушение соотношения НАДН/НАД обусловливает, таким образом, нарушение интермедиарного метаболизма на уровне цикла трикарбоновых кислот. В связи с тем что пиридиннуклеотиды участвуют во всех метаболических реакциях организма, можно полагать, что нарушение соотношения НАДН/НАД при алкогольной интоксикации вызывает метаболические нарушения во многих органах и системах, в том числе и в сердце.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Ацетальдегид алкоголя. Окисление ацетальдегида алкоголя
Предлагаемая технология может быть использована в пищевой и медицинской промышленности для создания функциональных продуктов питания и ингредиентов для производства продуктов питания и напитков. В качестве объекта исследований были выбраны дрожжи Saccharomyces cerevisiae, обладающие высокой каталитической активностью по отношению к этиловому спирту и ацетальгидегиду. С целью получения этанол-метаболизирующей системы, состоящей из двух ферментов (алкогольдегидрогеназы и альдегиддегидрогеназы), проводят ионообменную хроматографию с использованием карбоксиметилцеллюлозы и диэтиламиноэтилцеллюлозы. Особенность данной технологии заключается в ускоренном метаболизме окисления этилового спирта и продуктов его распада до уксусной кислоты. В нашей стране продукты питания и препараты, направленные на снижение токсического действия этанола и продуктов его метаболизма (ацетальдегида) на живой организм, в достаточном количестве и ассортименте не производятся, в связи с этим данное направление является перспективным.
1. Баньковский А.А. Изоферменты альдегиддегидрогеназы печени и их роль в предпочтении крысами этанола / А.А. Баньковский, Ю.Н. Островский, В.И. Сатановская // Вопросы медицинской химии. – 1986. – Т. 32. – № 2. – С. 34-36.
3. Бокий И.В. Использование анализа активности алкогольдегидрогеназы и липидного состава крови в качестве дополнительных критериев для диагностики острой и хронической интоксикации алкоголем : методические рекомендации. – Л., 1985. – С. 20.
5. Кершенгольц Б.М. Некоторые методические подходы к изучению метаболизма этанола / Б.М. Кершенгольц, Е.В. Серкина // Лабораторное дело. – 1981. – № 2. – С. 126.
На сегодняшний день накоплены убедительные данные о губительном воздействии чрезмерного потребления алкогольных напитков на продолжительность жизни населения, его смертность, работоспособность, социально-культурное поведение [4].
Уровень потребления алкоголя в России в пересчете на чистый этанол составляет 15-18 литров в год на человека, что превышает средние европейские показатели примерно на 50% [2].
Этанол в силу своих химических свойств и особенностей биотрансформации оказывает токсическое и наркотическое воздействие на живой организм. Одним из наиболее важных и загадочных последствий потребления алкоголя является абстинентный алкогольный синдром. Такое состояние длится обычно не более суток, но может продолжаться и дольше. При этом наблюдаются многочисленные изменения в балансе гормонов, медиаторов и других биологических веществ в живом организме. Также это приводит к учащению пульса и повышенной нагрузке на сердце, что может вызвать инсульт или сердечный приступ. Существенно, что человек, злоупотребляющий алкогольными напитками, не ощущает потребности в пище, а для купирования недугов, связанных с интоксикацией, организму требуется новая порция этилового спирта, возникает алкогольная зависимость [1].
Негативные последствия потребления этилового спирта связаны с накоплением высокой концентрации высокотоксичного вещества - ацетальдегида. Токсическое и наркотическое действие уменьшается по мере его окисления. Основным местом метаболической трансформации этанола является печень и эпителий желудка. Метаболическое окисление алкоголя происходит с участием мультиферментной системы, состоящей из двух ферментов: цитозольной алкогольдегидрогеназы (АДГ) и митохондриальной ацетальдегидрогеназы (АЛДГ) [3].
Скорость катаболизма алкоголя и альдегида уксусной кислоты различна у каждого человека и определяется генетическим фактором.
В нашей стране продукты питания и препараты, направленные на снижение токсического действия этанола и продуктов его метаболизма (ацетальдегида) на живой организм, в достаточном количестве и ассортименте не производятся. В связи с этим создание конкурентоспособных отечественных гармонизирующих ингредиентов, предназначенных для связывания и выведения токсических продуктов метаболизма этилового спирта из организма, является актуальным и практически важным.
Целью настоящего исследования явилась разработка технологии получения этанол-метаболизирующей системы, обеспечивающей биокаталитическое окисление спирта.
Объект и методы исследований
В качестве объекта исследований были выбраны дрожжи Saccharomyces cerevisiae, обладающие высокой каталитической активностью по отношению к этиловому спирту и ацетальгидегиду.
Культивирование дрожжей осуществляли в периодическом биореакторе объемом 5,0 л на питательной среде с использованием молочной сыворотки в течение 18 ч при температуре 36±2 °С, рН среды 4,8±0,2, перемешивании 500±5 об/мин и аэрации воздуха 30±0,2 л/ч. По окончании процесса культивирования дрожжи отделяли от культуральной жидкости центрифугированием в течение 15±1 мин при 15000±100 об/мин, промывали дистиллированной водой.
Определение биомассы дрожжей осуществляли как разницу биомассы до и после культивирования. Для количественной характеристики культивирования дрожжей пользовались показателем - удельной скоростью роста, которая характеризует часовой прирост на единицу растущей биомассы.
Для выделения этанол-окисляющего мультиферментного комплекса дрожжи S. cerevisiae измельчали на планетарной шаровой мельнице РМ 400 в присутствии стеклянных шаров марки Glass beads approximately 80 mesh. Особенности трансформации дрожжей рода S. cerevisiae изучали в электронном микроскопе JTM-100Ex (JEOL) с увеличением в 8000-10000 раз методом негативного контрастирования.
Каталитическую активность АДГ оценивали по скорости окисления кофермента никотинамиддинуклеотида восстановленного (НАДН), которую регистрировали на самописце спектрофотометра по убыли величины оптической плотности при длине волны 340 нм. Каталитическую активность альдегиддегидрогеназы (АЛДГ) определяли методом Б.М. Кершенгольц и Е.В. Серкиной [5], регистрируя начальную скорость образования НАДН при окислении ацетальдегида с образованием уксусной кислоты.
Содержание белка определяли на анализаторе общего азота (белка) «Rapid N cube», работающего по методу сжигания пробы Дюма с регистрацией общего азота на детекторе теплопроводности.
Концентрирование этанол-окисляющей мультиферментной системы проводили методом ультрафильтрации, через полиамидные мембраны УПМ 67.
С целью очистки концентрата от контаминирующей микрофлоры был применен способ микрофильтрации с использованием мембран марки фирмы «Millipore» с диаметром пор 0,22 мкм. Процесс микрофильтрации проводили при температуре 19±2 °С под разрежением 0,1-0,3МПа.
Далее для более полной очистки ферментного комплекса от инертных белков и белков, молекулярная масса которых более 100 кДа, был применен метод ионообменной хроматографии (ИОХ) на колонке с карбоксиметилцеллюлозой (КМ-целлюлозой) и диэтиламиноэтилцеллюлозой (ДЭАЭ-целлюлозой). КМ-целлюлоза, благодаря своей функциональной группе, обладает свойствами слабого анионообменника, а ДЭАЭ-целлюлоза - свойствами слабого катионообменника.
Степень чистоты на каждой стадии получения и очистки ферментного комплекса определяли электрофоретическим способом в полиакриламидном геле (ПААГ).
Специфичность белковой фракции к этиловому спирту и ацетальдегиду проверяли путем сравнения аминокислотного состава с коммерческими препаратами. Определение аминокислотной последовательности проводили на автоматическом секвенаторе, работающем по методу Эдмана, основанному на обработке исследуемого белка фенилизотиоцианата, что приводит к отщеплению одной аминокислоты с N-конца последовательности и последующей ее идентификацией с помощью жидкостной хроматографии под давлением.
Степень микробиологической чистоты оценивали путем подсчета колоний, выросших на чашках Петри с питательными средами. В качестве питательных сред использовали мясо-пептонный агар, картофельный и солодовый агары.
Общую бактериальную обсемененность ферментного препарата рассчитывали как среднее арифметическое число колоний микроорганизмов на 1 г препарата для всех разведений.
Достоверность экспериментальных данных определяли методом математической статистики на ЭВМ.
Изоэлектрическую точку ферментов определяли методом изоэлектрического фокусирования на установке фирмы «BioRat».
Молекулярную массу полученного АДГ и АЛДГ определяли методом гель-фильтрации на хроматографе FPLC с использованием тестовых белков.
Результаты исследований
Технологическая схема получения этанол-метаболизирующей системы (ЭМС), обеспечивающей биокаталитическое окисление этилового спирта, включает следующие стадии: приемку и оценку качества сырья, культивирование дрожжей на питательной среде с добавлением молочной сыворотки, трансформацию (разрушение) клеток, экстракцию, осаждение белковой фракции ацетоном, диализ, ультра- и микрофильтрацию, ионообменную хроматографию с использованием сорбентов карбоксиметилцелюллозы (КМ-целлюлозы) и диэтиламиноэтилцеллюлозы (ДЭАЭ-целлюлозы), смешивание компонентов (никотинамиддинуклеотид восстановленный, никотинамиддинуклеотид окисленный, раствор фосфатного буфера и раствор агрозы), полимеризацию, измельчение, хранение и реализацию.
Согласно технологической схеме, представленной на рисунке 1, процесс выработки ЭМС начинается с приемки сырья и проверки его качественных показателей согласно действующей документации.

Рис. 1. Технологическая схема получения ЭМС.
В производстве ЭМС используют следующее сырье:
- никотинамиддинуклеотид окисленный (США, фирма-производитель МР Biomedicals, концентрация 97%); никотинамиддинуклеотид восстановленный (США, фирма МР Biomedicals, концентрация 97%); дрожжи S. сerevisiae по ГОСТ 171-81; мелассная питательная среда по ГОСТ 171-81; молочная сыворотка по ОСТ 10-02-02-3; агароза (98%, фирма-производитель «BioWhittaker»); питьевая вода по ГОСТ Р 51232-98; натрий фосфорнокислый однозамещенный по ГОСТ 24576; натрий фосфорнокислый двузамещенный по ГОСТ 4172-76.
Отобранное для производства ЭМС сырье направляют на культивирование в периодическом режиме в биореакторе при температуре 36±2 °С и рН 4,5-5,0 при перемешивании 500±5 об/мин и аэрации воздуха 30±0,2 л/ч.
По достижении стационарной фазы культивирование дрожжей прекращают. Для этого биомассу дрожжей отделяют от питательной среды сепарированием при двукратной промывке суспензии водой для удаления остатков среды, бактерий и примесей. На заключительном этапе дрожжи фильтруют на вакуум-фильтрах и охлаждают до температуры 10±2 °С. С целью наиболее полного извлечения белковых веществ дрожжевое сырье подвергают трансформации на шаровой мельнице РМ 400 с использованием стеклянных шаров марки Glass beads approximately 80 mesh в течение 3,5±0,5 ч. Полученный гомогенат экстрагируют в фосфатном буфере (рН 9,5) в течение 3,0±0,5 ч. Осаждение белковых фракций проводят при температуре 0±2 °С ацетоном с выдержкой по 30±5 мин. Для более полного извлечения белковой фракции процесс осаждения повторяют дважды.
Для удаления органического растворителя и низкомолекулярных примесей из полученной фракции проводят очистку методом диализа против дистиллированной воды в течение 3,0±0,5 ч при температуре 0±2 °С и постоянном перемешивании. По окончании очистки методом диализа образовавшийся сгусток удаляют на сепараторах и проводят концентрирование полученной белковой фракции с последующей очисткой от контаминирующей микрофлоры методом микрофильтрации на мембранах с диаметром пор 0,22 мкм.
С целью получения этанол-метаболизирующей системы, состоящей из двух ферментов (алкогольдегидрогеназы и альдегиддегидрогеназы), проводят ионообменную хроматографию с использованием КМ-целлюлозы и ДЭАЭ-целлюлозы.
В белковую фракцию добавляют компоненты согласно рецептуре, приведенной в таблице 1, перемешивают, полимеризуют и измельчают при температуре 0±2 °С. После этого полученный ЭМП хранят при температуре 0±2 °С и используют по назначению.
Таблица 1 - Рецептура этанол-метаболизирующего ферментного препарата
Найдено вещество, эффективно расщепляющее этанол в организме
Неспособность организма полностью расщеплять этиловый спирт скоро можно будет вылечить приемом лекарства. Найдено вещество, восстанавливающее функцию дефектного фермента альдегиддегидрогеназы, который играет важную роль в цепочке расщепления этанола в организме человека.
Тяжкое состояние похмелья вызвано весьма несложным процессом, доступным на уровне учебника химии 10 класса. Стремясь вывести этиловый спирт, организм окисляет его до самых простых веществ – углекислого газа и воды. Однако окисление этанола (C2H5OH) проходит в несколько стадий – сначала образуется уксусный альдегид (CH3CHO), затем ацетат (CH3COO - ), не обладающий токсичностью (уксусную кислоту в небольших количествах добавляют к еде), и только потом конечные продукты.
Именно накопление в организме уксусного альдегида вызывает симптомы похмелья – токсичные вещества организм выводит только с водой, вместе с ней уходят и растворенные в ней соли.

В результате мы испытываем симптомы обезвоживания, а также учащенное сердцебиение и дрожание рук – симптомы обессоливания. При нормальной работе альдегиддегидрогеназы ацетальдегид успешно разрушается в нашем организме, однако беда в том, что в случае мутации этот фермент перестает функционировать должным образом. Более того, такая мутация наблюдается аж у 40% азиатского населения, а всего в мире от нее страдают более миллиарда человек. Симптомы наличия мутантного гена очень просты – при употреблении алкоголя лицо человека сильно краснеет, у него возникает тошнота и тахикардия. Такое нарушение небезобидно: например, риск возникновения рака пищевода у носителей дефектного фермента в сто раз выше, чем у обладателей нормального гена.
Альдегиддегидрогеназа (ALDH2) отнюдь не является «антипохмельным» энзимом – она вообще играет ключевую роль в процессах детоксикации, так как многие ядовитые вещества по своей химической природе являются альдегидами. Так, например, без этого фермента не может проходить расщепление промышленного токсиканта акролеина (пропеналя), а также биоактивация сердечно-сосудистого препарата нитроглицерина, применяемого при стенокардии – недостаточном снабжении сердца обогащенной кислородом кровью. В случае если человек является носителем мутации, его измененный фермент ALDH2*2 теряет способность обеспечивать все эти важные защитные процессы.
Однако такая врожденная проблема, как оказалось, излечима химическим путем. По данным исследования, опубликованного в Nature Structural and Molecular Biology, низкомолекулярное вещество, которое его создатели назвали Alda-1, способно поддерживать функцию дефектного фермента, выступая в его работе как сопровождающая молекула.
Серия экспериментов по взаимодействию Alda-1 и дефектного фермента ALDH2 показала, что Alda-1 восстанавливает структуру деактивированного энзима и вводит его в работу. Нормально функционирующий фермент создает «каталитический туннель» — пространство внутри трехмерной структуры фермента, где происходит метаболизм ацетальдегида. В структуре деактивированного фермента этот туннель отсутствует, однако Alda-1 образует с фрагментами фермента дополнительные связи, которые стабилизируют необходимую трехмерную структуру и формируют нужный каталитический туннель. Таким образом, с помощью Alda-1 дефектный фермент начинает действовать на ацетальдегид так же, как и нормальный.
Пока ученым не удалось «научить» ALDH2*2 расщеплять другие альдегиды, однако «генетическое похмелье» лечить уже возможно.
Исследователи надеются, что им удастся разработать более эффективные аналоги Alda-1, которые будут селективно восстанавливать метаболизм и других молекул, разложение которых зависит от альдегиддегидрогеназы.
«Важнейшее открытие – механизм активации блокированных ферментов – позволяет надеяться на создание эффективных общедоступных лекарств. Это касается не только употребления алкоголя, но и других процессов токсикации», — отметил доктор Кеннет Уоррен, директор американского Института употребления алкоголя и алкоголизма.
Читайте также:
