Амелобластома - лучевая диагностика
Добавил пользователь Евгений Кузнецов Обновлено: 29.01.2026
Сегодня технология конусно-лучевой компьютерной томографии (КЛКТ) позволила при минимальной дозе облучения, получить истинно многоплоскостные и 3D-изображения структур челюстно-лицевой области и дала толчок к большому объему исследований с целью диагностики и оценки патологии в области головы и шеи.
Новообразования черепно-челюстно-лицевой области по отношению к новообразованиям других локализаций составляет 8–22% [1, 2, 3]. В последние годы отмечается значительное увеличение исследований органов головы и шеи и, как результат, увеличение количества диагностированных новообразований этих анатомических областей.
К объемным образованиям челюстно-лицевой области относятся доброкачественные и злокачественные опухоли, опухолеподобные поражения, а также кисты, отличающиеся деструктивным ростом. Существует огромное количество литературы посвященной этому вопросу. Многообразие морфологических и гистологических форм, а также клинических проявлений привело к введению большого количества терминов и классификаций [5]. Путаница в медицинской литературе, посвященной этому вопросу вызывает, значительные трудности при проведении исследований.
Нужно отметить, что в начальном периоде своего развития объемные образования не отличаются специфичностью симптомов [4,5], именно поэтому затрудняется распознавание истинной природы деструктивных процессов и затягиваются сроки выявления опухолей.
Безусловно, окончательная диагностика всего многообразия объемных образований базируется на результатах патоморфологического исследования биопсийного материала, которая с большой точностью позволяет верифицировать неопластический процесс. Но сложная анатомия головы часто накладывает ограничения в создании доступа для получения материала из опухоли или просто оказывается невозможным. Именно в таких случаях, предварительная, доверификационная диагностика на основе данных компьютерной томографии становится чрезвычайно важной, а грамотный системный подход к чтению исследований и знания рентгенсимеотики приобретают огромное значение [6, 7].
Анализ данных компьютерной томографии позволяет:
1. констатировать наличие объемного образования,
2. определить его распространенность,
3. дать характеристику границ и тени,
4. выявить поражение в глубину лицевого и мозгового черепа, вовлеченность в патологический процесс жевательных и мимических мышц, мышц глаза, зрительного нерва, глазных яблок, содержимого крыловидно-небных и подвисочных ямок, ретромандибулярных, носоглоточных и окологлоточных пространств
5. контролировать послеоперационные изменения
Именно эти характеристики позволяют получить информацию о стадии развития патологии, ее распространенности и выбрать адекватную тактику лечения, в том числе хирургического.
Приведенные ниже клинические случаи дают представление об основных признаках, которые необходимо знать при дифференциации злокачественного новообразования ЧЛО и отличительные особенности их от доброкачественного объемного образования [6,9].
Клинический случай №1
Пациент, муж, 19 лет обратился с жалобами на припухлость левой средней трети лица (Рис. 1).
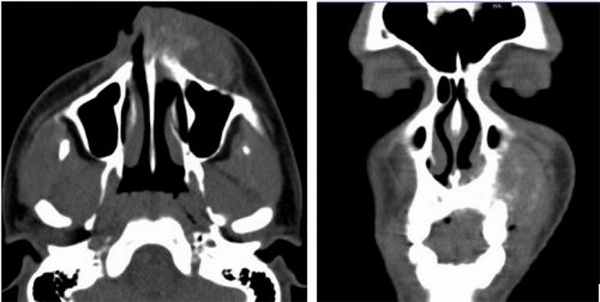
Рис. 1. КТ свидетельствует об остеосаркоме, опухолевый инфильтрат происходит из передней стенки верхней челюсти слева, с вовлечением альвеолярной кости (остеолиз).
Клинический случай №2
Пациент муж., 16 лет, в анамнезе удаление зуба год назад. Обратился с жалобами на резкое увеличение объема лица слева, дисфагию и трудности при разговоре в связи с давлением опухолевой массы на глотку (Рис. 2,3).
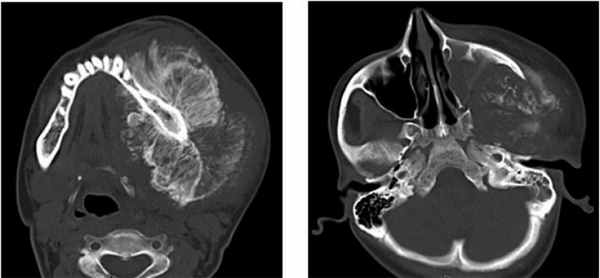
Рис. 2. КТ свидетельствует об остеосаркоме, поражена левая половина верхней челюсти, вовлечены крыловидный отросток и нижняя челюсть с инфильтрацией в виде солнечных лучей и выраженной периостальной реакцией. Ассоциированные деформация и отек мягких тканей.
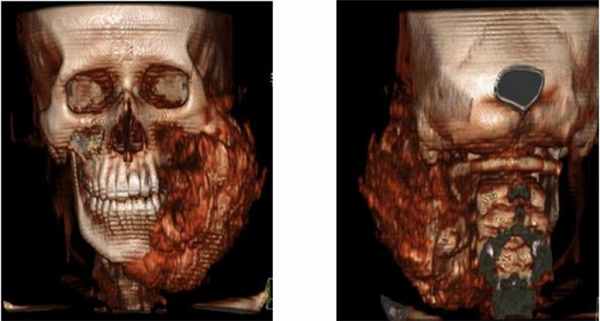
Рис. 3. 3d-реконструкция остеосаркомы с деформацией и отеком мягких тканей.
Принимая во внимание эти рентгенологические диагностические признаки, необходимо помнить, что они не абсолютно достоверны. Редко, но все же они могут проявляться и при доброкачественных опухолях и объемных образованиях ЧЛО, имеющих различный генез [6, 8].
Основные отличительные КТ признаки доброкачественных опухолей и опухолеподобных заболеваний ЧЛО, которые имеют дифференциально-диагностическое значение, приведены на клинических примерах № 3, 4, 5 и заключаются в следующем:
1. смещение, деформация костных структур, сопровождаемые остеопенией с постепенным истончением кости вплоть до появления дефектов;
2. деструкция кости от давления, а не инфильтративный остеолиз (основной признак дифференциации злокачественных опухолей);
3. неоднородность структуры тени за счет облаковидных образований большей плотности , а не костные фрагменты внутри тени.
Клинический случай №3
Пациент муж., 50 лет, в анамнезе операция удаления амелобластомы в пределах видимо здоровых тканей. Обратился с жалобами на повторное развитие опухолеподобного образования (Рис. 4).

Рис. 4. КТ свидетельствует о рецидиве кистозной формы амелобластомы.
Поражено тело нижней челюсти больше справа, определяется «вздутие» и неравномерное истончение передней пластины тела челюстной кости, обширный участок деструкции с четкими, полицикличными контурами, неправильной овальной формы, размерами 4,5 х 3,5 х 3,0 см. Кортикальный слой передней поверхности челюсти значительно истончен, местами не определяется, периостальная реакция отсутствует. В патологически измененном участке видны перегородки и известковые включения. Правое ментальное отверстие и дистальный отдел канала правого нижнеальвеолярного нерва не определяется.
Клинический случай №4
Пациент муж., 32 года (Рис. 5).
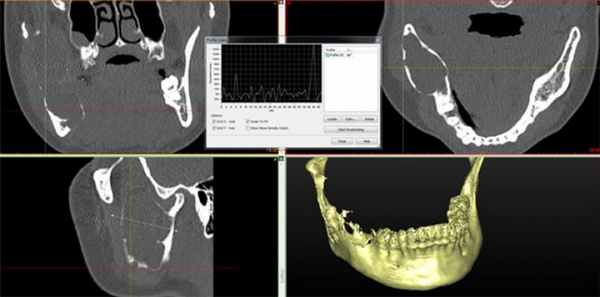
Рис. 5. КТ свидетельствует об объемном образовании нижней челюсти, требующем верификации.
Поражена правая ветвь нижней челюсти. Определяется объемное кистозное образование, овальной формы с четкими полицикличными контурами, замещающее весь венечный отросток и распространяющееся на суставной отросток. Объем кости увеличен за счет вздутия. Кортикальный слой значительно истончен, местами не прослеживается. Канал нижнеальвеолярного нерва вплотную прилежит к образованию, верхняя его стенка в проксимальном отделе не прослеживается. В подьязычной области справа виден лимфоузел, размерами 1,7 на 0,9 см.
Клинический случай №5
Пациент муж., 17 лет. КТ-исследование подтверждает наличие новообразований (Рис. 6,7).

Рис. 6. Ортопантомограмма пациента с одонтогенными кератокистами.
КТ свидетельствует о наличии множественных одонтогенных кератокист. Определяются множественные овальные, зубосодержащие полости, с четкими ровными справа и полицикличными контурами слева, однородной рентгенпрозрачности. В теле и ветвях нижней челюсти образование распространяется вдоль кости от премоляров справа и моляров слева и до вершин мыщелковых отростков. Костные структуры незначительно увеличены в размерах за счет вздутия, кортикальные пластины истончены. Дивергенция корней зубов № 43, 44. Объемные зубосодержащие образования верхней челюсти вросли в верхнечелюстные синусы, занимая практически весь объем, а справа — распространилось в подвисочную ямку.
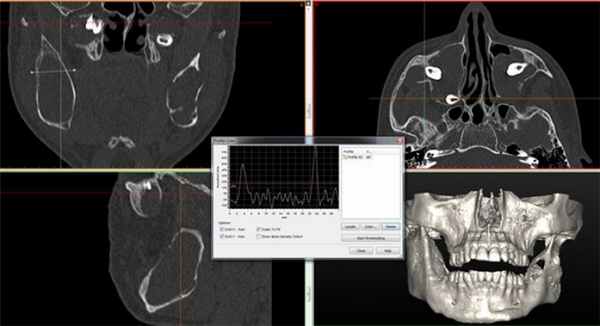
Рис. 7. КТ исследование свидетельствует о наличии множественных одонтогенных кератокист.
Выводы: Исследования компьютерной томографии абсолютно необходимы для подтверждения наличия объемного образования, определения степени его распространенности и вовлечения смежных анатомических структур, постановки доверификационного диагноза, что позволяет обосновать выбор метода лечения и способ его реализации. При этом важно описывать с особой подробностью границы тени, характеристику изменений со стороны костных структур, в том числе и костных фрагментов, оказывающихся внутри тени, отмечать преобладание признаков инфильтративного остеолиза или остеопении костных структур от давления, в какой стадии этого процесса они обнаруживаются . По характеристике этих признаков часто можно судить о скорости роста опухоли и активности процесса разрушения костных структур, что оказывается очень важным, при постановке доверификационного диагноза.
Литература:
- Пачес А.И. Опухоли головы и шеи. – М.: Медицина, 2000. –480 с.
- Терновой С.К., Араблинский А.В., Синицын В.Е. Современная лучевая диагностика придаточных пазух носа. – М., 2004. –115с.
- Gahbauer H.W., Yanagisawa K., Yanagisawa E. Chapter XI. Head and neck radiology // Edited by Lee K.J.-Appleton and Lange, Stamford, Connecticut. – 1999. – P. 1007–1067.
- Козлова А.В., Калина В.О., Гамбург Ю.Л. Опухоли ЛОР органов. – М.: Медицина, 1979. – 352 с.
- Маланчук В. А. , Копчак А. В. Доброкачественные опухоли и опухолеподобные поражения челюстно-лицевой области и шеи. –К.,2008. –271с.
- Габуния Р.И., Колесникова Е.К. Компьютерная томография вклинической диагностике. Гл. 2. Органы головы и шеи. – М.:Медицина, 1995. – 38 с.
- Yoshiura K., Weber A.L., Runnels S., Scrivani S.J. Cystic lesionsof the mandible and maxilla // Neuroimaging Clin N. Am. –2003. – №13(3). – Р. 485–494.
- Рабухина Н.А., Голубева Г.И., Перфильев С.А. Спиральная компьютерная томография при заболеваниях челюстно-лицевой области. – М.: Медипресс-информ, 2006. – 126 с.
- Фейгин Г.А., Шалабаев Б.Д., Миненков Г.О. Компьютерная томография в диагностике и лечении объемных образований челюстно-лицевой области. М – Бишкек: Изд-во КРСУ, 2008. – 237 с.
Автор: Дахно Л.А. — врач стоматолог хирург, врач рентгенолог, действительный член Международной медицинской SimPlant Academy (с 2005года), ITI (ID 42537) и Европейской академии черепно-челюстно -лицевой радиологии EADMFR (ID 100001988).
Амелобластома - лучевая диагностика
2. Калакуцкий Н.В., Журавлев И.В. Амелобластома нижней челюсти ‒ особенности дифференциальной диагностики. Институт стоматологии. 2011; 4 (53): 82–3.
3. Краевский Н.А. Патологоанатомическая диагностике опухолей человека // Н.А. Краевский, А.В. Смолянников, Д.С. Саркисов. ‒ М. : Медицина. ‒ 1982. ‒ 511с.
4. Митрошенко П. Н. Планирование реконструктивных операций с использованием метода лазерной стереолитографии // Вестник стоматологии и челюстно-лицевой хирургии. 2004. Т. 1. Вып. 4. С. 14-27.
5. Семкин В.А., Григорьян А.С. Особенности хирургической тактики при различных формах амелобластических опухолей // Стоматология. 2012. № 4. С. 25-27.
6. Экспериментальные модели в патологии: учебник/ В.А. Черешнев, Ю.И. Шилов, М.В. Черешнева, Е.И. Самоделкин, Т.В. Гаврилова, Е.Ю. Гусев, И.Л. Гуляева. ‒ Пермь: Перм. гос. ун-т., 2011. ‒ 267 с.
Амелобластома, или адамантинома - это доброкачественная одонтогенная опухоль, местом локализации которой является тело нижней челюсти в области моляров и премоляров (80%). Чаще всего встречается в возрастном промежутке в 20-50 лет и среди женщин, и среди мужчин. Размеры очагов деструкции варьируются от 7х5х3 миллиметров до 4х3х2 сантиметров. При тяжело прогрессирующей форме амелобластома распространяется на все тело нижней челюсти [1].
Существует несколько теорий относительно происхождения данной опухоли. Наиболее обоснованными являются первые две теории - А.И. Абрикосова и В.Р. Брайцева и Н.А. Астахова.
А.И. Абрикосов в 1956 г. предположил, развитие амелобластомы связано с периодом формирования зуба в стадии эмалевого органа. После прорезывания зуба эмалевый орган в норме подвергается редукции. Однако при патологии он может сохраняться и пролиферировать, что и является причиной образования амелобластомы.
Другая точка зрения, высказанная В.Р. Брайцевым и Н.А. Астаховым в 1907 и 1908 гг., говорит в пользу эпителиальных остатков в периодонте и кости, так называемых «островков Маляссе». Эта гипотеза подтверждается, во-первых, большим гистологическим разнообразием опухоли, а во-вторых, наличием данных эмалевых структур в опухоли некоторых больных.
Также существуют и другие теории, которые пока мало изучены: это теория А.В. Петрова о метаплазии соединительной ткани и И.Г. Лукомского о пролиферации эпителия верхнечелюстной пазухи [1].
По клинико-анатомическим характеристикам опухоли выделяют ее кистозную (90% случаев) и солидную формы. Кистозная форма представляет собой пустоты в ткани кости, разделенные перегородками. Полости как правило состоят из коллоидоподобного субстрата. Края опухоли могут быть фестончатыми или склерозированные, в меньшей степени уплотненные. Солидная же амелобластома имеет одну капсулу овального или округлого очертания, пустую или заполненную жидкостью [6].
По микроскопическому строению различают амелобластому:
- фолликулярную;
- плеоморфную;
- базально-клеточную;
- акантоматозную;
- гранулярно-клеточную.
Самые распространенные формы - это фолликулярная и плеоморфная. Первая характеризуется образованием фолликулов в соединительной ткани, а вторая наличием тяжей одонтогенного эпителия.
На начальных этапах образования амелобластомы может не наблюдаться никаких неприятных ощущений. Амелобластома обладает довольно медленным прогрессированием в связи с направлением ее роста в верхнечелюстную пазуху. Как правило, в первые шесть месяцев наблюдается деформация нижней челюсти с нарушением ее эстетической и функциональной характеристик. В зоне роста опухоли выявляется веретенообразное вздутие гладкой или бугристой формы, которое вызывает деформацию альвеолярного отростка и дальнейшее расшатывание зубов (преимущественно жевательной группы). В результате развивается болевой и акустический симптомы при движении височнонижнечелюстного сустава, которые вызваны резорбцией кости, что вызовет проблемы с жеванием и глотанием. По мере прогрессирования опухоли развивается гнойный воспалительный процесс, нередко с прокладыванием свищевых ходов в полости рта. К тому же при отсутствии оперативного хирургического лечения возникает риск дальнейшего поражения глазничной и носовой полостей [2].
В период разрастания амелобластома деформирует зубной ряд и нижнюю челюсть соответственно. Встречаются случаи нагноения амелобластомы, которые сопровождаются отеком мягких тканей в области ее локализации, иногда осложняется формированием свищей. Запущенные случаи сопровождаются кровоточивостью и опуханием слизистой оболочки, прилегающей к месту формирования опухоли.
Данное образование развивается достаточно протяженно, но в определенных случаях (4% от полного числа вариативных адамантином) ее рост может значительно ускорятся, что указывает на озлокачествление этого новообразования.
На разрезе опухоль серовато-розового цвета с губчатой структурой. Основу амелобластомы составляет волокнистая соединительная ткань, богатая веретенообразными клетками, в которой ветвятся тяжи одонтогенного эпителия. Вокруг каждого тяжа находятся цилиндрические клетки, к которым с внутренней стороны примыкают полигональные клетки с переходом в звездчатые формы. Также видны ячейки неправильной формы, которые и отличают амелобластому от эмалевого органа. Кисты в опухоли разрушают эпителиальные ячейки, поэтому при микроскопировании можно обнаружить только цилиндрические клетки, находящиеся на периферии.
Для диагностирования амелобластомы используют следующие методы:
- рентгенография (дает возможность определить размеры образования, границы опухоли и структуру ее очага);
- компьютерная томография (КТ – более точный метод, позволяющий послойно изучить образование);
- магнитно-резонансная томография челюсти (МРТ- тоже самое);
- биопсия (сложности с окончательной постановкой диагноза);
- цитологическое исследование (исследуется состав опухоли, подтверждается достоверность диагноза) [3].
Хирурги применяют технику предоперационного компьютерного 3-D моделирования. По результатам моделирования изготавливаются специальные шаблоны, которые точно определяют размер забора костного компонента лоскутов.
Амелобластома требует дифференциальной диагностики с плоскоклеточным раком челюстно-лицевой области, цистаденоидной карциномой слюнной железы, дентальными кистами, вызванными воспалительным процессом [2].
Лечение заключается в хирургическом удалении ткани. При наличии гнойного воспаления проводится санация полости рта. После вылущивания амелобластомы ее стенки обрабатываются фенолом, что приводит к некрозу элементов опухоли и замедляет ее рост. В случае резекции нижней челюсти на этапе удалении амелобластомы, после заживления показана костная пластика и протезирование зубного ряда (постоянное ношение ортопедических конструкций). Зашивать послеоперационную полость не надо, по причине возможного рецидива опухоли. Для этого используют специальный тампон для эпителизации стенок полости [4, 5].
При запущенном процессе проводится частичная экзартикуляция челюсти (операция выкручивания челюсти по линии суставной щели без отпиливания кости). Взамен удаленного фрагмента челюсти устанавливают костную пластинку с применением ортопедических конструкций. В случае приобретения опухолью злокачественного характера (или неоперабельности) используют лучевую терапию. В послеоперационном периоде (обычно спустя три недели) пациентам назначается антибиотикотерапия и даются рекомендации по приему мягкой пищи. В первое время после выписки рекомендуется употреблять не твердую и не грубую пищу, а после еды промывать полость с помощью специального баллончика [3, 4, 5].
Неоперабельная амелобластома успешно прошла лечение протонной терапией как основным методом лечения
Мы сообщаем о случае 87-летнего мужчины, страдающего от неоперабельной амелобластомы правой челюсти, которая была успешно вылечена протонной терапией как основным методом лечения дозами до 66 Гр в 33 фракциях. Лечение хорошо переносилось, прерываний из-за токсичности не было. При последующих посещениях у пациента наблюдался полный клинический ответ на лечение без признаков заболевания и полное восстановление после острых побочных эффектов. В этом отчете мы обсудим потенциальные и возможные подводные камни протонной терапии при лечении конкретных клинических ситуаций.
ВВЕДЕНИЕ
Амелобластома - редкая доброкачественная одонтогенная опухоль, возникающая на нижней и верхней челюстях с потенциальным местным агрессивным поведением. Злокачественная амелобластома (то есть, метастазирующая амелобластома и амелобластическая карцинома) встречается редко. Рост этого вида рака обычно медленный; однако значительное ухудшение состояния пациента может возникнуть из-за местной инвазивности. Хирургия является основным методом лечения. Когда ее применение возможно, она обеспечивает локальный контроль в пределах от 69% (если выполняется только энуклеация) до 96% при резекции[1]. Роль лучевой терапии (ЛТ) неясна из-за недостатка данных, представленных в литературе относительно ее эффективности при лечении этого заболевания[2].
Протонная терапия (ПТ) представляет собой уникальный метод для проведения ЛТ, который использует физические свойства частиц, теряющих энергию в конечной точке пробега, что обеспечивает низкую входную дозу и почти нулевую дозу за пределами их пути [3]. Эти особенности делают лечение протонами особенно эффективным в определенных клинических ситуациях; позволяют улучшить результаты лечения, уменьшить побочные эффекты и повысить качество жизни пациента[4,5].
В работе сообщается о случае неоперабельной амелобластомы, пролеченной ПТ как основным методом лечения. Пациент дал письменное согласие на использование своих данных для научного отчета.
ИСТОРИЯ БОЛЕЗНИ
В мае 2013 года 85-летний мужчина с раком прямой кишки в анамнезе был госпитализирован в отделение неотложной помощи в Больницу Тренто с неконтролируемым носовым кровотечением. Рентгенологические обследования выявили сложное многоступенчатое новообразование, возникшее на правой челюсти с локальной инвазивностью в полости носа, а также в пазухах решетчатой кости и верхней челюсти (рис. 1).
Рис. 1 Осевые, сагиттальные и фронтальные МРТ изображения с контрастом, показывающие увеличение амелобластомы в мае 2013 года.
Был проведен гистологический диагноз плексиформной амелобластомы (рис. 2).
Рис. 2 Типичный плексиформный рост опухоли, расположенный в анастомозирующих двойных колонках кубических клеток, с минимальным свидетельством центрального звездчатого ретикулума. С подкрашиванием гематоксилин-эозином, 200 ×.
Команда специалистов по лечению уха, носа и горла предложила операцию, но пациент отказался. Было начато медицинское лечение симптомов. Во время последующего наблюдения отмечалось медленное и непрерывное увеличение очага поражения начиная с октября 2015 года. Когда состояние ухудшилось, пациент был госпитализирован в отделение неотложной помощи с оро-назальным кровотечением, правым лагофтальмом и затруднением дыхания. Магнитный резонанс (МР) показал увеличение объема опухоли (соответственно 97, 62 и 70 мм в переднезаднем, поперечном и краниокаудальном диаметрах) и новое поражение носоглотки, орбиты (дна и медиальной стенки) и мышц нижней прямой кишки (рисунок 3).
Рис. 3 (А) Аксиальные, сагиттальные и фронтальные МРТ изображения с контрастом, сделанные в октябре 2015 года. (B) Области внутри красных линий представляют собой увеличение расширения опухоли и инвазивности по сравнению с исходными изображениями.
Данный клинический случай обсуждался на совещании многопрофильной коллегии врачей, где патология была признана неоперабельной из-за возраста пациента, сопутствующей патологии и отказа от хирургического вмешательства. Коллегия рекомендовала ПТ, которая действовала в Тренто с октября 2014 года, как местное лечение с радикальным намерением, учитывая увеличение опухоли и ее непосредственную близость к оптическим структурам.
ЛЕЧЕНИЕ ПРОТОННОЙ ТЕРАПИЕЙ
Процедуры подготовки включали иммобилизацию пациента с использованием головной рамки с индивидуальной 3-точечной термопластичной маской. Был предложен загубник, чтобы отжать язык и полость рта от подвергаемого лечению объема. Однако он не использовался из-за индивидуальных особенностей пациента.
Снимок для планирования моделирования (толщина среза 2 мм) был получен с помощью диагностических МРТ и КТ для разграничения объема мишени и органов в зоне риска (ОЗР).
Клинический объем мишени определялся путем добавления 3-миллиметровой границы вокруг общего объема опухоли. Планируемый объем мишени состоял из 4-миллиметрового увеличения изотропной клинической мишени. Для создания планируемого объема, подверженного риску, была добавлена изотропная граница 1,5 мм вокруг оптических нервов и хиазм. Назначенная доза для планируемого объема мишени составила 66 Гр (ОБЭ) в 33 суточных фракциях с максимальной допустимой дозой на 1% оптических структур ≤54 Гр (ОБЭ) (рисунок 4).
Рис. 4 Гистограмма объема-дозы, на которой желтые, оранжевые и красные изолинии представляют собой линии изодоз 54, 60 и 62,7 Гр соответственно.
Протонный план был создан при помощи системы планирования XIO (Xio Proton, Elekta AB, Стокгольм, Швеция) с использованием активных сканируемых протонов (диапазон энергий от 70 до 230 МЭВ, сигма пятна при 32 г / см2 ~ 2,65 мм), ускоренных циклотроном и излучаемая поворотным гентри (Приложения Ионного Пучка, IBA, Лувэн-ля-Нев, Бельгия). Для данного случая применялся метод однополевой оптимизации, в котором индивидуально оптимизированные ПТ поля доставляют гомогенную дозу к мишени. Была выбрана трехкомпонентная копланарная и некопланарная схема луча (250 ° стол 0 °, 110 ° стол 0 °, 340 ° стол 90 °, 0 °, 280 ° стол 90 °, 240 ° стол 90 °). Для поверхностных слоев некомпланарного пучка использовался энергетический адсорбер. Межточечный интервал был установлен на 0,3 см.
Лечение было проведено между ноябрем 2015 года и январем 2016 года с ежедневными онлайн проверками настроек. Еженедельное КТ сканирование выполнялось для проверки постоянного охвата целей и защиты от воздействия на ОЗР во время лечения. Перепланирование не потребовалось (рисунок 5).
Рис. 5 Сравнение гистограммы планируемого объема - дозы и гистограммы объема - дозы, полученной при еженедельном КТ сканировании, которое показывает стабильность охвата мишени и защиты от воздействия на ОЗР.
Что касается токсичности, у пациента наблюдался острый G3 радиационный дерматит и мукозит. Были прописаны кремы для наружного применения и краткий курс опиоидных анальгетиков. Делать перерывы в лечении не понадобилось. Полное восстановление после кожной и слизистой токсичности произошло по истечении одного и двух месяцев соответственно.
Первый МР после ПТ был проведен через 3 месяца после лечения и показал полную реакцию без признаков опухоли. На консультациях врачей ЛОР в течение следующих 18 месяцев не было обнаружено никаких признаков заболевания. Через 18 месяцев после окончания ПТ у пациента сохранялось очень хорошее качество жизни. Рисунок 6 иллюстрирует консолидированные МР изображения после ПТ. До настоящего времени токсичность визуально не наблюдалась. Недавно пациент обновил свои водительские права.
Рис. 6 Объединенные снимки после протонной терапии, показывающие полный клинический ответ, полученный (а) через 3 месяца после окончания протонной терапии и (б) через 1 год после окончания протонной терапии.
ОБСУЖДЕНИЕ
В данном отчете сообщается о случае крупной амелобастомы, успешно вылеченной ПТ как основным методом лечения при амелобластоме или амелобластической карциноме.
В исследовании Кеннеди и коллег[2] сообщалось о местном контроле 67% со средней дозой облучения 66,2 Гр (диапазон от 63 до 74,4 Гр) у 6 пациентов, получавших лечение с целебными намерениями одной только РТ (n = 2) или после операции (n = 4) в период с 1973 по 2007 гг. при среднем сроке наблюдения 7,8 лет.
В обоих случаях наблюдался быстрый и полный ответ. Учитывая относительно вялую естественную историю этих опухолей, такого быстрого ответа не ожидалось. Наоборот, в опубликованном исследовании рентгеновской лучевой терапии Кокой и др. [7] сообщалось только о частичном ответе во время однолетнего последующего наблюдения. Возможное объяснение противоречащих результатов этих исследований может заключаться в более высоких дозах облучения и использовании заряженных частиц с их своеобразной радиобиологией, которые могли повлиять на быстроту и полноту ответа опухоли.
Использование заряженных частиц, действительно, может быть целесообразным при лечении рака головы и шеи, в частности при параназальных раках пазух, где обычно требуются высокие дозы для лечения больших и сложных объемов мишеней, окруженных критическими ОЗР, такими как зрительный аппарат или ствол мозга. Несколько дозиметрических исследований, а в последнее время - клинические исследования, показали многообещающие результаты и потенциальные преимущества ПТ по сравнению с рентгеновской терапией при лечении рака головы и шеи[11–14]. Более того, недавний мета-анализ Пател и др. [15] продемонстрировал значительно лучшие результаты с точки зрения безрецидивной выживаемости и локально-регионального контроля над раком параназальных пазух и раком носовой полости, пролеченных заряженными частицами, по сравнению с пациентами, получавшими фотонную терапию.
В данном случае мы четко описали потенциал активного сканирования ПТ для успешной доставки радикальных доз на большие объемы, подвергаемые лечению, вблизи критических ОЗР, и для снижения риска токсичности. В настоящем докладе показан еще одно потенциальное показание для ПТ: использование метода для радикального лечения заболеваний головы и шеи у пожилых и ослабленных пациентов [15] , которые имеют ограниченную способность компенсировать побочные эффекты лечения [16]. Потенциал ПТ для уменьшения острых и поздних осложнений по сравнению с обычным РТ следует рассматривать многодисциплинарными коллегиями перед вынесением заключений о назначении лучевого лечения.
Потенциальный подводный камень этого метода при лечении синоназального рака - это сложная взаимозависимость между ошибками при подготовке к лечению и анатомическими неопределенностями (т. е., изменениями заполнения носовой полости и заполнения носовых пазух носа), которые могут возникать во время лечения с потенциальными соответствующими различиями между номинальным распределением дозы (рассчитанным по КТ планированию) и фактически доставляемой дозой[17]. В свете этого рекомендуется ввести еженедельные контрольные КТ сканирования с использованием трехмерных протоколов в протонной терапии с визуальным контролем[18], чтобы выявить необходимость перепланирования. Кроме того, разработка инструментов надежности для обеспечения реализации высококачественных планов имеет важное значение, особенно когда используются нестандартные неоднородные поля, как при многоуровневой оптимизации (т. е. многоуровневая оптимизация или модулированная по интенсивности ПТ) планирования[19].
ВЫВОДЫ
Мы сообщили о положительном результате ПТ как основного метода при лечении крупной неоперабельной амелобластомы у пожилого пациента, подтверждая и поддерживая роль ПТ для конкретных сложных клинических сценариев (например, синоназальный рак, большие объемы мишеней, радикальные методы лечения и излечимые пожилые люди и ослабленные пациенты).
References
| 1. | Lau SL, Samman N. Recurrence related to treatment modalities of unicystic ameloblastoma: a systematic review. Int J Oral Maxillofac Surg. 2006;35:681–90. |
| 2. | Kennedy WR, Werning JW, Kaye FJ, Mendenhall WM. Treatment of ameloblastoma and ameloblastic carcinoma with radiotherapy. Eur Arch Otorhinolaryngol. 2016;273:3293–7. |
| 3. | Wilson RR. Radiological use of fast protons. Radiology. 1946;47:487–91. |
| 4. | Mishra MV, Aggarwal S, Bentzen SM, Knight N, Mehta MP, Regine WF. Establishing evidence-based indications for proton therapy: an overview of current clinical trials. Int J Radiat Oncol Biol Phys. 2017;97:228–35. |
| 5. | Langendijk JA, Lambin P, De Ruysscher D, Widder J, Bos M, Verheij M. Selection of patients for radiotherapy with protons aiming at reduction of side effects: the model-based approach. Radiother Oncol. 2013;107:267–73. |
| 6. | Philip M, Morris CG, Werning JW, Mendenhall WM. Radiotherapy in the treatment of ameloblastoma and ameloblastic carcinoma. Hong Kong J Radiol. 2005;8:157–61. |
| 7. | Koca T, Basaran H, Arslan D, Sezen D, Cerkesli ZA, Kilinc O, Karaca S, Bassorgun CI, Okay HO, Demirci M. Prominent response with helical tomotherapy in recurrent ameloblastic carcinoma of maxillary sinus: a case report. Radiat Oncol. 2014;9:157. |
| 8. | Mendenhall WM, Werning JW, Fernandes R, Malyapa RS, Mendenhall NP. Ameloblastoma. Am J Clin Oncol. 2007;30:645–8. |
| 9. | Jensen AD, Ecker S, Ellerbrock M, Nikoghosyan A, Debus J, Munter MW. Carbon ion therapy for ameloblastic carcinoma. Radiat Oncol. 2011;6:13. |
| 10. | Durante M. New challenges in high-energy particle radiobiology. Br J Radiol. 2014;87:20130626. |
| 11. | McDonald MW, Liu Y, Moore MG, Johnstone PA. Acute toxicity in comprehensive head and neck radiation for nasopharynx and paranasal sinus cancers: cohort comparison of 3D conformal proton therapy and intensity modulated radiation therapy. Radiat Oncol. 2016;11:32. |
| 12. | Ruggieri R, Dionisi F, Mazzola R, Fellin F, Fiorentino A, Schwarz M, Ricchetti F, Amichetti M, Alongi F. Nasal cavity reirradiation: a challenging case for comparison between proton therapy and volumetric modulated arc therapy. Tumori. 2016;102(suppl 2):12–5. |
| 13. | Romesser PB, Cahlon O, Scher E, Zhou Y, Berry SL, Rybkin A, Sine KM, Tang S, Sherman EJ, Wong R, Lee NY. Proton beam radiation therapy results in significantly reduced toxicity compared with intensity-modulated radiation therapy for head and neck tumors that require ipsilateral radiation. Radiother Oncol. 2016;118:286–92. |
| 14. | McDonald MW, Zolali-Meybodi O, Lehnert SJ, Estabrook NC, Liu Y, Cohen-Gadol AA, Moore MG. Reirradiation of recurrent and second primary head and neck cancer with proton therapy. Int J Radiat Oncol Biol Phys. 2016;96:808–19. |
| 15. | Patel SH, Wang Z, Wong WW, Murad MH, Buckey CR, Mohammed K, Alahdab F, Altayar O, Nabhan M, Schild SE, Foote RL. Charged particle therapy versus photon therapy for paranasal sinus and nasal cavity malignant diseases: a systematic review and meta-analysis. Lancet Oncol. 2014;15:1027–38. |
| 16. | Daly ME, Lau DH, Farwell DG, Luu Q, Donald PJ, Chen AM. Feasibility and toxicity of concurrent chemoradiation for elderly patients with head and neck cancer. Am J Otolaryngol. 2013;34:631–5. |
| 17. | Fukumitsu N, Ishikawa H, Ohnishi K, Terunuma T, Mizumoto M, Numajiri H, Aihara T, Okumura T, Tsuboi K, Sakae T, Sakurai H. Dose distribution resulting from changes in aeration of nasal cavity or paranasal sinus cancer in the proton therapy. Radiother Oncol. 2014;113:72–6. |
| 18. | Veiga C, Janssens G, Teng CL, Baudier T, Hotoiu L, McClelland JR, Royle G, Lin L, Yin L, Metz J, Solberg TD, Tochner Z, Simone CB II, McDonough J, Teo BK. First clinical investigation of cone beam computed tomography and deformable registration for adaptive proton therapy for lung cancer. Int J Radiat Oncol Biol Phys. 2016;95:549–59. |
| 19. | Liu W, Frank SJ, Li X, Li Y, Park PC, Dong L, Ronald Zhu X, Mohan R. Effectiveness of robust optimization in intensity-modulated proton therapy planning for head and neck cancers. Med Phys. 2013;40:051711. |
Источник: International Journal of Particle Therapy, оригинальный текст статьи можно прочитать здесь.
Амелобластома челюсти
В клинике Ассута лечением амелобластомы занимается многопрофильная врачебная команда, включающая в себя: отоларинголога, челюстно-лицевого хирурга, патолога и онколога, а также при необходимости экспертов в других областях медицины.
Клиницисты больницы Ассута обладают большим опытом первичной и дифференциальной диагностики редких опухолей. Располагая мощным лабораторным оборудованием, патологи исследуют образцы клеток опухоли, чтобы определить ее гистологический тип (существуют различные виды амелобластом) и характер (доброкачественный или злокачественный). Эта ценная информация необходима врачу для выбора эффективной стратегии лечения.
Во всех случаях, когда у пациента диагностируется амелобластома челюсти, лечение в Израиле предполагает персонализированный подход. При составлении терапевтического протокола врачи клиники Ассута учитывают такие факторы, как размер, местоположение и степень распространения опухоли, а также индивидуальные особенности пациента и его личные предпочтения.
Лечение, как правило, хирургическое. Поскольку удаление амелобластомы может негативно повлиять на внешний вид, а также функцию глотания и речи, пациентам часто требуются реконструктивные операции. Известные на весь мир своим мастерством израильские пластические хирурги проводят уникальные операции, позволяющие восстановить внешность и функциональные способности. В клинике Ассута с перенесшими операцию пациентами работают врачи: диетологи, логопеды, стоматологи-ортопеды, физиотерапевты и реабилитологи,
Методы лечения амелобластомы в Израиле

Химиотерапия и лучевая терапия, по всей видимости, не оказывают никакого значимого влияния на большинство видов незлокачественных амелобластом, поэтому их обычно лечат хирургическим путем. Несмотря на доброкачественный характер, амелобластомы челюсти неуклонно проникают в окружающие ткани, разрушая их. Обычная амелобластома прорастает в окружающую кость и выходит за видимые рентгенологические границы. Частота рецидивов колеблется от 20 до 90%. Планируя лечение, израильские врачи учитывают стандартные характеристики опухоли (размер, локализация), гистопатологию, а также ее клинические и рентгенологические проявления.
Учитывая личный практический опыт и данные клинических исследований, израильские хирурги не прибегают к лечению амелобластомы кюретажем (выскабливанием), так как это может привести к образованию небольших островков опухоли в кости. Поэтому наиболее эффективным и распространенным методом лечения этого заболевания является хирургическое удаление опухоли. Операция может быть либо щадящей, когда врач стремится сохранить как можно больше тканей, расположенных вблизи очага поражения, либо радикальной – более инвазивной процедурой, после которой требуется реконструкция оперируемой области.
Поскольку амелобластомы склонны к распространению в окружающие ткани израильские врачи чаще всего прибегают к агрессивной хирургии или резекции единым блоком. Например, амелобластома верхнечелюстной кости особенно опасна из-за костной архитектуры – опухоль растет вверх, вовлекая синоназальные проходы, крыловидно-нижнечелюстную складку, орбиты, череп и мозг. Поэтому верхнечелюстные амелобластомы требуют радикального удаления, так как из-за близости опухоли к жизненно -важным структурам прогноз при рецидиве заболевания крайне неблагоприятный.
Оперативное лечение амелобластом требует «большого хирургического края» для достижения лучшего терапевтического эффекта. Израильские хирурги рекомендуют, чтобы края эксцизии включали в себя 1,5 см нормальной кости. Такой подход обеспечивает удаление всех раковых клеток и снижает риск рецидива заболевания. Если опухоль все же снова начинает расти не исключена повторная операция с последующей лучевой терапией.
Поскольку хирургическое лечение амелобластом может подразумевать удаление челюсти, мягких тканей, а также лицевых артерий и нервов, после операции израильские хирурги проводят реконструктивное вмешательство. Челюсть восстанавливается с помощью металлического имплантата или костного аутотрансплантата, взятого из другой части тела. Для реконструкции часто используется малоберцовая кость, так как часть ее можно задействовать без ущерба для функции нижней конечности. Если операция затронула такие важные функции, как жевание, глотание или речь, на помощь приходят опытные врачи-реабилитологи клиники Ассута, профессионализм которых доказывают многочисленные положительные отзывы пациентов.
После операции выполняется компьютерная томография, чтобы врач убедился в том, что опухоль удалена полностью. В течение последующих 5 лет пациентам необходимо проходить регулярные сканирования. Рецидив амелобластомы во многих случаях приводит к развитию рака. Врачи будут искать признаки злокачественного процесса, чтобы своевременно начать лечение.
Диагностика амелобластомы в Израиле
Поскольку амелобластомы челюсти относятся к достаточно редким опухолям, качественная диагностика имеет очень большое значение. Если вы не уверены в диагнозе, который поставили вам врачи на родине, в клинике Ассута есть эксперты, специализирующиеся на выявлении и лечении рака кости, поэтому вы всегда можете воспользоваться услугой «второе мнение».
Сегодня для того, чтобы пообщаться с израильскими профильными врачами, не обязательно тратить деньги на перелет и проживание в чужой стране. С помощью услуги «видеоконсультация» вы сможете задать доктору все интересующие вопросы в комфортной обстановке. Дополнительным плюсом этой услуги является то, что она дает вам право на одну бесплатную очную консультацию врача, если таковая понадобится.
Диагностический процесс в клинике Ассута четко скоординирован и занимает всего 3 дня.
Консультация профильного онколога
Многие амелобластомы обнаруживаются случайно во время рутинных стоматологических процедур. Врачи часто принимают опухоль за инфекцию и назначают курс антибиотиков. И, как правило, когда симптомы не исчезают после антибактериальной терапии, выполняется рентгенография и возникает подозрение на амелобластому.
При наличии таких подозрений израильский врач проведет физическое обследование пациента, составит историю болезни, выяснит факторы риска и возможные причины развития заболевания, после чего назначит дополнительные исследования.
Инструментальные и лабораторные исследования
Чтобы уточнить диагноз, а также собрать дополнительную информацию о состоянии здоровья пациента, необходимую для составления эффективного плана терапии, назначаются следующие дополнительные диагностические тесты:
- КТ. Это исследование не может окончательно подтвердить или опровергнуть диагноз. Однако компьютерная томография предоставляет врачу важную информацию о точном местонахождении опухоли и ее размере. Кроме того, КТ-сканы полезны для планирования лечения пациентов и выбора наилучшего способа хирургического удаления опухоли.
- МРТ. Это наиболее эффективный и точный неинвазивный метод диагностики амелобластомы. МРТ не только помогает выявить разницу между амелобластомой и другими схожими новообразованиями, но и может определить специфический тип опухоли.
- Биопсия. Взятие биопсии необходимо для подтверждения диагноза. В ходе процедуры врач берет небольшой участок ткани, после чего патолог проводит гистологический анализ на наличие специфических клеток.
Врачебный консилиум
После того, как результаты всех диагностических исследований будут готовы, лечащий врач представит их на врачебном консилиуме. Эксперты в различных областях медицины внимательно изучат медицинскую историю и результаты диагностики, после чего подтвердят или опровергнут диагноз и составят персонализированный план лечения, максимально адаптированный под уникальные потребности пациента.
Сколько стоит лечение амелобластомы в Израиле
Окончательная стоимость диагностики и лечения будет зависеть от нескольких факторов, таких как специфика диагноза, сложность хирургического лечения, длительность госпитализации, необходимость в реконструктивной операции и реабилитации и др. Поэтому предварительные цифры вы сможете узнать после консультации онколога и первичной диагностики. Но если говорить в среднем, то цена лечения амелобластомы в израильских клиниках примерно на треть, а иногда и вполовину ниже, чем в медицинских центрах других развитых стран.
Амелобластома - симптомы и лечение
Что такое амелобластома? Причины возникновения, диагностику и методы лечения разберем в статье доктора Куфтарева Виталия Александровича, стоматолога со стажем в 10 лет.
Над статьей доктора Куфтарева Виталия Александровича работали литературный редактор Вера Васина , научный редактор Елена Страндстрем и шеф-редактор Маргарита Тихонова
Определение болезни. Причины заболевания
Амелобластома (Ameloblastoma) — это доброкачественная опухоль, которая развивается из зубообразующих тканей. По мере её роста деформируются черты лица, смещаются и расшатываются зубы.
Амелобластома развивается медленно и бессимптомно, чаще возникает в области угла и ветви нижней челюсти. Почти никогда не вызывает воспаления.
![Амелобластома [11]](/pimg1/ameloblastoma-luchevaya-diagnostika-141E22.jpeg)
Существует редкий аналог данной опухоли — злокачественная амелобластома, относящаяся к группе одонтогенных раков. Она может давать метастазы в другие органы, например в кости, селезёнку, печень и лёгкие [1] .
Распространённость амелобластомы
Амелобластомы составляют примерно 1 % от всех случаев опухолей лица. В большинстве случаев они возникают в возрасте 30–40 лет. Мужчины и женщины болеют одинаково часто [1] [10] .
Причины развития амелобластомы
Точные причины появления амелобластомы не установлены. По одной из версий, она возникает из-за патологии развития зубного зачатка, по другой — происходит из одонтогенных эпителиальных остатков (островков Малассе).
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы амелобластомы
Чаще всего амеобластома возникает в области угла и ветви нижней челюсти, в области зубов мудрости [9] . На ранних стадиях заболевание протекает без симптомов.
Амелобластома относится к доброкачественным опухолям, которые развиваются внутри кости нижней челюсти. Как правило, она растёт медленно [10] . Если болезнь не лечить, то расшатываются и смещаются зубы, деформируется прикус. В дальнейшем, при достижении больших размеров опухоли, нарушается симметрия лица. Таким пациентам требуются обширные хирургические вмешательства и длительная реабилитация.
Иногда амелобластомы сочетаются с зубными кистами и непрорезавшимися зубами [9] . Но эти процессы могут развиваться и независимо друг от друга.
Патогенез амелобластомы
Амелобластома возникает из-за бесконтрольного деления клеток-предшественников тканей зуба (эмалевого органа), которые остались после его формирования. В большинстве случаев сами клетки не меняются, от нормальных они отличаются расположением относительно друг друга и высокой скоростью роста. В результате образуется опухоль, которая постепенно увеличивается, но не причиняет беспокойства, пока не достигнет больших размеров.
Что именно запускает развитие амелобластомы, пока неизвестно [10] .
Классификация и стадии развития амелобластомы
По Международной классификации болезней (МКБ-10) амелобластоме присвоены коды D16.4, D16.5: доброкачественное новообразование костей черепа и лица; доброкачественное новообразование нижней челюсти костной части.
Выделяют два типа амелобластом:
- Доброкачественные:
- солидная (поликистозная);
- уникистозная;
- внекостная (периферическая);
- десмопластическая.
- Злокачественные:
- метастазирующая амелобластома;
- амелобластная карцинома [1][10] .
Все эти формы проявляются одинаково: растут и деформируют лицо. Они различаются только по своему строению, что определяет тактику лечения.
Поликистозная форма встречается чаще всего, как правило поражает нижнюю челюсть. Возникает из остатков однотогенного эпителия, из которого образовались зубы. По структуре напоминает пчелиные соты или мыльные пузыри. Опухоль состоит из каркаса эпителиальных клеток, между которыми содержатся коллагеновые волокна. В клеточном компоненте выделяют периферическую и центральную части. Периферическая часть состоит из вытянутых и многоугольных клеток (столбчатых и звёздчатых). Клетки центральной части по своему строению отдалённо напоминают зубной зачаток.
Если рассматривать срез опухоли под микроскопом, можно условно выделить шесть подтипов:
- фолликулярную амелобластому — состоит из множества мелких островков клеток, при таком строении чаще всего формируется киста (пустое ограниченное пространство, заполненное жидкостью);
- плексиформную — образована из « склеившихся » островков эпителия с двойными рядами клеток-столбиков, расположенных « спина к спине » ;
- акантоматозную — полигональные клетки ( « звёздочки » ) теряют свои отростки и образуют кератиновый жемчуг в центре опухоли;
- базально-клеточную — клетки менее столбчатые, расположены в виде листов;
- гранулярную — в цитоплазме звёздчатых клеток появляются крупнозернистые включения (гранулы);
- десмопластическую — наблюдается плотная коллагеновая строма.
![Формы амелобластом: A, E — фолликулярная; B, F — плексиформная; C, G — акантоматозная; D, H — десмопластическая [12]](/pimg1/ameloblastoma-luchevaya-diagnostika-83572D.jpeg)
Уникистозная форма — вторая по распространённости после поликистозной амелобластомы. Эта опухоль, как правило, развивается в возрасте 20–30 лет. Часто возникает повторно, примерно раз в семь лет [1] . На рентгеновском снимке опухоль выглядит как фолликулярная киста, но без зачатка зуба. Делится на два подтипа: люминальный и интралюминальный. В первом случае стенка кисты выстилается эпителием амелобластомы, во втором — эпителий выступает внутрь полости. Чаще всего на рентгенограмме определяется одна такая полость, но может быть и несколько.
Периферическая форма — самый редкий вариант. Мужчины болеют примерно в два раза чаще, чем женщины, средний возраст пациентов составляет 50 лет [10] . Опухоль возникает в мягких тканях и не проникает в кости, ограничивается слизистой оболочкой десны и альвеол. Растёт медленно и безболезненно. При исследовании среза опухоли напоминает акантоматозный тип поликистозной амелобластомы [1] .
Десмопластическая форма отличается от остальных необычным гистологическим и рентгенологическим рисунком. На рентгенограмме у неё нет чётких границ, чередуются плотные и прозрачные структуры с неровными краями. Это говорит о большей агрессивности такой формы по сравнению с остальными доброкачественными вариантами. Под микроскопом видна изменённая рыхлая соединительная ткань, окружающая островки эпителиальных клеток. Иногда изменения заметны и в костной ткани.
Метастазирующая амелобластома появляется как следствие озлокачествления одной из доброкачественных форм. Даёт метастазы во внутренние органы, чаще всего в лёгкие. По своему рентгенологическому или гистологическому строению может не отличаться от доброкачественной формы.
Амелобластическая карцинома может развиваться самостоятельно или в результате озлокачествления доброкачественной формы. Амелобластная и амелобластическая — по сути одно и то же, хотя есть незначительные отличия на клеточном уровне. Клетки карциномы становятся низкодифференцированными, т. е. после деления никак не развиваются и не меняются. Опухоль быстро и агрессивно растёт, её клетки обладают повышенной митотической активностью — стараются быстрее разделиться пополам, образуя две опухолевые клетки из одной. Новообразование становится болезненным, может выходить за пределы костной ткани. Диагностируется гистологически, т. е. изучается срез под микроскопом.
Характерные признаки амелобластической карциномы:
- много незрелых клеток с ярко выраженными ядрами (ядерный гиперхроматизм);
- есть очаги некроза — часть клеток опухоли может погибать из-за неадекватного обмена питательных веществ и выведения продуктов жизнедеятельности [1][4][6][10] .
Осложнения амелобластомы
Все осложнения амелобластомы связаны с её инвазивным ростом. При запущенных доброкачественных опухолях может деформироваться лицо и зубные ряды.
К отдалённым осложнениям относится озлокачествление опухоли. Этот процесс протекает бессимптомно, вплоть до поздних стадий, на которых диагностируется несколько опухолей и в других органах. При этом резко снижается вес, появляются сильные боли. Может нарушиться работа поражённых органов, например:
- при поражении лёгких будут проблемы с дыханием [1] ;
- при запущенном поражении костей возникают патологические переломы;
- при метастазировании в область ворот печени может возникнуть механическая желтуха; на ранних стадиях патология выявляется только с помощью биохимического анализа крови (уровня АСТ, АЛТ и щелочной фосфатазы).
Диагностика амелобластомы
При подозрении на амелобластому применяются следующие методы:
- Рентгенограмма (ортопантомограмма) — на двухмерном снимке видна опухоль с характерными признаками амелобластомы (поражение в виде мыльных пузырей), что позволяет предположить этот диагноз.
- КЛКТ (конусно-лучевая компьютерная томография) — трёхмерный снимок даёт больше информации о положении опухоли в костной ткани, её размерах и строении. Но даже с помощью этого метода можно поставить лишь предварительный диагноз [2][3] .
- МРТ (магнитно-резонансная томография) — покажет патологию в мягких тканях.
- Цитологический и гистологический метод — пункция и трепан-биопсия.
Выбор способа диагностики зависит не столько от оснащения лечебного учреждения, сколько от клинической ситуации и информации, которая нужна в данный момент. Первые три метода приведут врача к финальному гистологическому методу, который чаще всего проводится уже после того, как опухоль была удалена хирургическим путём. С его помощью можно установить форму амелобластомы.
Хотя амелобластома крайне редко становится злокачественной (описано около 30 случаев метастазирующей амелобластомы [1] ), целесообразно провести комплексное обследование: МРТ всего организма и анализ крови на онкомаркеры (Ki-67, SOX2). Эти исследования помогут заподозрить наличие злокачественной амелобластомы. Достоверно определить злокачественность опухоль можно только гистологическим методом после операции.
Только проведя весь комплекс диагностических мер и тщательно проанализировав результаты, можно поставить окончательный диагноз и назначить адекватное лечение [2] [3] [7] [9] [10] .
Дифференциальная диагностика
Лечение амелобластомы
Доброкачественные амелобластомы удаляются хирургически с иссечением 1 см здоровых тканей. Чтобы избежать рецидива, очень важно удалить всю опухоль целиком. Как правило, одновременно проводят реконструктивную пластику нижней челюсти с использованием титановых пластин и аутотрансплантата.
Амелобластная карцинома тоже удаляется хирургически, но иссекается больше здоровых тканей — 2–3 см. Затем проводится химио- и лучевая терапия: участок, где располагалась опухоль, облучают рентгеновскими лучами и принимают специальные препараты — цитостатики, которые замедляют пролиферацию (размножение) клеток , но, к сожалению, не только опухолевых, но и и всех быстро делящихся клеток организма.
Злокачественная амелобластома удаляется с иссечением 1–2 см здоровых тканей. Химио- и лучевая терапия обычно не требуются. Злокачественная амелобластома может давать метастазы, в остальном у неё сохраняются признаки доброкачественной опухоли, т. е. сами клетки не претерпевают злокачественного изменения. Лучевая терапия в этом случае не нужна.
Операцию должен проводить хирург, прошедший специальную подготовку: челюстно-лицевой хирург, пластический хирург, хирург-онколог, оториноларинголог.
Целесообразно выбрать более щадящий хирургический метод, сохраняющий функцию нижней челюсти, не обезображивающий лицо пациента и позволяющий избежать рецидива. При расположении опухоли в костном массиве производят частичную резекцию нижней челюсти с сохранением её непрерывности. При обширных амелобластомах, распространяющихся на край нижней челюсти, показана сквозная резекция нижней челюсти, при значительном разрушении ветви с поражением мыщелкового отростка — экзартикуляция нижней челюсти (вместе с опухолью) в пределах здоровых тканей [13] .
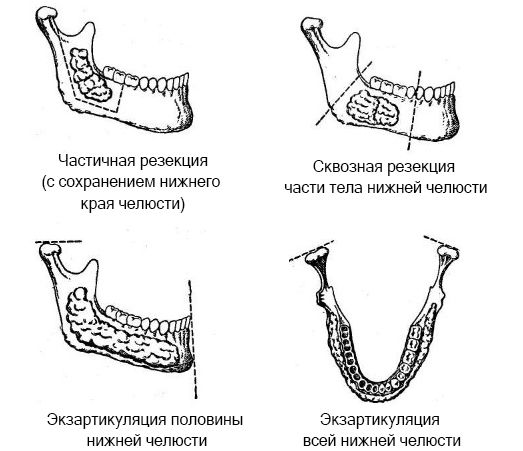
Хирургическое лечение зачастую не ограничивается непосредственно операцией по удалению опухоли. Из-за полного отсутствия симптомов на ранних сроках амелобластому обычно диагностируют достаточно поздно, когда она достигает крупных размеров. После её удаления могут оставаться значительные дефекты, нарушающие работу зубочелюстной системы и внешний вид пациента. Поэтому после удаления опухоли, как правило, следуют одна или несколько реконструктивных операций с длительной реабилитацией [5] [7] .
К реконструктивным операциям относятся:
- пересадка костного трансплантанта;
- пересадка кожи и тканевых трансплантантов — проводится, если деформированы мягкие ткани.
После таких операций пациентам рекомендуется находиться в стационаре или дома на больничном. Чаще всего требуется иммобилизация челюстей, т. е. их обездвиживание.
Прогноз. Профилактика
Доброкачественная амелобластома очень часто возникает повторно. В таких случаях снова требуется операция и, вероятнее всего, восстановительная хирургия. Метастазирующая амелобластома и амелобластная карцинома встречается очень редко, поэтому о прогнозе говорить сложно [1] [10] .
Профилактика амелобластомы
Профилактики нет, так как до сих пор не известны причины заболевания. Главным фактором в лечении будет ранняя диагностика, поэтому при появлении первых симптомов следует обратиться к врачу. Ранней диагностике также способствуют регулярные визиты к стоматологу (каждые полгода). Особенно внимательно нужно следить за своим состоянием пациентам, у которых уже была обнаружена и удалена амелобластома.
Читайте также:
