Антикоагулянты в офтальмологии. Послеоперационные болевые ощущения
Добавил пользователь Евгений Кузнецов Обновлено: 27.01.2026
Нестероидные противовоспалительные средства (НПВС) широко используются в офтальмологической практике. Они доказали свою эффективность для поддержания мидриаза, купирования послеоперационного иридоциклита, профилактики кистозного макулярного отёка в хирургии катаракты. Применяются в лечение зуда при аллергических конъюнктивитах. Другая перспективная область применения НПВС — кераторефракционная хирургия. Развитие кераторефракционной хирургии, а именно переход на полностью лазерные технологии (FemtoLasik, ReLеx), привело к сокращению времени операции, снижению операционной (хирургической) травмы и ограничению применения стероидов.
Современные тенденции кераторефракционной хирургии:
• сокращение времени операции;
• снижение операционной травмы;
• уменьшение субъективного дискомфорта пациента во время операции и в первые часы после операции
Стандартная схема медикаментозного сопровождения пациентов после кераторефракционной операции в раннем послеоперационном периоде — это антибактериальная и далее слезозаместительная терапия. Вопрос о применении противовоспалительных средств, стероидных и нестероидных, до сих пор остается дискутабельным, хотя в настоящее время увеличивается число публикаций, которые содержат сведения об успешном применении НПВС.
Основные жалобы пациентов в раннем послеоперационном периоде: боль, жжение, светобоязнь, слезотечение, ощущение инородного тела.
Целью нашего исследования явился анализ особенностей послеоперационного периода у пациентов при фемтолазерных рефракционных операциях на фоне применения различных НПВС. Под наблюдением находилось 80 пациентов (160 глаз), которым выполнена кераторефракционная операция по различным технологиям: FemtoLasik (54 пациента) с применением фемтосекундного лазера VisuMaх для формирования роговичного лоскута и эксимерного лазера Mel80 для проведения абляции, также рефракционной экстракции лентикулы роговицы по технологии Relex (26 пациентов), которая проводилась на одном фемтосекундном лазере VisuMax. Миопия варьировала от —1,5 D до —7,5 D, астигматизм от 0,5 до 5,0 D, острота зрения была в среднем — 0,07 ± 0,01 (от 0,03 до 0,25) , среднее ВГД —18,7±0,07 (от 14 до 22) мм рт. ст.
Схема периоперативного медикаментозного сопровождения в нашем исследовании была следующая:
• Антибиотик (АБ) по 1к. 3 раза в день за один день до операции, непосредственно перед операцией (за 60 и 30 минут), в первые сутки после операции и последующие 7 дней. В качестве антибактериального препарата был выбран препарат Вигамокс.
• НПВС применялись непосредственно перед операцией (за 60 и 30 минут), в первые сутки после операции по 1к. 3 раза в день. Инстилляции продолжались 1-3 дня, что соответствовало сроку выраженности субъективного дискомфорта у пациентов.
В соответствии с различными НПВС пациенты были разделены на 4 группы (в каждой по 20 человек — 40 операций) :
1-ая группа — Индоколлир 0.1% (Baush&Lomb),
2-ая группа — Дикло-Ф 0.1% (Promed Exports),
3-ая группа — Неванак 0.1% (Alcon),
4-ая группа — Акьюлар ЛС 0,4% (Allergan)
Проводилось комплексное офтальмологическое обследование, включающее биомикроскопию с флюоресцеиновым тестом, определение некорригированной остроты зрения вдаль (НКОЗ), корригированной остроты зрения (КОЗ), рефракции в первый-третий-седьмой день после операции, а также оценка субъективных ощущений пациентов: боль, жжение, светобоязнь, слезотечение, ощущение инородного тела в первые три часа после операции, вечером в тот же день после операции и на следующее утро после операции по специальным анкетам. Анализ интенсивности и выраженности боли проводился по визуальной аналоговой шкале боли (ВАШ, visual analog scale —VAS).
Общеизвестно, что дискомфортные ощущения при кераторефракционных операциях являются основной жалобой пациентов в раннем послеоперационном периоде и подробно описаны в клинике. Анкета, которую заполняли пациенты в данном исследовании, содержала наиболее частые варианты роговичного синдрома: от чувства инородного до боли, а также светобоязни и слезотечения. Выраженность их зависит от индивидуального порога болевой чувствительности, но при отсутствии дополнительного медикаментозного сопровождения отмечается практически у каждого пациента.
В результате получили следующие данные (Рис. 1-3):
Субъективные ощущения пациентов (%) в первые три часа после кераторефракционной операции на фоне инстилляций различных НПВС выглядели следующим образом: болевые ощущения — в группе Индоколлир и Дикло-Ф были сильно выражены (75% и 80% соответственно), в группе Неванак и Акьюлар ЛС — 5% , жалобы на жжение в глазах присутствовали у пациентов в группе Дикло-Ф в 100% случаев, в группе Индоколлир — 75%, а в группе Неванак и Акьюлар ЛС — 15% и 20% соответственно. Жалобы на ощущение инородного тела предъявляли все пациенты, кроме группы Неванак, жалобы на слезотечение и светобоязнь предъявлялись во всех группах, но в группе Неванак и Акьюлар ЛС процентное соотношение было значительно меньше.
Субъективные ощущения пациентов (%) в первые сутки (вечер) после кераторефракционной операции на фоне инстилляций различных НПВС выглядели следующим образом: динамика ощущений к вечеру была положительной во всех группах. Жалобы на болевые ощущения сохранялись только в группах Индоколлир и Дикло-Ф. В группах Акьюлар и Неванак отсутствовали. Жалобы на жжение в глазах предъявляли все пациенты, но группа Неванак и Акьюлар ЛС в меньшем процентном соотношении (15% и 20% соответственно). Жалобы на ощущение инородного тела присутствовали во всех группах , кроме группы Неванак. Жалобы на светобоязнь и слезотечение присутствовали только в группах Индоколлир и Дикло-Ф.
Субъективные ощущения пациентов (%) в первые сутки (утро) после кераторефракционной операции на фоне инстилляций различных НПВС: динамика ощущений также была положительная, жалобы на боль отсутствовали во всех группах, жалобы на жжение, светобоязнь и слезотечение присутствовали в группах Индоколлир и Дикло-Ф. Жалобы на ощущение инородного тела отсутствовали только в группе Неванак. Во всех остальных группах присутствовали, что коррелировало с незначительным отеком эпителия при биомикроскопии. При отмене препарата отек проходил на следующие сутки. При этом максимальная НКОЗ в первый день после операции оставалась высокой (0.9) и достигала максимума (1,0) в течении 3-7 дней .
Все же основной наш аспект в раннем послеоперационном периоде — профилактика болевых ощущений в первые три часа после кераторефракционной операции, поэтому основное внимание уделялось оценке интенсивности и выраженности боли в первые три часа после операции, которая проводилась по визуальной аналоговой шкале (ВАШ). Напомню, как проводится этот тест. Визуальная аналоговая шкала (ВАШ) — это прямая линия длиной 10 см, концы которой соответствуют крайним степеням интенсивности боли («нет боли» на одном конце, «мучительная нестерпимая боль» — на другом). Линия может быть как горизонтальной, так и вертикальной. Пациенту предлагают сделать на этой линии отметку, соответствующую интенсивности испытываемых им в данный момент болей. Расстояние между концом линии («нет болей») и сделанной больным отметкой измеряют в сантиметрах и округляют. Полученные данные представленны на рис. 4.
В нашем исследовании наиболее эффективным показал себя препарат Неванак. Анальгетический эффект наступал быстро — уже в первые 3 часа после кераторефракционной операции. Болевые ощущения отсутствовали практически у всех пациентов в исследуемой группе (95% пациентов), а 80% пациентов не предъявляли жалобы на какой-либо субъективный дискомфорт в глазах. При использовании данного препарата не было выявлено каких-либо побочных эффектов.
Схожую анальгетическую активность продемонстрировал препарат Акьюлар ЛС. При применении препарата более 3-х суток выявлялся остаточный отек эпителия роговицы, при более ранней отмене (после 1-х суток) эти явления практически отсутствуют.
Полученные результаты позволяют предположить, что, возможно, препарат Неванак 0.1% имеет более селективный механизм действия, что обуславливает быстрое наступление анальгетического эффекта и отсутствие побочных эффектов, свойственных для неселективных НПВС. Другим возможным обьяснением высокой эффективности Неванака может быть тот факт, что будучи пролекарством он преобразуется в активное вещество Амфенак в ткани роговицы, то есть в месте непосредственного воздействия на патологический процесс.
Препараты Индоколлир и Дикло-Ф не проявили выраженного анальгетического эффекта. Все пациенты в указанных группах в первые три часа после операции предъявляли жалобы на субъективный дискомфорт, а у 70% и 80% пациентов соответственно дискомфорт выражался в болевых ощущениях в глазах.
Наглядная иллюстрация результатов: флюоресцеиновый тест, биомикроскопическая картина на следующий день после кераторефракционной операции (группа Неванак) (Рис.5).
1) Включение нестероидных противовоспалительных препаратов (Неванак) в периоперативное медикаментозное сопровождение после кераторефракционной операций позволяет минимизировать субъективные жалобы пациента.
2) Высокие функциональные результаты в сочетании с комфортным течением раннего послеоперационного периода повышает качество современных лазерных технологий кераторефракционной хирургии.
3) Длительность применения НПВС, ориентированных в первую очередь на анальгетический эффект, не должна превышать 2-3 дней после операции. В течении данного срока реализуется положительный эффект НПВС и не формируются возможные побочные эффекты.
4) Итоговая схема ведения пациентов после кераторефракционных операций рекомендована в следующем виде:
• Антибиотик-фторхинолон (Вигамокс) по 1к. 3 раза в день за один день до операции, непосредственно перед операцией (за 60 и 30 минут), в первые сутки после операции и последующие 7 дней.
• НПВС (Неванак) непосредственно перед операцией (за 60 и 30 минут), в первые сутки после операции по 1к. 3 раза в день. Инстилляции НПВС после операции продолжаются от 1-го до 3-х дней.
• Слезозаместительная терапия по показаниям через 2-3 недели после операции.
Антикоагулянты в офтальмологии. Послеоперационные болевые ощущения
Антикоагулянты в офтальмологии. Послеоперационные болевые ощущения
В своей клинической практике авторы данной статьи практически никогда не отменяют антикоагуляционную или противотромботическую терапию перед выполнением витреоретинального хирургического вмешательства. Хотя благоразумнее подстраховаться, в случае если пациент принимает препараты, содержащие варфарин, в любом случае международное нормализованное отношение (MHO) должно быть в пределах терапевтических значений (обычно от 2 до 3).
Отмена антикоагулянтов может стать причиной возникновения инсульта, инфаркта миокарда, тромбоэмболии легочной артерии (ТЭЛА) и глубокого венозного тромбоза, что может привести к смерти пациента. По мнению авторов данной статьи, опасность интраоперационного кровотечения значительно переоценена по сравнению с рисками прекращения терапии антикоагулянтами. Надлежащим образом выполненная операция безопасна для пациентов, у которых величина MHO находится в терапевтическом диапазоне.
Использование канюли с тупым концом для выполнения местной анестезии значительно снижает риск кровотечения у данных пациентов, так же как использование коротких (1,25 дюйма) 27G игл, введенных в наименее васкуляризованное место орбиты (следует избегать верхней половины орбиты, особенно верхненосового квадранта) при орбитальной анестезии.

Послеоперационные болевые ощущения
Одной из причин болевых ощущений в послеоперационном периоде является субконъюнктивальная инъекция антибиотиков и стероидных препаратов в конце операции. Уменьшить болевые ощущения можно, если вводить эти препараты в субтеноново пространство с помощью канюли, если был произведен разрез конъюнктивы, но не в случае 25G бесшовной хирургии. Кроме того, введение анестетиков длительного действия, таких как бупивакаин, с помощью гибкой канюли в конце операции может значительно снизить послеоперационные болевые ощущения.
Это особенно важно у пациентов, которым требуется выполнение операции под общей анестезией и тех, кому произведено склеральное пломбирование.
Подавляющее большинство витреоретинальных операций могут быть безопасно, комфортно и эффективно выполнены под местной анестезией с минимальной седацией. По сравнению с общей анестезией, местная анестезия, выполненная надлежащим образом и под контролем параметров организма, более безопасна для пациента, снижает время восстановления в послеоперационном периоде и обладает более длительным периодом аналгезии после операции.
Тем не менее выбор анестезиологического пособия должен основываться на состоянии пациента, требованиях хирурга и навыках анестезиолога. Всегда надо держать в уме, что конечная цель - это удовлетворенность пациента и хорошие послеоперационные зрительные функции.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Антиаритмическая терапия до и после инвазивных методов лечения фибрилляции предсердий.
Оксана Михайловна Драпкина, профессор, доктор медицинских наук:
– Тарасов Алексей Владимирович. «Антиаритмическая терапия до и после инвазивных методов лечения фибрилляции предсердий».
Алексей Владимирович Тарасов, кандидат медицинских наук:
На сегодняшний день лечение пароксизмальной формы фибрилляции предсердий, безусловно, это антиаритмическая терапия и какие-то инвазивные методы лечения. Основным инвазивным методом лечения фибрилляции предсердий является катетерная радиочастотная абляция устья легочных вен. В основном сейчас делают антральную абляцию устья легочных вен. Основным показанием к радиочастотной абляции устья легочных вен является симптоматическая параксизмальная форма фибрилляции предсердий, резистентная как минимум к двум антиаритмическим препаратам. На сегодняшний день обсуждается – к одному антиаритмическому препарату или как минимум к двум антиаритмическим препаратам. Но пока это как минимум два антиаритмических препарата вы должны своему пациенту дать, если они не работают, только тогда решать вопрос о лечения фибрилляции предсердий именно методом катетерной абляции.
Также очень важно отметить, что такие пациенты должны быть без органической патологии сердца, потому что больные с органической патологией сердца имеют другие механизмы, не обязательно эктопия из устьев легочных вен, здесь уже вовлечены процессы в предсердной ткани, и у таких пациентов радиочастотная абляция будет либо малоэффективна, либо 50/50.
Что мы имеем после радиочастотной абляции. Послеоперационный период можно разделить на три периода. Первый период составляет три месяца, его называют ранним послеоперационным периодом, некоторые его называют слепым послеоперационным периодом. Это самый проблемный период, потому что возникают как рецидивы старой фибрилляций предсердий, так и рецидивы новых предсердных тахиаритмий, и дальше я объясню, почему. И на третьем месяце мы должны принять решение, как быть дальше. Далее следует непосредственно послеоперационный период от трех до двенадцати месяцев наблюдения. И после двенадцати месяцев – поздний послеоперационный период.
Какие проблемы нас ждут в раннем послеоперационном периоде? Прежде всего, самое неприятное то, что 15% направленных больных на инвазивное лечение фибрилляции предсердия чувствуют себя первых два-три месяца даже хуже. И в этом-то и вопрос антирекламы так называемой. Врач, направивший больного на радиочастотную абляцию, потому получает этого пациента через одну-две недели, и пациент ему говорит: «Доктор, мне стало хуже». Действительно, у 15% пациентов после радиочастотной абляции идет ухудшение какое-то. И связано это ухудшение с тем, что у 45% – 50% возникают предсердные тахиаритмии. И сейчас мы уже говорим, что если взять все эти предсердные тахиаритмии, в 50% возвращается фибрилляция предсердия, рецидивы, ранние рецидивы, и 50% новые регулярные предсердные тахикардии. И самое неприятное, что именно новые предсердные тахикардии и составляют сложность в терапии, в диагностике, потому что под ними могут лежать как левопредсердное трепетание, предсердные тахикардии – эктопические, которые очень сложно поддаются медикаментозной терапии.
И вот как пример кардиограмма, где представлена в раннем послеоперационном периоде левопредсердное трепетание предсердий. Раньше мы вообще практически мало видели левопредсердных трепетаний. И именно после радиочастотной абляции стали появляться вот эти параксизмы, которые доставляют нам порой достаточные сложности в выборе тактики лечения. И вот как пример такой неустойчивый параксизм предсердной тахикардии, причем непрерывно рецидивирующий, порой они идут у таких пациентов именно в ранний послеоперационный период.
С чем же связана проблема раннего послеоперационного периода? Прежде всего, вот эти рецидивы связаны с воспалительной реакцией, обусловленной термическим повреждением предсердной ткани. Надо не забывать также об автономной нервной системе. Дело в том, что внутренняя поверхность сердца не имеет болевых рецепторов, но она имеет очень мощную автономную нервную систему, и эта нервная система возбуждается. И, безусловно, пока существует воспаление, происходит запуск вот этих предсердных тахикардий порой новых. И надо не забывать об отсроченном эффекте радиочастотной абляции – опосредованном формировании так называемого рубцового препятствия. Потому что пока существует зона воспаления, аритмия может проводиться, но когда формируется рубец, безусловно, защита как изоляции устья легочных вен здесь уже происходит прочнее.
Но ранние рецидивы фибрилляции предсердий либо новых предсердных тахиаритмий не являются таким эталоном, что радиочастотная абляция неэффективна. 60% больных с ранними рецидивами предсердных тахикардий далее имели четкие устойчивый синусовый ритм, и процедура считалась эффективной. Поэтому нельзя считать, что если у пациента ранние рецидивы фибрилляции предсердий либо другие какие-то предсердные тахикардии, это неэффективность процедуры. Но у тех пациентов, у которых мы имеем полную эффективность радиочастотной абляции и в ранний и поздний послеоперационный период, мы уже будем говорить об абсолютной эффективности радиочастотной абляции. Поэтому существует такая терминология как абсолютная эффективность и ранняя эффективность. Мы говорим о ранней эффективности, если приступов в первые три месяца не возникает.
Какие методы обследования нужно проводить таким пациентам? Сбор анамнеза, выявление симптомных приступов аритмии. Безусловно, после радиочастотной абляции пациенты более к себе относятся внимательно и предъявляют жалобы. Нередко они могут предъявлять жалобы на учащение ритма, либо даже какие-то болевые ощущения в области сердца. Больному необходимо проводить ЭКГ в 12-ти отведениях для определения как нарушений проводимости ритма сердца, так и нарушений аритмии. Необходимо проводить 1–7-суточное Холтеровское мониторирование ЭКГ для выявления асимптомных аритмий. Мы рекомендуем проводить Холтеровское мониторирование через месяц, через два, три для оценки дальнейшей тактики лечения.
Сейчас существуют еще такие методы как имплантируемый подкожный кардиомонитор, петлевые кардиомониторы, ЭКГ, которые позволяют мониторировать кардиограмму до трех лет. И на каждом визите доктор может снимать показания и оценивать асимптомные рецидивы фибрилляции предсердий.
Какова тактика ведения больных после радиочастотной абляции в ранний период? Мы должны определиться с антиаритмической терапией, необходимость антиаритмической терапии, с антитромботической терапией – это очень важно, я в конце об этом скажу. И мы можем воспользоваться немедикаментозными методами лечения в слепой период. Сейчас очень активно используется чреспищеводная электрическая стимуляция для восстановления именно новых тахикардий, например, левопредсердное трепетание предсердий. И имеет эффективность восстановления при проведении чреспищеводной стимуляции. Если у больного страдает гемодинамика, мы должны проводить электрокардиоверсию.
В чем вопрос антиаритмической терапии в ранний послеоперационный период. Сейчас нет четкости – нужно ли восстанавливать ритм этим пациентам или же стараться удерживать синусный ритм. Потому что пока нет четких конкретных данных, какой выбор тактики лучше «ритм-контроль» или «частота-контроль»? В консенсусе о катетрной и хирургической абляции фибрилляции предсердий от 2007 года в тактике ведения для удержания синусного ритма рассматривался только амиодарон. Но я абсолютно не согласен, потому что мы берем пациентов достаточно молодого возраста, мы берем пациентов без органической патологии. И потом после радиочастотной абляции сажать на амиодарон – на токсичный препарат абсолютно неоправданно. Поэтому в консенсусе от 2012 года предлагается более расширенный список антиаритмических препаратов: флекаинид, пропафенон, соталол, дофетилид или дронедарон. Но пока на сегодняшний день четких конкретных рекомендаций нет.
Тактика ведения именно на третьем месяце, когда прекращается слепой период. На третьем месяце мы должны четко понять, как быть дальше с этим пациентом, необходимо ли проводить повторную радиочастотную абляцию. Дело в том, что повторная радиочастотная абляция проводится достаточно часто (по многим авторам до 20% до 40%) – в нашей клинике до 40%, и это абсолютно нормальная тактика ведения пациентов. Но только после третьего месяца, когда пройдет воспаление, мы должны сказать, нужно ли проводить повторную радиочастотную абляцию или же не нужно. Если проанализировать поздние рецедивы предсердный тахиаритмий, если больному проводилась только одна радиочастотная абляция, поздние рецидивы возникают в 11% – 29% случаев. Если больному проводили как минимум две радиочастотные абляции, к сожалению, поздние рецидивы все равно случаются (по разным авторам от 7% до 24% случаев).
Какие причины возникновения поздних рецидивов предсердных тахиаритмий? Прежде всего, это возобновление проведения в зоне радиочастотной абляции устья легочных вен, когда наша изоляция начала пропускать импульс. И чаще, что возникает, это наличие триггеров, расположенных вне легочных вен. Нередко мы направляем больных на изоляцию устья легочных вен нельзя сказать запущенных, но уже когда время уходит. И из источника устья легочных вен эктопия опускается на предсердную ткань. Мы изолировали только устье легочных вен, но все предсердия мы не можем изолировать, поэтому, безусловно, эти триггеры начинают выстреливать и начинают давать поздние рецидивы. Но могу сразу сказать, что поздние рецидивы достаточно хорошо лечатся нашей современной антиаритмической терапией.
Я хочу представить наше интересное исследование, которое было начато еще в 2009 году на базе Московского областного кардиологического центра и дальше продолжено в ГНИЦ ПМ. Это был пилотный проект. Нами было обследовано 134 пациента, которым была проведена антральная изоляция устья легочных вен. И вот какие результаты мы получили. Ранние рецидивы предсердных тахикардий до трех месяцев возникали практически в 50% случаев. Но лишь только к повторной радиочастотной абляции пришли порядка 30% данных пациентов.
Следующий очень важный момент. У 30% больных преобладали регулярные предсердные тахикардии, то есть достаточно много было регулярных предсердных тахикардий, которые ставили наших врачей порой в тупик, как их лечить. И чаще всего превалировало левопредсердное трепетание предсердия. И в 20 % случаев были рецидивы фибрилляции предсердий.
Данные пациенты наблюдались до 12 месяцев, но больше нас интересовал именно слепой период, потому что у нас были выбраны различные тактики ведения пациентов, и одна группа пациентов вообще не принимала антиаритмических препаратов. Мы сейчас стали включать пациентов с имплантацией ревили (00:15:58) для исключения асимптомных рецидивов фибрилляции предсердий, и таких пациентов с имплантированными устройствами мониторирования у нас уже 39, но исследование не закончено, поэтому окончательные данные я вам не могу сказать.
Хочется сказать пока по полученным результатам. 36% больных продолжают прием антиаритмических препаратов даже после раннего послеоперационного периода. И здесь есть такое понятие как клиническая эффективность радиочастотной абляции. То есть мы уменьшаем количество приступов фибрилляции предсердий на 75%, больной себя чувствует лучше, чем до радиочастотной абляции. Но радиочастотная абляция полностью не убирает эти приступы. Но совместно с приемом антиаритмических препаратов пациента это устраивает, и приступы достаточно редки – два-три раза в год, и это нас устраивает.
На сегодняшний день наиболее эффективным антиаритмическим препаратом в послеоперационном периоде через три месяца и после радиочастотной абляции является препарат 1С класса – пропафенон. Но это больше у больных с рецидивами фибрилляции предсердий. Если же у больных появляются новые регулярные предсердные тахикардии, то здесь пропафенон нередко сочетается с верапамилом, либо отдельно верапамил – у таких пациентов показал хороший результат.
В конце презентации я хочу показать несколько слайдов о проблемах тромбоэмболических осложнений у таких пациентов. Нельзя сказать, что радиочастотная абляция абсолютно безопасная процедура, и в 0,6% возникают тромбоэмболические или кардиогенные инсульты, а в 1% случаев это транзиторные ишемические атаки. Но на сегодняшний день самый обсуждаемый вопрос – появление «немых» ишемических инсультов. И некоторые авторы пишут, что до 35% у таких пациентов определяются «немые» ишемические инсульты. С чем может быть связано появление такого большого количества? Не только с тромбоэмболическими проблемами, но надо понимать, что специфика процедуры радиочастотной абляции и появление воздушных эмболов тоже может вносить серьезный вклад в определение «немых» ишемических инсультов.
В чем проблема тромбообразования, появления тромбоэмболических осложнений? 1) Это большая зона повреждения эндотелия предсердий. 2) Установка транссептального интродьюсера и катетеров-электродов. 3) Оглушение предсердий – это очень важный момент. Это примерно как при кардиоверсии происходит оглушение предсердий, и создаются все условия для образования тромбов. И этот риск тромбоэмболических осложнений напрямую зависит от количества баллов по шкале CHA2DS2-VASc.
И вот пример позаимствован из одного американского журнала, статья вышла пару месяцев тому назад, где четко представлены данные чреспищеводного эхо, и мы видим мягкие тромбы на транссептальной перегородке. И на втором рисунке представлены обугленные элементы на конце электрода после удаления из транссептальной перегородки, которые могут являться причиной как небольших, так и серьезных мозговых нарушений. Но это с одной стороны, с другой стороны надо понимать, что есть проблема тромбоэмболоических осложнений, но есть проблема и кровотечений. И такая проблема, как тампонада перикарда происходит от 0,8% до 6% в зависимости от разных источников. Сосудистые осложнения возникают от 0% до 13%. Поэтому мы должны все-таки с одной стороны подготовить больного антикоагулянтами, но с другой стороны понимать, что есть риск кровотечений.
На сегодняшний день существует следующая тактика. Подготовка больных к радиочастотной абляции должна быть такая же, как при проведении электрической кардиоверсии. Для пациентов с фибрилляцией больше 48 часов, если мы берем радиочастотную абляцию, безусловно, обязательно нужно делать чреспищеводное эхо, потому что тромбоз ушка левого предсердия является противопоказанием для проведения данной процедуры. Через 4-6 часов после радиочастотной абляции мы должны назначить либо варфарин, либо новые оральные антикоагулянты. И, безусловно, на сегодняшний день очень обсуждается применение новых оральных антикоагулянтов при проведении радиочастотной абляции. Но пока четких данных нет, какой все-таки выигрывает из новых оральных антикоагулянтов. Отмена антикоагулянтной терапии должна проводиться на втором-третьем месяце (по европейским данным на втором месяце, на третьем месяце – по российским рекомендациям). Но если у больного есть хоть один балл по шкале CHA2DS2-VASc. мы должны продолжать назначать этому пациенту антикоагулянтную терапию, потому что мы не можем четко сказать, что у этого пациента не будет поздних рецидивов фибрилляции предсердий. На этом я хочу закончить свой доклад. Спасибо за внимание.
Тонзиллэктомия: современные возможности послеоперационного обезболивания

Несмотря на некоторое снижение количества плановых тонзиллэктомий в последние годы, удаление миндалин остается одним из распространенных хирургических вмешательств. Среди факторов, значительно снижающих качество жизни пациентов после перенесенной операции, одно из ведущих мест занимает болевой синдром. Именно боль после тонзиллэктомии часто является главной причиной, определяющей необходимость контакта пациента с врачом в послеоперационном периоде [1].
Несмотря на большое количество исследований и клинических наблюдений по этой проблеме, до настоящего времени нет четко сформулированных взглядов на природу болевого синдрома, зависимости его возникновения и длительности от способа хирургического вмешательства на небных миндалинах, отсутствуют современные протоколы по лечению боли после тонзиллэктомии. Далеко не во всех специализированных оториноларингологических учреждениях уделяется должное внимание адекватной терапии послеоперационной боли, недостаточно учитывается этот компонент послеоперационного ведения пациентов и после выписки из стационара, на этапах амбулаторного наблюдения.
Эти обстоятельства определяют значение вопросов, связанных с послеоперационным ведением таких пациентов, и в частности с послеоперационным обезболиванием.
Согласно современным представлениям, боль рассматривается как сложное психоэмоциональное неприятное ощущение, в реализации которого важную роль играет ноцицептивная система, обеспечивающая восприятие, передачу и анализ болевого сигнала. В физиологических условиях боль играет защитную роль, способствуя формированию реакции, направленной на устранения ноцицептивного воздействия, или собственно болевого ощущения. Отсутствие болевой чувствительности (врожденное или приобретенное) препятствует адекватному реагированию на действие повреждающего фактора, что сопровождается усугублением патологических изменений в организме. В отличие от т. н. физиологической боли боль патологическая обуславливает формирование нозологически очерченных состояний со стороны различных органов и систем, представляя собой эндогенный патогенетический фактор и/или превращаясь в самостоятельный нейропатологический синдром (болезнь) [2].
Один из механизмов формирования боли, обусловленной воспалением (в т. ч. послеоперационным), связан с раздражением (сенситизацией) ноцицептивных нервных окончаний провоспалительными медиаторами. При этом происходит активация процессов вазодилатации и транссудации белков плазмы, каскадная экспрессия высокоактивных веществ -- серотонина, гистамина, брадикинина, субстанции Р, а также продуктов циклооксигеназного и липоксигеназного путей метаболизма арахидоновой кислоты -- эйкозаноидов. Последние включают в себя простагландины, тромбоксаны, лейкотриены и другие биологически активные вещества, принимающие активное участие в развитии воспалительного процесса, возникающего вследствие повреждения тканей или инфекции.
Простагландины играют важную роль в возникновении периферической сенситизации, понижая клеточные пороги передачи (первичная гипералгезия или периферическая гиперчувствительность), воздействуют на болевые рецепторы (Fanelli). Именно эйкозаноиды участвуют в возникновении таких признаков воспаления, как боль, отек, повышение температуры.
Определенные достижения в исследовании молекулярных механизмов болевых ощущений связаны с открытием рецепторов TRP (Transient Rezeptor Potential), в частности рецептора капсаицина TRPV1 [3]. Важную роль в активации ноцицептивных нервных волокон играют нейромодуляторы – пептид CGRP и субстанция Р, другие нейропептиды, действие которых сопровождается вазодилатацией и усилением проницаемости сосудистой стенки, активированием иммунокомпетентных клеток, экспрессией медиаторов воспаления. На фоне этих процессов, а также снижения рН в очаге воспаления происходит увеличение тепловой чувствительности TRPV1, когда даже нормальная температура тела является причиной раздражения рецептора и возникновения ощущения жжения. Считается, что именно этот механизм лежит в основе возникновения длительного раздражения ноцицепторов и болевых ощущений при воспалительных процессах в глотке [3—6].
Таким образом, особенности послеоперационной боли связаны с формированием первичного ноцицептивного импульса, возникновение которого обусловлено повреждающим воздействием и активацией нервных окончаний в очаге воспаления. С точки зрения причинно-следственных зависимостей, участвующих в формировании послеоперационной боли, хирургическое вмешательство следует рассматривать как травматическую процедуру, сопровождающуюся повреждением тканей и выраженной ноцицептивной импульсацией. Кроме этого, любое, даже минимально инвазивное вмешательство приводит к более или менее выраженной воспалительной реакции, что, как уже отмечалось выше, связано с экспрессией провоспалительных медиаторов, раздражением ноцицептивных нервных окончаний (рис. 1).
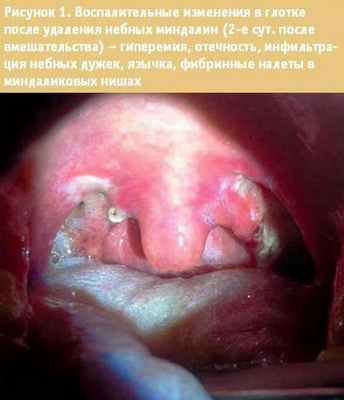
На этом фоне происходит снижение порога чувствительности ноцицепторов и увеличение возбудимости спинальных нейронов, участвующих в проведении болевых стимулов.
По данным опросов, послеоперационные болевые ощущения средней интенсивности отмечаются в 29,7% (26,4--33%) случаев, высокой интенсивности -- в 10,9% (8,4--13,4%) [7].
Частота обращений к врачу в послеоперационном периоде после тонзиллэктомии составляет 23%, из них почти половина (12%) таких контактов обусловлена болевым синдромом [1]. Оценка интенсивности боли после тонзиллэктомии выше у пациентов старше 15 лет, чем у детей [8]. Несмотря на то что большинство пациентов (родителей) удовлетворены результатами тонзиллэктомии, авторы полагают, что существующие подходы к лечению послеоперационной боли нуждаются в пересмотре.
Таким образом, несмотря на успехи, достигнутые в изучении патофизиологических и биохимических механизмов боли, совершенствование анестезии и хирургических технологий, послеоперационный болевой синдром продолжает оставаться актуальной проблемой современной хирургии. В полной мере это относится и к тонзиллэктомии, которая выполняется не только в плановом порядке, при хроническом тонзиллите, фарингеальной (назофарингеальной) обструкции, но часто -- при распространенности патологического процесса за пределы миндалины на окружающие ткани -- паратонзиллярном абсцессе, хроническом паратонзиллите. В этих случаях болевой синдром обусловлен не только операционной травмой, но и выраженными воспалительными изменениями в глотке и паратонзиллярном пространстве.
Целесообразность применения в послеоперационном периоде глюкокортикостероидов обусловлена их универсальным противовоспалительным действием -- активным торможением миграции клеток в очаг воспаления и экспрессии провоспалительных медиаторов, уменьшением проницаемости капилляров. Материалы контролируемых исследований свидетельствуют о клинической эффективности однократного интраоперационного введения дексаметазона с целью контроля болевых ощущениях после тонзиллэктомии у пациентов моложе 18 лет. После введения разовой дозы дексаметазона наблюдались менее выраженные послеоперационные болевые ощущения, такие дети раньше переходили на «твердую» диету по сравнению с группой плацебо [15]. Отмечаются более низкие значения оценки болевых ощущений после тонзиллэктомии в группе, получавших дексаметазон, уже через 30 мин после экстубации, значительно менее болезненное глотание через 12 и 24 ч по сравнению с контрольной группой [16]. При добавлении дексаметазона к местному анестетику (ропивакаин) при инфильтрационной анестезии во время тонзиллэктомии наблюдается более эффективное снижение боли, уменьшение общего потребления анальгетиков, улучшение глотания в послеоперационном периоде по сравнению с анестезией ропивакаином без добавления дексаметазона [17].
Современные протоколы послеоперационного обезболивания свидетельствуют о растущих масштабах применения неопиоидных анальгетиков -- нестероидных противовоспалительных препаратов и ацетаминофена.
В сравнительном клиническом исследовании (340 детей с рецидивирующим тонзиллитом и/или обструктивными симптомами) показано, что применение с целью купирования болевого синдрома после тонзиллэктомии парацетамола (115 пациентов), а также метамизола натрия (115) и ибупрофена (110) также не сопровождалось увеличением риска послеоперационного кровотечения [10]. По мнению экспертов, ибупрофен обладает некоторыми преимуществами в отношении переносимости перед другими нестероидными противовоспалительными препаратами [11]. В рандомизированном контролируемом исследовании ибупрофен и парацетамол с кодеином одинаково эффективно купировали боль после тонзиллэктомии, однако переносимость ибупрофена была лучше (отсутствовали опиоидные побочные эффекты -- запоры, рвота) [12]. Однако результаты другого проспективного рандомизированного двойного слепого исследования не подтвердили большую эффективность ибупрофена как анальгетика по сравнению с ацетаминофеном с кодеином у детей 6--16 лет, перенесших тонзиллэктомию (аденотониллэктомию). Во всяком случае, в первые три дня после операции ацетаминофен с кодеином оказался, по этим данным, более эффективным обезболивающим средством. Кроме этого, в группе пациентов, получавших ацетаминофен с кодеином, послеоперационные кровотечения отсутствовали, а в группе ибупрофена частота кровотечений составила 12,5%. По мнению авторов этого исследования, ацетаминофен с кодеином является более безопасным и более эффективным в лечении послеоперационной боли у пациентов, перенесших тонзиллэктомию/аденотонзиллэктомию, чем ибупрофен [13].
Определенный интерес в этом плане представляет препарат лизиновой соли кетопрофена (препарат ОКИ), обладающий противовоспалительным, обезболивающим и жаропонижающим свойством, с быстрым (уже через 15--20 мин после приема) началом и продолжительностью (до 8 ч) действия, хорошей переносимостью. В исследовании с участием 60 пациентов было показано, что лизиновая соль кетопрофена высокоэффективна для купирования воспалительных процессов в ротоглотке, в т. ч. и после двусторонней тонзилэктомии [9].
Вместе с тем, на фоне применения НПВС системного действия, неселективных в отношении ЦОГ-1, в частности ацетаминофена в суточных дозах 2 000 мг и выше, сохраняется риск возникновения серьезных осложнений, связанных с ульцерогенным действием на слизистую оболочку желудочно-кишечного тракта [14].
С целью снижения вероятности серьезных осложнений подчеркивается важность сбалансированного сочетания нестероидных противовоспалительных средств с местными анестетиками или назначения таких препаратов в виде монотерапии в минимально эффективных дозах.
Определенные перспективы в лечении болевого синдрома после тонзиллэктомии связаны с применением местных обезболивающих препаратов, обладающих высоким профилем безопасности и хорошими анестезирующими свойствами. Наиболее убедительные данные в этом плане получены в отношении опиоидов, кортикостероидов и бензидамина [18].
Как известно, фармакологические эффекты нестероидного противовоспалительного средства для местного применения бензидамина гидрохлорида (Тантум Верде) обусловлены ингибированием синтеза провоспалительных медиаторов -- в большей степени цитокинов и в меньшей -- простагландинов, а также его мембраностабилизирующим действием, влиянием на чувствительные нервные окончания и проведение болевых импульсов.
Применение препарата бензидамина в ранний период после хирургических вмешательств в ротоглотке (тонзиллэктомия, лазерные воздействия) показало, что у 12 (60,0%) больных отмечалось полное исчезновение жалоб, у 5 (25%) отмечалось заметное улучшение субъективных ощущений и лишь у 3 (15%) пациентов лечение оказалось малоэффективным [26].
При использовании Тантум Верде в виде дозированного спрея (по 2--3 инсуффляции на область тонзиллярных ниш 4 раза в день) после удаления небных миндалин, вмешательства по поводу паратонзиллярного абсцесса у детей отчетливое местное анальгезирующее действие наблюдалось уже через 15--20 с после инсуффляции препарата. При регулярном использовании бензидамина гидрохлорида у абсолютного большинства оперированных пациентов боль в горле исчезала в среднем на 1--3 сут/ раньше, чем в контрольной группе [19].
Необходимо подчеркнуть, что бензидамин обладает не только анальгезирующим, местноанестезирующим, но и противовоспалительным, а также антисептическим действием.
Противовоспалительное действие бензидамина связано с замедлением высвобождения ферментов из лизосом нейтрофильных гранулоцитов, миграции лейкоцитов и их агрегации, блокированием вазоактивных аминов и процессов агрегации тромбоцитов, а также стабилизацией клеточных мембран, ингибированием производства кислородных радикалов макрофагами. Терапевтический эффект бензидамина обеспечивается его стабилизирующим действием на клеточные мембраны без снижения функциональной активности и восстановительной способности тканей, способностью стимулировать процессы репарации и регенерации [27].
Бензидамин безопасен в применении и в таблетированной форме разрешен к применению в детском возрасте. Лишь у небольшого количества пациентов на фоне применения бензидамина-спрея возникает ощущение жжения или покалывания, однако это не является причиной отказа от использования препарата [20].
После тонзиллэктомии положительное действие оказывает декспантенол. Являясь производным пантотеновой кислоты, декспантенол значительно ускорял процесс заживления ран в миндаликовых нишах и уменьшал интенсивность жалоб, обусловленных послеоперационной болью в горле [21].
Вместе с тем, несмотря на эффективное снижение боли в горле после удаления небных миндалин и минимальную частоту нежелательных реакций при использовании топических препаратов, отмечается необходимость дальнейших исследований в этом направлении с целью объективизации и повышения надежности полученных результатов [20].
Наверное, в этой связи, будет уместным упомянуть и о таких попытках минимизировать неприятные субъективные ощущения после тонзиллэктомии, как использование жевательной резинки. Как показали наблюдения, жевание резинки со следующего дня после операции способствовало уменьшению боли в горле, исчезновению неприятного запаха изо рта, формированию более нежных фибринных налетов в нишах. При этом увеличения частоты кровотечений и других осложнений не отмечалось [22]. Однако в другом клиническом исследовании (проспективном рандомизированном контролируемом) были получены прямо противоположные результаты -- жевание резинки увеличивало интенсивность болевых ощущений, способствовало задержке с переходом пациентов на обычную диету [23].
Таким образом, послеоперационное обезболивание представляет собой актуальную проблему современной клинической медицины, в частности оториноларингологии. По-видимому, в настоящее время не приходится говорить о существовании какого-либо универсального метода уменьшения болевых ощущений после хирургических вмешательств. Использование с этой целью тех или иных препаратов зачастую продиктовано опытом врача, сложившимися традициями, возможностями конкретного лечебного учреждения и другими факторами.
Анализ опубликованных материалов свидетельствует о значении нестероидных противовоспалительных препаратов в минимизации болевых ощущений после удаления небных миндалин. Особый интерес в отношении купирования боли и перспективности применения связывают с местными обезболивающими препаратами, разработанными специально для применения в лор-практике. Наиболее убедительные данные в этом плане получены в отношении опиоидов, кортикостероидов и бензидамина (Тантум Верде).
Эффективным и безопасным способом снижения интенсивности боли, связанной с удалением миндалин, является однократное внутривенное введение дексаметазона.
Обнадеживающие результаты получены при использовании после тонзиллэктомии антибактериальных препаратов для местного применения как в виде монотерапии, так и в комплексе с системными препаратами.
Лапароскопия матки и придатков
В «Герцлия Медикал Центр» осуществляются все виды современных лапароскопических операций. Лапароскопия в гинекологии нашла широкое применение, заменив подавляющее большинство открытых хирургических процедур. Гинекологи клиники прошли специализацию в области лапароскопии матки и придатков в ведущих хирургических центрах мира и обладают огромным опытом. В клинике применяется новейшее медицинское оборудование, позволяющее проводить лапароскопические процедуры любой степени сложности.
Каковы преимущества лапароскопии в гинекологии?
Лапароскопическая хирургия (в частности лапароскопия в гинекологии) имеет ряд неоспоримых преимуществ перед традиционными (полостными) операциями:
- Возможность проведения полномасштабного хирургического вмешательства. Современные лапароскопические приборы обеспечивают проведение практически любой диагностической или лечебной процедуры, в том числе частичное или полное удаление органа, биопсию тканей, остановку кровотечения, исправление анатомических и функциональных дефектов, удаление спаек и др.;
- Безопасность. Высококачественная оптическая техника многократно увеличивает изображение операционного поля, позволяя хирургам проводить сложнейшие манипуляции без риска повреждения жизненно важных структур;
- Предотвращение осложнений во время операции и в послеоперационный период. Малотравматический характер лапароскопических процедур приводит к минимальному повреждению здоровых тканей и снижению вероятности инфекционных, а также реактивно-воспалительных осложнений. Кроме того, после лапароскопических вмешательств крайне мала вероятность развития послеоперационной грыжи;
- Уменьшение болевого синдрома в послеоперационный период. Отсутствие большой раны, а также сохранение мышечных структур предотвращает существенные боли после операции. Дискомфорт и незначительные болевые ощущения поддаются эффективному медикаментозному лечению и не препятствуют ранней мобилизации;
- Облегчение послеоперационного ухода также связано с отсутствием большого хирургического разреза. Одиночные кожные швы в местах введения оптики и хирургических манипуляторов не требуют специализированного ухода и не препятствуют выписке из стационара;
- Снижение общей стоимости лечения. Несмотря на то, что лапароскопическая процедура может стоить дороже открытой операции, общая цена на лечение существенно ниже благодаря минимальному периоду госпитализации и послеоперационной реабилитации.
Лапароскопия матки и придатков
Среди основных видов лапароскопических операций, осуществляемых гинекологами клиники, необходимо отметить следующие:
- Лапароскопия матки. Специалистами проводятся все виды лапароскопии матки при доброкачественных и злокачественных процессах матки (в том числе лапароскопия миомы матки, радикальная гистерэктомия);
- Лапароскопия яичников. Лапароскопия яичников широко применяется для удаления опухолей и кист, а также в диагностике и лечении синдрома поликистозных яичников;
- Лапароскопия маточных труб. Лапароскопия труб проводится при внематочной беременности, анатомической и физиологической непроходимости труб, воспалительных процессах;
- Лапароскопия шейки матки. В ходе процедур, выполняемых через влагалище, лапароскопия шейки матки позволяет провести ревизию полости малого таза на предмет подозрительных лимфатических узлов при раке шейки матки;
- Лапароскопия брюшной полости и полости таза с целью диагностики воспалительных и опухолевых заболеваний, спаек, биопсии, удаления лимфатических узлов, вскрытия абсцессов и участков изолированного экссудата.
Подготовка к лапароскопии матки и придатков
Перед лапароскопией матки и придатков необходимо пройти ряд исследований, включающих в себя общий и биохимический анализ крови, исследование свертываемости крови. На консультации анестезиолога определяется вид наркоза (общая или спинномозговая анестезия), а также необходимость индивидуальной предоперационной подготовки. Пациентки, принимающие антикоагулянты, а также страдающие сахарным диабетом и другими хроническими заболеваниями, получают подробные предварительные рекомендации специалистов, направленные на предотвращение осложнений. Необходимо избегать приема пищи и жидкости в течение 8 часов перед процедурой. Прием постоянных лекарственных препаратов в день операции заранее обговаривается с анестезиологом и лечащим врачом.
Как проводится лапароскопия матки и придатков
Такие операции как лапароскопия матки и яичников могут проводиться под общим наркозом или спинномозговой анестезией. Вне зависимости от выбора метода обезболивания во время лапароскопии матки и яичников отсутствуют какие-либо болезненные ощущения. Перед процедурой проводится премедикация, снижающая состояние тревоги и облегчающая анестезию. Во время операции в брюшную полость пациентки и в полость малого таза через небольшие отверстия вводится несколько приборов – оптическая камера, хирургические манипуляторы, трубка для нагнетания воздуха в брюшную полость (позволяет получить оптимальный доступ к органам) и дренирующая трубка для удаления жидкости. После проведения необходимых процедур удаляются все приборы. При соответствующих показаниях врач-хирург отделения гинекологии может оставить в одном из отверстий дренаж, а также катетер в мочевом пузыре.
Особенности послеоперационного периода
По окончанию хирургической процедуры пациентки некоторое время находятся в послеоперационной палате интенсивной терапии. Специалисты клиники тщательно наблюдают за жизненными показателями и признаками кровотечения. Дальнейшее лечение проводится в гинекологическом отделении медицинского центра. Отсутствие большого хирургического разреза сводит к минимуму уход за операционной раной, позволяя спуститься с кровати через несколько часов после лапароскопия матки и яичников. На следующий день врачи определяют характер и количество выделений из дренажа. Дренаж и мочевой катетер извлекаются через 24-72 часа после операции. При соответствующих показаниях могут быть назначены антибактериальные препараты, а также средства, препятствующие образованию тромбов в нижних конечностях. При необходимости применяются современные анальгетики полностью купирующие болевой синдром. После короткого периода госпитализации пациентки выписываются для дальнейшего амбулаторного наблюдения. Послеоперационные швы снимаются через 7 – 10 дней при посещении гинекологической амбулатории клиники «Герцлия Медикал Центр».
Читайте также:
