Атрезия двенадцатиперстной кишки. Атрезия пищевода или трахеопищеводный свищ
Добавил пользователь Владимир З. Обновлено: 29.01.2026
Атрезия двенадцатиперстной кишки. Атрезия пищевода или трахеопищеводный свищ
Атрезия двенадцатиперстной кишки встречается с частотой 1 случай на 10 000 родов. Эта патология обусловлена нарушением процесса реканализации отдела первичной кишки дистальнее фатерова (Vater) соска. Вследствие обструкции проксимальный участок двенадцатиперстной кишки расширяется, что создает в сочетании с увеличенным желудком характерный эхографический признак «двойного пузыря» (double bubble).
Другим следствием обструкции является то обстоятельство, что отсутствует пассаж кишечного содержимого через петли проксимального отдела тощей кишки и, таким образом, просвет ее значительно уменьшается. Такое состояние получило название «неиспользуемая» тощая кишка.
У 40% плодов с изолированной атрезией двенадцатиперстной кишки встречаются хромосомные нарушения, однако если имеются и другие аномалии, то этот показатель возрастает до 66%. Атрезия двенадцатиперстной кишки в большинстве случаев является маркером трисомии 21.
Атрезия пищевода или трахеопищеводный свищ. Атрезия пищевода встречается с частотой 2 случая на 10 000 родов. Ультразвуковая диагностика этого состояния достаточно проста: размеры желудка бывают меньше нормальных для соответствующего срока беременности, а в третьем триместре начинает отмечаться увеличение количества околоплодных вод. Размеры такого уменьшенного желудка не намного превышают размеры желчного пузыря.
Существует много состояний, при которых будут выявляться аналогичные признаки. Анатомические варианты атрезии пищевода или трахеопищеводных свищей подразделяют на пять типов. Уменьшенный желудок будет обнаруживаться только в случае наличия типа В или С, а более чем 95% плодов будут также иметься связанные с этим пороком трахеопищеводные свищи. Таким образом, отсутствие эхотени желудка при ультразвуковом исследовании наблюдается достаточно редко, а такой признак, как многоводие, - развивается только в третьем триместре.
В последних исследованиях было проведено изучение взаимосвязи между выявлением трахеопищеводного свища и хромосомными аномалиями. При наличии в сочетании с ним атрезии пищевода в 7% были диагностированы анеуплоидии. Если порок был изолированным, то хромосомные аномалии встречались с частотой от 3 до 10%. Однако в случаях изолированной атрезии пищевода (то есть без сочетания с трахеопищеводным свищом) хромосомные аберрации имели 20-25% плодов, причем чаще всего трисомию 18.
Омфалоцеле. Омфалоцеле встречается в 1 случае на 10 000 родов, при этом от 20 до 60% таких плодов имеют хромосомные аномалии. Риск анеуплоидии увеличивается, если оно сочетается с многоводием или маловодием. По данным D. A. Nyberg et al., риск составляет 16% в том случае, если грыжевой мешок содержит печень и петли кишечника и увеличивается до 66%, если в нем имеется только кишечник.
У 13% плодов с изолированным омфалоцеле имеются хромосомные аномалии, однако при сочетанных пороках их риск возрастает до 46%. При этом наиболее вероятными будут являться трисомии 18 и 13.
Диафрагмальная грыжа встречается в 3-4 случаях на 10 000 родов. Эту патологию довольно легко диагностировать при ультразвуковом исследовании, поскольку расположение желудка рядом с сердцем является характерным признаком этого порока развития. Хотя при изолированной диафраг-мальной грыже редко наблюдаются хромосомные аномалии, наличие ее в сочетании с другими пороками сопровождается анеуплоидией в 30%, при этом наиболее вероятной будет трисомия 18.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Атрезия двенадцатиперстной кишки. Атрезия пищевода или трахеопищеводный свищ
Атрезия пищевода относится к тяжелым порокам развития. Эта патология часто сочетается с другими пороками: врожденными пороками сердца, желудочно-кишечного тракта, мочеполовой системы и другими. В данной статье приводится результат опыта лечения 123 новорожденных с атрезией пищевода. Атрезия пищевода с нижним трахеопищеводным свищом диагностирована у 109 детей (88,6 %), атрезия с нижним и верхним свищами-3 (2,4 %), бессвищевая форма атрезии выявлена у 11 (9 %). В 42 наблюдениях атрезия пищевода сочеталась с другими пороками. Хирургическое вмешательство выполнено у 115 новорожденных (93,5 %). Всем детям проводилась сопутствующая поддерживающая терапия. 8 детей умерло от тяжелой сопутствующей патологии без оперативного лечения. Из числа оперированных новорожденных умерло 12 детей (9,8 %).
2. Атлас детской оперативной детской хирургии под редакцией П. Пури, М. Говарта. Пер. проф. Т.К. Немиловой. – Москва: МЕДпресс-информ, 2009. – С.43-62.
3. Детская хирургия. Учебник под редакцией Ю.Ф. Исакова, А.Ю. Разумовского. –Москва: ГЭОТАР-Медиа, 2014. – С.216-221.
4. Пренатальная эхография / под редакцией М.В. Медведева. Реальное время. – Москва, 2005. – С.439-442.
5. Разумовский А.Ю., Мокрушина О.Г., Ханвердиев Р.А. Торакоскопическая коррекция атрезии пищевода и трахеопищеводного свища из внеплеврального доступа // Детская хирургия. – 2011. – № 2. – С. 4-6.
6. Разумовский А.Ю., Мокрушина О.Г., Ханвердиев Р.А. и др. Эволюция метода торакоскопической коррекции атрезии пищевода у новорожденных // Российский вестник детской хирургии, анестезиологии и реаниматологии. – 2012. – № 1. – С. 92-98.
7. Фокер Дж., Козлов Ю.А. Процедура Foker – стратегия индукции роста пищевода путем его вытяжения. // Российский вестник детской хирургии, анестезиологии и реаниматологии. – 2016. – № 1. – С. 51-57.
Атрезия пищевода относится к тяжелым порокам развития. Эта патология часто сочетается с другими пороками: врожденными пороками сердца, желудочно-кишечного тракта, мочеполовой системы и другими. Атрезия пищевода входит в ассоциации VATER, VACTER и VACTERL. Ассоциации образованы из первых букв соответствующих английских терминов (Vertebraldefects, Analatresia, Tracheoesophagealfistula, Esophagealatresia, Rendysplasy, Radialdysplasy, Cardiacmalformations, Limbanomalies – врожденные пороки развития позвонков, атрезия ануса, трахеопищеводный свищ, или атрезия пищевода, пороки развития почек или дефекты лучевой кости, пороки сердца, аномалии конечностей). Если у новорожденного диагностирована одна из перечисленных аномалий, входящая в названные ассоциации, следует искать и другие пороки [3].
Несмотря на то, что благодаря совершенствованию оперативной техники и внедрению новых технологий достигнуты определенные успехи в лечении атрезии пищевода [5, 6], хирургическое лечение новорожденных с данным пороком по-прежнему остается сложной задачей [2,4]. Летальность при атрезии пищевода даже при оптимальной организации перинатальной помощи остается около 10 %, а при сочетании с другими аномалиями, особенно при пороках сердца, летальность может быть значительно выше [1].
Цель исследования – проведение анализа результатов лечения новорожденных с атрезией пищевода.
Материалы и методы исследования
В исследование были включены новорожденные с атрезией пищевода и сопутствующей патологией (123 ребенка), находившиеся на лечении в ГБУЗ СО ДГКБ № 1 им. Н.Н. Ивановой за период с 1996 по 2015 год.
В программу исследования входило: анализ пренатальной диагностики порока, первичный осмотр детей в родильном доме, клиническое исследование в специализированном лечебно-профилактическом учреждении, диагностика атрезии пищевода и сопутствующей патологии, определение длительности и качества предоперационной подготовки, определение объема оперативного вмешательства при коррекции порока, оценка результатов лечения, в том числе и отдаленных. В работе использовались клинические, рентгенологические, эндоскопические, ультразвуковые и лабораторные методы исследования.
Результаты исследования и их обсуждения
Все новорожденные с атрезией пищевода (123) поступали в отделение реанимации новорожденных ДГКБ № 1 им. Н.Н. Ивановой г. Самары из родильных домов и родильных отделений города и области в сроки от нескольких часов после рождения до 3-х суток. Следует отметить, что в Самарской области хирургическая помощь новорожденным с врожденной и приобретенной патологией оказывается только в этом лечебно-профилактическом учреждении.
По данным М.В. Медведева (2005), пренатальная диагностика атрезии пищевода основывается на таких косвенных признаках, как многоводие, связанное со снижением оборота околоплодных вод вследствие непроходимости пищевода, отсутствие эхографического изображения желудка или микрогастрия. При этом чувствительность эхографии в диагностике этого порока не превышает 40–50 %. В наших наблюдениях вышеназванные признаки атрезии пищевода выявлены пренатально лишь в 40 % при скрининговом обследовании беременных, родивших детей с атрезией пищевода. При выявлении пренатально косвенных признаков атрезии пищевода у плодов родоразрешение беременных, проживающих в г. Самаре и Самарской области, проводилось только в родильных домах г. Самары, что способствовало сокращению времени транспортировки новорожденных с атрезией пищевода в специализированное ЛПУ (ДГКБ № 1 им. Н.Н. Ивановой г. Самары).
При выявлении в родильном доме в первые часы после рождения ребенка признаков атрезии пищевода (появление обильных пенистых выделений изо рта и носовых ходов) проводилась аспирация содержимого рото- и носоглотки, которая повторялась каждые 15–20 минут, полностью исключалось кормление через рот, начиналась оксигенотерапия. Транспортировка новорожденного с атрезией пищевода в ДГКБ № 1 им. Н.Н. Ивановой г. Самары осуществлялась реаниматологом-неонатологом специализированным автотранспортом. Дети транспортировались в кювезе, во время транспортировки проводилась аспирация слизи из рото- и носоглотки.
Новорожденных доставляли в отделение реанимации новорожденных, где наряду с диагностическими методами, направленными на подтверждение диагноза атрезии пищевода и выявление сопутствующих пороков, начиналась предоперационная подготовка.
Для уточнения диагноза атрезии пищевода проводилась катетеризация пищевода рентгенконтрастным катетером с закругленным концом (уретральным катетером). Катетер вводили через нос на глубину до 8 см. Катетер или упирался в слепой конец пищевода или выходил через рот новорожденного. Через катетер отсасывали слизь, а затем проводили пробу Элефанта (при введении воздуха в слепой конец пищевода из носоглотки с шумом выделяется воздух). В некоторых наблюдениях выполнялась эзофагография с водорастворимым контрастом, который вводился в слепой конец пищевода в количестве не более 1 мл.
Атрезия с нижним трахеопищеводным свищом диагностирована в 112 (91 %) наблюдениях, бессвищевая форма – в 11 (9 %).
Из сопутствующих аномалий развития у 18 (14,6 %) новорожденных диагностирована атрезия двенадцатиперстной кишки, у 12 (9,8 %) – врожденные пороки сердца, у 12 (9,8 %) – атрезия прямой кишки, у 13 (10,6 %) – патология мочевыводящей системы. В 9 (7,3 %) наблюдениях диагностирован синдром Дауна.
Предоперационная подготовка проводилась длительностью от одних до четырех суток в зависимости от состояния ребенка, сроков поступления, наличия сопутствующей патологии. Ребенок обязательно помещался в кювез. В предоперационном периоде выполнялась аспирация слизи изо рта и носа ребенка, оксигенотерапия. При имеющемся нарушении дыхания, пневмонии, ателектазах, вызванных аспирацией слизи, проводилась ларингоскопия для санации дыхательных путей. Если предпринятые меры оказывались неэффективными, обязательным являлось выполнение бронхоскопии с тщательной аспирацией содержимого трахеи и бронхов. При состояниях, требующих респираторной поддержки, проводилась интубация трахеи и искусственная вентиляция легких. При этом эндотрахеальную трубку проводили ниже трахеопищеводного свища, что позволяло избежать такого тяжелого осложнения, как разрыв желудка за счет инсуффляции воздуха в желудок.
Всем детям назначалась инфузионная, антибактериальная и симптоматическая терапия.
Из 123 новорожденных с атрезией пищевода оперативное вмешательство выполнено у 115 пациентов. 8 неоперированных детей умерли в связи с наличием у них тяжелой сопутствующей патологии.
Метод хирургической коррекции атрезии пищевода зависел от формы порока. У пациентов с наиболее частой формой атрезии, при которой имелся дистальный трахеопищеводный свищ, с диастазом между отрезками пищевода не более 2,5 см, ликвидировался свищ и накладывался прямой анастомоз.
При большом диастазе прямой анастомоз наложить сложно. Для осуществления этой цели используются такие хирургические подходы, как циркулярная или спиральная миотомия, расширение отверстия в диафрагме и перемещение части желудка в грудную клетку. Кроме того, в настоящее время появились работы, в которых описывается опыт применения процедуры Фокера, индуцирующей рост пищевода путем вытяжения отрезков пищевода [7]. Но все же чаще всего при большом диастазе между отрезками пищевода накладывается шейная эзофагостома и гастростома. При бессвищевой форме порока, сопровождающейся большим диастазом, также первым этапом выполняется наложение шейной эзофагостомы и гастростомы [3, 5].
В наших наблюдениях прямой анастомоз наложен у 112 пациентов с атрезией пищевода при наличии нижнего трахеопищеводного свища. При этом у двух новорожденных при диастазе между отрезками пищевода от 2,5 до 3,5 см использовано удлинение проксимального отрезка пищевода в виде циркулярной миотомии по Livaditis [2].
Перед операцией проводилась периоперационная антибиотикопрофилактика. Оперативное вмешательство выполнялось под интубационным наркозом с вентиляцией мануально низким давлением на вдохе и небольшими объемами. Это позволяло избежать гипервентиляции, раздувания желудка, а также способствовало стабилизации трахеи. Для облегчения поиска хирургом верхнего отрезка пищевода в последний обязательно вводился зонд. Доступ – правосторонняя экстраплевральная торакотомия. Полунепарная вена по возможности не пересекалась. Выделение отрезков пищевода проводилось тщательно, чтобы избегать даже малейшей травмы его стенки и сохранить все волокна блуждающего нерва, сопровождающие нижний сегмент пищевода. После отведения трахеи обнаруживался трахеопищеводный свищ. После наложения швов-держалок на трахеальный и эзофагеальный концы свища свищ отсекался от трахеи, и дефект трахеи ушивался отдельными швами в один ряд мононитью 6/0. На верхний сегмент пищевода накладывалось два тракционных шва, служащих для облегчения его мобилизации. Далее трахея отделялась от пищевода. После мобилизации верхнего отрезка пищевода сегменты органа сближались и накладывался анастомоз конец-в-конец. Наложению анастомоза предшествовало рассечение верхушки верхнего отрезка точно над концом продвинутого в сегмент зонда. Анастомоз формировался отдельными рассасывающимися швами мононитью 6/0. Во всех наблюдениях проводился назогастральный зонд и выполнялось дренирование средостения.
У двух детей с большим диастазом сегментов, как уже было сказано, применена циркулярная миотомия по Livaditis, которая позволила удлинить проксимальный отрезок пищевода и наложить анастомоз конец-в-конец.
После операции продолжалась интенсивная терапия. При благоприятном течении послеоперационного периода кормление через зонд начиналось через 3–5 суток после операции. На 8–9 сутки проводилась эзофагография с целью определения состоятельности анастомоза. Для этого под контролем рентгеновского экрана через рот ребенку вводилось 1–2 мл водорастворимого контрастного вещества. Оценивалась проходимость анастомоза пищевода, исключались затеки контрастного вещества в средостение. При отсутствии осложнений ребенок начинал кормиться через рот.
Несостоятельность анастомоза выявлена у 6 детей (4,9 %). Ранним диагностическим признаком несостоятельности анастомоза являлось появление слюны по плевральному дренажу. У 3 новорожденных несостоятельность была частичной. На фоне консервативной терапии на 16–20 день наступило заживление зоны несостоятельности, что было подтверждено рентгенконтрастным исследованием пищевода. В этой группе больных в последующем сформировались стенозы пищевода с явлениями дисфагии, что потребовало бужирования пищевода. В трех наблюдениях отмечена несостоятельность анастомоза, при которой пришлось накладывать верхнюю эзофагостому и гастростому.
У 26 детей в послеоперационном периоде отмечались явления дисфагии, обусловленные мобилизацией сегментов пищевода. При рентгенологическом и эндоскопическом исследованиях анастомоза не выявлено сужения зоны. На фоне проведенной консервативной терапии явления дисфагии полностью купировались.
7-ми новорожденным с бессвищевыми формами атрезии пищевода (из 11 детей с бессвищевыми формами 4 умерли без операции в связи с тяжелой сочетанной патологией) выполнены шейная эзофагостомия и гастростомия. Этим детям через 10–12 месяцев была произведена загрудинная эзофагопластика левой половиной толстой кишки на левой ободочной артерии. Трансплантат располагали в изоперистальтической позиции. Операция завершалась дренированием средостения. После операции дети получали интенсивную терапию в отделении реанимации. Дренаж из плевральной полости удалялся через 2–3 дня. Через 7–10 дней проводилось рентгенконтрастное исследование для исключения несостоятельности анастомозов, и при отсутствии осложнений назначалось кормление через гастростому. Гастростомическая трубка удалялась через 3 месяца. Один ребенок оперирован повторно в связи с выявлением избыточных петель трансплантата.
Данный вид пластики пищевода был выполнен и у 3 пациентов, которым были наложены эзофаго- и гастростома в связи с полной несостоятельностью пищеводного анастомоза.
После операции по поводу атрезии пищевода умерло 12 детей. Следует отметить, что у всех умерших новорожденных отмечались сочетанные аномалии.
Таким образом, летальность составила 9,8 %. Стенозы пищевода, потребовавшие длительного бужирования, выявлены у 11 пациентов.
Атрезия пищевода - симптомы и лечение
Что такое атрезия пищевода? Причины возникновения, диагностику и методы лечения разберем в статье доктора Вавилова Артема Сергеевича, детского хирурга со стажем в 7 лет.
Над статьей доктора Вавилова Артема Сергеевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина
Определение болезни. Причины заболевания
Атрезия пищевода — это врождённый порок развития пищевода, при котором верхняя и нижняя часть пищевода не соединяются. В некоторых случаях при атрезии сегменты пищевода сообщаются с трахеей. Из-за этого дефекта пища не может попасть в желудок и задерживается в верхнем "слепом" конце пищевода. При наличии свища с трахеей, пища (или слюна, если кормление младенца ещё не начато) попадает в лёгкие, что вызывает тяжёлую пневмонию. Без хирургического вмешательства на ранних сроках атрезия пищевода приводит к смерти младенца.
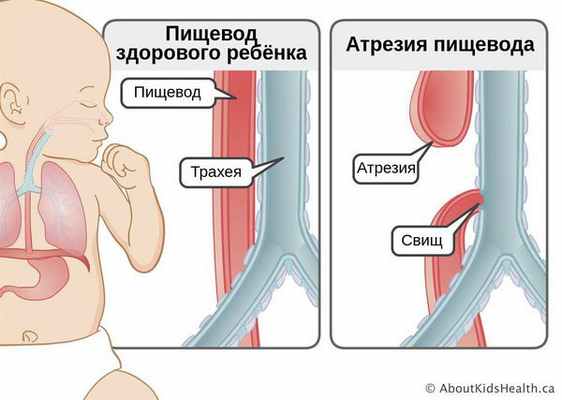
Достоверных причин появления атрезии пищевода не установлено. У развития пороков плода, в том числе атрезии пищевода, могут быть различные причины:
- генетические факторы;
- инфекции у матери;
- плохое питание матери во время беременности (дефицит необходимых микроэлементов, таких как йод, фолиевая кислота и др.);
- тяжёлые хронические заболевания (например, сахарный диабет);
- экологические факторы;
- употребление алкоголя и некоторых лекарственных средств, табачная зависимость.
Атрезия пищевода встречается как в изолированной форме, так и в вместе с другими аномалиями, которые собраны в специальную ассоциацию VACTERL. В неё входят аномалии позвоночника, атрезия ануса, пороки сердца, аномалии почек, дефекты лучевой кости.
Атрезия пищевода может сопутствовать синдрому Чарга — Стросса (аутоиммунной аномалии), синдрому Гольденхара (дефекту в развитии зубов, ушной раковины, глаз и лица), трисомии (наличию трёх хромосом вместо двух в клетках) и другим врождённым порокам развития.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы атрезии пищевода
Заподозрить наличие атрезии пищевода можно уже в первые минуты жизни новорождённого. Ребёнок не может проглотить слюну, поэтому акушеры наблюдают повышенное слюнотечение (гиперсаливацию). Один из самых характерных признаков — через нос или рот младенца начинает идти пена.
Проблемы выясняются сразу при первом кормлении: ребёнок будет давиться пищей. При атрезии пищевода полностью или частично нарушается прохождение пищи по пищеводу. В некоторых случаях может возникнуть синюшность кожи (цианоз) из-за недостатка кислорода в крови — в дыхательные пути попадает проглоченная пища и мешает дышать. Также отмечается рвота неизменённым молоком или смесью.
О наличии трахеопищеводного свища говорят приступы кашля во время кормления. Сильнее они проявляются при горизонтальном положении ребёнка, наблюдаются одышка и хрипы.
Младенцу с такими симптомами установливают назогастральный зонд. Если он упирается в препятствие, заворачивается и выходит через рот, то с большой вероятностью можно предполагать наличие атрезии пищевода.
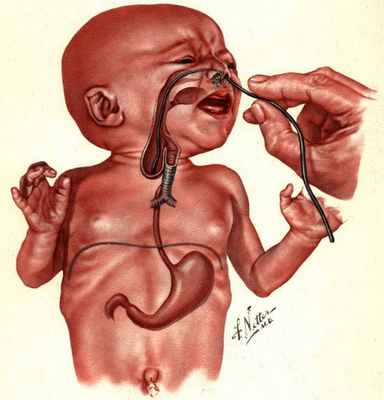
В пренатальном периоде атрезию пищевода можно заподозрить на УЗИ при наличии многоводия, отсутствия визуализации желудка и расширенного верхнего сегмента пищевода. Последний признак наиболее достоверный [1] [4] [9] .
Патогенез атрезии пищевода
Возникновение атрезии пищевода связано с нарушением формирования у эмбриона головного отдела первичной кишки во время беременности. Так как трахея и пищевод формируются из одного зачатка, на ранних стадиях они сообщаются. На 4-5 неделе развития эмбриона пищевод и трахея разделяются на два разных канала. При нарушении направления и скорости роста тканей складываются условия для формирования атрезии пищевода.
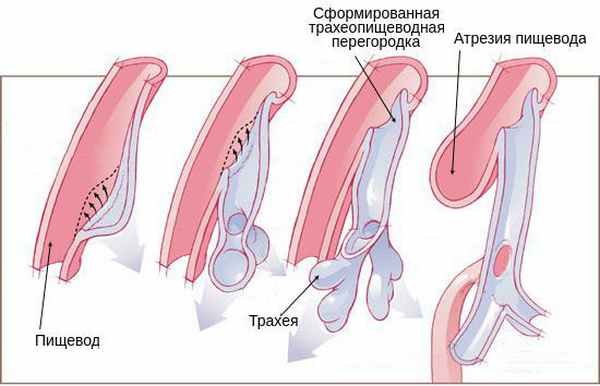
Когда эмбрион заглатывает околоплодные воды, при разобщении сегментов пищевода происходит перерастяжение верхней части. Из-за отсутствия проходимости по пищеводу перистальтические движения не происходят должным образом, нарушается глотательный рефлекс. Перерастянутый верхний сегмент пищевода сдавливает трахею, из-за чего хрящевые кольца трахеи формируются неправильно. При наличии трахеопищеводного свища околоподные воды из лёгких попадают в желудочно-кишечный тракт, что приводит к снижению давления внутри бронх. Из-за этого бронхи и альвеолы формируются неправильно [1] [4] [11] .
Классификация и стадии развития атрезии пищевода
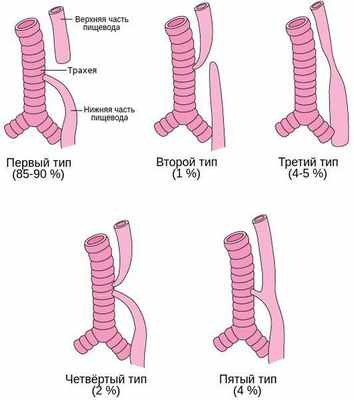
Встречается несколько основных анатомических вариантов атрезии пищевода:
- Атрезия пищевода с нижним трахеопищеводным свищём — верхний сегмент пищевода оканчивается слепо, а нижний формирует трахеопищеводный свищ. Встречается в 85-90 % случаев.
- Атрезия пищевода с верхним трахеопищеводным свищём — верхний сегмент пищевода формирует трахеопищеводный свищ, а нижний заканчивается слепо. Встречается в 1 % случаев.
- Изолированная атрезия пищевода — имеется большой промежуток между пищеводной трубкой и желудком, при этом трахеопищеводный свищ отсутсвует. Встречается в 4-5 % случаев.
- Атрезия пищевода с верхним и нижним трахеопищеводным свищём — встречается в 2 % случаев.
- Трахеопищеводный свищ без атрезии пищевода (Н-тип) — характеризуется наличием аномального соединения пищевода и трахеи, при этом нарушения проходимости пищевода нет. Встречается в 4 % [4] .
Трахеопищеводный свищ и атрезия пищевода чаще всего наблюдаются как комбинированная аномалия, но могут встречаться и как изолированные пороки развития.
Таким образом, можно выделить три основные формы данного заболевания:
- атрезия пищевода без свища;
- атрезия пищевода с трахеально-пищеводным свищём;
- врождённый трахеально-пищеводный свищ без атрезии.
При этом симптомы во всех формах атрезии пищевода будут одинаковы [1] [4] [8] .
Осложнения атрезии пищевода
При отсутствии своевременного лечения высок риск смертельного исхода. Этот риск увеличивается при наличии сопутствующих патологий [4] .
Когда желудок напрямую сообщается с трахеобронхиальным деревом через свищ, во время крика младенца из-за поступающего воздуха он перерастягивается. При этом подвижность диафрагмы ограничивается, и развивается ателектаз — спадение участка лёгкого в связи с частичным или полным отсутствием воздуха в альвеолах [4] . Если такой трахеопищеводный свищ поздно диагностировать, то это может привести к развитию аспирационной пневмонии (воспалению лёгких, спровоцированному попаданием внутрь инородных тел) и нарастанию дыхательной недостаточности.
Иногда через трахеопищеводный свищ в бронхи и альвеолы попадает содержимое желудка. Это может спровоцировать "химическую" пневмонию, которая способна перерасти в бактериальную [4] .
Диагностика атрезии пищевода
Опыт диагностики атрезии пищевода на УЗИ во время беременности не распространён широко, поэтому атрезия зачастую диагностируется уже в постнатальном периоде.
После рождения ребёнка при подозрении на атрезию пищевода диагностика проводится незамедлительно. В родильном зале в пищевод вводится желудочный зонд. При наличии атрезии зонд пройдёт на глубину 7-10 см, упрётся в слепой конец верхнего сегмента и, при дальнейшем продвижении, появится в полости рта. Во время зондового исследования также проводится проба Элефанта: через зонд шприцем вводится воздух, и при атрезии со слепым верхним сегментном воздух с шумом выходит наружу.
Если пробы с желудочным зондом подтвердили наличие атрезии, ребёнка переводят в хирургический стационар и делают рентгенологическое обследование.
На обследовании выполняются рентгеновские снимки грудной клетки и брюшной полости, предварительно в пищевод устанавливают рентген-контрастный зонд. Исследование проводится в прямой проекции в вертикальном положении ребёнка. Оценивают уровень стояния зонда (свёрнутый зонд в слепом верхнем сегменте); газонаполнение желудка и кишечника (при наличии трахео-пищеводного свища между нижним сегментом и трахеей будет определяться воздух в брюшной полости, при отсутствии воздуха в желудке и кишечнике исключается наличие нижнего трахеопищеводного свища).
Также проводится рентген-контрастное исследование. Через зонд в верхний сегмент пищевода вводится не более 1 мл контраста. При наличии верхнего трахеопищеводного свища, кроме пищевода окрашивается ещё и трахеобронхиальное дерево.
Во время проведения рентгенологического обследования можно выявить сопутствующие патологии — непроходимость кишечника, пороки развития позвоночника и пневмонию.
В виду высокой вероятности сочетанных аномалий проводятся дополнительные обследования — УЗИ сердца, УЗИ мочевыделительной системы, нейросонография — ультразвуковое исследование головного мозга.
Параллельно с рентгенологическим обследованием проводится и общеклиническое: общий анализ крови, биохимический анализ крови, коагулограмма, определение газового состава крови, группы крови с фенотипом [1] [4] [5] [7] [9] [10] [13]
Лечение атрезии пищевода
Каждый ребёнок с подозрением на атрезию пищевода должен быть переведён в специализированный стационар, где при подтверждения диагноза начнётся лечение.
Консервативного лечения атрезии пищевода не существует. Коррекция порока — только хирургическое лечение. Операция проводится после стабилизации состояния ребёнка и коррекции нарушений метаболизма. Готовность ребёнка к операции определяют по результатам лабораторных показателей и всех проведённых обследований. Предоперационная подготовка занимает от 12 до 24 часов.
В некоторых случаях проводится экстренное лечение. Показанием для экстренной операции могут быть сопутствующие патологии (например, дуоденальная непроходимость, или атрезия кишечника), а также осложнения, связанные с наличием широкого трахеопищеводного свища и невозможностью проводить адекватную искусственную вентиляцию лёгких. Экстренное лечение проводится в первые часы после выявления патологии.
Цель операции — восстановление проходимости пищевода, соединение его разобщённых отделов и устранение трахеопищеводного свища.
В зависимости от технической оснащённости клиники и квалификации хирурга оперативное лечение проводят традиционным способом (открытая операция — торакотомия), или с помощью эндоскопического оборудования (торакоскопия) [2] [4] [7] [8] [14]
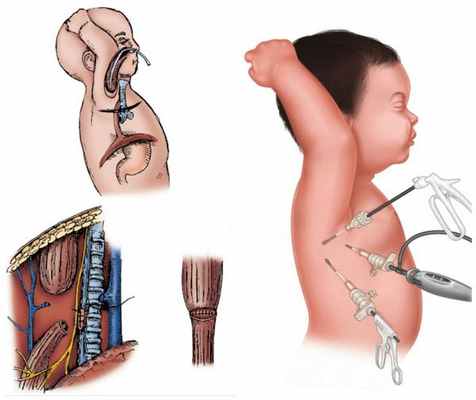
Этапная коррекция
Предпочтение к этапному лечению отдаётся у детей с нестабильной работой сердца и лёгких и детей с экстремально низкой массой тела. Этапное лечение также проводится при большом расстоянии между сегментами пищевода. Расстояние между сегментами пищевода, превышающее 2-3 см, считается противопоказанием к наложению первичного анастомоза (сшиванию концов пищевода в единый канал).
Первым этап коррекции: устранение трахеопищеводного свища и наложение гастростомы — специальной трубки, ведущей в желудок, с помощью которой можно искусственно подавать пищу.
Дальнейшая коррекция: наложение анастомоза (сшивание пищевода) или пластика пищевода с использованием тканей других органов. Предпочтительный орган для выполнения пластики пищевода — ободочная толстая кишка.
При невозможности сшивания пищевода или при повреждении его сегментов при попытке наложить анастомоз проводится двойная эзофагостомия по Баирову [5] . Дальнейшая пластика пищевода проводится через несколько месяцев после первого этапа операции.
Трудности в определении объёмов оперативного вмешательства возникают у детей с сочетанными пороками желудочно-кишечного тракта. Действия врачей в таких случаях для каждого ребёнка определяются индивидуально в зависимости от особенностей патологии. Но принцип ведения таких больных сводится к единому постулату: провести как можно меньше вмешательств с наиболее оптимальным эффектом.
Наиболее часто атрезия пищевода сочетается с высокой и низкой кишечной непроходимостью. Например, с атрезией мембраны двенадцатиперстной кишки или атрезией анального отверстия и прямой кишки.
При сочетании атрезии пищевода с высокой кишечной непроходимостью на первом этапе целесообразно наложить анастомоз пищевода и устранить трахеопищеводный свищ. Затем проводится радикальная операция для устранения кишечной непроходимости. Чтобы избежать в послеоперационном периоде застойные явления в желудке, нужно установить гастростому. В случае, если пришлось сшивать кишечник, также необходима установка трубки для внешнего питания.
При сочетании с низкой кишечной непроходимостью (атрезия анального отверстия или прямой кишки) выбор метода лечения определяется особенностями пороков. После разобщения трахеопищеводного свища и наложении анастомоза пищевода проводится коррекция низкой кишечной непроходимости. При высокой атрезии прямой кишки накладывается колостома — искусственный задний проход [1] [4] [5] .
Прогноз. Профилактика
При изолированных формах атрезии пищевода выживаемость достигает 90-100 %. При тяжёлых сочетанных аномалиях — значительно ниже, до 30-50 %.
Для прогноза по выживаемости в случае с артезией используются классификации по Waterston, Spitz, Poenaru. Данные классификации являются «оценочными» и используются больше для статистических измерений. На практике они не используются. Для примера приведём классификацию по Waterson:
- Класс А — масса тела при рождении больше 2500 граммов, нет пневмонии, нет сочетанных аномалий, выживаемость 99 %;
- Класс В — масса тела при рождении от 1800 до 2500 граммов, нет пневмонии, нет сочетанных аномалий; либо же масса тела при рождении более 2500 граммов, есть умеренная пневмония, имеются сочетанные аномалии, — выживаемость 95 %;
- Класс С — масса тела при рождении менее 1800 граммов, нет пневмонии, нет сочетанных аномалий; либо же масса тела при рождении больше 1800 граммов, есть тяжёлая пневмония, есть сочетанные аномалии, выживаемость 71 % [4] .
Осложнения после операции
В раннем послеоперационном периоде могут встречаться такие осложнения, как несостоятельность швов анастомоза пищевода и восстановление трахеопищеводного свища.
Если после начала кормления ребёнка в интубационной трубке появляется смесь, можно заподозрить, что трахеопищеводный свищ образовался снова. О нарушении герметичности анастомоза говорит появление слюны в страховочном дренаже в зоне анастомоза. В таких случаях для дополнительной диагностики проводится рентгенологическое исследование с использованием водорастворимых контрастных веществ. При обнаружении «утечки» проводится повторное оперативное вмешательство с целью устранения несостоятельности швов на пищеводе или трахее.
К поздним послеоперационным осложнениям можно отнести стеноз пищевода — канал становится более узким из-за рубцов. Возникает он обычно не ранее четырёх недель после проведённого оперативного вмешательства. Ребёнок начинает отказываться от еды, появляются явления дисфагии — затрудняется глотание, комок пищи не может пройти дальше по пищеводу.
Для диагностики стеноза пищевода проводится фиброэзофагоскопия и рентгеноскопия пищевода. Рентгенологическими признаками стеноза являются сужения в области зоны анастомоза и расширение пищевода выше анастомоза, отмечается замедление прохождения контрастного вещества за зону анастомоза. Если сужение пищевода всё-таки обнаружится, что в пищевод будет вставлена специальная трубка — буж, которая будет поддерживать канал в расширенном состоянии [1] [4] [11] .
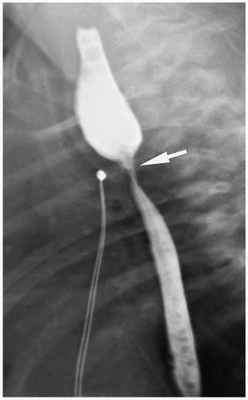
В ближайшие годы после оперативного лечения также могут отмечаться явления дисфагии — расстройства акта глотания и прохождения пищевого комка, связанные с желудочно-пищеводным рефлюксом или стенозом пищевода. Поэтому все дети, прооперированные из-за атрезии пищевода, подлежат постоянному наблюдению [1] [7]
Профилактика
Так как достоверных причин возникновения атрезии пищевода не установлено, специфических мер профилактики возникновения данного порока развития не существует.
Чтобы избежать появление аномалий развития, до или во время наступления беременности женщинам стоит придерживаться общих рекомендаций ВОЗ:
Атрезия пищевода
Атрезия пищевода – неполное формирование пищевода, часто ассоциированное с трахео-пищеводным свищем. Диагноз подозревается при невозможности постановки назогастрального или орогастрального зонда. Лечение подразумевает проведение восстановительной операции.
Атрезия пищевода – наиболее распространенная желудочно-кишечная атрезия. Частота составляет приблизительно 1 случай на 3500 живорожденных. Другие врожденные аномалии составляют до 50% случаев. Два синдрома специфически связаны с атрезией пищевода:
VACTERL (от англ Vertebral anomalies, Anal аtresia, Cardiovascular malformations, Tracheoesophageal fistula, Esophageal atresia, Renal anomalies, Radial aplasia, Limb anomalies – аномалии позвоночника, атрезия ануса, пороки сердца, трахеопищеводный свищ с атрезией пищевода, аномалии почек, гипоплазия лучевой кости, дефекты конечностей)
Симптомокомплекс CHARGE (от англ Coloboma – колобома, Heart defects – пороки сердца, Atresia of the choanae – атрезия хоан, Retardation of mental and/or physical development – задержка роста и развития, Genital hypoplasia – гипоплазия наружных половых органов, Ear abnormalities – аномалии ушей)
Приблизительно у 19% детей с атрезией пищевода наблюдаются симптомы VACTERL.
Выделяют 5 основных типов атрезии пищевода ( Типы и относительные частоты атрезии пищевода и трахеопищеводного свища Типы и относительные частоты атрезии пищевода и трахеопищеводного свища ). Большинство типов также ассоциировано со свищом между трахеей и пищеводом.
У большинства младенцев симптомы проявляются в неонатальном периоде, однако у детей с трахеопищеводной фистулой Н-типа симптомы могут проявляться значительно позже.
Характерными признаками избыточной секреции являются кашель и цианоз после попыток кормления, аспирационная пневмония. Эзофагальная атрезия с дистальным свищом приводит к вздутию живота, поскольку во время плача ребенка, воздух из трахеи нагнетается через фистулу в нижние отделы пищевода и желудка.
Типы и относительные частоты атрезии пищевода и трахеопищеводного свища
Относительные частоты основаны на компиляции из различных источников.
Диагностика атрезии пищевода
Постнатальная: установка назогастрального или орогастрального зонда и рентгенография
Рутинное пренатальное УЗИ может предположить наличие атрезии пищевода. Многоводие может присутствовать, но не является диагностическим признаком, поскольку может развиваться при многих других заболеваниях. Желудочный пузырь у плода может отсутствовать, но только в < 50% случаев. Реже встречается дилятированный верхний мешок пищевода, но обычно пободное характерно для плодов с многоводием и отсутствием желудочного пузыря.
После родов, при подозрении на атрезию пищевода, заподозренную при проведении пренатального ультразвукового исследования, или при наличии клинических показаний, вводится назогастральный или орогастральный зонд; на диагноз атрезии пищевода наталкивает невозможность продвижения зонда в желудок. Рентгеноконтрастный катетер определяет местоположение атрезии на рентгеновском снимке. В атипичных случаях небольшое количество водорастворимого контрастного вещества может быть необходимо для определения анатомии при рентгеноскопии. Контрастное вещество должно быть быстро аспирировано обратно, поскольку может вызвать химический пневмонит при попадании в легкие. Эту процедуру должен выполнять только опытный рентгенолог в центре, где новорожденному будет проведена операция.
Лечение атрезии пищевода
Цель предоперационного ведения – привести младенца в оптимальное состояние для операции и предотвратить аспирационную пневмонию, которая делает хирургическую коррекцию более опасной. Отказ от перорального кормления. Непрерывное отсасывание через назогастральный зонд из верхнего отдела пищевода предотвращает аспирацию проглоченной слюны. Ребенок должен находиться с приподнятой на 30–40 ° головой и на правом боку для облегчения опорожнения желудка и минимизации риска аспирации желудочного секрета через свищ. Если окончательная коррекция откладывается из-за глубокой недоношенности, аспирационной пневмонии или других врожденных пороков развития, то для декомпрессии желудка проводят наложение гастростомической трубки. Кормление через гастростому уменьшает риск заброса содержимого желудка через фистулу в трахео-бронхиальное дерево.
Восстановительная операция
При стабильном состоянии ребенка возможно проведение экстраплевральной хирургической коррекции атрезии пищевода и закрытие трахео-пищеводного свища. Замеченный свищ нуждается в лигировании. В приблизительно 90% случаев может быть выполнен первичный анастомоз пищевода. В оставшихся случаях, при существовании чрезвычайно длинного разрыва, существуют варианты выполнения операции по транспозиции желудка или толстокишечной интерпозиции.
Некоторые детские хирурги выполняют операцию по Фокеру. При этой операции вытяжные швы расположены на концах пищеводных мешков, выведенных чрескожно, и зафиксированных силиконовыми кнопками. Вытяжение постепенно воздействует на швы, что стимулирует удлинение пищевода от 1 до 2 мм/день. После того, как концы пищевода сходятся или максимально сближаются, выполняется первичный анастомоз ( 1 Справочные материалы по лечению Атрезия пищевода – неполное формирование пищевода, часто ассоциированное с трахео-пищеводным свищем. Диагноз подозревается при невозможности постановки назогастрального или орогастрального зонда. Прочитайте дополнительные сведения Наиболее распространенные острые осложнения – подтекание в месте анастомоза и формирование стриктуры. Сложности с кормлением после успешного хирургического вмешательства в 85% случаев возникают из-за плохой подвижности дистального сегмента пищевода. Этот дефект обусловливает желудочно-пищеводный рефлюкс примерно у 50% детей. Всем новорожденным с атрезией пищевода рекомендуется: лечение рефлюкса кислотно-супрессивной терапией Медикаментозное лечение Гастроэзофагеальный рефлюкс - это перемещение желудочного содержимого в пищевод. Гастроэзофагеальная рефлюксная болезнь (ГЭРБ) - это рефлюкс, который вызывает осложнения, такие как раздражительность. Прочитайте дополнительные сведения ( 2 Справочные материалы по лечению Атрезия пищевода – неполное формирование пищевода, часто ассоциированное с трахео-пищеводным свищем. Диагноз подозревается при невозможности постановки назогастрального или орогастрального зонда. Прочитайте дополнительные сведенияСправочные материалы по лечению
1. Shieh HF, Jennings RW: Long-gap esophageal atresia. Semin Pediatr Surg 26(2):72–77, 2017. doi: 10.1053/j.sempedsurg.2017.02.009
2. Krishnan U, Mousa H, Dall’Oglio L, et al: ESPGHAN-NASPGHAN guidelines for the evaluation and treatment of gastrointestinal and nutritional complications in children with esophageal atresia-tracheoesophageal fistula. J Pediatr Gastroenterol Nutr 63(5):550–570, 2016. doi: 10.1097/MPG.0000000000001401
Основные положения
Выделяют 5 видов атрезии пищевода; все из них, кроме одного, сопровождаются трахео-пищеводным свищом.
Иногда диагноз предполагают на основании данных пренатального УЗИ.
Клинические проявления включают избыточную секрецию, кашель и цианоз после попыток кормления и аспирационную пневмонию.
Диагностику проводят с помощью назогастрального или орогастрального зонда.
Лечится проводится путём хирургического вмешательства или кислотоподавляющей терапии.
Авторское право © 2022 Merck & Co., Inc., Rahway, NJ, США и ее аффилированные лица. Все права сохранены.
АТРЕЗИЯ ПИЩЕВОДА
Атрезия пищевода — порок развития, при котором проксимальный и дистальный концы пищевода не сообщаются между собой.
Пороки развития пищевода встречаются с частотой 1:3 000 – 1:5 000 новорожденных, наиболее частый вариант порока – сочетание атрезии с трахеопищеводным свищем.
Атрезия пищевода в более чем половине случаев (63-72%) сочетается с другими пороками развития.
- врожденные пороки сердца
- пороки развития ЖКТ
- пороки развития трахеобронхиального дерева.
- деформации костно-мышечной системы: позвоночного столба, ребер, конечностей.
- хромосомные аномалии: около 3% пациентов с атрезией пищевода и трахеопищеводным свищем имеют хромосомные аномалии – трисомии (18,13,21 пары хромосом).
Наиболее известные синдромы, которые встречаются при атрезии пищевода – это VACTER и CHARGE-синдромы.
В 1973 г Quan и Smith впервые описали VATER-ассоциацию, которая состоит из комбинации аномалий включающих пороки развития позвоночника (vertebral), аноректальной области (anorectal), трахеопищеводный свищ (tracheoesophageal) и пороки развития почек (renal).
Позднее этот синдром включил пороки развития сердца (cardiac) и конечностей (limb).
CHARGE-синдром (колобома, пороки сердца, атрезия хоан, задержка роста, генитальная гипоплазия, аномалии ушной раковины);
Диагноз атрезии пищевода устанавливается чаще всего в родзале, когда невозможна постановка назогастрального зонда при первичном осмотре. Ребенок не может проглотить слюну, в связи с чем, отмечается повышенная саливация, слюна пенится и отходит через рот и нос.
При подозрении на атрезию пищевода ребенка ни в коем случае нельзя кормить, так как невозможность проглатывания молока приводит к развитию аспирационной пневмонии!
Пренатальная эхографическая диагностика атрезии пищевода основывается, как правило, только на косвенных признаках порока, начиная с 18 недель беременности:
- многоводие, связанное с невозможностью проглатывания плодом амниотической жидкости, вследствие непроходимости пищевода.
- отсутствие эхографического изображения желудка или маленьких его размеров при динамическом ультразвуковом наблюдении (чаще при изолированной форме атрезии пищевода).
- в некоторых случаях может выявляться расширение глотки и проксимального конца пищевода.
Чувствительность эхографии в диагностике атрезии пищевода при комбинированном использовании эхографических признаков (многоводие, отсутствие эхотени желудка) не превышает 42%.
Основной диагностический признак атрезии пищевода при рождении ребенка – невозможность постановки желудочного зонда.
Далее обязательно проводится рентгенологическое обследование для подтверждения диагноза. На обзорном снимке грудной и брюшной полостей начало зонда определяется в слепом конце пищевода, далее наличие газа в желудочно-кишечном тракте позволяет дифференцировать свищевые формы атрезии пищевода. Отсутствие газа в желудке при обзорной рентгенографии чаще всего связано с отсутствием сочетания атрезии пищевода со свищем в трахею.
Новорожденные дети с установленным диагнозом атрезии пищевода нуждаются в проведении срочного оперативного лечения.
Операцией выбора является наложение прямого анастомоза между двумя концами пищевода.
В нашем отделении данная операция проводится малоинвазивным эндоскопическим методом – через минимальные проколы (3мм) в правой половине грудной клетки выявляются атрезированные концы пищевода и сшиваются между собой.
В случае невозможности одномоментного сшивания пищевода мы используем процедуру по поэтапному вытяжению пищевода по Foker, так же выполняемую эндоскопическим методом. По этой методике концы пищевода в состоянии максимального натяжения фиксируются к грудной стенке, тем самым получаю импульс к росту. В результате концы пищевода следующим этапом сшиваются между собой.
Приоритетным направлением в хирургии пищевода в нашем отделении является реконструкция собственного пищевода, что в последующем избавляет детей от необходимости замещать пищевод другими отделами кишки.
В ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России Вы получаете уникальную возможность получить БЕСПЛАТНО оперативное стационарное лечение по квотам на высоко-технологическую медицинскую помощь (ВМП по ОМС).
Читайте также:
