Диагностика двойни. Сосудистые анастомозы в монохориальной плаценте. Фето-фетальный трансфузионный синдром.
Добавил пользователь Валентин П. Обновлено: 30.01.2026
ГУ "Республиканский научно-практический центр "Мать и дитя" Министерства здравоохранения Республики Беларусь, Минск
ГУ «Республиканский научно-практический центр «Мать и дитя» Министерства здравоохранения Республики Беларусь, Минск, Республика Беларусь, 220053
Фетоскопическая лазерная коагуляция анастомозов плаценты при фето-фетальном трансфузионном синдроме у монохориальной триамниотической тройни, наступившей после применения ЭКО/ИКСИ
Журнал: Проблемы репродукции. 2016;22(5): 76‑81
Представлено клиническое наблюдение беременности монохориальной триамниотической тройней, наступившей после применения ЭКО у пациентки с первичным бесплодием. Ультразвуковые данные о хориальности были неоднозначными. Беременность осложнилась фето-фетальным трансфузионным синдромом, при котором два плода стали донорами и один реципиентом. Проведена фетоскопическая лазерная коагуляция анастомозов. В течение 2 сут наступила антенатальная гибель двух доноров. Выполнена магнитно-резонансная томография (Т2 и диффузно-взвешенное изображение) головного мозга выжившего плода. Поскольку патологических изменений установлено не было, беременность пролонгирована и завершилась преждевременными родами в срок 31 нед девочкой массой 1200 г.
Двойни бывают двух типов: дизиготные (ДЗ) и монозиготные (МЗ). ДЗ близнецы появляются в результате оплодотворения двух или более яйцеклеток. Такие дети имеют различный генетический материал, являются обычными сибсами и, как все дети одних родителей, имеют в среднем 50% совпадающих аллелей.
МЗблизнецы появляются вследствие разделения в начале эмбриогенеза единственной зиготы на две отдельные. В результате МЗ близнецы всегда одного пола и в каждом локусе у них содержатся идентичные генотипы. В экспериментах на животных установлено, что температурный режим, отсроченные от овуляции оплодотворение и имплантация, уровень поступления кислорода, воздействие некоторых тератогенных агентов могут влиять на частоту МЗ двоен [1]. Частота М.З. двоен при естественном зачатии составляет 0,45% [2]. По мнению ряда авторов, частота МЗ двоен выше, чем можно было бы ожидать [3]. Увеличение частоты МЗ двоен при применении ЭКО до 1,9— 5% связывают со стимуляцией овуляции, дефектами zonapellucida, технологией культивирования и другими манипуляциями ЭКО [2, 4, 5]. Семейные случаи монозиготности объясняются наследственным дефектом zonapellucidа, что приводит к раннему хэтчингу, как и при применении ЭКО.
Однако установить зиготность во время беременности достаточно сложно, и в практике акушера-гинеколога превалирует вопрос хориальности. Оценка хориальности значима и для прогнозирования поздних акушерских осложнений, прежде всего фето-фетального трансфузионного синдрома (ФФТС), антенатальной гибели одного плода из двойни и выработки тактики ведения беременности.
В основе ФФТС лежит неправильное распределение крови между обоими плодами, связанное с наличием сосудистых анастомозов в плаценте [7]. В результате кровь от одного плода (донора) шунтируется к другому (реципиенту). Это приводит к специфическим патологическим изменениям как у донора (маловодие, анемия, синдром задержки развития плода — СЗРП), так и у реципиента (многоводие, кардиомегалия, эритремия, неимунная водянка). ФФТС является причиной высокой перинатальной смертности (около 15—17% всех случаев многоплодия) [8].
Диагностировать ФФТС во II триместре беременности можно при наличии единственной плаценты, совпадении пола плодов, при разнице в развитии (массе) плодов не менее 20% и при дискордантности по объему амниотической жидкости. У первого плода развивается маловодие — максимальный вертикальный размер пакета вод составляет 2 см, у второго — многоводие с максимальным вертикальным размером пакета 8 см [8, 9]. Также наблюдаются различия в размерах мочевых пузырей: маленький и вплоть до отсутствия у донора и большой у плода с многоводием — реципиента. Кроме того, определяется нарушение кровотока в сосудах пуповины у донора (в тяжелых случаях — нулевой или реверсный конечный диастолический кровоток) и аномальный венозный кровоток у плода реципиента. Иногда у реципиента развивается водянка.
Наиболее сложной клинической ситуацией при развитии ФФТС является беременность тремя и более плодами. Трех-, четырехплодная беременность чаще всего мультизиготная и связана с суперовуляцией. Однако могут встречаться различные комбинации, когда одна из зигот делится с формированием МЗ пары при беременностях тремя и четырьмя плодами. Кроме того, единственная зигота может поэтапно и многократно делиться с формированием МЗ трех- и более плодной беременности [10,11].
Представляем клиническое наблюдение беременности монохориальной триамниотической (МХТА) тройней, наступившей после применения ЭКО и ИКСИ и осложнившейся ФФТС.
Материал и методы
Ультразвуковые исследования (УЗИ) выполнены на аппарате VOLUSON 730 с использованием трансабдоминального конвексного датчика 5 МГц и трансвагинального датчика 7 МГц. Процедуры селективной лазерной коагуляции анастомозов выполнены фетоскопом фирмы «Karl Storz GmbH» (Германия) с набором миниатюрных жестких эндоскопов прямого видения 0° диаметром 1 мм, длиной 20 см с аппертурным углом 70°, оптикой переднебокового видения 30°, тубусом фетоскопии диаметром 1,3 мм с двумя изолированными каналами для лазерных зондов диаметром 600 мкм. Использован хирургический лазерный аппарат ФОТЭК ЛК-50 (Беларусь) с длиной волны 1064 мкм, мощностью 60 Вт с импульсным режимом работы, частотой повторения импульсов 50 Гц, длительностью импульсов 150—250 мкс и световодом диаметром 600 мкм. Амниоредукция выполнена методом «свободной» руки спинальной иглой толщиной 20 G.
Результаты
При УЗИ в 12 нед беременности диагностирована ДХТА тройня. Копчико-теменной размер первого плода — 54,9 мм, второго — 56,2 мм, третьего — 59,9 мм. Толщина воротникового пространства первого плода — 1,3 мм (1,35 Мом), второго — 1,6 мм (1,11 Мом), третьего — 1,3 мм (1,04 Мом). Ни один из плодов в группу высокого риска по синдрому Дауна не вошел.
Повторное УЗИ выполнено в 16 нед беременности. Диагноз: дихориальная триамниотическая (ДХТА) тройня. Врожденных пороков развития у плодов не выявлено.
В сроке беременности 20 нед пациентка направлена для медико-генетического консультирования (МГК) в связи с возрастом 35 лет и трехплодной беременностью. При проведении ультразвукового (УЗ) осмотра врачом, имеющим большой опыт в работе с многоплодной беременностью, высказано предположение о том, что тройня является МХТА. Плацента располагалась по задней стенке матки, межамниотические мембраны тонкие, толщиной 0,9 и 1,3 мм, отходят они под прямым углом от поверхности плаценты (Т-признаки) (рис. 2, а) [12]. Все плоды оказались женского пола.
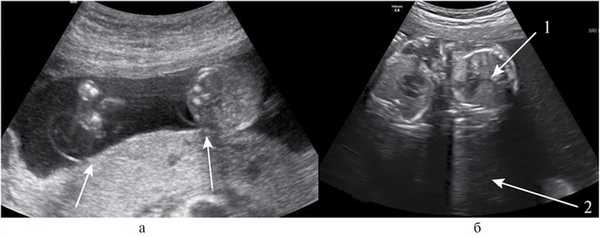
Рис. 2. УЗ-изображения МХТА тройни в 22—23 нед гестации. а — единственная плацента, расположенная по задней стенке матки. Стрелками обозначены Т-признаки; б — поперечные срезы грудной клетки на уровне сердца двух плодов-доноров (стрелка 1); выраженное многоводие у плода реципиента (стрелка 2).
По нашему глубокому убеждению, при многоплодии с неоднозначной или спорной хориальностью для определения прогноза беременности и выбора акушерской тактики необходимо исходить из худшего предположения. Согласно этому правилу, пациентка проинформирована о риске ФФТС как между двумя, так и между всеми тремя плодами и рекомендовано проведение динамических УЗ-осмотров каждые 2 нед.
При УЗИ в 22 нед беременности установлено: МХТА тройня, ФФТС II степени, многоводие у первого плода, маловодие у второго и третьего плодов (см. рис. 2, б). Результаты фетометрии представлены в таблице.
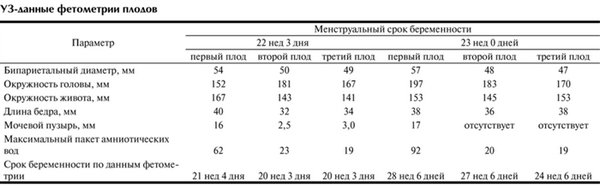
УЗ-данные фетометрии плодов
Таким образом, полученные УЗ- и клинические данные говорили в пользу гипотезы о МЗ происхождении всех трех плодов и развившемся ФФТС, при котором первый плод являлся реципиентом, а второй и третий — донорами. Учитывая нарастающее многоводие у первого плода-реципиента, высокий риск неблагоприятных акушерских осложнений, семье предложено прерывание беременности или проведение лазерной коагуляции анастомозов плаценты.
Семья приняла решение о проведении лазерной коагуляции анастомозов. В ходе МГК обсуждались риски выкидыша до 15%, неуспешной процедуры до 5%, антенатальной гибели одного или двух плодов до 30%, реверсного ФФТС до 10% [13, 14]. В срок беременности 23 нед 1 день по менструальному календарю выполнена процедура селективной лазерной коагуляции анастомозов плаценты. На плодовой поверхности визуализировалась сложная сосудистая сеть. Найдено 14 плацентарных анастомозов диаметром от 1 до 3 мм: 11 анастомозов — между первым и третьим плодом и 3 — между первым и вторым плодом. Учитывая многоводие, удалено 1000 мл светлых амниотических вод.
При контрольном УЗИ через 72 ч диагностирована внутриутробная гибель обоих плодов-доноров.
В сроке беременности 24 нед выполнена магнитно-резонансная томография (T2 и диффузно-взвешенное изображение) головного мозга выжившего плода для исключения патологических изменений головного мозга, таких как перивентрикулярная лейкомаляция, ишемия, кровоизлияния, отек и другие [15, 16]. Поскольку патологии головного мозга не выявлено, принято решение пролонгировать беременность на фоне антикоагулянтной терапии.
Через 10 сут после операции у плода реципиента развилось острое многоводие. В связи с этим выполнена процедура амниоредукции, в ходе которой удалено 800 мл светлых амниотических вод. В 28 нед беременности стало прогрессировать маловодие и в срок 31 нед произошло преждевременное излитие околоплодных вод. Путем кесарева сечения родилась недоношенная девочка массой 1240 г.
При патологоанатомическом исследовании макроскопически: МХТА послед. Единственная плацента размером 18×14×18 см, первая пуповина длиной 15 см имеет краевое прикрепление, вторая пуповина — 29 см, прикрепление оболочечное, третья — 28 см, также с оболочечным прикреплением. Второй плод женского пола длиной 29 см (длина стопы 3,9 см), мацерирован, без видимых пороков развития. Третий мацерированный плод женского пола длиной 28,5 см с длиной стопы 3,5 см также без видимых аномалий. При микроскопическом исследовании часть ворсин ворсинчатого хориона по строению соответствует сроку гестации 30—32 нед. Встречаются участки решетчатых инфарктов, облитерации сосудов стволовых ворсин и фиброза прилежащих более мелких ворсин. Одна септа состоит из двух листков амниона, слой трофобласта между ними отсутствует. Две других септы из-за дряблости плодных оболочек исследовать не удалось.
Тип плацентации при многоплодии связан с природой человеческого эмбриона. ДЗ двойни всегда ДХДА. Патологоанатомическое и морфологическое исследования последов при многоплодной беременности подтверждают характер плацентации при МЗ и ДЗ двойнях. МХ последы характеризуются единственным плацентарным диском. Количество амниотических мешков кратно количеству плодов, реже амниотический мешок единичный. Межамниотическая перегородка тонкая и представлена двумя слоями амниотической оболочки без сосудов и трофобласта. Этим обусловлена ее прозрачность, легкая смещаемость в ходе исследования и родов и невозможность точно установить исходную разделительную линию между соседними амниотическими мешками. Плацента М.Х. близнецов почти всегда имеет сосудистые анастомозы [17].
Возможно ли поэтапное деление эмбриона с 4-го по 7-й день жизни с формированием МХТА тройни? В нашей клинической практике мы встречали подобные наблюдения при самопроизвольно наступившей беременности. Поскольку известно, что частота МХ при применении ЭКО в 10 раз выше, чем при наступлении беременности в естественном цикле [2], можно ожидать, что поэтапное деление эмбриона при применении вспомогательных репродуктивных технологий (ВРТ) также может иметь место, что и демонстрирует наше наблюдение.
M. Telebian и соавт. [18] описали клиническое наблюдение МХДА тройни после проведения ЭКО/ИКСИ, в котором два плода были неразделившимися. При УЗИ в 6 нед гестации диагностирована одноплодная беременность, и только при УЗИ в 12 нед установлена трехплодная. Данное наблюдение показывает возможность поэтапного деления эмбриона после применения ЭКО, особенно при использовании ИКСИ. Как и в нашем наблюдении, визуализация одного плодного мешка в 6 нед беременности с последующей диагностикой тройни может быть дополнительным признаком для предположения о МЗ происхождении тройни.
H. Iwamoto и соавт. [19] также описали два клинических случая МХТА тройни после применения ВРТ. Одно наблюдение завершилось родами тремя мальчиками, во втором — произошел самопроизвольный аборт в 10 нед гестации. Авторы [19] считают, что такие факторы, как проведение манипуляций с zonapellucidа и длительное культивирование эмбриона до стадии бластоцисты, являются факторами риска МЗ многоплодной беременности, а такие манипуляции, особенно их сочетание, должны быть минимизированы.
Согласно собственным наблюдениям, частота ФФТС при МХ двойне составляет 5—6% [20]. Y. Sato и соавт. [14] показали, что частота ФФТС при трехплодной беременности с МХ плацентацией составляет 17%. Описан 41 случай троен, среди которых 17 были МХТА, 11 — ДХТА, 1 — ДХДА, 1 — МХМА. Средний срок появления УЗ-признаков ФФТС оказался 19 нед. Частота неблагоприятных акушерских осложнений, таких как внутриутробная смерть плода или плодов, грубые неврологические проявления у новорожденных, составили 14%. Частота легкой кистозной перивентрикулярной лейкомаляции у выживших плодов составила 5,3%.
S. Gandham и соавт. (2012) описали наблюдение беременности МХТА тройней, наступившей самопроизвольно и осложненной ФФТС. При УЗ-осмотре в срок беременности 20 нед 4 дня у 2 плодов диагностирован СЗРП и нулевой диастолический кровоток. Авторами рассматривалась возможность проведения как лазерной коагуляции анастомозов, так и окклюзии пуповин плодов с СЗРП. Однако была выбрана консервативная тактика ведения. С 24 нед беременности пациентке назначались кортикостероиды. К 26 нед гестации кровотоки плодов компенсировались, и беременность завершилась кесаревым сечением в срок 33 нед тремя новорожденными мужского пола в удовлетворительном состоянии. Вероятно, в описанном случае степень проявления ФФТС была минимальна, что позволило при консервативном наблюдении завершить беременность в 33 нед, что является средним сроком завершения беременности при тройне [21]. В нашем случае при динамическом УЗ-контроле ФФТС прогрессировал с нарастанием многоводия, что требовало проведения агрессивных акушерских мероприятий.
Несмотря на редкость описания ФФТС при тройне, особенно когда два плода являются донорами, показаны методы хирургической коррекции кровообращения. Так, G. Peeva и соавт. [13] описали проведение лазерной коагуляции анастомозов у 44 пациенток: 11 МХТА троен, 33 — ДХТА. Еще у 14 пациенток с ДХТА тройней процедура была выполнена при СЗРП у одного из плодов. Средний срок проведения процедуры составил 18 (15—24) нед. В случае ФФТС выживаемость при ДХТА тройне хотя бы одного плода составила 97%, всех плодов — 72,7%, при МХТА тройне — 81,8 и 39,4% соответственно. При СЗРП выживаемость хотя бы одного плода составила 78,6%, всех — 52,4%. Авторы пришли к заключению, что выживаемость плодов при МХТА тройне после лечения ФФТС невысока и значительно ниже, чем при ДХТА. Наше клиническое наблюдение показало, что два плода донора замерли на 3-и сутки после проведения лазерной коагуляции анастомозов плаценты, что подтверждает данные других авторов.
A. Kruse и соавт. [22] описали наблюдение МХТА тройни, наступившей самопроизвольно и осложнившейся в срок беременности в 18 нед ФФТС III степени по Qintero. Один из плодов был донором и имел маловодие (максимальный пакет вод — 10 мм), а второй — реципиентом с многоводием (максимальный пакет вод — 100 мм). Третий плод оказался интактен. Пациентка получала консервативное лечение (диета обогащенная белком). К 24-й неделе гестации объем амниотических вод нормализовался. В 32 нед выполнено кесарево сечение в связи с прогрессированием СЗРП у донора. Масса тела новорожденных составила 820, 2050 и 1800 г. Исследование плаценты установило наличие глубоких артериовенозных анастомозов только между плодами, для которых описывалось мало- и многоводие. Артерио-артериальные анастомозы, кровоток по которым рассматривается как компенсаторный механизм при ФФТС, присутствовали между всеми тремя плодами. Через 6 мес у всех детей были удовлетворительные показатели развития.
Заключение
Приведенное клиническое наблюдение и данные литературы показывают, что единственная зигота может многократно делиться не только при естественно наступившей беременности, но и при проведении процедур ЭКО с формированием МХ тройни. Наличие общей плаценты резко ухудшает прогноз беременности и может осложниться ФФТС как между двумя, так и между всеми тремя плодами. Факт переноса нескольких эмбрионов влияет на представление врачей о характере плацентации. Это может привести к ошибочной тактике ведения беременности, связанной с неправильно установленной хориальностью. Несмотря на то что определение количества плацент и амниотических мешков во II триместре беременности может вызывать затруднения, необходимо учитывать все УЗ-маркеры хориальности и амниональности, что позволит правильно оценить клиническую ситуацию и выбрать наиболее приемлемую тактику ведения. Проведение оперативного разделения кровообращения плодов при МХ тройне возможно, но связано с высоким риском гибели одного или нескольких плодов, что и демонстрирует наше наблюдение.
Диагностика двойни. Сосудистые анастомозы в монохориальной плаценте. Фето-фетальный трансфузионный синдром.
Диагноз моноамниотической двойни с помощью УЗИ можно установить в конце первого и начале второго триместра. Для диагностики можно использовать цветное картирование по Допплеру (Belfort M.S., et al., 1993). Родоразрешение показано в 34 нед после введения кортикостероидов для профилактики респираторного дистресс-синдрома у плода. Наиболее безопасным методом является кесарево сечение (Troffater K.F. 1988; Lee C.Y.,1992).
Нередко в монохориалыюй плаценте можно обнаружить сосудистые анастомозы (артерио-артериальные, артерио-венозные и вено-венозные), что ведет к смешиванию крови обоих плодов.
При наличии анастамозов возможны следующие исходы:
1) развитие двух плодов идет нормально;
2) имеет место фето-фетальная трансфузия, которая проявляется выраженной артериальной гипертензией, гипертрофией сердца, гиперволемией, полицитемией, многоводием у одного плода и задержкой развития другого;
3) нормальное развитие одного плода и тяжелая патология у другого (врожденное отсутствие сердца - acardiacus, мумификация - fetus papyraceus).
В бихориальной плаценте артерио-венозные анастомозы развиваются реже.
Фето-фетальный трансфузионный синдром встречается в 3,5-10% случаев ( Фукс М.А. 1987; Deprest J., 2002). Клинически он проявляется с 20-30 нед беременности. Диагноз фето-фетального трансфузионного синдрома антенатально можно установить па основании следующих данных: плоды одного пола, разница между массой плодов более 20%, имеется монохориальный тип плацентации и сосудистые анастомозы, у большего плода выявляется многоводие, у малого плода - маловодие, разница в концентрации гемоглобина превышает 5 г/л (Briiner J.P , Rosemoud R.L.,1993). Все критерии, кроме уровня гемоглобина, можно получить при ультразвуком исследовании.
Прогноз при синдроме трансфузии - неблагоприятный. При отсутствии лечения в 70-100% случаев плоды погибают (Hays P.M. 1986; Lantz M.E., Johnson T.R. 1993). Для лечения используют многократный амниоцентез (Wax J. et al., 1992; Mari G. et al. 1996). Однако J.Bruner et al. (1996) хороших результатов при использовании этого метода не получили. J.E.De Lia et al. (1999), J. Deprest (2002), R. Quintero (2002) с успехом применили лазерную фотокоагуляцию плацентарных сосудов. K.Benirschke et al. (1973). B.K.Wittman et al. (1986) рекламируют перевязку сосудов пуповины. Однако при этом имеется опасность развития неврологических нарушений у плода.
G.Ryan (2000) на основании анализа 300 случаев фето-фетальной трансфузии установил, что при серийном удалении околоплодных вод выжило 60% детей, но у 20% из них были неврологические изменения. При лазерной аблации сосудов плаценты в 75-80% случаев выжил один плод, в 60% -оба плода. Неврологические нарушения в возрасте 1 года наблюдались лишь у 5% детей, т.е. лазерная аблация дает лучшие результаты чем амниоредукция.
При фето-фетальном трансфузионном синдроме иногда прибегают к редукции одного из плодов, хотя при этом могут наблюдаться осложнения (Challis D. et a. 1999).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Фето-фетальный трансфузионный синдром ( Синдром фето-фетальной трансфузии )
Фето-фетальный трансфузионный синдром (ФФТС) – это тяжелое осложнение многоплодной монохориальной беременности, при которой из-за анастомозов в сосудистой сети плаценты возникает дисбаланс кровотока у плодов. Проявлениями служит диспропорциональность развития близнецов, многоводие в пузыре «рецепиента» при маловодии у «донора», ряд серьезных пороков развития обоих плодов, их внутриутробная гибель. Диагностика производится на основании картины ультразвуковых исследований, эхокардиографии и допплерографии, выполняемых обычно во второй половине беременности. Для сохранения беременности осуществляют лазеркоагуляцию плацентарных анастомозов, периодическое амниодренирование, окклюзию пуповины более пострадавшего плода для сохранения другого.
МКБ-10

Общие сведения
Синдром фето-фетальной трансфузии встречается исключительно при монозиготной двойне (крайне редко - тройне), когда близнецы объединены общим хорионом. Официальная статистика свидетельствует, что это осложнение возникает у 17,5% женщин, беременность которых носит монохориальных характер. Ряд исследователей полагает, что встречаемость синдрома значительно выше, однако часто он приводит к самопроизвольному аборту на ранних сроках вынашивания ребенка («скрытая смертность»). Уровень перинатальной смертности при ФФТС высокий и в некоторых регионах достигает 65-100%, примерно 12-15% всех случаев внутриутробной гибели при многоплодной беременности обусловлено этим состоянием.
Причины
Морфологической предпосылкой для развития фето-фетального трансфузионного синдрома является наличие в хорионе анастомозов между сосудистыми сетями обоих плодов. При монохориальной беременности они выявляются в 60-90% и могут быть поверхностными и глубокими. Поверхностные вено-венозные и артерио-артериальные анастомозы способны транспортировать кровь в обоих направлениях (в зависимости от давления) и выравнивают объемы крови между близнецами. Строение глубоких анастомозов таково, что артериальная кровь, поступающая в котиледон плаценты из системы одного ребенка, переходит в венозную сеть другого. Предполагается, что превалирование количества глубоких сосудистых соединений в хорионе над числом поверхностных и становится причиной появления синдрома.
Факторы, приводящие к возникновению большего количества глубоких анастомозов, на сегодняшний момент неизвестны. Предполагается, что они возникают из-за патологии формирования плаценты «донора», в результате чего сосудистое сопротивление в ней растет, и формируются шунты, связывающие его с сосудами «реципиента». Обсуждается возможность влияния позднего разделения близнецов, тератогенных факторов, недостаточного кровоснабжения матки женщины. Выяснение точных причин ФФТС осложняется поздней диагностикой этого состояния и непредсказуемостью его появления.
Патогенез
Считается, что возникновение фето-фетального трансфузионного синдрома может произойти на разных сроках вынашивания, причем позднее возникновение осложнения благоприятней в прогностическом отношении. Иная точка зрения заключается в том, что предпосылки для ФФТС возникают еще на этапе разделения плодов (4-12 дни гестации), а выраженность и срок появления дальнейших нарушений зависит от количества глубоких анастомозов и степени дисбаланса кровообращения близнецов. Первоначально возникает простой переток крови от «донора» к «реципиенту», который не отражается на скорости развития и других характеристиках обоих плодов.
Уменьшение объема циркулирующей крови у близнеца-донора постепенно приводит к явлениям плацентарной недостаточности – внутриутробной гипоксии, задержке развития. Нарушается работа почек и снижается выделение мочи, что становится причиной уменьшения объемов мочевого пузыря и появления маловодия. Последний фактор оказывает влияние на скорость развития тканей легких, замедляя формирование дыхательной системы. При отсутствии лечения происходит внутриутробная гибель плода по причине гипоксии и тяжелого недоразвития основных органов и систем.
Близнец-реципиент при этом испытывает значительный прилив крови, уровень его ОЦК увеличивается, что повышает нагрузку на сердечно-сосудистую систему и почки. Это приводит к гипертрофии правых отделов сердца, общей кардиомегалии, внутриутробной недостаточности трехстворчатого клапана. Объем мочевого пузыря увеличивается, возникает многоводие. Изменение объема околоплодных вод у близнецов может быть незаметно в случае общего плодного пузыря (монохориальная моноамниотическая беременность). Внутриутробная или интранатальная смерть «реципиента» при отсутствии лечения наступает из-за пороков сердца и почек.
Классификация
Выделяют несколько степеней развития фето-фетального трансфузионного синдрома, основываясь на тяжести состояния плодов и разнице их основных показателей (КТР, объем околоплодных вод). По мере прогрессирования ФФТС нарушения беременности нарастают таким образом, что каждая стадия включает в себя патологии всех предыдущих этапов заболевания. Современная классификация выделяет пять стадий развития синдрома:
- 1 стадия. Ультразвуковыми исследованиями регистрируется только разница в объеме околоплодных вод между близнецом-донором (маловодие) и реципиентом (многоводие). Ранним следствием этого служит появление складок амниотической перегородки, что регистрируется уже на 11-17 неделе гестации (наиболее ранний признак ФФТС). В случае моноамниотической беременности 1-я стадия может не определяться.
- 2 стадия. На фоне разницы в объемах околоплодных вод у плода-донора не определяется наполнение мочевого пузыря, диагностируется его заметное отставание в развитии (КРТ и масса меньше более чем на 20%, нежели у «реципиента»). У последнего визуализируется значительный по объему и эхогенности мочевой пузырь.
- 3 стадия. Возникают прогрессирующие нарушения сердечно-сосудистой системы у обоих плодов, что проявляется изменением допплерометрической и эхокардиографической картины. У реципиента возникает кардиомегалия, недостаточность трехстворчатого клапана, расширение легочного ствола.
- 4 стадия. Развиваются признаки водянки плода-реципиента – отек всего тела, увеличение размеров печени, селезенки, накопление жидкости в полостях.
- 5 стадия. Диагностируется при внутриутробной смерти одного или обоих плодов.
Стадийность ФФТС не имеет четкой привязки к сроку беременности – при неблагоприятном и раннем развитии осложнения признаки 1-й стадии могут выявлять на 14-17 неделе. В акушерстве при синдроме считается важной границей срок в 25 недель гестации, так как появление нарушений ранее часто приводит к прерыванию беременности даже при лечении. Нередко принимается решение о сохранении только одного (более жизнеспособного) ребенка, тогда врачебное вмешательство может производиться в ущерб его близнецу.
Симптомы
Субъективных проявлений ФФТС не имеет, его обнаруживают при скрининговых ультразвуковых исследованиях. Беременные с такой патологией чаще, чем в норме, имеют гипертонус матки и другие состояния, угрожающие прерыванием вынашивания ребенка. Ряд исследователей допускает, что значительная часть самопроизвольных абортов при многоплодной беременности обусловлена ФФТС до его обнаружения. Осложнения патологии (внутриутробная смерть) могут проявляться болью в животе и груди, профузным маточным кровотечением либо появлением кровянистых выделений из влагалища. На поздних сроках признаком гибели близнецов является прекращение их движений (замирание).
Осложнения
Наиболее тяжелым осложнением синдрома фето-фетальной трансфузии является внутриутробная гибель обоих плодов. Отсутствие лечебных мер приводит к перинатальной смерти в 100% (при развитии ФФТС до 25-ти недель гестации) и в 80-90% - при его более позднем возникновении. Различные методы лечения повышают выживаемость как минимум одного ребенка. К осложнениям состояния также относят риск развития детского церебрального паралича у выживших детей - вероятность такого исхода колеблется от 5 до 20%. Редкими осложнениями является внутриутробная гибель плода с инфицированием или мумификацией трупа.
Диагностика
Обнаружение ФФТС происходит при плановом УЗИ беременной, уже при выявлении монохориальной многоплодной беременности женщина вносится в группу риска. УЗИ-признаки заболевания обнаруживаются после 16-й недели (крайне редко – после 11-12-й), затем для подтверждения диагноза и мониторинга состояния плодов назначают дополнительные методы исследования. С их помощью определяют прогностические перспективы фето-фетального трансфузионного синдрома и собираются данные для возможного лечения.
- УЗ-скрининг. При ФФТС особенно информативен во втором и третьем триместре. В зависимости от стадии с его помощью при этой патологии выявляют многоводие у реципиента (увеличение глубины наибольшего кармана вод, не соответствующее норме по сроку), увеличение размеров мочевого пузыря, на терминальных этапах – пороки развития органов и водянку (анасарку). У донора посредством УЗИ определяются маловодие (глубина кармана вод не более 20 мм), уменьшение размеров мочевого пузыря.
- Ультразвуковая фетометрия. У близнеца-донора возникает отставание в росте, несоответствие фетометрических показателей (лобно-затылочного размера, окружности головы, живота, грудной клетки, длины трубчатых костей скелета) сроку беременности. Разница в основных параметрах между плодами при ФССТ превышает 20%.
- Допплерометрия плода. Патологические изменения кровотока определяются с 3-й стадии ФФТС. К ним относят разницу систолодиастолического отношения в артериях пуповины плодов свыше 0,4, реверсный конечно-диастолический поток у донора. У плода-реципиента допплерометрия определяет аномальный венозный кровоток в пуповине, увеличение скорости потока крови в легочной артерии.
- Эхокардиография плода. Выявляет поздние проявления ФФТС, которые определяются у близнеца-реципиента. Это гипертрофия правых отделов сердца, кардиомегалия, недостаточность трехстворчатого клапана, уменьшение выброса правого желудочка.
Лечение ФФТС
Консервативное лечение ангиопротективными средствами и препаратами для коррекции микроциркуляции признано неэффективным и может использоваться только в качестве вспомогательной терапии. Аналогичной позиции специалисты придерживаются и в отношении гормональных (препараты прогестерона) и других лекарств, использующихся в акушерстве для сохранения беременности. Увеличивают выживаемость как минимум одного близнеца только методы фетальной хирургии:
Прогноз
Фето-фетальный трансфузионный синдром характеризуется неблагоприятным прогнозом – при отсутствии лечения и регулярного наблюдения у акушера-гинеколога это состояние практически всегда приводит к гибели плодов и самопроизвольному прерыванию беременности. Результативность хирургического вмешательства зависит от многих факторов: стадии развития ФФТС, срока беременности, наличия или отсутствия сопутствующих патологий у женщины. Довольно часто лечебные меры приходится производить в ущерб более пострадавшему ребенку для сохранения другого. Профилактика развития синдрома не разработана, так как неизвестны причины его возникновения.
Трансфузионный фето-фетальный синдром. Диагностика и механизмы развития фето-фетального синдрома
Трансфузионный фето-фетальный синдром возникает при монохориальной диамниотической беременности двойней и характеризуется несбалансированным обменом крови между системами плацентарной циркуляции двух плодов, который происходит через внутриплацентарные сосудистые анастомозы. Это может вызвать ухудшение состояния плодов вследствие диссоциации их развития вплоть до наступления гибели как «донора», так и «реципиента». Синдром впервые был описан F. Schatz в 1875 году.
Синонимы. «Соединенная» двойня. Этиология. Внутриплацентарные сосудистые анастомозы.
Риск рецидива. Неизвестен, но очень низок, учитывая незначительный шанс повторного развития монохориальной диамниотической двойни.
Распространенность. Фето-фетальная трансфузия осложняет развитие монохориальной двойни примерно в 13% случаев и в 17% является причиной перинатальной смертности при многоплодной беременности.
Диагностика. Эхографические критерии для установления диагноза синдрома фето-фетальной трансфузии основываются на обнаружении монохориального типа плацентации и визуализаци разделяющей плодовместилища амниотической мембраны, наличия одинакового пола у обоих плодов, развития во втором триместере беременности многоводия у плода-«реципиента» и маловодия у плода-«донора», при отсутствии других причин аномального изменения объема околоплодных вод, а также на основании выраженной диссоциации их развития.
Достоверным различием для установления диссоциации считается разница на уровне 20% и более между фетометрическими параметрами близнецов.
Другие признаки, которые могут наблюдаться, включают отсутствие визуализации мочевого пузыря у плода-«донора» и увеличение объема мочевого пузыря плода-«реципиента», патологические показатели систоло-диастолического отношения при допплерометрическом исследовании кровотока в артериях пуповины, водянку или застойную сердечную недостаточность любого из близнецов (чаще регистрируется у плода-«реципиента»). Более легкие формы синдрома бывает трудно диагностировать вследствие отсутствия единых критериев, однако при обнаружении различий в объеме околоплодных вод следует заподозрить наличие фето-фетального трансфузионного синдрома.
Разделение после 12-го дня приводит к формированию неразделившихся близнецов. Если два плода имеют одну плаценту, между их системами циркуляции возникают сосудистые анастомозы, которые могут быть трех типов: вено-венозные, артериоартериальные и артериовенозные. Если имеется сбалансированный обмен крови, то фетофетальной трансфузии не происходит даже в случаях, когда имеются множественные внутриплацентарные сосудистые соединения.
Плаценты при беременности, осложненной фетофетальным трансфузионным синдромом, имеют меньшее количество анастомозов, которые преимущественно бывают одиночными и имеют выраженный артериовенозный тип по сравнению с плацентами при двойнях без трансфузионного синдрома. Если происходит перераспределение крови, то у близнеца-«донора», или «насоса», возникает гиповолемия вследствие потери крови.
В результате плацентарной недостаточности развивается гипоксия, которая является причиной задержки внутриутробного развития. Снижение перфузии почек приводит к маловодию. Этот последний признак, когда он проявляется в тяжелой форме, создает классическую эхографическую картину, характерную для «соединенных» близнецов: амниотическая полость плода-«донора» становится слишком маленькой, амниотическая оболочка непосредственно прилегает к поверхности его тела, и он начинает выглядеть «зажатым» мышечными стенками матки. Гиперволемия с повышенной перфузией почек приводит к многоводию у плода-«реципиента».
Поскольку отсутствует потеря белков и клеточных компонентов из их систем циркуляции, то под воздействием разницы коллоидного осмотического давления вода проникает из материнского сосудистого русла через плаценту, поддерживая тем самым порочный круг развития гиперволемии, полиурии и гиперосмолярности, что приводит к застойной сердечной недостаточности, водянке и многоводию.
При наиболее тяжелых формах установление диагноза не должно вызывать затруднений: единая плацента, выраженное многоводие плода-«реципиента», окруженный стенками матки плод-«донор» сосниженной двигательной активностью и явные признаки диссоциации их развития.
Менее тяжелые формы, как уже упоминалось, диагностировать значительно сложнее вследствие отсутствия единых критериев, однако подозрение о фето-фетальной трансфузии должно возникать во всех случаях, когда обнаруживаются различия в количестве околоплодных вод в амниотических полостях независимо от наличия различий между массами плодов. Было показано, что разница гемоглобина в крови, определяемая путем выполнения кордоцентеза у близнецов, превышающая 2,4 г/дл, соответсвует наличию трансфузионного синдрома.
а) Терминология:
1. Сокращения:
• Синдром фето-фетальной трансфузии (СФФТ)
2. Определения:
• Осложнение беременности монохориальной двойней, вызванное внутриутробной трансфузией крови от плода-донора к плоду-реципиенту через артериовенозные анастомозы плаценты
• Стадия СФФТ определяется объемом амниотической жидкости, размерами мочевого пузыря, показателями допплерометрии и наличием водянки плода
б) Лучевая диагностика:
1. Критерии диагностики:
• Монохориальная двойня
• Маловодие одного плода + многоводие другого:
о Наблюдается только при беременности МДД; диагностика СФФТ моноамниотической двойни затруднена
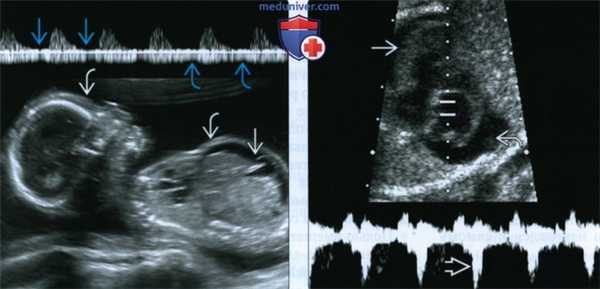
(Слева) СФФТ IV стадии. Длительно существующее шунтирование крови от плода-донора к плоду-реципиенту приводит к перегрузке объемом, в результате которой развивается водянка плода. Определяются утолщение кожи и асцит. Кроме того, обнаружены нарушения при допплеровском исследовании сосудов пуповины: нулевой конечный диастолический кровоток и пульсирующий кровоток в ПВ.
(Справа) Другой случай. Импульсная допплерография. У плода-реципиента определяются признаки сердечной декомпенсации: регургитация ТК, утолщение миокарда и перикардиальный выпот.
2. УЗИ при синдроме фето-фетальной трансфузии:
• Плод-донор:
о Маловодие - длина МВК о Признак «кокона» - выраженное маловодие, малые размеры и фиксированное положение плода-донора:
- Крайнее проявление признака — плод-донор плотно обернут плодными оболочками и «подвешен» к стенке матки подобно кокону
- Плод-донор может баллотировать в плодном пузыре плода-реципиента
- Определяется различная эхогенность околоплодных вод; гиперконцентрация мочи плода-донора → гиперэхогенность околоплодных вод
о Гиперэхогенность кишечника является признаком гипоксии плода-донора
о Нарушения по результатам допплерометрии ПА:
- Нулевой конечный диастолический кровоток или ретроградный конечный диастолический кровоток
• Плод-реципиент:
о Многоводие - длина МВК >80 мм в 100 мм в >20 нед.
о Нарушения по допплерометрии венозного протока или ПВ:
- Венозный проток: повышение пульсативности либо реверсный кровоток в венозном протоке в фазу сокращения предсердий
- ПВ: пульсирующий кровоток:
Отражает угрозу развития водянки плода
о Кардиомиопатия вследствие перегрузки объемом:
- Кардиомегалия, регургитация ТК, нарушение функции желудочков, бивентрикулярная гипертрофия миокарда
о Атрезия и стеноз легочной артерии - до 9,6% случаев:
- Изолированный стеноз легочной артерии наблюдается в 0,2% случаев неосложненной беременности МДД и в 2,9% случаев СФФТ с выполнением лазерной коагуляции
- Согласно результатам исследования серии случаев от 2015 г., после лазерной коагуляции в 18% случаев происходил регресс, в 65% потребовалось выполнение дилатации клапана у новорожденного
• Дискордантный рост плодов не является обязательным признаком СФФТ:
о В исследовании серии случаев СФФТ критерии селективной ЗРП соблюдались только у 20% плодов-доноров
• Возможно различие размеров пуповин: у плода-реципиента пуповина крупнее, чем у плода-донора
3. Рекомендации по лучевой диагностике:
• Во всех случаях беременности монохориальной двойней выполняют измерение МВК каждые 2 недели начиная с 16 нед.
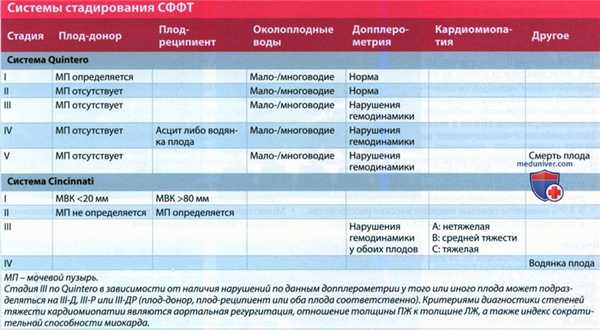
• Тактика лечения определяется стадией СФФТ:
о Существует несколько подходов к стадированию; общепринятой является система Quintero о Серьезное значение имеет ЭхоКГ плодов:
- Заболеваемость пороками сердца при СФФТ в 15-23 раза выше, чем при одноплодной беременности
- Заболеваемость среди плодов с СФФТ в 2,8 раза выше, чем среди монохориальных двоен без СФФТ
о В системе Cincinnati объединены система Quintero и данные ЭхоКГ, поскольку в 50-60% случаев СФФТ I и II стадий по Quintero отмечается дисфункция сердца
о В исследовании СФФТ, проведенном Национальными институтами здравоохранения США, показано, что наибольшей прогностической ценностью в отношении смерти плода-реципиента обладают ЭхоКГ-признаки кардиомиопатии
• Для диагностики синдрома анемии-полицитемии после выполнения лазерной коагуляции анастомозов измеряют ПСС кровотока в средней мозговой артерии:
о Хроническое шунтирование через небольшие артериовенозные анастомозы, не связанное с асимметрией околоплодных вод
о ПСС кровотока в средней мозговой артерии >1,5 МоМ (кратное медианы) у одного плода,

(Слева) В основе стадирования СФФТ лежат нарушения гемодинамики, выявляемые с помощью допплерометрии. СФФТ, стадия III-Д. У плода-донора (А) отмечаются нулевой и ретроградный конечный диастолический кровоток, а также пульсирующий кровоток в ПВ. Гемодинамика в пуповине у плода-реципиента (В) не нарушена.
(Справа) Макрофотография плаценты от беременности, осложненной СФФТ. Определяются крупные артериовенозные анастомозы (артерии плода-донора, вены плода-реципиента. Данные глубокие анастомозы на поверхности плаценты граничат «лицом к лицу».
в) Дифференциальная диагностика синдрома фето-фетальной трансфузии:
1. Преждевременный разрыв плодных оболочек одного плода:
• Диагностированная дихориальная беременность позволяет исключить СФФТ
2. Аномалии развития плода, напоминающие признак «кокона»:
• У здорового плода отсутствуют высокий сердечный выброс и многоводие
3. Селективная ЗРП:
• Разница ПМП >20%
• Возможно маловодие меньшего плода
• Объем амниотической жидкости у нормально развивающегося плода соответствует норме
(Слева) Лечение СФФТ с помощью эндоскопической лазерной коагуляции анастомозов плаценты. Доступ к плаценте осуществлен через амниотический мешок плода-реципиента, содержащий значительный объем околоплодных вод. Слева на рисунке находится плод-донор (признак «кокона»).
(Справа) В данном случае лазерная коагуляция по поводу СФФТ была выполнена за 16 нед. до родов. Сосудистый экватор плаценты лишен анастомозов в результате «дихорионизации».
г) Патологоанатомические особенности:
1. Общие сведения:
• Этиология:
о СФФТ возникает при наличии асимметричного артериовенозного шунтирования между плодами
о Одновременно могут существовать поверхностные и глубокие анастомозы:
- Поверхностные: между ветвями сосудов пуповины на поверхности плаценты
Артерио-артериальные (А-А) или вено-венозные (В-В) шунты; двунаправленный кровоток
- Глубокие: однонаправленный артериовенозный кровоток - ПА плода-донора проникает в плаценту, крово-снабжает котиледоны, кровь из которых сбрасывается в ПВ плода-реципиента:
Артерии и вены граничат «лицом к лицу»
Отличаются от нормальных парных сосудов; отчетливо визуализируются для селективной лазерной коагуляции
2. Стадирование, градация и классификация синдрома фето-фетальной трансфузии:
• Чаще всего применяется система Quintero; в других системах используется дополнительный критерий - данные ЭхоКГ
• Шкала сердечно-сосудистого профиля:
о Баллы начисляются в зависимости от наличия водянки плода, показателей допплерометрии венозного протока/ПВ/ПА, величины кардиоторакального индекса, сердечной функции (систолической функции желудочков) и наличия регургитации АВ-клапана
• Шкала детской больницы Филадельфии:
о Баллы начисляются в зависимости от четырех показателей допплерометрии и девяти показателей ЭхоКГ (размеры сердца, функции желудочков и клапанов, допплеровское исследование вен, размеры магистральных артерий, недостаточность клапана легочной артерии и др.)
д) Клинические особенности:
1. Клиническая картина:
• Монохориальная двойня с асимметрией объема амниотических полостей
2. Демографические особенности:
• СФФТ осложняет 10-15% случаев беременности монохориальной двойней:
о Синдром анемии-полицитемии после лазерной коагуляции возникает в 2-13% случаев СФФТ
• Синдром анемии-полицитемии возникает спонтанно в 3-5% случаях беременности монохориальной двойней в III триместре
3. Естественное течение и прогноз:
• Раннее начало и поздняя стадия СФФТ связаны с неблагоприятным прогнозом
• Лазерная коагуляция сосудов плаценты (ЛКСП):
о Выживаемость после выполнения лазерной коагуляции - 55-82,5% (выживаемость как минимум одного плода - 73-90,5%):
- Рецидивирование - 0-16%; прогрессирование - 1,4-14% (возможно повторное выполнение ЛКСП)
- Синдром анемии-полицитемии - 2-13% случаев
- С увеличением опыта применения отмечается улучшение исходов
о Медианный ГВ на момент рождения - 34 нед.
• Исходы ЛКСП в зависимости от стадии:
о Стадия I: выживаемость обоих плодов - 75,9%; выживаемость как минимум одного плода - 93,1%:
- Стабильное состояние или регресс без инвазивного вмешательства >75%
о Стадия II: выживаемость обоих плодов — 60,5%; как минимум одного — 82,7%
о Стадия III: выживаемость обоих плодов - 53,8%; как минимум одного - 82,5%
о Стадия IV: выживаемость обоих плодов - 50%; как минимум одного - 70%:
- Риск потери беременности, преждевременных родов после ЛКСП - 7%
о Укорочение шейки • Повреждение ЦНС диагностируют у 5-23% выживших детей, чаще при гибели одного из плодов
• Цереброплацентарное соотношение: пульсационный индекс средней мозговой артерии/пульсационный индекс ПА:
о Значение • Исследование с последующим наблюдением (до 6 лет) за 190 детьми:
о У 79,5% при осмотре и по результатам нейропсихологи-ческого тестирования отклонений не выявлено
о У 11,6% выявлены незначительные неврологические расстройства и нормальные результаты тестирования
о У 8,9% выявлены тяжелые неврологические расстройства и/или результат тестирования на 2 СО ниже среднего
4. Лечение синдрома фето-фетальной трансфузии:
• При сроке беременности от 24 нед. 0 дней до 33 нед. 6 дней и ≥III стадии СФФТ либо запланированном ЛКСП показано введение кортикостероидов
• Методом выбора при лечении СФФТ II—IV стадий при развивающейся беременности на сроке о Вопрос о необходимости лечения I стадии дискутабелен, поскольку в большинстве случаев состояние стабилизируется без каких-либо вмешательств
• Терапевтическое окно: 16-25 нед. (при условии высокой квалификации хирургов - 15-29 нед.):
о Как правило, выполняется селективная коагуляция анастомозов сосудистого экватора плаценты
о Некоторые хирурги сначала производят последовательную коагуляцию артериовенозных анастомозов донор-реципиент, затем - анастомозов реципиент-донор
• Техника Соломона заключается в коагуляции плаценты на отрезках, соединяющих соседние коагуляционные зоны, благодаря чему достигается «дихорионизация» экватора:
о Более высокий уровень выживаемости обоих плодов к 6 мес. (68,4% против 50,7%)
о Более низкий риск рецидивирования и развития синдрома анемии-полицитемии
• Мониторинг в отношении развития послеоперационного синдрома анемии-полицитемии
Редактор: Искандер Милевски. Дата обновления публикации: 12.11.2021
Читайте также:
