Диагностика лекарственной тромбоцитопенической пурпуры - лечение
Добавил пользователь Morpheus Обновлено: 27.01.2026
Тромботическая тромбоцитопеническая пурпура - клиника, диагностика
Тромботическая тромбоцитопеническая пурпура описана давно под названием болезни Moscowitz и характеризуется триадой: гемолитической анемией микроангиопатического характера, тромбоцитопения и неврологические признаки с повторными рецидивами по поводу различно локализированных поражений на уровне центральной нервной системы. Сосудистые поражения, капиллярные и артериальные принимают характер некрозирующей ангиопатии с тромбозирующими гиалинизациями в почечных гломерулах, в селезенке и в центральной нервной системе.
Гистопатологические исследования уяснили актуальную патогенетическую концепцию, без точного утверждения однако разрешающих этиологических факторов.
Возможно, что вирусная или микробная инфекция альтерирует первоначально посредством иммунных комплексов сосудистый эндотелий и этим путем вызывает явления внутрисосудистой диссеминированной коагуляции с гемолизом и тромбоцитопенией.
Но возможно также, что первоначально происходит внутрисосудистый гемолиз с высвобождением тромбопластиновых факторов, вызывающих внутрисосудистую диссеминированную коагуляцию и со судистые повреждения, благодаря которым самоподдерживается микроангиопатический гемолиз и далее самоподдерживание диссеминированного внутрисосудистого свертывания со своим эффектом снижения тромбоцитов и активации коагулирующих факторов, как это было доказано при помощи электронной микроскопии и исследований по иммунохимическому анализу (Brain и сотр.).
Констатируется характерное отложение ацидофильного PAS-положительного материала в стенках сосудов, под эндотелиях, а также и в просвете заполненным тромбусом. Тинкториальные реакции оказываются специфическими для материала коагулированного с фибрином благодаря действию иммунных комплексов; однако не было найдено воспалительных клеточных реакций вокруг или в стенках, как при узелковом периартериите. Идентифицируются однако, но без присутствия комплемента (Feldman и сотр., Craig и Gitlin).
На электронном микроскопе можно увидеть наряду с фибриллярным материалом коагулированного фибрина, аггрегированные гематии, тромбоциты и лейкоциты. Поражения отличаются с трудом от поражений при других синдромах с ДВС и встречаются в любом органе, в том числе в сердце, надпочечных и поджелудочной железах.
Гистологические исследования в костном мозге показали характерные поражения сосудов в 50% случаев, а также и в лимфатических ганглиях, поражения являющимися диагностическим методом intra vitam.
Мышечные поражения бывают реже и не могут служить методом для диагноза. Спленические поражения в исследованных случаях после спленектомии являются весьма характерными из-за процесса внутрисосудистой коагулятции в тромбозированных артериолах.

Экспериментальные исследования воспроизвели характерные поражения посредством методов вызывания сосудистого гемолизиса с порождением явления ДВС (Rabiner и сотр., Rubenberg и сотр.). Это явление происходит вероятно на почве местного дефицита активации плазминогена, благоприятствующего внутрисосудистой коагуляции (Kwaan и сотр.), или высвобождению тромбоцитарного Fe4 вызывающего эндотелиальные поражения и детерминирующего добавочно образование сгустков (Niewiarowski и сотр.).
То обстоятельство, что тромботическая тромбоцитопеническая пурпура может появляться как серьезное осложнение в эволюции красной волчанки, узелкового периартериита и синдрома Сжёгрена, как утверждает Aster, является аргументом в пользу патогенетического механизма автоиммунного заболевания. Однако не нашлись антитромбоцитарные и антиэритроцитарные антитела, что говорит о том, что поражение этих клеток является вторичным в рамках сложного процесса красной волчанки. Однако, в крови больных удалось выделить инфекционные агенты как вирусы и Pseudobarthonela (Mettler).
Клинические симптомы характерны в острой форме, которая в то же время и самая обычная; за короткое время появляются симптомы гемолитической анемии и желтуха, тромбоцитопеническая пурпура и признаки характерной нервной затронутости: парестезии или параплегии, которые эволюируют вплоть до потери сознания и комы. Лихорадка появляется с самого начала в большинстве случаев, как при больших церебральных поражений, вероятно по поводу поражений в гипоталамусе. Диффузные микротромбозы в абдоминальных сосудах детерминируют ложную картину острого панкреатита, острого холецистита, инфаркта мезентера или даже острого живота, которые требуют срочной лапаротомии, как в некоторых случаях красной волчанки или узелкового периартериита, находившихся под нашим наблюдением (Berceanu и сотр.).
Возможны появления коронарных поражений с нарушениями ритма и блокада ножки гиссова пучка. Характерна почечная затронутость с признаками очагового гематурического нефрита или с тяжелыми признаками некротизирующих кортикальнопочечных поражений с артериальной гипертензией и анурией по поводу острой почечной недостаточности (Dunea).
Лабораторные исследования показывают признаки ДВС с микроангиопатической гемолитической анемией на основании модификаций периферических эритроцитов. Aster утверждает, что без этих модификаций нельзя подозревать синдром тромботической тромбоцитопенической пурпуры. Hb быстро спадает ниже 5 г, а ретикулоциты повышены, как при остром гемолизе со значениями выше 20%. Возрастает косвенный билирубин у более чем 90% случаев, но тест Кумбса бывает редко положительным. Острый гемолиз сопровождается значительной миэлопролиферативной реакцией в костном мозге, обусловливая и повышенный лейкоцитоз, иногда с лейкемическими цифрами и постоянно фрагментированными эритроцитами.
Тромбоциты спадают вначале, оставаясь на уровне 10 000—50 000, благодаря сокращению продолжительности жизни до нескольких часов. Сокращение продолжительности жизни до нескольких дней обычное явление и для эритроцитов.
Признаки почечного поражения выступают посредством уремического синдрома с гематурией и протеинурией, с гиперкреатинемиеи в соответствии с тяжестью поражений, сильно возрастая в терминальном периоде тяжелых случаев.
Исследования по коагуляции проводились меньше и кажутся менее характерными. Хотя и существует синдром ДВС, в комплексе Квика слегка понижен лишь F.V и в некоторых случаях фибриноген.

В 10—20% случаях выявляются положительные тесты люпусного заболевания, а в почках находятся гломерулитные поражения, характерные для этого заболевания. Кроме этого в сыворотке появляются ложноположительные тесты на люэс. Возможно, что в этих случаях существует собственно люпусное заболевание, осложненное тромботической тромбоцитопенической пурпурой, особенно когда биологические тесты на красную волчанку персистируют и после исчезновения острого эпизода тромботической тромбоцитопенической пурпуры и (Amarosi u Ultman).
Эволюция и прогноз в исследованных случаях до современных методов лечения считались тяжелыми со смертельным исходом не более чем за 3 месяца более чем в 2/3 случаев. Большинство больных из 275 описанных до 1966 г. случаев в реферате Amarosi и Ultman скончались даже за несколько недель. Около одной трети случаев эволюирует в подострой форме до одного года или даже принимают аспект хронической эволюции, продолжающейся несколько лет. После 1966 г. благодаря современным методам лечения, цитируются многие случаи с длительным выживанием, некоторые с рецидивами, но другие с аспектом полного излечения.
Современная терапия явно изменила эволюцию и прогноз. Aster, предпринявший синтетический обзор опубликованных случаев, полагает, что диагноз надо оценивать только начиная с этого времени, после применения комбинированной терапии большими дозами предни-сона и спленектомии. Прежние методы трансфузий тромбоцитов считаются бесполезными или даже опсаными, так как подвоз тромбоцитов отягощает тромбозы в процессе ДВС. Гепаринотерапия и фибринолитические агенты, как перфузии стрептокиназы давали по-видимому хорошие результаты, но не существует статистического учета полностью оправдывающего эти лечения в комбинации с кортикотерапией или без нее.
Существуют случаи с большими или очень большими дозами преднисона, до 200— 300 мг/день совместно с высокими дозами гепарина. Кортикотерапия остается главным терапевтическим показанием. Лечение начинается с 100 мг ежедневно возрастая до нескольких сот мг; сразу же после уточнения диагноза рекомендуется спленектомия. Ее следует произвести до появления церебральных поражений и острой почечной недостаточности. В 13 случаях, анализированных Астером, которые не ответили на кортикотерапию, спленектомия дала явные и прочные ремиссии. В случаях, находившихся под наблюдением Бухарестской Клиники Гематологии (A. Colita и сотр.) были также получены скорые ремиссии после спленектомии. Смертельные рецидивы в случаях с ремиссиями после спленектомии встречались редко до сих пор.
Другими терапевтическими показаниями антикоагулирующего характера являются аспирин и пирамидон, оказывающие аггрегационное действие на тромбоциты. Их можно назначать во время ремиссий, с профилактической целью или при хронических формах.
Хорошие результаты спленэктомии являются аргументом в пользу иммунной природы болезни; благодаря элиминации селезенки устраняется орган богатый иммунной тканью, производящей антитела, а также и орган максимального лизиса гематий с высвобождением тромбопластина — причины ДВС.
Правильное диагностицирование увеличило частоту случаев и позволило оценить полученные результаты. Сомнительную ценность имеют повидимому антикоагуляционные и антиаггрегационные лечения, в то время как плазмотерапия, экссангвинотрансфузия, но в особенности трансфузия и замена плазмы дают повидимому наилучшие результаты в течение острого периода болезни (Pisciotta и сотр.). Рекомендуется плазматический замен в объеме 80—100 мл/кг веса тела, с 2—3-кратным повторением. Хороший эффект интерпретируется по-разному, либо благодаря элиминации и дилюции агрессивного фактора для тромбоцитов и сосудистой стенки (Taft), либо благодаря защитному подвозу нормальной плазмы (Bukowski и сотр.).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Диагностика лекарственной тромбоцитопенической пурпуры - лечение
С клинической точки зрения, пурпура у сенсибилизированного по поводу ранее использованного медикамента появляется спустя несколько часов, до 24 часов после последнего применения. Исключением является пурпура по поводу солей золота, которая может появляться даже через месяц после применения, имея в виду долговременную персистенцию сенсибилизирующего антигена. Симптомы имеют в основном характер анафилактического заболевания с ознобой, лихорадкой, мышечносуставными болями и даже рвотами и болезненным состоянием с гипотензией.
Вначале может появляться гистаминовый уртикарный "rash", вслед за которым или одновременно появляется общая пурпурная петехиальная сыпь. В суровых формах с падением тромбоцитов ниже 5000 происходят желудочнокишечные кровотечения, гематурия, метрорагии у женщин и, редко, менингоцеребральные геморрагии, как и при идиопатической тромбоцитопенической пурпуре. Если введение сенсибилизирующего медикамента прерывается, за 3—6 дней пурпура и геморрагические явления исчезают, так как большинство медикаментов элиминируется сравнительно быстро.
Как мы указывали выше, сыпь появляется поздно после сенсибилизации солями золота, которые элиминируясь медленно, способствуют поддерживанию пурпуры в течение месяцев.
После некоторых медикаментов, механизм сенсибилизации которых еще не выяснен, может появляться пурпура идиопатического характера, как идиопатическая тромбоцитопеническая пурпура, которая продолжается и после элиминации сенсибилизирующего медикамента.
Лабораторные исследования и некоторые клинические тесты in vivo уточняют диагноз тромбоцитопенической пурпуры по поводу сенсибилизации к медикаментам. В текущей практике применяются те же тесты, что и для диагноза пурпуры: подсчет тромбоцитов в рамках полной гемограммы, тест ретракции сгустка, миэлограмма с мегакариоцитограммой.
Все они показывают усиленный лизис тромбоцитов на периферии, как и при идиопатической тромбоцитопенической пурпуре, с медуллярным гиперпроизводством, причем мегакариоциты находятся в избытке с возросшими функциональными формами в абсолютных цифрах. Однако существуют безусловно и случаи с альтерацией мегакариоцитов благодаря непосредственному действию токсического вещества после определенных медикаментов, таких как мышьяковые производные, сульфамиды, фенил-бутазон, соли золота.
Диагноз сенсибилизации ставит своей целью выявление антител антимедикамент и иммунных комплексов антиген-антитело в сыворотке больного. Gynn и сотр. рекомендуют в особенности тест агглютинации, тест ингибирования ретракции сгустка из сыворотки больного, тест Карпаткина на высвобождение F3, реакция фиксирования комплемента.
С технической точки зрения, в той фазе, когда уже элиминировались иммунные комплексы или сенсибилизирующий медикамент, тесты in vitro оказываются положительными только в том случае, если в реакцию включается соответствующий медикамент. Тесты бывают непосредственно положительными если в сыворотке присутствуют иммунные комплексы, имеющие in vitro действие агглютинации, лизиса или фиксирования комплемента, а также и ингибирования ретракции сгустка.
Сыворотка с токсическими иммунными комплексами для тромбоцитов, меченных 51 Cr дает положительные реакции с высвобождением 51 Cr, аминокислот и кислотных фосфатаз, причем последние увеличены и в сыворотке.
Тесты in vivo для определения роли медикамента обычно бывают положительными в течение периода когда антитела персистируют в циркуляции или прикреплены в тканях. Так, поглощение или инъецирование малых доз медикамента вызывает сокращение тромбоцитов с пурпурой. Имея в виду тот факт, что невозможно знать дозы, вызывающие пурпуру для каждого больного и медикамента в отдельности, этот тест не рекомендуется, так как некоторые попытки дали весьма опасные пурпуры и геморрагии.
Можно производить тесты интрадермореакции, которые дают немедленные местные и общие положительные реакции с тромбоцитопенией, а иногда даже с пурпурой. Методы кожного переноса, как например классический тест Праушница-Кюнстера (Prauschnitz-Kunster), более не рекомендуются, так как существует опасность заболевания вирусным гепатитом.
Следует подчеркнуть, что некоторые близкие по структуре медикаменты не дают реакции перекрестной сенсибилизации. Так например, дигиталисные гликозиды и производные хинина и хинидина, являющиеся изомерами, первые левовращающиеся, вторые правовращающиеся, имеют разную антигенность.
Лечение пурпур по поводу сенсибилизации — этиологическое в том смысле, что применение медикамента следует прерывать, когда появляется пурпура или когда лабораторный анализ показывает тромбоцитопению. У некоторых больных, леченных долгое время аналгетиками, сульфамидами, надо исследовать время от времени тромбоцитопенизирующий эффект прерывая введение медикамента до возникновения клинических проявлений болезни.
При появлении пурпуры надо прекратить применение медикамента и ждать пока она пройдет без специального лечения. Если пурпура имеет суровый характер и сопровождается геморрагиями и не проходит за 6—10 дней, применяется кортизон, чтобы увеличить резистентность капилляров и смягчить токсический противотромбоцитарный эффект иммунных комплексов. Трансфузия тромбоцитов остается обычно безрезультатной в течение острого периода, так как они уничтожаются, как и тромбоциты больного постолько посколько персистируют антитела и иммунные комплексы.
При продолжительных пурпурах по поводу солей золота, которые персистируют долгое время в тканях, можно применять добавочно кодирующие медикаменты как EDTA.
Идиопатическая тромбоцитопеническая пурпура
1. Настоящий клинический протокол устанавливает общие требования к диагностике и лечению идиопатической тромбоцитопенической пурпуры и предназначен для оказания медицинской помощи пациентам старше 18 лет в стационарных и амбулаторных условиях организаций здравоохранения, имеющих в своем составе гематологические отделения или гематологические консультативные кабинеты.
2. Для целей настоящего клинического протокола используются основные термины и их определения в значениях, установленных в Законе Республики Беларусь от 18 июня 1993 года «О здравоохранении» в редакции Закона Республики Беларусь от 20 июня 2008 года (Ведамасцi Вярхоўнага Савета Рэспублiкi Беларусь, 1993 г., № 24, ст. 290; Национальный реестр правовых актов Республики Беларусь, 2008 г., № 159, 2/1460), а также следующие определения:
тромбоцитопения – снижение количества тромбоцитов в крови ниже 150 х 10[9]/л при нормальных границах значений 150–450 х 10[9]/л;
идиопатическая тромбоцитопеническая пурпура – заболевание, характеризующееся снижением уровня тромбоцитов ниже 100 х 10[9]/л и обусловленное выработкой антител к антигенам тромбоцитов. Наименование нозологической формы заболевания (шифр по Международной статистической классификации болезней и проблем, связанных со здоровьем, десятого пересмотра, принятой в 1989 году сорок третьей сессией Всемирной ассамблеи здравоохранения): D69.3 Идиопатическая тромбоцитопеническая пурпура.
3. По степени тяжести тромбоцитопении подразделяют на:
легкую тромбоцитопению – количество тромбоцитов в крови от 100 до 150 х 10[9]/л;
умеренную тромбоцитопению – количество тромбоцитов в крови от 50 до 100 х 10[9]/л;
тяжелую тромбоцитопению – количество тромбоцитов в крови менее 50 х 10[9]/л.
4. По длительности заболевания идиопатическую тромбоцитопеническую пурпуру подразделяют на:
впервые выявленная;
персистирующая – длительность заболевания от 3 до 12 месяцев (не достигшие ремиссии пациенты, рецидивы);
хроническая – длительность заболевания более 12 месяцев.
5. Патогенетически тромбоцитопении обусловлены ускоренным распадом или потреблением тромбоцитов, снижением их продукции, секвестрацией (депонированием) тромбоцитов.
5.1. Ускоренное разрушение или потребление тромбоцитов, встречается у пациентов: с иммунными тромбоцитопениями (идиопатические тромбоцитопении (далее – ИТП)); симптоматическими тромбоцитопениями (тромбоцитопения при системной красной волчанке); при диссеминированном внутрисосудистом свертывании; при возникновении микроангиопатических синдромов (HELLP-синдром, тромботическая тромбоцитопеническая пурпура, гемолитический уремический синдром); гестационная тромбоцитопения.
5.2. Снижение образования тромбоцитов (сопровождается уменьшением количества мегакариоцитов в костном мозге) встречается у пациентов с лейкозами, при апластической анемии, при дефиците фолиевой кислоты, при приеме лекарственных средств, при вирусных инфекциях.
5.3. Секвестрация (депонирование) тромбоцитов – накопление тромбоцитов в увеличенной селезенке пациента. Наблюдается при циррозах, лимфомах, болезни Гоше и других.
Диагностика
ДИАГНОСТИКА ИДИОПАТИЧЕСКОЙ ТРОМБОЦИТОПЕНИЧЕСКОЙ ПУРПУРЫ
6. Первичная диагностика ИТП проводится в организациях здравоохранения врачами различных специальностей.
6.1. Диагностическими критериями постановки диагноза ИТП являются:
снижение количества тромбоцитов в общем анализе крови;
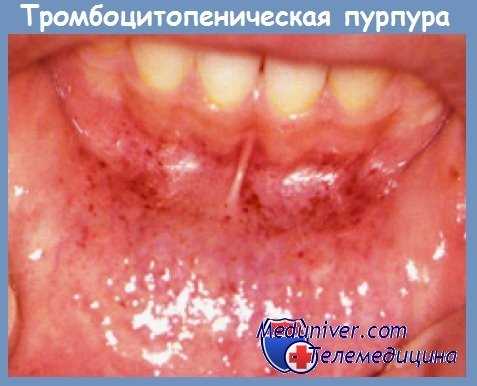
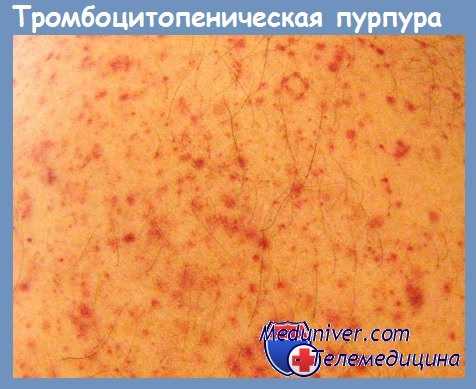
появление петехиально-пятнистой кровоточивости на кожных покровах и слизистых.
6.2. Верификация диагноза ИТП и дифференциация с вторичными тромбоцитопениями осуществляется в организациях здравоохранения, имеющих в своем составе гематологические отделения или гематологические консультативные кабинеты.
7. К группе риска развития вторичных тромбоцитопений относятся пациенты со следующими патологическими состояниями:
наличие заболевания, вызванного вирусом иммунодефицита человека, наличие вирусного гепатита, других инфекций, а также аутоиммунных заболеваний, иммунодефицитных состояний, лимфопролиферативных заболеваний, после вакцинации;
заболевания печени (включая алкогольный цирроз печени);
прием лекарственных средств (нестероидные противовоспалительные лекарственные средства, противотуберкулезные лекарственные средства, противоопухолевые лекарственные средства), злоупотребление алкоголем, употребление хинина (в том числе в напитках);
заболевания крови (миелодиспластический синдром, лейкемии, фиброз костного мозга, апластическая анемия, мегалобластная анемия, метастатическое поражение костного мозга);
трансфузии компонентов крови (посттрансфузионная пурпура);
врожденная тромбоцитопения (синдромы Вискота Олдрича, Бернара Сулье, тип IIb болезни Виллебранда и другие).
8. Клиническая картина ИТП.
8.1. Клиническим проявлением ИТП является только геморрагический синдром по типу петехиально-пятнистой кровоточивости.
8.2. Наличие выраженной спленомегалии свидетельствует о вторичной тромбоцитопении.
8.3. Лихорадка, потеря массы тела, гепатомегалия, лимфаденопатия свидетельствуют о возможном наличии ВИЧ-инфекции, системной красной волчанки, лимфопролиферативного заболевания как причин вторичной тромбоцитопении.
9. Обязательная диагностика:
9.1. общий анализ крови:
для ИТП характерна изолированная тромбоцитопения без изменений со стороны других ростков кроветворения;
для ИТП нехарактерны изменения морфологии клеток крови и лейкоцитарной формулы. Изменения морфологии клеток крови и лейкоцитарной формулы определяются при вторичной тромбоцитопении: шизоциты при тромботической тромбоцитопенической пурпуре и гемолитико-уремическом синдроме; увеличенное количество гигантских тромбоцитов или малых тромбоцитов при врожденной тромбоцитопении, наличие агрегатов тромбоцитов в мазках крови – в пользу псевдотромбоцитопении, связанной со стабилизацией крови этилендиаминтетрауксусной кислотой;
9.2. цитологическое исследование мазка костного мозга (подсчет формулы костного мозга) или гистологическое исследование препарата костного мозга для исключения причин вторичной тромбоцитопении у пациентов с симптомами системного заболевания кроветворной ткани, а также для обоснования целесообразности выполнения спленэктомии;
9.3. для исключения вторичной тромбоцитопении клинически неотличимой от ИТП проводится исследование на наличие: антител к вирусам иммунодефицита человека (HIV); гепатита С (анти-HCV); антигена вируса гепатита В (HBsAg);
9.4. для исключения наследственных иммунодефицитных заболеваний, как причин вторичной тромбоцитопении проводится количественное определение сывороточных иммуноглобулинов;
9.5. для диагностики аутоиммунной гемолитической анемии и в случае предполагаемой терапии анти-D-иммуноглобулином проводится прямая проба Кумбса.
10. Дополнительная диагностика:
проведение скрининговых тестов на антифосфолипидный синдром;
определение антитиреоидных антител и функции щитовидной железы:
исследования по особым показаниям: количественное или качественное определение ДНК (РНК) вирусов гепатита А, В, С, D, G; ДНК цитомегаловируса; вируса Эпштейн-Барр; антител к вирусам гепатита В (анти-HBsAg) и другим вирусам или бактериям.
Лечение
ЛЕЧЕНИЕ ИДИОПАТИЧЕСКОЙ ТРОМБОЦИТОПЕНИЧЕСКОЙ ПУРПУРЫ
Лечение ИТП проводится в организациях здравоохранения, имеющих в своем составе гематологические отделения или гематологические консультативные кабинеты.
11. При определении показаний к началу терапии ИТП учитывают:
выраженность кровоточивости;
наличие сопутствующих заболеваний (артериальная гипертензия, сахарный диабет, хроническая сердечно-сосудистая недостаточность, ожирение, остеопороз и другие);
возможные осложнения планируемой терапии;
профессиональные риски травматизации;
толерантность к побочным эффектам предлагаемой терапии;
необходимость оперативных вмешательств;
мотивацию пациента к лечению;
употребление лекарственных средств, которые могут спровоцировать кровоточивость на фоне тромбоцитопении (непрямые антикоагулянты, противовоспалительные лекарственные средства, ненаркотические анальгетики);
возраст пациента (старше 60 лет);
кровотечения в анамнезе.
12. Лечение не показано пациентам с уровнем тромбоцитов в общем анализе крови более 50 х 10[9]/л при отсутствии кровоточивости, обусловленной дисфункцией тромбоцитов, травмами, оперативными вмешательствами, сопутствующими заболеваниями, антикоагулянтной терапией.
13. Терапия первой линии (начальная терапия для впервые выявленных пациентов).
13.1. Стандартная начальная терапия.
13.1.1. Кортикостероиды для системного применения в одном из следующих вариантов:
дексаметазон в дозе 40 мг/сутки, перорально в 1 прием в течение 4 дней, 1–4 дни цикла с интервалом 14–28 дней, 3–4 цикла;
метилпреднизолон в дозе 30 мг/кг/сутки внутривенно в виде 1 часовой инфузии в течение 3 дней. Снижение дозы ступенчато 20 мг/кг/сутки внутривенно 4–6 дни, 10 мг/кг/сутки внутривенно 7–9 дни с переходом на пероральный прием преднизолона в дозе 1 мг/кг/сутки;
преднизолон в дозе 0,5–2 мг/кг/сутки перорально до подъема уровня тромбоцитов выше 30–50 х 10[9]/л. При достижении эффекта необходимо быстрое снижение дозы вплоть до его отмены. При отсутствии эффекта продолжительность терапии преднизолоном не должна превышать 4 недель.
13.1.2. Иммуноглобулин человека нормальный (для внутривенного введения): для исходного лечения используется доза 0,4 г/кг, вводимая 5 дней подряд или от 0,4 до 1 г/кг однократно, или в течение 2 последовательных дней. При необходимости в дальнейшем можно вводить 0,4 г/кг с интервалами от 1 до 4 недель для поддержания достаточного уровня тромбоцитов.
Ответ на терапию достигается в течение от 24 часов до 2–4 дней от начала. Эффект транзиторный, уровень тромбоцитов в общем анализе крови пациента возвращается к исходному уровню в течение 2–4 недель.
Для пациентов с дефицитом иммуноглобулина А обязательны лекарственные средства с минимальным содержанием иммуноглобулина А (не более 0.2 мг/мл).
14. Ургентная терапия. Показания к экстренному восстановлению гемостатически достаточного уровня тромбоцитов возникают при необходимости оперативных вмешательств, угрозе или развитии кровотечения в центральную нервную систему, желудочно-кишечный тракт, мочевыделительную систему.
14.1. Для остановки кровотечения применяют введение высоких доз иммуноглобулина человеческого нормального (для внутривенного введения) – 1 г/кг, в том числе в сочетании с кортикостероидами.
14.2. Высокие дозы метилпреднизолона 30 мг/кг/сутки внутривенно в виде 1 часовой инфузии.
14.3. Применение с гемостатической целью трансфузии донорских тромбоцитов, а также экстренная спленэктомия.
14.4. Мероприятия общего порядка: отмена лекарственных средств, снижающих функцию тромбоцитов; медикаментозное прекращение менструации; минимизация травматичности оперативного вмешательства; применение ингибиторов фибринолиза для предупреждения рецидивирующих кровотечений, кровотечений при проведении оперативного вмешательства и лечении зубов: аминокапроновая кислота по 1–4 г каждые 4–6 часов (до 24 г в сутки) внутрь.
15. Терапия второй линии. При неэффективности применения кортикостероидов и иммуноглобулина человеческого нормального (для внутривенного введения) переходят к терапии второй линии.
15.1. Спленэктомия является методом выбора в рамках терапии второй линии. Спленэктомию выполняют не ранее, чем через 6 месяцев после установления диагноза.
16. Наличие противопоказаний к спленэктомии или отсутствие согласия пациента на операцию делают необходимым применение медикаментозной терапии второй линии.
16.1. Моноклональные антитела.
Ритуксимаб применяют в дозе 375 мг/м[2] 1 раз в неделю, внутривенно капельно (начальная скорость инфузии 50 мг/ч, при отсутствии реакций гиперчувствительности возможно повышение скорости на 50 мг/ч каждые 30 мин (до 400 мг/ч)), курс лечения составляет 4 недели.
Высокий уровень ответа дает сочетание ритуксимаба с высокими дозами дексаметазона.
Ритуксимаб абсолютно противопоказан пациентам с активным гепатитом В.
Назначение ритуксимаба возможно только решением консилиума с обязательным участием врачей-гематологов после получения информированного согласия пациента.
16.2. Элтромбопаг (агонист рецепторов тромбопоэтина) назначается в дозах 25, 50 и 75 мг/сутки внутрь однократно. Лекарственное средство показано пациентам с хронической ИТП, у которых была проведена спленэктомия и которые не отвечают на лечение кортикостероидами и иммуноглобулинами, а также пациентам, имеющим противопоказания к спленэктомии, как терапии второй линии.
Элтромбопаг назначается на длительное время для поддержания числа тромбоцитов свыше 50 х 10[9]/л. Ответ у всех групп пациентов достигается через 1–2 недели терапии. Терапию можно считать неэффективной, если пациент не дает ответа на нее в течение 4-х недель. У пациентов, принимающих элтромбопаг, можно уменьшить объем сопутствующей терапии либо отменить ее полностью.
16.3. Этапы терапии элтромбопагом:
период подбора (титрования) дозы: старт с 50 мг/сутки перорально, шаг вверх/вниз 25 мг/сутки перорально, с временным интервалом 2–3 недели;
период стабильной (после стабилизации числа тромбоцитов) терапии;
период отмены.
16.3.1. При отмене возможно возникновения «рикошетной» тромбоцитопении, которая имеет транзиторный характер (разрешается через 2–3–4 недели), однако в этот период может потребоваться дополнительное назначение кортикостероидов или внутривенного иммуноглобулина для снижения риска кровотечений.
16.3.2. При снижении уровня тромбоцитов менее 50 х 10[9]/л в общем анализе крови, показано возобновление приема (возврат к прежней дозе) элтромбопага, поскольку снижения эффективности элтромбопага при длительном применении и (или) повторных назначениях не наблюдается.
Оптимальным путем профилактики данного явления является постепенная отмена элтромбопага.
При отмене элтромбопага контроль уровня тромбоцитов в общем анализе крови пациента проводится с частотой 1 раз в неделю в период снижения дозы и отмены лекарственного средства, в том числе в течение одного месяца после полной отмены.
17. При подготовке к плановым хирургическим вмешательствам (спленэктомия и другие), при травматических повреждениях с целью снижения риска кровотечений возможно краткосрочное назначение элтромбопага в дозе 50–75 мг/сутки перорально.
18. Лекарственные средства второй линии, назначаемые решением консилиума с участием врачей-гематологов:
циклоспорин в дозе 5 мг/кг в день в течение 6 дней, затем 2,5–3 мг/кг/сутки под контролем уровня лекарственного средства в крови (100–200 нг/мл);
микофенолата мофетил назначают в прогрессирующих дозах от 250 мг до 1000 мг/сутки 2 раза в неделю в течение 3 недель;
даназол назначают в дозе 200 мг 2–4 раза в сутки (10–15 мг/кг/сутки внутрь);
азатиоприн назначают в дозе 150 мг/сутки (1–2 мг/кг/сутки);
циклофосфамид назначают в дозе 1–2 мг/кг в сутки внутрь минимум 16 недель или внутривенно 0,3–1 г/м[2] 1–3 введения каждые 2–4 недели. Назначают пациентам резистентным к глюкокортикостероидам и с рецидивами после спленэктомии, ответ на терапию обычно регистрируется в течение 8 недель;
винкристин назначают в дозе 1–2 мг в неделю, 1–3 недели (до 6 мг) только внутривенно, с интервалом в 1 неделю, доза индивидуальна. Необходима индивидуальная коррекция дозы винкристина на основе клинического ответа на лечение и выраженности токсических эффектов.
19. Лечение пациентов с ИТП в случае отсутствия эффекта после терапии первой или второй линий.
19.1. Элтромбопаг применяют в дозе 25–75 мг ежедневно внутрь.
Лекарственная тромбоцитопеническая пурпура - причины, механизмы развития
Лекарственная тромбоцитопеническая пурпура была первой, в которой исследован и доказан иммунологический патогенез. Механизм сенсибилизации через медикаменты был инкриминирован первоначально Ackroyd, а затем подтвержден Miescher. Несколько позже, после 1960 г., вырисовывается концепция иммунологического автоантителового заболевания при идиопатической тромбоцитопенической пурпуре, благодаря исследованиям Harrington и Shulmann.
В настоящее время считается, что тромбоцитопении, появляющиеся после применения медикаментов пероральным путем или после инъекций, возникают в результате действия трех механизмов:
1) прямое токсическое действие медикаментов на мегакариоциты, детерминируя медуллодепрессию обычно глобальную или с медуллярной аплазией;
2) прямое токсическое действие медикаментов на тромбоциты, детерминирующее их агглютинацию или лизис в циркуляции;
3) сенсибилизация через медикаменты, что детерминирует образование антитромбоцитарных или антимедикаментозных антител, которые постолько посколько медикамент персистирует в организме вызывают тромбоцитопении.
Тромбоцитопении первой группы описаны в ряду гемоцистопений по поводу медуллярных дисфункций и аплазий. Они приводятся ниже. Тромбоцитопении второй группы, в которых ристоцетин выступает как медикамент несомненного действия, происходят по поводу тромбоагглютинирующего действия именно ристоцетина. Это действие возможно воспроизводить in vitro и любое клиническое или серологическое исследование на циркулирующие антитела оказывается отрицательным.
Третья группа — самая богатая и ее можно смешивать с группой идиопатической тромбоцитопеческой пурпуры. Поэтому идиопатические формы должны быть пересмотрены, между прочим и после исключения форм тромбоцитопений по поводу сенсибилизации к медикаментам. Как мера предосторожности, рекомендуется, чтобы при любой пурпуре еще неизвестной причины прерывалось применение любого медикамента, способного создавать сенсибилизацию. Из классификации ниже, воспроизведенной по Gynn и Aster, сенсибилизирующий иммунный механизм оказался несомненным in vivo и in vitro лишь в отношении хинина и хини дина, седормида, стилбофена <фуадин), дигитоксина и новобиоцина.
Большинство случаев принадлежат первым трем веществам. Отмечаются однако случаи сенсибилизации и после сульфамидов, в том числе диуретических тиазидов, после аспирина, пирамидона, фенилбутазона, мышьяковых солей и даже вследствие поглощения определенных продуктов питания. Среди них цитируются случаи после поглощения определенных сортов фасоли и после цитурсовых. Рост числа седативных медикаментов, вошедших в обиход, повысил частоту тромбоцитопений вследствие барбитуровых производных, дилантина, мепробамата.
Медикаменты и другие вещества, сгруппированные по тромбоцитопенизирующему действию (по К.Н. Aster, модифицировано)
А. Суппрессия производства тромбоцитов: тиазидовые диуретики, этиловый спирт, эстрогенные гормоны
Б. Прямой токсический эффект на циркулирующие тромбоциты: ристоцетин
Б. Иммунологическое уничтожение тромбоцитов:
- Аналгезики: ацстаминофен (парацетамол), антипирин, аспирин, фенилбутазон, салицилат натрия.
- Антибиотики: цефалотин, новобиоцин, парааминосалицилат, пенициллин, стрептомицин, сульфадиазин, сульфатиазол, сульфатоламид
- Хинхоновые алкалоиды: хинидин, хинин - Съестные: цитрусовые, фасоль и пр.
- Седативы, гипнотики, противосудорожные : алилизопропил-ацетилурея (седормид), алилизопропил-барбитуровая кислота, дифенилгидантоин (дилантин), этилалил-ацетилурея, параметадионе, фенобарбитал, мепробамат
- Дериваты сульфонамидов: ацетазсламид, хлорпропамид, диазоксид, толубтамид
- Разные: антазолин, антилюэсные мышьяковые, висмут, хлорохин, хлортиазид, коллоидальнее серебро, сульфат меди, дигитоксин, соли золота, гидрохлортиазид, укусы насекомых, инсектициды, гидразид, ртутные диуретики, метилдопа, вакцина Пертуссис, пропилурацил, спиронолактон, стибофен (фуадин), тетанический токсоид, тиоурацил.
Многочисленные сенсибилизации и тромбоцитопении отмечались в результате длительного применения солей золота при хроническом ревматическом заболевании; так как соли золота остаются долгое время фиксированными в тканях, поддерживают пурпуру хронического характера, которая может становиться началом автоиммунного заболевания.
Патогенез тромбоцитопений по поводу сенсибилизации к медикаментам объясняется двумя механизмами, один более давний Акройда (Ackroyd), а другой несколько новее, утвержденный Шульманном и в основном признанный всеми исследователями, как и в случае гемолитической анемии по поводу сенсибилизации к медикаментам.
Согласно гипотезе Ackroyd, сенсибилизация происходит благодаря медикаменту, который играет роль гаптена, финксируясь на тромбоцитарных оболочковых структурах. Комплекс медикамент-тромбоцит является иммуногенным порождая антитело анти-комплекс с агглютинирующим или литическим действием с фиксированием комплемента на тромбоцитарном теле. По Ackroyd, антитело—IgG и оказывает селективное действие на нормальные тромбоциты, независимо от антигенной тромбоцитарной группы; оно очень малореактивное в отношении тромбоцитов Rhessus и совсем не реактивные для тромбоцитов других видов.
Согласно гипотезе Shulmann, подтвержденной и работами Miescher и сотр. медикамент не имеет большого аффинитета к тромбоцитам и следовательно не может быть для них сенсибилизирующим гаптеном. Зато он имеет аффинитет к протеиновым структурам плазмы, которые становятся „carrier" (носителем) медикамента и таким образом происходит сенсибилизация, так как в этой ситуации медикамент является гаптеном. Сенсибилизация детерминирует образование антитела антимедикамент, которое фиксируется на медикаменте, еще находящимся в циркуляции или в тканях и порождает иммунные комплексы антителомедикамент.
Последние проявляют большой аффинитет к тромбоцитам и после фиксирования на них, агглютинируют или лизируют их путем фиксирования комплемента. Как и для гематий, некоторые комплексы могут не уничтожать тромбоциты, а только модифицировать их оболочки и таким образом они каптируются РЭС.
По гипотезе Ackroyd, который исследовал сенсибилизации седормидом, тромбоцитопения персистирует постолько посколько персистируют и антитела антимедикамент, которые действуют таким образом и на тромбоциты. По гипотезе Shulmann, который работал с хинидином, антитела не дают тромбоцитарных поражений сами, а только в присутствии медикамента персистирующего в циркуляции, образуя иммунные комплексы единственно действующие на тромбоциты.
Эта гипотеза нашла наилучшее подтверждение. Возможно однако, что известные медикаменты действуют путем одного механизма, а другие — путем другого механизма. Оба механизма, рассмотренных и в связи с гемолитической анемией, действительны для всех гемоцитопений по поводу сенсибилизации к медикаментам и даже по поводу изоиммунизации (Shulmann). Дальнейшие исследования над различными категориями медикаментов часто создающих сенсибилизации, смогут уточнить преобладаемость одного из этих механизмов.
Возможно однако, что и при аутоиммнной гемолитической анемии по поводу медикаментов, некоторые тромбоцитопенические пурпуры возникают не по поводу антитела-антимедикамент, а в силу образования собственно автоиммунного механизма. Медикамент с латентным сенсибилизирующим действием, после длительного повторного применения может вызывать у некоторых лиц с иммунной лабильностью разрыв толерантности с появлением антитромбоцитарных антител, как это случается при красной волчанке после гидразинофталазина и других противогипертензивных медикаментов при аутоиммунной гемолитической анемии.
Тромбоцитопатии
Тромбоцитопатии - группа наследственных и приобретенных нарушений гемостаза, возникающих вследствие качественной неполноценности тромбоцитов при их нормальном количестве. Тромбоцитопатии у детей проявляются склонностью к образованию петехий и гематом при незначительных травмах, кровотечениям (носовым, желудочно-кишечным, маточным) различной степени выраженности, анемией. Выявление тромбоцитопатии у детей требует тщательного лабораторного исследования системы гемостаза, проведения функциональных проб, пункции и исследования костного мозга и др. Лечение тромбоцитопатии у детей проводится детским гематологом и включает общую и местную гемостатическую терапию.
Общие сведения
Тромбоцитопатии – геморрагические диатезы, развивающиеся в результате нарушения первичного тромбоцитарного звена гемостаза. Популяционная частота тромбоцитопатий достигает 5-10%. Наследственные тромбоцитопатии являются наиболее частой причиной кровотечений неясного генеза у детей; на их долю приходится от 36 до 65%. Тромбоцитопатии представляют собой актуальную проблему для педиатрии и детской гематологии, поскольку их распространенность зачастую недооценивается, и многие дети с геморрагическим синдромом длительно и безуспешно лечатся у специалистов узкого профиля – детских отоларингологов, детских гинекологов, детских стоматологов, детских гастроэнтерологов, детских урологов.
Классификация тромбоцитопатий
Тромбоцитопатии объединяют в себе гетерогенную группу заболеваний, которые могут быть поделены на наследственные (врожденные) и приобретенные (симптоматические).
1. Наследственные тромбоцитопатии:
- с нарушением агрегационной функции тромбоцитов - дизагрегационные тромбоцитопатии (эссенциальная атромбия 1 типа, тромбастения Гланцмана, аномалия Пирсона-Стоба, аномалия Мея-Хегглина и др.)
- с дефектом реакции освобождения (эссенциальная атромбия 2 типа, аспириноподобный синдром и др.)
- с недостаточным хранением гранул и их компонентов (синдром «серых тромбоцитов», синдром Хержманского-Пудлака)
- с нарушением адгезии тромбоцитов (болезнь Виллебранда, макроцитарная тромбоцитодистрофия Бернара-Сулье)
- тромбоцитопатии, сочетающиеся с различными врожденными дефектами (врожденными пороками сердца, гликогенозами, синдромом Марфана, Элерса-Данлоса, Вискотта-Олдрича и др.)
2. Приобретенные тромбоцитопатии, развивающиеся в течение жизни на фоне других заболеваний.
В детском возрасте наследственные тромбоцитопатии встречаются в 3 раза чаще, чем приобретенные.
Причины тромбоцитопатий
Первичный тромбоцитарно-сосудистый гемостаз включает в себя ряд последовательных реакций: адгезии, агрегации, ретракции кровяного сгустка и активации плазменного гемостаза.
При повреждении кровеносного сосуда под воздействием главного стимулятора адгезии – коллагена эндотелия, тромбоциты набухают и приклеиваются к стенке сосуда. В реализации этапа первичного гемостаза участвуют ионы Ca, белок эндотелия - фактор Виллебранда и контактирующий с ним мембранный гликопротеин Ib тромбоцитов. Вслед за адгезией начинается фаза агрегации, в процессе которой происходит быстрое увеличение тромба. В эту фазу выделяются биологически активные вещества (тромбин, аденозинфосфат (АДФ), катехоламины, серотонин и мн. др.), вызывающие вазоконстрикцию и усиливающие адгезию и агрегацию тромбоцитов. Под влиянием происходящих процессов рыхлая тромбоцитарная пробка уплотняется и подвергается ретракции – сокращению с самопроизвольным отделением сыворотки от сгустка.
Причиной наследственных тромбоцитопатий выступают дефекты генов, кодирующих те или иные факторы, принимающие участие в обеспечении тромбоцитарно-сосудистого гемостаза. Врожденные тромбоцитопатии могут наследоваться по аутосомно-доминантному или аутосомно-рецессивному типу.
Функциональная неполноценность тромбоцитов при приобретенных тромбоцитопатиях может быть связана с приемом тромбоцитоактивных лекарственных препаратов (НПВС, аспирина, пенициллинов, антикоагулянтов и др.), В12-дефицитной анемией, ДВС-синдромом, лейкозом, циррозом печени, геморрагическим васкулитом, системной красной волчанкой, диффузным гломерулонефритом, почечной недостаточностью, гигантскими ангиомами, тромбозами, массивными гемотрансфузиями, лучевой болезнью и пр.
Симптомы тромбоцитопатий
Диапазон проявлений тромбоцитопатии у детей очень широк. Клиническая манифестация врожденной тромбоцитопатии может быть связана с перинатальной патологией (ацидозом, гипоксией), родовыми травмами, вирусными или бактериальными инфекциями, сепсисом, гиповитаминозом, инсоляцией, проведением физиотерапевтических процедур (УФО, УВЧ), массажа, прививки и др.
Ведущим в клинике различных форм тромбоцитопатии является рецидивирующий геморрагический синдром, тяжесть которого может варьировать от легкой кровоточивости до обильных кровотечений. У новорожденных тромбоцитопатия может проявляться кефалогематомами, внутричерепными кровоизлияниями, кровоточивостью и медленным заживлением пупочной ранки. Кровотечения микроциркулярного типа характеризуются петехиями, экхимозами, возникающими при незначительных травмах, трении тела одеждой. В отличие от гемофилии, для тромбоцитопатии не характерны гемартрозы и межмышечные гематомы.
При тромбоцтопатиях у детей раннего возраста отмечаются кровотечения при прорезывании зубов, рецидивирующие носовые кровотечения, повышенная кровоточивость десен, длительное заживление мелких повреждений. У девочек-подростков часто имеется «семейная» склонность к меноррагиям, ювенильным дисфункциональным маточным кровотечениям. У пациентов с тромбоцитопатиями даже малые хирургические вмешательства (удаление зуба, тонзиллэктомия и др.) сопровождаются обильными и длительными кровотечениями. Реже в клинике тромбоцитопатий встречаются желудочно-кишечные кровотечения, гематурия, кровоизлияния в склеры.
Вследствие повышенной кровопотери у детей с тромбоцитопатиями развивается анемический синдром, характеризующийся общей слабостью, бледностью кожных покровов, головокружениями, одышкой, тахикардией, артериальной гипотонией, склонностью к обморокам.
При сочетании тромбоцитопатии с дисплазией соединительной ткани у детей выявляются нарушения осанки, плоскостопие, нефроптоз, пролапс митрального клапана и др. аномалии развития.
Диагностика тромбоцитопатий
Как показывает практика, диагноз тромбоцитопатии у детей редко устанавливается своевременно. Участковые педиатры, как правило, не придают должного значения геморрагическим проявлениям и направляют детей к узким специалистам: детскому ЛОРу – при носовых кровотечениях; детскому гинекологу – при обильных менструациях; детскому стоматологу – при кровоточивости десен и т. д. Между тем, дети с тромбоцитопатиями нуждаются в как можно более ранней специализированной консультации гематолога для уточнения диагноза и формы тробоцитопатии.
Диагностика тромбоцитопатии включает несколько этапов, главными из которых являются анализ клинических проявлений и семейного анамнеза, углубленное исследование системы гемостаза. Функциональные эндотелиальные пробы (баночная, манжеточная, щипковая, проба жгута) при тромбоцитопатиях, как правило, положительные: на коже, в месте воздействия остаются многочисленные петехии или кровоподтек.
Лабораторный этап диагностики тромбоцитопатии начинается с клинического анализа крови, определения времени кровотечения, показателей коагулограммы. В процессе диагностического поиска тромбоцитопатии проводится определение количества тромбоцитов и тромбоцитарной формулы, изучение их морфометрических характеристик и функции (адгезивности; агрегационной активности тромбоцитов с АДФ, ристомицином, адреналином, тромбином, коллагеном; определение тромбоцитарных факторов свертывания и др.). Лабораторное обследование ребенка с тромбоцитопатией должно выполняться не менее 3-х раз в разные периоды заболевания (во время клинической ремиссии и в момент геморрагических проявлений).
Для оценки функции кроветворения в некоторых случаях назначается проведение стернальной пункции или трепанобиопсии и исследование миелограммы.
Лечение тромбоцитопатий
При наследственных тромбоцитопатиях проведение этиотропного лечения невозможно. Поэтому весь комплекс терапевтических мероприятий делится на неотложную терапию по купированию геморрагического синдрома и профилактическое лечение. В течение всей жизни пациентам с тромбоцитопатией запрещается употребление уксуса с пищей (в т. ч. в консервах), алкоголя. Рекомендуется обогащение рациона продуктами, богатыми витаминами А, С и Р; арахисом.
Медикаментозная терапия тромбоцитопатии проводится гемостатическими средствами (этамзилат натрия, адроксон, кальция глюконат, аминокапроновая кислота и др.), препаратами метаболического действия (инозин, АТФ, оротат калия, фолиевая кислота). Полезно употребление кровоостанавливающих фитосборов. Плановые профилактические курсы лечения тромбоцитопатии рекомендуется проводить 2-4 раза в год в зависимости от тяжести геморрагического синдрома.
Для локальной остановки кровотечений из поверхностных ран используется орошение кровоточащей поверхности охлажденным раствором аминокапроновой кислоты, нанесение адроксона, аппликации фибринной пленки с тромбином. При носовом кровотечении необходимо ведение в носовые ходы гемостатической губки, проведение анемизации слизистой носа. При маточных кровотечениях применяются препараты, усиливающие сокращение матки (этистерон), внутривенное введение аминокапроновой кислоты; РДВ полости матки при тромбоцитопатии должно проводится под прикрытием гемостатической терапии. При массивной кровопотере может потребоваться переливание эритроцитарной массы, тромбоцитов и плазмы.
При симптоматической тромбоцитопатии необходимо проведение лечения основного заболевания, исключение приема тромбоцитоактивных препаратов и других провоцирующих моментов.
Прогноз и профилактика тромбоцитопатии
Своевременное выявление тромбоцитопатии у ребенка и проведение адекватной профилактической терапии позволяет предупредить выраженную кровопотерю и повысить качество жизни. При массивных внутричерепных геморрагиях, сопровождающих течение некоторых форм тромоцитопатии, прогноз для жизни неблагоприятный.
Мерами профилактики тромбоцитопатий служат медико-генетическое консультирование семей с наследуемым геморрагическим синдромом, отказ от бесконтрольного приема медикаментов. Дети с установленным диагнозом тромбоцитопатии должны находиться на диспансерном учете у педиатра, детского гематолога, детского офтальмолога, ЛОРа, стоматолога; регулярно проходить полное лабораторное обследование, получать превентивное лечение, исключить занятия травмоопасными видами спорта. Вопрос о проведении профилактической вакцинации детей решается в индивидуальном порядке.
Читайте также:
