Диазепам и датролен при мышечной спастичности. Синдром Ламберта-Итона
Добавил пользователь Алексей Ф. Обновлено: 27.01.2026
Инъекции BoNT-A в обязательном порядке входят в комплексные программы реабилитации взрослых пациентов со спастичностью любой этиологии и детей, страдающих ДЦП. Тенденцией современного реабилитационного подхода является профилактическое применение BoNT-A в остром периоде инсульта и черепно-мозговой травмы, а также более раннее начало ботулинотерапии при ДЦП. Наряду с лечением или профилактикой спастичности у данной категории больных, ботулинотерапия применяется для коррекции сиалореи, нейрогенных расстройств мочеиспускания, трофических расстройств и болевых синдромов, сопутствующих пациентам с поражением ЦНС. Ботулинотерапия в неврологии активно используется при фокальных и сегментарных мышечных дистониях, гемифациальном спазме, ДЦП, ноцицептивных и нейропатических болях (миофасциальном синдроме, мигрени, головной боли напряжения, постгерпетической и другой форме нейропатий, лицевых болях), ригидности (паркинсонической), треморе, остаточных явлениях нейропатии лицевого нерва (синкинезии, контрактуре), сиалорее, при органических поражениях ЦНС, вегетативных расстройствах (гипергидрозе, эритрофобии), и других синдромах.
Преимущества ботулинотерапии
• Высокая избирательность действия;
• Простота подготовки и выполнения инъекции;
• Возможность коррекции полученных результатов;
Противопоказания к проведению ботулинотерапии
• Гиперчувствительность к любому компоненту препарата;
• Воспалительный процесс в месте предполагаемой инъекции;
• Острые инфекционные заболевания;
• Миастения, синдром Ламберта-Итона;
• Заболевания с нарушением нервно-мышечной передачи;
• Беременность и лактация
Использование БТ при спастичности
Спастичность (греч.spastikos – стягивающий). Классическое определение Lance J. W. 1980 г. в котором спастичность определяется как моторное расстройство, характеризующееся зависимым от скорости повышением тонических рефлексов растяжения – мышечного тонуса – с повышенными сухожильными рефлексами вследствие гипервозбудимости рефлекса растяжения как компонента синдрома верхнего мотонейрона, в настоящее время пересмотрено, поскольку не достаточно полно отражает те сложные патофизиологические механизмы, лежащие в основе еѐ формирования и многообразие клинических характеристик этого симптомокомплекса.
Согласно же современному определению, спастичность – это нарушение сенсомоторного контроля из-за повреждения верхнего мотонейрона, проявляющееся в перемежающейся или длительной непроизвольной активации мышц (Группа EU-SPASM, 2006).
5 наиболее распространенных типов (паттернов) спастичности верхней конечности:
• Тип I – приведенное, ротированное кнутри плечо;
• Тип II – согнутый локоть;
• Тип III – согнутое запястье;
• Тип IV – пронированное предплечье;
• Тип V – разогнутый локоть
В широкомасштабном исследовании ULIS было показано, что наиболее распространенным паттерном спастичности руки является тип III (41,8%).
3 формы спастичности кисти:
• Спастическая согнутая кисть;
• Внутренняя червеобразная кисть

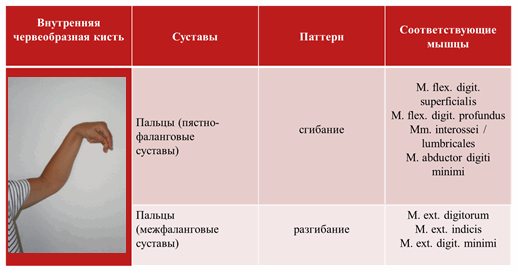
Основным лечебным средством у больных со спастическим парезом являются миорелаксанты. Существуют 2 группы миорелаксантов: системного (пероральные миорелаксанты центрального или периферического действия) и фокального действия (препараты ботулинического токсина типа А).
Согласно рекомендациям Американской академии неврологии 2016 года несколько препаратов BoNT-A — абоботулотоксин, онаботулотоксин и инкоботулотоксин — имеют высочайший уровень рекомендаций А как эффективные препараты для снижения мышечного тонуса и улучшения пассивной функции конечности, а также один из них — абоботулотоксин — имеет еще уровень рекомендации В для улучшения активной функции конечности.
На сегодняшний день в России существует несколько препаратов BoNT-A, использующихся с целью коррекции фокальной спастичности. У каждого препарата имеется свой спектр показаний к лечению.
Начало действия препарата отмечается уже через 5–7 дней, а при повторных инъекциях возможно и раньше, пик эффекта, выражающийся в снижении мышечного тонуса, наблюдается в среднем через 4–6 недель, а длительность действия составляет 3–4 месяца, что потенциально дает возможность в этот период «терапевтического окна» функционального восстановления.
Рекомендации по применению препаратов BoNT-A
- Пациентам со спастичностью мышц верхней конечности ≥2 балла по MAS (Modified Ashworth scale) на любом реабилитационным периоде рекомендованы локальные инъекции БТА с целью уменьшения степени выраженности спастичности, улучшения пассивной функции конечности, улучшения самообслуживания и снижения болевого синдрома, связанного со спастичностью.
Уровень убедительности рекомендации А (уровень достоверности доказательств – 1а).
Комментарии: Эффективность применения BoNT-A при постинсультной спастичности верхней конечности показана в клинических исследованиях высокого класса доказательности с участием в общей сложности более 1500 пациентов.
Ботулинотерапию можно назначать уже через 1–2 недели после инсульта.
- Пациентам со спастичностью мышц верхней конечности ≥2 балла по MAS и с целями лечения, связанными с восстановлением активной функции верхней конечности, в период действия BoNT-A рекомендованы высокоинтенсивные методики физической реабилитации.
Уровень убедительности рекомендации А (уровень достоверности доказательств – 1b).
Комментарии: Период действия BoNT-A, составляющий 12–24 недели следует использовать как «терапевтическое окно» для реализации интенсивных методов физической реабилитации на фоне снижения спастичности. Кроме того, в отдельном РКИ было показано преимущество назначения BoNT-A (Абоботулинотоксина А в дозировке 1000 ЕД на верхнюю конечность) в отношении степени восстановления активных движений.
Пациентам со спастичностью мышц нижней конечности ≥2 балла по MAS в любом реабилитационным периоде рекомендованы локальные инъекции BoNT-A с целью уменьшения степени выраженности спастичности.
Уровень убедительности рекомендации А (уровень достоверности доказательств – 1a).
Комментарии: Эффективность BoNT-A в отношении снижения степени спастичности нижней конечности показана в нескольких РКИ высокого качества. В ряде работ также отмечается улучшение функции ходьбы на фоне снижения спастичности мышц ноги при терапии BoNT-A.
Использование БТ при различных формах дистонии:
Дистония – неритмичные вращательные насильственные движения в различных частях тела с вычурными изменениями мышечного тонуса и формированием патологических поз.
Наряду с дистонической позой и дистоническими движениями к клиническим критериям диагноза относят корригирующие жесты (сенсорные трюки), зеркальную дистонию и двигательную избыточность.
Корригирующие жесты – специальные сенсорные приемы, которые пациент использует для кратковременного устранения или уменьшения дистонического гиперкинеза (прикосновение рукой к любой точке вовлеченной области или имитации каких-то манипуляций). Например: касание пальцем века или брови, ношение солнечных очков, жевание жвачки или леденца при блефароспазме; ношение воротника Шанца, касание затылком стены или подголовника, прикосновение пальцем к щеке или сжимание мочки уха при цервикальной дистонии; охлаждение конечности перед письмом при писчем спазме; пение, сосание леденца при оромандибулярных дистониях; ритмичные постукивания стопой при гиперкинезах нижних конечностей и т. д.
Двигательная избыточность (преимущественно ЭМГ-признак) – сопровождается нецеленаправленными мышечными сокращениями.
Зеркальная дистония – возникновение дистонических гиперкинезов или позы при специфических действиях, выполняемой контралатеральной (условно здоровой) конечностью.
Использование ботулинического токсина типов А и В стало прорывом в симптоматическом лечении фокальной дистонии, блефароспазма, цервикальной дистонии и гемифациального спазма.
Блефароспазм – фокальная форма дистонии, характеризующаяся усиленным морганием и непроизвольным зажмуриванием глаз, возникающая в возрасте 40–60 лет, чаще поражающая женщин, чем мужчин (1,8:1), с распространенностью в общей популяции около 5 случаев на 100 000 населения. Обычно проявления возникают постепенно, начиная с частого моргания и/или ощущения раздражения глаз. Состояние провоцируется стрессом, ярким светом, усталостью, эмоциональным напряжением, чтением, резким порывом ветра.
- частое моргание (77%);
- спазм век (66%), мышц лба (24%) и средней зоны лица (59%);
- подергивания не ограничиваются вовлечением только круговой мышцы глаза, определяются также в области межбровья, лба и носа;
- характерны многообразные корригирующие жесты: касание пальцем века, ношение очков, жевание конфет и т. д.
- при дальнейшем прогрессировании в 58–77% случаев гиперкинезы появляются в мускулатуре нижней части лица, шеи, гортани и глотки (возникают параспазмы);
- блефароспазм исчезает во сне (75%), во время отдыха (55%), разговора (22%), пения (20%).
- функциональная слепота;
- косметический дефект.
Использование ботулинического токсина типа А рассматривается как наиболее эффективное, быстрое, но временное лечение блефароспазма. Более 95% пациентов с блефароспазмом сообщают о значительном улучшении при использовании ботулотоксина.
Пик паралитического эффекта наступает в течение 5–7 дней после инъекции. Пациенты, как правило, отмечают улучшение через 2–3 дня после инъекции, со средней продолжительностью положительного эффекта до 3-х месяцев. Более 5% пациентов отмечают эффект в течение более 6 месяцев. Некоторым пациентам инъекции требуются ежемесячно.
Гемифациальный спазм — периферический миоклонический гиперкинез, проявляющийся кратковременными непроизвольными сокращениями мышц одной половины лица (иногда отмечается и двустороннее поражение), в зоне иннервации лицевого нерва. Характеризуется краткими клоническими движениями круговой мышцы глаза, затрагивает другие мышцы лица (m.corrugator, m.frontalis, platysma, m.zygomaticus). Чаще возникает у женщин, обычно начинается в пятом или шестом десятилетии жизни. Возникновение гемифациального спазма у пациентов моложе 40 лет является редким явлением и может быть следствием демиелинизирующего заболевания (например, рассеянный склероз).
Причинами гемифациального спазма могут быть:
- компрессия лицевого нерва сосудом (дистальные ветви передней нижней мозжечковой артерии или позвоночной артерии — вазоневральный конфликт);
- поражение ствола мозга вследствиеинсульта, рассеянного склероза;
- травмы головного мозга, опухоли, артериовенозные пороки развития.
Методом выбора лечения гемифациального спазма являются инъекции ботулинического токсина типа А. Терапевтический эффект начинается через 3–5 дней и может длиться 3–6 месяцев.
Цервикальная дистония (ЦД) – локальная форма мышечной дистонии, характеризующаяся непроизвольными движениями мышц шеи с формированием патологических поз головы и шеи. При этом отмечаются быстрые ритмичные движения головы, которые обозначаются, как дистонический тремор головы. Также частым симптомом являются боли в области затылка, шеи и плеч, а также гипертрофия вовлеченной группы мышц.
Распространенность – 9 случаев на 100 000 населения. Заболевание может начаться в любом возрасте, средний возраст дебюта заболевания – 40 лет, чаще возникает у женщин, в качестве провокационной пробы можно попросить пациента пройтись.
Тяжесть ЦД варьирует от легкой до тяжелой. При незначительной выраженности поражения голова отклоняется периодически и с минимальной амплитудой, возможно движение в противоположную сторону, корригирующие жесты эффективны. При тяжелой ЦД дистоническая поза постоянна, движения в противоположную сторону невозможны, корригирующие жесты неэффективны.
Чаще всего носит спорадический характер. Среди наследственных вариантов следует рассматривать генотипы DYT1, DYT6, DYT7.
К факторам риска развития ЦД относятся:
- травма головы и шеи;
- инфекции, спондилез, опухоли, рубцовая ткань или растяжение связочного аппарата шейного отдела позвоночника;
- инфаркт базальных ганглиев;
- нейродегенеративные заболевания;
- лекарственное и токсическое воздействие.
Ботулинотерапия является «золотым стандартом» терапии первой линии при ЦД. Эффективность и безопасность введения ботулинического токсина типа А имеет уровень доказательности А. Все препараты ботулинического токсина типа А имеют аналогичные показания к терапии ЦД. FDA (США) утвердило применение следующих препаратов при цервикальной дистонии:
- Onabotulinumtoxin A;
- Abobotulinumtoxin A;
- Incobotulinumtoxin A;
- Rimabotulinumtoxin B.
Препаратом выбора при лечении цервикальной дистонии является BoNT-A (BoNT-В – препарат резерва для пациентов с резистентностью к BoNT-A). Ключом к успеху лечения служит правильный выбор мышцы для введения препарата.
Начинать лечение пациентов, ранее не получавших ботулинотерапию, следует с минимальной эффективной дозы. Дозу следует подбирать индивидуально, в соответствии с потребностями пациента, учитывая положение шеи и головы, локализацию боли, размер и степень гипертрофии мышц.
Повторные инъекции делают не ранее, чем становится заметным снижение эффекта первой дозы. Целесообразность фиксированного 12-недельного интервала между инъекциями не доказана. Индивидуально подобранные интервалы между инъекциями могут обеспечить лучший эффект лечения пациентов с ЦД. Интервалы между инъекциями должны определяться на основе индивидуальной потребности пациента.
Диазепам и датролен при мышечной спастичности. Синдром Ламберта-Итона
Диазепам и датролен при мышечной спастичности. Синдром Ламберта-Итона
Диазепам эффективен для лечения спазма мышц, связанного с повреждениями спинного мозга, но менее эффективен, чем баклофен, особенно при спазме сгибателя.
Диазепам — это бензодиазепин. Препарат полезен в лечении спастичности, т.к. уменьшает тонус мышц, понижая полисинаптические и моносинаптические рефлексы, которые способствуют поддержанию спазма мышц. Действие диазепама происходит как на спинальном, так и на супраспинальном уровнях. Спинальный уровень действия для уменьшения спастичности более важен. Для оказания этого эффекта в спинном мозге диазепам связывается с бензодиазепиновыми рецепторами в ГАМКА-рецепторном комплексе на центростремительных окончаниях нерва, образующих синапс с а-мотонейронами. Это увеличивает пресинаптическое ингибирование, вызываемое ГАМК, при котором возрастает поступление ионов О" внутрь клетки после взаимодействия с ГАМКа-рецепторами. Диазепам можно назначать внутрь или внутривенно. Период полувыведения 60 час, в который активный метаболит нордиазепам вносит свой вклад. Диазепам вызывает дозозависимую сонливость.
Дантролен
В отличие от баклофена и диазепама, дантролен устраняет спастичность, оказывая прямое действие на скелетные мышцы.
Дантролен — производное гидантоина, которое не только устраняет мышечный спазм, но также вызывает мышечную слабость, что ограничивает его клиническое использование. Механизм действия заключается в ингибировании скелетномышечного сопряжения возбуждение-сокращение. Препарат уменьшает количество Са2+, высвобождаемого из саркоплазматического ретикулума, в результате снижается связь между возбуждением и сокращением, что заканчивается редукцией сокращения, генерируемого в мышце. Фармакологическая активность дантролена доказана уменьшением сокращений скелетных мышц в экспериментальных и клинических условиях.
Дантролен используют для устранения спазма при параплегии и гемиплегии.
Дантролен используют для лечения злокачественной гипертермии (состояния, которое развивается во время общей анестезии) при чрезмерном накоплении внутриклеточного Са2+. Дантролен обычно назначают внутрь, но при этом он абсорбируется неполностью. Препарат имеет период полувыведения 9 час и метаболизируется печенью.
Побочные эффекты датролена. Включают мышечную слабость и угнетение, иногда гепатотоксичность. Препарат противопоказан пациентам с дыхательной недостаточностью или болезнью печени. Также рекомендуются регулярные обследования функции печени.
Двигательные нарушения в результате дефектов возбудимости мышцы. Многие нарушения движения связаны с дефектами в базальных ганглиях, но некоторые нарушения — результат ухудшения нервно-мышечной передачи и возбудимости скелетных мышц (например, синдром Ламберта-Итона, синдром Мак-Ардла, врожденная миотония и тетания).
Синдром Ламберта-Итона
Синдром Ламберта-Итона (миастенический синдром) связан с некоторыми опухолями (особенно с раком легкого). Этот синдром чаще наблюдается у мужчин в возрасте 50-60 лет. Поскольку НМС — место дефекта, проявления напоминают миастению гравис (симптомы утомляемости и пониженных рефлексов конечностей). Однако синдром Ламберта-Итона отличается от миастении гравис тем, что мышечная слабость, которая особенно затрагивает мышцы конечностей, не купируется антихолинэстеразными средствами. Это связано с тем, что синдром Ламберта-Итона — результат разрушенного сопряжения между возбуждением окончания нерва и высвобождением АХ в НМС. У некоторых пациентов это связано с аутоантителами против нейрональных потенциал-зависимых Са2+-каналов. Оказывается, что потенциал-зависимые Са2+-каналы экспрессируются в ткани мелкоклеточного рака легкого и как антиген способствуют развитию антител Са2+-канала. Терапия этого синдрома направлена на увеличение высвобождения нейромедиатора в НМС:
• физические упражнения для улучшения мышечной силы;
• соли кальция, которые могут быть полезны, т.к. Са2+ играет важную роль в высвобождении нейромедиаторов из нервных окончаний;
• 3,4-диаминопиридин, который увеличивает высвобождение медиатора, блокируя проведение К+ в нервных окончаниях. 3,4-Диаминопиридин — простой аналог пиридина, который способен блокировать разнообразные потенциал-зависимые Са2+-каналы с некоторой селективностью к одному типу К+-каналов по сравнению с другим. Этот препарат используют экспериментально, он имеет ограниченное клиническое применение из-за распространенных неблагоприятных эффектов, связанных с ингибированием потенциалзависимых К+-каналов. Это приводит к широкому диапазону побочных эффектов, главный из которых — возбуждение ЦНС. Препарат назначают внутрь от 4 до 5 раз в день.
Заболевания периферической нервной системы
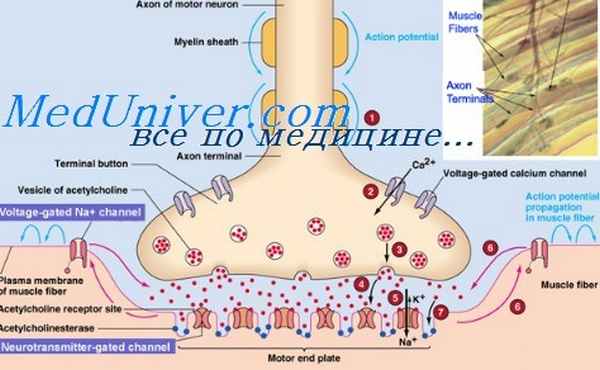
Рис. 8.15 Высвобождение нейротрансмиттера и его взаимодействие с никотиновыми рецепторами в нервно-мышечном синапсе. При миастении гравис никотиновые рецепторы блокируются антителами, предотвращая взаимодействие между нейротрансмиттерами и рецепторами. АХ — ацетилхолин.
Миастения гравис — редкое аутоиммунное заболевание, влияющее на нервно-мышечную систему (рис. 8.15). Характерные симптомы: слабость скелетных мышц и утомление после кратковременного периода повторной деятельности с восстановлением после короткого периода отдыха. Однако в случае прогрессирования болезни сила мышцы у пациентов не всегда возвращается к исходному состоянию после отдыха. Около 85% больных миастенией испытывают общую слабость, поражающую веки, глазные мышцы, мышцы туловища, диафрагмы и длинные мышцы шеи. Иногда слабость ограничивается только веками и экстраокулярными мышцами (15% пациентов), что проявляется птозом.
Миастения гравис встречается в США приблизительно в 100 случаях на 1 млн, обычно у женщин в возрасте около 50 лет и у мужчин старше 60 лет.
Патофизиологические особенности миастении гравис—результат дефицита никотиновых холинергических рецепторов в мышцах
При миастении гравис количество никотиновых холинергических рецепторов в концевых мышечных пластинах составляет только « 30% нормы. Дефицит рецепторов связан с иммунологическим ответом, вовлекающим тимус, т.к. сила мышц у таких пациентов обычно улучшается после тимэктомии. В сыворотке крови пациентов с миастенией присутствуют антитела к никотиновому рецептору, и антиген может быть локализован в тимусе (рис. 8.16), т.к. холинергические рецепторы обнаружены на поверхности мышечных клеток в тимусе.
Рис. 8.16 Источник образования антигенов и антител при миастении гравис. Схематическое изображение участка тимуса, который содержит модифицированные мышечные клетки с никотиновыми рецепторами на поверхности. Предполагается, что эта железа может быть источником антигена, который служит моделью для получения никотиновых антител у больных миастенией. Эти антитела блокируют никотиновые рецепторы в нервно-мышечном соединении и предотвращают взаимодействие между нейротрансмиттером и никотиновыми рецепторами (см. рис. 8.18). АХ — ацетилхолин.
При миастении гравис сокращение скелетных мышц неадекватно для поддержания физической активности
При миастении гравис мышечное сокращение не может быть поддержано, т.к. число взаимодействий нейромедиатор-рецептор меньше нормы вследствие уменьшения количества доступных для функционирования никотиновых рецепторов в концевых мышечных пластинах из-за антител (см. рис. 8.16). В связи с этим во многих мышечных волокнах происходит нарушение передачи, т.е. потенциалы действия могут быть сгенерированы лишь в небольшом количестве мышечных волокон. Вероятно, поэтому сокращение невозможно даже после не большого периода мышечной активности. Однако это можно предотвратить увеличением числа холинергических взаимодействий нейромедиатор-рецептор.
Эффективная лекарственная терапия миастении гравис увеличивает число холинергических взаимодействий нейромедиатора с рецептором
Лечение миастении гравис заключается в следующем:
- увеличение концентрации АХ в нервно-мышечном синапсе (например, антихолинэстеразными средствами);
- подавление иммунного ответа.
АХ неэффективен как лекарственный препарат, т.к. быстро метаболизируется ацетилхолинэстеразой в НМС и вызывает неблагоприятные эффекты стимуляции мускариновых рецепторов. Однако концентрация АХ в НМС может быть увеличена антихолинэстеразными средствами, которые ингибируют метаболизм АХ. Максимальные эффекты антихолинэстеразных средств обычно развиваются быстро в начале лечения, но после нескольких недель или месяцев терапии такие средства теряют эффективность. Тогда необходимо добавить другие препараты.
Фермент холинэстераза, которую ингибируют этими средствами, существует в двух структурно связанных изоэнзимах: (1) ацетилхолинэстераза (метаболизирует ацетилхолин), которая найдена преимущественно в НМС (и холинергических нейроэффекторных синапсах); (2) семейство эстераз, называемое псевдохолинэстераза или бутирилхолинэстераза (субстраты — неспецифические эфиры), которые найдены главным образом в плазме крови. Эти две разновидности фермента имеют два главных участка связывания — эстеразный и анионный, за которые антихолинэстеразные лекарства конкурируют с ацетилхолином, что ингибирует его метаболизм. Лекарства, которые ингибируют ацетилхолинэстеразу, можно объединить в две группы на основании участка связывания и стабильности взаимодействия с ферментом (например, обратимые и необратимые ингибиторы).
Карбаматы — обратимые антихолинэстеразные средства, широко используемые в лечении миастении гравис
Карбаматы, особенно неостигмин и пиридостигмин, обратимо ингибируют ацетилхолинэстеразу, связываясь в анионных и эстеразных участках. В течение периода ингибирования (3-6 час) концентрация АХ в НМС увеличивается, в результате происходят повторные взаимодействия с уменьшенным числом никотиновых холинергических рецепторов. Это ведет к улучшению сокращения мышц у пациента с миастенией. Оба средства назначают внутрь, но пиридостигмин имеет большую биодоступность и длительность действия (T1/2 = 4 час), чем неостигмин (Т1/2 = 2 час), и всасывается не полностью.
Силу дыхательных движений и жизненную емкость легких обычно используют для мониторирования увеличения мышечной силы после приема антихолинэстеразных средств
Для контроля и диагностики миастении гравис используют антихолинэстеразное средство ультракороткого действия — эдрофоний хлорид. Этот метод контроля является профилактической мерой для предотвращения передозировки, которая может уменьшить мышечную силу за счет АХ-вызванной блокады деполяризации никотиновых холинергических рецепторов в НМС у пациентов с миастенией гравис. Эдрофоний хлорид конкурирует с ацетилхолином за обратимое связывание в анионном участке ацетилхолинэстеразы. Улучшение мышечной силы с помощью эдрофония хлорида длится около 5 мин, если препарат вводят внутривенно. Однако, несмотря на непродолжительное действие эдрофония хлорида, в наличии должен быть атропин, чтобы противостоять мускариновым побочным эффектам в результате накопления ацетилхолина.
Для лечения миастении гравис также используют длительно действующие (более 3-8 час) антихолинэстеразные средства типа амбенония. Этот препарат действует подобно карбаматам. Фосфорорганические соединения редко используют в клинике, т.к. трудно контролировать дозы из-за необратимого связывания этих препаратов с эстеразным центром ацетилхолинэстеразы. Фосфорорганические антихолинэстеразные вещества используют прежде всего как инсектициды (например, паратион, малатион) и как химическое оружие (например, табун, зарин). Иногда для лечения некоторых форм глаукомы применяют эхотиофат.
ПОБОЧНЫЕ ЭФФЕКТЫ. Эти эффекты возникают из-за накопления ацетилхолина, ведущего к возбуждению мускариновых рецепторов во многих тканях. Побочными эффектами могут быть абдоминальные спазмы, гиперсаливация, увеличение бронхиальной секреции, миоз и брадикардия. Эти эффекты устраняют антагонисты мускариновых рецепторов типа атропина, но обычно его не назначают, поскольку лучше не маскировать появление мускариновых эффектов, которые являются показателем чрезмерной антихолинэстеразной терапии. Большинство пациентов становятся толерантными к этим неблагоприятным эффектам.
ЛЕКАРСТВЕННЫЕ ВЗАИМОДЕЙСТВИЯ. Эффективность антихолинэстеразных веществ снижается, а симптомы миастении гравис усиливаются, если пациент подвергается воздействию тубокурарина (антидеполяризующий миорелаксант) или амино-гликозидного антибиотика, который нарушает нервно-мышечную передачу.
ЛЕКАРСТВА, КОТОРЫЕ ПОДАВЛЯЮТ ИММУННЫЙ ОТВЕТ ПРИ МИАСТЕНИИ ГРАВИС. Поскольку эффективность антихолинэстеразной терапии часто уменьшается через несколько недель или месяцев, используют дополнительные терапевтические меры: назначение иммунодепрессантов типа глюкокортикостероидов, которые показаны, если мышечная сила неадекватна.
Механизм действия глюкокортикостероидов обсужден подробно в Кортикостероиды. Глюкокортикостероиды используют в лечении миастении гравис, т.к. они ингибируют синтез антител к никотиновым холинергическим рецепторам в НМС (табл. 8.6). Для этого обычно назначают преднизолон или преднизон, что ведет к увеличению числа доступных никотиновых холинергических рецепторов для взаимодействия с АХ. В результате сила мышц у пациентов с миастенией улучшается. Есть предположение, что полезные эффекты преднизолона могут быть частично обусловлены увеличенным синтезом АХ-рецепторов, которые также улучшают нервно-мышечную передачу при миастении гравис из-за подавления образования антител.
Гипертония - Hypertonia
Эта статья о повышенной активности и сопротивлении мышц. Для повышения артериального давления см. Гипертония.
Гипертония это термин, который иногда используется как синоним спастичность и ригидность в литературе, посвященной повреждению Центральная нервная система, а именно поражения верхних мотонейронов. [1] Нарушение способности поврежденного двигательные нейроны регулировать нисходящие пути приводит к неупорядоченным спинномозговые рефлексы, повышенная возбудимость мышечные веретена, и уменьшился синаптический торможение. [2] Эти последствия приводят к аномальному увеличению мышечный тонус симптоматических мышц. [3] Некоторые авторы предполагают, что нынешнее определение спастичности, зависящей от скорости сверхактивности рефлекс растяжения, недостаточен, так как не учитывает пациентов, демонстрирующих повышенный мышечный тонус при отсутствии чрезмерной активности рефлекса растяжения. Вместо этого они предлагают "обратимая гипертония«является более подходящим и представляет собой излечимое состояние, которое реагирует на различные методы лечения, такие как лекарство и / или физиотерапия. [4]
Содержание
Презентация
Симптомы, связанные с расстройствами центральной нервной системы, подразделяются на положительные и отрицательные категории. К положительным симптомам относятся те, которые увеличивают мышечную активность за счет повышенной возбудимости рефлекса растяжения (т. Е. Ригидность и спастичность), а к отрицательным симптомам относятся симптомы недостаточной мышечной активности (т.е. слабое место ) и снижение двигательной функции. [5] Часто две классификации считаются отдельными сущностями расстройства; однако некоторые авторы предполагают, что они могут быть тесно связаны. [6]
Патофизиология
Гипертония вызывается поражения верхних мотонейронов которые могут возникнуть в результате травмы, заболевания или состояний, связанных с повреждением центральной нервной системы. Отсутствие или снижение функции верхних мотонейронов приводит к потере торможения с последующей гиперактивностью нижние двигательные нейроны. В зависимости от местоположения поражения могут возникать различные паттерны мышечной слабости или гиперактивности, вызывающие множество неврологических симптомов, в том числе: спастичность, жесткость, или дистония. [3]
Спастическая гипертония связана с неконтролируемым спазмы мышц, жесткость или выпрямление мышц, шоковые сокращения всей или части группы мышц, а также аномальные мышечный тонус. Это наблюдается при таких расстройствах, как: церебральный паралич, Инсульт, и повреждение спинного мозга. Ригидность - это тяжелое состояние гипертонии, при котором сопротивление мышц возникает во всем диапазоне движений пораженного сустава независимо от скорости. Это часто связано с поражением базальный ганглий. У людей с ригидностью проявляется скованность, ограниченный диапазон движений и потеря моторного контроля. Дистоническая гипертония относится к сопротивлению мышц пассивному растяжению (при котором терапевт осторожно растягивает неактивную сокращенную мышцу до комфортной длины при очень низких скоростях движения) и тенденции конечности возвращаться к фиксированной непроизвольной (а иногда и ненормальной) позе после движение. [ нужна цитата ]
Управление
Терапевтические вмешательства лучше всего подбирать индивидуально для конкретных пациентов. [ нужна цитата ]
Основные принципы лечения гипертонии - избегать вредных раздражителей и обеспечивать частые физические упражнения. [ нужна цитата ]
Физические вмешательства
Физиотерапия было показано, что он эффективен в борьбе с гипертонусом за счет использования растяжки, направленной на уменьшение двигательный нейрон возбудимость. [7] Целью сеанса физиотерапии может быть максимальное подавление чрезмерного тонуса, создание у пациента ощущения нормального положения и движения и облегчение нормальных моделей движений. Хотя статическая растяжка была классическим средством увеличения диапазона движений, Растяжение PNF был использован во многих клинических условиях для эффективного уменьшения мышечной спастичности. [8]
Глазурь и прочее местные анестетики может на короткое время снизить рефлексивную активность для облегчения двигательной функции. Тормозящее давление (сильное давление на мышечные сухожилия), способствующее сохранению тепла тела и ритмичному вращению (медленное повторяющееся вращение пораженной части тела для стимуляции расслабления) [9] также были предложены в качестве потенциальных методов уменьшения гипертонуса. Помимо статического литья с вытяжкой, техники наложения шин чрезвычайно ценны для расширения диапазона движений суставов, потерянных из-за гипертонуса. [10] Более нетрадиционный метод ограничения тона - циклическое выполнение быстрых повторяющихся пассивных движений в пораженном суставе; это также продемонстрировало результаты в отношении людей без физических недостатков. [7] Для более постоянного улучшения состояния необходимы упражнения и обучение пациентов. [9] Изокинетический, [11] [12] [13] [14] аэробный, [15] [16] [17] и силовой тренинг [18] [19] [20] [21] упражнения следует выполнять в соответствии с предписаниями физиотерапевта, а стрессовые ситуации, которые могут вызвать повышение тонуса, следует минимизировать или избегать. [9]
Фармацевтические вмешательства
Баклофен, диазепам и дантролен остаются тремя наиболее часто используемыми фармакологическими средствами при лечении спастической гипертонии. Баклофен обычно является препаратом выбора при спастичности спинного мозга, в то время как дантролен натрия - единственный агент, который действует непосредственно на мышечную ткань. Тизанидин также доступен. Фенитоин с хлорпромазин могут быть потенциально полезными, если седация не ограничивает их использование. Кетазолам, еще не доступный в Соединенных Штатах, может стать значительным дополнением к фармакологическому набору вариантов. Интратекальный Прием антиспастических препаратов допускает высокую концентрацию препарата вблизи места действия, что ограничивает побочные эффекты. [10]
Диазепам и датролен при мышечной спастичности. Синдром Ламберта-Итона
Рис. 8.15 Высвобождение нейротрансмиттера и его взаимодействие с никотиновыми рецепторами в нервно-мышечном синапсе. При миастении гравис никотиновые рецепторы блокируются антителами, предотвращая взаимодействие между нейротрансмиттерами и рецепторами. АХ — ацетилхолин.
Миастения гравис — редкое аутоиммунное заболевание, влияющее на нервно-мышечную систему (рис. 8.15). Характерные симптомы: слабость скелетных мышц и утомление после кратковременного периода повторной деятельности с восстановлением после короткого периода отдыха. Однако в случае прогрессирования болезни сила мышцы у пациентов не всегда возвращается к исходному состоянию после отдыха. Около 85% больных миастенией испытывают общую слабость, поражающую веки, глазные мышцы, мышцы туловища, диафрагмы и длинные мышцы шеи. Иногда слабость ограничивается только веками и экстраокулярными мышцами (15% пациентов), что проявляется птозом.
Миастения гравис встречается в США приблизительно в 100 случаях на 1 млн, обычно у женщин в возрасте около 50 лет и у мужчин старше 60 лет.
Патофизиологические особенности миастении гравис—результат дефицита никотиновых холинергических рецепторов в мышцах
При миастении гравис количество никотиновых холинергических рецепторов в концевых мышечных пластинах составляет только « 30% нормы. Дефицит рецепторов связан с иммунологическим ответом, вовлекающим тимус, т.к. сила мышц у таких пациентов обычно улучшается после тимэктомии. В сыворотке крови пациентов с миастенией присутствуют антитела к никотиновому рецептору, и антиген может быть локализован в тимусе (рис. 8.16), т.к. холинергические рецепторы обнаружены на поверхности мышечных клеток в тимусе.
Рис. 8.16 Источник образования антигенов и антител при миастении гравис. Схематическое изображение участка тимуса, который содержит модифицированные мышечные клетки с никотиновыми рецепторами на поверхности. Предполагается, что эта железа может быть источником антигена, который служит моделью для получения никотиновых антител у больных миастенией. Эти антитела блокируют никотиновые рецепторы в нервно-мышечном соединении и предотвращают взаимодействие между нейротрансмиттером и никотиновыми рецепторами (см. рис. 8.18). АХ — ацетилхолин.
При миастении гравис сокращение скелетных мышц неадекватно для поддержания физической активности
При миастении гравис мышечное сокращение не может быть поддержано, т.к. число взаимодействий нейромедиатор-рецептор меньше нормы вследствие уменьшения количества доступных для функционирования никотиновых рецепторов в концевых мышечных пластинах из-за антител (см. рис. 8.16). В связи с этим во многих мышечных волокнах происходит нарушение передачи, т.е. потенциалы действия могут быть сгенерированы лишь в небольшом количестве мышечных волокон. Вероятно, поэтому сокращение невозможно даже после не большого периода мышечной активности. Однако это можно предотвратить увеличением числа холинергических взаимодействий нейромедиатор-рецептор.
Эффективная лекарственная терапия миастении гравис увеличивает число холинергических взаимодействий нейромедиатора с рецептором
Лечение миастении гравис заключается в следующем:
- увеличение концентрации АХ в нервно-мышечном синапсе (например, антихолинэстеразными средствами);
- подавление иммунного ответа.
Лечение миастении гравис
АХ неэффективен как лекарственный препарат, т.к. быстро метаболизируется ацетилхолинэстеразой в НМС и вызывает неблагоприятные эффекты стимуляции мускариновых рецепторов. Однако концентрация АХ в НМС может быть увеличена антихолинэстеразными средствами, которые ингибируют метаболизм АХ. Максимальные эффекты антихолинэстеразных средств обычно развиваются быстро в начале лечения, но после нескольких недель или месяцев терапии такие средства теряют эффективность. Тогда необходимо добавить другие препараты.
Фермент холинэстераза, которую ингибируют этими средствами, существует в двух структурно связанных изоэнзимах: (1) ацетилхолинэстераза (метаболизирует ацетилхолин), которая найдена преимущественно в НМС (и холинергических нейроэффекторных синапсах); (2) семейство эстераз, называемое псевдохолинэстераза или бутирилхолинэстераза (субстраты — неспецифические эфиры), которые найдены главным образом в плазме крови. Эти две разновидности фермента имеют два главных участка связывания — эстеразный и анионный, за которые антихолинэстеразные лекарства конкурируют с ацетилхолином, что ингибирует его метаболизм. Лекарства, которые ингибируют ацетилхолинэстеразу, можно объединить в две группы на основании участка связывания и стабильности взаимодействия с ферментом (например, обратимые и необратимые ингибиторы).
Карбаматы — обратимые антихолинэстеразные средства, широко используемые в лечении миастении гравис
Карбаматы, особенно неостигмин и пиридостигмин, обратимо ингибируют ацетилхолинэстеразу, связываясь в анионных и эстеразных участках. В течение периода ингибирования (3-6 час) концентрация АХ в НМС увеличивается, в результате происходят повторные взаимодействия с уменьшенным числом никотиновых холинергических рецепторов. Это ведет к улучшению сокращения мышц у пациента с миастенией. Оба средства назначают внутрь, но пиридостигмин имеет большую биодоступность и длительность действия (T1/2 = 4 час), чем неостигмин (Т1/2 = 2 час), и всасывается не полностью.
Силу дыхательных движений и жизненную емкость легких обычно используют для мониторирования увеличения мышечной силы после приема антихолинэстеразных средств
Для контроля и диагностики миастении гравис используют антихолинэстеразное средство ультракороткого действия — эдрофоний хлорид. Этот метод контроля является профилактической мерой для предотвращения передозировки, которая может уменьшить мышечную силу за счет АХ-вызванной блокады деполяризации никотиновых холинергических рецепторов в НМС у пациентов с миастенией гравис. Эдрофоний хлорид конкурирует с ацетилхолином за обратимое связывание в анионном участке ацетилхолинэстеразы. Улучшение мышечной силы с помощью эдрофония хлорида длится около 5 мин, если препарат вводят внутривенно. Однако, несмотря на непродолжительное действие эдрофония хлорида, в наличии должен быть атропин, чтобы противостоять мускариновым побочным эффектам в результате накопления ацетилхолина.
Длительно действующие антихолинэстеразные средства
Для лечения миастении гравис также используют длительно действующие (более 3-8 час) антихолинэстеразные средства типа амбенония. Этот препарат действует подобно карбаматам. Фосфорорганические соединения редко используют в клинике, т.к. трудно контролировать дозы из-за необратимого связывания этих препаратов с эстеразным центром ацетилхолинэстеразы. Фосфорорганические антихолинэстеразные вещества используют прежде всего как инсектициды (например, паратион, малатион) и как химическое оружие (например, табун, зарин). Иногда для лечения некоторых форм глаукомы применяют эхотиофат.
ПОБОЧНЫЕ ЭФФЕКТЫ. Эти эффекты возникают из-за накопления ацетилхолина, ведущего к возбуждению мускариновых рецепторов во многих тканях. Побочными эффектами могут быть абдоминальные спазмы, гиперсаливация, увеличение бронхиальной секреции, миоз и брадикардия. Эти эффекты устраняют антагонисты мускариновых рецепторов типа атропина, но обычно его не назначают, поскольку лучше не маскировать появление мускариновых эффектов, которые являются показателем чрезмерной антихолинэстеразной терапии. Большинство пациентов становятся толерантными к этим неблагоприятным эффектам.
ЛЕКАРСТВЕННЫЕ ВЗАИМОДЕЙСТВИЯ. Эффективность антихолинэстеразных веществ снижается, а симптомы миастении гравис усиливаются, если пациент подвергается воздействию тубокурарина (антидеполяризующий миорелаксант) или амино-гликозидного антибиотика, который нарушает нервно-мышечную передачу.
ЛЕКАРСТВА, КОТОРЫЕ ПОДАВЛЯЮТ ИММУННЫЙ ОТВЕТ ПРИ МИАСТЕНИИ ГРАВИС. Поскольку эффективность антихолинэстеразной терапии часто уменьшается через несколько недель или месяцев, используют дополнительные терапевтические меры: назначение иммунодепрессантов типа глюкокортикостероидов, которые показаны, если мышечная сила неадекватна.
Глюкокортикостероиды
Механизм действия глюкокортикостероидов обсужден подробно в Кортикостероиды. Глюкокортикостероиды используют в лечении миастении гравис, т.к. они ингибируют синтез антител к никотиновым холинергическим рецепторам в НМС (табл. 8.6). Для этого обычно назначают преднизолон или преднизон, что ведет к увеличению числа доступных никотиновых холинергических рецепторов для взаимодействия с АХ. В результате сила мышц у пациентов с миастенией улучшается. Есть предположение, что полезные эффекты преднизолона могут быть частично обусловлены увеличенным синтезом АХ-рецепторов, которые также улучшают нервно-мышечную передачу при миастении гравис из-за подавления образования антител.
Читайте также:
