Дифференциация тератом средостения. Липомы средостения
Добавил пользователь Skiper Обновлено: 27.01.2026
Тератомы делятся на зрелые и незрелые. Все зрелые тератомы хорошо инкапсулированы, неправильно округлой или овальной формы, различной величины. На разрезе часто видны кисты. Незрелые имеют вид солитарных узлов, иногда с мелкими полостями. Поверхность их бугристая, ткань плотная. Содержимое таких кист – похожая на сало тягучая масса, бу- рая жидкость, волосы. Тератомы могут включать участки желез, зубы, кости, иногда и частично развитый плод.
Выделяют бессимптомно протекающие, неосложненные, но проявляющиеся клинически и осложненные тератомы. Располагаясь в переднем средостении, чаще в средней его трети, тератомы сопровождаются кардиоваскулярными нарушениями (тахикардия, сжимающая
боль в области сердца), хотя боли встречаются реже, чаще возникает одышка и цианоз. Компрессия крупных бронхов, трахеи ведет к одышке, иногда к приступообразному кашлю, кровохарканью. Инфицирование опухоли вызывает повышение температуры и нарастание симптоматики.
Основной диагностический метод – комплексное рентгенологическое исследование. При
этом определяется округлое или овоидное образование с четкими границами, не смещаю-
щиеся при глотании и кашле, в нем могут выявляться зубы, кости. Чаще всего тератомы приходится дифференцировать от медиастинального зоба, тимомы и перикардиальной кисты. При медиастинальном зобе в отличие от тератом одышка более выражена, могут быть явления тиреотоксикоза. Тимома часто располагается посредине, тератомы – сбоку от средней линии
Неврогенные опухоли
Составляют 30% всех первичных новообразований средостения
Могут исходить из различных нервных стволов средостения и нервных элементов различных органов средостения - из ганглиев и стволов симпатического нерва, блуждающих и межреберных нервов, оболочек спинного мозга.
Неврогенные опухоли располагаются в заднем средостении. Опухоли обычно располагаются в костно-вертебральном синусе и по мере роста распространяются на боковую поверхность позвоночника и задние отделы ребер; большей частью новообразование расположено с одной стороны, но может находиться и кпереди от позвоночника, вдаваясь в обе плевральные полости, иногда частично проникая в позвоночный канал в виде «песочных часов».
Из клеток симпатического нервного ствола возникают ганглионеврома, нейробластома, симпатикобластома и феохромацитома, а к опухолям, образовавшимся из переферических нервов, относятся неврома, нейрофиброма и невринома. Хемодектома – опухоль из клеток хеморецепторов или хеморецепторных телец, преимущественно из кадиоаортальной группы телец, располагающихся вокруг дуги аорты, растет медленно, обрастая вокруг крупных сосудов, нервных стволов.
Ганглионеврома имеет округлую форму. Капсула выражена хорошо, «ножка» широкая.
Ганглионейробластома характеризуется более низкой дифференциацией элементов, дезорганизацией структуры, ее так же называют неврогенной саркомой. Метастазирует медленно, но нередко наблюдается обширное метастазирование. Низкодифференцированные неврогенные саркомы зарактеризуются бурным, инфильтративноо характера ростом, ранним, отдаленным метастазированием.Невринома, или шваннома, берет начало из шванновских оболочек нерва. Опхоль округлой или овальной формы, капсула выражена хорошо. Харатенизуется медленным ростом. Нейрофиброма - опухоль из фиброзных элементов нервных стволов, имеет округлую форму. Ножка опухоли широкая, связана с нервом. Нейрофиброма - некапсулированная опухоль и в процессе своего роста диффузно прорастает периневральную соединительную ткань, более склонна к озлокачествлению.
Симптомалогия и клиника неврогенных опухолей средостения. Выделяют три группы признаков:
1.Неврологические признаки.
2.Сдавление сосудов и органов средостения.
3.Деформация костей грудной клетки.
1. Боли в груди, головные боли, синдром Горнера, изменение чувствительности кожи на стороне поражения, парезы нижних конечностей.
При малигнизации неврогенной опухоли усиливаются боли, ухудшается самочувствие, отмечается быстрое увеличение тени опухоли в средостении, которое теряет четкость контуров. Наблюдается смещение органов средостения.
Появление синдрома Горнера: птоз, миоз и энофтальм говорит о сдавлении симпатического ствола.
2. Вторая группа симптомов обусловлена сдавлением органов средостения и сосудов - боли в груди, одышка, сердцебиение, расширение подкожных вен («голова Медузы»).
Симптомы, связанные с нарушением функции органов грудной полости вследствие давления опухоли, симптомы интоксикации организма. Чаще отмечается болевой синдром, повышенная утомляемость, слабость, зоны гипестезии, одышка, кашель, повышенная температура тела, потливость, похудание, раздражительность, сердцебиение, чувство сдавления за грудиной, осиплость голоса, симптом Горнера, онемение рук.
Решающее значение в диагностике рентгенологическое исследование - овальная или округлой формы интенсивная, гомогенная тень, имеющая четкие контуры, располагающаяся в задне-верхних отделах средостения. Узуры тел позвонков и ребер, расширение межреберных промежутков и разрыв реберно-позвоночных сочленений. При опухолях типа «песочных часов» отмечается расширение межпозвоночных отверстий.
Мезенхимальные опухоли
Это опухоли из волокнистой соединительной ткани (фибромы), из хрящевой и костной ткани (хондрома, остеохондрома, остеобластокластома), из остатков спинной струны (хордома), из жировой ткани (липома, гибернома), опухоли из различных мезенхимальных тканей (мезенхимомы), опухоли, исходящие из сосудов (гемангиомы, лимфангиомы и др.), опухоли из мышечной ткани (лейомиомы, рабдомиомы).
Фиброма средостения– довольно редкое заболевание. Обычно эти опухоли локализуются в переднем и реже в заднем средостении. Источником их образования являются соединительно-тканные пластинки, фасции, фиброзные слои плевры и другие фиброзные элементы. Опухоль 4-5 см. в диаметре находится в капсуле. В ранних стадиях фибромы клинически не проявляются, при увеличении опухоли появляются неприятные ощущения, тяжесть и боли в груди, кашель, одышка.
Выделяют три группы симптомов, связанных с локализацией опухоли в средостении:
при нахождении опухоли в переднем средостении доминирует респираторные, кардиальные и венозные симптомы.
расположенная в среднем средостении опухоль вызывает респираторные симптомы и симптомы, связанные с вовлечением в патологический процесс возвратного нерва.
для опухолей заднего средостения характерны хилоторакс, дисфагия, корешковые боли.
У больных с опухолями задне-верхнего отдела средостения иногда наблюдается сдавление пограничного симпатического ствола с последующим симптомом Горнера.
Липомы и гиберномы.
Встречаются наиболее часто у женщин, склонных к ожирению
По локализации эти опухоли можно разделить на пять групп:
медиастинальные (распологаются только в средостении)
шейно-медиастинальные (на шее и в средостении)
абдомино-медиастинальные (опухоли из предбрюшинной клетчатки передней брюшной стенки, проникающие в переднее средостение через щель Лорея)
интрамуральные (локализуются в органах грудной полости и средостения)
парастернально-медиастинальные (распологаются в виде песочных часов в переднем средостении и впереди от реберных хрящей)
Структура липом средостения дольчатая. Опухоль окружена тонкой капсулой, плотновата, имеет форму того пространства, которое она занимает. Редко в ткани жировой опухоли можно увидеть скопления крупных, незрелых жировых клеток - «тутовые ягоды». Опухоль из этих клеток эмбрионального типа называют гиберномой. Размеры различные. Гибернома окружена более плотной капсулой, дольчата.
Липомы средостения развиваются медленно и не дают вначале никаких симптомов. При локализации опухоли вблизи сердца, между сердцем и костной частью грудной клетки появляются неприятные ощущения, боль в груди, одышка. При локализации опухоли вблизи пищевода могут быть симптомы дисфагии.
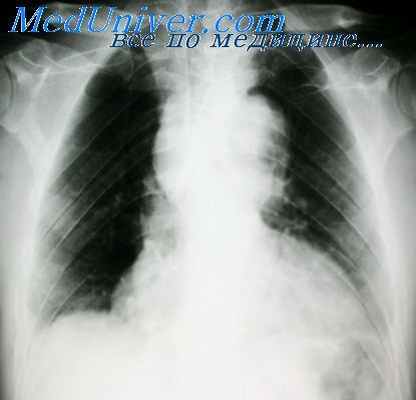
Иногда липомы распластываются по наружному, переднему или заднему контуру сердца, создавая впечатление расширения границ сердечной тени, но наиболее частая локализация – правый кардиодиафрагмальный угол, где при рентгенологичесом исследовании определяется однородная тень овальной формы, малой интенсивности, с четкими контурами, прилегающая к сердцу и диафрагме.
Крайне редко некоторыеторые из опухолей перерождаются в липосаркомы, что характеризуется признаками сдавления органов и сосудов средостения.
Лимфангиома средостения.
Происходят в связи с нарушением развития и формирования лимфатических сосудов и вен, имеют тонкие стенки соединительнотканного характера, множество полостей, содержащих белковую массу, выстланных изнутри эндотелием.
Дифференциация тератом средостения. Липомы средостения
Дифференциация тератом средостения. Липомы средостения
Нужно учитывать, что при медиастинальном зобе в отличие от тератом одышка более выражена, могут иметь место явления тиреотоксикоза. На рентгенограммах нередко отмечается смещение трахеи, иногда тень имеет треугольную форму, своим основанием обращенную к шее. При глотании в этих случаях заметно смещение тени кверху. Применение радиоактивного йода в ряде случаев помогает поставить точный диагноз медиастинального зоба (А. Туров, Б. К. Осипов, 1953).
Тимомы и опухоли передневерхнего средостения дифференцировать труднее, но с учетом некоторых специфических, главным образом рентгенологических, признаков все же возможно. Тимома часто располагается посредине, тератомы — сбоку от средней линии. При тератомах имеются боли, на рентгенограмме иногда видны костные включения. Все же ошибки в диагнозе этих двух видов опухолей встречаются довольно часто (Сабистон и Скотт, Б. К. Осипов и др.). Мы также наблюдали одного подобного больного.
Наконец, целомическая киста перикарда может быть отдифференцирована на основании отчасти клинических симптомов, которые выражены при тератоидных новообразованиях и очень часто отсутствуют при целомической кисте. Кроме того, последняя, как правило, располагается в переднем перикардо-диафрагмальном углу справа и бывает особенно отчетливо заметна при рентгенографии с применением искусственного пневмоторакса, устанавливающего ее связь с перикардом.
Липомы и гиберномы средостения
Липомы средостения — весьма редкие опухоли. Описание их в литературе некоторых стран совсем не приводится, в других — представляет исключительную казуистику.
Описан также особый вид липомы, названный Джери (Gery, 1914) гиберномой на основании предположения о происхождении опухоли из ткани, являющейся гомологом желез тех животных, которые переносят зимнюю спячку.
Первый о липомах средостения упоминает Фотчергил (Fothergill, 1781). К 1930 г. Джейтер и Лидейн (Jater, Lyddane) собрали в мировой литературе 11 подобных наблюдений, а Кратчер и Плотт (Crutcher, Plott) в 1945 г. опубликовали еще 58 случаев.
О редкости липом средостения говорит и тот факт, что даже при большом личном опыте некоторых хирургов, удалявших около 100 опухолей и кист средостения, операции по поводу липом встречались 1—2 раза (Сабистон и Скотт, 1955; Б. К. Осипов, 1957; наши наблюдения и др.).
Частота всех этих вариантов липом средостения различна. Килей и Вана (Keeley, Vana) в 1956 г. тщательно изучили материалы, опубликованные за 15 лет — с 1940 по 1955 г., по вопросу о липомах средостения. Всего собрано 30 историй болезни, из которых 18 относились к медиастинальным, 7 — к шейно-медиастинальным и 11 — к трансмуральным липомам. Абдомино-медиастинальные и парастернальномедиастинальные липомы описаны у 5 больных [Гуссенбауер (Gussenbauer), Рапан (Rapant) и др.].
Строение липом средостения в большинстве случаев не отличается от обычных липом. Это дольчатые опухоли, имеющие тонкую капсулу. Опухоль плотновата, имеет форму того пространства, которое она занимает в средостении (овальная, сплющенная, полушаровидная, типа песочных часов и т. д.).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Дифференциация тератом средостения. Липомы средостения
Представлен опыт лечения 37 больных с тератомами средостения. Клинические проявления тератом носят стертый характер. Решающая роль в диагностике принадлежит КТ, которая выявляет размеры, локализацию и структуру опухоли. Трансторакальная, игловая биопсия была информативной у 18 больных из 37 (46,4%), что объясняется неоднородной структурой опухоли и трудностями в интерпретации биоптата. Выбор оперативного доступа диктовался преимущественно локализацией, а также размерами опухоли. Оперативный доступ – стернотомия был использован у 20 больных, торакотомия – у 17. Опухоль удалена радикально у 34 больных, в 1 случае операция была паллиативной, и у 2 больных выполнены пробные торакотомии. Зрелая тератома была у 32 пациентов, незрелая (злокачественная) – у 5. Послеоперационные осложнения в виде кровотечений случились у 2 (5,4%) больных. Летальных исходов не было. При незрелых тератомах в дальнейшем проводилась лучевая терапия 50-65 Гр и интенсивная химиотерапия на основе платины. Отдаленные результаты прослежены у 16 пациентов. Все пациенты, где были зрелые тератомы, живы. Трое больных, где была малигнизация опухоли, умерли в течение 2 лет, несмотря на адъювантное лечение.
1. Флорикян А.К. Герминогенные опухоли средостения (тератодермоидные новообразования) // Международный медицинский журнал 2009. № 3. C. 74-81.
2. Пикин О.В., Колбанов К.И., Маканин М.А., Казакевич В.И., Рудаков Р.В., Королев А.В. Зрелая тератома передневерхнего средостения, осложненная перфорацией в легкое // Российский онкологический журнал. 2012. № 2. С. 29-31.
4. Miyazawa M., Yoshida K., Komatsu K., Kobayashi N., Haba Y. Mediastinal mature teratoma with rupture into pleural cavity due to blunt trauma. Ann Thorac. Surg. 2012. Vol. 93. N 2. P. 37-40.
5. Ruan Z., Wang S., Wang Z., Ling Y. A rare case of bilateral massive hemothorax from spontaneous rupture of a primary mediastinal mixed germ cell tumor. Ann Thorac. Surg. 2012. Vol. 93. N 6. Р. 62-64.
Тератомы – это своеобразная группа новообразований, состоящих из тканевых и органоподобных элементов. Первое упоминание о тератоме средостения принадлежит Rubino в 1810 году, а в отечественной литературе тератому средостения впервые описал А.П. Буйвид в 1889 году. Тератомы средостения - наиболее частые опухоли, состоящие из герминативных клеток, которые не имеют существенных гендерных различий и могут происходить в любом возрасте, однако наиболее часто возникают в возрасте 20-40 лет, составляя около 15% предсредостенных опухолей у взрослых и 25% предсредостенных опухолей у детей. Тератомы составляют вторую по частоте нозологическую форму новообразований средостения – 15,7–23,1% [1; 2], уступая по частоте только неврогенным опухолям. Тератома средостения возникает в результате спонтанного сосудистого развития некоторых стволовых клеток, оставшихся в средостении во время развития примордиального тимуса на эмбриональной стадии. Тератомы часто встречаются вблизи области тимуса [3]. Обычно данные опухоли в своем составе имеют ткани эктодермы, мезодермы, эндодермы [4]. Тератомы подразделяются на зрелые (доброкачественные) и незрелые (злокачественные), что очень важно для определения тактики лечения и оценки прогноза. По встречаемости зрелые/незрелые тератомы соотносятся 10/1 [5].
Цель настоящей работы – обобщить наш опыт лечения данных опухолей и подчеркнуть основные аспекты данной проблемы.
Материал и методы исследования. В данной работе мы представляем опыт лечения 37 пациентов с тератомами средостения, находившихся на лечении в клиниках торакальной хирургии ГБУЗ СО «ПТД», УНИИФ – филиала ФГБУ «НМИЦ ФПИ» Минздрава России и ГБУЗ СО «СООД». Мужчин было 24, женщин – 13. Возраст больных от 16 до 58 лет. Клинические и анамнестические данные у подавляющего большинства пациентов изначально были неспецифическими: утомляемость и потеря веса у 13 пациентов, одышка у 4, субфебрилитет у 6, боль в груди у 4 и умеренная дисфагия у 1 пациента (у ряда больных эти симптомы сочетались). У 15 пациентов клинических проявлений не было, и заболевание было выявлено при профилактической флюорографии. В 4 случаях пробная торакотомия ранее выполнялась в других больницах. У одного пациента 3 года назад опухоль была удалена не полностью также при торакотомии. У 1 пациентки частичная стернотомия и резекция опухоли выполнены 4 года назад в другом городе. Следовательно, в двух последних случаях речь шла о рецидивах опухоли. При компьютерной томографии (КТ) во всех случаях выявлялось дополнительное солидное образование в переднем средостении, а у 17 больных патологическое образование имело массивные размеры, отклоняло сердце с магистральными сосудами и сдавливало легкие вплоть до полного компрессионного ателектаза. Умеренная компрессия трахеи при трахеобронхоскопии определялась у 2 больных. Морфологическая верификация опухоли имелась у всех больных, перенесших ранее хирургические вмешательства, а у остальных пациентов выполнялась биопсия под рентгеном, КТ- или УЗИ- контролем.
Выбор оперативного доступа диктовался преимущественно локализацией, а также размерами опухоли. Если диаметр опухоли не превышал 10 см и медиальный край ее не достигал срединной линии, то выполняли боковую торакотомию с соответствующей стороны. Стернотомия (полная продольная или частичная продольно-поперечная) выполнялась при больших размерах опухоли и при расположении краев опухоли за срединной линией. Мы выполнили полную продольную стернотомию у 19 пациентов и частичную продольно-поперечную стернотомию - у 1 пациента. У одной пациентки, у которой опухоль рецидивировала после предыдущей резекции, нам пришлось выполнить повторную стернотомию. В 17 была предпринята боковая торакотомия. Для оценки кровопотери на разных этапах операции текущая кровопотеря была измерена у 8 человек на трех этапах: выполнение доступа, мобилизация опухоли в средостении и при отделении опухоли от спаек с грудной стенкой и легким. Для фиксации грудины накладывали обычные проволочные швы. Плевральные полости и средостение дренировали.
Обезболивание. Особых соображений по поводу анестезии не было. Применялась стандартная двулегочная вентиляция легких и внутривенная анестезия.
Дополнительное противоопухолевое лечение не применялось в случаях, когда доброкачественная зрелая тератома была подтверждена при морфологическом исследовании удаленной опухоли. Лучевая терапия 50-65 Гр и интенсивная химиотерапия на основе платины проводились пациентам со злокачественными тератомами.
Результаты исследования и их обсуждение. У 34 пациентов опухоль была удалена полностью. При этом в 2 случаях потребовалось удаление верхней доли левого легкого, а у 4 больных – ограниченные атипичные резекции легких, когда опухоль была тесно спаяна с легочной тканью. В 9 случаях потребовалась резекция перикарда. У одного пациента была проведена субтотальная резекция левой стенки перикарда, после чего мы закрыли дефект широким лоскутом париетальной плевры. Истинная опухолевая инвазия соседних анатомических структур при этом была выявлена при морфологическом исследовании лишь у 3 больных с подтвержденной малигнизацией тератомы. У 1 пациента операция была паллиативной из-за инвазии полой вены и предсердия, а у 2 больных радикальная операция оказалась невозможной по той же причине. Морфологическое исследование также выявило у этих двух пациентов злокачественную трансформацию. Операционная кровопотеря варьировала от 230 до 2530 мл (в среднем = 440 мл) и возникла в основном из-за сильно васкуляризированных спаек между опухолью и грудной стенкой. Наиболее сложным и травматичным этапом хирургического вмешательства оказалось рассечение опухоли от спаек с грудной стенкой. Измерение кровопотери на этапах операции показало, что 83% общей кровопотери произошло во время отделения опухоли от грудной стенки. Во всех этих случаях имели место опухоли больших размеров (более 15 см в наибольшем диаметре). Самая крупная опухоль (зрелая тератома) была массой 3,5 кг. В одном случае опухоль располагалась в переднем косто-диафрагмальном синусе и была изначально трактована как внелегочная секвестрация. При торакотомии оказалось, что это зрелая тератома, исходящая из переднего средостения и спустившаяся на длинной (около 20 см) ножке в передний косто-диафрагмальный синус. Послеоперационные осложнения в виде кровотечений случились у 2 (5,4%) больных, причем у одного пациента, где была удалена гигантская незрелая тератома, это было фибринолизное кровотечение объемом 2530 мл. Летальных исходов не было.
По результатам морфологического исследования зрелая тератома подтверждена у 32 пациентов, незрелая – у 5. Отдаленные (от 2 до 7 лет) результаты прослежены у 16 пациентов. Все пациенты, у которых были зрелые тератомы, живы и здоровы. Трое больных, где была малигнизация опухоли, умерли в течение 2 лет, несмотря на адъювантное лечение.
Приводим следующие наблюдения.
Наблюдение 1. Женщина 18 лет. Студентка. Жалоб не предъявляет. При флюорографии и последующей КТ определяется массивное затемнение, исходящее из переднего средостения, пролабирующее в левую плевральную полость (рис. 1а). Средостение смещено вправо. Структура опухоли неоднородна: видны множественные костно-хрящевые включения и кистозные участки (рис. 1б). Операция: полная продольная стернотомия. Опухоль отделена от грудной стенки. Верхняя доля левого легкого в ателектазе. От легкого опухоль отделена швом аппарата ТА-60. Ножка опухоли исходит из переднего средостения и также пересечена после прошивания ТА-60 (рис. 1в). Продолжительность операции 2 часа 15 минут, кровопотеря 530 мл. Гистологически: зрелая тератома (рис. 1г). Послеоперационный период гладкий. Контрольный осмотр через 2 года – здорова.
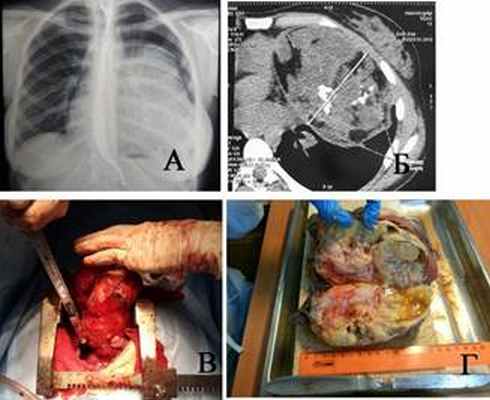
Рис. 1. Наблюдение 1: а) обзорная рентгенограмма пациентки, б) компьютерная томограмма той же больной, в) полная продольная стернотомия, отсечение ножки опухоли, г) опухоль на разрезе – зрелая тератома
Наблюдение 2. Мужчина 24 лет. Строитель. В течение 2 недель стал ощущать слабость, боль в груди, Т >38o, одышку. До этого считал себя здоровым, работал. На КТ определяется массивное солидное гомогенное образование, занимающее практически весь левый гемиторакс и смещающее средостение вправо (рис. 2 а, б). При УЗИ левой плевральной полости определяется жидкость. При плевральной пункции удалено около 2,5 л серозного экссудата. Трансторакальная игловая биопсия: опухолевая ткань, наиболее вероятно герминогенной природы с участками некроза. Операция: полная продольная торакотомия. Опухоль с большими техническими трудностями из-за плотных сращений отделена от грудной стенки. Выделение сопровождалось значительным диффузным кровотечением. Легкое в ателектазе, инвазии его нет. Множественные сосудистые ножки, исходящие из переднего средостения, лигированы и пересечены. Опухоль удалена. Масса опухоли 2,8 кг (рис. 2в). Продолжающееся фибринолизное кровотечение в послеоперационном периоде купировано, кровопотеря возмещена. Дальнейший послеоперационный период без осложнений. При выписке левое легкое полностью расправлено (рис. 2г). Морфологически: незрелая тератома. Далее химиотерапия в режиме ВЕР 4 цикла. Смерть от прогрессирования опухолевого процесса 2 года спустя.
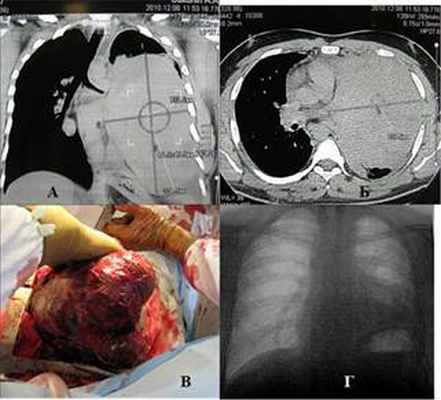
Рис. 2. Наблюдение 2: а, б) компьютерные томограммы пациента, в) полная продольная стернотомия, извлечение препарата, г) обзорная рентгенограмма пациента спустя 7 дней после операции
Клиническая проблема заключается в том, что вначале бессимптомные тератомы переднего средостения могут достигать огромных размеров, но даже при этом симптомы часто бывают неспецифичны. Большинство пациентов с тератомой средостения не имеют явных симптомов, опухоль можно обнаружить лишь при рентгенографии грудной клетки или компьютерной томографии грудной клетки.
Клинические проявления симптоматических пациентов в основном включают: 1. Симптомы связаны с компрессией структуры ткани переднего средостения, вызванной эффектом опухолевой массы, включая стеснение в груди, одышку, массу шеи, синдром верхнего средостения, синдром Хорнера. 2. Симптомы вызваны разрывом опухоли, которая может содержать пищеварительные ферменты, поджелудочной железы, слюнной железы и других тканей, которые действуют на окружающие ткани и проникают в соседние органы, что осложняется плевральным выпотом и гемотораксом, которые в результате вызывают одышку, кровохарканье и обструктивную пневмонию, а также перикардиальный выпот и тампонаду перикарда. У одного из наших пациентов была тупая травма грудной клетки, и гигантская тень изначально была интерпретирована как свернувшийся гемоторакс. Отсюда возникает резонный вопрос: где была профилактическая флюорография? Клинические проявления зрелых тератом у взрослых менее выражены, чем у детей.
Решающая роль в диагностике принадлежит КТ, которая выявляет размеры, локализацию и структуру опухоли. Рентгенография грудной клетки и компьютерная томография могут показать круглую или округлую массу в переднем средостении, частичную дольчатую, кальцификацию в опухоли и даже зуб или кость. Зрелые тератомы - это в основном кистозные массы, в то время как незрелые тератомы - это в основном твердые массы. Большинство тератом средостения расположены в переднем средостении, которые легко ошибочно диагностируются как тимома перед операцией и должны быть тщательно идентифицированы. Однако морфологический диагноз до операции удается получить не всегда.
По нашим данным, игловая биопсия оказалась информативной у 18 больных из 37 (46,4%). Частично этот факт можно объяснить тем, что опухоль имела неоднородную структуру и в значительном большинстве случаев в биоптате преобладали бесструктурные массы, что серьезно затрудняло интерпретацию биоптата.
Вторая проблема - хирургическая. Выбор хирургического метода в основном зависит от локализации, размеров и соотношения опухолевого тела и окружающих тканей. Если опухоль затрагивает средостение билатерально, верхнюю полую вену, внутреннюю вену, сосуды головы и шеи, а начальная часть опухоли неясна, целесообразно выбрать срединную торакотомию для хирургической резекции, когда возможна реконструкция сосудов. Для тех опухолей, у которых опухолевое тело выходит через верхнюю апертуру грудной клетки к шее, Т-образный разрез должен быть сделан через грудину в сочетании с разрезом шейного воротника. При необходимости лобэктомии или клиновидной резекции легкого может быть выбрана заднебоковая торакотомия. При необходимости может быть добавлен боковой разрез грудины с передней торакотомией.
Также может быть использована боковая торакотомия на стороне опухоли. Стоит также отметить, что из-за большой опухоли, обширной адгезии, большой раневой поверхности, неполного расширения легких и остаточной полости в грудной полости и других факторов легко вызвать послеоперационное кровотечение. Следует обратить внимание на защиту диафрагмального нерва, возвратного гортанного нерва, блуждающего нерва и нерва плечевого сплетения, когда опухоль плотно прилегает к поверхности средостения, чтобы избежать серьезных осложнений. В случае если опухоль невозможность удалить полностью, опухолевая ткань должна быть удалена как можно больше, а остаточная кистозная стенка должна быть обработана для уменьшения послеоперационной секреции. Небольшая остаточная опухолевая кистозная стенка в стенке кровеносного сосуда не влияет на прогноз. Непростой аспект операции - выделение опухоли из спаек, на что указывал ряд авторов. На данном этапе операции может развиться тяжелое кровотечение, которое трудно остановить.
Мы также столкнулись с такими проблемами, о чем свидетельствуют наши данные, указанные выше: на данном этапе произошло более 80% общей кровопотери. Развитие таких васкуляризированных спаек можно объяснить длительным медленным ростом опухоли в тесном контакте с париетальной плеврой, перифокальным воспалением. Добавим, что причиной невозможности радикальной операции у 4 наших больных, оперированных ранее, были тяжелые сращения с грудной стенкой, имитирующие инвазию опухоли, и сильное кровотечение при попытках выделения опухоли. Следует подчеркнуть, что мы не обнаружили в таких случаях инвазии опухоли в грудную стенку, а только спайки. На этот факт указывали и другие авторы. Наконец, рассуждая о выборе оперативного доступа, мы можем утверждать, что полная срединная стернотомия предпочтительнее прежде всего потому, что этот доступ обеспечивает хорошую визуализацию и удобство манипуляций в средостении вблизи сердца и магистральных сосудов. Такого же мнения придерживаются ряд отечественных и зарубежных авторов [2; 5].
Заключение. Планируя выбор оперативного доступа, авторы считают, что полная срединная стернотомия предпочтительнее прежде всего потому, что этот доступ обеспечивает хорошую визуализацию и удобство манипуляций в средостении вблизи сердца и магистральных сосудов. И, наконец, онкологическая проблема лечения тератом средостения заключается в отсутствии надежных методов адъювантного лечения, позволяющего остановить опухолевую прогрессию при незрелых тератомах даже в случаях радикального удаления опухоли. Имеющиеся в литературе данные и результаты нашего исследования показали, что прогноз в большинстве таких случаев неблагоприятный, несмотря на последующую химиотерапию и облучение. Химиотерапия на основе платины при незрелых тератомах оставляет надежду на благоприятный прогноз. Однако своевременное обнаружение опухоли на ранней стадии является важнейшим фактором, обеспечивающим удовлетворительный исход лечения.
Международная конференция “современная компьютерная и магнитно-резонансная томография в многопрофильной клинике” (11—12 ноября 1997 г, г. Москва)

Конференция открылась приветственными выступлениями академика В.Д. Федорова и президента Российской ассоциации радиологов проф. П.В. Власова.
Ключевые слова
Полный текст
Конференция открылась приветственными выступлениями академика В.Д. Федорова и президента Российской ассоциации радиологов проф. П.В. Власова.
Доклад Ф. Зоннельфельда (г. Утрехт, Нидерланды) “Сегодня и завтра компьютерной томографии” был посвящен в основном использованию этого нового вида исследования в хирургии с целью правильного планирования тактики оперативного вмешательства. Для получения полной информации о патологических изменениях органов и тканей человеческого организма он рекомендовал более широкое использование возможностей КТ в предоперационном, операционном и послеоперационном периодах. Проводить КТ-исследование необходимо в трехмерном изображении с соответствующей реформацией визуального изображения, нужно шире использовать томограммы для дифференциации тканей, модулировать и получать КТ-изображение в цветном варианте.
Темой доклада Р. Ринмюллера (г. Грац, Австрия) была неинвазивная диагностика заболеваний коронарных артерий с помощью электроннолучевой компьютерной томографии. Было представлено 14 критериев определения патологического поражения коронарных сосудов путем использования компьютерной томографии. С помощью современных компьютерных томографов можно исследовать не только состояние коронарных сосудов, но и функциональное нарушение миокарда, состояние перфузии, степень сужения просвета коронарных сосудов, ишемию миокарда и обызвествление стенок коронарных сосудов.
С докладом о применении МРТ невысоких магнитных полей выступил У. Айхофф (Германия). Он показал хорошие диагностические возможности высокоэнергетических МРТ, позволяющих обследовать патологически измененные ткани и органы человеческого организма на молекулярном уровне. В клинической практике приборы с высоким полем могут дать превосходные изображения, если применяются подходящие импульсные и градиентные последовательности с учетом особенностей поведения сигналов при этих полях. Высокоэнергетические МР-томогра-фы способствуют исследованию с высоким разрешением нервной и кардиоваскулярной систем в физиологическом и патологическом состояниях в реальных временных рамках. МР-ангиогра-фия, основанная на использовании высоких магнитных полей, позволяет получить изображение по коэффициенту диффузии, а также сверхбыстрые методы для динамической и функциональной томографии, использующие незначительную часть намагниченности.
Н.В. Нуднов (Москва) оценил в своем выступлении роль лучевых методов в проведении диагностических и лечебных пункций. Новые лучевые методы исследования с помощью рентгеновских, ультразвуковых и КТ аппаратов обеспечивают надежный способ контроля за манипуляциями и интерпозицией иглы в исследуемых органах и тканях. По его данным, диагностические биопсии позволили в 68,1% случаев установить морфологическую природу поражений, причем положительные результаты УЗ-биопсий составили 73%, КТ-биопсий — 65,3%. Положительный эффект лечебных вмешательств (аспирация, дренирование) получен у 88,6% больных. В 9,4% случаев диагностические и лечебные вмешательства сопровождались развитием осложнений.
Секционные заседания конференции были посвящены патологическим изменениям центральной нервной системы, заболеваниям легких и средостения, сердечно-сосудистой системы, органов брюшной полости и забрюшинного пространства, костно-мышечной системы и заболеваний молочной железы.
И. И. Камалов, Г. В. Савкин и соавт. (Казань) представили доклад о современной компьютерной и магнитно-резонансной томографии заболеваний и травм головного мозга. Сканирующие последовательности МРТ по сравнению с РКТ позволяют получить изображение головного мозга с более высоким уровнем дифференцирования серого и белого веществ за счет получения сильного, но различного по интенсивности ЯМР-сигнала от жидких сред (внутримозговой жидкости, крови) и липидов. При МРТ-исследовании лучше, чем при РКТ, визуализируются структуры, находящиеся в глубинных отделах головного мозга. Достаточно достоверные результаты были получены при МРТ-диагностике рассеянного склероза, очаговых геморрагий и инфарктов головного мозга. С помощью МРТ можно провести дифференциальную диагностику злокачественных и доброкачественных опухолей. При метастатических поражениях головного мозга и арахноидэндотелиомах авторы применяли РКТ с внутривенным введением контрастных веществ в связи с относительно низкой контрастностью МРТ - изображения.
Распознавание патологических изменений ЦНС при РКТ основывалось на прямых и косвенных признаках. По различным изменениям коэффициента поглощения рентгеновских лучей патологические процессы ЦНС при РКТ условно делятся на 4 группы: с нормальным коэффициентом поглощения, пониженным, повышенным и полиморфным. МРТ и РКТ обладают бесспорным преимуществом перед другими методами лучевой диагностики и дополняют друг друга в особо сложных диагностических случаях, а также способствуют объективному контролю за эффективностью лечения.
Магнитно-резонансная томография в диагностике заболеваний спинного мозга и позвоночника нашла отражение в докладе M. М. Пановой, С. А. Гаспаряна, Т. А. Ахадова (Москва). МРТ показана при опухолях, метастазах, сирингомиелии и кистах различной этиологии, дегенеративных заболеваниях позвоночника, врожденных аномалиях, травмах, синдроме неудачного вмешательства на спинном мозге и позвоночнике, различных миелопатиях. Применение МРТ сокращает сроки диагностики заболеваний, а значит, и сроки стационарного лечения, позволяет избежать неоправданных оперативных вмешательств, провести органосохраняющие операции, сократить объем операционной травмы. MPT-исследование необходимо выполнять с оптимальным алгоритмом применения импульсных последовательностей МРТ.
Р.А. Алтунбаев, И.И. Камалов (Казань) доложили об изменениях эпидуральной клетчатки на нижнепоясничном уровне при КТ-исследовании больных с корешковой и некорешковой люмбоишиалгией. Уплотнения клетчатки переднего эпидурального пространства часто сочетались с выпячиванием в позвоночный канал межпозвонковых дисков, но были выявлены уплотнения и без дисковых выпячиваний. Уплотнения эпидуральной клетчатки в 2 раза чаще cо четались с пролапсами, чем с протрузией дисков. Значительно реже они вызывали изменения формы дурального мешка и положения нерва На-жотга. Показательно преобладание невральных КТ нарушений в связи с уплотнениями эпидуральной клетчатки у больных с корешковыми расстройствами по сравнению с КТ-картиной, выявляемой при некорешковых поражениях.
Возможности спиральной компьютерной и магнитно-резонансной томографии в диагностике объемной патологии органов грудной клетки были освещены А.Н. Иванковым, В.А. Рогожиным (Киев). Преимущество спиральной КТ отмечено в диагностике центрального рака легкого с дополнительной информацией о состоянии самого опухолевого узла, культи бронха, а также перибронхиального роста. Спиральная КТ более четко определяет состояние лимфоузлов корня и средостения. При периферической форме рака она полностью исключает “пропуск” при сканировании узлов до 1 см. При неспецифических воспалительных процессах в легких спиральная КТ позволяет обнаружить многочисленные мелкие полости распада, выявить участки эмфиземы, неравномерность изменения просвета бронхов, а также рентгенонегативные очаги в труднодоступных зонах реберно-позвоночных и сердечно-диафрагмальных синусов. При туберкулезе спиральная КТ дает возможность более детально изучить структуру инфильтратов, установить в них мелкие полости распада и перифокальные бронхиальные отсевы, лимфогенные дорожки к корню и плевре. Важные достоинства этого метода существенно дополняются преимуществами МРТ в определении и дифференциации неврогенных опухолей средостения, тератом, липом, опухолей вилочковой железы и лимфоаденопатий. Липомы и тератомы (11%) имеют при этом характерные MPT-сигналы. Особое место МРТ занимает в диагностике аневризм различных отделов аорты, а также таких ее осложнений, как частичное тромбирование и расслоение.
О возможностях спиральной КТ в диагностике патологии артериального русла сообщили В. Н. Макаренко, А. В. Иваницкий (Москва). КТ-ангиография, представленная авторами, основана на спиральном (объемном) рентгеновском сканировании при первом прохождении болюса контрастированной крови в исследуемой зоне и требует полной и четкой синхронизации сканирования с введением контрастного вещества. Опыт работы авторов на спиральном компьютерном томографе средней мощности (рентгеновская трубка —3,5 млн. тепл. ед.) показывает прекрасные возможности визуализации сосудов Виллизиева круга, сонных, позвоночных, почечных артерий и вен. По мнению авторов, на сегодня нет достойной альтернативы спиральной КТ с болюсным контрастированием при исследованиях расслаивающейся аневризмы аорты.
О новом подходе к лучевой диагностике вазоренальной гипертонии сообщили В. Н. Макаренко и соавт. (Москва). Авторы изучали потенциал КТ-ангиографии для оценки сосудистого русла и паренхимы почек, а также возможности сокращения диагностического алгоритма обследования пациентов с клиникой вазоренальной гипертонии. Результаты показали, что КТ-ангиография является малоинвазивным и высокоинформативным методом, имеющим большой потенциал для оценки не только артерий и вен почек, но также паренхимы и выделительной системы. Благодаря рациональному использованию спиральной КТАГ, значительно сокращается объем лучевых исследований у больных с вазоренальной гипертонией.
Е.И. Алейников и А.Г. Мыльников (Москва) изучали возможности КТ и МРТ в диагностике острого панкреатита и его осложнений. РКТ дает возможность достоверно верифицировать и определять распространенность некроза поджелудочной железы, в то время как МРТ отчетливо визуализирует зоны скоплений жидкости в паренхиме поджелудочной железы и парапанкреатическом инфильтрате. Более отчетливо, чем при КТ, в зонах некроза поджелудочной железы и парапанкреатического инфильтрата авторы получали изображение магистральных кровеносных сосудов и оценивали по ним состояние кровотока, выявляли тромбоз. Благодаря отсутствию лучевой нагрузки, возможны частые повторные МРТ для контроля за динамикой течения воспалительно-деструктивного процесса в поджелудочной железе и парапанкреатической клетчатке.
А. К. Морозов и соавт. (Москва) поделились опытом исследований МРТ при заболеваниях и повреждениях костно-суставной системы. По их данным, трудно переоценить МРТ-исследование в распознавании и дифференциальной диагностике мягкотканных опухолей, мягкотканного компонента костных опухолей, дисплазий, воспалительных процессов. МРТ позволяет проводить диагностику и дифференциальную диагностику опухолевых, дегенеративно-дистрофических воспалительных и костно-ревматических процессов с высокой достоверностью, что обеспечивает выбор оптимальной тактики лечения.
В целом конференция способствовала расширению кругозора специалистов в области использования современных методов лучевой диагностики.
Опухоли средостения: клиника и лечение
Средостение ( mediastinum ) – комплекс органов, расположенных в грудной полости между левой и правой медиастинальной плеврой, задней поверхностью грудины и грудным отделом позвоночника и шейками ребер.
Чаще всего средостение делится на 3 отдела (переднее — периваскулярное, среднее — висцеральное, заднее — паравертебральное). Опухоли и кисты — новообразования различного гистогенеза, объединенные в общую нозологическую группу благодаря расположению в одной анатомической области.
Патоморфологические формы характеризуются чрезвычайным многообразием. Развитие опухолей и кист среди жизненно важных органов в ограниченном пространстве приводит к сдавлению, смещению элементов средостения, создавая риск для жизни больного.
Опухоли могут исходить из самих органов, эктопированных и тканей между ними. Кисты являются следствием патологических процессов и пороков развития с формированием полостей.
Особенностями проблем опухолей и кист являются морфологические и анатомо-физиологические характеристики средостения, трудности морфологической верификации, неопределенность лечебной тактики при ряде заболеваний.
Цены на платные услуги
Клиника и методы диагностики опухолей средостения
В структуре онкологических заболеваний опухоли и кисты составляют 3–7 %, из них 80 % — доброкачественные, 20 % — злокачественные. Озлокачествление доброкачественных опухолей отмечается в 17–41 % случаев.
Чаще встречаются в возрасте 18–45 лет. Рак развивается из тканей органов средостения, нервной и соединительной ткани, клеток стволовых и появляющихся при нарушенном внутриутробном развитии.
Причины заболевания до конца не выяснены. По мнению большинства ученых-медиков, патология развивается из-за воздействия:
- ионизирующего излучения;
- контакта с канцерогенами в быту и профессиональной среде;
- вирусов Энштейна – Барра, ВИЧ и других.
- одышка, головные боли, синюшность губ, расширенные вены и отечность лица и шеи;
- истощение, утомляемость, мышечная слабость;
- нарушение сердечного ритма, его замедление или учащение;
- повышение температуры тела до 37 о С;
- плеврит;
- кашель;
- боль в грудной клетке и суставах;
- кровохарканье;
- значительная потеря массы тела – до 15 кг.
Заболевание может маскироваться под вялотекущий бронхит или пневмонию, что затрудняет диагностику. У трети больных на начальных стадиях симптомов нет.
В клинике опухолей и кист средостения выделяют два периода:
- скрытый бессимптомный — опухоль случайно выявлена на рентгене легких или компьютерной томографии;
- выраженную клинику — боль, затруднение дыхания, кашель, субфебрилитет, признаки компрессии органов (верхней полой вены, пищевода, трахеи, нервов и спинного мозга, сердца).
Для диагностики используют:
- рентгеноскопию грудной клетки в нескольких проекциях;
- УЗИ;
- КТ и МРТ, позитронно-эмиссионную томографию;
- эндоскопические методики – фибробронхоскопию, медиастиноскопию, видеоторакоскопию;
- пункционную биопсию, в том числе увеличенных лимфоузлов;
- лабораторные анализы.
Злокачественные опухоли средостения имеют короткий бессимптомный период развития, быстро увеличиваются в размерах, метастазируют, дают симптомы компрессии органов.
Лечение опухоли средостения
Тактика зависит от стадии заболевания. Хирургический метод приоритетен при всех формах опухолей и кист, за исключением лимфом, при которых тактика требует индивидуализации (приоритет — химиолучевой метод). При злокачественных опухолях средостения хирургический метод может сочетаться с лучевым, химиотерапией, которые повышают эффективность терапии.
Показанием к хирургическому лечению являются опухоли и кисты средостения независимо от наличия клиники, локального и местного распространения, за исключением лимфом. При герминогенных опухолях возможна неоадъювантная химиотерапия.
Показанием к хирургическому лечению являются опухоли и кисты средостения независимо от наличия клиники, локального и местного распространения, за исключением лимфом. При герминогенных опухолях возможна неоадъювантная химиотерапия.
Противопоказания к хирургическому лечению:
- выраженный синдром сдавления верхней полой вены (венозное давление выше 200 мм вод. столба.);
- генерализация злокачественного процесса;
- прорастание пищевода, трахеи, главных бронхов с невозможностью их резекции;
- сопутствующая органная недостаточность.
При невозможности хирургического лечения показано проведение химиолучевой терапии.
Читайте также:
