Эффективность лечения эндофтальмита (внутриглазной инфекции)
Добавил пользователь Валентин П. Обновлено: 29.01.2026
Эндофтальмит — инфекционный острый гнойный воспалительный процесс внутренних оболочек глаза и стекловидного тела; одно из самых тяжелых осложнений интраокулярной хирургии и проникающих ранений глаза; ургентное состояние, требующее неотложного лечения.
2. Этиология эндофтальмита:
3. Патогенез эндофтальмита:
- Повреждение роговицы, склеры;
- Нарушение иммунологической изолированности глаза;
- Развитие аутоимунного процесса;
- Снижение сопротивляемости к инфекции;
- Проникновение возбудителя в стекловидное тело;
- Образование гнойного очага с расплавлением внутренних оболочек.
4. Пути проникновения инфекции при эндофтальмите:
- Первичное инфицирование через разрез, непосредственно в момент ранения, операции (эндофтальмит развивается на 1, 2, 3 сутки);
- Вторичное инфицирование (эндофтальмит возникает в поздние сроки);
- Причина: дезадаптация краев раны (отек, инфильтрация, размозжение, колебания ВГД, фильтрующий рубец, сквозные швы).
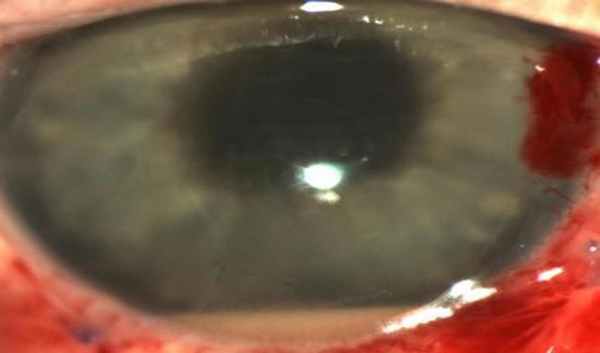
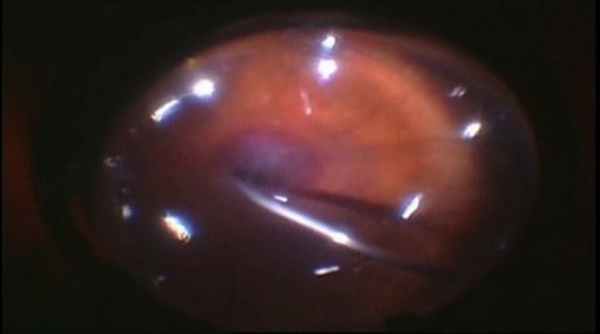
Биомикроскопия. Гипопион.
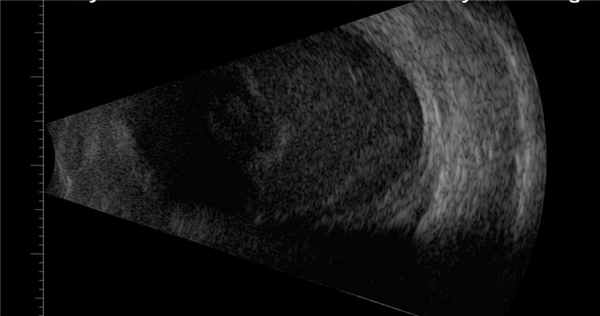
В-сканирование. Экссудат в стекловидном теле.
Хирургическое лечение эндофтальмита —
Принцип хирургии внутриполостных гнойных процессов — вскрытие гнойной полости, освобождение ее от скопившегося гноя, обеспечение дренирования;
«Где гной, там разрез», «где гной, там очищай» (Гиппократ).
Показания к хирургическому лечению эндофтальмита
- отсутствие рефлекса с глазного дна;
- гипопион;
- фиброзная экссудация;
- невозможность офтальмоскопии;
- снижение зрения до проекции света;
- УЗИ: уплотнение очагов стекловидного тела, утолщение, приподнятость сетчатой и сосудистой оболочек, наличие фиброзных шварт.
Приоритет исследования!
Наш опыт применения силиконовой тампонады в лечении эндофтальмита впервые был представлен в 2002 году (Худяков А.Ю., Егоров В.В.)

Использование нами силиконовой тампонады при витрэктомии по поводу эндофтальмита. Преимущества:
- Силикон заполняет авитреальную полость – отсутствие полого пространства;
- Устраняется возможность накопления клеток и медиаторов воспаления
- Эффективное бактериостатическое действие силикона.
Клинический случай. Эндофтальмит после экстракапсулярной экстракции травматической катаракты.
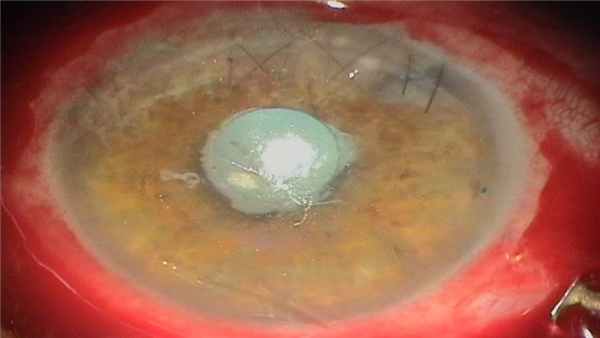
Вид операцинонного поля.
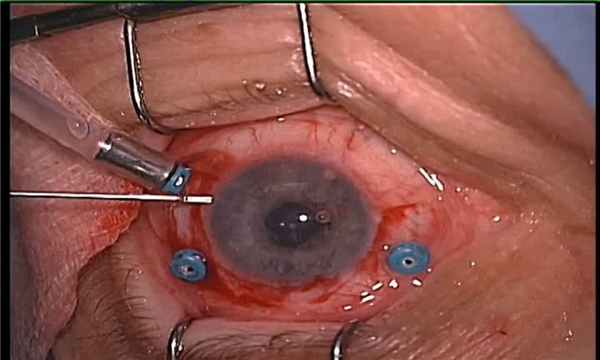
Этапы операции.
Начало операции.
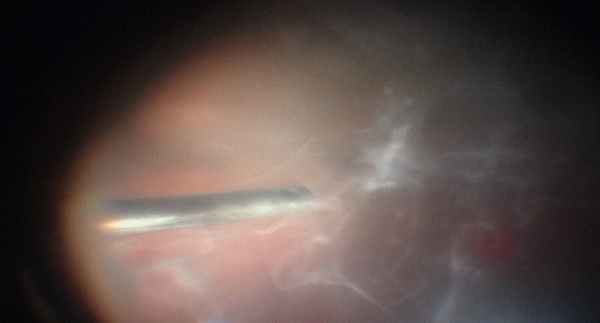
В ходе операции удаления изменённого стекловидного тела.
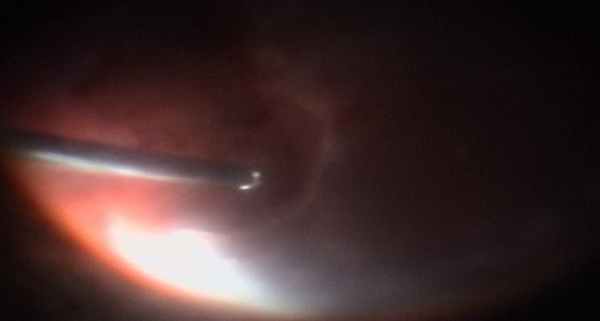
Удаление гнойного экссудата на периферии на заключительном этапе операции.
Заполнение витреальной полости силиконовым маслом в конце операции.
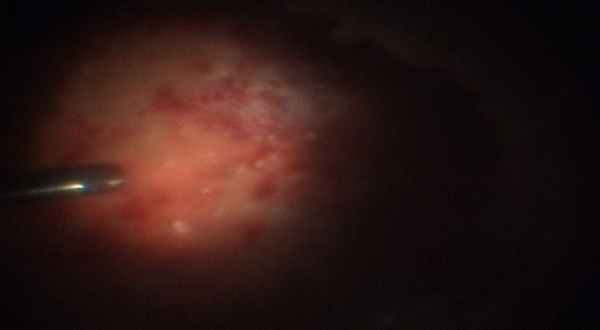
По нашим данным, использование силиконовой тампонады сохранило размеры и форму глазного яблока в 90% глаз.
Силиконовая тампонада — патогенетически обоснованный метод лечения эндофтальмита, опыт нашего отделения указывает на то, что операцию необходимо выполнять не позднее 1-2 суток выявления острого эндофтальмита.
В нашем отделении разработана оптимальная методика хирургического лечения макулярных разрывов большого диаметра.
Мы впервые в РФ сообщали о эффективности силиконовой тампонады при рецидивирующем и персистирующим инволюционном макулярном разрыве (ИМР).
Нами проведен сравнительный анализ исходов лечения ИМР методами воздушной и силиконовой тампонады — для выбора оптимальной технологии лечения ИМР большого диаметра.
Доказана высокая эффективность метода.
До операции. Макулярный разрыв более 1000мкн.
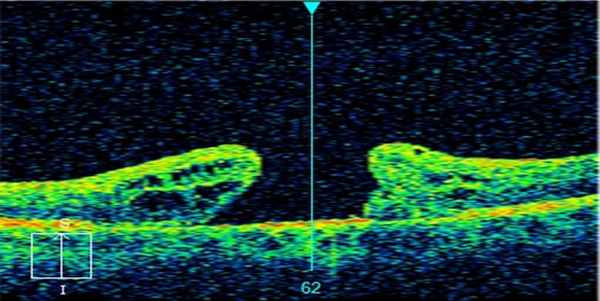
После операции. Разрыв закрыт.
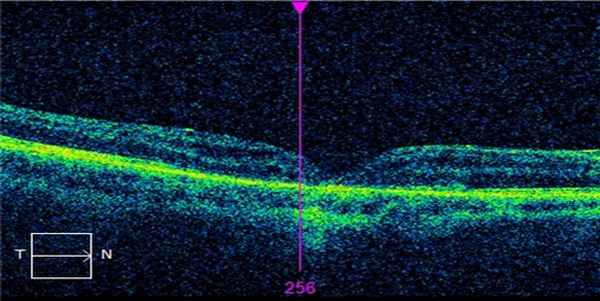
Нами сделан вывод, что при хирургии макулярного разрыва 3 и 4-й стадий предпочтительнее использовать силиконовую тампонаду.
Ее преимущества — минимизация риска разблокирования разрывов при завершении силиконовой тампонады в стандартные сроки, сохранение адаптации разрыва при более длительной тампонаде.
В отделении изучены возможности хирургического лечения массивной субретинальной геморрагии на фоне влажной формы возрастной макулярной дегенерации и внедрена технология операции.
Приоритет метода.
Нами впервые, в 2015 году опубликована методика хирургического лечения массивной субмакулярной геморрагии на фоне влажной формы ВМД путем субретинального введения рекомбинантной проурокиназы («Гемаза») и пневмодислокации сгустка крови.
Клинический материал.
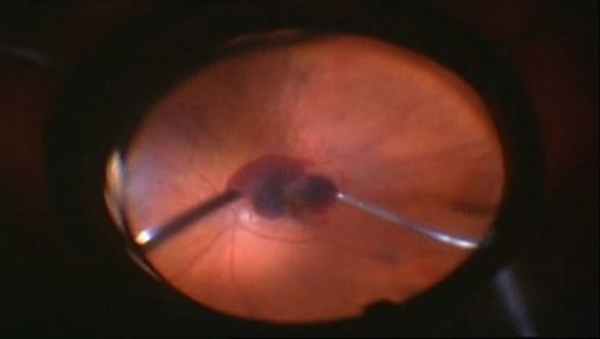
Этапы операции. 25G витректомия.
Пункция иглой 38G и введение в субмакулярное пространство раствора гемазы.
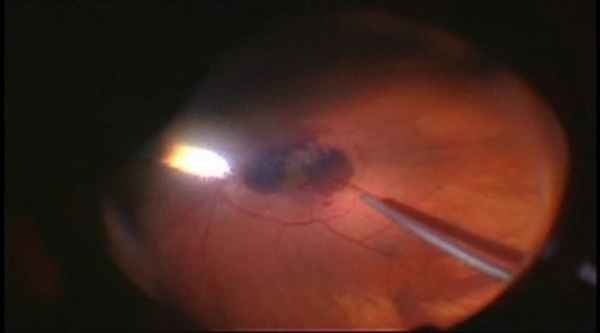
Пневморетинопексия.
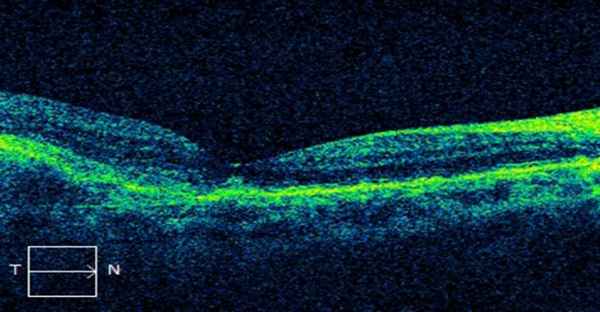
После операции. ОСТ. Вернулась анатомическая форма фовеа.
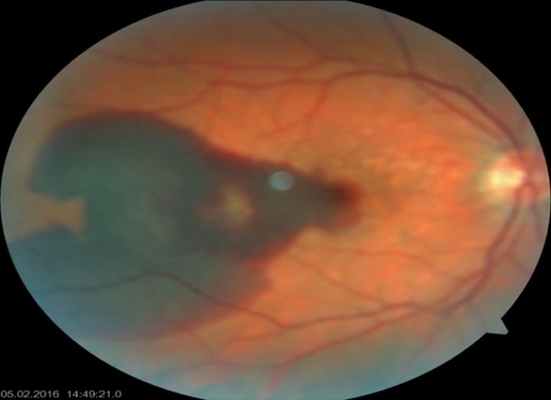
После операции. Глазное дно. Массивное субмакулярное кровоизлияние рассосалось.
Единый информационный телефон 8 (4212) 25-27-37
680033, г. Хабаровск, ул. Тихоокеанская,211
Все права защищены.
© ХФ ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России 2009-2021 г.
Информация, представленная на сайте не является публичным договором
и носит информационно-ознакомительный характер.
Эффективность лечения эндофтальмита (внутриглазной инфекции)
Эффективность лечения эндофтальмита (внутриглазной инфекции)
По мнению П. И. Лебехова, в период, предшествующий разработке описанных выше современных методов комплексного лечения внутриглазной раневой инфекции, в частности — хирургических и медикаментозно-хирургических, прогноз гнойного иридоциклита, не переходящего в травматический эндофтальмит, сравнительно благоприятный. При этом удается сохранить на достаточно высоком уровне функции глаза, если он не пострадал от самого механического повреждения.
Что же касается эндофтальмита, то прогноз его лечения длительное время оставался неутешительным. В этой связи В.Р.Одинцов в 1939г. рекомендовал даже производить энуклеацию или экзентерацию (при панофтальмите) глазного яблока сразу же, как только устанавливается диагноз травматического эндофтальмита. Причиной такого прогноза в эпоху отсутствия антибиотиков была высокая частота развития менингита и сепсиса в исходе эндофтальмита.
Введение и клиническую практику сульфаниламидов и антибиотиков позволило отказаться от этих рекомендаций. Хотя прогноз травматического эндофтальмита оставался неутешительным, в 50-60-е гг. у 35-40% больных уже удавалось сохранить глазное яблоко в случаях раневой внутриглазной инфекции, причем в ряде случаев даже с удовлетворительными зрительными функциями. По данным П. И. Лебехова, использование только медикаментозного метода антибактериальной терапии обеспечивает сохранение глаза у 21,7% больных с зндофтальмитом.
Н. Н. Нурмамедов и соавт., проанализировав результаты лечения эндофтальмита у 200 больных за период 1970-1980 гг., при подобном подходе констатировали гибель глаза в 69,1% случаев. Использование комбинированного лечения с интравитреальными инъекциями антибиотиков позволило повысить количество сохраненных глаз при травматическом эндофтальмите до 71,2% с хорошей зрительной функцией у 19,4% больных при своевременно начатом лечении (Лебехов П. И.).
На клиническом материале архива Московского НИИ глазных болезней им. Гельмгольца были проанализированы результаты лечения внутриглазной посттравматической инфекции у 280 больных, находившихся па лечении в институте в период с 1968 по 1977 г. (Южаков А. М.). Данный период характеризовался отсутствием разработанных позднее методов хирургического лечения (закрытая витрэктомия, дренирование передней камеры) и интравитреального введения антибиотиков (непрерывная перфузия).

Лечение включало удаление внутриглазного инородного тела у 153 пациентов, проведение интенсивной местной и общей антибактериальной терапии, а также кортикостеро-идной, дезинтоксикационной, неспецифической рассасывающей, десенсибилизирующей и общеукрепляющей терапии. При этом внутримышечно вводили пирогенал, под конъюнктиву инъецировали фибринолизин, внутривенно вводили хлористый натрий, глюкозу, уротропин, внутрь назначали димедрол или супрастин, поливитамины. Местно назначались различные антибактериальные препараты.
Антибиотики вводили под коныоиктиву и ретробульбарно, а также внутримышечно или внутрь. Кортикостероиды применяли в виде глазных капель, подкопъюнктивальных инъекций, а при тяжелом клиническом течении назначали внутрь по соответствующей схеме.
В результате проведенного лечения внутриглазной инфекционный процесс, протекавший в виде гнойного иридоциклита, был ликвидирован у 102 (92,7%) из 110 больных. У 73 больных положительный терапевтический эффект достигнут при консервативном лечении. У 29 больных вследствие недостаточной эффективности консервативной терапии был произведен парацентез роговицы с промыванием передней камеры и введение в псе раствора антибиотика (1000 ЕД линкомицина, 2000 ЕД неомипина или мономицина). Данная процедура позволила получить положительный терапевтический эффект.
У 8 больных гнойный процесс прогрессировал с распространением инфекции на задний отдел глазного яблока. Несмотря на замену антибиотиков, использование интравитреального введения антибиотиков, прогрессировавший диффузный эндофтальмит вызвал необходимость энуклеации. Следует отмстить, что интравитреальное введение антибиотиков осуществлялось при уже далеко зашедшем инфекционном процессе, когда зрение у больных было почти полностью утрачено (светоощущение с неправильной проекцией).
Результаты лечения больных с инфекцией заднего отдела глазного яблока были значительно хуже, чем в случаях гнойного иридоциклита. Из 156 больных, у которых инфекционный процесс протекал в виде эидофтальмита, глаз был сохранен только у 59 (37,8%). Для оценки эффективности различных способов введения антибиотиков больные были разделены на три группы.
В первой группе, состоявшей из 89 больных, антибиотики вводили под конъюнктиву глазного яблока и ретробульбарно, одновременно назначали внутримышечно или внутрь. Выбор антибиотика в большинстве случаев осуществлялся произвольно, бактериологическая диагностика не произволилась. В результате проведенного лечения инфекция была ликвидирована у 22 (24,7%) больных.
Во вторую группу были объединены больные, у которых терапия была дополнена внутривенным введением антибиотика (морфоциклина, олеандомицина или тетраолеана), а также применением антистафилококкового у-глобулина. Положительный терапевтический эффект получен у 10 (32,3%) из 31 больного. У остальных больных глаз был энуклеирован.
Больным третьей группы, состоявшей из 36 пациентов, на фоне интенсивной местной и общей антибиотикотерапии препараты инъецировали интравитреально. При этом использовали неомицин или мономицин в дозе 2000 ЕД. Глаз был сохранен у 27 (75%) пациентов.
Из общего числа больных с положительными результатами лечения эндофтальмита у 46 (78%) острота зрения при выписке была в пределах от 0 до светоощущения с правильной проекцией, у 11 (18,6%) — от 0,001 до 0,09 и у 2 (3,4%) — от 0,1 до 0,2. Наиболее частыми причинами снижения остроты зрения у больных, перенесших внутриглазной инфекционный процесс, являлись заращение зрачка, помутнение хрусталика, швартообразование в стекловидном теле и отслойка сетчатки.
Таким образом, результаты предшествующего опыта лечения внутриглазной раневой инфекции свидетельствуют, что тактика офтальмолога при развившемся внутриглазном гнойном воспалении должна быть достаточно активной, с использованием современного комплексного лечения с акцентом на раннее введение антибиотика в полость глаза и раннее использование хирургических методов лечения.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Современные аспекты лечения острых бактериальных послеоперационных эндофтальмитов
Острый бактериальный послеоперационный эндофтальмит является разрушительной внутриглазной инфекцией с тенденцией к увеличению заболеваемости и распространенности. Этому явлению способствует общемировой рост хирургической активности в совокупности с увеличением продолжительности жизни населения. На сегодняшний день частота встречаемости острого эндофтальмита варьирует от 0,039% до 0,59% в лучших мировых офтальмологических клиниках. Современные подходы к комплексному лечению острых бактериальных послеоперационных эндофтальмитов подробно описаны в исследованиях EVS 1995 и ESCRS 2013, где отражены два основных стандарта лечения: «золотой» и «серебряный». «Золотой стандарт» включает в себя проведение 3-портовой витрэктомии с посевом содержимого передней камеры и витреальной полости на микрофлору и интравитреальным введением антибиотиков на завершающем этапе операции в течение 1 часа после диагностирования острого эндофтальмита. Выполнение «Серебряного стандарта» приемлемо при отсутствии витреоретинальной операционной и подготовленного хирурга, т.е. в тех случаях, когда выполнение полноценного витреоретинального вмешательства не представляется возможным. В таких случаях хирургическое вмешательство ограничивается забором содержимого витреальной полости и передней камеры на посев микрофлоры с интравитреальным введением антибиотиков на завершающем этапе операции. На сегодняшний день перед хирургами стоит задача не только подавления инфекции и сохранения глаза как органа, но и максимально возможное сохранение зрительных функций. В обзоре литературы рассмотрены вопросы выбора антибиотиков, которые обладают достаточно широким спектром действия, минимальной резистентностью, приемлемыми темпами стерилизации и минимальной токсичностью. Обсуждаются вопросы фармакокинетики современных антибиотиков и факторы, оказывающие на нее влияние: молекулярная масса антибиотика, степень разжижения стекловидного тела, коэффициент растворимости препарата, степень воспаления глазного яблока, состояние иридохрусталиковой диафрагмы и витреальной полости (факия, афакия, артифакия, авитрия, силиконовая тампонада), плотность раствора с разведённым антибиотиком. Рассмотрены особенности и преимущества витреоретинального вмешательства. Проведен анализ выбора заместителей стекловидного тела, которые способны улучшать анатомические результаты лечения. Таким образом, в настоящее время продолжается поиск наиболее эффективного алгоритма лечения острого бактериального эндофтальмита.
Ключевые слова
Об авторах
д.м.н., врач-офтальмохирург заведующий витреоретинальным отделением,
ул. Академика Бардина 4-А, Екатеринбург, 620149
ул. Академика Бардина 4-А, Екатеринбург, 620149
д.м.н., член корреспондент РАН, проректор по лечебной работе,
ул. Островитянова, 1, Москва, 117997
Список литературы
1. Trends in aging — United States and Worldwide. Morbidity and Mortality Weekly Report. 2003;52(6):101-4, 106.
2. West ES, Behrens A, McDonnell PJ, et al. The incidence of endophthalmitis after cataract surgery among the US Medicare population increased between 1994 and 2001. Ophthalmology. 2005;112:1388–94. DOI:10.1016/j.ophtha.2005.02.028
3. Taban M, Behrens A, Newcomb RL, et al. Acute endophthalmitis following cataract surgery. A Systematic Review of the Literature. Arch Ophthalmol. 2005;123:613–20.
4. Kunimoto DY, Kaiser RS. Wills. Eye Retina Service. Incidence of endophthalitis after 20- and 25-gauge vitrectomy. Ophthalmology. 2007;114(12):2133–7. DOI:10.1016/j.ophtha.2007.08.009
5. Barry P., Cordoves L., Gardner S. ESCRS Guidelines for Prevention and Treatment of Endopthalmitis Following Cataract Surgery. Co Dublin: Temple House, Temple Road, Blackrock, 2013. р. 7-8.
6. Malyugin B.E., Shpak A.A., Morozova T.A. [Pharmacological support of modern cataract surgery]. [Ophthalmology]. 2010, р.15 (in Russ.).
7. Barry P., Cordoves L., Gardner S. ESCRS Guidelines for Prevention and Treatment of Endopthalmitis Following Cataract Surgery. Co Dublin: Temple House, Temple Road, Blackrock, 2013. р. 21-22.
9. Abdhish R. Bhavsar. [Vitreoretinal surgery]. Moscow, Logosfera, 2013:259. (in Russ.).
10. Abdhish R. Bhavsar. [Vitreoretinal surgery] Moscow, Logosfera, 2013:264. (in Russ.).
11. Peyman GA, Schulman JA. Intravitreal drug therapy. Jpn J Ophthalmol. 1989;33(4):392–404.
12. Baum J, Peyman GA, Barza M. Intravitreal administration of antibiotic in the treatment of bacterial endophthalmitis. III. Consensus. Surv Ophthalmol. 1982;26(4):204–206. DOI: 10.1016/0039-6257(82)90080-7.
13. Urtti A. Challenges and obstacles of ocular pharmacokinetics and drug delivery.Adv Drug Deliv Rev. 2006;58:1131–1135. DOI: 10.1016/j.addr.2006.07.027.
14. Endophthalmitis Vitrectomy Study Group. Spectrum and susceptibilities of microbiologic isolates in the Endophthalmitis Vitrectomy Study. Am J Ophthalmol. 1996;122:1–17.
15. Esmaeli B, Holz ER,Ahmadi MA,Krathen RA, Raad II. Endogenous endophthalmitis secondary to vancomycin-resistant enterococci infection. Retina. 2003;23(1):118–9.
17. Bains HS, Weinberg DV, Feder RS, Noskin GA. Postoperative vancomycin-resistant Enterococcus faecium endophthalmitis. Arch Ophthalmol. 2007;125(9):1292–3. DOI:10.1001/archopht.125.9.1292
18. Tang CW, Cheng CK, Lee TS. Community-acquired bleb-related endophthalmitis casued by vancomycin-resistant enterococci. Canadian Journal of Ophthalmology. 2007;42(3):477–8. DOI: 10.3129/canjophthalmol.i07-057
19. Clark NC, Weigel LM, Patel JB, FCT Comparison of Tn1546-like elements in vancomycin-resistant Staphylococcus aureus isolates from Michigan and Pennsylvania. Antimicrobial Agents and Chemotherapy. 2005;49:470–2.
20. Tiwari HK, MrS Emergence of vancomycin resistant Staphylococcus aureus (VRSA) from a tertiary care hospital from northern part of India. BMC Infectious Diseases. 2006;6:156. DOI: 10.1186/1471-2334-6-156.
21. Gillis LM, White HD, Whitehurst A, DCS Vancomycin-tolerance among clinical isolates of Streptococcus pneumoniae in Mississippi during 1999 –2001. Am J Med Sci. 2005;330:65–8.
22. Novak R, Henriques B, Charpentier E, et al. Emergence of vancomycin tolerance in Streptococcus pneumoniae. Nature. 1999;399(6736):590–3.
23. National Nosocomial Infections Surveillance System. National Nosocomial Infections Surveillance (NNIS) System Report, data summary from January 1992 through June 2004, issued October 2004. American Journal of Infection Control. 2004;32(8):470–85.
25. Clinical and Laboratory Standards Institute. Perfomance Standards for Antimicrobial Susceptibility Testing; Sixteenth Information Supplement M 100-S16. 2006. p.121.
26. D.C. Hooper. Target Modification as a Mechanism of Antimicrobial Resistance. In Bacterial Resistance to Antimicrobials. Ed. By K. Lewis, A.A. Salyers, H.W. Taber, R. G. Wax. Marcel Dekker, Inc. New York. 2002. p. 161-182.
27. Han DP, Wisniewski SR, Wilson LA, et al. Spectrum and susceptibilities of microbiologic isolates in the Endophthalmitis Vitrectomy Study. Am J Ophthalmol. 1996;122:1–17.
28. Smith MA, Sorenson JA, Lowy FD. Treatment of experimental methicillinresistant staphylococcus epidermidis endophthalmitis with intravitreal vancomycin. Ophthalmology. 1989;93:1328–1335.
29. Pflugfelder SC, Hernandez E, Fliesler SJ, et al. () Intravitreal vancomycin. Retinal toxicity, clearance, and interaction with gentamicin. Arch Ophthalmol. 1987;105:831–837.
30. Levinson ME. Pharmacodynamics of antibacterial drugs. Infect Dis Clin N Am 2000;14:281–291.
31. Piguet B, Chobaz C, Gounauer PA. Rétinopathie toxic sur injection intravitréenne d'Amikacine et Vancomycine. Klin Monatsbl Augenheilkd. 1996;208:358–359.
32. Comer GM, Miller JB, Schneider EW, Khan NW, Reed DM, Elner VM, Zacks DN. Intravitreal Daptomycin: A safety and efficacy study. Retina. 2011 Jun;31(6):1199206. DOI: 10.1097/IAE.0b013e318207d1b9.
33. Bernard H, Barza M. Ceftazidime or amikacin: choice of intravitreal antimicrobials in the treatment of postoperative endophthalmitis. Arch Ophthalmol. 1994;112(1):17–18.
34. Ozkiris A, Evereklioglu C, Kontas O, Oner AO, Erkilic K. Determination of nontoxic concentrations of piperacillin/tazobactam for intravitreal application: an electroretinographic, histopathologic and morphometric analysis. Ophthalmic Res. 2004;36:139–144. DOI: 10.1159/000077326.
35. Pathengay A, Mathai A, Shah GY, Ambatipudi S. Intravitreal piperacillin/ tazobactam in the management of multidrug-resistant Pseudomonas aeruginosa endophthalmitis. J Cataract Refract Surg. 2010;36(12):2210–2211. DOI: 10.1016/j.jcrs.2010.09.013.
36. Mitra AK, Anand BS, Duvvuri S. In: The biology of eye. Fischbarg J, editor. Academic, New York; 2006. Drug delivery to the eye; pp. 307–351.
37. Maurice DM. In: Symposium on ocular therapy. Leopold IH, Burns RP, editor. Wiley, New York; 1976. Injection of drugs into the vitreous body; pp. 59–72.
38. Barza M, Kane A, Baum J. Pharmacokinetics of intravitreal carbenicillin, cefazolin, and gentamicin in rhesus monkeys. Invest Ophthalmol Vis Sci. 1983;24(12):1602–1606.
39. Coco RM, López MI, Pastor JC, Nozal MJ. Pharmacokinetics of intravitreal vancomycin in normal and infected rabbit eyes. J Ocul Pharmacol Ther. 1998;14(6):555–563. DOI: 10.1089/jop.1998.14.555.
40. Pearson PA, Hainsworth DP, Ashton P. Clearance and distribution of ciprofloxacin after intravitreal injection. Retina. 1993;13(4):326–330.
41. Pharmacokinetics. Endophthalmitis: diagnosis and management. (Illustrated edition, 81–92) Taylor & Francis, London; 2004.
42. Hegazy HM, Kivilcim M, Peyman GA, Unal MH, Liang C, Molinari LC, Kazi AA. Evaluation of toxicity of intravitreal ceftazidime, vancomycin, and ganciclovir in a silicone oil-filled eye. Retina. 1999;19:553–557.
43. Johnson F, Maurice D. A simple method of measuring aqueous humor flow with intravitreal fluoresceinated dextrans. Exp Eye Res. 1984;39:791–805
44. D. Kanski. [Clinacal Ophthalmology: systematic approach]. Wroclaw: Elsevier Urban & Partner, 2009. — 944 р. (in Russ.).
45. Results of the Endophthalmitis Vitrectomy Study. A randomized trial of immediate vitrectomy and of intravenous antibiotics for the treatment of postoperative bacterial endophthalmitis. Endophthalmitis Vitrectomy Study Group. Arch Ophthalmol. 1995;113(12):1479-96.
46. Sternberg Jr P, Martin DF. Management of endophthalmitis in the postEndophthalmitis Vitrectomy Study era. Arch Ophthalmol. 2001; 119(5): 754–755. DOI:10.1001/archopht.119.5.754
47. Durand ML. The post-Endophthalmitis Vitrectomy Study era. Arch Ophthalmol 2002; 120(2): 233–234.
48. Kuhn F, Gini G.Vitrectomy for endophthalmitis. Ophthalmology 2006;113(4): 714. DOI:10.1016/j.ophtha.2006.01.009
49. Barry P., Cordoves L., Gardner S. ESCRS Guidelines for Prevention and Treatment of Endopthalmitis Following Cataract Surgery. Co Dublin: Temple House, Temple Road, Blackrock, 2013. р.21
50. Kuhn F, Gini G. Ten years after. Are findings of the Endophthalmitis Vitrectomy Study still relevant today? Graefes Arch Clin Exp Ophthalmol. 2005;243:1197–1199.
51. Lebedev Ya.B., Egorov V.V., Khudyakov A.Yu., Zhigulin A.V., Rudenko V.A., Mashchenko N.A. [Long-term results of the use of silicone tamponade in the treatment of endophthalmitis]. [Modern technologies of treatment of vitreoretinal pathology. 2013, р. 122. (in Russ.).
52. Egorov V.V., Lebedev Ya.B., Khudyakov A.Yu., Smolyakova G.P. [Silicon tamponade of vitreous cavity in the surgical treatment of endophthalmitis]. Silikonovaya tamponada vitreal'noi polosti v khirurgicheskom lechenii endoftal'mita. [Cataract and Refractive Surgery]. Kataraktal'naya i refraktsionnaya khirurgiya. 2012;3:2629.53. (in Russ.).
53. Oldrich Chrapeka, Renata Vecerovab, Dagmar Koukalovab, Klara Maresovaa, Barbora Jirkovaa, Martin Sina, Jiri Rehaka. The in vitro antimicrobial activity of silicone oils used in ophthalmic surgery. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 2012 Mar; 156(1):7–13. DOI: 10.5507/bp.2011.060.
54. Thomas BJ, Yonekawa Y, Ruby AJ, Capone A Jr. Aggressive Surgical Therapy With Early Vitrectomy, Panretinal Photocoagulation, and Silicone Oil Tamponade for Streptococcus mitis Endophthalmitis. Ophthalmic Surg Lasers Imaging Retina. 2015 Sep 1;46(8):893-5.
55. Goel N, Bhambhwani V, Ghosh B. Multidrug-resistant Pseudomonas aeruginosa endophthalmitis in a silicone oil-filled eye treated with piperacillin/ tazobactam: report of a case and review of literature. Int Ophthalmol. 2015 Aug; 35(4):599-602. DOI: 10.1007/s10792-015-0072-8. Epub 2015 Jun 3.
56. Pinarci EY, Yesilirmak N, Bayar SA, Sizmaz S, Akkoyun I, Yilmaz G. The results of pars plana vitrectomy and silicone oil tamponade for endophthalmitis aft er intravitreal injections. Int Ophthalmol. 2013 Aug;33(4):361-5. DOI: 10.1007/s10792-012-9702-6. Epub 2013 Jan 1.
59. Bali E, Huyghe P, Caspers L, Libert J., Vitrectomy and silicone oil in the treatment of acute endophthalmitis. Preliminary results. Bull Soc Belge Ophtalmol. 2003;(288):9-14.
60. Zhang J, Han F, Zhai X. Clinical analysis of 23-gauge vitrectomy for the treatment of acute endophthalmitis after cataract surgery. Eur J Ophthalmol. 2015 Apr 1:0. DOI: 10.5301/ejo.5000608.
61. Hegazy HM, Kivilcim M, Peyman GA, Unal MH, Liang C, Molinari LC, Kazi AA. Evaluation of toxicity of intravitreal ceftazidime, vancomycin, and ganciclovir in a silicone oil-filled eye. Retina.1999;19:553–557. DOI: 10.1097/00006982-19991100000013.
62. Frolychev I.A., Pozdeeva N.A. [Vitrectomy PFOS tamponade with replacement on silicone oil in the treatment of postoperative endophthalmitis]. Vitrektomiya s vremennoi endotamponadoi PFOS s zamenoi na silikonovoe maslo v lechenii posleoperatsionnykh endoftal'mitov. [Annals of the Orenburg State University]. Vestnik Orenburgskogo gosudarstvennogo universiteta. 2013;153(4):287-290 (In Russ.).
Анализ результатов лечения пациентов с эндофтальмитом по данным Городского офтальмологического центра при ГМПБ № 2 за 2014-2015 годы

Цель работы: оценить сроки развития, зрительные функции при поступлении и при выписке, результаты консервативного и хирургического лечения эндофтальмита различного генеза.
Материалы и методы. Исследованы 40 пациентов, получавших лечение по поводу послеоперационного, эндогенного, посттравматического эндофтальмита. Средний возраст пациентов — 61 год.
Результаты и обсуждение. Пациенты с послеоперационным эндофтальмитом имеют более высокую исходную остроту зрения, и выполнение неотложной витрэктомии является методом выбора. Пациентам с тяжёлым эндогенным эндофтальмитом чаще требуется выполнение энуклеации. Интравитреальное введение антибиотика при эндофтальмите далеко не всегда приводит к улучшению, но может применяться как дополнение к общей терапии или как мера в ожидании пациентом витрэктомии.
Ключевые слова
Полный текст
Введение
На сегодняшний день эндофтальмит остаётся одним из наиболее опасных послеоперационных и посттравматических осложнений. Травмы глазного яблока примерно в 20 % случаев становятся причиной бактериальных эндофтальмитов. По данным G. Вrinton et al., развитие эндофтальмита наблюдается в 7,4 % после проникающих ранений, причём наличие внутриглазного инородного тела в таких случаях повышает риск гнойной инфекции в 2 раза [1, 2]. Огнестрельные ранения глаза военного времени осложняются развитием эндофтальмита в 4,2 % наблюдений [3]. По данным ESCRS (2013), частота возникновения эндофтальмита после хирургии катаракты составляет от 0,039 до 0,59 %. Использование роговичных тоннельных разрезов в сравнении с методикой выполнения склерального тоннельного разреза увеличивало риск развития послеоперационного эндофтальмита почти в 6 раз; использование силиконовой интраокулярной линзы (в сравнении с акриловой) — более чем в 3 раза; а хирургические осложнения сопровождались 5-кратным увеличением данного риска [4]. Важно отметить, что постоянное развитие технологий и качественный рост хирургии не исключают возможности развития эндофтальмита.
Эндогенный эндофтальмит встречается редко, предрасполагающими факторами являются иммунодефицитные состояния (сахарный диабет, хроническая почечная недостаточность, наркотическая зависимость и др.) [7]. Механизм его развития связан с гематогенным заносом микробных возбудителей в капилляры радужки и ресничного тела из отдалённых воспалительных очагов в организме: при фурункулах, абсцессах, флегмонах, синуситах, тонзиллите, пневмонии, остеомиелите, сепсисе, менингите, септическом эндокардите и других состояниях.
Исследование EVS (1995) рекомендовало проводить витрэктомию только в случаях с остротой зрения на уровне светоощущения. Однако, учитывая технические достижения в области витреоретинальной хирургии, анализ более поздних исследований показал улучшение функциональных результатов при более широком использовании витрэктомии в случаях послеоперационного эндофтальмита, включая пациентов с лучшей, чем светоощущение, остротой зрения (более поздний результат, 91 % с окончательной остротой зрения ≥ 20/40 в сравнении с 53 % в рамках исследования EVS) [5, 6].
Цель работы
Оценить сроки развития, зрительные функции при поступлении и при выписке, результаты консервативного и хирургического лечения эндофтальмита у пациентов, госпитализированных по данному поводу в Городской офтальмологический центр ГМПБ № 2 в 2014–2015 годах, принимая во внимание тот факт, что ГМПБ № 2 является ведущим городским учреждением, принимающим пациентов по скорой помощи.
Материалы и методы
Исследование проводилось на базе отделения микрохирургии глаза № 2 ГМПБ № 2, специализирующегося на витреоретинальной патологии и травме глаза. За 2014–2015 годы на отделении получали лечение 40 пациентов, поступивших по неотложной помощи с диагнозом эндофтальмит, из них 19 мужчин и 21 женщина. Возраст пациентов варьировал от 21 до 86 лет, средний возраст составил 61 год. Хирургические вмешательства проводились с использованием офтальмологического комбайна Constellation (Alcon) и микроскопа Lumera I (Сarl Zeiss).
Результаты и обсуждение
Руководствуясь общепринятым делением эндофтальмита на послеоперационный, посттравматический и эндогенный, исследуемые пациенты были разделены на три указанные группы и по возрасту (см. табл. 1).
Таблица 1. Распределение пациентов по этиологии эндофтальмита и по возрасту
Table 1. Distribution of patients according to endophthalmitis etiology and age
Таким образом, более половины исследованных пациентов (24 человека, 60 %) составили группу с послеоперационным эндофтальмитом. Эндогенный эндофтальмит наблюдался у 11 больных (27,5 %), посттравматический — у 5 больных (12,5 %). У оперированных пациентов пик развития эндофтальмита пришёлся на возрастную группу старше 60 лет, эндогенный эндофтальмит чаще развивался у больных в возрасте 40–60 лет, эндофтальмит как осложнение травмы глаза равномерно проявлялся в обеих группах больных трудоспособного возраста (до 60 лет) — по 2 человека в каждой группе, после 60 лет отмечен 1 случай его развития (из 5).
Послеоперационный эндофтальмит. Критериями включения в данную группу явились наличие в анамнезе одной или нескольких хирургических операций со вскрытием глазного яблока и развитие процесса на оперированном глазу в раннем или позднем послеоперационном периоде. При этом у больных, как правило, отсутствовали отягчающие общие заболевания, или они были компенсированы. Из 24 больных с послеоперационным эндофтальмитом 9 оперированы в ГМПБ № 2, 15 — в других учреждениях города.
По виду вмешательства и срокам проявления послеоперационного эндофтальмита пациенты распределились следующим образом (см. табл. 2). Если больной перенёс несколько вмешательств на глазу, то решающее значение имела и учитывалась последняя выполненная операция.
Таблица 2. Распределение пациентов по виду вмешательства и срокам развития эндофтальмита
Table 2. Distribution of patients according to surgery type and endophthalmitis development terms
ФЭК + ИОЛ (ЭЭК + ИОЛ)
Гипотензивные операции (СТЭ + ЗТС, кл. Ahmed)
Витрэктомия по поводу ЭРМ
Экстрасклеральное пломб. (с пункцией)
Как видно из таблицы 2, значительную часть составили пациенты после катарактальных операций (14 из 24). У большинства из них эндофтальмит развился в раннем послеоперационном периоде — в срок до одной или до двух недель после операции. У 3 из 14 пациентов операция протекала с разрывом задней капсулы, в 2 случаях имплантирована переднекамерная ИОЛ. После гипотензивных операций развитие эндофтальмита отмечалось реже — у 6 больных, у 4 из них — в позднем послеоперационном периоде на глазах с терминальной стадией глаукомы, у 2 пациентов — после постановки клапана Ahmed. Примечательно, что пациенты после вмешательств на стекловидном теле (витрэктомия, ИВВЛ) составили меньшую часть, однако у них эндофтальмит возник быстрее всех — на 2-й день после операции.
Эндогенный эндофтальмит. В данную группу включены пациенты, у которых развитие эндофтальмита происходило на фоне общих некомпенсированных заболеваний или состояний, сопровождающихся ослаблением иммунитета. Если эти пациенты и имели в анамнезе какие-либо вмешательства на глазах, то, как правило, они были выполнены давно, и вряд ли факт развития внутриглазной инфекции был связан с ними.
Большинство больных этой группы (7 из 11) страдало сахарным диабетом, и увеит (с переходом в эндофтальмит) возникал у них на фоне декомпенсации общего заболевания или же вследствие его осложнений (флегмона подошвенной части стопы, остеомиелит и др.). Из других заболеваний (у 3 пациентов соответственно) можно отметить хр. гепатиты В и С, хр. пиелонефрит, рак простаты (с установлением эпицистостомы). У одного пациента 77 лет с хр. пиелонефритом и хр. почечной недостаточностью эндофтальмит был двусторонним. Необходимо отметить, что значительная часть упомянутых пациентов поступала в стационар при довольно тяжёлом общем состоянии, и помимо офтальмолога в их лечении принимали участие эндокринологи, хирурги, урологи и другие специалисты. Кроме того, данная категория больных для уточнения диагноза и лечения требовала проведения самых разных диагностических мероприятий, что возможно в условиях многопрофильного стационара.
У одной пациентки 44 лет односторонний задний увеит с переходом в эндофтальмит развился на фоне полного благополучия, и нам не удалось выявить возможных соматических причин его возникновения.
Посттравматический эндофтальмит, по нашим данным, был выявлен у 5 пациентов: в 4 случаях — после проникающих ранений роговицы с наличием внутриглазного металлического инородного тела; пятый пациент получил контузию глазного яблока с разрывом по корнеосклеральному рубцу, выпадением внутренних оболочек и ИОЛ.
Лечение эндофтальмита. Пациент с эндофтальмитом требует проведения незамедлительных диагностических и лечебных мероприятий сразу после поступления в стационар. Его лечение является нелёгкой задачей, так как врач должен представлять и учитывать целый ряд факторов: исходные функции, состояние оптических сред, возможность офтальмоскопии, данные В-сканирования, скорость развития инфекции, общее состояние пациента. Оценка вышеупомянутых факторов имеет большое значение и требует от врача принятия решения в пользу проведения неотложной хирургии (витрэктомии, энуклеации) или же консервативной антибактериальной и противовоспалительной терапии. Важно отметить, что в случае необходимости выполнения срочной высокотехнологичной операции (витрэктомии) хирург должен располагать необходимым оборудованием и проводить вмешательство при поддержке анестезиологической бригады.
Основные виды лечения послеоперационного, эндогенного и посттравматического эндофтальмита представлены в таблице 3.
Таблица 3. Основные методы лечения эндофтальмита
Table 3. Main methods of endophthalmitis treatment
Клинические случаи хирургического лечения эндофтальмита
Проведен анализ лечения эндофтальмита на примере 4 клинических случаев: 3-м пациентам выполнена витрэктомия с тампонадой витреальной полости силиконовым маслом, 1 пациенту – витрэктомия с интравитреальным введением антибиотика. У всех пациентов наблюдалась полная сохранность глазного яблока и наличие зрительных функций. Своевременная витрэктомия с введением интравитреально антибиотиков либо замещение стекловидного тела силиконовым маслом – достаточно эффективный способ лечения эндофтальмита.
Ключевые слова: эндофтальмит, витрэктомия, силиконовая тампонада.
Актуальность. Безусловно, одним из неотложных состояний в офтальмологии является гнойное воспаление тканей глазного яблока, развивающееся в результате внутриглазной раневой инфекции. Экзогенное инфицирование внутриглазных тканей может произойти после проникающих ранений глаза, полостных операций на глазном яблоке, при прободных гнойных язвах роговицы. Инфекционный эндофтальмит чаще всего является осложнением открытой травмы глаза (95-97%), реже – хирургического вмешательства (2-4%). Эндогенные инфекционные эндофтальмиты встречаются редко – в 1-2% [1]. Эндогенный путь заноса инфекции возможен в результате метастазирования при гнойных септических процессах любой локализации, при общем сепсисе (послеродовый, хирургический, пневмония и др.). Причиной могут стать также фокальные инфекционные очаги (больные зубы, синуситы, тонзиллит, заболевания желудочно-кишечного тракта, мочевыводящих путей, половых органов и др.). Инфекционный эндофтальмит после экстракции катаракты является редким, но серьезным осложнением, создающим определенную угрозу зрительному исходу хирургического вмешательства [5]. Лечение послеоперационного эндофтальмита является непростой проблемой в хирургии катаракты [3]. Посттравматический эндофтальмит остается одним из самых тяжелых осложнений и приводит к гибели глаза даже при самых современных методах лечения [4].
Современные подходы к лечению эндофтальмита включают в себя проведение витрэктомии, интраокулярной антибиотикотерапии и интравитреальной тампонады стекловидного тела различными заместителями, что дало существенный сдвиг в его исходах [2].
Цель. Проанализировать эффективность хирургического лечения эндофтальмита различного генеза на примере клинических случаев.
Материал и методы. Проведен анализ случаев лечения эндофтальмита у 4 пациентов (4 глаза) за период с 2013 по 2014 гг. Возраст пациентов варьировал от 40 до 74 лет. В 3 случаях эндофтальмит возник впоследствии хирургии катаракты, в 1 – как последствие интравитреального введения препарата Луцентис.
Все пациенты были направлены из других медицинских учреждений с различными сроками развития эндофтальмита.
Клинически при поступлении у пациентов отмечалась смешанная инъекция конъюнктивы глазного яблока, различной степени выраженности отек роговицы, в одном случае – гнойная инфильтрация роговицы. В передней камере желеобразный экссудат бело-желтого цвета, у одного пациента – в сочетании с фибринозной пленкой, спаянной с радужкой. Всем пациентам при поступлении брался посев на микрофлору и чувствительность к антибиотикам. Посев воспалительного экссудата передней камеры давал рост преимущественно грам(+) кокков.
Пациент С., 62 лет, обратился за помощью через 1 мес. после интракапсулярной экстракции катаракты с признаками эндофтальмита. Было назначено консервативное лечение, из передней камеры аспирирован воспалительный экссудат и введен раствор антибиотика в камеру и витреальную полость. Учитывая отсутствие положительной динамики от проводимой терапии на 5 сутки, пациенту выполнена стандартная трехпортовая витрэктомия с тампонадой витреальной полости силиконовым маслом.
Пациентка К., 70 лет, обратилась через 2 мес. после факоэмульсификации с симптомами эндофтальмита. Было назначено противовоспалительное лечение, в полость глаза введен раствор антибиотика, но в результате отсутствия динамики в течение 2-х суток госпитализации пациентке выполнена витрэктомия с тампонадой витреальной полости силиконовым маслом.
Пациентка Х., 74 года, направлена через 7 дней после факоэмульсификации с клиникой инфекционного эндофтальмита. В 1-е сутки после госпитализации выполнена субтотальная витрэктомия с тампонадой полости силиконовым маслом.
Пациентка В., 65 лет, обратилась через 2 недели после интравитреального введения раствора Луцентис с симптомами эндофтальмита. Учитывая слабоположительную динамику от проводимого консервативного лечения, пациентке на 3 сутки выполнена витрэктомия с введением в витреальную полость антибиотика. Тампонады силиконовым маслом не понадобилось.
Результаты и обсуждение. Во всех 4 случаях пациентам в различные сроки от 1 до 5 суток после госпитализации выполнена субтотальная трехпортовая (23G) витрэктомия: в 3 случаях – с тампонадой полости глаза силиконовым маслом, в 1 случае – с интравитреальным введением антибиотика. Хирургическое вмешательство начиналось с промывания передней камеры и аспирации воспалительного экссудата. После удаления измененного стекловидного тела отмечался (в 2 случаях) отек сетчатки, стушеванность границ диска зрительного нерва, полнокровие и расширение сосудов сетчатки, множественные интраретинальные кровоизлияния, а также характерные эпиретинальные «ватообразные» экссудаты, которые удалялись путем аспирации. В 2 других случаях после витрэктомии возникла сложность с удалением задней гиалоидной мембраны, плотно прилегающей к сетчатке. Это было связано как с плохой визуализацией из-за отека роговицы и с трудностью дифференцировки сетчатки у одного из пациентов, так и с плотным прилеганием мембраны к сетчатке у другого. По этой же причине у данных пациентов не удалось полностью удалить экссудат.
Трудности, возникшие в ходе операции, напрямую коррелировали со сроками хирургии и соответствующим образом сказывались на функциональном результате.
У всех пациентов наблюдались полная сохранность глазного яблока и наличие зрительных функций. На 1-е сутки после операции отмечалось купирование признаков эндофтальмита: экссудат в передней камере отсутствовал, определялся розовый рефлекс. При выписке в 1 случае острота зрения – счет пальцев с 15 см., в 2 случаях – 0,02 н/к, в одном случае – 0,1 н/к. При дальнейшем наблюдении зрение улучшилось только у одного пациента до 0,3-0,4 н/к.
Однако после выписки через 10-14 дней 2 пациента были повторно госпитализированы с явлениями фибринозно-пластического иридоциклита. Клиническая картина сопровождалась гипопионом и фибринозным выпотом в переднюю камеру, смешанной инъекцией конъюнктивы, отеком роговицы. В одном случае для купирования процесса достаточно было курса противовоспалительной и антибактериальной терапии, в другом – промывание передней камеры с аспирацией воспалительного экссудата. Зрительные функции составили 0,02 и правильную светопроекцию соответственно.
У пациентов с повторно развившимися явлениями воспаления неблагоприятным фоном, возможно, послужили: хронический блефарит у одного и заболевания желудочно-кишечного тракта в сочетании с хроническим пиелонефритом у другого, а также, вероятно, недостаточно адекватная антибиотикотерапия.
Заключение. Эндофтальмит – грозное осложнение, которое требует незамедлительного вмешательства. Успех лечения эндофтальмита в современной практике может обеспечить своевременная витрэктомия с введением интравитреально антибиотиков либо замещение стекловидного тела силиконовым маслом на ранних этапах неэффективности консервативного лечения.
Читайте также:
