ЭКГ при синдроме Бругада и его лечение
Добавил пользователь Дмитрий К. Обновлено: 27.01.2026
Что такое синдром Бругада? Какова его распространенность? Какие лекарственные средства применяются при синдроме Бругада? Внезапная смерть — наиболее грозное проявление заболеваний сердечно-сосудистой системы. Основными причинами внезапной сердечной
Что такое синдром Бругада?
Какова его распространенность?
Какие лекарственные средства применяются при синдроме Бругада?
Внезапная смерть — наиболее грозное проявление заболеваний сердечно-сосудистой системы. Основными причинами внезапной сердечной смерти у взрослых можно считать ишемическую болезнь сердца и инфаркт миокарда, однако в последние годы все большую остроту приобретает проблема внезапной смерти в отсутствие явных заболеваний миокарда или коронарных сосудов, особенно в молодом возрасте.
Сегодня накоплено достаточное количество данных о природе заболеваний, сопряженных с риском внезапной смерти. Определено, что многие из них генетически детерминированы, а это представляет особую опасность, так как под угрозой находится не только больной, у которого выявили заболевание, но и его дети и близкие родственники. Данные заболевания пока крайне редко выявляются в обычной клинической практике. Больные умирают, как правило, не в специализированных стационарах, а дома или на улице, и врачу поликлиники или бригаде скорой помощи остается констатировать смерть. При этом ставится достаточно неопределенный диагноз: острая сердечно-сосудистая недостаточность. При аутопсии не выявляется поражений мышцы сердца или коронарных сосудов. У детей, как ни парадоксально, чаще всего посмертно диагностируется острая респираторная вирусная инфекция, минимальными проявлениями которой пытаются объяснить внезапную смерть. Все это дает основание утверждать, что в крупных российских клиниках отсутствует достаточный опыт наблюдения и выявления данных больных. Внимание специалистов-кардиологов нередко привлекают только первые симптомы заболевания, прежде всего синкопе и приступы сердцебиения. Однако нередко первым и последним проявлением заболевания является внезапная смерть.
В современной клинической медицине выделен ряд заболеваний и синдромов, тесно ассоциированных с высоким риском внезапной смерти в молодом возрасте. К ним относятся синдром внезапной смерти младенцев (sudden infant death syndrome), синдром удлиненного интервала QT, синдром внезапной необъяснимой смерти (sudden unexplained death syndrome), аритмогенная дисплазия правого желудочка, идиопатическая фибрилляция желудочков и ряд других. Одно из наиболее «загадочных» заболеваний в этом ряду — это синдром Бругада (CБ). Несмотря на то что во всем мире опубликованы сотни работ, посвященных данному заболеванию, а на крупнейших международных кардиологических конгрессах регулярно проводятся тематические секции, в отечественной литературе имеются лишь единичные описания синдрома, далеко не всегда полностью отражающие типичную картину заболевания. Вместе с тем именно СБ является, по мнению многих специалистов, «ответственным» за более чем 50% внезапных, некоронарогенных смертей в молодом возрасте.
Официальная дата открытия синдрома — 1992 год. Именно тогда испанские кардиологи, братья П. и Д. Бругада, работающие в настоящее время в различных клиниках мира, впервые описали клинико-электрокардиографический синдром, объединяющий частые семейные случаи синкопальных состояний или внезапной смерти вследствие полиморфной желудочковой тахикардии, и регистрацию специфического электрокардиографического паттерна.
Преимущественный возраст клинической манифестации СБ — 30-40 лет, однако впервые данный синдром был описан у трехлетней девочки, имевшей частые эпизоды потери сознания и впоследствии внезапно погибшей, несмотря на активную антиаритмическую терапию и имплантацию кардиостимулятора. Клиническая картина заболевания характеризуется частым возникновением синкопе на фоне приступов желудочковой тахикардии и внезапной смертью, преимущественно во сне, а также отсутствием признаков органического поражения миокарда при аутопсии.
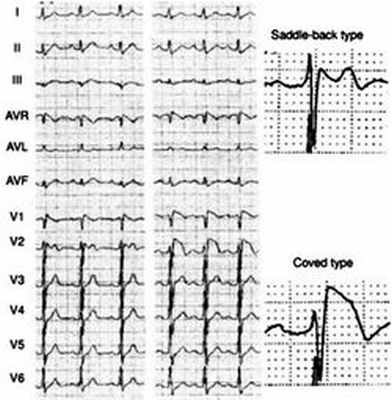
Кроме типичной клинической картины, при СБ выделяют специфический электрокардиографический паттерн. Он включает блокаду правой ножки пучка Гиса, специфический подъем сегмента ST в отведениях V1-V3, периодическое удлинение интервала PR, приступы полиморфной желудочковой тахикардии во время синкопе. Выделяются следующие клинико-электрокардиографические формы синдрома Бругада:
- Полная форма (типичная электрокардиографическая картина с синкопе, пердсинкопе, случаями клинической или внезапной смерти вследствие полиморфной желудочковой тахикардии).
- Клинические варианты:
- типичная электрокардиографическая картина у асимптоматичных больных без семейной истории внезапной смерти или синдрома Бругада;
- типичная электрокардиографическая картина у асимптоматичных больных, членов семей больных с полной формой синдрома;
- типичная электрокардиографическая картина после проведения фармакологических тестов у асимптоматичных обследуемых, членов семей больных с полной формой синдрома;
- типичная электрокардиографическая картина после проведения фармакологических тестов у больных с повторными синкопе или идиопатической фибрилляцией предсердий.
- типичная электрокардиографическая картина с явной блокадой правой ножки пучка Гиса, элевацией сегмента ST и удлинением PR-интервала;
- типичная электрокардиографическая картина с элевацией сегмента ST, но без удлинения PR-интервала и блокады правой ножки пучка Гиса;
- неполная блокада правой ножки пучка Гиса с умеренной элевацией сегмента ST;
- изолированное удлинение интервала PR.
Характерно, что типичный ЭКГ-паттерн чаще регистрируется у больных в период перед развитием фибрилляции желудочков, что свидетельствует о необходимости динамического наблюдения за больными с подозрением на СБ. При пробе с дозированной физической нагрузкой и лекарственной пробе с симпатомиметиками (изадрин) ЭКГ-проявления СБ уменьшаются, в то время как при пробе с медленным внутривенным введением антиаритмических препаратов, блокирующих натриевый ток, увеличиваются. Согласно стандартному протоколу обследования больных с подозрением на СБ, рекомендуется использовать для проб следующие антиаритмические препараты: гилуритмал (аймалин) в дозе 1 мг/кг, новокаинамид (прокаинамид) в дозе 10 мг/кг или флекаинид в дозе 2 мг/кг. Необходимо учитывать, что при введении указанных препаратов у больных с СБ могут развиваться опасные желудочковые тахиаритмии, вплоть до фибрилляции, поэтому проводиться такие пробы должны при условии полной готовности к оказанию экстренной помощи. Но, несмотря на это, пробы на сегодняшний день — наиболее достоверный критерий выявления опасного, угрожающего жизни заболевания, требующего постоянного наблюдения и многолетней антиаритмической терапии. При проведении инвазивного электрофизиологического исследования (ЭФИ) у больных с СБ часто индуцируются желудочковые аритмии, однако ЭФИ вряд ли можно считать «золотым стандартом» диагностики полной клинической формы синдрома. До 1992 года нередко описывались случаи наблюдения молодых больных с типичным ЭКГ-паттерном СБ, синкопальными состояниями и нормальными показателями ЭФИ. В дальнейшем такие больные, оставленные без лечения, внезапно погибали (Mandell W., 1985).
В последние годы в диагностике больных с риском опасных желудочковых аритмий, особенно «микроаномалий ЭКГ», значительно возросла роль стандартной электрокардиографии. Так, у пациентов с СБ, по нашим наблюдениям, нередко регистрируется эпсилон-волна — eW, характеризующая замедленную деполяризацию в области выводного тракта правого желудочка. Данный признак представляет собой «большой» диагностический критерий другого заболевания, сопряженного с высоким риском внезапной смерти, — аритмогенной дисплазии правого желудочка. Однако, учитывая единый источник возникновения аритмии при обоих заболеваниях — выводной тракт правого желудочка, его можно отнести и к диагностически значимым ЭКГ-проявлениям СБ. У больных с риском внезапной смерти большое внимание уделяется удлинению интервала QT как фактору риска желудочковых аритмий. Однако ряд наблюдений, проводившихся в последнее время, показал, что проаритмогенную роль играет и укорочение QT, наблюдаемое именно у больных с СБ и идиопатической фибрилляцией желудочков. Предлагается даже термин «синдром укороченного интервала QT» (Gussak I., 2000). Наши наблюдения свидетельствуют о том, что у всех больных с СБ отмечены значения интервала QT менее 50 процентили, а у наиболее тяжелых больных — менее 5. Эти изменения могут быть связаны с особенностями электрофизиологии кардиомиоцита при СБ — значительным укорочением 2-й фазы потенциала действия в эпикарде правого желудочка (при удлинении интервала QT задействован противоположный электрофизиологический механизм). Очевидно, асинхронизм реполяризации любой природы повышает аритмогенную готовность миокарда. При холтеровском мониторировании может отмечаться высокий циркадный индекс (ЦИ — отношение средней дневной к средней ночной ЧСС) — более 1,45 (норма от 1,24 до 1,44).
Степень распространенности синдрома пока неясна. Так, в одной из областей Бельгии распространенность СБ составила 1 на 100 000 жителей (Brugada P., 1999). По данным японских исследователей, проанализировавших 22 027 электрокардиограмм из популяции, распространенность ЭКГ-паттерна СБ в этой стране составила 0,05-0,6% у взрослых и 0,0006% (анализ 163 110 электрокардиограмм) у детей (Tohyou J. и соавт., 1995; Hata Y. и соавт., 1997).
Еще одна интересная особенность СБ заключается в том, что заболевание не регистрируется у афро-американцев; с другой стороны, в Европе СБ чаще выявляется у представителей так называемого «кавказского» этнического типа, к которому, согласно международным градациям, относятся и выходцы из стран Восточной Европы. Характерно, что и первый из описанных случаев заболевания братья Бругада выявили у польской девочки. Это свидетельствует о том, что распространенность СБ в российской популяции может оказаться достаточно высокой.
Предполагается, что при СБ имеет место аутосомно-доминантный путь наследования с поражением гена SCN5a в 3-й хромосоме. Этот же ген поражен у больных с третьим молекулярно-генетическим вариантом синдрома удлиненного интервала QT (LQT3) и при синдроме Ленегра — заболеваниях, также сопряженных с высоким риском внезапной аритмогенной смерти.
В 93,3% случаев приступы при СБ возникают в вечернее и ночное время (с 18 до 06 часов), причем чаще во второй половине ночи. Это, несомненно, подтверждает роль усиления вагусных влияний в возникновении фибрилляции желудочков при СБ. Данный циркадный паттерн свидетельствует также о различиях в патогенезе возникновения фатальных аритмий у пациентов с СБ и ишемической болезнью сердца, когда основной циркадный пик внезапной смерти приходится на ранние утренние часы (Deedwania P., 1998).
Необходимо проводить дифференциальную диагностику СБ с рядом заболеваний, которые могут стать причиной схожих электрокардиографических проявлений: аритмогенной дисплазией правого желудочка, миокардитами, кардиомиопатиями, болезнью (миокардитом) Чагаса (Chagas), болезнью Steinert, опухолями средостения.
Для предупреждения фибрилляции желудочков при СБ используются классические антиаритмические препараты, обеспечивающие эффект в 60% случаев. Генетически детерминированное поражение натриевых каналов теоретически предполагает меньшую эффективность препаратов 1-й группы, а также возможность проявления проаритмогенного эффекта при их использовании. Согласно алгоритму формирования антиаритмической терапии, известному под названием «сицилианский гамбит» (Europ Heart J, 1991; 12), антиаритмическими препаратами, обеспечивающими активную блокаду натриевых каналов, являются новокаинамид, дизопирамид, хинидин, ритмонорм, гилуритмал, флекаинид, энкаинид. Менее выраженное блокирующее действие отмечено у лидокаина, мексилетина, токаинида, бепридила, верапамила, кордарона и обзидана. Можно предположить, что при СБ более безопасно применять препараты, не блокирующие натриевые каналы, — дилтиазем, бретилиум, соталекс, надолол (коргард). Однако целенаправленных исследований в этой области пока не проводилось. Наиболее эффективным методом предотвращения развития жизнеугрожающих аритмий у больных СБ на сегодняшний день является имплантация кардиовертеров-дефибрилляторов.
Мировая статистика свидетельствует о широком распространении СБ в мире. Вместе с тем низкая его выявляемость в настоящее время в России, очевидно, связана с меньшей ориентацией врачей на весь клинико-электрокардиографический симптомокомплекс, часто не имеющий особенностей в отдельных составляющих, позволяющих уверенно поставить диагноз. Поэтому у всех больных с синкопальными состояниями неясной этиологии, ночными пароксизмами удушья, случаями внезапной смерти в семье (особенно в молодом возрасте и в ночное время), типичным ЭКГ-паттерном необходимо исключить синдром Бругада. Для этого таким пациентам следует проводить фармакологические пробы, динамическое ЭКГ-обследование как самого больного, так и его родственников, холтеровское мониторирование. Кроме того, одним из наиболее достоверных методов диагностики СБ является молекулярно-генетическое исследование.
Московский НИИ педиатрии и детской хирургии Минздрава РФ совместно с Международным фондом синдрома Бругада и P. Бругада начиная с 1999 года проводит исследование распространенности синдрома Бругада в российской популяции. Все российские специалисты, у которых наблюдаются больные с подозрением на синдром Бругада, могут их бесплатно заочно проконсультировать на основании данных ЭКГ и проведенных обследований. Выявленные больные будут включены в единый Международный регистр, что обеспечивает возможность проведения молекулярно-генетических исследований.
Синдром Бругада
Синдром Бругада (СБ) – это генетическое заболевание сердца, сопряженное с повышенным риском внезапной смерти.
Обычно заболевание развивается в зрелом возрасте, в среднем около 40 лет, и, по оценкам, является причиной не менее 4% всех случаев внезапной смерти, среди которых не менее 20% приходится на пациентов со структурно нормальным сердцем.
В большинстве случаев СБ диагностируют молодым совершеннолетним пациентам, чаще всего мужского пола, после внезапной смерти члена семьи или при появлении таких симптомов, как обморок или остановка сердца. СБ имеет характерную электрокардиографическую структуру, представленную типичной элевацией сегмента ST в правых прекордиальных электрокардиографических отведениях (от V1 до V3), называемой паттерном Бругада 1 типа. Если электрокардиографические признаки предполагаются, но не диагностированы (паттерн Бругада 2 или 3 типа), для подтверждения или исключения диагноза может потребоваться проведение теста с антиаритмическими препаратами I класса (например, аймалином или флекаинидом), которые обнаруживают диагностический (тип 1) паттерн Бругада.
Обычно пациенты с СБ имеют структурно нормальное сердце, хотя магнитно-резонансная томография выявила легкие структурные аномалии правого желудочка у подгруппы пациентов.
Это заболевание, по-видимому, связано с нарушением работы одного или нескольких ионных каналов - структур, обеспечивающих транзит этих ионов (натрия, калия, магния и кальция) через поверхность клетки. Первым генетическим изменением, выявленным при СБ, было изменение гена SCN5A, кодирующего натриевый канал. Впоследствии с СБ были связаны многочисленные и новые генетические аномалии; описано более 300 мутаций.
Каковы симптомы заболевания?
Характерной особенностью СБ является чрезвычайная вариабельность клинической картины.
К сожалению, у значительного процента пациентов первым клиническим проявлением заболевания является внезапная смерть, вызванная летальными желудочковыми аритмиями. Последнее катастрофическое явление подчеркивает сложность лечения заболевания в плане прогнозирования того, какие люди будут подвержены наибольшему риску, поскольку до этого явления у подавляющего большинства пациентов не наблюдается каких-либо тревожных симптомов.
Заболевание может протекать абсолютно бессимптомно или проявляться симптомами, связанными с сердечной аритмией, с эпизодами обморока (т.е. потерей сознания), приступами учащенного сердцебиения или повышения частоты сердечных сокращений. Иногда у пациентов могут наблюдаться судороги и симптомы, которые можно спутать с эпилепсией. Зачастую симптомы развиваются в состоянии покоя, на этапе восстановления после физической нагрузки или во время ночного сна.
- учащенное сердцебиение
- одышка
- усталость
- обморок
Как диагностируется?
Своевременная диагностика имеет решающее значение при этом синдроме, поскольку пациент может подвергаться риску развития потенциально летальных аритмий. При подозрении на синдром Бругада необходимо собрать семейный анамнез и электрокардиографическую трассировку, а также провести другие кардиологические исследования, включая эхокардиограмму (чтобы исключить наличие какого-либо заболевания сердца).
Подтверждение диагноза синдрома Бругада возможно при наличии спонтанного паттерна 1-го типа.
Однако в большинстве случаев картина ЭКГ позволяет предположить, но не диагностировать СБ (паттерн 2 или 3 типа), и может потребоваться фармакологический тест с аймалином, который у предрасположенных пациентов вызывает появление паттерна Бругада 1 типа и, следовательно, позволяет исключить или подтвердить диагноз синдрома Бругада.
В случае положительного фармакологического теста может потребоваться эндокавитальное электрофизиологическое исследование (ЭЭС), чтобы проверить возможную уязвимость пациента к потенциально злокачественным желудочковым аритмиям.
Рекомендуемая диагностика
- Электрокардиограмма (ЭКГ)
- ЭКГ по Холтеру
- Стресс-тест
- Эхокардиограмма
- КардиоТелефон
- Пассивная ортостатическая проба (тилт-тест)
Как лечится?
После постановки диагноза СБ терапевтический подход зависит от степени риска пациента. Синдром Бругада не имеет определенного клинического развития, поэтому у пациента могут появляться новые клинические элементы, указывающие на возможное изменение степени риска. Поэтому целесообразно проводить проверки каждые шесть месяцев.
В настоящее время терапевтические варианты, доступные для лечения синдрома Бругада, относятся в основном к трем типам:
- Имплантируемые сердечные дефибрилляторы (ИСД, внутриполостные или подкожные) или имплантируемые кардиомониторы (подкожный ИКМ или петлевой регистратор)
- Транскатетерная эпикардиальная абляция аритмического субстрата
- Медикаментозная терапия специфическими антиаритмическими препаратами (хинидин)
В нашем центре мы разработали подход, основанный на клинических характеристиках каждого конкретного человека, на базе нашего обширного и длительного клинического опыта, включающего тысячи случаев с продолжительным последующим наблюдением.
ИСД – единственная терапия с доказанной эффективностью в предотвращении внезапной аритмической сердечной смерти.
Имплантация дефибриллятора необходима в случае обнаружения СБ характеристиками высокого риска. Стратификация риска основана на оценке ряда объективных клинических параметров (электрокардиографических, неинвазивных, клинических параметров, полученных в результате электрофизиологического исследования) вместе с наличием симптомов, относящихся к потенциально летальным аритмиям.
Учитывая возможное наличие наджелудочковых аритмий или нарушений, обычно использование внутриполостного дефибриллятора предпочтительнее, хотя у молодых субъектов или у пациентов, у которых возникли проблемы в связи с внутриполостным дефибриллятором, можно выбрать имплантацию подкожного дефибриллятора.
Для оптимизации наиболее подходящего терапевтического выбора на основе клинических потребностей каждого отдельного пациента всегда необходим подход, основанный на множестве параметров. Фактически, каждый из этих выборов основан на оценке риска развития потенциально летальных аритмий, которую проводят как во взрослой, так и в педиатрической популяции. В последнем контексте в самых серьезных и наиболее рискованных случаях возможна имплантация дефибриллятора. В условиях явно меньшего риска можно предложить имплантацию кардиомонитора под кожу (имплантируемый кардиомонитор ИКМ, более известный как петлевой регистратор), который постоянно записывает электрокардиограмму. Последний вариант позволяет наблюдать за пациентами на протяжении многих лет с целью документирования любых аритмий, которые могут изменить оценку аритмического риска с течением времени, и, следовательно, изменить терапевтическую стратегию, если это необходимо.
Каждое из этих устройств, ИСД или ИКМ, доступно в сочетании с технологией удаленного мониторинга, более известной как домашний мониторинг. Данная технология позволяет контролировать работу этих устройств дистанционно, пока пациент находится дома. Модем, подключенный по беспроводной связи, записывает информацию с имплантированного устройства и отправляет ее на защищенный веб-сайт, доступ к которому имеют только врачи. Таким образом, врачи могут проверить не только правильность работы устройства, но и начало любой аритмии, чтобы оперативно вмешаться, используя наиболее подходящие терапевтические стратегии.В 2015 году наша группа под руководством профессора Паппоне доказала, что аритмогенный субстрат синдрома Бругада преимущественно расположен в эпикардиальной области отводящих путей и передней стенки правого желудочка. Эти области характеризуются наличием аномальных электрических потенциалов, которые могут привести к возникновению аритмий, способных спровоцировать остановку сердца у пациентов с СБ.
После точного выявления эпикардиального аритмогенного субстрата наша команда всегда подтверждала, что эпикардиальная абляция радиочастотным методом способна устранить все электрические аномалии, что приводит к немедленному исчезновению электрокардиографической картины синдрома Бругада и отсутствию желудочковых аритмий при последующем наблюдении.
Данную процедуру предложили и разработали в нашем центре, который является самым опытным центром в мире по данному виду вмешательства.
В настоящее время в нашем центре проводится проспективное исследование для оценки эффективности и безопасности этого вида вмешательства.
Сегодня более 600 пациентов с синдромом Бругада перенесли абляцию, при этом частота периоперационных осложнений была крайне низкой.
Стратегия абляции, предложенная нашей группой может быть безопасной и эффективной у большего числа пациентов с синдромом Бругада, отнесенных к группе риска.
Этот опыт является крупнейшей в мире историей болезни пациентов с СБ, прошедших абляцию, и определяет первый шаг для новой стратегии лечения СБ, доступной для пациентов с данным состоянием.Синдром Бругада
Синдром Бругада — это редкое заболевание сердца, характеризующееся желудочковой тахиаритмией и повышенным риском внезапной сердечной смерти.
Клинические проявления синдрома Бругада могут наблюдаться в любом возрасте, но обычно дебют заболевания приходится на зрелый возраст. Типичный пациент с СБ — здоровый мужчина 35-40 лет, не имеющий в анамнезе заболеваний сердца или каких-либо признаков сердечно-сосудистой недостаточности.
Для синдрома Бругада характерны такие проявления, как затруднение дыхания, обмороки, желудочковая тахиаритмия (фибрилляция желудочков) и снижение коронарного кровоснабжения.
Распространенность СБ во всем мире составляет ~5 случаев на десять тысяч человек, но в странах Юго-Восточной Азии заболеваемость намного выше: до 10 случаев на десять тысяч человек. У мужчин этот синдром диагностируют до 8 раз чаще.
Причины возникновения
25-30% случаев синдрома Бругада связаны с мутациями в гене SCN5A, которые влияют на структуру и функцию натриевых каналов, вследствие чего снижается содержание натрия в кардиомиоцитах (мышечных клетках сердца) и нарушается проводимость сердца.
На данный момент в научной литературе описаны более 200 мутаций 18 различных генов, также ассоциированных с синдромом Бругада. Но роль, которую они играют в возникновении этого редкого заболевания, еще предстоит определить. Большая часть мутаций наследуется от родителей к детям (по аутосомно-доминантному типу). Ребенок, чей родитель является носителем мутационного гена, имеет 50% шанс унаследовать СБ.
Приобретенная (негенетическая) форма СБ (65-70%) ассоциируются с некоторыми лекарствами (блокаторами натриевых каналов); высоким уровнем калия или кальция в крови; низким уровнем калия; лихорадкой. В некоторых случаях причину развития синдрома установить не удается.
Симптомы
Обычно клинические проявления синдрома Бругада возникают в покое — во время сна или отдыха — и включают затруднение дыхания, обмороки, судороги, желудочковую тахиаритмию и остановку сердца. Внезапная остановка сердца может являться начальным симптомом СБ примерно у трети пациентов.
Нередко синдром Бругада протекает без явных признаков или симптомов (аритмии, затруднения дыхания, потери сознания). Риск внезапного и полного прекращения сердечной деятельности у таких пациентов значительно ниже.
Диагностика
Врач проводит подробный опрос пациента, изучает семейную историю (включая семейную историю внезапной сердечной смерти). Физикальный осмотр, как правило, не выявляет никаких отклонений, поэтому пациенту назначается ЭКГ — в некоторых случаях с использованием лекарственных препаратов (блокаторов кальциевых каналов), которые помогают определить характерные признаки синдрома Бругада. Дополнительно, для дифференциальной диагностики, могут назначаться другие инструментальные исследования сердца, суточное мониторирование ЭКГ (холтер).
Лабораторная диагностика может включать генетическое исследование на мутацию в гене SCN5A, анализ на уровень кальция и калия, анализы на уровень МВ-креатинкиназы и тропонина (для исключения других диагнозов).
Дифференциальный диагноз
Чаще всего синдром Бругада дифференцируют (различают) со следующими заболеваниями:
- синдром Романо — Уорда — врожденный синдром удлиненного интервала QT 3 типа, также обусловленный мутациями в гене SCN5A (существует мнение, что LQT3 и синдром Бругада могут быть разными типами одного и того же расстройства);
- аритмогенная кардимиопатия (АКМП);
- мышечная дистрофия Дюшенна;
- другие заболевания и расстройства: острый миокардит, гиперкалиемия, гиперкальциемия.
Лечение синдрома Бругада
Лекарственных препаратов, воздействующих на причину развития синдрома Бругада, не существует. Пациентам с высоким риском желудочковой тахиаритмии и внезапной остановки сердца предлагается имплантация кардиовертер-дефибриллятора. Использование антиаритмических препаратов спорно: с одной стороны, такие препараты, как хинидин, способны снижать количество эпизодов желудочковой тахиаритмии, с другой стороны, известны случаи, когда их применение у пациентов с СБ было связано с возникновением фатальной аритмии.
Рекомендации по терапии для пациентов с бессимптомным течением заболевания противоречивы: наблюдение до появления симптомов (хотя начальным симптомом может являться остановка сердца), изучение семейной истории, электрофизиологическое исследование сердца с целью определения показаний к установке кардиовертер-дефибриллятора. Генетическое тестирование рекомендуется не только пациентам с СБ, но и их родственникам. Также пациентам предлагается симптоматическое и поддерживающее лечение.
Особенности и преимущества лечения синдрома Бругада в клинике Рассвет
Кардиологи Рассвета занимаются диагностикой и лечением всех заболеваний, связанных с поражением сердца и сосудов, в том числе — редких болезней и синдромов.
Наши специалисты проводят оценку индивидуального риска сердечно-сосудистых событий, основанную на доказательных методах и математических расчетах. Такой подход позволяет предсказать риск коронарной катастрофы, вовремя принять меры профилактики, изменить образ жизни и сохранить здоровье сердца на долгие годы.
В распоряжении кардиологов Рассвета современное медицинское оборудование, позволяющее точно диагностировать не только типичные заболевания сердца и сосудов, но и редкие болезни и синдромы, которые остаются «медицинской загадкой» для большинства специалистов других медицинских учреждений.
Наши пациенты могут быть уверены в том, что в Рассвете им поставят правильный диагноз, подберут эффективное лечение типичного или редкого заболевания, предложат индивидуальную схему симптоматической и поддерживающей терапии, если лекарства, воздействующего на причину редкой болезни, не существует.
ЭКГ синдрома Бругада
![]()
Синдром Бругада имеет генетические корни. При этом заболевании существует опасность внезапной сердечной смерти. Течение синдрома можно наблюдать на электрокардиограмме. Впервые этот синдром был обнаружен в 1992 году испанскими специалистами, однако в наше время медики практически так ничего и не знают об этом заболевании. Давайте же поговорим о том, что такое синдром Бругада на ЭКГ: признаки и лечение.
С каждым годом в мире, особенно в южных и восточных регионах Азии, быстро растет число людей, страдающих синдромом Бругада. Чаще всего болезнь поражает людей среднего возраста. При этом мужское население подвержено большему риску заболеть почти в девять раз.
Сегодня данный синдром считается клиническим заболеванием. У больных не наблюдается органических патологий сердца, а на ЭКГ проявляется БПНПГ (блокада правой ножки пучка Гиса). Также в некоторых грудных отведениях наблюдается рост ST-сегмента.
Причины развития
- Генетический синдром — мутация некоторых генов, отвечающих за развитие этой аномалии. Поэтому мутации в этих генах, возможно, являются причиной появления данной болезни. Тем не менее у многих пациентов нет генетического подтверждения синдрома;
- Патологические сбои и в других генах, которые должны отвечать за белки;
- Торможение автономной нервной системы, при которой наблюдается усиление аритмогенеза. Этим объясняется то, что при синдроме возникают приступы в большинстве случаев в вечернее время или ночью.
Признаки
Для синдрома Бругада характерным симптомом является состояние синкопального вида, а также ВСС. Почти у больных, у которых произошла внезапная смерть, в анамнезе наблюдались синкопальные приступы.
При тяжелом случае заболевания случаются обмороки с сопровождением судорог. У некоторых пациентов приступы протекают при полном сознании, однако появляется резкая слабость, кожа становится бледной, а сердце работает с перебоями.
Обычно симптомы клинического состояния данной патологии характеризуются появлением тахикардии и фибрилляции желудочков. Чаще они проявляются у мужчин до 40 лет, но встречается у детей и у людей после 50-ти лет.
Синдром Бругада, как говорилось уже выше, возникает в ночное время, когда сердечные сокращения низкие. Небольшой процент патологии приходится на развитие после тяжелого труда и приема алкоголя.
Методы диагностики
Электрокардиография является одним из основных и самых эффективных исследований различных заболеваний сердца, в том числе и синдрома Бругада. Данная процедура способна выявить заболевание, в результате чего будут приняты своевременные меры борьбы с ним. Электрокардиограмма в Москве может определить случаи БПНПГ и элевацию ST-сегмента в грудных отведениях. А это дает возможность определить и точно поставить диагноз данного синдрома.
Синдром Бругада является наследственной патологией. Признаки этого недуга проявляются на ЭКГ с пяти лет. Тем не менее существует факт, что на электрокардиографии не всегда можно заметить развитие болезни.
Бывает, что признаки болезни проявляются на ЭКГ периодически, а это создает сложности в определении точного диагноза. Тем не менее в этом случае главным определяющим станет изменение сегмента ST, который поднимается в конкретных отведениях и имеет совершенно другую, непохожую форму для здорового сердечного органа. Таким образом, врач может увидеть форму СБ при каждом конкретном случае.
Если при прохождении электрокардиограммы врачу сложно определить присутствие заболевания, тогда пациенту предлагают проведение такой же процедуры, только с применением нагрузки. Больному вводят симпатомиметики, в результате все случаи СБ, ранее обнаруженные, будут уменьшаться. При вводе новокаинамида, проявления, наоборот, увеличиваются. В таком случае врач имеет возможность определить правильный диагноз и назначить эффективное лечение.
Стоит заметить, что причиной невозможности определения синдрома Бругада на электрокардиографии могут стать некоторые препараты, которые человек принимает в этот момент. Это могут быть психотропные средства, а также блокаторы и различные антиаритмические препараты. В этом случае специалист назначает повторную электрокардиограмму после окончания приема этих лекарств.
Лечение
![]()
При определении данного заболевания вначале врач назначает антиаритмические средства. Прием медикаментов он назначает каждому больному индивидуально. Самостоятельно принимать лекарства не стоит, так как они могут быть совершенно бесполезны, а в некоторых случаях даже вредны. Обычно для лечения синдрома Бругада в Москве назначаются такие лекарственные препараты, как амиодарон и хинидин.
Однако наиболее эффективным методом борьбы с данной болезнью считается ИКВД. В этом случае, риск появления ВВС равен почти нулю. Метод лечения заключается в том, что больному проводят операцию, во время которой в тело вживляется антиаритмический препарат. Этот аппарат способен контролировать ритм сердца. Небольшого размера компьютер работает бесперебойно, управляя работой органа.
Это устройство также может быть полезным при фибрилляции желудочков.
Узнать больше о синдроме Бругада можно на консультации врачей-кардиологов в клинике "ПрофМедПомощь" в Мосве.
Синдром Бругада и бругадоподобные изменения на ЭКГ при лечении психотропными препаратами
Проблеме безопасности психотропной терапии в настоящее время уделяется большое внимание 1. Частота негативных кардиоваскулярных эффектов при лечении нейролептиками, антидепрессантами, антиконвульсантами, нормотимиками достигает 75% [2, 3]. Психически больные имеют достоверно более высокий риск внезапной смерти (ВС). Так, в сравнительном исследовании (Herxheimer A. et Healy D., 2002 г.) показано 2-5-кратное увеличение частоты ВС у пациентов с шизофренией в сравнении с двумя другими группами (больные глаукомой и псориазом) [5]. Риск ВС для индивидов, принимающих типичные антипсихотики, в 2,39 раза [6], а атипичные - в 1,5 раза [7] превышает таковой у тех, кто не получает эти препараты. Американское агентство по контролю за продуктами питания и лекарствами (USFDA) cообщило в 2006 году об 1,6-1,7-кратном повышении риска ВС при использовании всех современных антипсихотических препаратов [9]. Одним из предикторов ВС считают синдром Бругада (СБ), являющийся причиной смерти 4% всех случаев ВС и 20% случаев ВС у лиц со структурально неизменённым сердцем [10].
В 1992 году испанские кардиологи Педро и Джозеф Бругада опубликовали наблюдение за 8 пациентами (6 мужчин и 2 женщины) с эпизодами клинической смерти в анамнезе [11]. Инструментальные методы исследования (эхокардиография, ангиография, электрофизиологическое исследование, биопсия миокарда у 4 пациентов) не выявили какое-либо органическое заболевание сердца. Единственной особенностью у этих пациентов было наличие на ЭКГ особой формы блокады правой ножки пучка Гиса (БПНПГ) с подъёмом сегмента ST. Синкопальные состояния сопровождались регистрацией на ЭКГ полиморфной желудочковой тахикардии «torsade de pointes» (TdeP), возникавшей после ранних парных желудочковых экстрасистол и при программированной стимуляции. В дальнейшем 4 пациентам имплантировали кардиовертеры-дефибрилляторы, у 2 нарушения ритма исчезли на фоне приёма бета-блокаторов, седьмой пациент принимал амиодарон и дифенилгидантоин (дифенин) на фоне электрокардиостимуляции в режиме VVI, восьмой пациент неожиданно скончался во время имплантации кардиостимулятора. Таким образом, братья Бругада впервые подробно описали характерный паттерн ЭКГ, позволяющий определить высокий риск возникновения жизнеугрожающих желудочковых аритмий у лиц без органической патологии сердца.
В настоящее время СБ - это клинико-электрокардиографический синдром, характеризующийся синкопальными состояниями и эпизодами ВС у пациентов без органических изменений сердца и проявляющийся на ЭКГ постоянной или транзиторной БПНПГ с подъёмом сегмента ST в правых грудных отведениях (V1-V3). По клинической картине различают симптомный (синкопальный) и бессимптомный (бессинкопальный) вариант СБ, по выраженности изменений на ЭКГ - классический (явный), интермиттирующий и латентный (скрытый) СБ.
Ионным механизмом СБ при мутации гена SCN5A является уменьшение количества или ускоренная инактивация натриевых каналов в клетках эпикарда правого желудочка, приводящие к уменьшению плотности потока натрия и преждевременной реполяризации эпикарда [20]. Функция натриевых каналов нарушается также вследствие перемещения их с поверхности клеток в эндоплазматический ретикулум [22]. Потеря вершины потенциала действия (ПД) с характерной «вырезкой» в начале фазы плато на некоторых участках эпикарда при том, что в эндокарде ПД имеет нормальную величину, создаёт дисперсию реполяризации стенки желудочка и трансмуральный градиент напряжения, что на ЭКГ проявляется подъёмом сегмента ST (точки J) [23]. Волна реполяризации появляется от седловины или купола ПД (в зависимости от разницы во времени деполяризации эндокарда и эпикарда). При задержке в деполяризации эпикарда на ЭКГ появляется отрицательный зубец Т. Изменения ЭКГ по типу БПНПГ при СБ связаны с ранней реполяризацией, но не с задержкой проведения импульса по системе Гиса - Пуркинье.
Возрастание градиента между эндокардом и эпикардом, когда на различных участках эпикарда реполяризация идёт с разной скоростью, приводит к выраженной дисперсии реполяризации и рефрактерности между эпикардом и эндокардом и образованию «уязвимого окна», попав в которое экстрасистола может вызвать аритмию по механизму re-entry. ПД из тех мест, где он протекает быстрее, проводится к местам, где его образование задерживается, и возникает дополнительное возбуждение по типу повторного входа во 2-ую фазу ПД. Появляющиеся вследствие этого ранние экстрасистолы попадают в «уязвимое окно» и запускают желудочковую тахикардию и/или фибрилляцию желудочков (ФЖ) [24].
Предполагается, что, помимо генетических нарушений, большое значение в развитии ПЖТ и ФЖ при СБ имеет автономная нервная система. В ряде исследований показано, что активация парасимпатической или торможение симпатической нервной системы усиливает аритмогенез [25, 26]. Действительно, в 93,3% случаев синкопальные приступы при СБ возникают в вечернее и ночное время (с 18 до 6 часов), причём чаще во второй половине ночи [27]. Кроме того, в патогенезе СБ играет роль дисбаланс между б- и в-адренергической стимуляцией. Так, при введении пациентам б-адреномиметиков или в-адреноблокаторов наблюдалось увеличение подъёма сегмента ST, а при введении б-адреноблокаторов и в-адреномиметиков - его уменьшение [28].
Основные клинические признаки СБ - синкопальные состояния и эпизоды ВС. Выраженность клинических проявлений СБ определяется степенью повреждения натриевых каналов: при повреждении менее 25% каналов ЭКГ-паттерн и нарушения ритма наблюдаются только после введения блокаторов натриевых каналов, при увеличении количества повреждённых натриевых каналов свыше 25% резко возрастает риск ВС. Приблизительно 80% больных, перенесших ВС, до этого имели в анамнезе обмороки, в том числе с судорогами [29]. У ряда пациентов приступы протекают без потери сознания, в виде резкой общей слабости и перебоев в работе сердца. Описаны различные нарушения ритма при СБ: суправентрикулярные аритмии, фибрилляция предсердий, атриовентрикулярная узловая тахикардия, однако самыми частыми и жизнеопасными являются TdeP и ФЖ [10].
Основным диагностическим критерием СБ является обнаружение на ЭКГ признаков БПНПГ с подъёмом сегмента ST (точки J) в отведениях V1-V3 [10]. Также в этих отведениях может регистрироваться инвертированный зубец Т. Описаны два типа подъёма сегмента ST при СБ: «saddle-back type» («седло») и јoved type»(«свод») (см. рис. 1). Подъём јoved type» достоверно преобладает при симптомных формах СБ, с TdeP и ФЖ в анамнезе, в то время как «saddle-back type» чаще встречается при бессимптомных формах СБ. Однако изменения на ЭКГ при СБ могут носить преходящий характер, что требует поиска дополнительных методов верификации. Некоторые авторы для диагностики СБ предлагают использовать высокие (на 1-2 межреберья выше) правые грудные отведения. Для верификации СБ используют также тесты с введением блокаторов натриевых каналов (аймалин - 1 мг/кг за 5 мин внутривенно или 400 мг перорально, новокаинамид - 10 мг/кг за 10 мин внутривенно, пилсикаинид - 1 мг/кг за 10 мин внутривенно) [13]. Тест с блокаторами натриевых каналов проводится в условиях реанимационного отделения, так как во время его проведения велика вероятность развития TdeP и ФЖ.
![]()
В повседневной практической работе мы наблюдаем появление БПНПГ необычной формы (с умеренным подъёмом сегмента ST) конфигурации «saddle-back type» у пациентов, принимающих психотропные препараты в дозах терапевтического стандарта. При этом регистрация таких бругадоподобных изменений на ЭКГ сопровождает ухудшение психосоматического состояния больных по типу «чрезмерной транквилизации», с симптомами общей слабости, сонливости, гипотонии, брадикардии, что напоминает клиническую картину глубокой гиперседации. После коррекции терапии или отмены психотропного препарата наблюдается быстрая обратная динамика ЭКГ-изменений вслед за улучшением клинического состояния больных. Приводим собственные наблюдения.
Больная Ж. 56 лет поступила в психиатрическую больницу по направлению скорой психиатрической (СПП) помощи 10.05.2007 в 23.15 с диагнозом: Органическое поражение головного мозга с психическими нарушениями. Из анамнеза заболевания: систематически алкоголизировалась около 20 лет, сформировался абстинентный синдром, запои по 3-4 дня. Психическое состояние ухудшилось с декабря 2006 года, нарушился сон, появился страх, что могут завладеть комнатой, а её убить, слышала шаги в коридоре, ночью казалось, что кто-то вскрывает дверь в квартиру. Для улучшения самочувствия больная стала систематически употреблять корвалол (1 пузырёк на 2-3 приёма). Вечером 10 мая усилилось чувство страха, видела, как какие-то люди ножом открывали дверь её квартиры, слышала, как они переговаривались. Решила, что её могут убить, стала стучать по батареям, кричать. Соседями была вызвана СПП. Осмотрена врачом приёмного покоя. Сознание не помрачено, в целом, ориентирована верно. Настроение снижено, непрерывно плачет, тревожна, говорит, что видела людей, которые хотели её убить и завладеть квартирой. Интеллект значительно снижен. Соматически: пониженного питания, вес 46 кг, рост 162 см. Температура тела 36,5 ºС. Кожные покровы и видимые слизистые бледные, на спине, голенях и в области лба ссадины. Язык влажный, не обложен. Тоны сердца приглушены. Пульс 96 в минуту, хорошего наполнения. АД 110/70 мм. рт.ст. Дыхание везикулярное, хрипов нет, частота дыхательных движений 14 в 1 мин. Живот мягкий, безболезненный. Печень у края рёберной дуги. Стул, диурез в норме. Неврологический статус: черепные нервы - зрачки d=s, фотореакция замедлена, язык по средней линии. Снижена чувствительность стоп. При ходьбе неустойчива. Диагноз: Алкоголизм II-III стадии. Алкогольная энцефалопатия. Затяжной алкогольный параноид. В приёмном покое: Sol. Seduxeni 0,5%-2,0 внутримышечно. В отделении: усиленное наблюдение, обследование по схеме, Sol. Seduxeni 0,5%-4,0 в/м на ночь, Sol. Glucosae 40%-20,0 и Sol. Acidi ascorbinici. 5%-4,0 внутривенно струйно.
11.05.2007 в 9.40 при первичном осмотре анамнез собрать невозможно из-за отсутствия продуктивного контакта с больной. Больная лежит в постели с закрытыми глазами, на вопросы не отвечает, на своё имя не откликается. Реагирует на интенсивные раздражители, открывает глаза, совершает нецеленаправленные движения конечностями, «мычит», избирательно выполняет простые команды. Степень нарушения сознания можно оценить как глубокое оглушение (сопор). Невролог: состояние средней тяжести. Складывается впечатление, что больная медикаментозно загружена. АД 110/70, PS 80 в 1 мин, температура 35,8 ºC.
Неврологический статус: черепные нервы d=s, фотореакции вялые, ограничений движений глазных яблок не определяется, носогубные складки симметричны. Язык в полости рта. Глотание не нарушено. Речь дизартрична. Сухожильные рефлексы с верхних конечностей низкие d=s, с нижних конечностей отсутствуют. Патологических нет. Явных парезов нет. Мышечный тонус симметричный, диффузно умеренно снижен по экстрапирамидному типу. Менингеальных знаков нет. Снижение чувствительности стоп и голеней. В области лба цветущая гематома. С диагностической целью проведена люмбальная пункция, получен бесцветный, прозрачный ликвор. Исследование ликвора: цитоз 7/3, белок 0,254‰, реакция Нонне-Апельта ++, реакция Панди +, глюкоза 3,7 ммоль/л. Диагноз: Токсическая энцефалополиневропатия с психоорганическим синдромом и двигательными нарушениями.
Лечение: Sol. Prednisoloni 60 mg, Sol. Vit Acidi ascorbinici 5%-10,0, Sol. Piracetami 20%-10,0, Sol. Glucose 5%-200,0 внутривенно капельно N5. Sol. Reamberini 400,0 внутривенно медленно. Sol. Vit B1 2,0 в/м 2 раза в день. Sol. Vit B12 500г в/м N10.
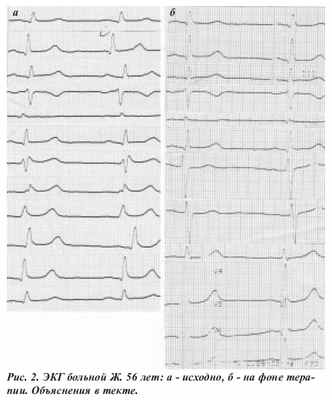
На ЭКГ от 11.05.2007 (рис. 2а): ритм синусовый с частотой 66 в 1 мин. Одиночная предсердная экстрасистола. Неполная блокада правой ножки пучка Гиса (с подъёмом точки J). Глюкоза крови 6,7 ммоль/л, билирубин общий 7,87 мкмоль/л, анализ крови: гемоглобин 105, эритроциты 3,5, цветовой показатель 0,9, лейкоциты 5,2, палочкоядерные 4, сегментоядерные 55, эозинофилы 3, базофилы 1, лимфоциты 27, моноциты 10. СОЭ 45 мм/час, СРБ ++. Осмотрена терапевтом. Из анамнеза: гепатит В в 2006 году. Диагноз: Токсическая миокардиодистрофия. Железодефицитная анемия.
![]()
На фоне дезинтоксикационной терапии состояние пациентки улучшилось. На следующий день при осмотре дежурным врачом: сидит в постели, утром завтракала, жалуется на головокружение, слабость. На ЭКГ от 14.05.2007 (рис. 2б): ритм синусовый частотой 62 в 1 мин. Обратная динамика «бругадоподобных» изменений. В последующем больная стала активнее, настроение выровнялось, начала посещать прогулки. Выписана домой с улучшением, без психопродуктивной симптоматики, агрессивных, суицидных тенденций.
Почему в условиях реального психиатрического стационара у некоторых пациентов лечение терапевтическими дозами нейротропных препаратов приводит к опасным кардиотоксическим и гиперседативным эффектам? Известно, что за биотрансформацию лекарственных средств в организме ответственны: система микросомального окисления цитохромов P (CYP), уридиндифосфат-глюкуронозилтрансферазы (УГТ), Р-гликопротеин и другие фармакодинамические и фармакокинетические факторы [59].
Ферменты цитохромов P локализуются в печени, кишечнике, слизистых оболочках, лёгких, почках, головном мозге и в коже. На каждый фермент влияют генетические, конституциональные и средовые факторы [60]. Выделяют 4 статуса генетически детерминированного метаболического фенотипа [61]: extensive (fast) metabolizers - быстрые метаболизанты, имеющие две активные формы энзимов, в клиническом аспекте - это пациенты стандартных терапевтических доз; intermediate metabolizers - промежуточные, имеющие одну активную форму энзима; poor (slow) metabolizers - медленные метаболизанты, не имеющие активных форм энзимов, вследствие чего концентрация препарата в плазме крови может возрастать в 5-10 раз; ultra-extensive (rapid) metabolizers - сверхинтенсивные метаболизанты, имеющие три и более форм энзимов и ускоренный лекарственный метаболизм.
Пожилой возраст, различные заболевания печени и почек снижают метаболический фенотип вплоть до poor (slow) metabolizers. Из одиннадцати известных ферментов CYP в метаболизме психотропных препаратов важную роль играют пять: CYP1A2, CYP2C9, CYP2C19, CYP2D6 и CYP3A4, причём CYP3A4 ответственен за метаболизм более 90% психотропных препаратов, подвергающихся биотрансформации в печени [59, 62]. Различные лекарственные средства (в том числе и сами нейротропные), состояния и пищевые продукты являются ингибиторами CYP и при определённых лекарственных комбинациях может сложиться ситуация, когда концентрация лекарственного средства, метаболизируемого посредством фермента CYP, повышается многократно из-за ингибирования этого же фермента другим, совместно назначенным препаратом. УГТ [63] и Р-гликопротеин [64] ответственны за метаболизм многих анксиолитиков, антидепрессантов, антипсихотиков, стабилизаторов настроения. При ингибировании этих систем некоторыми лекарственными препаратами складывается аналогичная CYP ситуация с повышением терапевтических доз до уровня токсических.
Недавно был описан механизм взаимодействия, касающийся распределения лекарственного препарата на клеточном уровне - захват лизосомами [65]. Антидепрессанты и нейролептики считаются основными липофильными соединениями, которые в клетке поглощаются лизосомами. Ткани таких органов, как лёгкие, печень и почки, богаты лизосомами и больше других в организме поглощают лекарственные вещества с этим типом распределения. Взаимное ингибирование процесса захвата лекарственных препаратов лизосомами приводит к повышению концентрации их в плазме крови, что более всего влияет на ткани с низкой плотностью лизосом, например, сердца, и вызывает усиление кардиотоксического действия.
Эти и многие другие фармакокинетические факторы могут объяснить случаи неблагоприятных побочных действий лекарственных препаратов, назначенных в средних дозах, включая описанные выше. Наблюдаемые нами на ЭКГ бругадоподобные изменения встречались, преимущественно, у пациентов среднего и пожилого возраста, с сопутствующей соматической патологией, при лечении антидепрессантами (в том числе атипичными, селективными ингибиторами обратного захвата серотонина), нейролептиками, антиконвульсантами и бензодиазепиновыми анксиолитиками и сопровождали клиническую картину глубокой и пролонгированной гиперседации. На наш взгляд, лечащие врачи-психиатры должны быть осведомлены в вопросах безопасности и кардиотоксичности назначаемых ими нейротропных лекарственных средств. Выделяют группу индивидуального риска кардиоваскулярных осложнений при лечении психотропными препаратами. Это лица пожилого возраста, пациенты с сердечно-сосудистой патологией (заболевания сердца, аритмии, брадикардия менее 50 ударов в минуту), с синкопальными состояниями в анамнезе, с синдромом удлинённого интервала QT (врождённым или приобретённым), с электролитным дисбалансом (гипокалиемия, гипокальциемия, гипомагнеземия, гипоцинкемия), с низким уровнем метаболизма, с дисфункцией автономной нервной системы, с выраженными нарушениями функций печени и почек, с сопутствующей терапией препаратами, блокирующими калиевые, натриевые или кальциевые каналы сердца и/или ингибирующими CYP, УГТ и Р-гликопротеин.
Российский Научно-Практический
рецензируемый журнал
ISSN 1561-8641Читайте также: