Экстракорпоральная мембранная оксигенация (ЭКМО) у пациента с отравлением
Добавил пользователь Alex Обновлено: 27.01.2026
1 ФГУП «Государственный научно-исследовательский институт особо чистых биопрепаратов» ФМБА России, Санкт-Петербург, Россия
2 ФГБУ «Государственный научный центр Российской Федерации – Федеральный медицинский биофизический центр им. А.И. Бурназяна» ФМБА России, Москва, Россия
3 ГБУЗ ЛО «Гатчинская клиническая межрайонная больница», Гатчина, Россия
Высоковирулентный вирус SARS-CoV-2, впервые появившись в Ухане (Китай), быстро распространился по всему земному шару, поразив более 14,5 миллионов человек и приведя к смерти более 600 тысяч человек.
Клиническое течение заболевания крайне разнообразно: от асимптоматичного течения до тяжелейших осложнений и угрожающей жизни полиорганной недостаточности. Среди факторов, предрасполагающих к тяжелому течению заболевания, можно выделить возраст и наличие сопутствующих заболеваний: пожилые пациенты и больные с выраженной сопутствующей патологией подвержены более высокому риску развития тяжелого острого респираторного синдрома (SARS) и смерти. Еще одним лабораторным показателем тяжести состояния при поступлении в стационар, является повышенный уровень D-димера (продукта распада фибриногена), что говорит о повышенном тромбообразовании [4, 5].
В настоящее время методом выбора спасения жизни при развивающейся дыхательной недостаточности является экстракорпоральная мембранная оксигенация (ЭКМО, «искусственное легкое»), заключающаяся в прямой оксигенации крови в обход пораженной легочной ткани. Данный метод является инвазивным, дорогостоящим и доступным только в клиниках специализированной медицинской помощи.
В условиях пандемии и массового поступления заболевших со средней и тяжелой формой заболевания особое значение приобретает метод гипербарической оксигенации, являющийся высокоэффективным неинвазивным способом спасения жизни, позволяющим в большинстве случаев избежать применения ИВЛ и ЭКМО [7].
Физические и физиологические основы ГБО
Гипербарическая оксигенация (ГБО) является признанным в мире методом лечения анаэробной и аэробной инфекции с некрозом мягких тканей, отравлений продуктами горения, хронических незаживающих ран, в том числе диабетических язв, осложнений лучевой терапии, последствий инсультов и травм головного мозга, декомпрессионной болезни и ряда других заболеваний и состояний [3].
Выбор метода ГБО для лечения пациентов с новой коронавирусной инфекцией не был случайным или эмпирическим. В основе обоснования самого метода лежат универсальные газовые законы, прежде всего закон Генри-Дальтона. Практическая реализация закона Генри-Дальтона при проведении гипербарической оксигенации заключается в том, что, находясь в барокамере, пациент вдыхает газовую смесь с повышенным содержанием кислорода при повышенном давлении, что позволяет увеличить кислородную емкость тканей и объем кислорода, растворенного в них. Захват и связывание молекул кислорода гемоглобином находится в зависимости от диффузии растворенного кислорода через стенку альвеол, стенку капилляра в плазму крови и через клеточную мембрану эритроцитов к гемоглобину. Снижение диффузии молекул кислорода на любом этапе отражается на последующем ухудшении показателя насыщения крови кислородом.
При интерстициальном вирусном отеке легких и нарастании дыхательной недостаточности стандартная кислородная поддержка через маску теряет эффективность, так как не имеет возможности влиять на давление газа в альвеолах. Как следствие, становится невозможным восполнение кислородного голодания и компенсация легочной и системной воспалительной реакции. Действие закона Генри-Дальтона при гипербарической оксигенации улучшает кислородное снабжение на всех физиологических этапах: повышает скорость диффузии кислорода в легочной ткани, растворимость кислорода в плазме крови, насыщение кислородом гемоглобина и доставку кислорода в микроциркуляторное русло тканей, страдающих от гипоксии, тем самым позволяет уменьшить или ликвидировать все формы кислородной задолженности [3].
Для клиницистов важна не столько физическая составляющая этого процесса, сколько клинико-физиологические эффекты, происходящие в организме в ответ на это воздействие. В первую очередь это антигипоксический эффект, позволяющий быстро поднять сатурацию и устранить гипоксию, прежде всего в центральной нервной системе, возникшую за счёт воспалительного процесса в лёгких при коронавирусной инфекции. Биоэнергетический эффект стимулирует расщепление глюкозы и поднимает уровень макроэргов, что может создать ресурсную базу для повышения толерантности к физической нагрузке и более раннему применению физической терапии для восстановления активности пациентов. При применении ГБО происходит стимуляция эпителизации и ангиогенеза за счёт увеличения функционирующих сосудов, прежде всего плазменных капилляров, снижается риск развития тромботических осложнений за счёт дезагрегации тромбоцитов и гепариноподобного влияния на свертывающую систему гипербарического кислорода. Вазопрессорный эффект процедуры ГБО обладает выраженным противоотечным свойством, а фармакодинамический и дезинтоксикационный эффекты усиливают действие противовирусных и антибактериальных препаратов и устраняют их побочное действие [3].
Одним из механизмов позитивного влияния ГБО на клеточном и молекулярном уровнях является прямое действие гидростатического давления и гипероксии на эпигенетическое модулирование экспрессии отдельных белок-продуцирующих генов человеческого генома. Самыми значительными кластерами стимулируемых генов являются гены роста, гены клеточного восстановления, гены клеточных медиаторов и противовоспалительные гены, в то время как в кластер подавляемых генов вошли гены воспалительного процесса и гены апоптоза. В частности, повышенный уровень растворенного в тканях кислорода обладает определенным антивирусным эффектом: увеличение количества свободных кислородных радикалов [8], повышение продукции индуцируемого гипоксией фактора (HIF), который в свою очередь стимулирует выработку антивирусных пептидов, таких как дефензины, кателецидины и понижает выделение воспалительных цитокинов, в том числе интерлейкина-6, приводящего к цитокиновому шторму [7, 9, 10].
В многочисленных исследованиях показано, что применение ГБО приводит к продолжительному системному воздействию на патофизиологические процессы заболеваний, особенно при остром воспалительном процессе в легких, нарушении перфузии тканей, тяжелых формах острого респираторного дистресс-синдрома и последствий острой сердечной недостаточности [3, 11, 12].
Таким образом, гипербарическая оксигенация (ГБО), базирующаяся на основных принципах физиологии и использующая законы физики для повышения диффузии и растворяемости кислорода в крови, может рассматриваться как альтернативный экстракорпоральной мембранной оксигенации (ЭКМО), эффективный и неинвазивный метод лечения новой коронавирусной инфекции, осложненной пневмонией.
Опыт применения ГБО при осложнениях COVID-19 в Китае
В апреле 2020 года в КНР (Речной госпиталь, г. Ухань) было опубликовано две статьи о клиническом применении гипербарической оксигенации (ГБО) у пациентов с пневмонией, вызванной новой коронавирусной инфекцией (COVID-19).
В частности, в опубликованном клиническом анализе лечащими врачами предложена выборка из пяти случаев лечения пациентов с тяжелой и критической формами течения инфекции COVID-19, двусторонней пневмонией, подтвержденной при компьютерной томографии и несостоятельностью стандартной ингаляционной кислородной поддержки (без интубации). Все пациенты до проведения сеансов ГБО находились на стандартной масочной ингаляционной терапии кислородом, при которой среднее значение показателя сатурации крови находилось на уровне 70%.
Сеансы гипербарической оксигенации проводились при давлении 1,6 АТА (2 АТА у одного из пациентов): первый сеанс длительностью 90 минут, последующие – 60 минут [13]. После проведения ГБО у каждого из пациентов в течение дня наблюдалось устойчивое увеличение показателя сатурации, сохраняющееся до утра следующего дня. Анализ колебаний показателя сатурации в течение суток, проведенный авторами, показал его снижение у всех пациентов до минимального значения в 8 часов утра и его общее динамическое нарастание с начала проведения гипербарической оксигенации.
После проведения 3-8 сеансов ГБО у всех пациентов отмечалось клиническое улучшение состояния (снижение температуры, нормализация частоты дыхания, уменьшение кашля) и улучшение лабораторных показателей (состав газов артериальной крови, снижение показателей фибриногена и D-димера). Среднее значение показателя сатурации возрастало ежедневно (p
Экстракорпоральная мембранная оксигенация при остром инфаркте миокарда, осложненном кардиогенным шоком
Кардиогенный шок — одна из основных причин смерти пациентов с острым инфарктом миокарда и летальность при этом составляет 60-80%. ЭКМО — экстракорпоральная мембранная оксигенация — является методом жизнеобеспечения у больных с кардиогенным шоком. Материалы и методы: пациентка 53 лет с острым инфарктом миокарда, осложненным тяжелым кардиогенным шоком, рефрактерным к медикаментозной терапии и внутриаортальной баллонной контрпульсации (ВАБК). Больной была подключена вено-артериальная ЭКМО и выполнено стентирование коронарных артерий. ЭКМО поддерживалась с объемной скоростью перфузии 4,5 л/мин (2,5 л/мин/м2). Продолжительность ЭКМО составила 138,5 часов (5,8 сут), продолжительность ВАБК — 9 суток. За исключением небольшого кровотечения в первые сутки из места установки артериальной канюли, осложнений, связанных с ЭКМО, не отмечено. В отделении реанимации пациентка находилась 12 суток. Результаты: для лечения кардиогенного шока используется ВАБК, которая при тяжелом кардиогенном шоке малоэффективна. Одним из возможных способов жизнеобеспечения и стабилизации состояния является ЭКМО. Современные системы ЭКМО могут использоваться для ургентного периферического подключения и обеспечения вмешательства на коронарных артериях. ЭКМО можно использовать для реанимации и временного поддержания жизни, что позволяет спасти до 50—75% больных с рефрактерным кардиогенным шоком. Выводы: неотложное коронарное стентирование с поддержкой ЭКМО является эффективным методом лечения острого инфаркта миокарда, осложненного тяжелым кардиогенным шоком. Ключевые слова: ЭКМО, кардиогенный шок, стентирование коронарных артерий.
Об авторах
Список литературы
1. Мороз В.В., Лихванцев В.В., Гребенчиков О.А.Общая реаниматология.
2. Babaev A., Frederick P.D, Pasta DJ., Every N., Sichrovsky T., HochmanJ.S.; NRMI Investigators.Trends in management and outcomes of patients with acute myocardial infarction complicated by cardiogenic shock.JAMA.2005; 294 (4): 448—454.
4. Sia S.K., Huang C.N., Ueng K.C., Wu Y.L., Chan K.C.Double vessel acute myocardial infarction showing simultaneous total occlusion of left anterior descending artery and right coronary artery.Circ. J.2008; 72 (6): 1034—1036.
5. Lee M.S., Pessegueiro A., Tobis J.The role of extracorporeal membrane oxygenation in emergent percutaneous coronary intervention for myocardial infarction complicated by cardiogenic shock and cardiac arrest.J. Invasive Cardiol.2008; 20 (9): E269—E272.
6. Shammas N.W., Roberts S., Early G.Extracorporeal membrane oxygena-tion for unprotected left main stenting in a patient with totally occluded right coronary artery and severe left ventricular dysfunction.J. Invasive Cardiol.2002; 14 (12): 756—759.
7. Dardas P., Mezilis N., Ninios V., Theofilogiannakos E.K., Tsikaderis D., Tsotsolis N., Kolettas A., Nikoloudakis N., Pitsis A.A.ECMO as a bridge to high-risk rotablation of heavily calcified coronary arteries.Herz.2012; 37 (2): 225—230.
8. Vainer J., van Ommen V., Maessen J., Geskes G., Lamerichs L., Waltenberger J.Elective high-risk percutaneous coronary interventions supported by extracorporeal life support.Am. J. Cardiol.2007; 99 (6): 771—773.
10. Westaby S., Anastasiadis K., Wieselthaler G.M.Cardiogenic shock in ACS. Part 2: role of mechanical circulatory support.Nat. Rev. Cardiol.2012; 9 (4): 195—208.
11. Chen Y.S., LinJ.W., Yu H.Y., Ko WJ.,Jerng J.S., Chang W.T., Chen WJ., Huang S.C., ChiN.H., Wang C.H., Chen L.C., TsaiP.R., WangS.S., HwangJJ., Lin F.Y.Cardiopulmonary resuscitation with assisted extracorporeal life support versus conventional cardiopulmonary resuscitation in adults with in hospital cardiac arrest: an observational study and propensity analysis.Lancet.2008; 372 (9638): 554—561.
12. Bakhtiary F., Keller H., Dogan S., Dzemali O., Oezaslan F., Meininger D., Ackermann H., Zwissler B., Kleine P., Moritz A.Venoarterial extracorpo-real membrane oxygenation for treatment of cardiogenic shock: clinical experiences in 45 adult patients.J. Thorac. Cardiovasc. Surg.2008; 135 (2): 382—388.
Экстракорпоральная мембранная оксигенация (ЭКМО) у пациента с отравлением
Широко применяются различные методы почечно-заместительной терапии, которые представлены гемодиализом, гемодиафильтрацией, гемофильтраций. Данные методики применяются при остром почечном повреждении на фоне развития полиорганной недостаточности, сепсиса. Также гемодиафильтрация применяется при отравлении различного генеза как наиболее эффективная альтернатива форсированного диуреза и при отравлении нефротоксичными ядами и почечном повреждении при отравлении медикаментозными средствами.
Плазмообмен применяется при отравлении гепатотоксичными ядами как альтернатива «искусственной печени», при гипербилирубинемии, панкреатите со значительно повышенной амилазой, гемолизе.
Ведущими специалистами в области почечно-заместительной терапии и экстракорпоральной гемокоррекции являются врачи анестезиологи-реаниматологи Татьяна Олеговна Светличная, Александр Сталиевич Ковальчук, Игорь Олегович Цветков
Центр является уникальным, единственным в городе Москве и в России подразделением, оказывающим любые виды экстракорпоральной поддержки жизни.
Экстракорпоральная мембранная оксигенация (ЭКМО) - это «мост» между критическим состоянием ребенка и его выздоровлением. ЭКМО – это использование механических устройств, которые временно (от нескольких дней до нескольких месяцев) поддерживают функции сердца и/или легких (полностью или частично) при сердечно-легочной недостаточности, ведущее к восстановлению функции органа или его замещению.
Целью проведения ЭКМО является стабилизация состояния ребенка с возможностью хирургической коррекции порока развития, интраоперационной поддержки газообмена при операциях на верхних и нижних дыхательных путях и магистральных сосудах, а также послеоперационной стабилизации состояния пациента. У новорожденных с тяжелой дыхательной недостаточностью без хирургических заболеваний ЭКМО также является методом выбора, когда традиционные методы не эффективны.
Проведение всевозможных методов экстракорпоральной гемокоррекции при тяжелый септических состояниях, проведение почечно-заместительной терапии возможно благодаря наличию нескольких видов аппаратов для кратковременных и длительных процедур.

Специалисты воссоздали пешеходные маршруты, заложенные еще при строительстве больницы в середине XIX века.
Благотворительный фонд помощи детям, рожденным раньше срока, «Подари солнечный свет» провел акцию «Жизнь в каждой капле»
Врачи детской Филатовской больницы получили почетные награды.
Мероприятие провел д.м.н, заведующий отделением анестезиологии-реанимации Эрик Агавелян.
Чем опасен бабушкин огород и игрушки старшего брата.— на эти и другие вопросы отвечает Дмитрий Маркович Долгинов
Демонстрация оперативных вмешательств в режиме реального времени, с комментариями ведущих специалистов страны.
От нашего учреждения выступили 9 участников, врач по лечебной физкультуре Хромов Александр Николаевич получил золотую медаль
Сегодня в Филатовской больнице поздравляли врачей с Днем Медика
13 июня исполнилось 94 года со дня рождения Вячеслава Александровича Таболина
10 июня в Ереване было подписано соглашение о сотрудничестве между больницами Москвы и Еревана
Выездной курс повышения квалификации с 14 по 17 июня
Врачи детской Филатовской больницы провели операции по кохлеарной имплантация
В преддверии Международного Дня Защиты детей в музее Филатовской больницы прошла экскурсия
В рамках проведения Всемирного Дня здоровья 20.04.2022 г. в 12:00 в онлайн режиме состоится Лекция-беседа для родителей
12 апреля в 12.00 (мск) состоится онлайн лекция для врачей и родителей «Нарушения слуха - глобальная проблема современной медицины»
Тема первого консилиума: Хирургическое лечение портальной гипертензии у детей
30 марта 1922 года больнице присвоено имя русского педиатра, профессора Нила Федоровича Филатова
15 февраля в Посольстве России в Узбекистане состоялась встреча проректора по инновационной деятельности РНИМУ им. Н.И. Пирогова.
Онлайн-трансляция конференции 4 марта в 10.00
Сотрудники Филатовской детской больницы были награждены почетными грамотами Генеральной прокуратуры
История ECMO
Экстракорпоральная мембранная оксигенация (ЭКМО) является методом протезирования жизненно важных функций организма, таких как газообменная функция легких и насосная функция сердца. На протяжении десятилетий ЭКМО используется в качестве кардиореспираторной поддержки при патологии сердца и легких, рефрактерной к общепринятым методам лечения. Особое значение данной методики было продемонстрированно в период развития тяжелых вирусных эпидемий (свиной грипп) вызывавших развитие острого респираторного дистресс синдрома. ЭКМО прочно заняло место в интенсивной терапии, обеспечивая временное замещение обратимо утраченных функций сердца и/или легких при условии их восстановления или наличия перспективы трансплантации.
Российские ученые были одними из пионеров, кто задумался о возможности оксигенации крови человека для медицинских целей. Сергей Сергеевич Брюхоненко (1890 г. – 1960 г.)

был одним из пионеров данного направления. В 1924 г. им был создан прототип аппарата искусственного кровообращения автожектор, который позволил проводить опыты с изолированной перфузией головы собаки. Однако данные работы носили экспериментальный характер и по существу длительное время были недоступны для международного медицинского сообщества.

Одним из ключевых компонентов ЭКМО является перенос кислорода в кровь через полупроницаемую мембрану. Этот феномен был впервые описан Колфф (Kolff) и Берк (Berk) в 1944 году, когда они отметили, что кровь проходя через целлофановые камеры искусственной почки обогащается кислородом.
Концепция применения искусственной оксигенации крови в медицинских целях была разработана в начале 1950-х годов. Первоначально устройства, используемые в то время, были пузырьковыми или дисковыми с прямым контактом крови и кислорода. Гигантский объем заполнения оксигенатора, большой объем искусственной поверхности, контактировавшей с кровью и несовершенный метод насыщения кислородом вызывал значимые изменения состава крови, гемолиз и не мог использоваться для долгосрочной поддержки. В 1951 г. Джон Хейшам Гиббон разработал аппарат искусственного кровообращения.

В 1953 г. выполнил первую в мире успешную операцию по закрытию дефекта межпредсердной перегородки (оксигенатор состоял из 14 – 20 проволочных сетчатых экранов в пластиковом контейнере) John Heysham Gibbon (1903—1973)

В 1955 г. ДэВаль (R.A.DeWall) и Лиллееу (C.W.Lillehei) представили пузырьковый прямопоточный оксигенатор с временем работы 4 часа.
А в 1956 г. пионер гемодиализа и создания искусственных органов W. Kolff (1911 г. - 2009 г.) представил первый мембранный оксигенатор.

Разработка первого мембранного оксигенатора с использованием полиэтилена в качестве мембраны, выполненная Кловес (G.H. Clowes) в 1956 году, позволила внедрить методику экстракорпоральной мембранной оксигенации (сердечно-легочный обход) в широкий спектр клинических процедур, в первую очередь открыв новую эру в кардиохирургии - операции на открытом сердце с искусственным кровообращением.

1960-е и 1970-е годы были отмечены революционными достижениями в области применения технологии длительной сердечно-легочной поддержки.

Значимый вклад в разработку и развитие технологии ЭКМО внесла лаборатория Колобова (T. Kolobow). В 1963 г. он впервые применил микропористую силиконовую мембрану в оксигенаторе, что принципиально изменило длительность применения экстракорпоральной поддержки.
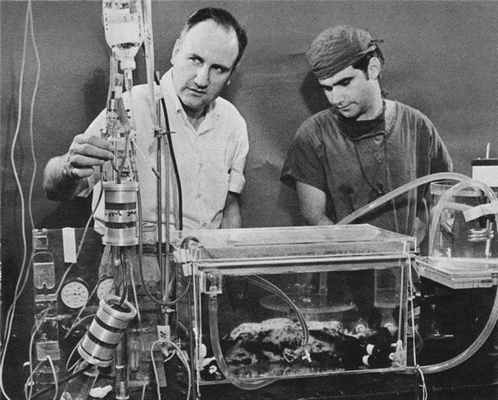
В 1965 г., Рашкинд (Rashkind) с коллегами впервые пытались использовать пузырьковый оксигенатор в качестве поддержки у новорожденных с прогрессирующей дыхательной недостаточностью.
В 1969 г, Дорсон (Dorson) с коллегами впервые использовали мембранный оксигенатор для искусственного кровообращения (ИК) у детей.
В 1970 г, Баффес (Baffes) с коллегами впервые успешно использовали ЭКМО в качестве поддержки у детей с врожденными пороками сердца после кардиохирургического вмешательства.
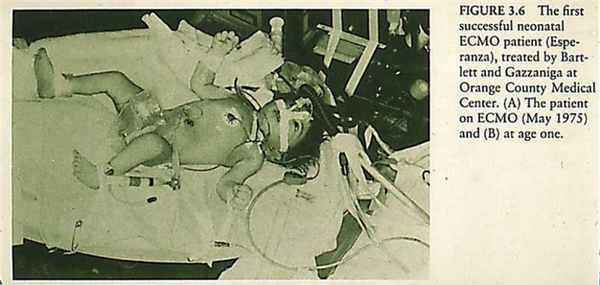
В 1975 г, Бартлетт (Bartlett) с коллегами впервые успешно применил ЭКМО у новорожденной с тяжелым дыхательным дисстрес синдромом вызванным аспирацией мекония.
В 1971 г., Хил (J.D. Hill) выполнил первое успешное применение ЭКМО у взрослого. Пациент Т. 24 года (ЧМТ. Разрыв аорты. Скелетная травма. ОРДС. Лечение: на 4 – е сутки, в связи с развитием критической дыхательной недостаточностью начата процедура ВА ЭКМО (периферическое подключение). Продолжительность 75 ч. Объемная скорость перфузии 3,0 – 3,6л/мин. Результаты лечения – Пациент Т. выписан.
1974 г. первое многоцентровое исследование эффективности ЭКМО-терапии у взрослых пациентов с тяжелой дыхательной недостаточностью. Однако результаты проведенных клинические исследования применения ECMO-терапии у группы взрослых пациентов с легочной недостаточностью не выявили улучшения выживаемости. В последствии это было объяснено следующими причинами: (1) пациенты сильно различались по типу и сложности их состояния; (2) применение ЭКМО поддержки было необоснованно, у большей части пациентов повреждение ткани легких было необратимым; (3) применение ЭКМО терапии начиналось слишком поздно, осложнения, вызванные гипоксией нивелировали положительный эффект ЭКМО поддержки; (4) продолжавшаяся интенсивная вентиляторная поддержка оказывала негативный эффект на повреждение легких. Первичный опыт применения ECMO у детей был аналогичен опыту взрослых. Тем не менее, эти исследования продемонстрировали, что у соответствующих пациентов, которым начинали ЭКМО в ранние сроки и у которых не имелось необратимого повреждения легочной ткани перспектива разрешения легочной недостаточности была статистически достоверной.
С появлением новых технологий (насос центрифужного типа вместо роликового; появление мембранных оксигенаторов, покрытых гепарином магистралей, автоматизации оборудования с помощью которого проводят ЭКМО) и совершенствованием метода проведения ЭКМО распространённость применения методики увеличилась. Значительный всплеск интереса к методике наблюдался в 2009 году во время пандемии вируса гриппа A/H1N1, А/H5N1, когда данная технология сыграла важную роль в терапии острой дыхательной недостаточности у пациентов с ОРДС. В настоящее время ЭКМО уверенно внедряется в клиническую практику как метод сердечно-легочной поддержки не только в кардиохирургических, но и в многопрофильных стационарах как методика временной поддержки жизнедеятельности (ECLS) при рефрактерной реанимации, кардиогенном шоке, тромбоэмболии легочной артерии, гипотермии, тяжелом астматическом статусе, отравлении кардиотоксическими препаратами, тяжелых электролитных нарушениях сотава крови и тд.
Респираторная поддержка новорожденных и младенцев
Первоначальные меры по стабилизации включают мягкую тактильную стимуляцию, изменение положения головы и отсасывание слизи изо рта и носа с последующим проведением (по необходимости) таких процедур:
Постоянное положительное давление в дыхательных путях (ППД)
Неинвазивная вентиляция с положительным давлением (NIPPV)
Искусственная вентиляция легких с использованием мешка Амбу или механическая вентиляция
Новорожденным, у которых не удается достичь достаточного насыщения крови кислородом, необходимо провести полное кардиологическое обследование для исключения врожденных сердечно-легочных аномалий Краткий обзор врожденных сердечно-сосудистых аномалий (Overview of Congenital Cardiovascular Anomalies) Врожденный порок сердца является наиболее распространенной врожденной аномалией, которая возникает у почти 1% живорожденных ( 1). Среди врожденных дефектов врожденный порок сердца является ведущей. Прочитайте дополнительные сведения и назначить высокочастотную вентиляцию легких, оксид азота, экстракорпоральную мембранную оксигенацию или их сочетание.
Алгоритм для реанимации новорожденных
* ИВЛ: инициировать реанимационые мероприятия с применением комнатного воздуха (21% O2) для доношенных детей или 21–30% O2 для недоношенных детей. Если цели насыщения крови O2 не достигнуты, повышайте титр концентрации вдыхаемого кислорода.
† Соотношение 3:1 сжатий:вдохов в общей сложности 90 сжатий и 30 вдохов в минуту. Сжатия и возможность вдохов осуществляются последовательно, не одновременно. Таким образом, проводится 3 сжатия со скоростью 120 манипуляций/минуту, затем 1 вдох через 1/2 секунды.
CPAP = постоянное положительное давление в дыхательных путях; ЭКГ = электрокардиография; ЭТТ = эндотрахеальная трубка; ЧСС = частота сердечных сокращений; PPV = вентиляция с положительным давлением; SpO2 = насыщение кислородом; UVC = катетер пупочной вены.
Кислород
Кислород можно доставлять с помощью назальной канюли или лицевой маски. Чтобы достичь PаО2 50–70 мм рт.ст. у недоношенных новорожденных Недоношенные младенцы Ребенок, родившийся до 37 недель беременности, считается недоношенным. Недоношенность определяется гестационным возрастом, в котором рождается ребенок. Раньше любой ребенок, родившийся с весом. Прочитайте дополнительные сведения и 50–80 мм рт.ст. у доношенных младенцев, либо кислородной сатурации 90–94% у родившихся преждевременно и 92–96% у родившихся в срок новорожденных, необходимо отрегулировать концентрацию кислорода. Более низкое PаО2 у новорожденных обеспечивает почти полное насыщение гемоглобина, поскольку фетальный гемоглобин имеет более высокое сродство к кислороду; поддержание более высокого PаО2 повышает риск ретинопатии недоношенных Ретинопатия недоношенных Ретинопатия недоношенных является двусторонним расстройством, вызванным аномальной васкуляризацией сетчатки у недоношенных детей, особенно с низкой массой тела при рождении. Исходы варьируются. Прочитайте дополнительные сведения . Независимо от того, как кислород доставляется ребенку, он должен быть нагрет (36–37 ° С), увлажнен для предотвращения секреции из-за охлаждения и высыхания и предотвращения бронхоспазма.
Катетеризация пупочной артерии, как правило, подходит для отбора проб на анализ газового состава артериальной крови у новорожденных, которым необходима концентрация вдыхаемого кислорода (FIO2) ≥ 40%. Если пупочный катетер не установлен, можно катетеризировать лучевую артерию для непрерывного мониторинга артериального давления и забора крови, если результат теста Аллена Исследование газового состава артериальной крови (ГСАК) в норме.
Новорожденные, не отвечающие на эти манипуляции, для улучшения сердечного выброса нуждаются в жидкости и являются кандидатами на вентиляцию в режиме CPAP или с помощью маски и мешка Амбу (40–60 вдохов в минуту). ППД, как с помощью аппарата искусственной вентиляции лёгких, так и с пузырьковым генератором давления, может помочь избежать интубации (и, таким образом, минимизировать вентилятор-индуцированное повреждение лёгких) даже у недоношенных детей. Однако если ребенок не насыщается кислородом или требует длительной искусственной вентиляции при помощи мешка Амбу, показана эндотрахеальная интубация с механической вентиляцией легких. Хотя для очень незрелых новорожденных (например, при сроке < 28 недель беременности или с массой < 1000 г) поддержка искусственной вентиляцией иногда начинается сразу после родов (см. также 1 Справочные материалы по Кислороду Первоначальные меры по стабилизации включают мягкую тактильную стимуляцию, изменение положения головы и отсасывание слизи изо рта и носа с последующим проведением (по необходимости) таких процедур. Прочитайте дополнительные сведения ), чтобы они могли получать терапию сурфактантом в качестве профилактики. Поскольку дыхательная недостаточность часто развивается у новорожденных на фоне бактериального сепсиса Неонатальный сепсис Неонатальный сепсис является инвазивной инфекцией, как правило, бактериальной, развивающейся в неонатальном периоде. Симптомы сепсиса многообразны, неспецифичны и включают снижение спонтанной. Прочитайте дополнительные сведения , обычно требуется проведение бактериологических исследований крови и назначение антибиотиков у кислород-зависимых новорожденных до получения результатов посева крови.
Справочные материалы по Кислороду
1. Lista G, Fontana P, Castoldi F, et al: ELBW infants: To intubate or not to intubate in the delivery room? J Matern Fetal Neonatal Med 25 (supplement 4):63–65, 2012. doi: 10.3109/14767058.2012.715008
Постоянное положительное давление в дыхательных путях (СИПАП)
При СИПАП постоянное давление сохраняется в течение всего дыхательного цикла, обычно в пределах 5-7 см H2O, без дополнительной поддержки давления на вдохе. СИПАП поддерживает альвеолы открытыми и улучшает оксигенацию, уменьшая количество крови, шунтированной в участке ателектаза во время спонтанного дыхания ребенка. CPAP проводится при помощи носовых канюлей или масок и различных аппаратов для создания положительного давления, его также можно получить при помощи эндотрахеальной трубки, подключенной к стационарным аппаратам для ИВЛ с установленной на нуле скоростью.
Пузырьковый ППД ( 1 Справочные материалы по ППД Первоначальные меры по стабилизации включают мягкую тактильную стимуляцию, изменение положения головы и отсасывание слизи изо рта и носа с последующим проведением (по необходимости) таких процедур. Прочитайте дополнительные сведения ) - это низкотехнологичный способ обеспечения ППД, при котором отводящая трубка попросту погружается в воду, чтобы обеспечить сопротивление выдоху, равное глубине трубки в воде (выдох создает пузырек в воде, отсюда и название).
CPAP показан в том случае, когда требуется FIO2 ≥ 40% для поддержания приемлемого PаO2 (50–70 мм рт.ст.) у детей с респираторными расстройствами, ограниченными по времени (например, диффузным ателектазом Ателектаз Ателектаз - это спадение легочной ткани с потерей объема легкого. При обширном ателектазе пациенты могут испытывать одышку или респираторную недостаточность. Также у них может развиваться пневмония. Прочитайте дополнительные сведения Распространенными осложнениями назального ППД являются растяжение желудка, аспирация, пневмоторакс Пневмоторакс Синдромы утечки воздуха в легких связаны с оттоком воздуха из нормального легочного воздушного пространства. (См. также Обзор перинатальных респираторных нарушений (Overview of Perinatal Respiratory. Прочитайте дополнительные сведения , а также назальные пролежни Системы определения стадии Повреждения, вызванные давлением - это области некроза и часто изъязвления (также называемые пролежнями), где мягкие ткани сдавливаются между костными выступами и внешними твердыми поверхностями. Прочитайте дополнительные сведенияСправочные материалы по ППД
Неинвазивная Вентиляция с Положительным Давлением (НВПД [NIPPV])
NIPPV ( Неинвазивная вентиляция с положительным давлением (NIPPV) Неинвазивная вентиляция с положительным давлением (NIPPV) Можно провести следующую механическую вентиляцию: Неинвазивную, с использованием различных типов лицевых масок инвазивная, с применением эндотрахеальной интубации Правильный выбор и использование. Прочитайте дополнительные сведения ) обеспечивает вентиляцию с положительным давлением с помощью носовых канюль или назальной маски. Она может быть синхронизирована (т.е. вызвана усилием при вдохе младенца) или несинхронизирована. NIPPV может обеспечить скорость поддерживающей вентиляции легких и может усиличить спонтанное дыхание младенца. Максимальное давление может быть установлено до необходимых пределов. Это особенно полезно для пациентов с апноэ, чтобы облегчить экстубацию и предотвращение ателектаз. Обнаружено, что назальная перемежающаяся вентиляция с положительным давлением (НПВПД) снижает частоту неблагоприятных исходов при экстубации и необходимость в повторной интубации в течение 1 недели более эффективно, чем назальный ППД; однако это не влияет на развитие хронических заболеваний легких или смертность.
Читайте также:
