Эмпирическая лекарственная терапия желудочковой тахикардии. Имплантируемые кардиовертеры-дефибрилляторы
Добавил пользователь Валентин П. Обновлено: 27.01.2026
Пароксизмальная желудочковая тахикардия (ПЖТ) - абсолютно жизнеугрожающее нарушение ритма, требующее немедленной госпитализации.
Наряду с фибрилляцией желудочков, желудочковая тахикардия - ведущая причина остановки кровообращения и внезапной смерти в России и в мире.
ПРИЧИНЫ РАЗВИТИЯ ПАРОКСИЗМАЛЬНОЙ ЖЕЛУДОЧКОВОЙ ТАХИКАРДИИ
Причины развития ПЖТ:
1. тяжёлые заболевания сердечно-сосудистой системы:
- инфаркт миокарда
- кардиомиопатии
- пороки сердца
- сердечная недостаточность
- миокардит (тяжёлое течение)
- частая алкоголизация в значительных количествах
- вдыхание паров клея
- наркотические вещества
3. травма сердца
4. лекарственные средства: сердечные гликозиды, антидепрессанты, флекаинид , фторхинолоны
5. врожденные аномалии проводящей системы сердца (синдром Бругада)
6. идиопатическая ЖТ – причина развития неясна

ГРУППЫ РИСКА ПАРОКСИЗМАЛЬНОЙ ЖЕЛУДОЧКОВОЙ ТАХИКАРДИИ
В группе риска развития болезни, в первую очередь - пациенты, перенесшие инфаркт миокарда. А также имеющие врожденные аномалии развития проводящей системы сердца и тяжёлое токсическое поражение миокарда.
СИМПТОМЫ ПАРОКСИЗМАЛЬНОЙ ЖЕЛУДОЧКОВОЙ ТАХИКАРДИИ И ПЕРВАЯ ПОМОЩЬ
В случае развития у таких пациентов остановки кровообращения нужно немедленно начать реанимационные мероприятия и проводить их до прибытия врачей. Единственный эффективный способ прерывания этой аритмии - дефибрилляция (то есть подача электрического тока специальным устройством-дефибриллятором). Но в ожидании бригады реанимации, каждый должен уметь помочь таким пациентам.
Клинически ПЖТ проявляется внезапной потерей сознания и остановкой кровообращения, то есть такие пациенты не дышат, у них нет пульса и сознания. В этой ситуации необходимо немедленно нанести удар кулаком по грудине пациента (узкая плоская кость в центре грудной клетки) и начать непрямой массаж сердца (НМС).
Как проводится НМС:
- пациент должен лежать на твердой поверхности
- оказывающий помощь интенсивно надавливает на грудную клетку пациента с частотой 100 нажатий в минуту и на глубину 5-6 см
- реанимацию проводят до приезда медицинской бригады
Непрямой массаж сердца выполняет функцию насоса и руки реанимирующего, по сути, заменяют собой остановившееся сердце пациента.
Нередко пароксизмы ЖТ проявляется рецидивирующими (то есть повторяющимися) обмороками, со спонтанным (то есть самостоятельным) восстановлением сознания.
МЕХАНИЗМЫ РАЗВИТИЯ ПАРОКСИЗМАЛЬНОЙ ЖЕЛУДОЧКОВОЙ ТАХИКАРДИИ
Почему останавливается сердце пациента при ПЖТ?
Механизм развития этого нарушения ритма сердца следующий. В силу повреждающего фактора в миокарде (мышце сердца) возникают очаги повреждения, по типу микроинфарктов, меняющие общий «электрический фон» сердца.
В этой связи вокруг таких очагов или в них самих заводятся маленькие «торнадо» - пароксизмы желудочковой тахикардии. Они заставляют биться сердце с высокой частотой и основной источник этой аритмии в миокарде желудочков сердца.
В отличие от предсердий, желудочки «рассчитаны» на работу с частотой 60-80-100 в минуту. При ЖТ частота сердечных сокращений превышает 200 в минуту и сердце, конечно, не может долго работать в таком режиме. И тогда оно останавливается. Это и есть внезапная сердечная смерть.
Спасти такого пациента может вовремя поданный разряд тока на грудную клетку через дефибриллятор. Во многих странах мира запущена программа по профилактике внезапной сердечной смерти и обучению населения навыкам первой медицинской помощи, в том числе и при внезапной остановке кровообращения. К сожалению, в нашей стране этой манипуляцией владеют лишь медицинские работники.
ЛЕЧЕНИЕ ПАРОКСИЗМАЛЬНОЙ ЖЕЛУДОЧКОВОЙ ТАХИКАРДИИ
При развитии ЖТ необходима экстренная госпитализация и немедленное восстановление синусового ритма. Ритм восстановливается либо медикаментозно, либо методом электроимпульсной терапии (ЭИТ).
Внутривенно вводится антиаритмический препарат (амиодарон (кордарон). Затем, для профилактики повторного развития аритмии, пациент принимает этот препарат в монотерапии или с другими препаратами.
В случае ЭИТ используется разряд тока, подаваемый через грудную клетку. Пациента погружают в медикаментозный сон, затем накладывают электроды дефибриллятора и подают разряд тока. Этот метод основан на том, что основой развития ПЖТ является электрическая нестабильность миокарда.
Разряд тока производит своеобразную «встряску» миокарда, подавляя «несанкционированные» очаги аритмии. После проведения ЭИТ, также для профилактики рецидива (повторного развития) аритмии, пациент принимает антиаритмические препараты.
На принципе ЭИТ основано применение имплантируемых кардиовертеров-дефибрилляторов (ИКД) при ПЖТ. Небольшое устройство, напоминающее электрокардиостимулятор, вживляется под кожу, а электроды от него «спускаются» в сердце по сосудам. Если аритмии нет, то это устройство «молчит».
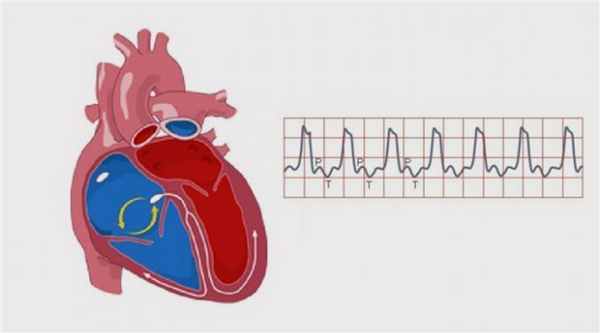

Если развивается пароксизм желудочковой тахикардии, то ИКД срабатывает и подает разряд тока на сердце, тем самым подавляя очаг аритмии. Благодаря ИКД пациент защищен от риска внезапной остановки сердца и, по сути, носит в себе постоянно маленький дефибриллятор. Имплантацией этих устройств занимаются сердечно-сосудистые хирурги в специализированных аритмологических центрах, к каким относится МО «Новая больница».
Имплантация ИКД не требует наркоза, проводится через маленький разрез на коже, уже на следующий день после операции пациент может заниматься привычной деятельностью. Однако, после имплантации ИКД пациент должен находиться под наблюдением кардиохирурга-аритмолога и такое наблюдение доступно и в нашей клинике.
Пароксизмальная желудочковая тахикардия может быть неустойчивой, т.е кратковременной, и проходить самостоятельно. Но требуется наблюдение и лечение, поскольку есть риск ее повторного развития и угрозы для жизни пациента.
Иногда кардиохирурги прибегают к аблации очагов ПЖТ, то есть «прижигают» аритмогенный очаг с помощью холодового воздействия (криодеструкции), либо лазером. Эти манипуляции также выполняются в кардиохирургических стационарах. И требуется дальнейшее наблюдение и лечение под руководством кардиохирурга-аритмолога.
Особая разновидность ЖТ - пароксизмы этого нарушения ритма на фоне врождённых аномалий проводящей системы сердца (например, при синдроме Бругада). Проводящая система сердца (ПСС) – «электрическая проводка» в сердце, превращающая электрический импульс в сокращение миокарда. При синдроме Бругада, пациент рождается с «предуготованностью» развития жизнеугрожающих аритмий, в т.ч. ПЖТ.
«Проводка» у таких пациентов «искрит». Это - пароксизм аритмии. До воздействия провоцирующего фактора (например, приема лекарств) пациент здоров, но в случае контакта с этим фактором реализуется предуготованность к аритмии, и она развивается. Нередко первый и последний раз в жизни.
Поэтому такое внимание уделяют кардиологи и аритмологи семейному анамнезу. При наличии врождённых аномалий ПСС настораживает факт смерти в молодом возрасте от неизвестных причин кого-то из родственников, особенно первой – второй линии родства.
Наличие электрокардиограммы (ЭКГ), снятой на скорости 50 мм/cек - обязательная часть любой консультации кардиолога и аритмолога. Уже при анализе обычной ЭКГ врач распознает признаки синдрома Бругада и вовремя помогает своему пациенту.
ДИАГНОСТИКА ПАРОКСИЗМАЛЬНОЙ ЖЕЛУДОЧКОВОЙ ТАХИКАРДИИ
Диагностируется ПЖТ при регистрации обычной ЭКГ, а также при холтеровском мониторировании ЭКГ (суточного мониторинга электрокардиограммы).
ПРОФИЛАКТИКА ПАРОКСИЗМАЛЬНОЙ ЖЕЛУДОЧКОВОЙ ТАХИКАРДИИ
- Знание семейного анамнеза. Если были внезапные смерти в семье (особенно у родственников первой-второй линии в молодом возрасте), то обратитесь к кардиологу для выявления риска развития ПЖТ.
- Профилактика развития сердечно-сосудистых заболеваний (инфаркт, кардиомиопатия): контроль артериального давления, отказ от курения, профилактика и лечение вирусных заболеваний
- Здоровый образ жизни (отказ от курения, алкоголя)
- Прием антиаритмических средстви установка имплантируемых кардиовертеров-дефибрилляторов
Пациенты с этой патологией наблюдаются и лечатся у кардиологов-аритмологов и кардиохирургов. Все эти услуги доступны в нашей клинике «Новая больница».
Эмпирическая лекарственная терапия желудочковой тахикардии. Имплантируемые кардиовертеры-дефибрилляторы
Эмпирическая лекарственная терапия желудочковой тахикардии. Имплантируемые кардиовертеры-дефибрилляторы
Эмпирическая лекарственная терапия означает только то, что препарат назначают без предварительной оценки его эффективности. Эмпирическая лекарственная терапия для первичного лечения ЖТ была обычной до начала 1980-х гг., но с распространением ЭФИ стала считаться неприемлемой. Когда в конце 1990-х гг. ЭФИ, в свою очередь, утратило доверие и было признано, что антиаритмические препараты I класса вызывают феномен проаритмии, это заставило навсегда отказаться от идеи простого возвращения к эмпирической терапии (по крайней мере, с помощью большинства антиаритмических препаратов) при устойчивой ЖТ.
Тем не менее эмпирическая терапия антиаритмическими препаратами может быть полезной как дополнительная тем больным, которым имплантирован кардиовертер-дефибриллятор, и тем, кто отказался от имплантации или не подлежит ей по ряду причин. В настоящее время для эмпирической терапии чаще всего применяют препараты III класса из-за их относительно низкой способности усиливать возвратную ЖТ.
Клиническими исследованиями доказано, что особенно эффективным может быть амиодарон и что он более эффективен, чем препараты I класса. Исследование CASCADE (Cardiac Arrest in Seattle — Conventional Versus Amiodarone Drug Evaluation) показало, что амиодарон был значительно эффективнее для снижения смертности и частоты возникновения рецидивов аритмии, чем традиционные препараты. Однако многим пациентам, принимавшим участие в этом исследовании, были установлены ИКД, поэтому невозможно было достаточно точно оценить эффект амиодарона в отношении снижения смертности.
Риск рецидивов аритмии у пациентов с устойчивой ЖТ могут снижать и другие препараты III класса. Некоторое положительное действие может оказывать соталол; имеются также доказательства полезности дофетилида и проходящего стадию исследования азимилида. Всегда, когда это возможно, эмпирическую терапию следует иметь в виду при лечении больных с ИКД. Для пациентов же с устойчивой ЖТ ее нельзя считать надежным средством первого выбора.
Имплантируемые кардиовертеры-дефибрилляторы
Имплантируемый кардиовертер-дефибриллятор (ИКД) —- это прибор, который автоматически определяет начало желудочковой тахиаритмии и купирует ее с помощью разряда постоянного электрического тока (при ФЖ или очень быстрой ЖТ) или с помощью очереди (пачки) импульсов, задающих ритм (при более медленной устойчивой ЖТ). ИКД применяются в клинике с начала 1980-х гг., и уже накоплен большой международный опыт по их использованию. В настоящее время хирургическая смертность при имплантации кардиовертеров-дефибрилляторов составляет менее 1 %. Доказано, что эти приборы исключительно эффективны для предотвращения внезапной смерти от желудочковых тахиаритмии. У пациентов, перенесших остановку сердца, риск рецидива угрожающей жизни аритмии спустя 2 года составляет 40 %. ИКД снижают его до 2 % через 1 год и до 6 % спустя 5 лет. Никакой другой метод лечения так эффективно не снижает риск внезапной смерти у этой категории больных.
Несколько труднее ответить на вопрос, снижает ли ИКД смертность среди пациентов с относительно хорошо переносимой устойчивой мономорфной ЖТ. Хотя многим, если не большинству, эпизодам фибрилляции желудочков предшествуют, по крайней мере, несколько пароксизмов ЖТ, неясно, насколько часто у пациентов с рецидивирующими продолжительными приступами гемодинамически стабильной ЖТ может развиться ФЖ. Несмотря на это, существуют, по меньшей мере, две причины, по которым следует предусмотреть возможность установки ИКД таким пациентам.
Во-первых, ИКД могут купировать мономорфную ЖТ с помощью пейсмекерного алгоритма (безболезненно), восстанавливая синусовый ритм без осуществления болезненного электрошока. Во-вторых, у подавляющего большинства больных с мономорфной ЖТ уже имеются показания для имплантации кардиовертера-дефибриллятора. Доказано, что ИКД значительно улучшает выживаемость пациентов со сниженной фракцией выброса при наличии в анамнезе инфаркта миокарда или сердечной недостаточности (а это большинство пациентов с мономорфной ЖТ) независимо от того, имелась ли у них раньше желудочковая тахикардия. Следовательно, большинство пациентов с ЖТ соответствуют общепринятым критериям для имплантации кардиовертера-дефибриллятора.
- Вернуться в оглавление раздела "Кардиология."
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Желудочковая тахикардия (ЖТ)
Желудочковая тахикардия это ≥ 3 последовательных желудочковых комплексов с частотой ≥ 120 ударов в минуту. Симптомы зависят от длительности и могут варьировать от их полного отсутствия до ощущения сердцебиения, коллапса гемодинамики и смерти. Диагностируется по электрокардиографии. Лечение продолжительных эпизодов проводится посредством кардиоверсии или антиаритмиков, в зависимости от симптомов. При необходимости проводится долгосрочное лечение посредством имплантируемого кардиовертера-дефибриллятора.
Некоторые эксперты используют для верификации желудочковой тахикардии (ЖТ) частоту ритма ≥ 100 ударов в минуту. Повторяющиеся желудочковые ритмы с меньшей частотой называются ускоренными идиовентрикулярными ритмами, или медленной ЖТ; как правило, они являются благоприятными и не требуют лечения при отсутствии клинической симптоматики.
Большинство пациентов с ЖТ имеют значимое заболевание сердца, в частности перенесенный инфаркт миокарда Острый инфаркт миокарда (ИМ) Острое поражение миокарда - это миокардиальный некроз в результате резкой обструкции коронарной артерии. Симптоматика данных состояний включает дискомфорт в грудной клетке, сопровождающийся. Прочитайте дополнительные сведенияЖелудочковая тахикардия может быть мономорфной и полиморфной, а также неустойчивой и устойчивой.
Мономорфная ЖТ: одиночный патологический фокус или механизм риентри и регулярные, идентичные по морфологии QRS комплексы
Полиморфная ЖТ: нескольких различных фокусов или дополнительных путей и неправильной формы QRS комплексы
Неустойчивая ЖТ: длится < 30 секунд
Устойчивая ЖТ: продолжительность ≥ 30 секунд или меньше вследствие гемодинамического коллапса
ЖТ часто переходит в фибрилляцию желудочков Фибрилляция желудочков (ФЖ) Фибрилляция желудочков вызывает нескоординированное дрожание желудочков с отсутствием эффективного сокращения. Она вызывает незамедлительное синкопе и смерть в течение нескольких минут. Лечение. Прочитайте дополнительные сведенияСимптомы и признаки желудочковой тахикардии
Короткая по длительности или с медленной частотой желудочковая тахикардия может быть асимптомной. Устойчивая ЖТ почти всегда симптомная, вызывающая сердцебиения, симптомы недостаточности гемодинамики или внезапную сердечную смерть.
Диагностика желудочковой тахикардии
Диагноз желудочковой тахикардии устанавливается по ЭКГ (см. рисунок Желудочковая тахикардия с широкими QRS Желудочковая тахикардия с широкими QRS. ). Любая тахикардия с широкими QRS комплексами (QRS ≥ 0,12 секунды) должна рассматриваться как ЖТ пока не доказана другая тахикардия.
Диагноз подтверждается при наличии на ЭКГ диссоциации зубцов Р, сливных комплексов или наджелудочковых «захватов», униформности векторов QRS в грудных отведениях (конкордантности) с дискордантным вектором Т-волны (противоположные векторы QRS), и расположении оси QRS во фронтальной плоскости в северо-западном квадранте. Дифференциальный диагноз проводится с суправентрикулярной тахикардией Пароксизмальная суправентрикулярная тахикардия (СВТ), включая синдром Вольфа-Паркинсона- Уайта В возникновении наджелудочковых тахикардий по механизму риентри (НЖТ) участвуют электрические проводящие пути, расположенные выше бифуркации пучка Гиса. У пациентов возникают эпизоды внезапного. Прочитайте дополнительные сведения из-за блокады ножек пучка Гиса или через дополнительный путь проведения (см. рисунок Модифицированные критерии Бругада для желудочковой тахикардии Модифицированные критерии Бругада для желудочковой тахикардии ). Однако по причине того, что некоторые пациенты переносят ЖТ удивительно хорошо, заключение о том, что хорошо переносимая тахикардия с широкими комплексами, вероятно, является суправентрикулярной, является ошибкой. Использование лекарств, подходящих для лечения суправентрикулярной тахикардии (например, верапамил, дилтиазем) у пациентов с ЖТ, может вызвать гемодинамический коллапс и смерть.
Здравый смысл и предостережения
По причине того, что некоторые пациенты переносят желудочковую тахикардию удивительно хорошо, ошибочным является заключение о том, что хорошо переносимая тахикардия с широкими комплексами, вероятно, является суправентрикулярной.
Желудочковые тахикардии
Желудочковая тахикардия (ЖТ) – вид пароксизмальной тахикардии (ссылка на страницу). Характеризуется нарушением синусного ритма и увеличением числа сокращений желудочков. Причиной заболевания служит изменения со стороны мышцы сердца или проводящей системой желудочков сердца, вследствие чего реализуется механизм re-entry (круговой аритмии), либо часть клеток сердца начинают проявлять повышенную электрическую активность, что приводит к ускоренной работе желудочков сердца.
Во время приступа частота сердечных сокращений (ЧСС) колеблется от 140 до 220 ударов в минуту. Среди всех нарушений ритма ЖТ самая опасная, т.к. она может трансформироваться в жизнеугорожающую аритмию – фибрилляцию желудочков. Кроме того, во время приступа желудочки сокращаются часто, но не в полном объеме. Это может привести к недостаточности кровоснабжения головного мозга и вызвать потерю сознания.
Причины желудочковой тахикардии
В 98% причиной возникновения желудочковой тахикардии является сердечное заболевание, в остальных 2% причина остается не выявленной. Такая патология называется идиопатической.
Заболевания, которые могут привести к ЖТ:
- ;
- постинфарктная аневризма;
- реперфузионные аритмии;
- миокардиты;
- кардиосклероз;
- кардиомиопатии;
- саркоидоз; ;
- генетические заболевания
Отметим провоцирующие внешние факторы, влияющие на развитие ЖТ:
- стрессовые ситуации;
- частые психоэмоциональные напряжения;
- повышенная физическая нагрузка;
- хирургическое вмешательство;
- передозировка лекарственными препаратами;
- гормональный дисбаланс в организме.
Симптомы желудочковой тахикардии
Симптомы зависят от продолжительности приступа и от сложности нарушений. Иногда ЖТ протекает бессимптомно.
К основным недомоганиям относятся:
- учащенное сердцебиение;
- боль и жжение в груди;
- резкое головокружение;
- потеря сознания;
- судороги;
- слабость;
- тревожность или чувство страха.
Чтобы быть уверенным в правильной работе своего сердца и вовремя устранить причину возникновения симптомов ЖТ, обратитесь за консультацией к врачам аритмологам - кардиологам ФНКЦ ФМБА России. В Кардиологическом центре ФНКЦ ФМБА разработано несколько программ обследования сердца. Врачи-кардиологи подберут нужную для вас программу и назначат подходящую диагностику.
Диагностика
Если вы почувствовали резкое учащение сердцебиения, стоит незамедлительно обратиться к врачу. После физикального осмотра, пациента отправляют на ЭКГ для точного определения диагноза.
В качестве дополнительной диагностики используют:
- суточный мониторинг ЭКГ;
- ЭФИ (электрофизиологическое исследование сердца);
- ЭХО;
- коронарография – рентгеноконтрастный метод исследования.
Врач может назначить взятие лабораторных анализов, результаты которых укажут на сопутствующие патологии.
Своевременная диагностика – основополагающий фактор в успешном лечении заболевания. Не игнорируйте недомогания – обратитесь за помощью к специалистам ФНКЦ ФМБА!
Профилактика желудочковой тахикардии
При обнаружении симптомов важна незамедлительная диагностика с целью устранения причины заболевания и его лечения. В большинстве случаев профилактика является вторичной и заключается в предотвращении рецидива. Поэтому важная часть профилактики – регулярное обследование сердечно-сосудистой системы. Специалисты Кардиологического центра ФНКЦ ФМБА проводят комплексные проверки сердца, ознакомиться с программами можно тут.
Чтобы предупредить появление или повторение желудочковой тахикардии, важно следовать рекомендациям врача и выполнять все его назначения.
К дополнительным мерам профилактики относятся:
- регулярный контроль артериального давления;
- контроль веса тела;
- правильное питание: исключить жирное, жареное, острое, соль;
- полный отказ от вредных привычек;
- занятия лечебной физкультурой и умеренными физическими нагрузками.
Как лечить желудочковую тахикардию
На сегодняшний день доказанным эффективным лечением ЖТ является катетерная радиочастотная аблация. Для профилактики развития жизнеугрожающих состояний у пациентов с желудочковой тахикардии имплантируют кардиовертер-дефибриллятор, назначают анитиаритмическую терапию. В большинстве случаев эти методики комбинируют, чтобы добиться максимально благоприятного прогноза для пациента.
Эмпирическая лекарственная терапия желудочковой тахикардии. Имплантируемые кардиовертеры-дефибрилляторы
Кардиология:
Стратегии антиаритмической терапии с целью профилактики остановки сердца
Исторически сложилось, что пациентам с внебольничной остановкой сердца и гемодинамически стабильной ЖТ назначают мембранно-активные ААП. Такой подход был основан на предположении, что высокая частота желудочковых аритмий является пусковым механизмом для потенциально фатальных аритмий и что электрофизиологические нарушения и/или нестабильность миокарда, предрасполагающие к потенциально фатальным аритмиям, можно устранить с помощью этих препаратов.
Терапевтическая стратегия при желудочковых аритмиях заключается в их подавлении с помощью ААП, при электрофизиологических нарушениях — в подавлении индуцируемости ЖТ или ФЖ во время программируемой электрической стимуляции. Данные наблюдений показали, что подавление непосредственно аритмии, выявленной при амбулаторной регистрации, может быть выполнено путем эмпирического использования амиодарона, бета-АБ или мембранно-активных ААП. Было высказано предположение, но не доказано, что такие методы позволят уменьшить риск смерти.
Что касается мембранно-активных препаратов, утверждалось, что пациенты, принимавшие после остановки сердца ААП класса I, имели худшие исходы, чем те, кто этих ААП не получал; таким образом была подвергнута сомнению польза этих ААП. Это было окончательно подкреплено результатами исследования CAST, показавшим, что определенные ААП класса I у таких пациентов были нейтральными или даже вредными, а терапия бета-АБ имела определенные преимущества, как и амиодарон. В итоге положительные результаты закрепили превосходство ИКД-терапии для большинства пациентов, переживших тахиаритмическую остановку сердца.
В исследовании ESVEM (Electrophysiologic Study Versus Electrocardiographic Monitoring) было высказано предположение, что ААП класса III соталол превосходит класс I мембранно-активных ААП у пациентов с жизнеугрожающей желудочковой тахиаритмией, но не сравним с амиодароном или β-АБ.
Таким образом, стратегия подавления аритмии для снижения риска у выживших после ЖТ и ФЖ пользовалась успехом в течение короткого периода времени, но потом уступила место амиодарону и возможно, β-АБ, назначенным эмпирически. Сочетание амиодарона и β-АБ у пациентов после ИМ было предложено в качестве более полезной стратегии, чем назначение любого другого препарата в виде монотерапии.
Анализ результатов исследований EMIAT (European Myocardial Infarct Amiodarone Trial) и CAMIAT (Canadian Amiodarone Myocardial Infarction Trial), а также других работ укрепили успех применения β-АБ для специфической профилактики ВСС у нерандомизированных пациентов после перенесенного ИМ.

а) Амбулаторная регистрация электрокардиограммы и эмпирическая терапия. Разработка надежных методов анализа амбулаторной регистрации ЭКГ побудила некоторых исследователей изучить пользу таких регистраций для определения риска устойчивых тахиаритмий и оценить возможности лекарственной терапии для подавления такой аритмии при профилактике внезапной сердечной смерти (ВСС). В настоящее время эта стратегия устарела, но амбулаторный мониторинг по-прежнему используют для оценки риска развития жизнеугрожающих устойчивых аритмий у лиц с определенными формами структурных или электрофизиологических нарушений, сопровождающихся высоким риском.
Например, в исследованиях MADIT (Multicenter Automatic Defibrillator Implantation Trial) и MUSTT (Multicenter Unsustained Tachycardia Trial) использовали стратегии выявления неустойчивой ЖТ у пациентов после НМ и с другими маркерами риска ранней смерти. Хотя в дизайне исследований фоновая аритмия не служила мишенью терапии, была доказана целесообразность использования этого метода для определения риска. Аналогичным образом, особенно у симптоматических пациентов, амбулаторную регистрацию ЭКГ используют для определения риска при различных патологических состояниях: ГКМП, СУ QT, ДПЖ и у больных с ДКПМ и СН.
В нескольких исследованиях эмпирическая антиаритмическая терапия, преимущественно амиодароном, для предотвращения рецидива остановки сердца или других опасных для жизни аритмий получила относительное преимущество. Имеет ли подобная ААТ абсолютный успех в плане профилактики летальных исходов, можно определить только по результатам плацебо-контролируемых клинических испытаний, которые невозможны. В контролируемых исследованиях AVID (Antiarrhythmics Versus Implantable Defibrillators), CIDS (Canadian Implantable Defibrillator Study) и CASH (Cardiac Arrest Study Hamburg) предположили, что эмпирически назначенный амиодарон менее эффективен, чем ИКД, для снижении риска смерти среди выживших после жизнеугрожающих аритмий, особенно при ФВ < 35%.
В контролируемом исследовании SCD-HeFT (Sudden Cardiac Death in Heart Failure Trial) по изучению первичной профилактики ВСС у пациентов с CM II/III ФК амиодарон также, как и ИКД, не выполнили своих задач.
б) Программируемая электрокардиостимуляция. Вторая основная антиаритмическая стратегия основана на подавлении индуцируемости устойчивой желудочковой аритмии, считающейся маркером риска во время ЭФИ. Использование программируемой ЭКС для определения пользы ААП на основе подавления индуцируемости стало популярным методом оценки длительной терапии среди выживших после внебольничной остановки сердца. ЭКС стала предпочтительным методом лечения, несмотря на разную чувствительность и специфичность различных протоколов по ЭКС и статус миокарда, реагирующего на ЭКС во время клинической остановки сердца.
Тем не менее, большинство исследований описывают возникновение индуцибельной аритмии у относительно небольшого количества выживших после остановки сердца (в среднем < 50%).
Лекарственная супрессия индуцируемости во время ЭФИ в качестве конечной точки вторичной профилактики ВСС или первичной профилактики в группах высокого риска у больных после ИМ уступила терапевтической пользе ИКД (с некоторыми исключениями среди отдельных категорий пациентов при первичной профилактике). ЭФИ по-прежнему используют для определения риска в ряде клинических случаев. Несмотря на большую и немного противоречивую базу данных о роли ЭФИ в определении риска, результаты исследований вторичной профилактики среди выживших после остановки сердца показали отсутствие необходимости проведения обычного ЭФИ у таких людей, особенно при доступной имплантации ИКД.
Все исследования вторичной профилактики продемонстрировали преимущества ИКД по сравнению с терапией ААП (обычно амиодароном) без анализа какой-либо пользы от определения риска при электрофизиологическом тестировании. В случаях, когда можно определить потенциально обратимые пусковые механизмы остановки сердца, а также у некоторых лиц после остановки сердца с предполагаемым механизмом в виде преходящей ишемии и ФВ > 40%, возможны ограничения по проведению таких исследований в качестве рекомендаций по терапии. Напротив, некоторые исследований по первичной профилактике, в частности MADIT и MUSTT, использовали для определения риска ЭФИ и продемонстрировали его большие преимущества.
MADIT II, в которое были включены пациенты с более низкой ФВ, чем в MADIT или MUSTT, и в котором не учитывали маркеры аритмии, также продемонстрировало преимущества выживаемости при ИКД-терапии. Вопрос о том, необходима ли разработка критериев для электрофизиологического тестирования, еще не решен. До настоящего времени ЭФИ используют для определения показаний к установке ИКД у пациентов, отобранных согласно критериями, изложенным в MADIT и MUSTT.
Вопрос о значении индуцированных неустойчивых форм желудочковой тахикардии (ЖТ) остается дискуссионным. Высказано предположение, что индукция неустойчивой желудочковой аритмии может свидетельствовать о риске, однако это считается, как правило, неспецифическим признаком при отсутствии у пациента структурных поражений сердца или при использовании строгого протокола. Подавление неустойчивой аритмии в качестве конечной точки терапии не рассматривается как валидное.
Вопрос об использовании факта неиндуцируемости при основном электрофизиологическом тестировании для прогнозирования риска и применению рекомендаций по долгосрочному ведению также остается нерешенным. В прошлом мнения до крайности менялись: сначала пациентов с потенциально высоким риском без индуцируемости желудочковых аритмий считали электрофизиологически стабильными, которым не нужна длительная антиаритмическая терапия, потом пришли к мнению, что такие пациенты находятся в категории риска, но этот метод не является конечной целью лечения, поэтому следует использовать другие способы. В настоящее время принято следующее: выжившие после остановки сердца без четкой идентификации преходящих и излечимых факторов считают пациентами высокого риска независимо от индуцируемости ЖТ. Некоторые внебольничные остановки сердца могут быть результатом преходящей ишемии, поэтому для этих пациентов будет полезна антиишемическая терапия.
в) Стратегии хирургического вмешательства при лечении аритмий с профилактикой внезапной остановки сердца. Ранее популярные хирургические методы лечения аритмий в настоящее время имеют ограниченное применение. Методы криоаблации с картированием могут быть использованы у пациентов с гемодинамически стабильной индуцибельной устойчивой мономорфпой ЖТ во время ЭФИ при условии соответствующей анатомии желудочка и КА, поддающейся катетерной аблации. Однако эти методы применяют у выживших после внеболышчной остановки сердца нечасто, в зависимости от вида аритмии, развившейся после остановки сердца.
Хирургический подход может быть использован в качестве дополнительной терапии при установке ИКД, если для устранения аритмии нужны частые разряды. Процедуры коронарной реваскуляризации играют определенную роль у выживших после остановки сердца в случае ишемического генеза и наличия соответствующей анатомии для хирургического лечения.
г) Лечение с помощью катетерной аблации. Метод катетерной аблации для лечения желудочковых тахиаритмий наиболее успешен при доброкачественных фокальных тахикардиях, местом происхождения которых является ПЖ или левая сторона МЖП, а также при некоторых ЖТ с механизмом re-entry.
За редкими исключением, катетернкю абляцию не используют для лечения желудочковых тахиаритмий у пациентов высокого риска или пациентов с увеличенным аритмогенным риском. Для ЖТ, связанной с механизмом re-entry по ножке пучка Гиса при КМП, а также других структурных поражений сердца, аблация правой ножки пучка Гиса для прерывания контура может быть успешной.
Однако у большого количества пациентов со структурными поражениями сердца и риском ВСС или у выживших после остановки сердца такое вмешательство ограничено. Тем не менее катетерная аблация служит дополнительным методом лечения пациентов с ИКД, перенесших несколько тахиаритмических событий.
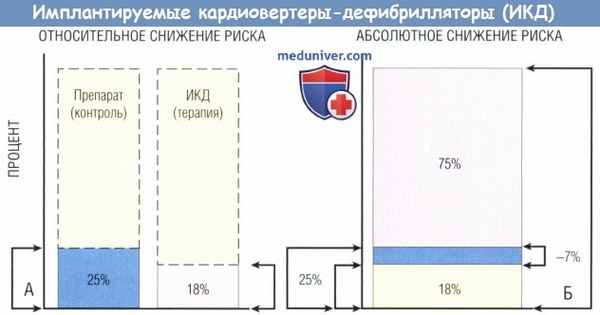
Относительный и абсолютный успех применения имплантируемых кардиовертеров-дефибрилляторов (ИКД) в исследовании AVID (Antiarrhythmics Versus Implantable Defibrilators).
(А) В подгруппе ИКД-терапии смертность за 2 года составила 18% vs 25% в подгруппе, получавшей ААП, 27% относительного снижения фатальных событий в популяции.
(Б) Когда относительное снижение экстраполируют на общую численность населения, абсолютное снижение фатальных событий в общей популяции составляет 7%.
Более 16 лет прошло с момента первого клинического использования ИКД и публикации результатов первых крупномасштабных рандомизированных клинических сравнительных исследований по ИКД-терапии и лечения ААП. В течение этого периода отчеты зафиксировали способность имплантируемых устройств устранять потенциально фатальные аритмии, но не выявили значимых относительных или абсолютных преимуществ ИКД, поскольку оставалась возможной смерть от сопутствующих факторов; кроме того, определение соответствующего разряда ИКД для прекращения события могло быть фатальным. Тем не менее, значение ИКД-терапии растет по сравнению с другими формами лечения пациентов после внебольничной остановки сердца и, в меньшей степени, тех, кто на основе конкретных клинических маркеров имеет высокий риск развития первичной остановки сердца.
После публикации результатов исследования MADIT стала доступна информация об относительных преимуществах дефибрилляторов но сравнению с терапией ААП (в основном амиодароном) для первичной профилактики ВСС в популяции очень высокого риска (рис. 36-24; табл. 36-5). Результаты показали уменьшение на 59% относительного риска ОС (в итоге 54%) и на 19% абсолютного риска смерти в течение последующих 2 лет наблюдения. Через год были опубликованы данные первого важного исследования AVID по вторичной профилактике с помощью ИКД по сравнению с ААП. Это исследование показало уменьшение на 27% относительного риска ОС в течение 2 лет наблюдения и снижение абсолютного риска на 7%. Результаты исследования AVID были опубликованы вскоре после анализа двух других исследований CIDS (Canadian Implantable Defibrillator Study) и CAS (Cardiac Arrest Study Hamburg).
Эти исследования были ограничены количеством исследуемых, но продемонстрировали апалогичную тенденцию. Итогом проведенных исследований по вторичной профилактике стал вывод о предпочтении ИКД-терапии у лиц с внебольничной остановкой сердца или гемодинамически значимой ЖТ. Анализ подгрупп в исследовании AVID позволил предположить, что успех ограничивается пациентами с ФВ < 35%; в случае более высокой ФВ результаты применения амиодарона или ИКД могут быть равнозначными.
В исследованиях были задокументированы способность имплантируемых устройств устранять потенциально фатальные аритмии и относительное преимущество ИКД-терапии по сравнению с амиодароном у некоторых групп пациентов. Отсутствие плацебо-контролируемых клинических испытаний по-прежнему препятствует количественному определению пользы относительно уровня смертности из-за неспособности определить положительные стороны вмешательства.
Несмотря на эти ограничения, ИКД-терапия в настоящее время является предпочтительным методом лечения для лиц, выживших после остановки сердца, при риске рецидивов и для первичной профилактики у пациентов с высоким риском. Основные вопросы, включая относительную пользу амиодарона по сравнению с дефибрилляторами у пациентов более низкого риска, выживших после внебольничной остановки сердца, роль β-АБ и ангиишемической хирургической и лекарственной терапии в качестве окончательных подходов, все еще не имеют ответа.
Но гораздо более значимой проблемой является использование имплантируемых дефибрилляторов для первичной профилактики остановки сердца у пациентов с промежуточным уровнем риска. Для решения этой проблемы необходимы исследования эффективности финансовых затрат помимо эффективности лечения.
Читайте также:
