Окклюзия печеночной артерии
Добавил пользователь Валентин П. Обновлено: 27.01.2026
Маскин С.С., Александров В.В., Матюхин В.В., Ермолаева Н.К.
Федеральное государственное бюджетное образовательное учреждение высшего образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации, г. Волгоград, Россия
ЗАКРЫТЫЕ ПОВРЕЖДЕНИЯ ПЕЧЕНИ: АЛГОРИТМ ДЕЙСТВИЙ ХИРУРГА В УСЛОВИЯХ ТРАВМОЦЕНТРА I УРОВНЯ
При ЗТЖ консервативному лечению подлежат пострадавшие с внутриорганными (I I AAST) и небольшими субкапсулярными (I AAST) ненапряженными стабильными гематомами печени (отсутствие в них турбулентного кровотока при УЗДГ или отсутствие экстравазации контрастного вещества в паренхиму органа на КТ-ангиографии) [7, 21], если нет распространения центральной гематомы под капсулу органа и увеличения размеров органа [7, 8, 12].
Согласно рекомендациям Всемирного общества неотложной хирургии (World Society of Emergency Surgery), гемодинамически стабильные пациенты с закрытой ТП и отсутствием других абдоминальных повреждений, требующих операции, должны пройти попытку неоперативного ведения независимо от степени травмы (A2) [ 4].
При отрицательной динамике по данным УЗИ/КТ показано использование ультразвуковой допплерографии и ангиографии, последняя позволяет осуществить эндоваскулярный гемостаз [5, 9, 10, 22].
Рентгеноэндоваскулярную окклюзию ветвей печеночной артерии проводят трансфеморальным или трансаксиллярным доступом, катетер подводят к источнику кровотечения и осуществляют редукцию кровотока введением в просвет сосуда эмболов, часто дополняют введением в афферентный сосуд окклюзирующей спиралиилипериферической заглушки [3, 5, 10, 12] .
Показания к эндоваскулярной эмболизации (ЭЭ):
1. КТ-признаки продолжающегося кровотечения при отсутствии геморрагического шока (А2) [4, 5, 22].
2. Сохраняющаяся гипотония после тампонады/пакетирования [ 4, 9, 14].
3. Посттравматическая ложная аневризма печеночной артерии и ее ветвей [ 4, 7], артерио-венозная фистула или их сочетание. ЭЭ ветвей печеночной артерии в 80 % случаев позволяет избежать повторных хирургических вмешательств [3, 10].
4. Нестабильные гематомы [5, 7] , внутрипеченочные гематомы, осложненные гемобилией [3]. Ермолов А.С. и др. [7] считают показанием к ангиографии и эндоваскулярному гемостазу наличие кровотока в гематоме. Отсутствие допплеровских признаков кровотока и клиники артериобилиарного свища, небольшие размеры гематомы дают возможность выполнить ее пункцию под ультразвуковым контролем; при гематомах более 5 см показано наружное дренирование [7, 21].
В систематическом обзоре 459 публикаций, проведенном Green C.S. et al. [10] из MEDLINE, SCOPUS и Cochrane Library, показана общая эффективность ангиоэмболизации при ТП 93 %.
При наличии признаков продолжающегося интраабдоминального кровотечения у гемодинамически нестабильных пациентов с закрытой травмой печени и отсутствии других причин для шока показана экстренная операция (А2) [4, 6-8, 22].
Лапароскопические операции с низкой вероятностью конверсии выполняются у пострадавших при гемоперитонеуме до 500 мл и отсутствии признаков продолжающегося интенсивного внутрибрюшного кровотечения и шока [7, 9] , при ТП I-II ст. тяжести [5, 9, 22] .
Показаниями к лапаротомии служат: объем гемоперитонеума более 500 мл при нестабильной гемодинамике [7, 8] ; продолжающееся интраабдоминальное кровотечение, когда эндовидеохирургический или эндоваскулярный гемостаз технически невозможен/неэффективен [7]; отсутствие визуализации источника продолжающегося кровотечения [9, 12, 21, 22].
Для остановки кровотечения широко используются физические средства (табл.).
Таблица. Преимущества и недостатки некоторых физических методов гемостаза
Преимущества
Точное рассечение ткани
Минимальное распространение тепла
Длины световых волн с тканевой селективностью
Дороговизна аппарата и расходных материалов
Необходимость обучения и сертификации
При лапароскопическом использовании уменьшается визуализация из-за дымообразования
Риск повреждения соседних органов и тканей при долгой экспозиции
При использовании необходима защита глаз
При сильном кровотечении уменьшается коагулирующий эффект
Уменьшение распространения тепла
Исключение ожога тканей и прохождения тока через пациента
Не требуется нейтральный электрод
Высокая стоимость аппарата и расходных материалов
Ограничение сосудами 2-3 мм или меньше – низкая прочность на более крупных сосудах [1, 9]
Пользовательские (технические) ограничения
Относительная медленность работы
Удобство применения в тканях
Большой опыт использования
Ограничение сосудами 2 мм или меньше
Искрение, прилипание, нагар
Боковое термическое повреждение
Инструменты создают небольшое давление, не деформируя коллаген сосудистой стенки
При лапароскопическом использовании из-за дымообразования уменьшается визуализация [8]
Меньший риск дополнительных электроповреждений
Значительный опыт использования в хирургии
Не требуется нейтрального электрода
Коагулирует сосуды диаметром до 2 мм – на более крупных сосудах прочность коагулята непредсказуема
Используется при небольших (до 2 см) поверхностных повреждениях [7]
Часто требуются повторные аппликации
Боковое распространение тепла
Коагуляционный некроз глубиной около 5 мм с возможным его отслоением и развитием повторного кровотечения; грубый рубец и выраженный спаечный процесс
Гомогенная термокоагуляция сосудов d до 7 мм
Отсутствие карбонизации тканей
Минимальное воздействие в латеральных направлениях
Быстрая и безопасная коагуляция и диссекция
Нет образования аэрозолей
Хороший обзор зоны операции [8]
Максимальная глубина коагуляции 3 мм
Меньшее закисление тканей (способствует скорейшему заживлению)
Невозможно остановить кровотечение из крупной артерии
Нет технической возможности локального воздействия на сосуд
Потребность в охлаждении плазмотрона проточной водой с высокой степенью очистки, электропитании от сети 380 В, заправке баллонов дефицитным аргоном [7,8]
На базе кафедры госпитальной хирургии ВолгГМУ изучена возможность использования локального криогемостаза при повреждениях печени и селезенки [1] за счет отека тканей, сдавления мелких сосудов, внутрисосудистого стаза форменных элементов крови с тромбообразованием. Криовоздействие при травме печени способствует ижелчестазу. При ТП криогемостаз показан в случае продолжающегося кровотечения из паренхимы, при сохранении магистрального кровотока и отсутствии необходимости резекции органа [1].
Большую известность получили и местные гемостатические материалы. Однако широкому внедрению в хирургию часто препятствует высокая стоимость. Их используют в сочетании с другими хирургическими мерами или тампонированием при венозном или умеренном паренхиматозном кровотечении (В1) [8, 9].
Широко для местного гемостаза стали использовать биополимеры коллагена и желатина. Гемостатическая коллагеновая губка применяется при капиллярных и паренхиматозных кровотечениях и противопоказана при повреждении крупных сосудов, вызывает рубцевание, обладает антигенной активностью, может способствовать инфицированию вирусами гепатита и ВИЧ [19]. Тромбокол-биокомпозиция коллагена с тромбоцитарной массой и антибактериальными средствами эффективна при капиллярно-паренхиматозных кровотечениях, в условиях гипокоагуляции и гиперфибринолиза.
Гемостатическое действие губки из желатина (Spongostan, Gelfoam, Гемасепт) связано с ее ячеистой структурой и абсорбцией на ней многократно превосходящих собственную массу количеств крови, разрушением клеток крови с высвобождением тромбопластина [15].
Кровоостанавливающее действие препаратов на основе целлюлозы ( Surgicel ) обусловлено способностью оксицеллюлозы вступать в химическую связь с гемоглобином. Целлюлоза также способствует формированию фибринового сгустка и активации тромбоцитов.
Часто используются препараты тиссукол и тахокомб. Основные компоненты клея – тиссукол-тромбин, фибриноген, фактор свертывания XIII – выделяются из донорской плазмы. При нанесении на раневую поверхность происходит его полимеризация и образуется эластичная фибриновая пленка белого цвета. В результате останавливаются диффузные кровотечения, склеиваются ткани, ускоряется заживление ран. Его использование требует согревания и смешивания компонентов перед нанесением, а также специального устройства для наложения на поврежденную поверхность [8, 9].
Тахокомб представлен коллагеновой пластиной, покрытой апротинином, фибриногеном, тромбином и рибофлавином. При контакте с раневой поверхностью тромбин превращает фибриноген в фибрин, и образуется фибриновый сгусток. Апротинин препятствует фибринолизу плазмином. Агрегация тромбоцитов стимулируется коллагеном. Обладает высокой адгезивной способностью, «склеивается» с раневой поверхностью за 3-5 минут. При профузном кровотечении он может «смываться» с раневой поверхности. Пластина плохо фиксируется на неровной раневой поверхности из-за ригидности коллагеновых волокон.
Препарат Quik Clot представляет собой пористый минеральный порошок, абсорбирущий воду, увеличивая концентрацию факторов свертывания крови и ускоряя образование тромба. Препарат Celox на основе хитозана обладает повышенной адгезией к форменным элементам крови и тканям, герметизирует кровоточащую рану и не приводит к развитию экзотермической реакции [9, 23].
При обнаружении разрывов в зоне прикрепления круглой связки печени, капсулы достаточен гемостаз электрокоагуляцией. При разрыве паренхимы печени глубиной более 2 см возможно использование гемостатической губки, Тахокомба (при умеренном кровотечении) или ушивание (при сильном кровотечении) с использованием эндохирургической техники или через мини-лапаротомный/лапаротомный доступы [20].
Подкапсульная гематома представлена флюктуирующим плоским образованием темного цвета под капсулой Глиссона. Если она стабильная, занимает менее 10 % поверхности, нет необходимости в ее ревизии. Диагностику дополняют интраоперационным ультразвуковым исследованием для определения кровотока в ней и наблюдением в последующие дни. При нестабильной подкапсульной гематоме любого размера или стабильной, занимающей более 10 % поверхности печени, напряженной гематоме капсула над ней должна быть вскрыта, кровотечение остановлено. Возможно укрытие декапсулированного участка печени сеткой Surgicel [22] .
Гематомы ворот печени необходимо тщательно осматривать для исключения повреждения магистральных сосудов и внепеченочных желчных протоков. Внутрипеченочную гематому трудно диагностировать даже интраоперационно. Если она стабильная, то подлежит консервативному лечению и динамическому наблюдению.
При абдоминальной травме универсальным доступом является верхне-средне-срединная лапаротомия [8, 20, 21, 24] . Если выявлено повреждение ретрогепатического отдела НПВ и печеночных вен, то возможно расширение разреза на правую половину грудной клетки в VII-VIII межреберье с диафрагмотомией [7, 9].
В момент лапаротомии кровотечение усиливается за счет снижения интраабдоминального давления. Анестезиолог старается стабилизировать гемодинамику, хирург выполняет временный гемостаз (В2) [4, 20], а ассистент эвакуирует кровь с использованием аппарата для реинфузии [7]. Если гипотония имеет критический характер (АДсист < 70 мм рт. ст.), а ревизия органов брюшной полости затруднена вследствие большого гемоперитонеума, целесообразно прижать кулаком или сосудистой вилкой аорту к позвоночнику сразу ниже диафрагмы продолжительностью до 20-30 мин [7, 24]. Прием позволяет стабилизировать состояние пациента, приостановить артериальное и паренхиматозное кровотечение и выиграть время для интенсивной терапии (С1) [9, 24].
Альтернативой данному приему может быть установка баллона-обтуратора (С2) через бедренную артерию под рентгенологическим контролем на уровень 1-й зоны брюшного отдела аорты [12, 16]. В клинике военно-полевой хирургии Военно-медицинской академии им. С.М. Кирова за 5 лет выполнены 22 эндоваскулярные баллонные окклюзии аорты [16]. Была получена достоверно большая выживаемость в первые 12 часов [16] при использовании данного метода.
При наличии интенсивного кровотечения из паренхимы печени, глубоких разрывах с повреждением сегментарных сосудов, ассистент выполняет бимануальную компрессию органа [8, 22], а хирург для временной остановки кровотечения и обнаружения поврежденных сосудов осуществляет прием Прингла, пережимая печеночно-двенадцатиперстную связку (ПДС) [9, 20, 22]. С целью уменьшения печеночной недостаточности следует:
1) пережимать ПДС не более 20 минут с 5-минутным восстановлением кровотока через 10 минут окклюзии, а при полной сосудистой изоляции печени – не более 10 минут [7];
2) переливать в момент устранения сдавления ПДС перфторан (20 мл/кг массы). При его отсутствии можно использовать изотонический раствор хлорида натрия (30 мл/кг) с реополиглюкином (15 мл/кг). Эффективно также введение глюкокортикоидов [7];
3) осуществлять медленное восстановление кровотока после данного приема.
Тактика ведения пациентов с закрытой травмой печени во многом обусловлена гемодинамическим статусом пациента. При его стабильности возможна попытка консервативного ведения, при необходимости дополненная эндоваскулярным гемостазом. При хирургическом лечении ТП и профузном кровотечении необходим быстрый временный гемостаз с последующим окончательным, где при показаниях к тактике damage control оптимальной является тампонада печени.
Информация о финансировании и конфликте интересов.
Исследование не имело спонсорской поддержки.
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Окклюзия печеночной артерии
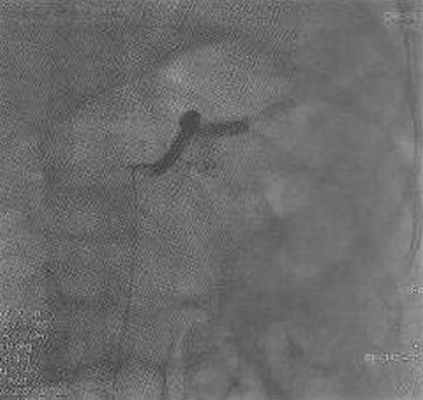
Рис. 6. Пациентка Е. 42 лет. Контрольная ангиография селезеночной артерии (после установки эмболизирующих спиралей). Окклюзия селезеночной артерии
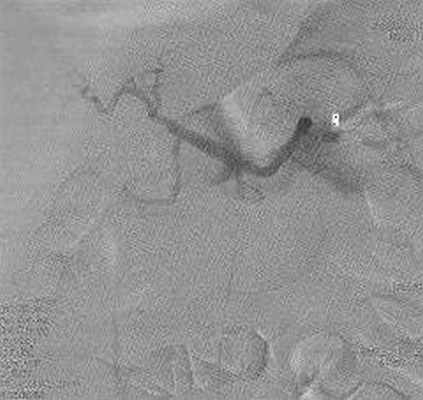
Рис. 7. Контрольная целиакография пациентки Е. 42 лет после установки эмболизирующих спиралей. Окклюзия селезеночной артерии с коллатеральным заполнением дистального русла. Контрастирование печеночной и желудочно-двенадцатиперстной артерий
Учитывая данные ЦДК, ангиографическую картину, ситуация расценена как SASS. Решено выполнить эмболизацию селезеночной артерии спиралями. В селезеночную артерию через катетер введены 3 эмболизационные спирали IMWCE "Cook" диаметром 8 мм, длиной 5 мм.
Две спирали установлены в области ворот селезенки, третья спираль фиксирована в среднем сегменте артерии (рис. 5).
При контрольной ангиографии селезеночной артерии кровоток по селезеночной артерии дистальнее спиралей не определяется (окклюзия ствола селезеночной артерии) (рис. 6).
При контрольной ангиографии чревного ствола визуализируется окклюзия селезеночной артерии, значительно усилился кровоток по печеночной артерии до уровня долевых ветвей, контрастируется a. gastroduodenalis (рис. 7). Определяется значительный сброс контраста в левую желудочную артерию.
* 13.12.10. - релапаротомия, декомпрессионное дренирование общего желчного протока по Холстеду в связи с подтеканием желчи между швами билиарного анастомоза.
На 5-е сут после эмболизации при УЗ-контроле отмечено появление гипоэхогенной зоны до 6 х 4 см в верхнем полюсе селезенки, которая увеличивается до 6 х 10 см к 14-м сут. На 11-е сут. - появление незначительного асцита. С 15-х сут. зафиксировано появление множественных гиподенсных зон по всей паренхиме селезенки (рис. 9).
Рис. 8. Пациентка Е. 42 лет. Собственная печеночная артерия после эмболизации селезеночной артерии. Повышение максимальной систолической скорости и снижение ИР
Рис. 9. Пациентка Е. 42 лет. Гипоэхогенная клиновидная зона - инфаркт селезенки (3-й сут после эмболизации)
22.12.10 на основании СКТ и УЗИ брюшной полости установлен диагноз инфаркта селезенки. С 19-х сут после эмболизации у пациентки начинается длительный период фебрильной лихорадки с периодическими ознобами. Проводится массивная антибактериальная терапия - цефотаксим, метрогил, ванкомщин, еульперазон, меронем, тазоцин. Лабораторно отмечается лейкоцитоз, при этом печеночные ферменты и билирубин в норме, умеренный холестаз. Повышены уровни прокалъцитонина и С-реактивного белка, в посевах крови микроорганизмов не выявлено.
Период лихорадки продолжался в течение 3 нед. с тенденцией к постепенному снижению температуры. На 33-и сут отменены все антибактериальные препараты, температура постепенно нормализуется.
При контрольной СКТ брюшной полости 11.01.11 селезенка увеличена в объеме (максимальные размеры 171 х 93 х 186 мм), отмечается увеличение площади гиподенсных очагов и уменьшение объема неизмененной паренхимы. Свободной жидкости в брюшной полости нет.
Рис. 10. Пациентка Е. 42 лет. Собственная печеночная артерия, режим ЦДК (1 мес. после эмболизации селезеночной артерии)
Пациентка выписана из клиники 19.01.11 в удовлетворительном состоянии с нормальной температурой тела. Наблюдается в амбулаторном центре трансплантации органов ФГУ "ПОМЦ ФМБА России" по настоящее время. Используется двухкомпонентная схема иммуносупрессии: такролимус + микофенолаты. При контрольном УЗ-исследовании 02.02.11: размер трансплантата - правая доля 138 мм, левая доля 68 мм, паренхима однородная. Диаметр воротной вены (ВВ) - 11 мм, скорость кровотока по ВВ - 0,22 м/с. ПА - 6 мм, скорость кровотока по ПА - 0,7 м/с, ИР - 0,68. Печеночные вены HV0 (рис. 10). Диаметр холедоха 7,2 мм. Селезенка 210 X 80 мм, зона разряжения после инфаркта - без динамики. Асцита нет. В биохимических анализах крови нормализовались уровень лейкоцитов, билирубин, печеночные ферменты. Сохраняется умеренный холестаз — щелочная фосфатаза 293 Ед./л, гамма-ГТП 59 Ед./л, С-реактивный белок 29 ме/л.
Клинический пример № 3
Пациент К. 33 лет поступил в отделение трансплантации ФГУ "ПОМЦ ФМБА России" для выполнения ортотопической трансплантации печени по поводу цирроза печени смешанной этиологии (HCV + токсической), класса С по Чайлд-Пъю, в стадии декомпенсации, портальной гипертензии, варикозного расширения вен пищевода III ст., спленомегалии, гиперспленизма, асцита в анамнезе.
В октябре 2010 г. начата противовирусная терапия гепатита С короткими интерферонами. С ноября 2010 г. РНК вируса гепатита С в крови не определяется.
13.01.11 выполнена операция - ортотопическая трансплантация печени от трупного донора. Ход операции — без особенностей. Размеры селезенки — 20 см в длиннике.
Динамика лабораторных и инструментальных показателей пациента К. 33 лет
| Дата | 14.01.11 | 15.01.11 | 16.01.11 | 17.01.11 | 20.01.11. | 27.01.11 | 04.02.11 |
| V ВВ, м/с | 0,7 | 0,6 | 0,45 | 0,4 | 0,4 | 0,3 | 0,35 |
| V ПА, м/с | 0,3 | 0,3 | 0,65 | 0,45 | 0,69 | 0,5 | 0,42 |
| Селезенка, мм | 160/50 | 170/80 | 180/50 | 200/50 | 180/78 | 210/78 | 210/83 |
| V СА, м/с | 0,5 | 0,65 | 0,65 | 0,65 | 0,65 | 0,65 | 0,65 |
| ACT, Ед./л | 462 | 1220 | 316 | 128 | 69 | 13 | 15 |
| АЛТ, Ед./л | 275 | 560 | 323 | 190 | 127 | 12 | 9 |
| ЛДГ, Ед./л | 961 | 3296 | 1491 | 1514 | 1334 | 735 | 753 |
Лабораторно с первых суток после эмболизации отмечено постепенное снижение печеночных ферментов и полная их нормализация на 7-е сут. На 3-й сут после рентгенэндохирургического вмешательства при УЗИ-контроле зафиксировано появление гипоэхогенной зоны в нижнем полюсе селезенки с тенденцией к увеличению количества и размеров гипоэхогенных участков, асцит. На 12-е сут. начинается длительный период лихорадки до 37,8 °С в вечерние часы, проводилось консервативное лечение. Пациент выписан из клиники 18.02.11 в удовлетворительном состоянии при нормализации температуры тела. Наблюдается в амбулаторном центре трансплантации органов ФГУ "ПОМЦ ФМБА России" по настоящее время. Ведется на духкомпонентной схеме иммуносупрессии — циклоспорин + микофенолаты.
Связь развития синдрома обкрадывания селезеночной артерией с качеством трансплантированных органов не была прослежена. Во всех случаях МОЗ на основании смерти мозга у доноров со стабильной гемодинамикой, приемлемой лабораторной картиной. При гистологическом исследовании донорской печени (протокол клиники) жировой гепатоз не превышал 10%. Во всех случаях операция трансплантации печени выполнена по единой методике: кавакавальный анастомоз "конец в бок" с боковым отжатием НПВ реципиента без вено-венозного обхода, портальный и артериальный анастомозы "конец в конец" непрерывным швом, холедохохоледохоанастомоз "конец в конец" без наружного дренирования желчных протоков. Сопоставимы были длительность операции (220-240 мин), время агепатического периода (40 мин) и тепловой ишемии. Время холодовой ишемии во всех случаях не превышало 8 ч.
Достоверными критериями диагностики SASS, по нашим наблюдениям, являются:
- Нарастание уровня трансаминаз и ЛДГ с/без нарастанием цифр билирубина.
- Неуклонное увеличение скорости кровотока по воротной вене.
- Уменьшение, вплоть до исчезновения, скорости кровотока по печеночной артерии с/без нарастанием индекса резистентности.
Относительным признаком можно считать сохраняющийся размер селезенки в послеоперационном периоде.
В наших случаях ведущим методом первичной диагностики SASS была ультразвуковая доплерография. При подозрении на развивающийся синдром обкрадывания единственным методом окончательной верификации диагноза является целиакография, малоинвазивный и безопасный метод, даже на ранних сроках послеоперационного периода при сохраняющихся коагуляционных нарушениях. При подтверждении синдрома обкрадывания селезеночной артерией нам представляется оправданной тактика поэтапной эмболизации сегментарных ветвей селезеночной артерии, начиная от верхнего полюса, с оценкой изменений в печеночном кровотоке. Дискутабельным остается вопрос о целесообразности и показаниях к интраоперационной перевязке селезеночной артерии.
Полученный нами опыт свидетельствует о необходимости иметь в арсенале центров, занимающихся трансплантацией печени, возможность экстренной ангиографической диагностики и интервенционной коррекции возникающих нарушений.
Синдром обкрадывания селезеночной артерией после ортотопической трансплантации печени является грозным и потенциально опасным осложнением, поэтому актуально дальнейшее накопление и систематизация опыта диагностики и лечения этого патологического состояния.
Аневризма печеночной артерии
Аневризма печеночной артерии - патологическое расширение печеночной артерии, занимает четвертое место среди всех аневризм внутренних органов. Опасность представляют осложнения аневризмы - разрыв или тромбоз.
Печеночная аневризма может располагаться вне печени в ее воротах, либо внутри печени в ветвях собственной печеночной артерии. Аневризма печеночной артерии может долгое время никак себя не проявлять, но ее осложнения имеют очень высокий риск летального исхода от внутрибрюшного или кишечного кровотечения.
Чаще всего аневризма печеночной артерии бывает случайной находкой при обследовании органов брюшной полости по другому поводу. Аневризму могут выявить при УЗИ органов брюшной полости или компьютерной томографии.
Причины аневризмы печеночной артерии
Самой частой причиной развития печеночной аневризмы являются травмы печени, нетравматические аневризмы могут вызываться системными воспалительными заболеваниями, желчекаменная болезнь и холангит. Одной из возможных причин является атеросклероз с дегенерацией сосудистой стенки печеночной артерии.
Ранения и разрывы печени являются одной из самых частых причин внутрипеченочной аневризмы. Причем аневризма может развиться через любое время после перенесенной травмы. Так как болезнь проявляется только при осложнениях, диагностика бывает либо случайной, либо запоздалой.
Жалобы и симптомы
Неосложненное течение аневризмы может не вызывать никаких жалоб и тогда диагноз становится случайной находкой. При выслушивании живота можно определить в проекции печени систолический шум. Аневризмы больших размеров могут вызвать сдавление желчных протоков и механическую желтуху. При больших аневризмах может ощущаться боль в правом подреберье, такие образования могут прощупываться при обычной пальпации живота, как пульсирующая опухоль.
Осложнения печеночной аневризмы
При осложнении аневризмы прорывом в желчные пути может развиться клиника желудочно-кишечного кровотечения - рвота с кровью, черный стул. При разрыве аневризмы печеночной артерии в свободную брюшную полость развивается клиника профузного внутреннего кровотечения с холодным липким потом, слабостью, учащением пульса.
При образовании артерио-венозного свища между аневризмой и воротной веной развивается картина портальной гипертензии с характерными кровотечениями из варикозно-расширенных вен пищевода.
Спасти пациента с разорвашейся аневризмой или желудочно-кишечным кровотечением на фоне прорыва аневризмы в желчные пути очень сложно. Поэтому, если при случайном обследовании выявляется аневризма печеночной артерии - необходима срочная консультация сосудистого хирурга.
Прогноз при аневризме печеночной артерии
Заболевание протекает скрыто и часто проявляется только при развитии осложнений. При осложнениях кровотечением в брюшную полость или желчные пути прогноз очень сомнительный. Только своевременное и быстрое вмешательство у подготовленных специалистов позволяет рассчитывать на успех и выживание пациента.
В силу такой опасности, аневризмы печеночных артерий должны оперироваться в ближайшее время после выявления заболевания. После эндоваскулярного лечения или открытой операции риски разрыва аневризмы устраняются и пациент выздоравливает.
Окклюзия печеночной артерии
Из-за двойного кровоснабжения печени инфаркт печени, вызванный окклюзией печеночной артерии, встречается редко. Окклюзия печеночной артерии может быть вызвана атеросклерозом, эмболией, тромбозом, васкулитом или гипотензивным шоком, и иногда тромбоз печеночной артерии может возникнуть после беременности или оральных контрацептивов. Заболевание быстро начинается, и состояние опасно. Если диагноз и лечение не ранние, смертность высока. Окклюзия печеночной артерии встречается крайне редко, и заболевание редко диагностируется перед смертью.
Базовые знания
Доля заболеваний: 0,001%
Восприимчивые люди: хорошо для людей среднего и пожилого возраста
Режим заражения: неинфекционный
Осложнения: паралитическая кишечная непроходимость
патогенный микроорганизм
Причиной окклюзии печеночной артерии
Окклюзия печеночной артерии может быть вызвана эмболией, тромбозом, наружным сжатием, утолщением стенки кровеносных сосудов и ятрогенными факторами, узелковым полиартериитом, эмболией подострого эндокардита, воспалением, инфильтрацией опухоли и печени Тромбоз в артериях, внешняя инвазия и компрессия злокачественных опухолей, утолщение стенки сосуда во время артериосклероза, разрушение интимы, гиперплазия или выделение, вторичный тромбоз и непреднамеренное перевязывание во время операции могут вызвать печень Окклюзия артерий, в последние годы, с популяризацией интервенционных методов, в катетеризации или интервенционной эмболизации, эмболия печеночной артерии имеет тенденцию к росту, поэтому строгий выбор показаний, строгие правила технической операции, чтобы минимизировать несчастные случаи и неблагоприятные последствия ,
Следствием окклюзии печеночной артерии является инфаркт печени. Если одновременно происходит обструкция воротной вены, она часто приводит к летальному исходу. Смертность при окклюзии печеночной артерии в нормальной печени выше, чем у пациентов с циррозом печени. Размер инфаркта печени зависит от категории циркуляции коллатеральной артерии. Центральная часть бледная и окружена кровавым кровоизлиянием: в центральной области наблюдается большое количество некроза гепатоцитов, хотя вокруг имеется некроз гепатоцитов, но нет значительных изменений в области портала, а клетки печени в области инфаркта являются беспорядочными и нерегулярными.
профилактика
Профилактика закупорки печеночной артерии
Не существует эффективных профилактических мер для этого заболевания, и это наиболее эффективная профилактическая и лечебная мера для активного лечения основного заболевания. Как только заболевание возникает, его нужно активно спасать и обязательно отдыхать в постели, чтобы обеспечить питание.
усложнение
Осложнения печеночной артерии Осложнения паралитического кишечника
Пациенты часто имеют паралитическую кишечную непроходимость, олигурию, азотемию, кому и умирают в течение короткого периода времени. Можно наблюдать одновременную или последовательную эмболизацию нескольких органов артерий.
симптом
Симптомы окклюзии печеночной артерии Общие симптомы Бледная бледная боль, желтуха, падение артериального давления, отсутствие паралича кишечника, нервная кома, олигурия, почечная ишемия
В большинстве случаев пациенты среднего и пожилого возраста, внезапное начало, внезапная боль в правом верхнем квадранте, потливость, бледность, учащенный пульс, кровяное давление, боль в печени и чихание, мышечное напряжение, желтуха, быстро углубляющаяся с лихорадкой, нарушение функции печени Протромбиновое время резко увеличивается, и лечение без витамина К может быть восстановлено, часто сопровождается параличом кишечника, олигурией, шоком и комой и вскоре умирает. Если пациент проходит острую фазу, следует обратить внимание на висцеральную функцию каждой системы. Изменения и соответствующие симптомы и признаки, такие как спленомегалия, отек поджелудочной железы, кишечные ишемические проявления, почечная ишемия, вызванная олигурией, отсутствие мочи или уремии.
исследовать
Окклюзия печеночной артерии
1. Количество лейкоцитов в крови увеличивается.
2. Тест функции печени Аланин аминотрансфераза, аспартатаминотрансфераза значительно увеличилась.
3. Протромбиновое время значительно продлевается, но не витамин К может быть восстановлен.
4, ультразвуковое исследование Допплера можно увидеть в прерывании кровотока печеночной артерии, может быть побочная компенсация, но редко, может быть разжижение в паренхиме печени, КТ можно увидеть в области концентрированной или разбросанной плотности паренхимы печени, целиакии ангиографии Диагноз является наиболее значимым: можно видеть, что печеночная артерия является усеченной или конической, и вокруг нее может быть коллатеральное образование.
диагностика
Диагностика и диагностика окклюзии печеночной артерии
диагностика
Заболевание является редким заболеванием, поэтому ему не хватает клинического описания.В дополнение к первичному заболеванию у пациента внезапно появляются внезапные боли в правой верхней части живота, сопровождающиеся коллапсом, кровяным давлением, болезненностью в правой верхней части живота и печени, напряжением мышц и углублением желтухи. Лихорадка, плохой дух.
Дифференциальный диагноз
Болезнь трудно диагностировать до рождения. Только на основании исходного заболевания, когда присутствуют вышеуказанные клинические проявления, заболевание может быть связано. Распространенными первичными заболеваниями являются клеточный эндокардит, узелковый полиартериит или сложные операции на верхней части живота. В связи с этим внезапное появление боли в животе следует дифференцировать от следующих заболеваний: 1. желчная колика, 2. острый живот, 3. острый перитонит.
Диагностическая и интервенционная радиология 2015
№01 2015
Эндопротезирование ложной аневризмы общей печеночной артерии №01 2015
Российский национальный исследовательский медицинский университет им. Н.И. Пирогова, кафедра хирургических болезней №1 педиатрического факультета, Москва, Россия 117997 Россия, г. Москва, ул. Островитянова, 1
Представлен клинический случай успешного эндоваскулярного лечения ложной аневризмы печеночной артерии (больной за полгода до операции переносил лапароскопическую гастрэктомию, холецистэктомию с лимфодиссекцией по поводу аденокарциномы желудка).
Материалы и методы: больной Е., 61 год. В анамнезе язвенная болезнь желудка 8 лет. В 2013 г. выявлена аденокарцинома тела желудка, T4N0M0, выполнена лапароскопическая гастрэктомия, холецистэктомия, лимфоаденодиссекция D2 (январь 2014 г.). Послеоперационный период осложнился тромбозом левой ветви воротной вены, наружным желчным свищем, поддиафрагмальным абсцессом слева, который был дренирован. При обследовании по данным КТ-ангиографии − аденома левого надпочечника и аневризма собственной печёночной артерии. При селективной артериографии аневризма общей печёночной артерии в средней порции размерами 10´20 мм. Лечение было двухэтапным. Первоначально были использованы спирали Azur -18, но попытка не увенчалась успехом – полость аневризмы не затромбировалась. Вторым этапом установлен стент-графт в печеночную артерию.
Результаты: имплантация выполнена без осложнений, аневризма выключена из кровотока. Пациент выписан в удовлетворительном состоянии, дополнительных оперативных вмешательств не требовалось. Через 3 месяца выполнена контрольная артериография, при которой выявлен тромбоз эндопротеза. Но при этом кровоснабжение печени осуществлялось через коллатеральные ветви.
Резюме:
Представлен клинический случай успешного эндоваскулярного лечения ложной аневризмы печеночной артерии (больной за полгода до операции переносил лапароскопическую гастрэктомию, холецистэктомию с лимфодиссекцией по поводу аденокарциномы желудка).
Материалы и методы: больной Е., 61 год. В анамнезе язвенная болезнь желудка 8 лет. В 2013 г. выявлена аденокарцинома тела желудка, T4N0M0, выполнена лапароскопическая гастрэктомия, холецистэктомия, лимфоаденодиссекция D2 (январь 2014 г.). Послеоперационный период осложнился тромбозом левой ветви воротной вены, наружным желчным свищем, поддиафрагмальным абсцессом слева, который был дренирован. При обследовании по данным КТ-ангиографии − аденома левого надпочечника и аневризма собственной печёночной артерии. При селективной артериографии аневризма общей печёночной артерии в средней порции размерами 10´20 мм. Лечение было двухэтапным. Первоначально были использованы спирали Azur -18, но попытка не увенчалась успехом – полость аневризмы не затромбировалась. Вторым этапом установлен стент-графт в печеночную артерию.
Результаты: имплантация выполнена без осложнений, аневризма выключена из кровотока. Пациент выписан в удовлетворительном состоянии, дополнительных оперативных вмешательств не требовалось. Через 3 месяца выполнена контрольная артериография, при которой выявлен тромбоз эндопротеза. Но при этом кровоснабжение печени осуществлялось через коллатеральные ветви.
Pseudoaneurysm of common hepatic artery: endovascular treatment
Shipovskiy V.N. – MD, PhD, professor
*Mamaeva D.A. – MD, postgraduate
N.I. Pirogov Russian National Research Medical University,
Chair of Surgical Diseases №1, of Pediatric Faculty, Moscow
1, Str. Ostrovityanova, Moscow, Russian Federation, 117997
ABSTRACT:
Case report of successful endovascular treatment of pseudoaneurysm of common hepatic artery (patient underwent laparoscopic gastrectomy, cholecystectomy with lymph node dissection in treatment of gastric adenocarcinoma) is presented.
Materials and methods: patient E., 61 year. In anamnesis: ulcer disease for the period of 8 years. In 2013, gastric adenocarcinoma T4N0M0 had been revealed and in january 2014 patient underwent laparoscopic gastrectomy, cholecystectomy with lymph node dissection D2. Post-operative period was complicated by thrombosis of left branch of portal vein, external biliary fistula, left subdiaphragmatic abscess with further drainage. During CT-angiography - adenoma of left adrenal gland and aneurysm of proper hepatic artery were revealed. Selective angiography revealed aneurysm of common hepatic artery in middle third, sized 10´20 mm. Patient underwent double-staged treatment. Primary patient underwent embolization of aneurysm with Azur-18 coils, but aneurysm cavity had incomplete thrombosis. As a second stage patient underwent stent-graft implantation in hepatic artery.
Results: stent implantation was uncomplicated, aneurysm was excluded from blood flow. Patient was discharged in good condition, without any additional operation. Control angiography was performed in 3 months and thrombosis of stent with collateral blood flow were revealed.
Введение
Ложные аневризмы висцеральных артерий – редкое заболевание, причиной которого чаще всего является ятрогенное (интраоперационное) повреждение артериальной стенки. В мировой и отечественной литературе описаны единичные примеры. При этом данное заболевание может осложниться массивной кровопотерей и привести к смерти пациента. В нашей практике ложная аневризма печеночной артерии выявлена впервые. Представляем вашему вниманию описание клинического случая.
Материалы и методы
Больной Е., 61 год, поступал в ГКБ № 57 г. Москвы в плановом порядке 15.05.2014. При поступлении жалоб не предъявлял. Из анамнеза страдает язвенной болезнью желудка 8 лет. В 2013 г. выявлена аденокарцинома тела желудка, T4N0M0, выполнена лапароскопическая гастрэктомия, холецистэктомия, лимфоаденодиссекция D2 (январь 2014 г.). Послеоперационный период осложнился тромбозом левой ветви воротной вены, наружным желчным свищем, поддиафрагмальным абсцессом слева, который был дренирован. При обследовании по данным КТ-ангиографии выявлена аденома левого надпочечника и аневризма собственной печеночной артерии. Госпитализирован для дообследования и решения вопроса об оперативном лечении. При УЗИ лоцировать аневризму печеночной артерии четко не удалось. В плановом порядке выполнена селективная артериография, при которой выявлена аневризма общей печеночной артерии в средней порции, 10´20 мм (рис. 1). Диагноз подтвержден при КТ с контрастированием. Пациенту было решено выполнить оперативно лече-ние – эмболизацию псевдоаневризмы. 29.05.2014 г. левым трансаксилярным доступом установлен интродьюсер 6F. Селективно в стволе чревного ствола установлен гайд-катетер 6JR. Суперселективно проводник 0,014” проведен в полость аневризмы. Установлены две спирали Azur-18 (Terumo), 0,4´4 см и 0,8´14 см. Через 20 мин. выполнена контрольная ангиография − тромбоз основной полости аневризмы на 90% (рис. 2). Послеоперационный период протекал без осложнений. Жалобы пациент не предъявлял. Учитывая широкую шейку аневризмы и возможность миграции спиралей от дальнейшей эмболизации решено отказаться.
С целью контроля остаточной полости псевдоаневризмы пациенту через 8 дней была выполнена повторная артериография. Выявлено, что аневризма в области шейки не тромбирована, спирали Azur -18 располо-жены вне зоны контрастирования псевдоаневризмы (рис. 3). Подтекания контрастного вещества за пределы аневризмы и артерии не выявлено. Ангиографическая картина расценена, как миграция спиралей Azur -18 из контрастированного сегмента аневризмы в тромботические массы псевдоаневризмы периартериального пространства. Было решено выполнить имплантацию стент-графта. Из левого трансаксилярного доступа установлен интродьюсер 6F. Селективно в чревный ствол установлен гайд-катетер 6JR. Проводник Asashi 0,014’’ проведен в дистальную порцию ветви печеночной артерии. По проводнику без технических проблем проведен стент-графт 4,0 ´18,0 мм (Boston Sientiphic) и раскрыт в зоне шейки аневризмы под давлением 8 атмосфер. Контрольная артериография: аневризма не контрастируется, затеков контрастного вещества не отмечается (рис. 4). Послеоперационный период протекал без осложнений. Больной выписан на 3 сутки в удовлетворительном состоянии. Через 3 мес. пациент повторно был госпитализирован для выполнения контрольной артериографии. Жалобы пациент не предъявлял. Выявлено, что общая печеночная артерия не контрастируется в проксимальной трети (2 см) – тромбоз стент-графта. Однако дистальные отделы печеночной артерии заполняются по коллатеральным ветвям (рис. 5).
В настоящий момент в мировой и отечественной литературе отсутствует большое количество наблюдений по ведению и лечению данной группы больных. Обычно рассматриваются висцеральные артерии органов брюшной полости в целом. Аневризмы печеночной артерии описываются редко. Превалируют статьи с одним или несколькими наблюдениями. Но прослеживается общая тенденция. Если в конце XX столетия Wagner W.H. с соавт. предлагают только открытые хирургические вмешательства, такие как лигирование общей печеночной артерии, акцентируя внимание на отсутствие некроза печени при перевязке печеночной артерии [1], то уже в 2001 г. выходят работы Hossain A. с соавт. и Kasirajan K. с соавт., которые описывают успешные случаи эндоваскулярного лечения (эмболизации) аневризм висцеральных артерий, и делают вывод о том, что эмболизация аневризм висцеральных артерий (в том числе печеночных) – это альтернативный метод лечения пациентов [2,3].
В 2002 г. Gabelmann A. с соавт. описывает хорошие отдаленные результаты эмболизации аневризм висцеральных артерий. Из 23 случаев (3 из которых аневризма печеночной артерии) за время наблюдения (42 мес.) был выявлен только 1 рецидив заболевания. Авторы считают эмболизацию аневризм методом выбора не зависимо от локализации, этиологии и клинических проявлений заболевания [4]. Grego F.G. с соавт. представляют результаты работы, в которой сравнивают отдаленные результаты открытых шунтирующих операций и эмболизации, и делают вывод, что при эндоваскулярном лечении снижается количество осложнений и рецидивов заболевания [5]. Garg A. с соавт. описывают успешный случай эмболизации с использованием клея [6]. Sakai Н. с соавт. впервые в 2004 г. описывают успешное эндопротезирование ложной аневризмы печеночной артерии у пациентки после трансплантации печени по поводу цирроза [7]. А Jenssen G.L. с соавт. в 2007 г. также результативно проводят эндоваскулярное лечение больной с ложными аневризмами чревного ствола и печеночной артерии с использованием стент-графта [8]. В настоящее время для диагностики повреждения печеночной артерии S. Abbara c соавт. рекомендуют компьютерную томографию с внутривенным введением контрастного вещества. Метод позволяет верифицировать ложную аневризму, ее локализацию, определить активность кровотечения в настоящий момент. Авторы акцентируют внимание на сроках формирования ложной аневризмы, псевдоаневризма может не выявляться при обследованиях сразу и формироваться в течение несколько дней, а возможно, и месяца. Предлагаются такие варианты лечения, как протезирование артерии, изолированное интраоперационное лигирование производится только по жизненным показаниям и при интактной воротной вене, успешно внедряется эмболизация ветвей печеночной артерии, расположенных внутрипеченочно [9].
Jecko V. с соавт. описали разрыв печеночной артерии после оперативного вмешательства по поводу люмбалгии, который привел к смерти пациентки [10], Fatic N. с соавт. выполнили успешное протезирование печеночной артерии после резекции желудка по Бильрот-II [11]. Asai K. с соавт. произвел эндопротезирование ложной аневризмы печеночной артерии после панкреато-дуоденальной резекции у больной по поводу холангиокарциномы [12]. Lü P.H., Zhang X.C., Wang L.F. описывают 8 случаев использования стент-графта для выключения ложной аневризмы печеночной артерии. У 6 из них осложнения в ближайшем послеоперационном периоде не наблюдались, у 1 больного – окклюзия печеночной артерии, у 1 пациента – вазоспазм и эндолик. Этим больным процедура дополнялась установкой спиралей в просвет артерии. Оценка результатов произведена через 14 мес., стенозы или тромбозы стентов не выявлены [13]. Суворова Ю.А. и соавт. считают рентгенэндоваскулярный гемостаз с помощью стент-графта методом выбора в лечении массивного послеоперационного кровотечения из магистральных артерий (в том числе общей печеночной), особенно у больных с высоким хирургическим риском. Описано 2 случая успешного эндопротезирования общей печеночной артерии [14]. Также описано успешное эндопротезирование аневризмы селезеночной артерии [15]. В сентябре 2014 г. на ежегодном конгрессе эндоваскулярных хирургов CIRSE в Глазго (Великобритания), Sundeep Punamia, был опубликован стендовый доклад, в котором автор описал возможность эмболизации псевдоаневризмы печеночной артерии из чрескожно чреспеченочного доступа. Эта методика предлагается при окклюзии общей печеночной артерии, когда нет возможности выполнить эмболизацию антеградным доступом [16]. В представленном клиническом наблюдении выполнена успешная имплантация стент-графта в печеночную артерию при ложной (посттравматической) аневризме с хорошим клиническим результатом. Ангиографические результаты эндопротезирования неоднозначны в данном случае. С одной стороны после успешной имплантации произошел его тромбоз в ближайшем послеоперационном периоде. С другой стороны тромбоз стент-графта не привел к нарушению кровоснабжения печени в бассейне общей печеночной артерии из-за развития хороших коллатеральных сосудов. В итоге полость псевдоаневризмы выключена из кровотока без дефицита кровоснабжения печени. Минимальная инвазивность операции основной положительный момент для данного пациента, так как альтернативой являлось протезирование печеночной артерии через лапаротомный доступ, что тяжело выполнимо с технической точки зрения и неблагоприятно для самого пациента в связи с выраженным рубцовым процессом в верхнем этаже брюшной полости. Выполненное стентирование позволило пациенту проводить дальнейшее лечение по онкопрограмме без риска для жизни со стороны сосудистых осложнений. Лечение ложной аневризмы печеночной артерии является редким малоизученным ятрогенным осложнением различных хирургических вмешательств и требует дальнейшего изучения.
Читайте также:
