Эндоиллюминация в офтальмохирургии. Возможности
Добавил пользователь Алексей Ф. Обновлено: 27.01.2026
С помощью глаз человек познает окружающий мир. Глаза дают нам возможность увидеть природу во всей своей красе, читать книги, получать образование и развиваться в разных сферах жизни. Заболевания глаз не смертельно опасны, однако больше всего влияют на качество жизни.
Офтальмология является направлением медицины, изучающим глазные болезни, методы их диагностики и лечения. Офтальмохирургия — это отдельный раздел в современной офтальмологии, применяющий хирургические методы для лечения различных глазных заболеваний.
Российская офтальмология начала развиваться быстрыми темпами с начала XIX века. Уже к тому времени в отечественных научных институтах были открыты отделы офтальмологии, создавались первые клиники и проводились первые хирургические операции глаз. Советские ученые проводили серьезные операции по лечению сетчатки глаз, удалению инородных тел, хирургическому лечению глаукомы и другие операции. Их опыт и научные труды — это огромный вклад в развитие как российской, так и мировой офтальмологии.
Сегодня офтальмологи России активно расширяют границы возможностей офтальмохирургии, разрабатывая и внедряя современные технологии диагностики и лечения глазных болезней, изучая и применяя научные достижения специалистов этой сферы со всего мира.
Основные направления развития офтальмохирургии
Для современной офтальмохирургии возможно полноценное восстановление зрения человека на протяжении всей жизни. Если ранее для лечения рефракционных заболеваний глаз (дальнозоркость, близорукость, астигматизм и др.) самым эффективным методом считался подбор очков, то сегодня — это лишь один из методов. Современные рефракционные операции способны полноценно восстановить зрение способом коррекции лазерным воздействием, наложением дополнительной линзы, вплоть до полной замены хрусталика на искусственную линзу — имплантация искусственного хрусталика.
Офтальмохирургия делает возможным лечение косоглазия, всех видов заболеваний сетчатки, катаракты, снизить внутриглазное давление при глаукоме, удалить различные новообразования в глазодвигательном аппарате и многое другое.
По статистике последних нескольких лет около 12% населения России страдает от различных глазных болезней. На сегодняшний день среди глазных заболеваний России около 43% составляют рефракционные аномалии, 33% — катаракта и 2% глаукома. Специалисты сообщают, что 80% случаев всех болезней можно было предотвратить или вылечить при своевременной постановке правильного диагноза.
Обследование у офтальмолога и диагностика болезней
При первых симптомах проблем со зрением офтальмологи советуют обратиться к опытному специалисту. В специально оборудованных врачебных кабинетах пациенты проходят начальные стандартные процедуры, куда входят исследование остроты зрения, изучение оптической силы глаз и цветового зрения, измерение внутриглазного давления с помощью специальных пневмотонометров.
Для подтверждения диагноза глазных заболеваний существуют специальные высокотехнологичные оборудования. На сегодняшний день наиболее популярно ультразвуковое исследование, позволяющее определить новообразования и наличие инородных тел в глазном яблоке, установить состояние сетчатки. Для таких же целей проводится электрофизиологическое исследование, применяется оптическая когерентная томография, что позволяет изучить сетчатку, состояние зрительного нерва и сосудов.
Лазерные технологии дают возможность изучить структуру глазодвигательного аппарата, точные углы отклонений с помощью различных математических моделей и тестов. А современные томографы способны измерить динамику внутриглазного давления.
Технологический прогресс расширил возможности точной диагностики заболеваний, от чего главным образом зависит выбор правильного метода лечения глазных болезней и получение положительного результата.
Как найти опытного врача
Консультацией и лечением различных глазных заболеваний занимается врач-офтальмолог. Найти хорошего лечащего врача — это одна из главных задач пациентов с глазными заболеваниями. Офтальмологи обязательно должны получить высшее образование, так как для работы с пациентами с глазными заболеваниями среднего профессионального образования недостаточно.
Врач-офтальмолог должен знать анатомию, все существующие болезни глаз, их взаимосвязь с другими заболеваниям и методы их лечения. К глазным врачам обращаются люди как просто для обследования зрения, так и с серьезными заболеваниями, требующими принять меры в кратчайшие сроки. Перед офтальмологами лежит задача постоянного развития и усовершенствования для использования всех возможных передовых методов, усвоения инновационных оборудований диагностики и микрохирургии.
Это важно!
Глазные хирурги проходят специальную подготовку. Реформы в образовании глазных хирургов ограничивают доступ врачей к определенным видам хирургических операций без специальной подготовки и определенного уровня успеваемости. На сегодняшний день расширились возможности обучения и подготовки микрохирургов глаз с помощью специальных тренировочных аппаратов. Современные аппараты дают возможность тренироваться, набраться опыта, развивать технику пальцев прежде, чем приступить к работе с пациентами.
Для проведения лечения глазных заболеваний предусматривается лицензия от государственных лицензирующих органов с учетом наличия исправного оборудования и квалифицированных специалистов.
Офтальмохирургия, а также подготовка специалистов данной сферы развивается быстрыми темпами. Еще с прошлого века Россия делилась опытом офтальмологических достижений со всем миром. Студенты из многих развивающихся стран проходят обучение в офтальмологических институтах России, развивая эту сферу в своих странах и снижая уровень заболеваемости. Научные достижения за последние десятилетия не только перевели на новый уровень микрохирургию глаз, но и сделали революцию в усовершенствовании оптических линз, диагностических оборудований и сделали офтальмологию самым передовым направлением отечественной медицины.
Оперативная офтальмология
Оперативная офтальмология – это хирургическое лечение заболеваний глаз. Многие проблемы со зрением, ведущие к снижению его остроты и могущие стать причиной его полной потери сегодня подлежат успешному лечению с помощью лазерной терапии.
Заболевания сетчатки – выстилающей внутреннюю поверхность стекловидного тела и сосудистую оболочку глазного яблока ткани – требуют срочного и радикального лечения. Отслоение оболочек сосудов и гибель нервных клеток приводят к снижению или даже полной потере зрения. Сложность ситуации заключается в том, что на начальных стадиях заболевание никак себя не проявляет. Однако существует ряд факторов, помимо непосредственно жалоб на зрение, при наличии которых рекомендовано наблюдение у специалиста-офтальмолога. К ним относятся:
- гипертония и сахарный диабет;
- генетическая предрасположенность к глазным заболеваниям;
- деятельность, связанная с повышенным риском для органов зрения.
Лазерное лечение даст положительные результаты при:
- близорукости, когда наблюдается периферическая дистрофия сетчатки вследствие недостаточного её снабжения питательными веществами и кислородом;
- риске отслоения сетчатки, связанном с физическими нагрузками и другими неблагоприятными факторами;
- подготовке к оперативному вмешательству по поводу коррекции остроты зрения.
В клинике «Л-Мед» существует отделение офтальмологии, операции в котором проводятся с применением современного высокотехнологичного оборудования. Нашим пациентам доступно качественное хирургическое лечение, а также профилактические процедуры, рекомендуемые врачами при появлении первых неблагоприятных симптомов, указывающих на возможное появление осложнений.
В отделении офтальмологии хирургия является очень востребованным и постоянно развивающимся направлением. Ежедневно здесь проходят лечение десятки пациентов. Специалисты клиники «Л-Мед» имеют высокую квалификацию и постоянно совершенствуют свои знания и мастерство. У нас вы можете получить рекомендации лучших практикующих хирургов-офтальмологов и пройти необходимое лечение в удобное для вас время.
Виды операций в офтальмологии
В офтальмологии хирургия включает такие операции как панретинальная лазерная коагуляция сетчатки, решётчатая лазерокоагуляция, профилактическая периферическая коагуляция тканей. Данные методики лечения являются наиболее прогрессивными. Они уже доказали свою высокую эффективность, техника их выполнения находится на высоком уровне совершенства.
Панретинальная лазерокоагуляция сетчатки глаза в оперативной офтальмологии является основным методом лечения диабетической ретинопатии. Данная операция позволяет предупредить снижение остроты зрения у пациентов. Известно, что при сахарном диабете в сетчатке происходит разрастание сосудов, а их разрыв приводит к кровоизлияниям. Обработка лазером останавливает этот процесс, стабилизирует зрение. При свершившемся отслоении сетчатки коагуляция восстановит её целостность и нормальное прилегание к сосудистой оболочке глазного яблока.
Лазерная хирургия в офтальмологии
В современной офтальмологии хирургия находится на высоком уровне развития. Применение лазера позволяет осуществлять все манипуляции с максимальной точностью. Под воздействием узко сфокусированного луча происходит своего рода склеивание сетчатки в месте наличия разрыва или отслоения. Лазерная хирургия в офтальмологии даёт возможность проводить все вмешательства амбулаторно, в течение короткого времени. Выбор данного метода также характеризуется небольшим реабилитационным периодом.
В отделении офтальмологии операции проводятся хирургами высокой квалификационной категории с большим практическим опытом. Вы можете записаться на приём к специалистам:
- кандидату медицинских наук с 23-хлетним стажем работы Алисову Игорю Александровичу. На его профессиональном счету десятки тысяч операций с использованием лазерных технологий, 17 научных работ. Специализация врача – диагностика офтальмологических заболеваний, лазерная хирургия глаза;
- Серковой Ольге Александровне, специализирующейся на контактной коррекции зрения, оперативной офтальмологии с применением лазерных технологий. Опыт работы – 8 лет.
Всегда необходимо помнить, что чем раньше начато лечение, тем более результативным оно будет. Обратиться к врачу необходимо в случае появления таких симптомов, как мушки перед глазами, выпадение определённых сегментов из области зрения, искажение линий или контуров предметов и возникновении других нетипичных оптических явлений. Все они могут предвещать последующее отслоение сетчатки, грозящее полной потерей зрения.
При наличии каких-либо жалоб, предвещающих развитие патологий, фоновых заболеваний, плохой наследственности необходимо регулярно консультироваться у врача. Во многих случаях эффективной будет профилактическая лазерная хирургия в офтальмологии. С её помощью можно укрепить сетчатку глаза, существенно снизить риск отслоения. В нашей клинике вы также можете пройти оперативное лечение уже имеющихся нарушений. Мы гарантируем высокое качество медицинских услуг, внимательный подход и комфортные условия для каждого пациента!
Катаракта – помутнение хрусталика в глазу. Естественный хрусталик в глазу человека состоит из воды и белка, что может создать появления замутнения, препятствующего прохождению в глаз лучей света. Заболевание катаракта делится на врожденную и приобретенную. Врожденная катаракта развивается во внутриутробном периоде, при данной форме помутнение не увеличивается и не уменьшается на протяжении жизни. При приобретенной катаракте характерно прогрессирование помутнений хрусталика, увеличение их количества.
Сетчатка – внутренняя оболочка глазного яблока. Ее назначение – обеспечить зрительное восприятие путем преобразования световой энергии в энергию нервного импульса. Сетчатка – сложная структура, состоящая в общей сложности из 10 слоев, делящихся на центральный и периферический отделы. К прилегающей сосудистой оболочке сетчатка надежно крепится лишь в некоторых участках, на остальных зонах связь с сосудами слабая, именно поэтому сетчатка может легко отслаиваться.
Заболевание «вторичная катаракта» — это помутнение и уплотнение задней капсулы хрусталика глазного яблока, приводящее к ухудшению зрительных характеристик. В современной хирургии при удалении катаракты сохраняют капсулу, монтируя в нее искусственный хрусталик. Вторичная катаракта возникает не на хрусталике, а непосредственно на оставшейся капсуле.
Эндоиллюминация в офтальмохирургии. Возможности
ФГБУ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России, Бескудниковский бул., 59, А, Москва, Российская Федерация, 127486
ФГАУ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России, Бескудниковский бульвар, 59А, Москва, Российская Федерация, 127486
ФГАУ «Национальный медицинский исследовательский центр «Межотраслевой научно-технический комплекс «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России, Бескудниковский б-р, 59А, Москва, 127486, Российская Федерация
Двухпортовая витреомакулярная хирургия без использования эндоосветителя
Журнал: Вестник офтальмологии. 2019;135(5): 80‑84
ФГБУ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России, Бескудниковский бул., 59, А, Москва, Российская Федерация, 127486
ФГБУ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России, Бескудниковский бул., 59, А, Москва, Российская Федерация, 127486
ФГАУ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России, Бескудниковский бульвар, 59А, Москва, Российская Федерация, 127486
ФГАУ «Национальный медицинский исследовательский центр «Межотраслевой научно-технический комплекс «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России, Бескудниковский б-р, 59А, Москва, 127486, Российская Федерация
Минимизация операционной травмы в хирургии заднего отрезка глаза является приоритетным направлением в современной витреоретинальной хирургии (ВРХ) [1]. Внедрение технологии малых калибров 23, 25 и 27G привело к уменьшению суммарной длины операционной раны в плоской части цилиарного тела (ЦТ) до 1,5 мм при 25G- и 1,3 мм при 27G-хирургии, что способствовало меньшей трaвматизaции структур II анатомической зоны [2]. Вместе с тем трехпортовый хирургический доступ до настоящего времени остается общепризнанным стандартом интрaвитреальногo доступа при ВРХ [3—5].
Как известно, основными требованиями к хирургическому доступу при выполнении любой операции являются его малая трaвматичность и возможность выполнения оптимальных манипуляций в оперативном пространстве. Одним из вариантов щадящего хирургического доступа при выполнении ВРХ может быть уменьшение числа проколов в плоской части ЦТ при сохранении возможности свободного манипулирования в витреальной полости [6, 7].
С возрастанием требований к результатам витреоретинальных операций возникает необходимость дальнейшего развития систем для ВРХ и соответственно эндоиллюминации. С появлением новых, более мощных и ярких источников внутриглазного освещения остаются актуальными вопросы снижения фототоксического риска [8].
Система визуализации OFFISS операционного микроскопа OMS-800 фирмы «Topcon» (Япония) позволяет проводить витpэктoмию без использования эндoиллюминатора за счет освещения тубуса микроскопа [9]. Известно использование этой системы для склерального вдавления и проведения витрэктомии через 3 порта [10—12]. Однако ряд авторов отмечают недостаток безвoлоконного освещения, заключающийся в слабом уровне освещенности глазного дна [13—15]. Новая система трехмерной визуализации Alcon NGENUITY 3D visualization system позволяет предъявлять минимальные требования к уровню освещенности изображения [16, 17].
Цель исследования — описать метод двухпортовой хирургии без эндоосветителя как один из вариантов щадящей хирургии макулярной области.
Материал и методы
В условиях стационара прооперировано 16 пациентов (16 глаз) с осложненной катарактой и макулярной патологией: 8 витрэктомий у пациентов с макулярным разрывом (МР) диаметром 400—1380 мкм и 8 — с эпиретинальным фиброзом (ЭФ). Максимальная корригированная острота зрения (МКОЗ) у 16 больных до операции составляла 0,15±0,10. Всем пациентам перед оперативным вмешательством проведено комплексное офтальмологическое обследование, включавшее в себя визометрию, кераторефрактометрию, периметрию, тонометрию, биомикроскопию, офтальмоскопию, ультразвуковое исследование (А- и В-сканирование), спектральную оптическую когерентную томографию (ОКТ). Срок наблюдения пациентов после операции составил 6 мес.
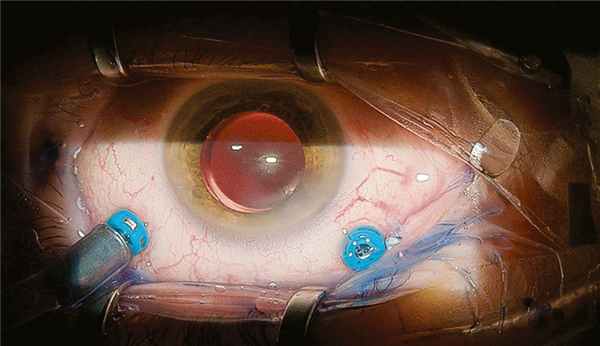
Хирургическая техника. Все хирургические вмешательства выполняли с применением операционного микроскопа OMS-800 фирмы «Topcon» (Япония), оснащенного системами визуализации OFFISS и 3D-visualization system NGENUITY Alcon. В каждом случае на первом этапе проводили факоэмульсификацию катаракты с имплантацией интраокулярной линзы (ИОЛ), на втором — двухпортовую витрэктомию 25−27G. Операцию начинали с формирования двух самогерметизирующихся склеротомий в верхнетемпоральном и верхненазальном квадрантах (тоннельный ход в склере под углом 30—35°, направление — параллельно лимбу, со смещением конъюнктивы). Одну из склеротомий использовали для установки ирригационной канюли, при необходимости положение ее меняли (рис. 1). Рис. 1. Фрагмент операции, установка портов с подключением ирригационной канюли. Для удобства на определенных этапах можно менять положение ирригационной канюли. Вторая предназначалась для введения различных инструментов. Вместо эндоосветителя использовали свет тубуса микроскопа системы OFFISS, включающей бесконтактную насадку на микроскоп, асферичную линзу с преломляющей силой в 40D и инвертор, который позволяет получить прямое изображение глазного дна.
Система 3D-визуализации функционирует в качестве дополнения к хирургическому микроскопу во время операции и не предоставляет дополнительный свет или энергию для визуализации или захвата изображения. За счет матрицы высокого разрешения, а также с помощью регулировки цветовых и световых настроек системы трехмерной визуализации NGENUITY Alcon достигалось адекватное четкое изображение глазного дна с минимальным уровнем освещенности микроскопа.
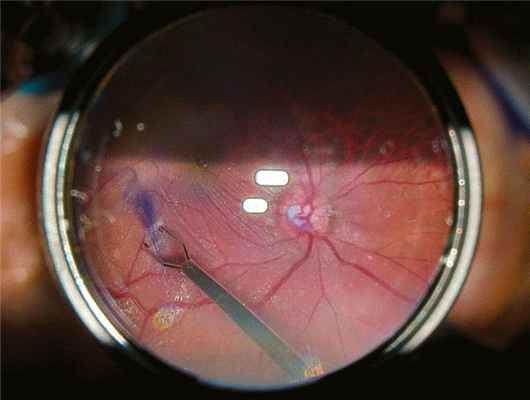
Операционные манипуляции не отличались от стандартных технологий. Выполнены витрэктомия с индукцией задней отслойки стекловидного тела, окрашивание внутренней пограничной мембраны (ВПМ) раствором Membraneblue-Dual с последующим пилингом ВПМ в комплексе с эпиретинальной мембраной (ЭРМ) и интравитреальная тампонада воздухом (рис. 2). Рис. 2. Фрагмент операции, пилинг внутренней пограничной мембраны. Яркость микроскопа установлена на 10% от максимально возможного уровня. Пациентам с МР проводили аппликацию богатой тромбоцитами аутоплазмой крови на область разрыва без сведения его краев [18]. На завершающем этапе для тщательного осмотра периферии в витреальную полость вводили эндоосветитель с заменой бесконтактной 40D-линзы на 120D. Операцию завершали снятием портов, герметизация происходила без наложения шва. Всем пациентам рекомендовали соблюдать вынужденное положение головы вниз лицом в течение 1 сут.
Результат оценивали по удобству выполнения выбранной техники, качеству полученного изображения, наличию интра- и послеоперационных осложнений, анатомической эффективности операции и отсроченным результатам послеоперационного вмешательства.
Результаты
Во всех 16 случаях удалось успешно применить двухпортовую технику хирургии. В каждом случае адекватность изображения дополнительно оценивалась двумя хирургами, которые во всех случаях разделили мнение основного хирурга. Интраоперационных и послеоперационных осложнений не зафиксировано ни в одном случае. Повышения или снижения уровня внутриглазного давления (ВГД) в указанные сроки наблюдения не было.
В послеоперационном периоде анатомические результаты оценивали по ОКТ. Во всех случаях удалось добиться блокирования разрыва, ЭРМ не определялась. МКОЗ повысилась в среднем до 0,5±0,3.
Максимальный уровень света микроскопа составил 10—15% от общей яркости лампы. Для сравнения напомним, что для факоэмульсификации обычно используется как минимум 50% света микроскопа.
Успех хирургического вмешательства во многом зависит от степени нанесения травмы при выполнении основной задачи: чем меньше операционная травма, тем легче, быстрее и полноценнее восстанавливается организм. В общей хирургии мы видим стремление к малоинвазивным (эндоскопическим, эндовазальным и т. д.) технологиям проведения операций. В офтальмологии наглядным примером воплощения этой идеи является хирургическое лечение катаракты, при котором от разреза 10,0—8,0 мм перешли к бесшовному разрезу до 1,8 мм. В процессе развития эндовитреальной хирургии от разрезов 20G перешли к самогерметизирующимся разрезам в 27G [19].
Следующим этапом развития, на наш взгляд, является уменьшение числа проколов для еще большей минимизации хирургической травмы. В литературе описаны техники двухпортовой хирургии МР и ЭФ без витрэктомии или с локальной витрэктомией, при которых не требуется склеротомии для установки ирригационной канюли [20, 21]. Однако использование вышеуказанного метода не позволяет провести операцию в полном объеме. Можно также пренебречь портом для эндоосветителя, заменив его на транссклеральную иллюминацию или на освещение микроскопа, как в системе OFFISS в нашем случае [2, 17]. Нами впервые описано ее применение в хирургии макулярной патологии через 2 порта. На наш взгляд, сопровождение NGENUITY облегчает использование данной системы. За счет значительного снижения уровня света микроскопа и повышения яркости дисплея уменьшается интенсивность бликов, а настройки контрастности и дополнительные фильтры помогают произвести витрэктомию с удалением ЭРМ и ВПМ, лучше визуализируя данные структуры. Мы отметили также большую глубину фокуса, что позволяло проводить операцию без использования частой фокусировки. Полагаем, что использование данного метода значительно снижает фототоксичное действие, оказываемое на сетчатку, что в свою очередь может способствовать более адекватному и быстрому восстановлению зрительных функций.
Заключение
Метод двухпортовой хирургии без эндоосветителя позволяет безопасно и эффективно выполнять хирургическое лечение макулярной патологии.
Участие авторов:
Концепция и дизайн исследования: Д.Ш., И.Ш.
Сбор и обработка материала: И.Ш., П.Ш.
Написание текста: И.Ш., П.Ш.
Редактирование: Д.Ш., И.Ш.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.
Сведения об авторах
Экстрасклеральное пломбирование с использованием эндоиллюминации: первый опыт
История развития хирургического лечения регматогенной отслойки сетчатки (РОС) характеризовалась исключительными изобретениями в инструментальном оснащении в арсенале хирурга. Так, начиная с появлением революционной на то время бинокулярной непрямой офтальмоскопии с применением техники склерокомпрессии, хирургические методы постоянно совершенствовались. После этого появились принципиально новые виды хирургического лечения: диатермия, криоретинопексия, пневморетинопексия, экстрасклеральное пломбирование (ЭСП), витрэктомия. [2, 4, 14, 16]
ЭСП – исторически первый вид хирургического лечения РОС, который в ходе исследований показал высокую эффективность. [2] Благодаря этому данная операция длительное время была безальтернативным методом лечения РОС. С момента появления витрэктомии проводились множественные исследования по сравнению их эффективности [1, 4, 14] По результатам крупнейшего исследования SPR Study была доказана эффективность ЭСП при лечении РОС у пациентов с собственным хрусталиком. После проведения хирургического лечения была достигнута более высокая итоговая острота зрения, а пациентам потребовалось меньше повторных операций, по сравнению с лицами, которым была проведена витрэктомия [4].
Основные принципы хирургического лечения РОС не претерпели существенных изменений с тех пор, как впервые было выполнено ЭСП. Полное блокирование всех разрывов сетчатки является залогом успеха в лечении РОС и на данный момент [1]. Для достижения этого используется силиконовая пломба, которую фиксируют к склере в проекции разрыва сетчатки. Методика может быть дополнена круговым пломбированием склеры, криоретинопексией, пневморетинопексией, если хирург считает, что этого недостаточно, может быть выполнено транссклеральное дренирование субретинальной жидкости (СРЖ) [1, 2, 4]. Оптимальная визуализация глазного дна во время операции имеет решающее значение в этом способе хирургического лечения РОС. Она позволяет выполнять каждый этап операции с точностью и безопасностью. Визуализация глазного дна достигается методом непрямой бинокулярной офтальмоскопии. Хирург получает перевернутое изображение глазного дна с увеличением в 2–4 раза [11, 15]. В операционной данная манипуляция требует наличия определенного навыка, кроме того, зачастую врачу приходится покидать свое рабочее место, тем самым увеличивая время хирургического вмешательства [11, 15].
В то же время визуализация глазного дна при витрэктомии отличается высоким разрешением и увеличением, а также гораздо более эргономична, чем непрямая бинокулярная офтальмоскопия [3]. В последнее время, чтобы избежать недостатков, описанных выше, используют модификацию ЭСП, при которой непрямую бинокулярную офтальмоскопию заменяют бесконтактной системой интраоперационной визуализации глазного дна с использованием эндосветовода. Это обеспечивает панорамный вид операционного поля с оптимальной визуализацией периферических отделов сетчатки и хорошим увеличением [6, 8, 12, 13].
Изучить эффективность ЭСП с использованием эндоиллюминации при хирургическом лечении пациентов с первичной РОС.
Материал и методы
Материалом для исследования послужили данные комплексного клинического обследования и хирургического лечения пациентов с РОС. За период 2017–2019 годы на базе Республиканского офтальмологического центра на функциональной основе УЗ «10-я городская клиническая больница» г. Минска было выполнено хирургическое лечение 17 пациентам (17 глаз) с РОС. Исследуемые демографические показатели: пол и возраст пациентов. Клинические данные, которые мы подвергали статистической обработке: давность отслойки сетчатки; распространенность отслойки сетчатки (количество квадрантов, вовлеченных в отслойку сетчатки); локализация, количество и вид разрывов сетчатки; состояние хрусталика пациента; наличие отслойки сетчатки в макулярной области, максимально корригированная острота зрения (МКОЗ), наличие и стадия пролиферативной витреоретинопатии (ПВР). Всем пациентам было проведено стандартное офтальмологическое обследование: бесконтактная тонометрия; исследование остроты зрения с коррекцией, биомикроскопия, осмотр глазного дна с фундус-линзой Гольдмана, ультразвуковое исследование глазного яблока (сканер ультразвуковой UD-8000 Tomey), фундус-камера (Carl Zeiss Meditec AG VISUCAM 500), оптическая когерентная томография заднего отрезка (томограф оптикокогерентный Stratus OCT 3000), интраоперационная видеорегистрация (Zeiss OPMI Lumera 700). Хирургическое лечение РОС было выполнено методом ЭСП с использованием эндоиллюминации.
Техника операции следующая. Выполняется круговой разрез конъюнктивы у лимба, прямые мышцы глаза берутся на лигатуры. Под мышцами проводится циркляжная силиконовая лента 2,5 мм, которая фиксируется к склере в 4 квадрантах Z-образными швами. Концы ленты затягиваются силиконовым капилляром (рис. 1).
Под силиконовую циркляжную ленту в проекции разрыва сетчатки устанавливается экстраслеральная силиконовая пломба (ЭСП) гладкой поверхностью к склере. В качестве ЭСП используют силиконовый губчатый жгут. ЭСП фиксируют по краям передний край. На 90 градусов от предполагаемого разрыва сетчатки через разрез склеры в 3,5 мм от лимба вводится эндоокулярный световод (23–25G). Через бесконтактную систему интраоперационной визуализации глазного дна визуализируются разрыв и вал вдавления. Накладывается шов на склеральный разрез (рис. 2).
ЭСП фиксируется на всем протяжении к склере узловыми швами. Силиконовая циркляжная лента фиксируется к пломбе Z-образным швом (рис. 3).
Концы ленты фиксируют силиконовым капилляром, затягивают до нормального офтальмотонуса. Правильное положение пломбы относительно разрыва сетчатки проверяют повторным введением эндоокулярного световода в витреальную полость. При необходимости может быть выполнено наружное дренирование субретинальной жидкости (СРЖ), пневморетинопексия газом SF6. На склеральный разрез накладывают узловой шов (рис. 4). Накладывают непрерывные и узловые швы на рану конъюнктивы.
При обследовании пациентов в предоперационном периоде, а также в различные сроки послеоперационного наблюдения (после операции, 3, 6, 9 и 12 месяцев) мы исследовали следующие показатели: МКОЗ, состояние разрыва сетчатки, состояние хрусталика пациента, необходимость повторных хирургических вмешательств и лазерной коагуляции сетчатки, наличие и стадию ПВР.
Статистическая обработка результатов клинического исследования проведена на персональной ЭВМ с использованием статистических пакетов Statistica 10 (StatSoft Inc., США) и Microsoft Excel 2016 MSO (версия 16.0.4498.1000) для Windows 10.
Результаты и обсуждение
В настоящее исследование были включены 17 пациентов (17 глаз) с первичной РОС. Демографические и дооперационные клинические данные представлены в табл. 1.
У 5 пациентов (29,4%) РОС развилась на фоне миопии высокой степени (МВС). В трех случаях (17,6%) ранее пациентам была выполнена лазерная коагуляция разрыва сетчатки, прогрессирование которого привело к развитию РОС. У 13 пациентов до операции был обнаружен один разрыв сетчатки (76,5%). Только верхняя локализация разрывов сетчатки встречалась чаще, чем нижняя локализация. Так, в 9 случаях (52,9%) разрыв/разрывы сетчатки были локализованы в верхней полусфере, в 4 случаях (23,5%) – в нижней. В остальных 4 случаях (23,5%) разрывы располагались в нижней и верхней полусферах. В 7 случаях (41%) макулярная область была вовлечена в отслоечный процесс.
В 5 случаях (29,4%) было выполнено локальное пломбирование склеры. В остальных 12 случаях (70,6%) локальное ЭСП было дополнено циркляжным силиконовым элементом. Оперативное вмешательство было дополненно транссклеральным дренированием СРЖ в 10 случаях (59%) и пневморетинопексией газом SF6 50% в 8 случаях (48%). У одного пациента после фиксации ЭСП была проведена эндолазеркоагуляция. Это стало возможным благодаря интраоперациионной визуализации сетчатки в области разрыва на валу вдавления. В двух случаях (11,8%) интраоперационно были найдены не диагностированные ранее разрывы сетчатки. Мы считаем, что это стало возможным благодаря возможности изменения угла освещения эндосветоводом при осмотре глазного дна во время операции. Кроме того, после дренирования СРЖ и фиксации ЭСП значительно изменяется конфигурация остлоенной сетчатки и становятся доступными осмотру те ее участки, которые нельзя было осмотреть до операции.
Среднее время наблюдения составило 12,8 месяца (8–15 месяцев). Динамика зрительных функций отображена на диаграмме (рис. 5). В подгруппе пациентов с вовлеченной макулярной зоной в отслойку сетчаки мы получили более выраженную положительную динамику. В обшей группе пациентов МКОЗ повысилось с 0,35 до 0,46. В подгруппе пациентов с отслоенной макулярной областью положительная динамика более выраженная – МКОЗ повысилась с 0,1 до 0,28.
Прогрессирование катаракты, которое привело к снижению зрительных функций, было отмечено у одного пациента (5,9%) через 6 месяцев после оперативного лечения. Прогрессирование ПВР послужило причиной рецидива отслойки сетчатки у двух пациентов (11,8%). Рецидивы были диагностированы через 3 и 5 месяцев соответственно. В обоих случаях была выполнена витрэктомия с тампонадой витреальной полости силиконовым маслом 5000 Cst.
Интраоперационная визуализация глазного дна, обеспечиваемая вышеописанным способом, имеет много преимуществ по сравнению с традиционной непрямой бинокулярной офтальмоскопией. Прежде всего, имеется более широкое поле обзора, что позволяет хирургу визуализировать задний полюс и диск зрительного нерва, чтобы вовремя заметить его пульсацию [5]. Хирург может изменить поле обзора с помощью хирургического микроскопа, контроля системы фокусировки и увеличения изображения. Интраоперационная система визуализации глазного дна позволяет хирургу визуализировать маленькие разрывы сетчатки, а также разрывы, расположенные ближе к крайней периферии сетчатки. Данный метод позволяет получить прямое изображение глазного дна в отличие от непрямой офтальмоскопии, что позволяет хирургу выполнять хирургические маневры просто и точно [7, 8, 13].
Кроме того, данная система визуализации обеспечивает лучший обзор при частичном помутнении оптических сред (помутнения роговицы, хрусталика, капсульной сумка и стекловидного тела) [5]. Возможность разместить эндосветовод в любом квадранте позволяет хирургу получить четкий обзор желаемого сектора сетчатки [6, 8]. Лучшая визуализация глазного дна достигается, когда лучи света перпендикулярны поверхности сетчатки. По этой причине, а также для минимизации риска ятрогенного повреждения хрусталика мы предпочитаем размещать световод на 90 градусов от разрыва сетчатки, выявленного во время предоперационного обследования.
После удаления световода, во время фиксации ЭСП, может произойти выпадение волокон стекловидного тела через склеротомическое отверстие [5]. Поэтому мы рекомендуем наложение узловых швов на данный разрез склеры. Перед последующим введением эндосветовода швы снимаются.
Данный способ позволяет проводить такие процедуры, как введение газа в витреальную полость, транссклеральное дренирование СРЖ проводить под контролем зрения. [5] Кроме того, это избавляет хирурга от необходимости несколько раз за операцию надевать и снимать бинокулярный офтальмоскоп, что требует привлечения дополнительного медицинского персонала, а также он не покидает свое рабочее место для проведения непрямой офтальмоскопии. После ее выполнения неизбежно следует замена хирургических перчаток, а также возникает необходимость в настройке операционного микроскопа заново. Введение световода в витреальную полость и герметизация разреза склеры также занимают время, однако эти этапы операции более эргономичны для хирурга. Среднее время операции в нашем исследовании составило 67 мин, что сопоставимо с данными литературы (62–104 мин) [6, 7].
Некоторые авторы упоминают об ятрогенном повреждении хрусталика, эндофтальмитах и токсическом повреждении сетчатки светом при освещении глазного дна эндосветоводом [13]. В нашем исследовании не было зафиксировано ятрогенного повреждения хрусталика. Несмотря на то что введение световода в витреальную полость превращает непроникающую традиционную операцию ЭСП в проникающую операцию, в нашей группе пациентов воспалительных осложнений, в том числе эндофтальмитов, зафиксировано не было.
Успешный анатомический результат после первой операции в нашем исследовании достигнут у 82% пациентов, а успешный итоговый анатомический результат – у 94%. В двух случаях потребовалось дополнительное введение газа SF6 в витреальную полость. В обоих случаях не наблюдалось положительной динамики в течении 5 и 7 дней соответственно (сохранялась СРЖ, разрыв располагался в проекции вала вдавления, однако края его были приподняты). В обоих случаях после введения газа SF6 разрыв оказался блокирован на валу вдавления, наблюдалась резорбция СРЖ в течение нескольких дней. Процент успешного достижения анатомического результата после первой операции и после повторного хирургического лечения сопоставим с результатами, полученными при использовании как традиционной техники ЭСП, так и с использованием эндоиллюминации. [5–10, 12, 13, 16] Сравнительный анализ исследований представлен в табл. 2 и 3.
Одно из самых масштабных исследований по применению ЭСП с использованием эндоиллюминации было опубликовано Imai и соавт. в 2015 году [7]. Авторы использовали данную методику для визуализации разрывов сетчатки для дренирования СРЖ под контролем зрения. Были прооперированы 79 пациентов. Успешное достижение анатомического результата после первой операции было зафиксировано у 92,4% пациентов. Ятрогенные осложнения, связанные с введением эндосветовода отмечены в двух глазах. В одном случае авторы описывают ятрогенный разрыв сетчатки, который был идентифицирован во время операции и блокирован ЭСП. Во втором случае авторы отмечают контакт эндосветода с задней капсулой хрусталика пациента во время проведения криоретинопексии. Однако катаракта не развилась за все время периода наблюдения.
Еще более масштабное исследование было опубликовано в 2019 г. Frisina, Forlini и соавт. [5]. 213 глаз с РОС было прооперировано по описанной методике. Особенностью данного исследования был этап введения газовоздушной смеси в витреальную полость в момент первичного введения эндосветовода. Авторы рекомендуют проведение пневморетинопексии сразу после этапа локализации разрыва сетчатки. Введение газа производится под контролем зрения, что позволяет ввести адекватное количество газа.
Подводя итоги, можно выделить следующие преимущества использования интраоперационной эндоиллюминации при ЭСП.
1. Данный вид хирургического лечения эффективен для пациентов с РОС. В нашем исследовании успешное достижение анатомического результата после первой операции было зафиксировано у 82% пациентов, что коррелирует с данными авторов, которые также использовали данный способ (83–92%).
2. В нашем исследовании описаны случаи интраоперационной диагностики разрывов сетчатки, которые не были обнаружены до операции. Это было отмечено и в других исследованиях.
3. Хирурги, выполнявшие оперативное лечение по данной методике в нашем исследовании, отмечают улучшенную эргономику рабочего места при визуализации глазного дна с использованием операционного микроскопа и эндоиллюминации по сравнению с непрямой офтальмоскопией. К данному выводу пришли и другие авторы.
4. Данный способ упрощает взаимодействие между членами операционной команды, а также позволяет использовать данный способ для обучения. Это становится возможным благодаря тому, что хирург, ассистент и все врачи, присутствующие в операционной, видят одно и то же интраоперационное изображение глазного дна.
5. В нашем исследовании не зафиксировано осложнений, связанных с введением световода в витреальную полость (ятрогенное повреждение хрусталика, эндофтальмит), что говорит о безопасности применения данного вида хирургического лечения. В проанализированных исследованиях зарубежных авторов осложнения эпизодические, и риск их возникновения оценивается как крайне низкий.
Сведения об авторах:
Маркевич Владимир Юрьевич – старший преподаватель кафедры офтальмологии ГУО «Белорусская медицинская академия последипломного образования». Адрес: 220053, г. Минск, ул. Кузьмы Чорного, 3–15.
Имшенецкая Татьяна Александровна – д.м.н., профессор, зав. кафедрой офтальмологии ГУО «Белорусская медицинская академия последипломного образования». Адрес: 220013, г. Минск, ул. Петруся Бровки, 3/3.
Ярмак Ольга Александровна – к.м.н, доцент кафедры офтальмологии ГУО «Белорусская медицинская академия последипломного образования».
Эндоиллюминация в офтальмохирургии. Возможности
Проведено исследование возможностей фундус-камеры при диагностике патологии глазного дна в условиях специализированной поликлиники. Установлено, что фоторегистрация глазного дна на фундус-камере позволяет не только сократить время диагностики на амбулаторном этапе, но и повышает частоту верификации диагноза при заболеваниях сетчатки и зрительного нерва. Следует рекомендовать широкое использование метода фоторегистрации глазного дна, как высокоинформативного метода диагностики витреоретинальной патологии в офтальмологической практике.
1. Каталевкая Е.А. Первые результаты применения адаптивной оптики в ранней диагностике возрастной маку- лярной дегенерации // Нижегородский медицинский журнал. - 2007. - №6.- С. 147-149.
2. Сравнение различных методов скрининга диабетической ретинопатии / Ю.С. Астахов, Н.Н. Григорьева, Е.Б. Шкляров, Ф.Е. Шадричев // Сахарный диабет и глаз: материалы научно-практической конференции. - М., 2006. - С. 20-24.
3. Современные методы диагностики и лечения диабетических макулярных отеков / Л.И. Балашевич, М.В. Гацу, Я.В. Байбородов, Л.В. Чиж // Сахарный диабет и глаз: материалы научно-практической конференции. - М., 2006. - С. 31-38.
4. Родин А.С. Новые клинические возможности метода оптической когерентной томографии. Ранняя диагностика патологии макулы у пациентов с высокой остротой зрения // Офтальмология. - 2004. - Т. 1, № 4. - С. 24-28.
5. Artal P. et al. Compensation of corneal aberration by the internal optics in the human eye. - Opt J. of Vision. - 2001. - Vol. 1. - Р. 1.
6. Artal P., Navarro R. Simultaneous measurement of two point-spread functions at different locations across the human retina. - Applied Opt., 1992. - Vol. 31. - Р. 3646.
7. Dubinin A. et al. Human eye anisoplanatism: eye as a lamellar structure // Proc. SPIE. - 2006. - Vol. 6138. - Р. 613813.
8. Liang J. et al. Supernormal vision and high resolution retinal imaging through adaptive optics // J. Opt. Soc. Am. - 1997. - A14. - Р. 2884.
9. Navarro R. et al. Modulation transfer of the human eye as a function of retinal eccentricity // J. Opt. Soc. Am. - 1993. - A10. - Р. 201.
В современном мире заболевания сетчатки занимают ведущее место среди причин необратимой потери зрения. Часто причиной необратимой потери зрения является поздняя диагностика и, как следствие, начало лечения в далеко зашедших и необратимых стадиях заболевания. Это послужило стимулом к необходимости разработки новых более совершенных методов ранней диагностики хориоретинальной патологии [2, 9, 7]. В настоящее время в офтальмологии основными методами визуализации структур глазного дна являются офтальмоскопия, биомикроофтальмоскопия, фоторегистрация тканей глазного дна при помощи фундус-камеры, флюоресцентная ангиография глазного дна (ФАГД) с флюоресцеином и индоцианином зеленым, оптическая когерентная томография (ОКТ), сканирующая лазерная офтальмоскопия (СЛО). Все перечисленные методы исследования глазного дна имеют существенный недостаток, связанный с негативным влиянием аберраций оптической системы глаза на разрешающую способность приборов. Это обусловлено аберрациями оптической системы глаза. С возрастом аберрации увеличиваются, и в период от 30 до 60 лет аберрации высшего порядка удваиваются [2, 4, 5].
Офтальмологи большое внимание уделяют использованию адаптивной оптики для получения изображения глазного дна с высоким пространственным разрешением (величина, характеризующая размер наименьших объектов, различимых на изображении) [1, 6, 8]. Адаптивная оптика (АО) позволяет улучшить разрешение в направлении коррекции в глазу, но она не всегда эффективна относительно изображения всей сетчатки [4, 5, 10].
Цель настоящего исследования: оценить диагностические возможности фундус-камеры при исследовании больных с заболеваниями сетчатки и зрительного нерва.
Материалы и методы исследования
Обследован 141 больной с жалобами на ухудшение центрального зрения и подозрением на заболевание сетчатки и/или зрительного нерва при обследовании стандартными методами: визометрия, обратная офтальмоскопия, биомикроофтальмоскопия с линзой Гольдмана. Пациентам дополнительно выполнялась фоторегистрация изменений глазного дна на фундус- камере VISUCAM NM FA ZEISS и анализ изображений. Все пациенты обследовались в поликлинике ГУЗ РХ «Офтальмологическая больница им. Н.М. Одежкина» в течение 2010 года. Возраст пациентов варьировался от 20 до 68 лет (средний возраст - 44,0 ± 24,0 года).
Результаты исследования и их обсуждение
Высокая потребность в ранней диагностике патологии глазного дна натолкнула на мысль оценить диагностические возможности фундус-камеры в качестве дополнительного метода обследования больных с начальными стадиями ретинальной патологии. Сравнительная оценка диагностических возможностей методов визуализации картины глазного дна показала, что прямая и непрямая офтальмоскопия, биомикроскопия глазного дна доступна для пациента в условиях поликлиники и требует минимума технической оснащенности (положительные стороны). Отрицательными сторонами стандартной офтальмоскопии и биомикро- офтальмоскопии являются малое увеличение объектов, невозможность детализации мелких объектов, значительное влияние оптических аберраций, невозможность спектрального исследования картины глазного дна и объективного документирования полученного изображения.
Фоторегистрация картины глазного дна на фундус-камере VISUCAM NMFA имеет ограниченную доступность для пациента в условиях специализированной поликлиники, но имеет ряд преимуществ перед другими методами. Прежде всего, оно не требует расширения зрачка и внутривенного введения контрастного вещества в сосудистую систему глаза (при отсутствии необходимости проведения ФАГ), обеспечивает достаточную детализацию объектов глазного дна. При исследовании больных на фундус-камере имеют малую значимость оптические аберрации. Фундус-камера дает возможность мультиспектральной съемки и анализа изображения, проведения ФАГ, проведения сравнительной оценки полученных данных в динамике (мониторинг) и архивирование полученных данных, в том числе для передачи по цифровым каналам связи с целью дополнительной консультации данных пациента экспертами, например, в межрегиональных офтальмологических центрах или столичных НИИ глазных болезней. Камера легко может быть интегрирована в единую компьютерную сеть диагностических приборов. Таким образом, метод фоторегистрации глазного дна на фундус-камере VISUCAM VISUCAM NMFA имеет ряд значимых преимуществ как по степени воздействия на глаз, так и по качеству диагностики ретинальной патологии.
Учитывая тенденцию современных требований к повышению качества, доступности и сроков предоставления специализированной услуги, представим, что данный метод может выступить альтернативой целой группе традиционных методов на первичном приеме пациента. Одним из критериев этих требований, на наш взгляд, являются объективность, безошибочность постановки первичного диагноза и оптимальные затраты во времени исследования пациента. При исследовании группы пациентов (n = 141) вышеперечисленными методами выявлена следующая патология глазного дна: дистрофия сетчатки, в том числе, ма- кулодистрофия (5,7 %), диабетическая ретинопатия (31,9 %), врожденные аномалии зрительного нерва (4,3 %), подозрение на новообразование хориоидеи (5,7 %), микрокровоизлияния в сетчатку, под пигментный эпителий сетчатки (7,8 %), ангииты ре- тинальных сосудов (4,3 %), изменения на глазном дне при системно-синдромальных заболеваниях, факоматозы (2,8 %), изменения при окклюзиях ретинальных сосудов (37,6 %). Расхождение в диагнозе при стандартном обследовании и обследовании, дополненном цифровой фоторегистрацией глазного дна, составило 42,6 %. Расхождения в диагнозах отсутствовали лишь при ретинальных ангиитах и врожденных аномалиях зрительного нерва. Минимальный процент расхождения диагноза (1,4 %) отмечался при начальных стадиях системных заболеваний и факоматозах, а максимальный - (19,1 %) при диабетической ретинопатии. Следовательно, выполнение фоторегистрации изменений глазного дна на фундус-камере при установлении диагноза в условиях специализированной поликлиники минимизирует субъективизм и позволяет ретроспективно или в режиме on-line проконсультировать пациента с экспертом, что особенно важно при витреоретиналь- ной патологии, имеющей, с одной стороны, многочисленные варианты течения болезни, а с другой стороны, редко встречающиеся синдромы, трудные для диагностики.
Оптимальные временные затраты на исследование пациента также зависят от методики исследования и используемого при этом оборудования. Анализ затрат времени (n = 141) при исследовании стандартными методами и обследовании, дополненном на фундус-камере, показал низкую эффективность обычных методов исследования перед фоторегистрацией глазного дна (23,3 ± 6,7 % против 12,5 ± 2,5 %; p = 0,001). Оценка средневременных показателей при стандартном и дополненном протоколе исследования выявила, что коэффициент эффективности за 1 час работы на фундус-камере выше (1,9 ± 0,4 %), что указывает на ее значительное преимущество. При этом экономия затрат по времени особенно выделяется при подозрении на новообразование увеального тракта и микрокровоизлияния в сетчатку (в 2,3 раза).
В условиях специализированной поликлиники фоторегистрация изменений глазного дна на фундус-камере позволяет сократить время обследования пациента на амбулаторном этапе и повысить частоту верификации диагноза при патологии глазного дна. Данный метод диагностики ретинальной патологии в условиях специализированной поликлиники имеет значительные преимущества перед стандартными методами диагностики. Необходимо рекомендовать в специализированных поликлиниках и стационарах широкое использование метода фоторегистрации глазного дна, как высокоинформативного метода диагностики витреоретинальной патологии.
Читайте также:
