Физиология инсулина. Воздействие инсулина на клетку
Добавил пользователь Дмитрий К. Обновлено: 27.01.2026
Физиология инсулина. Воздействие инсулина на клетку
а) Активация инсулином рецепторов клеток-мишеней и результирующие ответы клеток. Для воздействия на клетку-мишень инсулин прежде всего связывается и активирует рецептор, расположенный на мембране клеток, — белок с молекулярной массой около 300000 (для облегчения понимания просим вас изучить рисунок ниже).
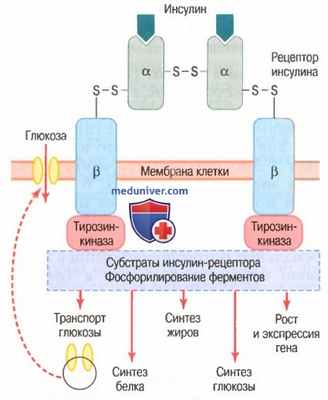
Схема инсулин-рецептора. Инсулин связывается с альфа-субъединицей рецептора, что вызывает фосфорилирование бета-субъединицы рецептора.
Это, в свою очередь, индуцирует активность тирозинкиназы. Рецептор тирозинкиназной активности запускает каскад реакций фосфорилирования в клетке, что увеличивает или снижает активность ферментов, включая субстраты инсулин-рецептора, которыми опосредованы влияния глюкозы на метаболизм глюкозы, жиров и белков.
Например, транспортеры глюкозы продвигаются к мембране клетки, облегчая поступление глюкозы в клетку
Активация рецептора сопровождается определенной последовательностью реакций.
Рецептор инсулина состоит из 4 субъединиц, связанных дисульфидными связями: 2 альфа-субъединицы располагаются практически снаружи мембраны и 2 бета-субъединицы прободают мембрану и продолжаются в цитоплазму. Инсулин взаимодействует с 2 наружными субъединицами, но благодаря существенным собственным связям субъединиц между собой внутренние бета-субъединицы при этом аутофосфорилируются, поэтому инсулиновый рецептор является примером энзим-связанного рецептора.
Аутофосфорилирование бета-субъединиц рецептора приводит к местной активации тирозинкиназы, которая в итоге вызывает фосфорилирование многих других внутриклеточных ферментов, включая группу, названную субстратами инсулин-рецептора. Различные типы СИР (например, СИР1, СИР2, СИРЗ) представлены в различных клетках. Система действует, активируя одни ферменты одновременно с инактивацией других. Таким образом, инсулин управляет внутриклеточными метаболическими механизмами, вызывая желательные реакции обмена белков, жиров и углеводов. Окончательные эффекты действия инсулина следующие.
1. Через несколько секунд после взаимодействия инсулина с рецептором проницаемость мембран для глюкозы у 80% клеток организма заметно повышается. Это особенно справедливо для мышечных клеток и адипоцитов, но совершенно не распространяется на нейроны мозга. Поступившая в клетки глюкоза фосфорилируется и становится субстратом для всех обычных этапов обмена углеводов.
Увеличение транспорта глюкозы в клетку предположительно является результатом перемещения множества внутриклеточных пузырьков к мембране клетки; эти пузырьки несут на своей мембране множество белков, обеспечивающих транспорт глюкозы; взаимодействуя с мембраной клетки, они облегчают поступление глюкозы в клетку. Если инсулина уже не оказывается в наличии, пузырьки отделяются от мембраны в течение 3-5 мин и возвращаются в середину клетки, сохраняя способность к использованию их по мере необходимости.
2. Мембрана становится более проницаемой для многих аминокислот, ионов калия, фосфатов, повышая транспорт этих веществ в клетку.
3. Медленные эффекты возникают через 10-15 мин и заключаются в изменении уровня активности большинства внутриклеточных метаболических ферментов. Этот эффект является результатом главным образом изменения процессов фосфорилирования ферментов.
4. Более медленные процессы продолжаются в течение нескольких часов и дней. Они являются результатом изменения скорости процесса трансляции на рибосомах и приводят к образованию новых белков. Еще более медленные эффекты опосредованы изменением скорости транскрипции ДНК в ядре клетки. Таким способом инсулин формирует многие ферментативные механизмы клеток для выполнения свойственных им метаболических задач.
Видео физиология гормонов поджелудочной железы и регуляции уровня глюкозы - профессор, д.м.н. П.Е. Умрюхин
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Механизмы действия инсулина
Инсулин обладает целым спектром биологических эффектов. Его главными мишенями служат печень, мышцы и жировая ткань, играющие ведущую роль в обмене глюкозы, однако инсулин влияет и на многие другие ткани. Это важнейший гормон, ответственный за транспорт, метаболизм и запасание клетками питательных веществ: он стимулирует анаболические процессы (утилизацию и запасание глюкозы, аминокислот и жирных кислот) и тормозит катаболические (распад гликогена, жиров и белков). Под действием инсулина стимулируется транспорт питательных веществ и ионов внутрь клетки, ускоряется внутриклеточное перемещение белков, активируются или инактивируются ферменты, изменяется количество белков путем изменения скорости транскрипции их генов и трансляции мРНК (рис. 61.3,61.4).
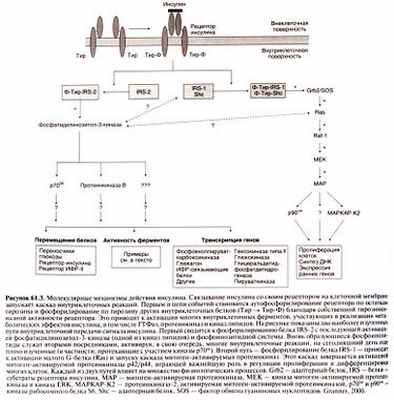
Некоторые эффекты инсулина проявляются в течение нескольких секунд или минут; среди них — стимуляция транспорта глюкозы и ионов, фосфорилирование и де-фосфорилирование ферментов, и даже ингибирование транскрипции гена фосфоенолпируваткарбоксикиназы (Granner, 1987; O’Brien and Granner, 1996). Для достижения других эффектов инсулина, в частности для изменения транскрипции большинства генов и изменения синтеза белка, требуется несколько часов. Эффект инсулина на пролиферацию и дифференцировку клеток проявляется только через несколько суток. Не ясно, обусловлены ли эти временные различия разными механизмами внутриклеточной передачи сигнала или разной кинетикой самих процессов, регулируемых инсулином.
Важнейший физиологический эффект инсулина — стимуляция транспорта глюкозы в мышцах и жировой ткани. Глюкоза проникает в клетки путем облегченной диффузии, которая опосредуется специальными белками — переносчиками глюкозы. Известны пять таких белков (GLUT1, GLUT2, GLUT3, GLUT4 и GLUT5); считается, что они осуществляют независимый транспорт глюкозы в клетки путем облегченной диффузии (Shepherd and Kahn, 1999). Белки — переносчики глюкозы представляют собой гликопротеиды с молекулярной массой около SO ООО; каждый из них имеет по 12 трансмембранных а-спиральных доменов. Стимуляция инсулином транспорта глюкозы, по крайней мере отчасти, обусловлена энергозависимым перемещением внутриклеточных везикул, содержащих белки GLUT4hGLUTI, к клеточной мембране (Suzuki and Копо, 1980; Simpson and Cushman, 1986; рис. 61.3). Этот эффект обратим: по мере разрушения инсулина белки —переносчики глюкозы возвращаются в свои внутриклеточные хранилища. Полагают, что нарушение данного процесса служит одним из патогенетических звеньев инсулинонезависимого сахарного диабета (Shepherd and Kahn, 1999).
Облегченная диффузия глюкозы в клетки по градиенту концентрации завершается фосфорилированием глюкозы. Образование глюкозо-6-фосфата из глюкозы катализируется гексокиназой, четыре изофермента которой, подобно белкам — переносчикам глюкозы, распределены в разных тканях по-разному. Активность двух изоферментов гексокиназы регулируется инсулином. Гексокиназа типа IV, часто называемая глюкокиназой, имеет молекулярную массу 50 ООО и обнаруживается наряду с белком GLUT2 в гепатоцитах и β-клетках. Глюкокиназа кодируется одним геном, но в печени и островках поджелудочной железы при транскрипции этого гена используются разные промоторы и разные первые экзоны (Printz et al., 1993а). Транскрипция гена глюкокиназы в печени регулируется инсулином (Magnuson et al., 1989). Гексокиназа типа II имеет молекулярную массу 100 000; она присутствует в скелетных мышцах, миокарде и жировой ткани вместе с белком GLUT4. Инсулин регулирует транскрипцию и гена белка GLUT4, и гена гексокиназы типа II (Printz et al., 1993b).
Глюкозо-6-фосфат служит общим субстратом для двух метаболических путей. Во-первых, он включается в гликолиз — каскад ферментативных реакций, в результате которого образуется АТФ. Многие из реакций гликолиза усиливаются под действием инсулина: либо за счет регуляции транскрипции генов, кодирующих ферменты, либо за счет фосфорилирования или дефосфорилирования сериновых и треониновых остатков, ведущего к изменению активности ферментов. Во-вторых, глюкозо-6-фосфат может превращаться в глюкозо-1-фосфат, из которого синтезируется гликоген. Инсулин стимулирует запасание гликогена, активируя гликогенсинтетазу (катализируемая этим ферментом реакция лимитирует скорость гликогенеза) и ингибируя фосфорилазу (катализируемая этим ферментом реакция лимитирует скорость гликогенолиза). Как и в случае гликолиза, эффекты инсулина опосредуются фосфорилированием и дефосфорилированием ферментов; это важнейший механизм действия данного гормона. Например, ацетил-КоА-карбоксилаза и АТФ-цитратлиаза активируются при фосфорилировании, а гликогенсинтетаза и пируватдегидрогеназа — при дефосфорилировании. Дефосфорилирование последних двух ферментов — результат активации инсулином фосфатаз. Подобным образом модифицируются и меняют свою активность десятки белков (Denton, 1986).
В настоящее время нет сомнений в том. что важнейшим из эффектов инсулина является регуляция транскрипции тех или иных генов. Примером может служить ингибирование транскрипции гена фосфоенолпируваткарбоксикиназы (Granner et al., 1983). Этот эффект инсулина проливает свет на механизм торможения им глюконеогенеза (Sasaki et al., 1984) и объясняет, почему при инсулинорезистентности, характерной для инсулинонезависимого сахарного диабета, печень синтезирует избыток глюкозы (Granner and O’Brien, 1992). Известно более 100 генов, транскрипция которых регулируется инсулином (O’Brien and Granner, 1996), и этот список продолжает расти. Однако механизм, посредством которого инсулин влияет на транскрипцию, пока еще не расшифрован.
Инсулин оказывает свои эффекты, связываясь с мембранным рецептором. У млекопитающих эти рецепторы имеются почти на всех клетках — как на тех, что считаются классическими мишенями инсулина (гепатоцитах, миоцитах и липоцитах), так и на клетках крови, головного мозга и половых желез. Число рецепторов инсулина колеблется от 40 (у эритроцитов) до 300 ООО на клетку (у гепатоцитов и липоцитов).
Рецептор инсулина представляет собой крупный трансмембранный гликопротеид, состоящий из двух а-субъединиц с молекулярной массой 135 ООО (по 719 или 731 аминокислотному остатку в зависимости от сплайсинга мРНК) и двух β-субъединиц с молекулярной массой 95 ООО (по 620 аминокислотных остатков). Субъединицы соединены дисульфидными связями в гетеротетрамер β-а-а-β (рис. 61.3) (Virkamaki et al., 1999). Обе субъединицы образуются из общего одноцепочечного предшественника, в составе которого аминокислотные последовательности а- и β-субъединиц разделены участком, состоящим из четырех основных аминокислотных остатков. Субъединицы рецептора наделены каждая своей функцией. Альфа-субъединицы расположены внеклеточно и содержат инсулинсвязываю-щий домен (см. выше), тогда как β-субъединицы образуют трансмембранный домен, обладающий тирозинкиназной активностью. После связывания инсулина с рецепторами происходит их агрегация и быстрая интернализация гормон-рецепторных комплексов. Поскольку двухвалентные антитела к рецептору инсулина, перекрестно связываясь с соседними рецепторами, имитируют эффект инсулина, а моновалентные антитела этим свойством не обладают, полагают, что агрегация рецепторов необходима для запуска каскада внутриклеточных реакций. После интернализации гормон-рецепторного комплекса рецептор инсулина либо разрушается, либо возвращается обратно в клеточную мембрану.
Фосфорилирование тирозиновых остатков и механизмы внутриклеточной передачи сигнала. Рецептор инсулина обладает собственной тирозинкиназной активностью (Virkamaki et al., 1999). Этим свойством обладают также рецепторы многих факторов роста, например эпидермального фактора роста, тромбоцитар-ного фактора роста и М-КСФ (Yarden and Ullrich, 1988). Знания о механизме передачи сигнала рецепторами с собственной тирозинкиназной активностью получены в основном при изучении белков, кодируемых онкогенами и вызывающих опухолевую трансформацию клеток, в частности тирозинкиназ семейства Src.
При связывании инсулина с а-субъединицами рецептора быстро происходит аутофосфорилирование тирозиновых остатков β-субъединиц. Эта аутокаталитическая реакция приводит к значительному усилению тирозинкиназной активности рецептора в отношении других белков. В нормальных клетках происходит также фосфорилирование сериновых и треониновых остатков рецептора инсулина, в основном под действием проте-инкиназ С и А. Эта последняя реакция ведет к подавлению тирозинкиназной активности рецептора (Cheatham and Kahn, 1995).
Тирозинкиназная активность рецептора необходима для проявления эффекта инсулина. Мутации, которые изменяют АТФ-связывающий центр или приводят к замене тирозиновых остатков, подвергающихся аутофосфорилированию, на другие, ведут к снижению собственной тирозинкиназной активности рецептора инсулина и ослаблению эффектов гормона (Ellis et al., 1986). Рецептор инсулина, не способный к аутофосфорилированию, полностью лишен активности.
Активированный рецептор инсулина запускает каскад внутриклеточных реакций, первой из которых является фосфорилирование четырех белков, называемых субстратами рецептора инсулина, — IRS-1, IRS-2, IRS-3 и IRS-4 (White et al., 1985). После фосфорилирования белок IRS-2 приобретает способность взаимодействовать с другими белками, которые содержат БШ-доме-ны (названные так вследствие гомологии с тирозинкиназой Src). Один из них — фосфатидилинозитол-3-киназа, гетеродимер, состоящий из каталитической субъединицы с молекулярной массой 110 000 (pi 10) и регуляторной субъединицы с молекулярной массой 85 000 (р85). Субъединица р85 содержит два БШ-домена, которые связываются с белком IRS-1. Фосфатидилинози-тол-3-киназа катализирует фосфорилирование фосфоинозити-дов в положении 3 инозитола, а продукты реакции участвуют во внутриклеточной передаче сигнала (фосфоинозитидная система). Фосфатидилинозитол-З-киназа активируется многими гормонами и факторами, которые стимулируют пролиферацию клеток; среди них — тромбоцитарный и эпидермальный факторы роста и ИЛ-4 (Virkamaki et al., 1999). Действие этого фермента на пролиферацию, по-видимому, опосредуется активацией проте-инкиназы В и, возможно, других киназ.
Одни из самых мощных митогенов — белки Ras, кодируемые одноименными онкогенами; они активируют каскад митоген-активируемых протеинкиназ. Об участии белков Ras в опосредовании эффектов инсулина задумались тогда, когда стало известно, что инсулин в числе прочих ферментов активирует и этот каскад (Avruch et al., 1994). Недавно выяснился и механизм этого участия, правда, не до конца. Активация рецепторов с собственной тирозинкиназной активностью, в том числе рецептора инсулина, приводит к взаимодействию еще одного содержащего SH2-домен белка — адаптерного белка Grb2 — с фосфорилированным белком IRS-1. Адагггерный белок Grb2 связывается с фактором обмена гуаниновых нуклеотидов SOS, и этот комплекс увеличивает сродство белков Ras к ГТФ. Активированный белок Ras взаимодействует с белком Raf-1 (серин-треониновой киназой), который, в свою очередь, активирует каскад митоген-активируемых протеинкиназ. Кроме того, активированный рецептор инсулина фосфорилирует содержащий БШ-домен адагггерный белок She, после чего тот связывается с белком Grb2. Это, по-видимому, приводит к усилению взаимодействия фактора обмена гуаниновых нуклеотидов SOS с клеточной мембраной, активации белков Ras и Raf-1 и каскада митоген-активируемых протеинкиназ. Механизм, посредством которого инсулин вызывает пролиферацию клеток, окончательно не установлен, но уже ясно, что в нем задействованы множественные, возможно даже избыточные, пути внутриклеточной передачи сигнала (Avruch et al., 1994).
Метаболическое действие инсулина, по-видимому, опосредуется белком IRS-2. Внутриклеточное перемещение белков — переносчиков глюкозы в мышцах и жировой ткани, ведущее к усилению транспорта глюкозы в клетки, — главный эффект инсулина. Перемещение белков-переносчиков блокируется ворг-маннином, ингибитором фосфатидилинозитол-3-киназы. Действие инсулина на транскрипцию генов ключевых ферментов углеводного обмена тоже блокируется вортманнином, поэтому не исключено, что он опосредуется белком IRS-2 и субстратами фосфатидилинозитол-3-киназы.
Анаболические препараты могут применяться только по назначению врача и противопоказаны детям. Представленная информация не призывает к применению или распространению сильнодействующих веществ и нацелена исключительно на снижение риска осложнений и побочных эффектов.
Что такое инсулин
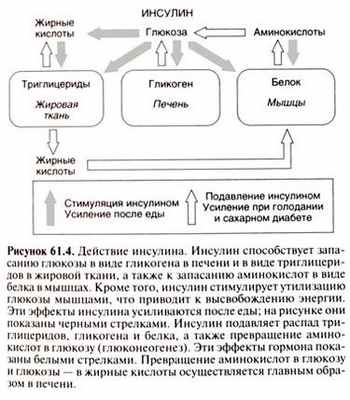
Инсулин - гормон, который регулирует уровень глюкозы в крови. Глюкоза - моносахарид, то есть простой углевод. После принятия пищи сложные углеводы расщепляются в ЖКТ до простых и всасываются в кровоток.
Инсулин регулирует обмен углеводов, принимает участие в белковом и углеводном обмене. Благодаря этому гормону происходит усваивание глюкозы из крови клетками органов и тканей. Ее остатки откладываются в клетках печени и мышцах в форме гликогена. Он представляет собой полисахарид, состоящий из молекул глюкозы. Это - накапливаемый резерв углеводов, который является первичным источником энергии для нашего тела. Она высвобождается и превращается в глюкозу, когда организм испытывает повышенную потребность в энергии. Это происходит при физических нагрузках, стрессах, при снижении уровня глюкозы в крови из-за пропуска приема пищи, дефиците калорий.
Участие инсулина в белковом обмене заключается в том, что этот гормон усиливает синтез нуклеиновых кислот, тормозит распад белковых соединений. При обмене жиров инсулин активизирует энергетические процессы в жировых клетках, участвует в синтезе жирных кислот.
Как действует инсулин
Именно этот гормон регулирует распределение энергии в виде глюкозы. По этому критерию все органы и ткани подразделяются на инсулинозависимые и инсулиннезависимые. Инсулинозависимыми являются печень, мышечная и жировая ткань. В них глюкоза попадает только тогда, когда инсулин "даст разрешение" на создание энергетических депо. При нехватке калорий, когда энергии недостаточно, жировая ткань и мышцы остаются без глюкозы, которую инсулин не пропускает в клетки. Она направляется головному мозгу и другим жизненно важным органам, которые являются инсулиннезависимыми.
Открытие инсулина и его роли в организме
За выработку этого гормона отвечает поджелудочная железа. Гормон вырабатывается специальными ß-клетками островков Лангерганса. Инсулин является жизненно важным гормоном, нарушение секреции которого приводит к серьезным сбоям обмена веществ. Самым известным заболеванием, которое связано с нарушением инсулинарной функции поджелудочной железы, является сахарный диабет (СД).
Самое первое описание симптомов сахарного диабета было сделано египтянином Имхотепом в 2980 году до н.э. Информация о СД была обнаружена и в древнегреческих папирусах, датируемых 1500 году до н.э.
Исследования, касающиеся природы "сахарной болезни", велись на протяжении многих лет. Открытие гормона, который регулирует уровень глюкозы в крови, принадлежит ученому Паулю Лангергансу. В 1869 году он обнаружил группу клеток в поджелудочной железе, которые отвечают за секрецию инсулина. Специалист смог доказать, что именно поджелудочной железе принадлежит функция регулировки уровня сахара в крови.
В 1900 году ученый Л. В. Соболев продолжил исследования этого органа и обнаружил, что патологические изменения островков Лангерганса приводят к сахарному диабету, а при их сохранении СД не возникает даже в случае атрофии железистой ткани.
Выделение гормона и открытие инсулинотерапии принадлежит канадскому врачу Фредерику Бантингу. Он первым в мире смог выделить так называемый "экстракт поджелудочной железы" из ее клеток, чтобы использовать его в лечении сахарного диабета. Это произошло только в 1921 году. Первоначально инсулин назвали айлетином, но потом его переименовали.
До появления инсулинотерапии люди с сахарным диабетом были обречены на быструю смерть. В 1922 году был получен препарат на основе очищенного инсулина животного происхождения. В 1923 году началось массовое производство этого лекарства. Он позволил людям с СД искусственно регулировать уровень глюкозы в крови и тем самым избежать смертельно опасных осложнений диабета.
В настоящее время инсулин для диабетиков получают методом генной инженерии. Такой препарат называют рекомбинантным. Его создают из вещества, которое вырабатывается штаммами дрожжей, помещенными в питательную среду. Этот способ позволил отказаться от сырья животного происхождения и получить препарат, действие которое идентично натуральному инсулину.
Секреция инсулина и ее нарушения
Для нормального течения обменных процессов важно, чтобы инсулин вырабатывался в нужном объеме. Минимальное количество этого гормона продуцируется всегда. Речь идет о базальной секреции инсулина. После еды и поступления глюкозы в кровь происходит активный выброс гормона – так называемый прандиальный пик. Это необходимо, чтобы глюкоза могла поступить в клетки органов и тканей.
При нормальной работе поджелудочной железы выработка инсулина после приема пищи происходит в две фазы. Быстрая фаза длится 1-3 минуты, медленная - до получаса.
Уровень инсулина в крови здоровых людей колеблется в широком диапазоне. Он зависит от возраста и физиологического состояния. У детей это значение составляет от 3 до 20 мкЕд/мл, у взрослых верхний порог достигает 25 мкЕд/мл.
У женщин во время беременности и после менопаузы происходят существенные изменения гормонального фона. Нормальные показатели инсулина в этом случае составляют от 6 до 27/36 мкЕд/мл.
Нарушением считается не только пониженная секреция гормона, но и повышенная. Существует несколько факторов, из-за которых поджелудочная железа не может вырабатывать инсулин в нужном количестве:
- СД первого типа. Патологический процесс обусловлен аутоиммунной реакцией. У людей с таким заболеванием ß-клетки островков Лангерганса разрушены и не могут покрыть потребность организма в гормоне. . Воспаление поджелудочной железы приводит к нарушению секреторной функции и нехватке инсулина из-за фиброза тканей. Сахарный диабет, который развивается при панкреатите, называют панкреатогенным или СД 3 типа.
- Травмы, операции на поджелудочной железе. Они вызывают повреждение островкового аппарата, который продуцирует инсулин.
- Злоупотребление быстрыми углеводами. Избыточное поступление глюкозы с пищей заставляет орган работать в усиленном режиме. Со временем это приводит к нарушению инсулинарной функции из-за износа поджелудочной железы.
- Интоксикация. Алкоголь, сильнодействующие лекарства, химические и природные яды, радиоактивные вещества повреждают клетки поджелудочной железы.
- Инсулинома. Опухоль β-клеток островков поджелудочной железы приводит к избыточной секреции инсулина.
Повышенное содержание гормона опасно из-за постоянной гипогликемии. Клетки органов и тканей не могут получать достаточное количество энергии из-за низкого уровня глюкозы. Гипогликемический приступ, при котором содержание глюкозы в крови падает ниже 2,5 ммоль/л, приводит к потере сознания, локальным поражениям нервной системы, может стать причиной инфаркта миокарда. В тяжелых случаях у пациента наступает гипогликемическая кома - смертельно опасное состояние.
Инсулин для диабетиков
При нарушении или отсутствии выработки инсулина глюкоза из пищи поступает в кровь, но не может попасть в клетки инсулинозависимых тканей, то есть мышц и жира. В то же время инсулиннезависимые органы получают глюкозу в избытке, что приводит к патологическим изменениям. При сахарном диабете в первую очередь страдают органы-мишени: сосуды, нервы, почки.

Инсулинотерапия используется в лечении диабета первого и второго типа. При СД 1 типа клетки поджелудочной повреждены, поэтому инъекции препарата становятся единственным способом контроля уровня глюкозы.
При СД второго типа нарушения возникают из-за снижения восприимчивости чувствительных к инсулину тканей. Он может вырабатываться в достаточном количестве или даже избытке, однако печень, жировая и мышечная ткань перестают воспринимать действие этого гормона. Возникает хроническая гипергликемия - повышенное содержание глюкозы в крови.
Основополагающую роль в лечении СД 2 типа играет диета с пониженным содержанием углеводов, прием препаратов для снижения уровня сахара, повышения чувствительности клеток к инсулину. Инъекции инсулина при диабете второго типа назначаются пациентам с прогрессирующим заболеванием. Как правило, это происходит, когда бета-клетки поджелудочной железы не могут справляться с выработкой эндогенного гормона, а сахаропонижающие препараты перестают давать эффект.
Диабет становится декомпенсируемым, то есть неконтролируемым, что чревато серьезными осложнениями. В этом случае на помощь приходит экзогенный инсулин - тот, который поступает извне.
Препараты для инсулинотерапии

Глюкоза раствор
- Показана при гипогликемии, недостаточности углеводного питания;
- При заболеваниях печении, коллапсе, шоке;
- Для коррекции дегидратации.
ИМЕЮТСЯ ПРОТИВОПОКАЗАНИЯ. ПЕРЕД ПРИМЕНЕНИЕМ ВНИМАТЕЛЬНО ПРОЧИТАЙТЕ ИНСТРУКЦИЮ ИЛИ ПРОКОНСУЛЬТИРУЙТЕСЬ С ВРАЧОМ
При лечении диабета используют инсулиновые препараты разных типов. У них одинаковый эффект, но они отличаются по быстродействию и продолжительности воздействия. Это необходимо, чтобы сделать лечение более физиологичным, ведь у здоровых людей уровень инсулина естественным способом повышается и понижается в течение дня.
При диабете используют инсулин четырех типов:
- Препарат быстрого действия вводят до принятия пищи. Он подействует через 15 минут и сохраняет эффект в течение 3-4 часов.
- Короткий инсулин также используют перед едой. Он сработает через 30-60 минут. Эффект сохраняется в течение 5-8 часов.
- Промежуточный инсулин срабатывает через 1-2 часа после укола. Эффект сохраняется в течение 14-16 часов.
- Длинный инсулин срабатывает через два часа после укола. Его эффект сохраняется до суток и более.
Режим терапии и дозировку препарата подбирает лечащий врач исходя из клинического случая. При СД 1 типа обычно используется базально-болюсная инсулинотерапия. Она включает препараты короткого и быстрого действия, чтобы использовать сахар из каждого приема пищи и поддерживать уровень глюкозы в норме в течение суток.
Гормон инсулин: действие, норма содержания в крови, инсулинотерапия при сахарном диабете
Инсулин – гормон, вырабатываемый в поджелудочной железе, названной так потому, что она расположена за желудком. Инсулин позволяет нашему организму использовать глюкозу для получения энергии. Глюкоза – это разновидность сахара, моносахарид (простой углевод), который содержится в многих продуктах.
После еды или перекуса в пищеварительном тракте ферменты расщепляют сложные углеводы и превращает их в глюкозу. Затем глюкоза всасывается в кровь через слизистую оболочку тонкой кишки.
Что делает инсулин с глюкозой?
Как только глюкоза попадает в кровоток, начинает работать инсулин. Гормон заставляет клетки нашего тела поглощать сахар и использовать его для производства энергии.
Также инсулин помогает сбалансировать уровень глюкозы в крови. Когда в крови слишком много глюкозы, инсулин сигнализирует организму о том, что нужно сохранить ее избыток в печени. Накопленная в клетках печени глюкоза не высвобождается до тех пор, пока ее уровень в крови не снизится, например, между приемами пищи или когда наше тело испытывает стресс, или нуждается в дополнительной энергии (во время тренировок, напряженной мыслительной работы).
Кроме печени, по «команде» инсулина избыток глюкозы накапливается в жировой (липидной) ткани, также создавая там своеобразные «депо» для быстрой компенсации потраченной энергии.
Второстепенное действие инсулина
Гормон «работает» не только с глюкозой, но и с белками, жирами и микроэлементами:
- обеспечивая процесс их нормального обмена;
- способствуя активизации синтеза аминокислот, благодаря чему повышается мышечная работоспособность;
- стимулируя активность ферментов, под действием которых избыток глюкозы превращается в гликоген;
- принимая участие в процессах регенерации (заживления) поврежденных тканей.
Немного истории
Выделенный из поджелудочной железы гормон инсулин был впервые успешно применен с лечебными целями канадским врачом, физиологом, Ф.Г. Бантингом. За это в 1923 году, в возрасте 32 лет, он был удостоен Нобелевской премии по физиологии и медицине вместе со своим шотландским коллегой, профессором Маклеодом, в лаборатории которого молодой ученый проводил опыты на собаках. Открытие инсулинотерапии полностью перевернуло подходы к лечению диабета. В честь признания заслуг Бантинга, трагически погибшего в авиакатастрофе во время второй мировой войны, в день его рождения, 14 ноября, отмечают Всемирный день борьбы с диабетом.

Фредерик Грант Бантинг – ученый, впервые получивший экстракт инсулина и успешно использовавший его в лечении диабета. Один из самых молодых лауреатов Нобелевской премии за все время ее присуждения.
Инсулин: норма содержания гормона в крови, способы повышения и снижения
Очень важно, чтобы уровень инсулина в крови всегда находился в пределах нормы. Как пониженный, так и повышенный инсулин – свидетельство нарушения метаболизма (прежде всего, углеводного обмена).
Однако определение количества выделенного в кровь гормона само по себе редко бывает достаточно информативным. Дело в том, что уровень инсулина в крови в норме может колебаться в широких пределах – от 3 до 20 мкЕд/мл у детей и до 25 мкЕд/мл у взрослых. У беременных и женщин после 60-ти лет эти границы смещены, количество гормона в норме у них колеблется от 6 до 27/36 мкЕд/мл.
Поэтому определять уровень инсулина в крови нужно вместе с уровнем глюкозы (сахара) – натощак и через определенное время после приема пищи. На основании этих показателей рассчитываются определенные индексы, которые позволяют врачу обнаружить проблему и принять меры для ее коррекции либо устранения.
Повышенный инсулин натощак при нормальном сахаре может быть следствием онкологического заболевания (аденокарциномы инсулин-продуцирующих клеток поджелудочной железы).
Излишне большое количество инсулина и нормальное количество сахара через 2 часа после приема пищи выявляют у людей с так называемым предиабетом. Обменные процессы у них идут вяло, и организм пытается ускорить метаболизм глюкозы за счет выработки повышенного количества гормона. Такая интенсивная работа со временем приводит к «износу» поджелудочной железы, в результате чего она уже не может производить не только избыточное, но и достаточное количество гормона.
Как понизить инсулин в крови
Отрегулировать норму инсулина в крови при его повышении на фоне приема пищи позволяют:
- препараты, уменьшающие инсулинрезистентность клеток организма (метформин и др.);
- нормализация нарушенного процесса ночного сна;
- дозированные занятия спортом – плавание, бег и т. д.
Кстати, при диагностике предиабета восстановление нормального ночного сна, как правило, становится важнейшим условием для похудения, возможности переносить физические нагрузки, а, главное – для восстановления гормонального обмена и устранения инсулинрезистентности. Это позволяет затормозить переход предиабета в диабет, а в ряде случаев и полностью остановить этот процесс.
Пониженный инсулин при высоком сахаре определяется тогда, когда поджелудочная железа неспособна выработать нужное количество инсулина самостоятельно, т.е. у больного развивается сахарный диабет. Такая картина может наблюдаться как при диабете 1 типа (СД1), так и при инсулиннезависимой форме заболевания. И хотя диабет второго типа (СД2) называется инсулиннезависимым, при снижении функции поджелудочной железы ниже определенных значений таким больным, как и людям с сахарным диабетом 1 типа, показано лечение инсулином.
Инсулин как средство от диабета
Инъекции инсулина могут помочь в лечении обоих типов диабета. Инъекционный инсулин при сахарном диабете действует как замена или дополнение к инсулину вашего организма. При диабете 1-го типа необходимо вводить инсулин для контроля уровня глюкозы в крови.
Многие люди с диабетом 2-го типа могут контролировать уровень глюкозы в крови с помощью приема пероральных препаратов и/или изменения образа жизни. Однако если эти методы лечения не помогают, то, как уже говорилось выше, им тоже может понадобиться инсулин.
Терапия инсулином при диабете 1-го типа
Поскольку в организме больных с данной формой заболевания практически нет собственного инсулина, его запас необходимо пополнять каждый день для поддержания стабильного уровня сахара (глюкозы) в крови. Поэтому основное лечение больных с СД1 заключается в инсулинотерапии. Все виды инсулина дают одинаковый эффект. Они имитируют естественное повышение и понижение уровня инсулина в организме в течение дня. Состав различных типов инсулина влияет на то, как быстро и как долго они работают.
- Инсулин быстрого действия: этот тип инсулина начинает работать примерно через 15 минут после инъекции. Чаще всего используется перед едой. Его эффект может длиться от трех до четырех часов.
- Инсулин короткого действия: вы вводите этот инсулин также перед едой. Короткий инсулин начинает работать через 30–60 минут после введения, его действие длится от пяти до восьми часов.
- Инсулин промежуточного действия: этот тип инсулина начинает действовать через один-два часа после инъекции, и его действие может длиться от 14 до 16 часов.
- Инсулин длительного действия или длинный инсулин: начинает действовать не раньше, чем через два часа после введения, эффект длится до 24 часов или более.
При базально-болюсном режиме терапии вводятся два вида инсулина:
- «Базальная» доза инсулина (также называемая инсулином длительного действия) позволяет клеткам тела перерабатывать сахар, обеспечивая организм энергией, необходимой для поддержания его нормального функционирования.
- В дополнение к базальному инсулину, людям с диабетом 1-го типа во время приема пищи нужен еще «болюсный» инсулин (быстродействующая доза), которая помогает правильно использовать сахар из каждого приема пищи.
Т.е., базальный инсулин поддерживает уровень сахара на желаемом уровне вне приёмов пищи и в ночные часы, чтобы обеспечить накопление фонового инсулина, а болюсный – перед приемом пищи, чтобы предотвратить скачки уровня сахара в крови после приема пищи.
Введение и дозировка
Инсулин не принимается перорально. Его необходимо водить с помощью шприца, шприц-ручки для инсулина или инсулиновой помпы. Тип инъекции и вид инсулина подбирается лечащим врачом с учетом ваших потребностей и личных предпочтений.
Физиология инсулина. Воздействие инсулина на клетку
Регуляция углеводного обмена
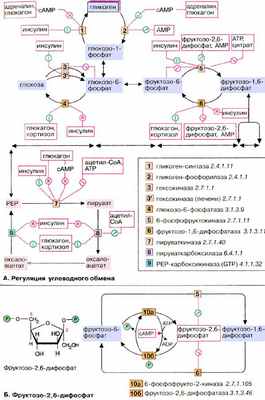
А. Регуляция углеводного обмена
У высших организмов обмен углеводов подвержен сложным механизмам регуляции, в которых участвуют гормоны, метаболиты и коферменты . Представленная здесь схема относится к печени , которая занимает в углеводном метаболизме центральное место (см. с. 302). Некоторые из представленных механизмов не действуют в других тканях.
Одной из важнейших функций клеток печени является накопление избыточной глюкозы в виде гликогена и ее быстрое высвобождение по мере метаболической необходимости (буферная функция) . После полной мобилизации запасов гликогена печень может поставлять глюкозу за счет синтеза de novo ( глюконеогенез , см. сс. 156, 232). Кроме того, как и все ткани, она потребляет глюкозу путем гликолиза. Функции накопления (синтеза) глюкозы в виде гликогена и его распада должны быть взаимосогласованы. Таким образом, совершенно невозможно одновременное протекание гликолиза и глюконеогенеза, как и синтеза и деградации гликогена. Согласование процессов обеспечивается тем, что синтез (анаболизм) и распад (катаболизм) катализируются двумя различными ферментами и контролируются независимо. На схеме показаны только эти ключевые ферменты .
Гормоны. К гормонам, которые влияют на углеводный обмен, принадлежат пептиды инсулин и глюкагон , глюкокортикоид кортизол и катехоламин адреналин (см. сс. 362, 368). Инсулин индуцирует (см. с. 120) синтез de novo гликоген-синтазы [ 1 ], а также некоторых ферментов гликолиза [ 3, 5, 7 ]. Одновременно инсулин подавляет синтез ключевых ферментов глюконеогенеза ( репрессия, [ 4, 6, 8, 9 ]). Глюкагон как антагонист инсулина действует в противоположном направлении: индуцирует ферменты глюконеогенеза [ 4, 6, 8, 9 ] и репрессирует пируваткиназу [ 7 ], ключевой фермент гликолиза. Другие аффекты глюкагона основаны на взаимопревращении ферментов и опосредованы вторичным мессенджером цАМФ (сАМР, см. с. 114). По этому механизму тормозится синтез гликогена [ 1 ] и активируется расщепление гликогена [ 2 ]. Подобным образом действует и адреналин. Торможение пируваткиназы [ 7 ] глюкагоном также обусловлено взаимопревращением ферментов.
Глюкокортикоиды, прежде всего кортизол (см. с. 362), индуцируют все ключевые ферменты глюконеогенеза [ 4, 6, 8, 9 ]. Одновременно они индуцируют ферменты деградации аминокислот и обеспечивают тем самым глюконеогенез исходными соединениями.
Метаболиты. Высокие концентрации АТФ (АТР) и цитрата тормозят гликолиз путем аллостерической регуляции фосфо фруктокиназы. Кроме того, АТФ тормозит пируваткиназу . Ингибитором пируваткиназы является ацетил-КоА. Все эти метаболиты образуются при распаде глюкозы ( торможение конечным продуктом ). АМФ (AMP), сигнал дефицита АТФ, активирует расщепление гликогена и тормозит глюконеогенез.
Важную роль в обмене веществ в печени играет фруктозо-2,6-дифосфат . Это сигнальное вещество образуется в незначительных количествах из фруктозо-6-фосфата и выполняет чисто регуляторную функцию: стимулирует гликолиз путем активации фосфофруктокиназы и подавляет глюконеогенез с помощью торможения фруктозо-1,5-дифосфатазы.
Образование и распад фруктозо-2,6-дифосфата катализируются одним и тем же белком [ 10а и б ]. В нефосфорилированной форме этот белок вызывает образование фруктозо-2,6-дифосфата [ 10а ]. После фосфорилирования цАМФ-зависимой киназой он действует как фосфатаза [ 10б ] и катализирует превращение фруктозо-2,6-дифосфата в фруктозо-6-фосфат. В присутствии адреналина и глюкагона в клетках печени повышается уровень цАМФ (см. с. 122), т.е. оба гормона воздействуют как на гликолиз, так и на глюконеогенез. Суммарным результатом является быстрое повышение уровня глюкозы в крови.
Читайте также:
