Фокально-сегментарный гломерулосклероз - эпидемиология, патогенез
Добавил пользователь Дмитрий К. Обновлено: 29.01.2026
Фокальный сегментарный гломерулосклероз (ФСГС), также известный как «фокальный гломерулярный склероз» или «фокальный узловой склероз». гломерулосклероз,” [1] гистопатологическое открытие рубцов (склероз) из клубочки и повреждение почек подоциты. [2] [3] Этот процесс нарушает фильтрующую функцию почек, что приводит к потере белка с мочой. [3] ФСГС является основной причиной избыточной потери белка -нефротический синдром - у детей и взрослых. [4] Признаки и симптомы включают: протеинурия, задержка воды и отек. [2] [5] Почечная недостаточность является частым длительным осложнением болезни. [5] [6] ФСГС можно классифицировать как первичный и вторичный в зависимости от того, какой конкретный токсический или патологический стрессор можно определить как причину. [7] [8] Диагноз устанавливается на основании биопсии почки, [2] [9] и лечение состоит из глюкокортикоидов и других иммуномодулирующих препаратов. [10] Ответ на терапию варьирует, у значительной части пациентов развивается терминальная стадия почечной недостаточности. [5] По оценкам, FSGS встречается у 2-3 человек на миллион, причем более высокому риску подвергаются мужчины и африканцы. [11] [12]
Содержание
Признаки и симптомы
Наиболее частые симптомы являются результатом ненормальной потери белка из клубочки почек, и включают: [2] [5]
- Пенистая моча (из-за избытка белка)
- Избыточное удержание воды (питтинг отек, из-за потери сыворотки альбумин )
- Восприимчивость к инфекции (из-за потери сыворотки антитела )
Общие признаки также связаны с потерей белков крови клубочками почек, в том числе: [2] [5] [9]
- Белок в моче (Протеинурия , часто в нефротический диапазон> 3,5 г / день)
- Низкий уровень сывороточного альбумина ( Причины и патофизиология
Почечный клубочки состоит из набора капилляров, из которых кровь фильтруется в Пространство Боумена. Большие молекулы, такие как белки, обычно слишком велики для фильтрации, и вместо этого они остаются в капиллярах.
ФСГС - это в первую очередь заболевание почек. клубочки, узел фильтрации ионов и растворенных веществ. [13] [14] Подоциты - это специализированные клетки, выстилающие Капсула Боумена которые способствуют созданию фильтрующего барьера, предотвращая фильтрацию молекул размером более 5 нм. [15] ФСГС вызывает повреждение подоцитов почек, в результате чего более крупные молекулы, в первую очередь белки, фильтруются и теряются через почки. [16] [17] Таким образом, многие признаки и симптомы ФСГС связаны с потерей белка.
По гистологии ФСГС проявляется повреждением (склероз ) к сегментам клубочков; кроме того, поражается только часть клубочков. [18] [19] Фокальный и сегментарный характер заболевания, наблюдаемый при гистологическом исследовании, помогает отличить ФСГС от других типов заболевания. гломерулярный склероз. [19]
ФСГС можно классифицировать по предполагаемой причине повреждения подоцитов. Первичная ФСГС включает случаи, в которых причина не может быть легко идентифицирована. [20] Предполагается, что в этих случаях набор неустановленных факторов циркуляции в крови способствует повреждению подоцитов. [20] [21]
Вторичный ФСГС вызывается идентифицируемым стрессом или токсином, который повреждает подоциты. [20] Многие причины вторичного ФСГС способствуют повреждению подоцитов из-за гиперфильтрации, что является сценарием избыточной фильтрации почечными клубочками. [22] Гиперфильтрация может быть вызвана, помимо других причин, ожирением или потерей контралатеральной почки. [22]
Вторичный ФСГС также может быть вызван токсинами, включая стероиды и героин. [23] [24]
В ФСГС участвует ряд генов. К ним относятся: НПХС1, который кодирует белок нефрин что способствует созданию фильтрующего барьера; [25] НПХС2, который кодирует белок подоцин обнаруживается в подоцитах; [26] и INF2, который кодирует актин-связывающий белок формин. [27]
Диагностика
Диагноз ФСГС ставится на основании биопсии почек, которая включает не менее 15 серийных разрезов, по меньшей мере, 8 клубочков. [28] [29] Гистологические особенности включают: склероз (рубцевание) части (в среднем: 15%) гломерулярного пространства, при этом только часть клубочков проявляет склероз. [30]
Другие тесты, полезные для диагностики, включают белок мочи, анализ мочи, сывороточный альбумин и липиды сыворотки. [2] Клиническая картина протеинурии, низкого уровня белка в крови (альбумин, антитела) и высокого холестерина в крови может подтвердить диагноз ФСГС, хотя они не помогают отличить ФСГС от других причин протеинурия. [5] [9]
Классификация
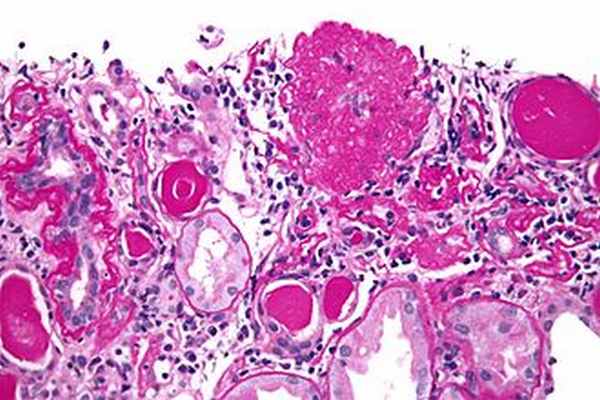
Микрофотография коллапсирующего варианта ФСГС (коллапсирующая гломерулопатия). Рухнул клубочки отображается вверху справа от центра. PAS пятно. Биопсия почки.
Пять взаимоисключающих вариантов очагового сегментарного гломерулосклероза можно выделить по патологическим данным, обнаруженным на почечная биопсия: [31]
- Сворачивающийся вариант
- Вариант поражения кончика клубочка
- Сотовый вариант
- Перихилярный вариант
- Не указано иное (БДУ) вариант.
Признание этих вариантов может иметь прогностический значение у лиц с первично-очаговым сегментарным гломерулосклерозом. Вариант коллапса связан с более высокой скоростью развития терминальная стадия почечной недостаточности, тогда как вариант с поражением кончика клубочка имеет низкую скорость прогрессирования до терминальной стадии почечной недостаточности у большинства пациентов. [32] Клеточный вариант демонстрирует клиническую картину, аналогичную коллапсу и варианту кончика клубочка, но имеет промежуточные результаты между двумя другими вариантами. [32]
Лечение первой линии при первичном ФСГС состоит из противовоспалительных препаратов. [10] Конкретно, глюкокортикоиды начинаются у пациентов с нефротический протеинурия диапазона (> 3,5 г / сут). [33] [34] Для пациентов, у которых сохраняется протеинурия нефротического диапазона, несмотря на глюкокортикоиды, или для пациентов с непереносимостью глюкокортикоидов ингибиторы кальциневрина (например, такролимус). [34] Успешное лечение определяется как снижение протеинурии до субнефротических значений. [6]
Лечение вторичного ФСГС включает лечение конкретного токсического или стрессового агента. [33]
Прогноз
Большинство нелеченных случаев ФСГС прогрессируют до терминальная стадия заболевания почек. [35] Важные прогностические факторы включают степень протеинурии и первоначальный ответ на терапию.
Пациенты с протеинурией нефротического диапазона (> 3,5 г / день) имеют более 50% прогрессирования до терминальной стадии заболевания почек через 10 лет. [6] Только 15% пациентов с субнефротическим диапазоном протеинурии прогрессируют до терминальной стадии почечной недостаточности через 10 лет. [6]
Первоначальный ответ на терапию также определяет долгосрочные результаты. Те, у кого определен «полный ответ», обычно проявляют протеинурию [36] Либо полный, либо частичный ответ связан с выживаемостью почек 80% через 10 лет по сравнению с примерно 50% среди пациентов, не ответивших на лечение. [36]
Эпидемиология
На ФСГС приходится 35% всех случаев нефротического синдрома, что делает его одной из наиболее частых причин нефротического синдрома в США. [7] На ФСГС приходится 2% всех случаев почечной недостаточности. [4] У афроамериканцев вероятность развития ФСГС в 4 раза выше. У мужчин вероятность развития ФСГС примерно в 2 раза выше, чем у женщин. [11]
Фокально-сегментарный гломерулосклероз - этиопатогенетические, клинические и морфологические особенности Текст научной статьи по специальности «Клиническая медицина»
Нефротический синдром: гистопатологическая дифференциальная диагностика. Часть 3: мембранозно-пролиферативный гломерулонефрит, IgA нефропатия, диабетическая нефропатия, амилоидоз, пострансплантационная нефропатия
Текст научной работы на тему «Фокально-сегментарный гломерулосклероз - этиопатогенетические, клинические и морфологические особенности»
© Петросян Э.К., 2006
ФОКАЛЬНО-СЕГМЕНТАРНЫЙ ГЛОМЕРУЛОСКЛЕРОЗ - ЭТИОПАТОГЕНЕТИЧЕСКИЕ, КЛИНИЧЕСКИЕ И МОРФОЛОГИЧЕСКИЕ ОСОБЕННОСТИ
Российский государственный медицинский университет, Москва
Среди причин развития нефротического синдрома (НС) в детском возрасте, фокально-сегментарный гломерулосклероз (ФСГС) занимает второе место. ФСГС клинически характеризуется протеинурией, как правило, неселективной, часто в сочетании с артериальной гипертензией и гематурией и быстрым развитием почечной недостаточности [1, 2].
Впервые ФСГС был описан в 1957 г. Rich [3]. С тех пор были опубликованы сотни случаев с клинической и гистологической характеристикой ФСГС, преследовавшие цель раскрыть патогенетические механизмы. Однако, несмотря на накопленный опыт, патогенетические механизмы ФСГС не установлены. ФСГС остается заболеванием со «многими масками», как высказывался V.D'Agati [4] в 1994 г., и его рассматривают как «загадку» [5]. ФСГС у детей и подростков является проявлением большого числа первичных и вторичных заболеваний почек. Первичный ФСГС - главная причина стероидрезистентного НС у детей (76%) и только в 55% случаев встречается у взрослых [6]. В последнее время отмечается увеличение частоты встречаемости ФСГС, что, вероятно, связано с новыми этиологическими и экологическими факторами 9. Причем частота заболеваемости и тяжесть ФСГС гораздо выше у африканцев и испанцев 13.
Основным проявлением первичного ФСГС является изолированная протеинурия, достигающая уровня нефротической с развитием клиники полного и неполного НС, нередко в сочетании с микро/макрогематурией, артериальной гипертен-зией. Заболевание нередко может начинаться с изолированной протеинурии и/или гематурии, которые длительно персистируют и впоследствии могут привести к развитию полного НС, как правило, резистентного к иммуносупрессивной терапии. По данным различных авторов, артериальная гипертензия при ФСГС встречается в 25-50% случаев, гематурия - в 25-80% [8]. ФСГС имеет персистирующее, рецидивирующее и прогрессирующее течение, часто с исходом в ХПН. Прогноз заболевания более благоприятный у больных с изолированной протеинурией [1, 2, 15].
Известно, что большинство случаев ФСГС спорадические, но также установлены случаи семейных
форм. Причиной развития семейного ФСГС является мутация генов, кодирующих компоненты подоцита. Среди наиболее изученных следует выделить гены нефрина и подоцита. К генетически детерминированным заболеваниям также относятся синдромы Де-нис-Драш и Фрайзер, при которых отмечается мутация транскрипционного фактора WT1. Вторичные формы ФСГС отмечаются на фоне метаболических нарушений, уменьшения почечной массы, инфекций. Исходя из столь разнообразных причин, приводящих к формированию ФСГС, в настоящее время создана классификация ФСГС Gusmano, 2004).
Классификация фокально-сегментарного гломерулосклероза
1. Первичный ФСГС (или идиопатический):
- гломерулярный тип изменений.
2. Вторичный ФСГС.
2.1. На фоне потери почечной массы:
- другие вирусные агенты.
2.3. Токсические препараты:
- нестероидные противовоспалительные препараты;
2.4. Метаболические нарушения:
2.5. Генетические факторы:
- мутация гена NPHS1;
- мутация гена NPHS2;
- мутация гена WT1;
- мутация гена а-актинин-4.
2.6. Исход других гломерулярных заболеваний.
Патогенез ФСГС так же сложен, как причины,
вызывающие его. Ведущую роль в патогенезе
идиопатического ФСГС играют Т-лимфоциты. У больных ФСГС обнаружено повышение концентрации многих цитокинов. Но самым значимым фактором в патогенезе ФСГС рассматривают фактор проницаемости (ФП), который, как считают, является продуктом Т-клеток [16]. Однако, вероятно, ФП - это группа белков, изменяющих проницаемость клубочка. Предположение причастности ФП в развитии ФСГС подтвердилось многими наблюдениями: частое повторное развитие ФСГС в трансплантированной почке [17], у больных с наличием ФП в сыворотке, эффект от применения плазмафереза [18], уменьшение протеи-нурии после использования иммуносорбционных белков [19]. Кроме того, обсуждается гуморальный аспект в метаболизме ФП. Так, отмечалось исчезновение протеинурии через год после трансплантации почки у реципиента с ФСГС [20], при отсутствии сывороточного ФП, а также передача ФП от матери к ребенку [21].
В настоящее время установлены механизмы развития ФСГС у больных с потерей почечной массы. Как известно, при уменьшении почечной паренхимы отмечается гипертрофия и гиперфильтрация в действующих клубочках. Эти же эффекты отмечаются при неправильном питании, с избыточным употреблением белков и соли, при увеличении концентрации некоторых ростовых факторов, таких как инсулиноподобный гормон роста, андрогенов, глюкокортикоидов. Также имеют значение генетические факторы. Заключительным шагом гипертрофии и гиперфильтрации является экспрессия ряда лимфокинов, обусловливающих склероз ткани [22].
Изменение структуры подоцита и его функции - явный фактор развития ФСГС. Подоциты - высоко специализированные клетки, функция которых заключается в синтезе некоторых белков ба-зальной мембраны, регуляции растяжимости клу-бочкового капилляра, ограничении прохождения отрицательно заряженных белков. При гломеру-лярных заболеваниях, характеризующихся высокой протеинурией, отмечаются выраженные структурные изменения подоцита в виде диффузного «сглаживания» ножек подоцитов, смещения щелевой диафрагмы к апикальной части подоцита и отделение подоцита от базальной мембраны [23]. Определение подоцитов в моче отмечалось у больных в активную стадию заболевания [24]. Синап-топодин, один из компонентов подоцита и тесно связанный с актиновой частью последнего, полностью исчезает в склерозированной области при ФСГС. GLEPP1 - рецептор, экспрессирующийся на апикальной поверхности подоцита. Его отсутствие обнаружено в склеротических областях при ФСГС. Вероятно, снижение его экспрессии предшествует процессу склероза. Другой компонент подоцита - подокаликсин - присутствует на апикальной части подоцита; его экспрессия также
снижена при ФСГС 25. В то же время при ФСГС остается совершенно сохранной экспрессия дистрогликанов, в отличие от заболевания с минимальными изменениями [28]. Все эти находки позволяют рассматривать нарушения в подоците как этиологический фактор в возникновении ФСГС. Нарушение структуры подоцита приводит к нарушению его функции и активации процессов апоптоза. Апоптоз, обусловливающий подоцито-пению, предшествует мезангиальной экспансии. Одним из факторов, усиливающих апоптоз, является TGFpl посредством активации различных молекул [29]. Во многих экспериментальных исследованиях отмечалось увеличение соотношения проапоптических (Вах) к противоапоптическим (Вс1) молекулам [30]. И, наконец, мутации мито-хондриальной ДНК, обнаруженные в подоците у пациентов с ФСГС, могут привести к нарушению окислительных процессов в клетке или первичной митохондриальной дисфункции 31. Все эти данные приводят к возникновению одного вопроса: чем является подоцит - «преступником» или «жертвой»?
К настоящему времени накоплено достаточно информации о факторах, индуцирующих склероз. Лидирует среди множества медиаторов по своей просклеротической функции ангиотензин II (А^П), влияющий на экскрецию тромбоцитарно-го фактора роста (PDGE), трансформирующего фактора роста (TGFP) и активацию ингибитора активатора плазминогена (РА11). Все эти факторы посредством разнообразных механизмов ведут к накоплению экстрацеллюлярного матрикса [34]. Более того, исследования последних лет продемонстрировали влияние альдостерона на прогресси-рование ФСГС, который вызывал фиброз почечной ткани с помощью нескольких механизмов [16]. Помимо дисрегуляции между синтезом и деградации экстрацеллюлярного матрикса, значительную роль в прогрессировании болезни играют тубулоинтерстициальные повреждения. Дефицит васкулоэндотелиального фактора роста (VEGF), регулирующего рост сосудов, также рассматривается как профибротический фактор [35, 36]. Кроме того, повреждение тубулоинтерстициальной ткани может быть обусловлено белковой перегрузкой. Высокая протеинурия, как известно, непосредственно повреждает эпителий канальцев, и в свою очередь стимулирует синтез вазоактивных молекул, таких как МСР1 (моноцитарный хемоат-трактантный белок 1), эндотелин 1 и остеопонтин [37]. К факторам прогрессирования также относят гиперлипидемию, существующую у пациентов с ФСГС. Известно, что липиды низкой плотности, патогномоничные для ФСГС, могут оказывать профибротическое действие, путем активации выработки вазоактивных метаболитов (эндотелина 1 и ренина), процессов апоптоза и синтеза профиб-ротических цитокинов (TGFp, PDGF). Следствием
всех этих процессов является синтез белков мезан-гиального матрикса и коллагенов [38].
При ФСГС различают несколько гистологических вариантов склероза: периферический (Tip lesions) с адгезией париетальных эпителиальных листков, так называемый «Ы1аг»-склероз - гиали-ноз васкулярного полюса, коллапсный гломеруло-склероз и клеточный вариант, характеризующийся сегментарной пролиферацией эпителиальных клеток, ранним склерозом и эндокапиллярной гиперк-леточностью [34]. Как указывают авторы, «Tip lesion» чаще встречается у детей и подростков и более чувствителен к иммуносупрессивной терапии. Для ФСГС, как правило, характерна стероидрезистент-ность. Однако положительный ответ на лечение стероидами наблюдается у детей с периферическим ва-
риантом, в отличие от hilar и смешанного поражения гломерул. В последнее десятилетие в качестве лечения ФСГС успешно используются ингибиторы ангиотензин - превращающего фермента (АПФ). Терапевтический эффект ингибиторов АПФ обусловлен снижением фильстрационного давления, синтеза экстрацеллюлярного матрикса, ингибици-ей факторов роста, таких как PDGF, TGF0 и PAI1, тем самым увеличивая деградацию матрикса [39].
ФСГС является исходом многих патологических процессов в клубочке. Разнообразные этиологические факторы - метаболические, инфекционные, генетические - могут быть причинами первичного и вторичного ФСГС. Столь широкий диапазон причин усложняет выработку терапевтических тактик, которые не всегда бывают эффективными.
1. Папаян А.В., Савенкова Н.Д. Клиническая нефрология детского возраста. - СПб., 1997. - 718 с.
2. Рябов С.И. Нефротический синдром. - СПб., 1992. - 352 с.
3. Rich A.R. // Bull. John. Hopkins Hosp. - 1957.
- Vol. 100. - P. 173-186.
4. D'Agati V.D. // Kidney Int. - 1994. - Vol. 46. -P. 1223-1241.
5. Cameron J.S. // Kidney Int. - 1996. - Vol. 57. -P. 119-131.
6. Kohler H.P., Grant P.J. // N. Engl. J. Med. -2000. - Vol. 342. - P. 1792-1801.
7. Bonilla-Felix M.,Parra C., Ferris M. et al. // J. Am. Soc. Nephrol. - 1997. - Vol. 8. - P. 82-86.
8. Gulati S.,Sharma A.P., Sharma R.K., Gupta A. // Am. J. Kidney Dis. - 1999. - Vol. 34. - P. 646-650.
9. Haas M., Spargo B.H., Coventry S. // Am. J. Kidney Dis. - 1995. - Vol. 26. - P. 740-750.
10. Haas M., Meehan S.M., Karrison T.G., Spargo B.H. // Am. J. Kidney Dis. - 1997. - Vol. 30. -P. 621-631.
11. Bakir AA., Bazilinski M.G.,Rhee H.L. et al. // Arch. Intern. Med. - 1989. - Vol. 149. - P. 182-184.
12. Ingulli E., Tejani A. // Pediatr. Nephrol. -1991. - Vol. 5. - P. 393-397.
13. Korbet S.M., Genchi R.M.,Borok R.Z., Schwartz M.M. // Am. J. Kidney Dis. - 1996. - Vol. 5. -P. 647-651.
14. Naprtcs: 1998 Annual Report. - Naprtcs, 1998.
15. Gulasi S., Sharma A.P., Sharma R.K., Gupta A. // Am. J. Kidney Dis. - 1999. - Vol. 34. - P. 646-650.
16. Нефрология. Руководство для врачей. / Под ред. И.Е. Тареевой. - М., 2000. - 688 с.
17. Epstein M. // J. Hypertens. - 2001. - Vol. 19.
18. Artero M.L., Sharma R., Savin V.J., Vincenti F. // Am. J. Kidney Dis. - 1994. - Vol. 23. - P. 574-578.
19. Dantal J., Bigot E., Bogers W. et al. // N. Engl. J. Med. - 1994. - Vol. 330. - P. 7-10.
20. Rea R., Smith C.,Sandhu K. et al. // Nephrol. Dial. Transplant. - 2001. - Vol. 16. - P. 416-417.
21. Kemper M.J, Wolf G, Muller-Wiefel D.E. // N. Engl. J. Med. - 2001. - Vol. 344. - P. 386-387.
22. Menin C., Scaini M.C., De Salvo G.H. et al. // J. Natl. Cancer Inst. - 2006. - Vol. 98. - P. 285-288.
23. Kerjaschki D. // J. Clin. Invest. - 2001. - Vol. 108. - P. 1583-1587.
24. Hara M.,Yanagihara T.,Kihara I. // Nephron.
- 2001. - Vol. 89. - P. 342-347.
25. Mundel P., Shankland S.J. // J. Am. Soc. Nephrol. - 2002. - Vol. 13. - P. 3005-3015.
26. Ohtaka A., Ootaka T., Sato H. et al. // Am. J. Kidney Dis. - 2002. - Vol. 39. - P. 475-485.
27. Ohtaka A., Ootaka T., Sato H., Ito S. // Nephrol. Dial. Transplant. - 2002. - Vol. 17. - P. 11-15.
28. Devarajan P., Spitzer A. // Am. J. Kidney Dis.
- 2002. - Vol. 39. - P. 625-636.
29. Schiffer M., Bitzer M., Roberts I.S. et al. // J. Clin. Invest. - 2001. - Vol. 108. - P. 807-816.
30. Wang W., Tzanidis A., Divjak M. et al. // J. Am. Soc. Nephrol. - 2001. - Vol. 12. - Vol. 12. -P. 1422-1433.
31. Doleris L.M., Hill G.S., Chedin P. et al. // Kidney Int. - 2000. - Vol. 58. - P. 1851-1558.
32. Hotta O., Inoue C.N., Miybayashi S. et al. // Kidney Int. - 2001. - Vol. 59. - P. 1236-1243.
33. Yamagata K., Muro K., Usui J. et al. // J. Am. Soc. Nephrol. - 2002. - Vol. 13. - P. 1816-1823.
34. Fogo A.B. // Am. J. Kidney Dis. - 2000. - Vol. 35. - P. 179-188.
35. Choi Y.J., Chakraborty S., Nguyen V. et al. // Hum. Pathol. - 2000. - Vol. 31. - P. 1491-1497.
36. Wardle E.N. // Nephrol. - 1999. - Vol. 83. -P. 106-110.
37. Zoja C, Benigni A., Remuzzi G. // Exp. Nephrol. 39. Fogo A.B. // Kidney Int. - 2001. - Vol. 59. - 1999. - Vol. 7. - P. 420-428. P. 804-819.
38. Joles JA., Kunter U., Janssen U. et al. // J. Am. Soc. Nephrol. - 2000. - Vol. 11. - P. 669-683.
© nonymKuna O.E., MenydKoea O.r, 2007
О.Б. Полушкина 12, О.Г. Желудкова 2
СОВРЕМЕННОЕ ПРЕДСТАВЛЕНИЕ ОБ ЭПЕНДИМОМАХ У ДЕТЕЙ: ЭПИДЕМИОЛОГИЯ, ДИАГНОСТИКА, ЛЕЧЕНИЕ
1 Российская детская клиническая больница Росздрава, 2 Федеральный научно-клинический центр детской гематологии, онкологии и иммунологии Росздрава, Москва
Эпендимарные опухоли (ЭО) - группа опухолей, возникающих из клеток эпендимы (эпенди-моцитов и субэпендимарных клеток) и локализующихся в различных отделах ЦНС [1].
Наиболее часто Э у детей локализуются в задней черепной ямке (60-70%), реже - в боковых желудочках (25%) и спинном мозге (5%) [4, 5]. Крайне редко опухолью поражается III желудочек (10%) [6]. В IV желудочке она растет экзофитно и может распространяться через отверстия нижнего угла и боковых карманов ромбовидной ямки в субарахноидальное пространство [7]. В боковых желудочках, как правило, поражаются только пе-ривентрикулярные отделы. Э спинного мозга часто сочетаются с нейрофиброматозом II типа [1, 2]. Э могут располагаться интрамедуллярно, в области корешков конского хвоста и filum terminale, а также возможно возникновение эктопических Э в парасакральной области [1, 2, 8]. Метастазирова-ние может выявляться как при анапластической Э, так и при Э II степени злокачественности. При первичной диагностике метастатическое распространение Э по ликворной системе выявляется в 5-30% случаев [2, 9, 10].
Э относятся к группе нейроэпителиальных опухолей.
В соответствии с гистологической классификацией, предложенной ВОЗ, выделяют следующие варианты Э [2, 8, 11]:
2. Анапластическая (злокачественная) эпендимома.
3. Миксопапиллярная эпендимома (развивается только в области filum terminale).
4. Субэпендимома (имеет в своей структуре гистологические признаки, типичные как для эпендимом, так и для астроцитом).
Классификация Э предполагает разделение их на 3 степени (Grade) злокачественности.
Злокачественные варианты Э у детей встречаются чаще, чем доброкачественные, и малигниза-ции подвержены все варианты Э, за исключением миксопапиллярных [8].
Существует 3 морфологических критерия, наличие которых позволяет определить степень злокачественности: пролиферация эндотелия, митозы, некрозы. Отсутствие всех критериев определяет I степень злокачественности опухоли, наличие одного критерия злокачественности - II степень, наличие двух и более критериев - III степень злокачественности.
Для определения распространенности опухолевого процесса используется классификация по Chang C., с помощью которой оценивают М-ста-дию заболевания:
М0 - признаков субарахноидальных или гематогенных метастазов нет;
М1 - опухолевые клетки в ликворе;
М2 - метастазы в пределах головного мозга;
М3 - метастазы в спинной мозг.
Предполагается проведение следующих методов для установления диагноза опухоли головного мозга (ОГМ), в том числе и Э: оценка клинических симптомов, методы нейровизуализации, гистологическое исследование опухоли. Для определения распространенности опухолевого процесса выполняют цитологическое исследование ликвора на наличие опухолевых клеток, МРТ спинного мозга и КТ/МРТ головного мозга без и с контрастным усилением (КУ).
Клинические проявления у детей с Э зависят в большей степени от места расположения опухоли.
Фокально-сегментарный гломерулосклероз - эпидемиология, патогенез
Фокально-сегментарный гломерулосклероз - эпидемиология, патогенез
Фокально-сегментарный гломерулосклероз — одна из важных причин первичного нефротического синдрома. Именно он чаще других гломерулопатий у детей заканчивается терминальной почечной недостаточностью. Среди причин терминальной почечной недостаточности у детей ему принадлежит второе место после пороков развития почек и мочевых путей. При биопсии обнаруживают спадение части (отсюда — сегментарный) капиллярных петель клубочка со склерозом мезангия. Поначалу поражение захватывает не все клубочки (отсюда — фокальный), и первыми страдают юкстамедуллярные нефроны.
Часто видны атрофированные канальцы и участки интерстициального фиброза — эти находки позволяют предположить фокально-сегментарный гломерулосклероз даже без явных признаков склероза в клубочках (табл. 8.3). У детей фокально-сегментарный гломерулосклероз, как правило, проявляется нефротическим синдромом, причем в 75—80% случаев лечение глюкокортикоидами не дает эффекта. В большинстве случаев причину установить не удается (первичный, или идиопатический, фокально-сегментарный гломерулосклероз), но в то же время известен ряд факторов, действие которых может привести ко вторичному фокально-сегментарному гломерулосклерозу.
При вторичном поражении протеинурия необязательно достигает величин, характерных для нефротического синдрома. Вторичный фокально-сегментарный гломерулосклероз в таких случаях может развиться в результате компенсаторной реакции на уменьшение числа функционирующих нефронов: в сохранившихся нефронах усиливается клубочковая фильтрация за счет повышения кровотока в клубочках, возникает их гипертрофия. В итоге это приводит к склерозу оставшихся клубочков. Такое развитие событий возможно при олигомеганефронии, односторонней агенезии или резекции почки, дисплазии почек, рефлюкс-нефропатии, некрозе коркового вещества почек.
Повышенная фильтрация в отдельных нефронах может играть роль в развитии фокально-сегментарного гломерулосклероза при серповидноклеточной анемии, тяжелом ожирении, цианотических пороках сердца, артериальной гипертонии. Любое прогрессирующее поражение клубочков может привести к фокально-сегментарному гломерулосклерозу, хотя в таких случаях часто бывают и другие морфологические изменения, характерные для основного заболевания. Наконец, фокально-сегментарный гломерулосклероз может развиться при ВИЧ-нефропатии и героиновой нефропатии.
Эпидемиология фокально-сегментарного гломерулосклероза
Первичный фокально-сегментарный гломерулосклероз обычно начинается у детей 2—7 лет. Мальчики, особенно младшего возраста, болеют несколько чаще. Кроме того, заболеваемость выше среди американских негров. В последние годы заболевание стало встречаться чаще как у детей, так и у взрослых, причем это нельзя объяснить только учащением случаев ВИЧ-нефропатии. Изредка фокально-сегментарный гломерулосклероз может быть наследственным. Так, фокально-сегментарный гломерулосклероз может наблюдаться у больных с наследственным (аутосомно-рецессивным) глюкокортикоидрезистентным нефротическим синдромом (ген NPHS2, сегмент 1q25—q31). Описан наследственный (аутосомно-доминантный) фокально-сегментарный гломерулосклероз, связанный с мутациями в сегментах 11q21—q22 и 19q13.
Патогенез фокально-сегментарного гломерулосклероза
Этиология фокально-сегментарного гломерулосклероза неизвестна. Высокая частота рецидивов в пересаженной почке, часто развивающихся в первые же часы после операции, говорит о роли неких системных факторов. Природа этих факторов и причины их образования неясны. У детей, чьи матери страдали фокально-сегментарным гломерулосклерозом во время беременности, при рождении отмечается нефротический синдром, но через несколько недель он исчезает без всякого лечения. Разработаны биологические пробы, основанные на том, что плазма больных фокально-сегментарным гломерулосклерозом увеличивает проницаемость клубочкового фильтра крыс для альбумина.
В ряде работ отмечалось, что если это свойство плазмы у реципиентов почки постоянно сохраняется, то риск рецидива болезни после трансплантации почки повышен; впрочем, в некоторых других работах это не подтвердилось. Некоторые специалисты считают болезнь минимальных изменений и фокально-сегментарный гломерулосклероз вариантами одного и того же заболевания, отличающимися степенью тяжести. Стоит также отметить, что гломерулосклероз может быть не столько причиной, сколько следствием протеинурии.

Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Фокально-сегментарный гломерулосклероз: современное состояние проблемы
Одним из наиболее прогностически неблагоприятных вариантов гломерулопатии является фокально-сегментарный гломерулосклероз (ФСГС), который выявляется при нефробиопсии у 5-20% больных с нефротическим синдромом (НС) и у 15% взрослых больных с хроническим гломерулонефритом. ФСГС рецидивирует в трансплантированной почке у 30-50% больных. Среди взрослых больных ФСГС преобладают мужчины. Плохой прогноз ФСГС объясняется неоднородностью заболевания и усугубляется плохим ответом на лечение. По современным данным ФСГС характеризуется склерозом мезангиальной матрицы, гиалинозом, повреждением капилляров, увеличением пенистых клеток и их адгезией между гломерулярным пучком и капсулой Боумена. В 2004 году было предложено следующие гистологические варианты ФСГС: верхушечный, перихилярный, коллабирующий, клеточный и классический. Каждый гистологический вариант ФСГС различается по этиологии, ответу на лечение и по прогнозу. Клиническая диагностика первичного ФСГС должна базироваться на исключении вторичных причин заболевания. Очаговые склеротические изменения в клубочках могут быть вызваны разными факторами и встречаться при различных состояниях, в том числе, и при уже имеющейся патологии почек. По данным международных рекомендаций при терапии ФСГС следует ориентироваться на величину суточной протеинурии. Для больных с ФСГС без выраженной протеинурии рекомендуется использование ингибиторов ангиотензинпревращающего фермента (иАПФ) или блокаторов рецепторов ангиотензина II (БРА). При ФСГС и НС наряду с иАПФ или БРА II используется иммуносупрессивная терапия. Взрослым больным глюкокортикоиды (ГК) назначаются ежедневно в один прием в дозе 1 мг/кг сутки, максимальная доза составляет 80 мг при ежедневном приеме и 120 мг при альтернирующем режиме. Резистентность к ГК констатируется при отсутствии эффекта через 16 недель. При наличии противопоказаний или непереносимости ГК используется ингибиторы кальцинейрина. Рекомендуемая начальная доза циклоспорина составляет 2мг/кг/сутки, принимается два раза в сутки с постепенным увеличением до 3,5-4 мг/кг/сутки. Длительность терапии при удовлетворительной переносимости циклоспорина составляет более шести месяцев. После достижения полной ремиссии дозу циклоспорина снижают постепенно по 0,5 мг/кг/сутки до минимально эффективной дозы (1,5-2 мг/кг/сутки) и проводят такую поддерживающую терапию в течение 1-2 лет. Возможен вариант терапии с использованием более низких доз ГК и циклоспорина, либо комбинация микофенолата мофетила с высокой дозой дексаметазона.
Ключевые слова
Об авторах
Кыргызская государственная медицинская академия имени И.К. Ахунбаева; ГОУ ВПО Кыргызско-Российский Славянский университет
Кыргызстан
Илхом Торобекович Муркамилов
ФГАОУ ВО Первый Московский государственный медицинский университет имени И.М. Сеченова
Россия
Москва
Конфликт интересов: Moscow
Список литературы
1. Saleem M.A. Molecular stratification of idiopathic nephrotic syndrome. Nat Rev Nephrol. 2019; 15: 750–765. DOI:10.1038/s41581-019-0217-5
2. Чеботарева Н.В., Бобкова И.Н., Непринцева Н.В. и др. Мочевые биомаркеры повреждения подоцитов: значение для оценки течения и прогноза хронического гломерулонефрита. Терапевтический архив. 2015; 6(87): 34-39. DOI: 10.17116/terarkh201587634-39
4. Beaudreuil S., Lorenzo H.K., Elias M. et al. Optimal management of primary focal segmental glomerulosclerosis in adults. Int J Nephrol Renovasc Dis. 2017; 10: 97–107. Published 2017 May 10. DOI:10.2147/IJNRD.S126844
7. Li M., Alfieri C.M., Morello W. et al. Assessment of increased glomerular permeability associated with recurrent focal segmental glomerulosclerosis using an in vitro model of the glomerular filtration barrier. Journal of Nephrology. 2019; 1-9. DOI:10.1007/s40620-01900683-2
8. Мельник А.А. Фокально-сегментарный гломерулосклероз: генетический анализ и целевая терапия. Почки. 2018; 7(1): 35-49. DOI:10.22141/2307-1257.7.1.2018.122218.
11. Wharram B.L., Goyal M., Wiggins J.E. et al. Podocyte depletion causes glomerulosclerosis: diphtheria toxin-induced podocyte depletion in rats expressing human diphtheria toxin receptor ransgene. J Am Soc Nephrol. 2005; 16(10): 2941-52. DOI:10.1681/ASN.2005010055
12. Hildebrandt F. Genetic kidney diseases. Lancet. 2010; 10: 375(9722): 1287-1295. DOI:10.1016/S0140-6736(10)60236-X
13. Игнатова М.С., Длин В.В. Нефротический синдром: прошлое, настоящее и будущее. Рос вестн перинатол и педиатр 2017; 62:(6): 29–44. DOI:10.21508/1027–4065–2017–62–6–29–44
14. Sánchez de la Nieta M.D., Arias L.F., de la Torre M. et al. Familial focal and segmentary hyalinosis. Nefrologia. 2003;23(2):172-6. PMID: 12778884. [in Spanish]
18. Yu D., Petermann A., Kunter U. et al. Urinary podocyte loss is a more specific marker of ongoing glomerular damage than proteinuria. Journal of the American Society of Nephrology. 2005; 16: 6: 17331741. DOI:10.1681/ASN.2005020159
23. Самусева Е.С. Первичный фокальный сегментарный гломерулосклероз (ФСГС): проблемы патоморфологической диагностики. Український журнал нефрології та діалізу. 2011; 2(30): 52-60
31. De Zeeuw D., Remuzzi G., Parving H.H. et al. Proteinuria, a target for renoprotection in patients with type 2 diabetic nephropathy: lessons from RENAAL. Kidney international. 2004; 65: 6: 2309-2320. DOI:10.1111/j.1523-1755.2004.00653.x
33. Samuel S., Bitzan M., Zappitelli M. et al. Canadian Society of Nephrology Commentary on the 2012 KDIGO clinical practice guideline for glomerulonephritis: management of nephrotic syndrome in children. American Journal of Kidney Diseases. 2014; 63: 3: 354-362
34. Ныркова П.А., Савенкова Н.Д. Исследования эффективности цитостатической терапии часто рецидивирующего, гормонозависимого и со стероидной токсичностью нефротического синдрома у детей. Нефрология. 2015; 19(1): 30-40
35. Савенкова Н.Д, Папаян А.В. Нефротический синдром в практике педиатра. С-Пб., Эскулап. 1999; 256 с.
36. Macian F. NFAT proteins: key regulators of T-cell development and function. Nat Rev Immunol. 2005; 5(6): 472-484. DOI:10.1038/nri1632
37. Козловская Л.В. Хронический гломерулонефрит: аргументы в пользу применения циклоспорина.Клиническая нефрология. 2010; 3: 56-61
38. Козловская Л.В. Фокально-сегментарный гломерулосклероз: фокус на циклоспорин. Клиническая нефрология. 2010; 5: 23-28
39. Cattran D.C., Appel G.B., Hebert L.A. et al. A randomized trial of cyclosporine in patients with steroid-resistant focal segmental glomerulosclerosis. North America Nephrotic Syndrome Study Group. Kidney Int. 1999; 56(6): 2220-2226. DOI:10.1046/j.15231755.1999.00778.x.
40. Niaudet P., Habib R. Cyclosporine in the treatment of idiopathic nephrosis. J Am Soc Nephrol. 1994; 5(4): 1049-1056. PMID: 7849244
41. Chapter 6: Idiopathic focal segmental glomerulosclerosis in adults. Kidney Int Suppl. (2011); 2012 Jun; 2(2): 181-185. DOI: 10.1038/kisup.2012.19
42. Shen X., Jiang H., Ying M. et al. Calcineurin inhibitors cyclosporin A and tacrolimus protect against podocyte injury induced by puromycin aminonucleoside in rodent models. Scientific reports. 2016; 6: 32087. DOI:10.1038/srep32087
43. Klaassen I., Özgören B., Sadowski C.E. et al. Response to cyclosporine in steroid-resistant nephrotic syndrome: discontinuation is possible. Pediatric nephrology. 2015; 30: 9: 1477-1483. DOI:10.1007/s00467015-3109-3
45. Fu Y.F., Liu G.l. Mycophenolate Mofetil Therapy for children with lupus nephritis refractory to both intravenous cyclophosphomide and cyclosporine. Clin Nephrol. 2001; 55(4): 318–321. PMID: 11334319
47. Gulati S., Pokhariyal S., Sharma R.K. et al. Pulse cyclophosphamide therapy in frequently relapsing nephrotic syndrome. Nephrol Dial Transplant. 2001; 16(10): 2013–2017. PMID: 11572890
49. Kamei K., Okada M., Sato M. et al. Rituximab treatment combined with methylprednisolone pulse therapy and immunosuppressants for childhood steroid-resistant nephrotic syndrome. Pediatr Nephrol. 2014; 29(7): 1181–1187. DOI: 10.1007/s00467-014-2765-z
50. Wang C.S., Liverman R.S., Garro R. et al. Ofatumumab for the treatment of childhood nephrotic syndrome. Pediatr Nephrol. 2017; 32(5): 835–841. DOI: 10.1007/s00467-017-3621-8
51. Ravani P., Bonanni A., Ghiggeri G.M. Randomised controlled trial comparing ofatumumab to rituximab in children with steroiddependent and calcineurin inhibitor-dependent idiopathic nephrotic syndrome: study protocol. BMJ Open. 2017; 7: e013319. DOI:10.1136/bmjopen-2016-013319
Фокальный сегментарный гломерулосклероз: симптомы, диагностика, лечение, прогноз
Фокальный сегментарный гломерулосклероз (ФСГС) является ведущей причиной заболевания почек во всем мире. Предполагаемая этиология первичного ФСГС является плазменным фактором с реактивностью на иммуносупрессивную терапию и риском рецидива после трансплантации почки. Адаптивный ФСГС связан с чрезмерной нагрузкой нефрона из-за увеличенного размера тела, уменьшенной емкости нефрона или одиночной клубочковой гиперфильтрации, связанной с некоторыми заболеваниями.
Введение
Фокальный сегментарный гломерулосклероз является ведущей клубочковой причиной почечной недостаточности. Он ссылается на гистологическую картину, которая характеризует 6 возможных основных этиологий, деля общую тему ушиба и истощения подоцитов.
Диагностика фокально-сегментарного гломерулосклероза полагается на интеграцию клинической истории (семейные заболевания, история рождения, пикового веса и массы тела, пользы лекарства), клинических заключений лаборатории (сыворотки альбумина, протеина мочи, и вирусных серологий) и ренальной гистопатологии. Протеинурия может находиться в нефротическом или субнефротическом диапазоне. Решающее значение имеет устранение других системных заболеваний или первичных патологий почек, которые могут привести к аналогичному представлению.
Эпидемиология и глобальное бремя
Распространенность фокального сегментарного гломерулосклероза, по сравнению с другими диагнозами подобных заболеваний, растет во всем мире. Однако абсолютную частоту и распространенность трудно установить, учитывая большие глобальные различия в показаниях, доступности и патологической поддержке биопсии почек.
Был проведен обзор опубликованной литературы по всему миру, который показывает, что ежегодные показатели заболеваемости составляют от 0,2 до 1,8 на 100 000 населения в год. Средний показатель заболеваемости составлял 2,7 пациента на миллион. Существует значительная расово-этническая предрасположенность. Кроме того, симптомы почечной недостаточности у женщин проявляются слабее, чем у мужчин.
Типология
Классификация фокального сегментарного гломерулосклероза многогранна. Она включает патофизиологические, гистологические и генетические аспекты. Первоначально ФСГС делили на первичную (идиопатическую) и вторичную формы. К последней можно отнести семейные (генетические), вирусассоциированные, лекарственно-индуцированные формы.
Клинические рекомендации фокально-сегментарного гломерулосклероза могут относиться к гистологическому варианту, прежде всего к глюкокортикоидной реактивности поражения кончика и агрессивному, неумолимому характеру коллапсирующих вариантов.
6 клинических форм
Объединяя генетическую восприимчивость, патофизиологические факторы, клинический анамнез и ответ на терапию целесообразно сгруппировать ФСГС в шесть клинических форм. Они включают в себя:
- первичную;
- адаптивную;
- высоко-генетическую;
- вирусно-опосредованную;
- лекарство-связанную;
- APOL1-связанную.
Гистопатология болезни
Минимальные симптомы гломерулонефрита у взрослых проявляются отсутствием тубулоинтерзитального рубцевания. Поражение кончика представляет собой фокальную адгезию клубочкового пучка к капсуле Боумена вблизи проксимального взлета канальца.
Наиболее характерным вариантом является коллапсирующий. Конкретный пример можно оценить в установке эндотелиальных тубуло ретикулярных включений, наблюдаемых при ультраструктурном анализе. Они могут наблюдаться в высоких состояниях интерферонов, включая вирусную инфекцию. Минимальное изменение заболевания и поражение наконечника являются наиболее отзывчивыми и наименее прогрессирующими, и коллапсирующими гломерулопатиями, устойчивыми к терапии и быстро прогрессирующими.
Признаки, указывающие на недуг
Признаки и симптомы гломерулонефрита у взрослых зависят от наличия острой или хронической формы. Они включают:
- Розовая или коричнево-окрашенная моча из-за повышенного количества эритроцитов (гематурия).
- Пенистая моча из-за избытка белка (протеинурия).
- Высокое кровяное давление (гипертония).
- Удержание жидкости (отек). Проявляется на лице, руках, ногах и животе.
Отдельно выделяются симптомы почечной недостаточности у женщин:
- Уменьшенный выход мочи.
- Задержка жидкости, вызывающая отеки ног.
- Одышка.
- Усталость.
- Спутанное сознание.
- Тошнота.
- Слабость.
- Нерегулярное сердцебиение.
- Боль в районе почек.
- Обморок или кома в тяжелых случаях.

Самый верный способ выявить ФСГС
Первое, что нужно сделать, - это анализ мочи для почек. Он включает в себя два теста:
- Отношение альбумина к креатинину. Слишком много альбумина в моче - ранний признак повреждения почек. Три положительных результата в течение трех месяцев или более является признаком заболевания.
- Скорость клубочковой фильтрации. Кровь проверяется на отходы под названием креатинин. Он поступает из мышечной ткани. Когда почки повреждены, возникают проблемы с удалением креатинина из крови. Результат теста используется в математической формуле с возрастом, расой и полом, чтобы узнать скорость клубочковой фильтрации.
Основные причины
Условия, которые могут привести к воспалению гломерул почек заключаются в:
- Инфекционных заболеваниях. Гломерулонефрит может развиться через 7-14 дней после перенесенных кожных инфекций (импетиго) или стрептококковых инфекций горла. Чтобы бороться с ними, организм вынужден вырабатывать много дополнительных антител, которые способны в конечном итоге поселиться в клубочках, вызывая воспаление.
- Бактериальный эндокардит. Бактерии могут распространяться по кровотоку и поселяться в сердце, вызывая инфекцию одного или нескольких сердечных клапанов. Бактериальный эндокардит связан с гломерулярной болезнью, но связь между ними неясна.
- Вирусная инфекция. Вирус иммунодефицита человека (ВИЧ), гепатит В и С могут вызывать заболевание.
- Волчанка. Может повлиять на многие органы и части тела, включая клетки крови, кожу, почки, сердце, суставы и легкие.
- Синдром Гудпасчера. Это редкое заболевание легких, которое имитирует пневмонию. Оно может вызвать гломерулонефрит и кровотечение в легких.
- Нефропатия. Это первичное гломерулярное заболевание возникает из-за отложений иммуноглобулина в клубочках. Может прогрессировать годами без заметных симптомов.
Дополнительные причины
К дополнительным причинам возникновения заболевания относятся:
- Полиартериит. Эта форма васкулита влияет на малые и средние кровеносные сосуды. Известна как гранулематоз Вегенера.
- Высокое кровяное давление. Функция почек снижается. Они хуже обрабатывают натрий.
- Очаговый сегментарный гломерулосклероз. Характеризуется рассеянным рубцеванием некоторых клубочков. Это состояние может быть результатом другого заболевания или возникать по неизвестной причине.
- Диабетическая болезнь почек (диабетическая нефропатия).
- Синдром Альпорта. Наследственная форма. Также может ухудшить слух или зрение.
- Множественная миелома, рак легких и хронический лимфолейкоз.

Механизм заболевания
Фокальный сегментарный гломерулосклероз - это разнообразный синдром, который возникает после травмы подоцитов по разным причинам. Источники повреждения различны:
- циркулирующие факторы;
- генетические аномалии;
- вирусная инфекция;
- медикаментозное лечение.
По большей части взаимодействие между этими драйверами неясно и сложно. Например, адаптивный ФСГС включает в себя как стресс подоцитов (несоответствие между клубочковой нагрузкой и клубочковой емкостью), так и генетическую восприимчивость.
Повреждение подоцитов от любой из форм ФСГС (или от других клубочковых заболеваний) инициирует процесс, приводящий к острому нефритическому синдрому. Происходит прогрессирующая потеря поврежденных подоцитов в мочевое пространство. Чтобы сбалансировать дефицит, эти клетки компенсируют гипертрофией, покрывая поверхности клубочковых капилляров.
При адаптивной ФСГС гломерулярная гипертрофия возникает в начале процесса заболевания. В других формах клубочковая гипертрофия происходит с прогрессивной потерей нефрона. Это приводит к увеличенным давлениям и течениям в остальных клубочках патента.
В следующих разделах рассматриваются патологические механизмы, терапия и лечение фокально-сегментарного гломерулосклероза.
Первичный ФСГС
Включает в себя генетический, вирусный и лекарство-связанный ФСГС. Механизм повреждения подоцитов включает циркулирующий фактор, возможно, цитокин, который делает конкретных пациентов восприимчивыми. Это наиболее распространенная форма у подростков и молодых взрослых. Она обыкновенно связана с протеинурией нефротик-ряда (иногда массивной), уменьшенными уровнями альбумина плазмы и гиперлипидемией.
В настоящее время терапия первичных ФСГС проводится на основе иммуносупрессивных агентов. Это глюкокортикоиды и ингибиторы кальциневрина, которые непосредственно модулируют фенотип подоцитов. Рецидивирующие ФСГС остаются клинической проблемой. Только одна из 77 первоначальных биопсий почек у пациентов, которые впоследствии имели рецидив, показала перигилярный вариант. Терапия плазмообменом может вызвать временную ремиссию.
Адаптивный ФСГС
Возникает после периода гиперфильтрации клубочков на уровне нефрона и гипертензии после патофизиологии. Условия, которые связаны с его развитием, включают:
- врожденную цианотическую болезнь сердца;
- серповидноклеточную анемию;
- ожирение;
- злоупотребление андрогенами;
- апноэ во сне;
- высокобелковую диету.
Продолжительность однонефронной клубочковой гиперфильтрации обычно измеряется за десятилетия до того, как прогрессирует гломерулосклероз. Адаптивный ФСГС приводит к прогрессирующим циклам клубочковой гипертрофии, стрессу и истощению, избыточному отложению внеклеточного матрикса в клубочке. Особенности почечной биопсии, поддерживающие диагностику, включают большие клубочки, преобладание перигилярных рубцов, демонстрирующих склеротические изменения. Клинические особенности включают в себя обычный сывороточный альбумин, который является необычным в первичном ФСГС.
Генетический ФСГС
Принимает две формы. Некоторые пациенты с определенной генетической предрасположенностью будут развивать заболевание, а другие - нет. Количество генов, связанных с ФСГС, растет с каждым годом, в значительной степени из-за распространения секвенирования всего экзома. На сегодняшний день идентифицировано не менее 38.
Некоторые гены связаны с синдромом, который включает экстраренальные проявления. Это может дать клинический ключ к тому, что у пациента может быть мутация в определенном гене. Другие связаны с характерными изменениями в морфологии базальной мембраны или морфологии митохондрий.
Если в семье ранее не проводилось генетическое тестирование, наиболее эффективным подходом является использование панелей, ориентированных на ранние ФСГС (младенческие и детские). Генетические тестовые ресурсы по всему миру доступны в Национальном центре биотехнологической информации и Национальных институтах здравоохранения.
Читайте также:
