Гиперкалиемия у онкологических больных - диагностика, лечение
Добавил пользователь Alex Обновлено: 23.01.2026
Гиперкалиемия – это увеличение уровня калия в сыворотке крови выше 5,5 ммоль/л или мэкв/л. Причиной является повышенное поступление калия в организм, его высвобождение из клеток или замедление выведения. Основные клинические симптомы включают общую мышечную слабость, тяжелые нарушения ритма сердца. Диагноз ставится на основании измерения в крови концентрации калия. В качестве мер лечения максимально ограничивается потребления калия, отменяются некоторых лекарственные средства, применяются препараты кальция, глюкозы, инсулина. При тяжелой гиперкалиемии проводится гемодиализ.
Гиперкалиемия
Гиперкалиемия – патологическое состояние, характеризующееся высоким содержанием калия в крови. Калий – это преимущественно внутриклеточный катион, обеспечивающий мембранный потенциал клеток, главным образом мышечных клеток и нейронов. Разница концентрации калия на внутренней и внешней поверхности клеточной мембраны определяет способность клетки к возбуждению. В организм человека этот макроэлемент поступает с пищей, выводится в основном с мочой, а также с калом и потом. Гиперкалиемия диагностируется примерно у 10% госпитализируемых в реанимационное отделение пациентов, у мужчин она возникает несколько чаще, чем у женщин. Более точные сведения о распространенности данного состояния отсутствуют.
Причины гиперкалиемии
Существует множество причин повышения содержания калия. Гиперкалиемия – это практически всегда полиэтиологическое состояние, т.е. она развивается при одновременном влиянии нескольких факторов, воздействующих на разные этапы калиевого метаболизма. В зависимости от механизма действия причинами гиперкалиемии могут выступать:
- Нарушение экскреции калия с мочой. Снижение выведения макроэлемента вследствие замедления кровотока в почечных клубочках происходит при острой и хронической почечной недостаточности. Также ухудшение калиевой экскреции наблюдается при дефиците альдостерона (надпочечниковой недостаточности), использовании лекарственных препаратов (ингибиторов АПФ, калийсберегающих диуретиков, нестероидных противовоспалительных средств).
- Усиленный выход из клеток. Любое заболевание или патологическое состояние, сопровождающееся повреждением или ускоренным катаболизмом тканей, приводит к гиперкалиемии. К ним относятся гемолитические анемии, синдром распада опухоли во время химиотерапии, злокачественная гипертермия. Резкое возрастание уровня калия происходит при синдроме длительного сдавления из-за массивного рабдомиолиза.
- Нарушение внутриклеточного транспорта. Переход калия внутрь клетки из межклеточного пространства нарушается при метаболическом ацидозе, дефиците инсулина (сахарный диабет 1 типа), приеме лекарственных препаратов (бета-адреноблокаторов, сердечных гликозидов, миорелаксантов).
- Повышенное экзогенное поступление. К гиперкалиемии может привести парентеральное введение большого количества хлорида калия, калиевых солей антибиотиков. При длительном хранении донорской крови наступает разрушение эритроцитов, выход из них калия, поэтому переливание такой крови может вызвать у реципиента гиперкалиемию.
К развитию гиперкалиемии предрасполагает диета с содержанием продуктов, богатых калием (кураги, чернослива, шоколада), прием биологически активных добавок с калием. Вероятность гиперкалиемии выше у маленьких детей и людей пожилого возраста, что может быть связано с физиологическим несовершенством выделительной функции почек. Также к факторам риска можно отнести заболевания, требующие лечения препаратами, вызывающими повышение калия – артериальную гипертензию, хроническую сердечную недостаточность (ХСН).
Патогенез
Независимо от причины, гиперкалиемия имеет одинаковый патогенез. Повышение концентрации калия во внеклеточной жидкости снижает мембранный потенциал, из-за чего увеличивается разница между потенциалом покоя клетки и критическим уровнем деполяризации. Это приводит к уменьшению возбудимости клетки, в ней хуже возникает и распространяется нервный импульс. Особенно сильно это отражается на функции клеток скелетных мышц, кардиомиоцитов проводящей системы сердца и нейронов.
Классификация
Отдельно выделяют так называемую ложную, или псевдогиперкалиемию, которая является лабораторным артефактом. Ее возникновение связано с высвобождением калия из форменных элементов во время образования сгустка в пробирке после забора крови на анализ. Часто данный феномен наблюдается при тромбоцитозе более 900 тыс., лейкоцитозе выше 70 тыс. При псевдогиперкалиемии отсутствуют симптомы, она не требует лечения. По уровню повышения калия (в ммоль/л) традиционно выделяют три степени гиперкалиемии:
- Легкую – от 5,5 до 6.
- Умеренную – от 6,1 до 6,9.
- Тяжелую – больше 7.
Более практичной с точки зрения прогноза и определения тактики лечения считается следующая классификация:
- Угрожающая жизни гиперкалиемия – уровень выше 6,5 в сочетании с наличием изменений на электрокардиограмме, характерных для гиперкалиемии.
- Неугрожающая жизни гиперкалиемия – концентрация ниже 6,5 моль/л, специфические ЭКГ-признаки отсутствуют.
Симптомы гиперкалиемии
Клинические симптомы и их выраженность в большей мере определяются не столько степенью гиперкалиемии, сколько скоростью ее наступления. Например, у многих больных, в течение нескольких лет страдающих хронической почечной недостаточностью, гиперкалиемия нарастает очень медленно. Поэтому зачастую у них отсутствуют какие-либо симптомы вследствие приспособления к ионному дисбалансу.
Основные симптомы гиперкалиемии включают мышечную слабость, быстрое наступление утомляемости, затруднение дыхания вследствие слабости дыхательных мышц. Во время физической нагрузки может возникнуть боль в мышцах. Иногда гипотония мышц бывает настолько выраженной, что больному трудно подняться с постели. Неврологические симптомы обычно ограничиваются сонливостью, парестезиями (ощущения покалывания, ползания мурашек) пальцев рук и ног.
Особенно токсичный эффект гиперкалиемия оказывает на сердце. Главные кардиологические симптомы ‒ замедление пульса, иногда приступы учащенного сердцебиения. У некоторых пациентов возникает боль в грудной клетке, напоминающая инфаркт миокарда. Атония мышц желудочно-кишечного тракта проявляется чувством тяжести в эпигастральной области, ощущением переполнения желудка, запорами.

Осложнения
Наиболее частыми и опасными осложнениями повышенного уровня калия считаются жизнеугрожающие нарушения ритма, которые без неотложного лечения приводят к смерти пациента примерно в 40% случаев. К таким аритмиям относятся полная атриовентрикулярная блокада, фибрилляция желудочков, асистолия (остановка сердечной деятельности). Выраженная гипотония дыхательной мускулатуры (диафрагмы и межреберных мышц) может вызвать дыхательную недостаточность и остановку дыхания. Атония органов ЖКТ в редких случаях способствует развитию динамической кишечной непроходимости.
Диагностика
Курировать пациента с гиперкалиемией может врач любой специальности, но наиболее часто такими больными занимаются нефрологи, реаниматологи. При сборе анамнеза уточняется, какие лекарства, биологические добавки принимает пациент. Во время физикального осмотра выявляются такие симптомы, как ослабление или угнетение сухожильных рефлексов, тахипноэ (больше 20 дыхательных движений в минуту), брадикардия (менее 60 ударов в минуту). Дальнейшее обследование должно быть направлено не только на диагностику гиперкалиемии и ее последствий, но также на поиск причины ее развития. Это необходимо для эффективного лечения.
- Лабораторные анализы. В гемограмме определяется содержание форменных элементов (эритроцитов, тромбоцитов, лейкоцитов), гемоглобина. В биохимическом анализе крови оценивается уровень глюкозы, креатинфосфокиназы, натрия. Измеряются показатели кислотно-основного равновесия. Если у больного имеются симптомы надпочечниковой недостаточности, проводится анализ на кортизол сыворотки, проба с АКТГ, ренин-альдостероновое соотношение.
- Оценка функции почек. Особенно важным в диагностике является оценка почечной функции. Определяется концентрация креатинина, мочевины, общее количество и удельный вес мочи. Рассчитывается скорость клубочковой фильтрации. Специфическим показателем, позволяющим сделать заключение о способности почек к калиевой экскреции, признан транстубулярный градиент калия (ТГК). Для его подсчета необходимо знать осмолярность мочи и сыворотки, концентрацию калия в моче, в сыворотке.
- Электрокардиография. ЭКГ - основной инструментальный метод диагностики гиперкалиемии, с помощью которого обнаруживаются следующие изменения: синусовая брадикардия, высокие остроконечные зубцы Т, расширение комплекса QRS. Также на кардиограмме отмечается укорочение интервала QT, удлинение интервала PQ, уплощение, расширение, а иногда исчезновение зубца P.
Дифференциальную диагностику гиперкалиемии нужно проводить с заболеваниями, в клинической картине которых преобладают симптомы мышечной слабости и гипотонии. Такими болезнями являются наследственные мышечные дистрофии, нейромышечные патологии (миастения, синдром Гийена-Барре), тиреотоксический периодический паралич. Остро возникший паралич требует проведения дифференциальной диагностики с ботулизмом.
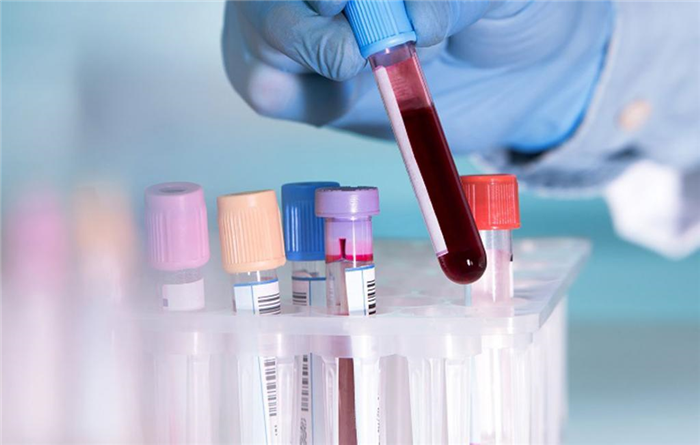
Лечение гиперкалиемии
Пациенты подлежат госпитализации для лечения в стационар, а при угрожающей жизни гиперкалиемии – в отделении реанимации и интенсивной терапии. Первым условием успешного лечения является отмена всех медикаментов, которые могут привести к гиперкалиемии (калийсберегающие диуретики, ингибиторы АПФ, НПВС и т.д.), прекращение введения калиевых солей. При дыхательной недостаточности может потребоваться подключение к аппарату искусственной вентиляции легких. Специфическое лечение гиперкалиемии предполагает несколько направлений:
- Стабилизация мембран кардиомиоцитов. При высокой жизнеугрожающей гиперкалиемии для лечения и предотвращения тяжелых нарушений ритма сердца внутривенно вводятся соли кальция, обладающего антагонистическим действием в отношении калия и улучшающего сократительную функцию миокарда. Предпочтительнее использовать глюконат кальция, так как хлорид кальция при попадании в подкожную клетчатку или мышечную ткань вызывает их некроз.
- Перемещение калия внутрь клеток. Для этого применяется введение инсулина с глюкозой, агонистов бета-адренорецепторов (сальбутамол). С этой же целью проводится коррекция метаболического ацидоза введением гидрокарбоната натрия (раствора соды).
- Ускоренное выведение калия. Для стимуляции экскреции калиевых ионов с мочой очень эффективны петлевые диуретики (фуросемид). Для выведения калия через кишечник назначаются энтеросорбенты, катионообменные смолы (полистеролсульфонат натрия). При развитии гиперкалиемии на фоне надпочечниковой недостаточности для лечения обязательно применяются гормональные препараты (флудрокортизон, гидрокортизон).
- Гемодиализ. Это экстренный способ выведения калия из организма. К такому лечению прибегают либо при неэффективности вышеперечисленных мер, либо сразу при очень высокой концентрации калия. Предпочтительно использовать диализирующий раствор с бикарбонатным буфером.
Прогноз и профилактика
Гиперкалиемия – тяжелое (а иногда и неотложное) патологическое состояние. Успех лечения напрямую зависит от своевременной диагностики. Частота летальных исходов от гиперкалиемии составляет от 20 до 41%. Вероятность смерти определяется не только уровнем калия, но и заболеванием, на фоне которого развилась гиперкалиемия. Основной причиной смерти являются опасные аритмии. Профилактика заключается в отмене биодобавок, содержащих калий, ограничении продуктов питания, богатых калием, у больных с хронической болезнью почек. Следует избегать одновременного использования препаратов, вызывающих гиперкалиемию, а в случае их назначения регулярно мониторировать уровень калия в крови.
3. The management of hyperkalaemia in the emergency department/ Aheel P., Crowe A. V.// J. Accid. Emerg. Med. — 2000.
4. Дифференциальный диагноз внутренних болезней: Алгоритмический подход/ Хили П.М., Джекобсон Э.Дж. - 2014.
Гиперкалиемия у онкологических больных - диагностика, лечение
Верхняя граница плазменной концентрации калия — 5—5,5 ммоль/л, среднее значение — 4,3 ммоль/л. Обычная диета (овощи, мясо) обеспечивает поступление 1—1,5 ммоль К+ на каждый килограмм пищи. Почки экскретирует около 90 % ежедневно потребляемого К+. На обмен калия между клетками и экстрацеллюлярной жидкостью влияют инсулин, кислотно-щелочное состояние, катехоламины, альдостерон, осмолярность плазмы, глюкагон, целостность клеточной стенки.
Почки способны поддерживать гомеостаз калия до тех пор, пока скорость клубочковой фильтрации (СКФ) остается выше 10 мл/мин, а суточный диурез (при умеренно сниженной СКФ) — больше 1 л. Некоторые заболевания почек сопровождаются выраженным нарушением экскреции калия при относительно сохранной СКФ (например, почечный канальцевый ацидоз). Ксенобиотики, вызывающие повышение уровня калия в крови, — НПВС, ингибиторы АПФ, циклоспорин, калийсберегающие диуретики.
Особенно часто лекарственная гиперкалиемия возникает у больных сахарным диабетом, людей пожилого возраста и при сопутствующей ХПН. Гипер-калиемию вызывает внутривенное введение препаратов калия в дозе более 0,5 ммоль К+ на килограмм массы тела в час (более 40 ммоль/ч), особенно при сопутствующем нарушении функции почек. Системный ацидоз уменьшает почечную экскрецию калия и вызывает его перемещение из внутриклеточного пространства в экстрацеллюлярную жидкость.
Возможно поступление калия в кровь из поврежденных клеток при внутрисосудистом гемолизе, рабдомиолизе, быстром лизисе опухоли. Нарушение правил взятия крови на анализ (длительное наложение жгута, разрушение эритроцитов при транспортировке крови в лабораторию или длительное хранение пробы) может привести к высвобождению большого количества калия из клеток крови и к ошибочному диагнозу гиперкалиемии. Завышенные значения калия сыворотки могут быть связаны не только с гемолизом, но и тромбоцитозом (более 1000 • 10 9 /л) или лейкоцитозом (более 50•10 9 /л).
Повторное определение калия сыворотки с соблюдением правил забора крови позволяет исключить лабораторную ошибку.
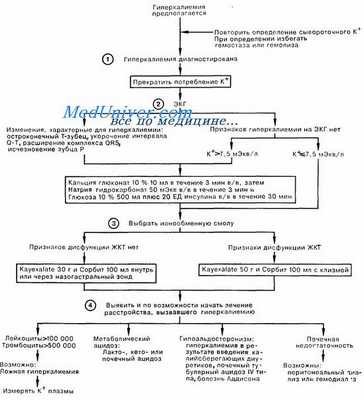
Умеренная гиперкалиемия протекает бессимптомно. Кардиальные эффекты проявляются обычно приуровне калия сыворотки более 6 ммоль/л. Начальные проявления изменения ЭКГ заключаются в появлении высоких остроконечных волн Т в сочетании с нормальным или уменьшенным интервалом Q—T. Увеличение калия приводит к удлинению интервала PR и уменьшению амплитуды волны Р. Дальнейший рост сывороточного калия приводит к расширению комплекса QRS, который затем превращается в подобие синусоиды, затем наступает асистолия. При уровне калия выше 7 ммоль/л мышечная слабость может приводить к развитию вялого паралича, нарушению речи и дыхания.
Для уточнения этиологии гиперкалиемии нужно определить суточную экскрецию с мочой калия, натрия и креатинина, а также мочевину и креатинин сыворотки крови. Нарушение экскреции калия диагностируется, если в условиях гиперкалиемии с мочой удаляется менее 20 ммоль К+ в сутки. Выделение небольшого количества калия (менее 20 ммоль) и мочи (менее 500 мл), низкая СКФ (менее 20 мл/мин), определяемая по клиренсу эндогенного креатинина, свидетельствуют о почечной недостаточности как наиболее вероятной причине гиперкалиемии. При преренальном характере гиперкалиемии быстрое восстановление волемии и нормогидратации приводит к нормализации уровня калия в крови.
Если суточная экскреция калия низкая, мочи — более 1 л в сутки, мочевина и креатинин крови — в пределах нормы, а суточная экскреция натрия не нарушена (около 20 ммоль/сут), можно предполагать нарушение секреции ренина или альдостерона либо отсутствие адекватной реакции почечных канальцев на альдостерон. Диагноз гипоренинемического гипоальдостеронизма подтверждается определением уровня ренина и альдостерона крови. Первичная недостаточность надпочечников (болезнь Аддисона) предполагает низкий уровень сывороточного кортизола и отсутствие его повышения после введения АКТГ (кортисин).
Если с мочой выводится более 20 ммоль калия в сутки, основную причину сохраняющейся гиперкалиемии следует искать в его избыточном поступлении с пищей или лекарственными препаратами либо перемещении из внутриклеточного пространства (хотя не исключено, что одновременно присутствует и нарушение его выделения). Нужно исключить быстро устраняемые причины экстрацеллюлярного транспорта калия: гипергликемию, гиперосмолярность крови, метаболический ацидоз. Причиной эндогенной гиперкалиемии могут быть гематомы, кровь в кишечнике (желудочно-кишечное кровотечение), внутрисосудистый гемолиз, распадающиеся ткани (в том числе опухолевые).
При появлении характерных для гиперкалиемии изменений ЭКГ необходимо введение кальция, снижающего пороговый потенциал мембраны кардиомиоцитов. Хлорид кальция (10 %) в дозе 2—3 г вводят внутривенно в течение 5—9 мин. Для уменьшения уровня сывороточного калия и перемещения его во внутриклеточное пространство можно вводить внутривенно глюкозу и инсулин (40 % глюкозы 60 мл, инсулина короткого действия 10 ЕД), повторяя введения каждые 15—20 мин. Внутриклеточный транспорт калия стимулирует также коррекция метаболического ацидоза (внутривенным введением раствора бикарбоната натрия).
Катионнообменные смолы связывают К+ в кишечнике (внутрь по 30—60 г в 20 % растворе сорбита). Фуросемид в условиях почечной недостаточности назначают в дозе 2 мг/кг внутривенно (обычно в виде капельной инфузии в течение 20—30 мин).
Экстренный гемодиализ (или гемофильтрация) проводится при неэффективности консервативной терапии гиперкалиемии и тяжелого метаболического ацидоза.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Гипокалиемия у онкологических больных - диагностика, лечение
Гипокалиемия — уровень К+ сыворотки менее 3,5 мг-экв/л (ммоль/л) — частое (и далеко не всегда диагностируемое) осложнение лечения онкогемато-логических больных. К сожалению, определение электролитного состава сыворотки крови в процессе лечения еще не стало рутинным.
Однако даже в случае выявления гипокалиемии врач часто ограничивается назначением препаратов калия, не проводя поиска причин и не вдаваясь в патофизиологические механизмы, приводящие к снижению уровня калия в сыворотке. Между тем причины гипокалиемии разнообразны, и низкий уровень калия сыворотки не всегда свидетельствует о его абсолютном дефиците в организме (около 98 % калия находится во внутриклеточном пространстве).
Гипокалиемию может вызвать диета с недостаточным содержанием калия либо неадекватная пропись полного парентерального питания (дефицит потребления). Гипокалиемия может быть следствием усиленного транспорта калия во внутриклеточное пространство (внутриклеточное перераспределение) под действием инсулина (в том числе при парентеральном питании), b2-агонистов адреналовых рецепторов, эндогенных катехоламинов (при стрессе), гормонов щитовидной железы (при тиреотоксикозе), при алкалозе (как метаболическом, так и газовом).
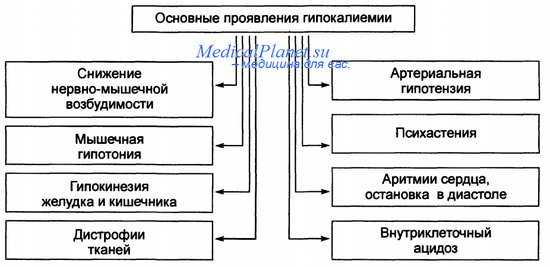
Избыточные экстраренальные потери могут быть вызваны диареей (в том числе вследствие чрезмерного применения слабительных), наружным дренированием желчи, тонкокишечной фистулой, приемом ионообменных смол, длительным наружным дренированием желудка (например, через назогастральный зонд). К значительным потерям калия приводит обильное потоотделение, а также гемо- или перитонеальный диализ со «стандартной» прописью диализирующего раствора (в котором обычно содержится К+ не более 2,5 ммоль/л). Избыточные потери калия с мочой (ренальные потери) выявляются при многих патологических состояниях и применении некоторых ксенобиотиков (амфотерицин В, тикарциллин, пиперациллин, петлевые диуретики).
Если за 24 ч пациент теряет с мочой более 20 ммоль калия, причиной гипокалиемии можно считать избыточную ренальную потерю калия. Если потери с мочой оказываются менее 20 ммоль/сут, вероятные причины гипокалиемии — дефицит потребления или избыточные экстраренальные потери.
Потенциально смертельное последствие гипокалиемии — сердечная аритмия, другие симптомы — нарастающая мышечная слабость, периферический паралич (возможен паралич дыхательной мускулатуры), тошнота, рвота, запор, динамическая кишечная непроходимость. Показаниями к экстренному лечению являются электрокардиографические признаки гипокалиемии [депрессия сегмента ST, уменьшенная амплитуда зубца Т, появление зубца U, увеличение интервала Q— T(U)], острый инфаркт миокарда (из-за высокого риска развития сердечной недостаточности), прогрессирующая мышечная слабость (в том числе слабость дыхательной мускулатуры).
Обычно применяют внутривенное введение хлорида калия (КCl). Если у пациента имеется и гипофосфатемия, предпочтительно применение фосфата калия. Максимальная скорость введения КCl — 2,2 г в час. Допустимая концентрация КCl в растворе для внутривенного введения — не более 2 % (при введении в периферическую вену концентрация должна быть значительно ниже). В ходе лечения гипокалиемии, начатого по экстренным показаниям, необходим повторный биохимический и электрокардиографический контроль (не реже 1 раза в час — до исчезновения симптомов тяжелой гипокалиемии). Резистентная к заместительной терапии гипокалиемия иногда бывает связана с сопутствующей гипомагниемией.
Гиперкальциемия у онкологических больных - диагностика, лечение
Гиперкальциемия является наиболее частым из опасных для жизни метаболических нарушений при злокачественных новообразованиях. Чаще всего гиперкальциемией осложняются миеломная болезнь и метастатический рак молочной железы (до 40 % больных), однако она может развиться и у пациентов с лимфогранулематозом, лимфомами, лейкозами и т. д.. Несмотря на то что к гиперкальциемии могут приводить многие заболевания, чаще всего ее развитие обусловлено гиперфункцией паращитовидных желез или различными злокачественными опухолями.
На долю других причин приходится менее 10 % случаев гиперкальциемии. Нормальный уровень паратиреоидного гормона исключает гиперпаратиреоидизм с большой степенью вероятности.
Гиперкальциемия, обусловленная злокачественной опухолью, наиболее часто имеет острое начало и выраженную клиническую симптоматику, требующую госпитализации и экстренной помощи. Наоборот, бессимптомная хроническая гиперкальциемия чаще обусловлена гиперфункцией паращитовидных желез.
При злокачественных новообразованиях за развитие гиперкальциемии отвечают два основных механизма. При одном из них (гуморальном) опухолевые клетки выделяют в системный кровоток биологически активные вещества, вызывающие повышенный остеолиз как в зонах метастатического поражения костей, так и за его пределами. Развитие гуморально обусловленной гиперкальциемии может наблюдаться и при отсутствии метастатического поражения костей. Наиболее часто за развитие такого типа гиперкальциемии у онкологических больных отвечает паратиреоидподобная субстанция (протеин) и активная форма витамина D3.
При остеолитическом типе гиперкальциемии разрушение костной ткани происходит только в области метастатического поражения. В данном случае резорбция кости обусловлена паракринной (местной) стимуляцией остеокластов различными цитокинами, выделяемыми опухолевыми клетками. Возможно и сочетание обоих механизмов.
Паратиреоидподобная субстанция (белок, частично гомологичный нормальному паратиреоидному гормону, но отличный от него при иммунологическом определении) отвечает за развитие гиперкальциемии при многих солидных опухолях, однако в онкогематологической практике имеет клиническое значение только у пациентов с Т-клеточной лимфомой/лейкемией. При лимфогранулематозе, неходжкинских лимфомах, миеломной болезни развитие гуморально обусловленной гиперкальциемии чаще связано с избыточным образованием активной формы витамина D3 (1,25 ОН2-витамин D3) под воздействием специфических ферментов, содержащихся в опухолевых клетках.
Выявление цитокинов, отвечающих за остеолитический тип гиперкальциемии, затруднительно в связи с невозможностью их определения в системном кровотоке. Считается, что в развитии остеолитической гиперкальциемии при различных злокачественных новообразованиях задействованы ИЛ-1, ИЛ-6, фактор некроза опухоли, PgE и т. д. Однако наиболее вероятно, что в большинстве случаев развитие гиперкальциемии у пациентов со злокачественными опухолями обусловлено комплексом биологически активных субстанций. Кроме того, необходимо помнить, что наличие у больного злокачественной опухоли не исключает наличия других причин гиперкальциемии (хроническая почечная недостаточность, передозировка витаминов групп D и А, гипертиреоз и т. д.).
Клинические проявления гиперкальциемии многообразны и затрагивают многие органы и системы, а также способны «маскироваться» под другие заболевания. Развитие гиперкальциемии может сопровождаться следующими симптомами: жажда, потеря веса, полиурия, дегидратация, мышечная слабость, летаргия, судороги, психоз, тошнота, рвота, запоры, кишечная непроходимость, почечная недостаточность, брадикардия и желудочковые аритмии. Тяжесть проявлений варьирует в широких пределах в зависимости от выраженности гиперкальциемии, скорости увеличения уровня кальция и общего состояния пациента. У пациентов с остро развивающейся гиперкальциемией наиболее частыми начальными симптомами являются тошнота, рвота, жажда и полиурия.
При отсутствии квалифицированной помощи развивается ступор или кома, что может быть принято (учитывая жажду, полиурию в анамнезе и т. д.) за проявления сахарного диабета. В данной ситуации постановка правильного диагноза и начало специфической терапии являются жизненно важными, так как развивающаяся вследствие рвоты и полиурии дегидратация может значительно усугубить течение гиперкальциемии, замыкая «порочный» круг.
Уровень общего кальция сыворотки (рутинно определяемый в большинстве лабораторий) обычно адекватно отражает выраженность гиперкальциемии.
Однако только 40 % кальция сыворотки присутствует в физиологически активной ионизированной форме, в то время как 50 % связано с белками крови (в основном с альбумином) и до 10 % образует комплексы с анионами (бикарбонатом, фосфатом, цитратом и др.). Биологические (и патологические) эффекты повышения уровня кальция зависят именно от величины ионизированной фракции. Доля ионизированного кальция увеличивается при гипоальбуминемии и, соответственно, снижается при гиперпротеинемии (например, при миеломной болезни). Когда изменения затрагивают только уровень альбумина, для более точной характеристики выраженности гиперкальциемии может быть использована следующая формула:
корригированный кальций (ммоль/л) = общий кальций (моль/л) + 0,8 х [4 —альбумин (г/дл)].
Если у пациента имеется выраженная гиперпротеинемия, необходимо прямое определение ионизированного кальция в лаборатории.
Разумеется, наилучшим лечением гиперкальциемии, обусловленной опухолевым ростом, является лечение основного заболевания, однако данное осложнение наиболее часто наблюдается у пациентов с распространенными опухолями, резистентными к противоопухолевой терапии. В связи с этим, а также учитывая, что гиперкальциемия представляет непосредственную угрозу для жизни больного, основным методом экстренной терапии являются симптоматические мероприятия, направленные на снижение уровня кальция в крови (за счет повышения экскреции кальция с мочой и уменьшения резорбции костной ткани).
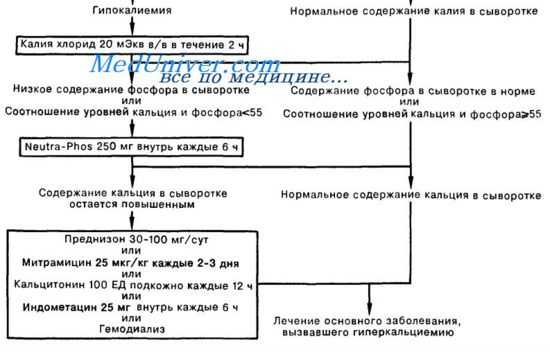
Попытки уменьшить поступление кальция в организм (диета со сниженным содержанием кальция) при гиперкальциемии, вызванной опухолью, неэффективны.
Должен быть приостановлен прием препаратов, снижающих экскрецию кальция (тиазидные диуретики), уменьшающих почечный кровоток (нестероидные противовоспалительные средства, Н2-блокаторы), и, разумеется, препаратов, напрямую вызывающих гиперкальциемию (препараты кальция, витамин D, ретиноиды).
Ключевым моментом в экстренной терапии больных с гиперкальцемией является гидратация, которая, кроме увеличения экскреции кальция, позволяет избежать последствий обезвоживания, обусловленного рвотой и полиурией. В то же время даже массивная гидратация (4 л в сутки и более) не позволяет купировать гиперкальциемию у большинства пациентов со злокачественными новообразованиями. При проведении такого лечения временная нормализация уровня кальция наблюдается лишь у трети больных. Ранее широко использовавшаяся методика создания «форсированного диуреза» при помощи фуросемида, по данным исследований, к сожалению, не повышает эффективности гидратационной терапии.
Более того, фуросемид потенциально способен увеличить явления гиповолемии и реабсорбцию кальция в почках. Гидратация, однако, остается необходимым начальным компонентом терапии больных с гиперкальциемией, так как необходима для коррекции гиповолемии (представляющей наибольшую опасность для жизни) и позволяет сохранить адекватную функцию почек, препятствуя кристаллизации солей кальция в канальцах.
Первой линией терапии, направленной на снижение резорбции костной ткани, в настоящий момент признаны бисфосфонаты (синтетические аналоги пирофосфата, устойчивые к воздействию пирофосфатазы). Данные препараты, связываясь с молекулами костного матрикса (кристаллические гидроксиапатиты), подавляют метаболическую активность остеокластов, что приводит к уменьшению резорбции костной ткани и соответственно снижению экстракции из нее кальция. Преимуществами бисфос-фонатов, определяющими их широкое использование, являются высокая эффективность (гиперкальциемия купируется у 80—100 % больных) при малой токсичности (у 20 % больных может развиваться повышение температуры тела, гриппоподобный синдром или умеренно выраженные местные реакции в области введения). Эффект бисфосфонатов развивается достаточно быстро (в течение нескольких дней) и длительно сохраняется.
В настоящий момент для использования доступны следующие препараты, показавшие свою клиническую эффективность: аредиа (памидронат), бондронат (ибандронат), зомета (золендронат). Кальцитонин (миакальцик) также обладает способностью снижать уровень кальция за счет увеличения его почечной экскреции и снижения резорбции костной ткани. Данный препарат является наиболее быстродействующим (начало действия через 2—4 ч). Основным недостатком кальцитонина является кратковременность действия. Пик терапевтического действия приходится на 24—48 ч лечения с последующим быстрым снижением эффекта. Кортикостероиды также способны тормозить резорбцию костной ткани остеокластами, однако из-за меньшей активности и большего количества побочных эффектов их используют только у пациентов с опухолями, чувствительными к данному виду терапии. Пликамицин (митрамицин) и нитрат галлия, используемые в зарубежной практике при резистентности к терапии бисфосфанатами, в России недоступны.
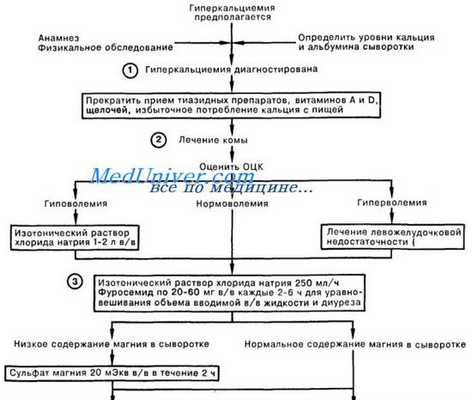
При выборе тактики ведения больного с гиперкальциемией необходимо оценить тяжесть состояния больного и уровень кальция в крови. Уровень общего кальция более 3 ммоль/л и/или наличие симптомов гиперкальциемии (особенно дегидратации, нарушений ЦНС) является абсолютным показанием для госпитализации. В случае гиперкальциемии пациенту немедленно должна быть начата гидратация. Скорость регидратации зависит от выраженности дефицита воды и наличия у пациента сопутствующих сердечно-сосудистых и почечных заболеваний. При выраженной дегидратации и отсутствии сопутствующей патологии оптимальным можно считать введение физиологического раствора со скоростью 300— 400 мл/ч в течение 3—4 ч. Более медленная гидратация необходима при наличии кардиальной патологии, особенно застойной сердечной недостаточности.
Строгий контроль за диурезом (с поправкой на исходную дегидратацию), уровнем электролитов (калия, магния, натрия, хлора) и креатинина является необходимым при проведении такой терапии. Использование фуросемида допустимо только в случае задержки жидкости после адекватной регидратации. Сразу же после того, как будет налажен адекватный диурез (обычно через 2—3 ч после начала гидратации почасовой диурез становится равным объему вводимой жидкости), необходимо начать введение бисфосфонатов в рекомендованной дозе (аредиа 90 мг, бондронат 2—6 мг или зомета 4 мг). В связи с риском развития нефротоксичности необходимо строго соблюдать рекомендованную скорость введения (длительность инфузии: аредиа и бондронат — не менее 2 ч, зомета не менее 15 мин). Для пациентов, находящихся в критическом состоянии и/или при уровне кальция более 3,8 ммоль/л, рекомендуется использовать комбинацию бисфосфоната с кальцитонином (8 ME каждые 6 ч, внутримышечно 2— 3 дня), что позволяет добиться более быстрого эффекта.
При наличии у пациента опухоли, чувствительной к терапии кортикостероидами, эти препараты должны быть добавлены к терапии. В случае отсутствия эффекта от первой дозы бисфосфонатов их введение может быть осуществлено повторно через 5—7 дней. Необходимо помнить, что без эффективной противоопухолевой терапии достигнутая после введения бисфосфонатов нормокальциемия обычно длится от 15 до 40 сут, после чего вновь отмечается повышение уровня кальция, требующее повторного введения бисфосфонатов. При почечной недостаточности пациентам с гиперкальциемией рекомендован гемодиализ.
Гиперкальциемия
Гиперкальциемия – это увеличение в сыворотке в крови концентрации общего кальция больше 2,8 ммоль/л или ионизированного кальция выше 1,3 ммоль/л. Причиной данного состояния могут быть гиперпаратиреоз, злокачественное новообразование, длительное применение лекарственных препаратов. Симптомы включают инсипидарный синдром (полиурия, полидипсия), общую мышечную слабость, нервно-психические расстройства. Для постановки диагноза большее значение имеет уровень ионизированного кальция (Ca2+). Для лечения применяют 0,9% NaCl, петлевые диуретики, бифосфонаты.
Кальций – это жизненно важный макроэлемент, выполняющий множество функций в организме человека (обеспечение мышечного сокращения, свертывания крови, проведение нервного импульса). Также кальций является основным компонентом костной ткани. В регуляции его метаболизма наиболее важное участие принимают кальцитриол (витамин Д), паратгормон. Гиперкальциемия – это довольно распространенное электролитное нарушение, оно возникает с частотой примерно 0,17 до 3,9 случая на 100 человек. Гендерные различия варьируют у людей разных возрастов. Этому состоянию больше подвержены мужчины молодого возраста, женщины старше 45 лет.
Причины гиперкальциемии
Гиперкальциемия практически всегда свидетельствует о каком-либо заболевании или патологическом процессе. Однако иногда она развивается вследствие физиологических причин (у новорожденных на 4 день жизни, у взрослых после приема пищи). Патологические причины данного состояния следующие:
- Гиперпаратиреоз. Это эндокринное заболевание, характеризующееся гиперсекрецией паратиреоидного гормона (ПТГ). Оно является наиболее частой причиной гиперкальциемии. Гиперпаратиреоз обусловлен аденомой, гиперплазией паращитовидных желез, почечной недостаточностью. Иногда гиперпаратиреоз возникает в рамках аутоиммунного полингландулярного синдрома или множественных эндокринных неоплазий.
- Онкологические заболевания. Признаны второй по частоте причиной данного электролитного нарушения. При раке оно возникает по двум механизмам. Первый - деструкция кости метастазами или первичным очагом (лейкозы, лимфомы, миеломная болезнь). Второй механизм заключается в синтезе раковыми клетками ПТГ-подобного пептида (рак легких, молочной железы, мочевого пузыря).
- Гранулематозные процессы. Хронические заболевания, характеризующиеся образованием в тканях (прежде всего в легких) клеточных гранулем, тоже могут являться причиной гиперкальциемии. К ним относятся туберкулез, саркоидоз, гистоплазмоз. Мононуклеарные фагоциты, входящие в состав гранулем, благодаря экспрессии 1-альфа гидроксилазы способны превращать витамин Д в активную форму (кальцитрирол, 1,25OH-D3), который усиливает всасывание кальциевых ионов тонким кишечником.
- Длительная иммобилизация. В результате длительного отсутствия двигательной активности активизируются остеокласты (клетки, разрушающие костную ткань путем растворения минеральных соединений). Это приводит к выходу кальциевых ионов из костей. Такое явление происходит при вынужденной иммобилизации после травм, нахождении в условиях невесомости (при полетах в космос).
- Прием лекарственных препаратов. В первую очередь это относится к витамину Д, препаратам кальция. Другие медикаменты (тиазидные диуретики, теофиллин, литий) тоже могут вызвать кальциевый дисбаланс путем усиления остеодеструкции или процессов реабсорбции в канальцах нефронов почек.
- Другие эндокринные расстройства. Помимо патологии паращитовидных желез, причиной гиперкальциемии иногда выступают другие эндокринные заболевания. Например, избыток тиреоидных гормонов при гипертиреозе усиливает деструкцию костной ткани. При надпочечниковой недостаточности снижается ингибирующее действие глюкокортикоидов на кальциевый метаболизм.
Увеличение в крови содержания кальция изменяет мембранный потенциал клеток, что приводит к угнетению нервно-мышечной проводимости в скелетных мышцах, миокарде, желудочно-кишечном тракте. Патогенез психоневрологических симптомов не до конца ясен. Предполагается роль замедления проведения нервных импульсов. Развивается кальцификация сосудов, внутренних органов, дистрофия, сморщивание тканей.
Вследствие гиперкальциурии (увеличения фильтрации кальция в канальцах нефрона) повышается риск нефролитиаза. Кальций ингибирует аденилатциклазу, что подавляет почечный эффект антидиуретического гормона. Также из-за высокой внеклеточной концентрации этого катиона усиливается секреция соляной кислоты обкладочными клетками желудка, что ведет к развитию пептических язв.
По течению выделяют хроническую и острую гиперкальциемию (гиперкальциемический криз). По уровню катиона (в ммоль/л) различают следующие степени тяжести гиперкальциемии:
- Легкая. Содержание общего Ca меньше 3, ионизированного - меньше 1,5.
- Умеренная. Уровень общего Ca до 3,5, ионизированного- до 1,8.
- Тяжелая. Общий Ca выше 3,5, ионизированный - более 1,8.
Отдельно рассматривается псевдогиперкальциемия. Часть кальция связывается с белками плазмы, поэтому такие заболевания как парапротеинемические гемобластозы (множественная миелома), характеризующиеся высоким содержанием белка в крови, сопровождаются увеличением уровня общего кальция. Исключить ложную гиперкальциемию помогает определение ионизированного кальция.
Симптомы гиперкальциемии
При легкой степени патологии симптомы могут вообще отсутствовать. При умеренной, тяжелой степени появляются мышечная слабость, иногда достигающая такой выраженности, что пациенту трудно подняться с постели. Характерны симптомы со стороны желудочно-кишечного тракта – тошнота, рвота абдоминальные боли. Значительно снижается аппетит, возникают запоры. Часто наблюдаются кардиологические симптомы (повышение артериального давления, тахикардия).
Даже при гиперкальциемии неонкологического происхождения вследствие анорексии и мышечной дистрофии больной сильно теряет вес, приобретает кахектичный вид, из-за чего может сложиться ложное впечатление о наличии у него злокачественного новообразования. Ослабление действия антидиуретического гормона на почки обусловливает появление таких симптомов как сильная жажда, увеличение мочеотделения до 5-6 литров за сутки.
Особенно ярко представлены нервно-психологические симптомы. Сначала возникает эмоциональная нестабильность, нарушение концентрации внимания, небольшая сонливость. При тяжелом течении патологии развивается спутанность сознания, делирий, психозы. Возможны галлюцинации. При длительно сохраняющемся высоком уровне кальция, он начинает откладывается в тканях суставов (хондрокальциноз), что вызывает артралгию.
Гиперкальциемия имеет широкий спектр неблагоприятных последствий. Наиболее частыми осложнениями являются остеопороз (из-за усиленного выхода из костей кальциевых ионов), патологические переломы, мочекаменная болезнь. Реже возникают острый панкреатит и кишечная непроходимость. Самым опасным для жизни состоянием считается гиперкальциемический криз, при котором летальность достигает 60%. Причиной смерти становятся сердечная или почечная недостаточность.
Еще одним тяжелым, но редким осложнением, признана кальцифилаксия (кальцифицирующая уремическая артериолопатия), характеризующаяся ишемическим некрозом кожи, подкожной жировой клетчатки. Она развивается у пациентов с терминальной стадией почечной недостаточности. Длительное повышение кальция в крови также может привести к ленточной кератопатии, кальцификации аорты и клапанов сердца с формированием сердечного порока.
Профиль врача-специалиста, курирующего пациента с этой патологией, определяется причиной, вызвавшей данное состояние. Чаще всего такие больные наблюдаются у эндокринологов, нефрологов, онкологов. При опросе пациента обязательно уточняется, какие лекарственные препараты он принимает. Во время осмотра врач обращает внимание на такие симптомы, как снижение мышечного тонуса, угнетение сухожильных рефлексов. Назначается дополнительное обследование, включающее:
- Лабораторные исследования. В биохимическом анализе крови измеряется уровень альбумина, мочевины, креатинина. Из электролитов, кроме общего и ионизированного Ca, определяется концентрация фосфора, хлоридов. Исследуется содержание витамина Д (25OH-D). ПТГ, ПТГ-подобных пептидов. Проверяется суточная экскреция Ca с мочой. При подозрении на тиреотоксикоз или гипокортицизм проводится анализ крови на гормоны (ТТГ, свободный Т4, кортизол).
- Функциональные пробы. Неоценимую помощь для дифференциальной диагностики причин данного расстройства оказывают специальные провоцирующие тесты. К ним относят пробы с нативным витамином Д, тиазидными диуретиками, кальцитонином. Исключить процесс, не связанный с повышенной секрецией ПТГ, позволяет проба стероидного подавления с преднизолоном.
- Инструментальные исследования. Для поиска аденомы или гиперплазии околощитовидных желез выполняется их УЗИ, компьютерная томография, сцинтиграфия. С целью определения минеральной плотности костной ткани проводится денситометрия, для диагностики нефролитиаза - УЗИ почек. При наличии симптомов, вызывающих подозрения на воспалительный процесс в легких или злокачественное новообразование, для их идентификации следует назначить рентгенографию, КТ легких, органов брюшной полости, маммографию.
Дифференциальный диагноз необходимо проводить по преобладающим симптомам. Инсипидарный синдром нужно дифференцировать с сахарным и несахарным диабетом. Мышечную слабость, гипотонию следует отличать от таковой при мышечных дистрофиях, миастении, полимиозите. Нервно-психические симптомы требуют исключения психиатрических заболеваний.
Лечение гиперкальциемии
Консервативная терапия
Пациентов с любой степенью тяжести для проведения лечения следует госпитализировать в стационар (эндокринологическое, нефрологическое отделение). Больные с тяжелыми неврологическими симптомами, гиперкальциемическим кризом должны быть переведены в отделение реанимации и интенсивной терапии. Требуется отменить все лекарственные препараты, которые могут вызвать повышение уровня кальция. Лечение гиперкальциемии имеет следующие направления:
- Усиление выведения кальция мочой. Сначала необходимо обеспечить адекватную регидратацию физиологическим раствором NaCl (0,9%). Это позволит улучшить перфузию почек, увеличить фильтрацию кальциевых ионов почечными клубочками. Дополнительно проводится форсированный диурез с помощью петлевых диуретиков (фуросемид). Необходимо постоянно мониторировать уровень электролитов крови.
- Снижение всасыванияCaв кишечнике. Для этой цели хорошо подходят фосфатные соли натрия или калия. Фосфаты строго противопоказаны для лечения вторичного гиперпаратиреоза, вызванного почечной недостаточностью. Также для подавления абсорбции Ca в ЖКТ применяются глюкокортикостероиды (преднизолон, гидрокортизон), синтетические противомалярийные препараты (гидроксихлорохин, хлорохин).
- Подавление резорбции костной ткани. Важный этап лечения гиперкальциемии, причиной которой стал гиперпаратиреоз или онкологическое заболевание. Наиболее эффективными препаратами для препятствования прогрессирования остеопороза являются бифосфонаты (памидроновая, золедроновая кислота), которые ингибируют активность остеокластов. Схожим механизмом действия, но более быстрым эффектом, обладает пептидный гормон кальцитонин, цитотоксический антибиотик митрамицин.
- Подавление выработки ПТГ и ПТГ-подобного белка. Для патогенетического лечения первичного и вторичного гиперпаратиреоза используются кальцимиметики (цинакальцет), которые повышают чувствительность рецепторов клеток ОЩЖ, тем самым уменьшая продукцию ПТГ. В качестве лечения гиперкальциемии, вызванной злокачественной опухолью, применяют нитрат галлия, ингибирующий секрецию клетками опухоли ПТГ-подобного протеина.
- Интенсивная терапия. Для лечения тяжелых жизнеугрожающих состояний (гиперкальциемический криз, кальцифилаксия), а также при неэффективности других консервативных методов терапии мерой экстренного снижения Ca в сыворотке является гемодиализ с использованием низкокальциевого диализирующего раствора.
Хирургическое лечение
Оперативное удаление паращитовидных желез – это главное лечение первичного гиперпаратиреоза. Основным показанием к хирургическому вмешательству считается уровень Ca выше 2,75 ммоль/л. Для профилактики послеоперационной гипокальциемии («синдрома голодных костей») пациенту назначаются витамин Д, препараты Ca. Злокачественные опухоли также подлежат удалению. Для лечения онкогематологических патологий выполняется трансплантация костного мозга.
Экспериментальное лечение
В настоящее время ведутся разработки новых лекарственных средств для лечения этого состояния. На стадии клинических испытаний находится препарат остеопротегерин, который является цитокином из семейства факторов некроза опухоли. Он тормозит дифференцировку остеокластов, стимулирует их апоптоз. В экспериментах in vitro аналог кальцитриола EB 1089 подавлял экспрессию гена ПТГ-пептида.
Гиперкальциемия – это тяжелое, а в некоторых случаях (особенно при остром течении) жизнеугрожающее патологическое состояние. При гиперкальциемическом кризе смертность очень высокая (60%). Частота летальных исходов при хроническом течении в среднем составляет 20-25%. Однако в большей степени прогноз определяется причиной повышения уровня Ca.
Профилактика данной патологии заключается в своевременной диагностике и правильном лечении заболеваний, на фоне которых она развивается. Перед началом применения витамина Д или других лекарственных препаратов, которые могут увеличить содержание Ca в крови, необходимо провести анализ крови для оценки его концентрации.
2. Первичный гиперпаратиреоз. Эпидемиология, клиника, современные принципы диагностики и лечения: Диссертация/ Мокрышева Н.Г. - 2011.
Читайте также:
- Забор венозной крови для анализов - гемограммы
- Развитие гортани. Формирование трахеи
- Злокачественные опухоли костей и доброкачественные, их симптомы и классификации
- Медицинский анамнез и физикальное обследование при расстройствах пищеварения
- Отравление гормонами щитовидной железы (левотироксином) и их побочные эффекты
