Хирургия портальной гипертензии. Эффективность азигопортального разобщения
Добавил пользователь Валентин П. Обновлено: 29.01.2026
Цель. Анализ различных стратегий коррекции осложнений синдрома портальной гипертензии в ГУ “Минский научно-практический центр хирургии, трансплантологии и гематологии”. Материал и методы. Проведено ретроспективное наблюдательное исследование пациентов, перенесших различные виды хирургического лечения. Выполняли шунтирующие операции по формированию портокавальных анастомозов, трансъюгулярное портосистемное шунтирование и трансплантацию печени. Изучены частота развития осложнений, госпитальная летальность, выживаемость, периоперационные показатели. Результаты. С 1980 г. в Центре выполнено 131 шунтирующее вмешательство, с 2008 г. по настоящее время - 880 трансплантаций печени и 232 трансъюгулярных портосистемных шунтирования. Госпитальной летальности среди 68 больных компенсированным циррозом, перенесших шунтирующие операции, не было, при циррозе Child-Pugh В - 19,5%, при циррозе Child-Pugh С - 87,5%. Общая летальность после TIPS составила 9,9% (8,2% после TIPS перед трансплантацией, 12,8% после TIPS как окончательного вида лечения). Госпитальная летальность после трансплантации печени составила 7,7%. Заключение. За 50 лет стратегия коррекции портальной гипертензии претерпела существенные изменения благодаря организации учреждений с замкнутым циклом оказания всех видов помощи больным этой категории. Лечение пациентов с осложнениями синдрома портальной гипертензии наиболее эффективно в стационарах, обладающих опытом рациональной консервативной терапии, эндоваскулярных вмешательств и трансплантации.
Ключевые слова:
печень, цирроз, портальная гипертензия, варикозное расширение, TIPS, трансплантация, отдаленные результаты, liver, cirrhosis, portal hypertension, varices, TIPS, transplantation, long-term results
Evolution of approaches to portal hypertension syndrome and principles underlying treatment personalization
Efimov D. Y., Fedoruk D. A., Nosik A. V., Kirkovsky L. V., Kozak O. N., Avdei E. L., Savchenko A. V., Korotkov S. V., Shcherba A. E., Rummo O. O.
Aim. To analyze various strategies aimed at mitigating complications of the portal hypertension syndrome at the Minsk Scientific and Practical Center for Surgery, Transplantology, and Hematology. Material and methods. Patients who had undergone different types of treatment were retrospectively observed: shunt surgery to form portacaval anastomoses, transjugular portosystemic shunt placement, and liver transplantation. The following parameters were analyzed: incidence of complications, hospital mortality rate, survival rate, and perioperative indicators. Results. Since 1980, 131 shunt surgeries have been performed at the Center, while 880 liver transplantations and 232 transjugular portosystemic shunt placement procedures have been performed since 2008. Among 68 patients with compensated cirrhosis who had undergone shunt placement, no hospital mortality rate was reported, whereas in patients with Child-Pugh B cirrhosis and Child-Pugh C cirrhosis, it reached 19.5% and 87.5%, respectively. Following TIPS, the overall case mortality rate amounted to 9.9% (following TIPS prior to transplantation - 8.2%, following TIPS used as the final treatment - 12.8%). After liver transplantation, in-hospital mortality rate reached 7.7%. Conclusion. Over 50 years, the strategy for managing portal hypertension has undergone significant changes due to the establishment of institutions providing a complete cycle of all treatment measures for such patients. Patients suffering from the complications of the portal hypertension syndrome tend to receive the most effective treatment in hospitals having experience in rational conservative therapy, endovascular procedures, and transplantation.
Keywords:
печень, цирроз, портальная гипертензия, варикозное расширение, TIPS, трансплантация, отдаленные результаты, liver, cirrhosis, portal hypertension, varices, TIPS, transplantation, long-term results
Хирургия портальной гипертензии. Эффективность азигопортального разобщения
Хирургия портальной гипертензии. Эффективность азигопортального разобщения
Модифицированные методы разобщения гастроэзофагеального коллектора могут быть успешно использованы у больных с портальной гипертензией, осложненной ВРВП, как альтернатива портосистемному шунтированию.
Многочисленные модификации операций по разобщению портокавальных коллатералей в гастроэзофагеальной зоне весьма разнообразны по объему и технике выполнения и включают в различных сочетаниях: трансэзофагеальное или трансгастральное прошивание варикозных вен; деваскуляризацию кардии желудка (свода, проксимальной его части или верхней 2/3) и абдоминальной части (нижней трети) пищевода; транссекцию пищевода с помощью сшивающих аппаратов; спленэктомию; ваготомию.
Для достижения лучших результатов лечения перспективно расширение объема разобщающей операции и арсенала способов воздействия на патогенетические механизмы возникновения кровотечения из ВРВ. Этого можно достичь в случаях планового хирургического вмешательства.
Среди многочисленных модификаций операций азигопортального разобщения за рубежом чаще других применяются методика Hassab, операция Sugiura— Futagawa и проксимальная резекция желудка.
Один из наиболее популярных методов азигопортального разобщения в лечении варикозно расширенных вен пищевода — способ оперативного вмешательства, предложенный в 1973 г. М. Sugiura и S. Futagawa. Он получил в Японии название «метод Токийского университета», а в остальных странах известен как операция Sugiura. При этой операции достигается наиболее полное разобщение портальной и кавальной систем.
Вмешательство состоит в обширной параэзофагеальной и парагастральной деваскуляризации, проводимой из торакального и абдоминального доступов.
При торакальном (первом) этапе проводятся деваскуляризация пищевода от кардии до нижней легочной вены и перевязка коммуникантных вен, связывающих варикозные вены и параэзофагеальное сплетение, а также пересечение пищевода на уровне диафрагмы с последующим его сшиванием.
Во время абдоминального (второго) этапа выполняются спленэктомия, деваскуляризация абдоминального отдела пищевода, кардиального отдела желудка и его дна, селективная ваготомия и пилоропластика. При одномоментной операции абдоминальный этап осуществляется трансдиафрагмально.
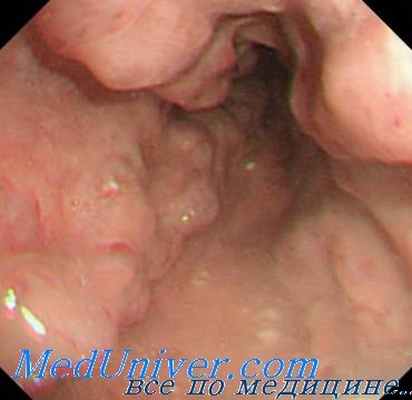
Важный момент вмешательства — проведение деваскуляризации непосредственно у пищевода, что позволяет сохранить коллатеральное кровообращение в параэзофагеальных и коронарных венах.
Вопрос о сохранении или перевязке коронарной вены желудка остается одним из дискутируемых вопросов разобщающих операций. Принцип ее сохранения заложен изначально в оригинальную методику операции Sugiura. Развивая эту концепцию, Y. Idezuki и соавт. считают, что данный этап теоретически важен в профилактике рецидива ВРВП, так как сохраненные параэзофагальные и медиастинальные коллатерали выполняют функцию спонтанных селективных портокавальных шунтов, функционирование которых подтверждено на основании изучения параметров кровотока по непарной вене до и после АПР (N. Kokudo и соавт., 1989 г.).
В ряде хирургических клиник придерживаются противоположного мнения, считая, что только прекращение кровотока по коронарной вене желудка предупреждает рецидивы ВРВП и появление ВРВЖ. По данным Н. Orozco и соавт. (1992 г.), при выполнении АПР необходимо сохранять только портосистемные коллатерали вне эзофагокардиальной области. Необходимость перевязки коронарной вены желудка обосновывается и с позиции изменения портального кровотока после включения данного этапа в операции АПР, поскольку гепатофугальный компонент по коронарной вене достигает 120—250 мл/мин. Перевязка коронарной вены увеличивает объемный портальный кровоток с 742,62 + 141,73 до 986,82 ± 134,58 мл/мин, а скорость кровотока в портальной системе увеличивается с 10,14 ± 2,13 до 13,41 ± 1,9 см/с (D.C. Zhong).
Учитывая основной недостаток — вскрытие двух полостей (брюшной и плевральной) и большой объем операции А.А. Шалимов и В.Н. Полупан разработали менее травматичное вмешательство с применением циркулярного сшивающего аппарата. После вскрытия брюшной полости осуществляли деваскуляризацию абдоминального отдела пищевода и дна желудка, проводили гастротомию, в пищевод вводили циркулярный сшиватель органов, непосредственно над пищеводно-желудочным переходом накладывали лигатуру, которая погружала стенки органа между головкой и телом аппарата. Пищевод пересекали и прошивали механическим швом. Учитывая большую вероятность развития несостоятельности швов, линию анастомоза дополнительно укрывали серозно-мышечными швами.
Придя к заключению, что венозный кровоток в кардиоэзофагеальной зоне при развитии флебэктазий происходит в основном на участке, ограниченном вверху нижними легочными венами, а внизу — границей между проксимальным и дистальным отделами желудка, А.А. Шалимов и соавт. проводили деваскуляризацию проксимальной половины желудка и абдоминального отдела пищевода, стволовую ваготомию, сагиттальную диафрагмотомию над пищеводом и, натягивая желудок, осуществляли деваскуляризацию пищевода до уровня нижней легочной вены слева, пересекая все сосуды, идущие к полому органу. После продольного рассечения привратника выполняли транссекцию пищевода с помощью аппарата. Операцию заканчивали пилоропластикой по Гейнеке—Микуличу, ушиванием диафрагмы узловыми швами и фундопликацией по Ниссену.
Используют и более щадящий вариант вмешательства: транссекцию пищевода после его деваскуляризации на протяжении 8—10 см либо трансабдоминальную транссекцию пищевода с одномоментным наложением аппаратного эзофагоэзофаго- или эзофагогастроанастомоза.
Оригинальный вариант тотального разобщения естественных портокавальных анастомозов гастроэзофагеального коллектора предложен Ф.Г. Назыровым и соавт.. Техника операции заключается в следующем: после щадящей мобилизации с сохранением кровотока желудка вплоть до абдоминального отдела пищевода проводят сшивание передней и задней стенок желудка в области кардии насквозь через все слои аппаратом «Ушиватель органов-60» на всем протяжении от большой до малой кривизны. Затем накладывают передний эзофагогастроанастомоз между абдоминальным отделом пищевода и кардиальным отделом желудка в обход танталовых скобок с камерой анастомоза более 3 см. При этом пищевод рассекают в продольном направлении, а кардию — в поперечном. Операцию завершают фундопликацией.
Помимо осуществления фундопликации А.А. Шалимов с соавт. с целью улучшения арефлюксных свойств пищеводно-желудочного перехода циркулярно прошивали кардию П-образными швами.
Подобным образом поступают Н.Я. Калита и О.Т. Котенко, прошивая варикозные вены в зоне пищеводно-желудочного перехода П-образными узловыми швами, проходящими через все слои пищевода и желудка.
«Арефлюксная» методика разработана в клинике В.И. Оноприева, в которой основную роль в развитии кровотечений из варикозных вен отводят фактору кислотной агрессии.
К выполнению фундопликации приводит стремление предотвратить заброс желудочного содержимого в пищевод, защитить пищеводный анастомоз от его воздействия и предупредить развитие воспалительных изменений слизистой оболочки. Однако некоторые авторы не рекомендуют после азигопортального разобщения проводить пластику пищеводного отверстия диафрагмы и фиксацию эзофагокардиального перехода, указывая на отсутствие достоверных сведений, подтверждающих явные преимущества выполнения различных типов фундопликации после разобщающих вмешательств.
При обширной парагастроэзофагеальной деваскуляризации, как правило, пересекают блуждающие нервы по типу стволовой или селективной ваготомии, заканчивая при этом операцию пилоропластикой, гастроэнтероанастомозом или пилородилатацией. Совершенствование вмешательства привело к выполнению селективной проксимальной ваготомии.
Выбор способа оперативного лечения в пользу операции разобщения, согласно сведениям К.А. Цыбырнэ, И.В. Мишина, может быть решен при наличии пептической язвы двенадцатиперстной кишки, оправдывающей выполнение селективной проксимальной ваготомии и пилоропластики. Аналогичного мнения придерживаются и зарубежные ученые.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Хирургия портальной гипертензии. Эффективность азигопортального разобщения
Российский научный центр хирургии им. Б.В. Петровского, РАМН
Российский научный центр хирургии им. Б.В. Петровского, РАМН
Российский научный центр хирургии им. Б.В. Петровского, РАМН
Модификация операции М.Д. Пациоры у больных портальной гипертензией
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2012;(10): 9‑13
Шерцингер А.Г., Манукьян Г.В., Жигалова С.Б., Манукьян В.Г., Черкасов В.А. Модификация операции М.Д. Пациоры у больных портальной гипертензией. Хирургия. Журнал им. Н.И. Пирогова. 2012;(10):9‑13.
Shertsinger AG, Manuk'ian GV, Zhigalova SB, Manuk'ian VG, Cherkasov* VA. The modification of the M.D. Patsiora's operation by portal hypertension. Pirogov Russian Journal of Surgery = Khirurgiya. Zurnal im. N.I. Pirogova. 2012;(10):9‑13. (In Russ.).
Российский научный центр хирургии им. Б.В. Петровского, РАМН
У 85 больных с гистологическим подтвержденным диагнозом цирроза печени, портальной гипертензии, варикозным расширением вен пищевода и желудка проведено исследование коллатерального венозного кровообращения желудка путем прямой чрескожной чреспеченочной портографии. Установлено, что в 100% наблюдений в формировании варикозной трансформации принимает участие левая желудочная вена, которая в изолированном варианте встречается в 27% наблюдений. В 68% наблюдений установлено значительное расширение задней желудочной ("полярной") вены, причем у 19 (22%) пациентов ее расширение отмечено в сочетании с расширением левой и короткими венами желудка. Полученные данные позволили модифицировать операцию М.Д. Пациоры, дополнив ее деваскуляризацией желудка в виде перевязки левой, задней и коротких вен желудка. Применение данной модификации позволило повысить двухлетнюю выживаемость с 77 до 97%, усилить гемостатический эффект с 51 до 89%, снизить частоту рецидивов венообразования с 25 до 5%, уменьшить проявления гастропатии в отдаленном послеоперационном периоде, обеспечивая таким образом повышение эффективности операции азигопортального разобщения.
Российский научный центр хирургии им. Б.В. Петровского, РАМН
Российский научный центр хирургии им. Б.В. Петровского, РАМН
Российский научный центр хирургии им. Б.В. Петровского, РАМН
Введение
Среди арсенала возможных хирургических вмешательств с целью лечения и профилактики гастроэзофагеальных кровотечений наибольшее распространение получили различные варианты портокавальных анастомозов (ПКА) и операции азиго-портального разобщения (АПР) [4, 8, 9, 12-14]. Ортотопическая трансплантация печени в России не может претендовать на роль основного метода хирургического лечения больных циррозом печени (ЦП) и портальной гипертензией (ПГ) [1, 2].
Доля малоинвазивных пособий в общей структуре хирургических вмешательств значительно возросла, но только в специализированных клиниках крупных городов России [10, 11].
Единственным вмешательством, выдержавшим испытание временем, вследствие простоты исполнения и доступности в любом хирургическом отделении остается операция, предложенная М.Д. Пациорой в 1965 г. Она заключается в проксимальной гастротомии и тщательном прошивании варикозно-расширенных вен (ВРВ) кардиального отдела желудка и кардиоэзофагеального перехода [3, 6].
Многолетний опыт наблюдения за оперированными больными (более 2000) позволил выявить наряду с положительными результатами определенные негативные моменты: появление новых ВРВ эзофагеальной зоны с последующим кровотечением из них в ближайшие или отдаленные сроки после операции [5, 7].
В связи с этим возникла необходимость изучения роли коллатеральных вен желудка (КВЖ), участвующих в формировании варикозной трансформации. Эти знания послужили основой для комбинированного хирургического вмешательства, при котором наряду с выполнением операции М.Д. Пациоры обязательным компонентом является перевязка или пересечение всех коллатералей, идущих из забрюшинного пространства к кардиальному отделу желудка [1, 13].
Материал и методы
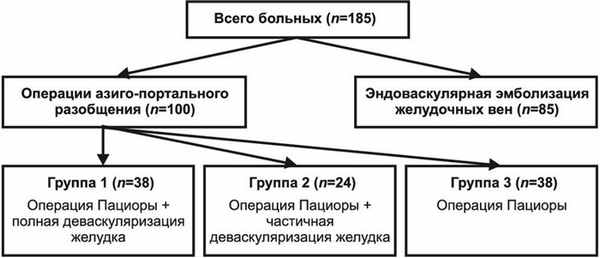
Всего в исследование включены 185 пациентов с клинически и гистологически подтвержденным диагнозом ЦП. 100 больным была выполнена операция АПР из абдоминального доступа, 85 - чрескожная чреспеченочная эмболизация вен желудка. Из 100 больных, которым произведена операция АПР, 62 в дополнение к операции М.Д. Пациоры была выполнена деваскуляризация желудка, остальным 38, составившим контрольную группу, - только операция М.Д. Пациоры. Не всем пациентам удалось произвести предполагаемый объем деваскуляризации, поэтому в свою очередь 62 пациента были разделены на 2 группы: 1-я - полная деваскуляризация (n=38), 2-я - частичная деваскуляризация (n=24). Таким образом, 100 больных разделены на 3 группы (рис. 1). Рисунок 1. Распределение пациентов по характеру хирургических вмешательств.
Критериями включения больных в исследуемые группы были:
1) наличие ВРВ пищевода и желудка II-III степени с угрозой пищеводно-желудочного кровотечения;
2) тяжесть течения ЦП, соответствующая группам А, АВ, В и ВС согласно классификации РНЦХ;
3) отсутствие в анамнезе каких-либо хирургических вмешательств, направленных на коррекцию ПГ и лечение ВРВ пищевода и желудка.
Главным критерием исключения больных из проводимого исследования являлось наличие признаков декомпенсации заболевания.
Исследуемые группы были репрезентативны по полу и возрасту.
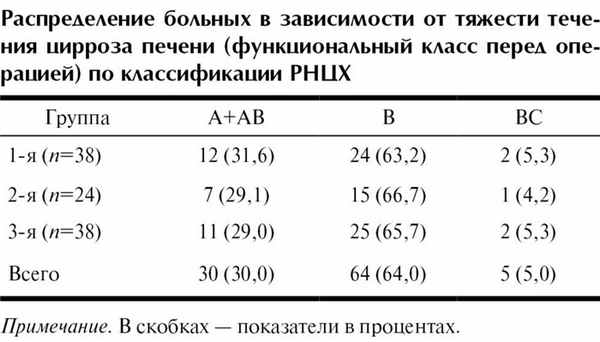
Распределение больных в зависимости от функционального состояния печени представлено в таблице.
Анализ результатов операций АПР проводился по следующим направлениям:
1) характер операции;
2) особенности течения ближайшего послеоперационного периода;
3) оценка результатов в отдаленный послеоперационный период.
В ближайшем послеоперационном периоде учитывали наличие различных осложнений и уровень летальности.
Результаты хирургического лечения в отдаленном послеоперационном периоде оценивали с учетом частоты и причин развития кровотечений на протяжении года после операции, выживаемости пациентов, рецидивов венообразования в желудке, а также состояния слизистой и ВРВ желудка. С этой целью проводили эндоскопический мониторинг в сроки 3, 6 и 12 мес после операции.
При выполнении эндоскопического исследования при поступлении больного, а также в отдаленном послеоперационном периоде оценивали состояние ВРВ, слизистой пищевода и желудка, а также определяли наличие признаков угрозы кровотечения.
В нашей работе у всех больных до операции диагностировали наличие ВРВ пищевода и желудка III степени (по классификации А.Г. Шерцингера, 1986 г.).
У 85 больных (54 мужчины и 31 женщина) с диагнозом ЦП проводили анализ результатов чрескожной чреспеченочной портографии [1] .
По функциональному состоянию печени субкомпенсированное течение ЦП отмечено у 55, декомпенсированное - у 30 больных.
Основными критериями включения в группу исследования являлись:
1) наличие клинически установленного диагноза ЦП;
2) сохранная проходимость спленопортальной оси (по данным УЗДГ);
3) наличие ВРВ пищевода и желудка II-III степени с угрозой развития пищеводно-желудочного кровотечения;
4) отсутствие в анамнезе сосудистых шунтирующих операций.
Результаты и обсуждение
В результате анализа полученных спленопортограмм нами установлено, что внеорганные региональные венозные желудочные коллекторы играют значительную роль в формировании варикозной трансформации вен пищевода и желудка.
Главным венозным коллектором, по нашим данным, является левая желудочная вена (ЛВЖ), расширение которой отмечено в 100% наблюдений. У 23 (27%) больных ЛЖВ выступала в качестве единственно значимого коллектора, участвующего в формировании ВРВ желудка и пищевода.
Изолированного участия КВЖ в формировании ВРВ мы не выявили. Частота вовлечения КВЖ в формирование ВРВ желудка составила 51% (43 пациента), причем в 39 (46%) наблюдениях - в сочетании с ЛЖВ и задней желудочной веной (ЗЖВ), в 4 (5%) - в сочетании с расширением ЛЖВ.
Роль КВЖ, участвующих в формировании варикозной трансформации, обсуждается давно. Речь идет о том, на какие коллатерали стоит обращать внимание при обсуждении причин рецидива венообразования в отдаленном периоде после выполнения операции АПР.
Каково практическое значение полученных данных? Прежде всего следует остановиться на роли коллатерали, впадающей в среднюю треть селезеночной вены, которую на начальном этапе исследований мы трактовали как самую проксимальную по месту отхождения КВЖ. Нам импонирует название описанной венозной коллатерали - «задняя желудочная вена».
Роль этой коллатерали в развитии ВРВ желудка недооценена. По нашему мнению, недиагностированное наличие ЗЖВ может повысить вероятность развития рецидивных ВРВ и кровотечения в отдаленном периоде после операции.
Из 85 наблюдений в 58 (68%) было выявлено расширение «полярной», или так называемой задней, желудочной вены, причем у 19 (22%) больных оно сочеталось с расширением ЛЖВ, у 39 (46%) - с расширением ЛЖВ и КВЖ.
Эти обстоятельства диктуют необходимость внедрения в существующий диагностический алгоритм в период, предшествующий хирургическому вмешательству, исследования коллатерального кровотока желудка, которое возможно либо путем прямой портографии, либо с помощью компьютерной ангиотомографии с трехмерной реконструкцией коллатерального венозного кровообращения желудка.
Произведенные хирургические вмешательства имели определенные особенности. Так, хотя средняя продолжительность операций в 1-й (158±43 мин) и 2-й (174±37 мин) группах по сравнению с контрольной группой (145±33 мин) была больше, это различие оказалось недостоверным (р>0,05). Нами не получено также достоверных различий по объему интраоперационной кровопотери.
Таким образом, такие факторы, как технические сложности хирургического вмешательства, объем интраоперационной кровопотери и продолжительность операции в рассматриваемых группах больных, не могли значимо влиять на течение ближайшего послеоперационного периода.
Из общего количества оперированных больных осложнения развились в 11% наблюдений. У 11 больных мы констатировали развитие 21 осложнения. Из этих 11 больных умерли 4, в том числе 2 во 2-й группе и 2 в контрольной. Общая летальность в послеоперационном периоде по отношению ко всем оперированным больным составила 4%. Летальных исходов в 1-й группе не отмечено.
Ведущим осложнением, приведшим к летальному исходу, стал геморрагический синдром, который проявился эпизодами пищеводно-желудочных и внутрибрюшных кровотечений.
Главной причиной подавляющего большинства развившихся осложнений, по нашему мнению, является исходная тяжесть течения заболевания со снижением степени компенсации функционального состояния печени и резервного потенциала пациентов.
Отдаленные результаты хирургических вмешательств в исследуемых группах больных изучены в сроки до 2 лет после операции. К концу 1-го года наблюдения мы имели информацию о течении отдаленного послеоперационного периода у 36 пациентов 1-й группы, у 20 больных 2-й группы и у 33 больных 3-й группы. К концу 2-го года наблюдения отдаленные результаты были изучены у 31, 15 и 28 больных соответственно 1, 2 и 3-й группы.
Эти количественные взаимоотношения к окончанию срока наблюдения сформировались вследствие имевших место летальных исходов в определенной части наблюдений и невозможности проконтролировать судьбу некоторых больных из-за смены места жительства и потери контакта с ними. В течение первых 6 мес наблюдения ни в одной из групп не отмечено летальных исходов.
В течение второго полугодия умерли 2 больных 2-й группы и 2 больных 3-й группы. В течение 2-го года наблюдения умерли еще 5 больных: 1 в 1-й группе, 2 во 2-й и еще 2 в 3-й группе.
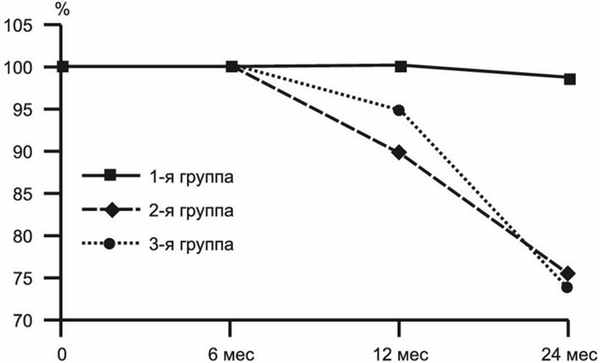
Полученные данные позволили рассчитать показатели выживаемости больных (рис. 2). Рисунок 2. Выживаемость больных в течение 2 лет наблюдения. К 6 мес наблюдения во всех группах отмечена 100% выживаемость. При дальнейшем наблюдении ситуация по данному показателю начинает меняться: к годичному периоду выживаемость в 1-й группе составляет 100%, во 2-й группе она снизилась до 94%, в 3-й - до 88%. К 2 годам наблюдения выживаемость в 1-й группе составила 96,7%; во 2-й - 78% и в 3-й группе - 77%.
Эндоскопический мониторинг осуществляли через 3, 6, 12 мес. С учетом полученных данных рецидивы венообразования в 1-й группе были достоверно ниже (p<0,05) по сравнению со 2-й и контрольной группами.
Также констатировали значительно худшую картину гастропатии (большая частота и тяжесть изменений в слизистой желудка) в контрольной и 2-й группах по сравнению с 1-й.
О роли деваскуляризации и методах ее проведения в общей композиции операции АПР можно судить на основании результатов проведенных исследований, посвященных проблеме формирования варикозной трансформации вен пищевода и желудка.
Применение многими авторами технологии деваскуляризации пищевода и желудка предусматривает пристеночное пересечение связочного аппарата вдоль малой и большой кривизны желудка, при этом стволовая часть регионарных коллекторов - ЛЖВ и ЗЖВ - остается интактной, что способствует более быстрой венозной реваскуляризации в местах пересечения и образованию вторичных ВРВ.
Кроме того, такая мобилизация представляет собой не что иное, как селективную или суперселективную ваготомию, целесообразность которой у этой категории больных сомнительна. К тому же подобный вариант деваскуляризации сопровождается пересечением не только множества мелких венозных, но и артериальных сосудов, что может негативно отразиться на трофике слизистой желудка и пищевода.
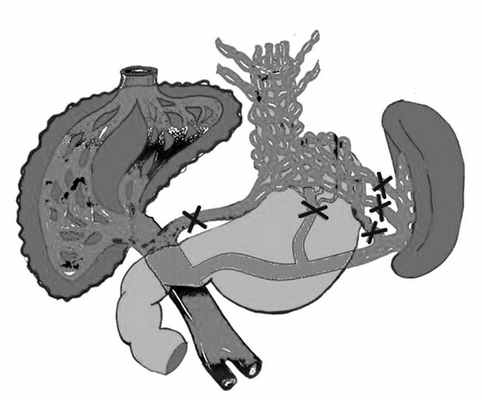
По нашему мнению, если в отношении КВЖ, проходящих в составе желудочно-селезеночной связки, особых разногласий в способе их блокирования нет - это достигается путем мобилизации верхней трети и кардиоэзофагеального отдела желудка, то в отношении ЛЖВ мы стоим на позиции необходимости ее пересечения или перевязки в составе желудочно-панкреатической связки, до момента ее разветвления в толще малого сальника (рис. 3). Рисунок 3. Схема деваскуляризации желудка.
Обязательным компонентом вмешательства является перевязка или пересечение всех коллатералей, идущих из забрюшинного пространства к кардиальному отделу желудка, особенно ЗЖВ.
Данный элемент АПР мы сочетаем с основным этапом операции - проксимальной гастротомией и тщательным прошиванием ВРВ эзофагокардиальной зоны, т.е. операцией по методу М.Д. Пациоры.
Оценка роли деваскуляризации при проведении операций АПР позволяет нам высказать ряд соображений.
1. Применение деваскуляризации в качестве самостоятельного метода лечения и профилактики кровотечений из ВРВ малоэффективно.
2. Выполнение деваскуляризации в качестве дополнительной меры АПР в ходе выполнения операции М.Д. Пациоры повышает эффективность вмешательства по отношению к профилактике кровотечений из ВРВ пищевода и желудка.
3. Осуществление деваскуляризации путем интраоперационной стволовой блокады основных венозных коллекторов желудка является менее травматичным, по сравнению с другими технологиями деваскуляризации.
5. Роль ЗЖВ в формировании варикозной трансформации вен желудка и необходимости ее перевязки при проведении этапа деваскуляризации недооценена.
6. При проведении операции М.Д. Пациоры в изолированном виде или в сочетании с неполной деваскуляризацией требуется более строгий послеоперационный мониторинг и при рецидиве венообразования следует, кроме эндоскопических методов их облитерации, использовать рентгено-эндоваскулярную эмболизацию сохранных венозных коллекторов желудка.
Таким образом, операция М.Д. Пациоры, дополненная деваскуляризацией желудка, не сопровождается достоверным увеличением интраоперационной кровопотери и продолжительности вмешательства. Применение деваскуляризации желудка в дополнение к прошиванию варикозно-расширенных вен пищевода и желудка позволило повысить двухлетнюю выживаемость с 77 до 97%, усилить гемостатический эффект с 51 до 89%, снизить частоту рецидивов венообразования с 25 до 5%, уменьшить проявление гастропатии в отдаленном послеоперационном периоде, обеспечивая таким образом повышение эффективности операции азигопортального разобщения.
С целью предоперационной верификации особенностей внеорганного коллатерального венозного кровотока желудка, планирования объема операции азиго-портального разобщения следует использовать компьютерную ангиотомографию или прямую портографию.
[1] Все исследования и вмешательства выполнял к.м.н. В.А. Черкасов - старший научный сотрудник отделения рентгенохирургических методов диагностики и лечения РОНЦ им. Н.Н. Блохина.
Эволюция технологий азигопортального разобщения в профилактике кровотечений портального генеза
Варикозное расширение вен пищевода и желудка является наиболее частым и опасным осложнением портальной гипертензии. Его выявляют у 80–90% больных циррозом печени. В развивающихся странах летальность при кровотечении достигает 60%, в странах с высоким уровнем развития гепатологической службы составляет порядка 20%. Среди больных циррозом, ожидающих трансплантации печени, она составляет 24,4%. В многочисленных клинических рекомендациях и лечебных протоколах для профилактики и остановки кровотечения предложено трансъюгулярное внутрипеченочное портосистемное шунтирование (TIPS), однако раннее развитие энцефалопатии и риск тромбоза шунта уменьшают ценность метода. Значительно ограничены возможности TIPS при подпеченочной портальной гипертензии. Недостатки портосистемных шунтирующих вмешательств заставляют уделять более пристальное внимание операциям азигопортального разобщения.
Ключевые слова
Об авторах
100115, Ташкент, ул. Кичик Халка Йули, д. 10, Узбекистан
доктор мед. наук, профессор, руководитель отделения хирургии портальной гипертензии и панкреатодуоденальной зоны, директор Республиканского специализированного центра хирургии им. акад. В. Вахидова, Ташкент
100115, Ташкент, ул. Кичик Халка Йули, д. 10, Узбекистан
доктор мед. наук, профессор, главный научный сотрудник отделения хирургии портальной гипертензии и панкреатодуоденальной зоны Республиканского специализированного центра хирургии им. акад. В. Вахидова, Ташкент
100115, Ташкент, ул. Кичик Халка Йули, д. 10, Узбекистан
доктор мед. наук, старший научный сотрудник отделения хирургии портальной гипертензии и панкреатодуоденальной зоны Республиканского специализированного центра хирургии им. акад. В. Вахидова, Ташкент
100115, Ташкент, ул. Кичик Халка Йули, д. 10, Узбекистан
младший научный сотрудник отделения хирургии портальной гипертензии и панкреатодуоденальной зоны Республиканского специализированного центра хирургии им. акад. В. Вахидова, Ташкент
Список литературы
1. Eck N.V. Ligature of the portal vein. Voeno Med. Jr. 1877; 130 (2): 1–2.
2. Whipple A.O. The problem of portal hypertension in relation to the hepatosplenopathies. Ann. Surg. 1945; 122 (4): 449–475.
3. Brunner F., Berzigotti A., Bosch J. Prevention and treatment of variceal haemorrhage in 2017. Liver Int. 2017; 37 (1): 104–115. DOI: 10.1111/liv.13277.
4. Villanueva C., Colomo A., Aracil C., Guarner C. Current endoscopic therapy of variceal bleeding. Best Pract. Res. Clin. Gastroenterol. 2008; 22 (2): 261–278. DOI: 10.1016/j.bpg.2007.11.012.
5. Carbonell N., Pauwels A., Serfaty L., Fourdan O., Lévy V.G., Poupon R. Improved survival after variceal bleeding in patients with cirrhosis over the past two decades. Hepatology. 2004; 40 (3): 652–659. DOI: 10.1002/hep.20339.
6. Garcia-Pagan J.C.G., Barrufet M., Cardenas A., Escorsell A. Management of gastric varices. Clin. Gastroenterol. Hepatol. 2010; 12 (6): 919–928. DOI: 10.1097/PMID.0000000000001725.
7. Cordon J.P., Torres C.F., García A.B., Rodriguez F.G., de Parga J.M.S. Endoscopic management of esophageal varices. World J. Gastrointest. Endosc. 2012; 4 (7): 312–322. DOI: 10.4253/wjge.v4.i7.312.
8. Yin L., Liu H., Zhang Y., Rong W. The surgical treatment for portal hypertension: A systematic review and meta-analysis. ISRN Gastroenterol. 2013; 2013: 464053. DOI: 10.1155/2013/464053.
9. Yang L., Yuan L.-J., Dong R., Yin J.-K., Wang Q., Li T., Li J.-B., Du X.-L., Lu J.-G. Two surgical procedures for esophagogastric variceal bleeding in patients with portal hypertension. World J. Gastroenterol. 2013; 19 (48): 9418–9424. DOI: 10.3748/wjg.v19.i48.9418.
11. Schiff E.R., Maddrey W.C., Sorrell M.F. Schiff's diseases of the liver. 11th edition. In 3 vol. Vol. 2. Lippincot Williams and Wilkins. November 2014. P. 68–111.
12. Jiang G.Q., Bai D.S., Chen P., Qian J.J., Jin S.J. laparoscopic splenectomy and azygoportal disconnection: A systematic review. JSLS. 2015; 19 (4): pii: e2015.00091. DOI: 10.4293/JSLS.2015.00091.
13. Nazyrov F.G., Castro-Benitez C., Devyatov A.V., Baba djanov A.K., Salimov U.R., Mardonov L.L. Comparisons between portosystemic shunting modalities in patients with liver cirrhosis and portal hypertension. Liver Res. Open J. 2016; 2 (1): 1–8. DOI: 10.17140/LROJ-2-109.
14. Hernández-Gea V., Berbel C., Baiges A., García-Pagán J.C. Acute variceal bleeding: risk stratification and management (including TIPS). Hepatol. Int. 2017 [Epub ahead of print]. P. 1–10. DOI: 10.1007/s12072-017-9804-3.
15. Puhl G., Gül S., Neuhaus P. Portosystemic shunt surgery between TIPS and liver transplantation. Chirurg. 2011; 82 (10): 898–905. DOI: 10.1007/s00104-011-2100-1.
16. Sarin S.K., Kumar A., Angus P.W., Baijal S.S., Chawla Y.K., Dhiman R.K., Janaka de Silva H., Hamid S., Hirota S., Hou M.C., Jafri W., Khan M., Lesmana L.A., Lui H.F., Malhotra V., Maruyama H., Mazumder D.G., Omata M., Poddar U., Puri A.S., Sharma P., Qureshi H., Raza R.M., Sahni P., Sakhuja P., Salih M., Santra A., Sharma B.C., Shah H.A., Shiha G., Sollano J. Primary prophylaxis of gastroesophageal variceal bleeding: consensus recommendations of the Asian Pacific Association for the Study of the Liver. Hepatol. Int. 2008; 2 (4): 429–439. DOI: 10.1007/s12072-010-9236-9.
17. de Franchis R. Revising consensus in portal hypertension: report of the Baveno V consensus workshop on methodology of diagnosis and therapy in portal hypertension. J. Hepatol. 2010; 53 (4): 762–768. DOI: 10.1016/j.jhep.2010.06.004.
18. Hosokawa I., Adam R., Allard M.A., Pittau G., Vibert E., Cherqui D., Sa Cunha A., Bismuth H., Miyazaki M., Castaing D. Outcomes of surgical shunts and transjugular intrahepatic portasystemic stent shunts for complicated portal hypertension. Br. J. Surg. 2017; 104 (4): 443–451. DOI: 10.1002/bjs.10431.
19. Feng A.C., Liao C.Y., Fan H.L., Chen T.W., Hsieh C.B. The modified Sugiura procedure as bridge surgery for liver transplantation: a case report. J. Med. Case Reports. 2015; 9: 50. DOI: 10.1186/s13256-015-0522-y.
20. de Franchis R. Expanding consensus in portal hypertension. Report of the Baveno VI Consensus Workshop: Stratifying risk and individualizing care for portal hypertension. J. Hepatol. 2015; 63 (3): 743–752. (European Association for the Study of the Liver). DOI: 10.1016/j.jhep.2015.05.022.
21. Wright A.S., Rikkers L.F. Current management of portal hypertension. J. Gastrointest. Surg. 2005; 9 (7): 992–1005. DOI: 10.1016/j.gassur.2004.09.028.
22. Garcia-Pagan J.C., De Gottardi A., Bosch J. Review article: the modern management of portal hypertension – primary and secondary prophylaxis of variceal bleeding in cirrhotic patients. Aliment. Pharmacol. Ther. 2008; 28 (2): 178–186. DOI: 10.1111/j.1365-2036.2008.03729.x.
23. Yachha S.K., Chetri K., Lal R. Management of portal hypertension. Indian J. Pediatr. 2002; 69 (9): 809–813. DOI: 10.1007/BF02723696.
24. Poddar U., Thapa B.R., Rao K.L., Singh K. Etiological spectrum of esophageal varices due to portal hypertension in Indian children: is it different from the West? J. Gastroenterol. Hepatol. 2008; 23 (9): 1354–1357.
25. Савельев В.С., Кириенко А.И. Клиническая хирургия: национальное руководство. В 3 томах. Том 2. М.: ГЭОТАР- Медиа, 2009. C. 627–641.
26. Elkrief L., Rautou P.E., Ronot M., Lambert S., Dioguardi Burgio M., Francoz C., Plessier A., Durand F., Valla D., Lebrec D., Vilgrain V., Castéra L. Prospective comparison of spleen and liver stiffness by using shear-wave and transient elastography for detection of portal hypertension in cirrhosis. Radiology. 2015; 275 (2): 589–598. DOI: 10.1148/radiol.14141210.
28. Boerema I., Klopper P.J., Holscher A.A. Transabdominal ligation-resection of the esophagus in cases of bleeding esophageal varices. Surgery. 1970; 67 (3): 409–413.
29. Jarnagin W.R. Blumgart's surgery of the liver, pancreas and biliary tract: expert consultation. 5th edition. 2 Vol. Set. Vol. 1. Philadelphia PA: Elsevier Saunders, 2012. P. 1140–1150.
30. Воробей А.В., Климович В.В., Жура А.В. Разобщающие операции в лечении кровоточащего пищеводно-желудочного варикоза при портальной гипертензии (обзор литературы). Медицинская панорама. 2007; 2: 29–34.
31. Затевахин И.И., Щеглов А.А. Применение октреотида в хирургической гастроэнтерологии. Методические руководства (пособие для врачей). М.: Медицина, 2000. C. 16–18.
32. Tanner N.C. Operative management of haematemesis and melaena; with special reference to bleeding from esophageal varices. Ann. R. Coll. Surg. Engl. 1958; 22 (1): 30–42.
33. Назыров Ф.Г., Акилов Х.А., Девятов А.В. Хирургия осложнений портальной гипертензии у больных циррозом печени. М.: ГЭОТАР Медицина, 2002. C. 8–40.
34. Walker R.M. Transection operations for portal hypertension. Thorax. 1960; 15: 218–224.
35. Yoshida H., Mamada Y., Taniai N., Yoshioka M., Hirakata A., Kawano Y., Mizuguchi Y., Shimizu T., Ueda J., Uchida E. Risk factors for bleeding esophagogastric varices. J. Nippon Med. Sch. 2013; 80 (4): 252–259.
36. Гарелик П.В., Могилевец Э.В., Мармыш Г.Г. Операция азигопортального разобщения в профилактике и лечении кровотечений из варикозно-расширенных вен пищевода и желудка. Журнал Гродненского государственного медицинского университета. 2011; 3 (35): 7–11.
37. Hassab M.A. Gastroesophageal decongestion and splenectomy in the treatment of esophageal varices in bilharzial cirrhosis: further studies with a report on 355 operations. Surgery. 1967; 61 (2): 169–176.
38. Liu Y., Li Y., Ma J., Lu L., Zhang L.A. Modified Hassab's operation for portal hypertension: experience with 562 cases. J. Surg. Res. 2013; 185 (1): 463–468. DOI: 10.1016/j.jss.2013.05.046.
39. Котив Б.Н., Дзидзава И.И., Жестовская С.И., Кудрявцева А.В. Синдром портальной гипертензии. Лекция. Ч. 1. Медицинская визуализация. 2010; 6: 21–36.
40. Hardy T.G., Pace W.G., Maney J.W., Katz A.R., Kaganov A.L. A biofragmentable ring for sutureless bowel anastomosis: an experimental study. Dis. Colon. Rectum. 1985; 28 (7): 484–490. DOI: 10.1007/BF02554090.
41. Forde K.A., McLarty A.J., Tsai J., Ghalili K., Delany H.M. Murphy’s button revisited. Clinical experience with the biofragmentable anastomotic ring. Ann. Surg. 1993; 217 (1): 78–81.
42. Debain J.J., Peytral C., Marandas P., Sauvage J.P. Stenoses caused by Murphy's button in the treatment of esophageal varices. Ann. Otolaryngol. Chir. Cervicofac. 1975; 92 (1–2): 5–16.
43. Sugiura M., Futagawa S. A new technique for treating esophageal varices. J. Thor. Cardiovasc. Surg. 1973; 66 (5): 677–685.
45. Selzner M., Tuttle-Newhall J.E., Dahm F., Suhocki P., Clavien P.-A.J. Current indications of a modified Sugiura procedure in the management of variceal bleeding. J. Am. Coll. Surg. 2001; 193 (2): 166–173.
47. Cooley D.A., DeBakey M.E. Subtotal esophagectomy for bleeding esophageal varices. AMA Arch. Surg. 1954; 68 (6): 854–871. DOI: 10.1001/archsurg.1954.01260050856015.
48. Nazyrov F.G., Devyatov A.V., Babadjanov A.Kh., Ruziboev S.A. Results of gastroesophageal collector total dissociation in patients with portal hypertension. J. Life Sci. Biomed. 2016; 6 (5): 115–119.
Хирургия портальной гипертензии. Эффективность азигопортального разобщения
Основная причина развития синдрома портальной гипертензии – цирроз печени, частота которого, по данным ВОЗ, составляет от 1 до 11% в популяции. Средний возраст заболеваемости циррозом печени – 46,1 года. В настоящее время заболеваемость циррозом печени в мире составляет около 20-40 больных на 100 тысяч населения.
Цирроз печени — шестая по частоте причина смерти в РФ и опережает такие онкологические заболевания, как рак желудка и толстой кишки. ВОЗ связывает этот факт с ростом заболеваемости вирусными гепатитами – в первую очередь гепатитом В и гепатитом С. Социальная и экономическая значимость проблемы вирусных гепатитов определяться высоким процентом перехода инфекции в хронические формы с последующим развитием тяжелых осложнений, среди которых цирроз печени и синдром портальной гипертензии.
Портальная гипертензия является неблагоприятным прогностическим фактором. Средняя продолжительность жизни после ее верификации – 1,5 года. У пациентов с циррозом печени в 90% случаев развивается варикозное расширение вен пищевода, которое в 30% случаев осложняется кровотечением, в том числе профузными. Летальность при кровотечении из вен пищевода составляет 20%, при рецидиве кровотечения — до 30%.
Оказание медицинской помощи пациентам с осложнениями портальной гипертензии в стационарах города и области выполняется в объеме «неотложной медицинской помощи», предусматривающей, как правило, остановку кровотечения и восполнение кровопотери. В дальнейшем, пациент наблюдается у врачей различных специальностей (хирург, гастроэнтеролог, гепатолог, инфекционист) в поликлинике по месту жительства. В лечебных учреждениях города специализированная, в том числе высокотехнологичная медицинская помощь при портальной гипертензии не реализуется, в виду значительных требований к подготовке специалистов, ведению пациентов в пери- и послеоперационном периодах.
До недавнего времени судьба таких пациентов была связана с мучительным ожиданием рецидива кровотечения с предсказуемым исходом. К большому сожалению, отсутствие информированности пациентов и врачей амбулаторного звена о месте возможного лечения, лишает их возможности получить высококвалифицированную медицинскую помощь по хирургической коррекции портальной гипертензии с целью профилактики кровотечений или их рецидива.
На базе 1-го хирургического отделения кафедры общей хирургии с клиникой пропедевтической хирургии Самарского государственного медицинского университета с 2013 года реализуются современные методы хирургической коррекции портальной гипертензии. Врачи клиники неоднократно проходили курсы повышения квалификации в специализированных центрах Москвы и Нижнего Новгорода. Наши сотрудники имеют богатый опыт лечения пациентов с такими сложными нозологическими формами патологии печени и ее сосудов как:
- цирроз печени различной этиологии, осложненный кровотечениями из варикозно расширенных вен пищевода;
- портальная гипертензия, обусловленная тромбозом печеночных вен с угрозой или состоявшимся кровотечением из варикозно расширенных вен пищевода;
- портальная гипертензия, обусловленная тромбозом воротной вены с угрозой или состоявшимся кровотечением из варикозно расширенных вен пищевода;
- острый тромбоз воротной вены;
- портальная гипертензия неясной этиологии с варикозным расширением вен пищевода;
- «портальная кавернома» (по данным УЗИ и/или КТ).
Оказание хирургической помощи при синдроме портальной гипертензии, осложненной кровотечениями из варикозно расширенных вен пищевода, предусматривает следующие опции лечения:
Шунтирующие операции:
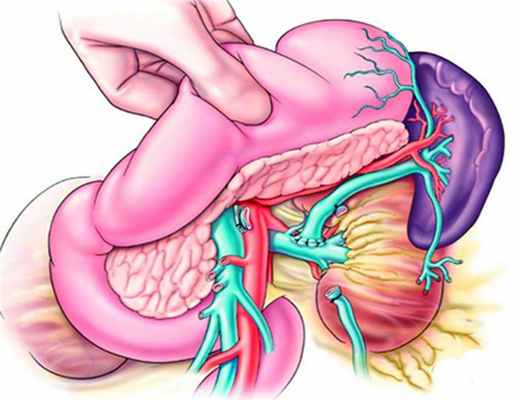
- наложение дистального спленоренального анастомоза;
- наложение проксимального спленоренального анастомоза;
- наложение селективного Н-образного спленоренального анастомоза.
Операции азигопортального разобщения:
- деваскуляризация желудка и пищевода (операция Hassab);
- аппаратная транссекция пищевода;
- прямые операции на венах желудка и пищевода (операция Tanner).
Эндоваскулярные операции:
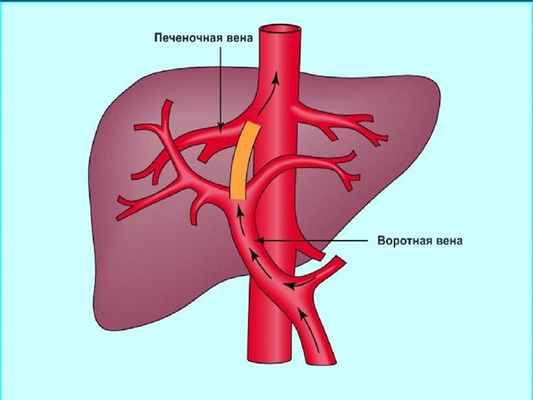
- наложение прямого портосистемного анастомоза (операция TIPS);
- редукция селезеночного кровотока;
- тандемные (гибридные) операции реканализации воротной вены (операция rendez-vous) по эксклюзивной технологии, не имеющей аналогов в РФ.
Эндоскопические операции:
- аппаратное лигирование варикозно расширенных вен пищевода и желудка.
Реабилитация пациентов в послеоперационном периоде включает в себя таргетное лечение в хирургическом отделении в ранние сроки после вмешательства, наблюдение в отдаленном периоде с повторными госпитализациями, в том числе, в отделение гастроэнтерологии Клиник (при необходимости).
Таким образом, в Клиниках СамГМУ есть все возможности для создания замкнутого цикла ведения пациентов с патологией печени, осложненной портальной гипертензией, а 1-е хирургическое отделение кафедры и клиники пропедевтической хирургии можно рассматривать как базу оказания специализированной и высокотехнологичной хирургической помощи профильным пациентам.
На базе специализированного консультативного Центра Клиник организован амбулаторный прием пациентов с синдромом портальной гипертензии с целью постановки их в лист ожидания и выполнения планового оперативного лечения. Для наибольшей эффективности консультации пациенту оптимально иметь при себе:
- Общий анализ крови.
- Биохимический анализ крови (билирубин, общий белок, альбумин, АлТ, АсТ, ЩФ, ГГТП, мочевина, креатинин, К, Na, Cl).
- Данные гемостаза (ПТИ, МНО, АЧТВ).
- Данные УЗИ органов брюшной полости.
- Данные ЦДК сосудов печени.
- Данные КТ брюшной полости с контрастным болюсным усилением (с диском на руках).
- Данные исследования крови на наличие вирусов гепатита В и С (антител к вирусам).
По вопросам лечения и консультирования обращайтесь к нашим специалистам по телефонам (в рабочие дни с 9.00 до 15.00):
При своевременно начатом лечении можно предупредить развитие опасных осложнений и остановить прогрессирование заболевания!
Последние статьи

Следует помнить, что клещи обитают не только в лесах, но и в парках, и на садовых участках. Могут быть клещи […]
Следует помнить, что клещи обитают не только в лесах, но и в парках, и на садовых участках. Могут быть клещи и в городах: на газонах, в траве вдоль обочин дорог. Клещи могут быть занесены домой животными; на ветках, на дачных или лесных цветочных букетах, вениках или траве; на одежде, в которой Вы гуляли в лесу. Дома клещ может присосаться к любому члену Вашей семьи, причем даже несколько суток спустя.
Когда наиболее опасны клещи?
Активизируются клещи в период с апреля по сентябрь — до первых заморозков. Пик активности приходится на май-июль, но укусы клещей возможны с апреля по октябрь.
Чем грозит укус клеща?
Иксодовые клещи являются переносчиками возбудителей некоторых природно-очаговых инфекций: клещевого энцефалита, иксодовых клещевых боррелиозов, моноцитарного эрлихиоза человека и гранулоцитарного анаплазмоза человека.
ЧТО ДЕЛАТЬ, ЕСЛИ УКУСИЛ КЛЕЩ?
Паниковать не нужно — вовремя принятые правильные меры помогут предотвратить возможные негативные последствия.
1. Удаляем клеща. Человеку, пострадавшему от укуса клеща, необходимо обратиться за медицинской помощью в территориальную поликлинику по месту жительства, в районную СЭС или районный травмпункт для удаления клеща, а также для организации медицинского наблюдения, с целью своевременной постановки диагноза клещевой инфекции и решения вопроса о назначении профилактического лечения. Если по какой-то причине у вас нет возможности обратиться за помощью в медицинское учреждение, то клеща придется удалять самостоятельно, причем, чем раньше Вы удалите впившегося паразита, тем лучше.
2. Отправляем снятого клеща на исследование. Удаленного клеща следует поместить в небольшую герметично закрывающуюся емкость с небольшим кусочком чуть влажной ваты или салфетки и направляют в лабораторию. Банку с клещом помещают в холодильник при невозможности ее транспортировки в лабораторию сразу после удаления клеща. В течение двух дней клеща надо отвезти в лабораторию для исследования на наличие клещевых инфекций.
Лабораторное исследование клещей организовано ФБУЗ «Центр гигиены и эпидемиологии в Самарской области» по следующему графику:
Однако, следует понимать, что наличие инфекции у клеща еще не значит, что заболеет человек. Анализ клеща нужен для спокойствия в случае отрицательного результата и бдительности — в случае положительного. Желательно, чтобы человек, пострадавший от укуса клеща, наблюдался врачом-инфекционистом в течение месяца, который в случае необходимости назначит необходимые меры профилактики или лечения.
Не надо заниматься самолечением, если есть сомнения – обратитесь к врачу! Если укус клеща имел место, в случае ухудшения самочувствия незамедлительно обратиться к врачу!
КАК ЗАЩИТИТЬСЯ ОТ УКУСОВ КЛЕЩЕЙ?
Необходимо соблюдать меры индивидуальной профилактики при посещении лесных массивов:

В Самарской области водится два вида ядовитых змей – обыкновенная и восточная степная гадюки. ! Не рекомендуется ходить по лесу […]
В Самарской области водится два вида ядовитых змей – обыкновенная и восточная степная гадюки.
! Не рекомендуется ходить по лесу босиком.
! Занимаясь поиском грибов или ягод, не раздвигать траву и кустарник руками, а использовать для этого палку. Потревоженная палкой змея быстро уползает.
! Нельзя брать змею в руки.
! Нужно помнить, что перед укусом змея сворачивается петлеобразно, затем молниеносно выбрасывает вперед переднюю часть тела, кусает и столь же мгновенно оттягивает голову назад.
Обычно гадюки не нападают на человека. Кусают гадюки либо в момент опасной близости человека, когда тот случайно наступает или трогает змею руками. Либо когда человек попадает в место гнездования гадюки, и та защищает территорию. Первый вариант намного более распространен. Второй обычно случается весной, в период размножения.
Для профилактики укусов необходимо правильно подбирать одежду и обувь, планируя визит в лес или на озеро. Свободные плотные брюки способны не дать змее добраться до кожи, а резиновые сапоги она вряд ли вообще прокусит. Кроме того, чаще всего гадюка предупреждает о своем присутствии шипением. Если оставить гадюку в покое, она обязательно будет стремиться уползти. По большому счету, чтобы не быть укушенным змеей, нужно просто быть внимательнее, и, если Вы все-таки ее увидели, не пытаться ловить или «играть» с ней.
ЕСЛИ ВАС УКУСИЛА ГАДЮКА
Во-первых, не паникуйте! Яд гадюки опасен, но не смертелен. Яд гадюки, в частности, резко нарушает проницаемость кровеносных сосудов — возникают обширные кровоизлияния под кожей. Область вокруг укуса отекает и приобретает синюшный оттенок. Смертность при укусе гадюки составляет не более 1% от числа всех укушенных. Наибольшую опасность представляет укус в область головы и шеи, т. к. в этом случае отек, последующий за укусом, может перекрыть дыхательные пути и человек задыхается. Так же опасны укусы для людей с ослабленной иммунной системой, людей с сердечно-сосудистыми и аллергическими заболеваниями. Очень опасны укусы для маленьких детей.
Самое главное при укусе — это в кратчайшие сроки обратиться за медицинской помощью. Если сделать это в течение 30-60 минут после укуса, можно будет ввести сыворотку, которая облегчит последствия попадания яда в организм. Сыворотка очень аллергогенна, не стоит вводить ее самостоятельно, без контроля со стороны медработника. Далее пострадавшему от укуса назначают антигистаминные препараты и инфузионную терапию, проводится профилактика столбняка.
ПЕРВАЯ ПОМОЩЬ ПРИ УКУСЕ ЗМЕИ
В первую очередь, чего делать нельзя:
- Нельзя прижигать рану каким бы то ни было способом (зеленкой, йодом, огнем).
- Нельзя разрезать рану.
- Нельзя принимать алкоголь. Так же желательно не курить. Не нужно добавлять вредных веществ в организм.
- Нельзя накладывать жгут. Кровь он остановит, но в месте укуса возможно омертвение тканей.
Что необходимо сделать:
- Укушенного змеёй человека уложить в горизонтальное положение.
- По возможности в первые 10 минут уменьшить количество попавшего в ранку яда. Это можно сделать стеклянной посудой (стаканом, банкой) по тому же принципу, что ставятся медицинские банки (сосуд переворачивается вверх дном, внутри спичкой или зажигалкой выжигается кислород, сосуд устанавливается на место укуса).
- Необходимо расстегнуть ворот рубашки, манжеты и пояса, снять кольца, браслеты, обувь (если укус был в ногу). Это нужно для того, чтобы впоследствии, когда пострадавшая конечность начнет отекать, ее не передавило.
- Давать пострадавшему обильное, желательно сладкое питье. Пить надо не залпом, а понемногу, это уменьшит концентрацию попавших в кровь токсинов.
- Если есть возможность, принять противоаллергический препарат и обезболивающее.
- Место укуса желательно обработать раствором марганцовки и приложить холод
- Если укус был в руку или ногу, необходимо ее зафиксировать. Чем меньше двигается конечность, тем медленнее яд будет распространяться по организму.
- Наложить повязку и доставить пострадавшего в больницу.
При соблюдении постельного режима и врачебных рекомендаций последствия укуса проходят через полторы-две недели.
Геморрагическая лихорадка с почечным синдромом (ГЛПС) – тяжелое инфекционное заболевание, протекающее с повышением температуры тела, общей интоксикацией, поражением почек и […]
Геморрагическая лихорадка с почечным синдромом (ГЛПС) – тяжелое инфекционное заболевание, протекающее с повышением температуры тела, общей интоксикацией, поражением почек и кровеносных сосудов.
Источником инфекции являются мелкие грызуны (рыжая полевка, полевая мышь, серая и черная крыса, разные виды серых полевок) — их выделения. Заболевания людей могут возникать в любое время года, но наиболее часто регистрируются летом и осенью.
Передача инфекции человеку происходит различными путями. Вирус выделяется от грызунов со слюной, экскрементами. Зимой, когда устойчивость вируса во внешней среде значительно увеличивается, основной путь передачи инфекции – воздушно-пылевой. Особенно часто такие заражения происходят в закрытых помещениях, а также при перевозке сена и соломы; при лесоповале, сборе хвороста, сухого листа, сломе старых деревянных зданий, где отмечаются мышиные норы. В теплый период года основные пути заражения – через инфицированные пищевые продукты, инфицированную воду и при соприкосновении кожи и слизистых оболочек с зараженными предметами, реже – при укусах зверьков.
Скрытый период (от заражения до заболевания) продолжается от 10 до 35 дней, чаще 2–3 недели.
Начальными признаками заболевания являются повышение температуры, головная боль, боли в мышцах, слабость, сильная жажда, иногда боли в горле, тошнота, рвота, может быть жидкий стул, сыпь на теле, боли в пояснице и в животе, могут появиться изменения в моче и уменьшится ее количество.
При появлении первых признаков заболевания следует немедленно обратиться к врачу, так как больной ГЛПС в начале заболевания нуждается в строгом постельном режиме и постоянном медицинском наблюдении.
В ЦЕЛЯХ ПРОФИЛАКТИКИ:
- Во время работы при большом количестве пыли необходимо использовать рукавицы и респиратор или ватно-марлевую повязку;
- Уборка помещений должна проводиться только влажным способом;
- Строго соблюдать правила личной гигиены;
- Продукты должны быть недоступными для грызунов, храниться в металлической, плотно закрывающейся таре. Повреждённые грызунами пищевые продукты нельзя использовать в пищу без термической обработки;
- Ни в коем случае нельзя прикасаться к живым или мёртвым грызунам без рукавиц или резиновых перчаток;
- Обеспечить недоступность для грызунов в загородных домах, сооружениях в целях исключения условий для проникновения и обитания в них грызунов.
Интервенционные методы лечения боли – это малоинвазивные хирургические технологии, которые позволяют точно подвести необходимую дозу нужного лекарственного препарата к проблемной […]
Интервенционные методы лечения боли – это малоинвазивные хирургические технологии, которые позволяют точно подвести необходимую дозу нужного лекарственного препарата к проблемной зоне и устранить болевые проявления, а также способны убрать нервные структуры формирующие болевой стимул без повреждения окружающих тканей. Более широко известный термин — лечебно-диагностические блокады.
Читайте также:
