Иммунофенотипирование острых лейкозов - цели, задачи
Добавил пользователь Алексей Ф. Обновлено: 28.01.2026
В статье представлены результаты исследований иммунофенотипирования (ИФТ) с помощью метода проточной цитофлуориметрии и частоты выявляемости среди больных детей острых лимфобластных лейкозов: В-лимфобластный лейкоз/лимфома (В-ОЛЛ/лимфома) и Т-лимфобластный лейкоз/лимфома (Т-ОЛЛ/лимфома). По частоте распространенности в Кыргызской Республике (Киргизии) среди больных детей выявляется В-ОЛЛ/лимфома в 83% случаев, для сравнения: Т-ОЛЛ/лимфома в 17% случаев. При дифференциальной диагностике выявляются чаще варианты иммунофенотипа В-common (BII) в 91% случаев и пре Т-ОЛЛ(ТII) в 69% случаев. Среди больных детей кыргызской национальности выявлены в 11% случаев Т-ОЛЛ/лимфома и в 63% случаев В-ОЛЛ/лимфома, а среди больных детей жителей русскоязычного населения Кыргызской Республики в 6% случаев Т-ОЛЛ/лимфома и в 20% случаев В-ОЛЛ/лимфома. По частоте выявляемости более распространенный В-лимфобластный лейкоз/лимфома (В-ОЛЛ/ лимфома): и среди больных детей женского пола в 88% случаев, и среди больных детей мужского пола в 80% случаев. В сравнении преобладает среди мужского пола Т-лимфобластный лейкоз/лимфома (Т-ОЛЛ/лимфома) в 20% случаев, a у детей женского пола несколько реже - в 12% случаев. В-лимфобластный лейкоз/лимфома (В-ОЛЛ/лимфома) выявляется чаще cреди больных детей мужского пола кыргызской национальности - в 67% случаев, а среди больных детей жителей русскоязычного населения Кыргызской Республики в 94% случаев. Встречается Т-лимфобластный лейкоз/лимфома (Т-ОЛЛ/лимфома) чаще среди больных детей мужского пола кыргызской национальности в 87% случаев, а среди больных детей мужского пола жителей русскоязычного населения Кыргызской Республики - в 88% случаев. Проведенные исследования методом проточной цитофлуориметрии позволяют определить вариант линейности иммунофенотипа и при правильной постановке диагноза и своевременно подобранной ПХТ-терапии, и при наличии HLA-идентичного здорового донора или плацентарной крови, провести близкородственную, неродственную трансплантацию гемопоэтических стволовых клеток.
2. Van Dongen J.M., Lhermitte I., Bottcher S. EuroFlow antibody panels for standardized n-dimensional flow cytometric immunophenotyping of normal, reactive and malignant leukocytes.14th EHA Congress. Berlin. 2009. Р. 10-155.
3. Dohner H., Estey E., Grimwade D. Diagnosis and management of AML in adults:2017 ELN recommendations from an international expert panel. Blood. 2017. vol. 129. P. 421-447.
4. Bene M.C., Gastoldi G., Knapp W. Proposals for the immunological classification of acute leukemia European Group for the Immunological Characterization of Leukemia (EGIL)Leukemia 1995. vol. 9. P. 1783 -1786.
5. Swerdlow S.H., Compo E., Harris N. World Health Organization(WHO)Classification of Tumours of Haematopoietic and Lymphoid Tissues.International Agency for Research on cancer. 2017. P. 1-100.
6. Баратова Д.А. Исследование пуповинной крови на цитомегаловирусную инфекцию и наличие вируса Эпштейна-Барр методом ПЦР // Идеи Пастера в борьбе с инфекциями: материалы IV международной конференции, посвященной 85летию Санкт-Петербургского института имени Пастера и 120 летию Парижского института Пастера (Санкт- Петербург, 2- 4 июня 2008 г.). СПб.: Издательство ООО «Литография», 2008. C. 76.
На сегодняшний день заболевание острый лейкоз волнует всех, встречается и в развивающихся, и в развитых странах и выявляется у людей всех рас, как среди взрослого населения, так и среди детей.
Острый лейкоз – это острое злокачественное заболевание системы крови, с поражением на уровне детерминированных родоначальных - стволовых клеток или ранних клеточных предшественников, характеризующимся наличием опухолевых (бластных) клеток в костномозговом пунктате или в периферической крови от 20% и более.
Как отмечают авторы [1], при постановке диагноза «острый лейкоз» цитогенетические, цитохимические, морфологические исследования остаются мощным инструментом в клинической практике, но для подробного изучения клеток костного мозга метод проточной цитофлуометрии и при правильном сборе материала имеет, несомненно, большие преимущества.
В обосновании иммунофенотипического диагноза при острых лейкозах c помощью метода проточной цитофлуориметрии необходимо оценить особенности иммунофенотипических характеристик опухолевых клеток и определить вариант направленности Т и В, и исключить миелоидную и редкие варианты неясной линейности.
При В-лимфобластном лейкозе к В-клеточным маркерам относят CD19, CD79a, (cyCD79a), CD22(cyCD22), CD10,CD20. Фенотипы CD19+CD10+ при остром В- лимфобластном лейкозе являются наиболее распространенными.
При острых лимфобластных лейкозах (Т-лимфобластный лейкоз/лимфома) опухолевые клетки имеют фенотип, сходный с Т-линейными предшественниками. К ранним маркерам при T-ОЛЛ относятся CD 99,CD34, CD1a, терминальная дезоксинуклеотидил трансфераза (TdТ), cyCD3, CD7.
При диагностике необходимо в первую очередь оценить цитоплазматическую экспрессию CD3, который является единственным линейно-специфическим антигеном Т-линии.
Для определения линейной принадлежности опухолевых клеток применяются наборы антител, по рекомендации консорциума Еврофлоу [2], Европейской сети лейкемии [3], а также иcпользуются для дифференциальной диагностики классификации Европейской группы иммунологической характеристики острых лейкозов (EGIL) [4] и Всемирной организации здравоохранения (WHO) [5].
Однако нам, клиницистам, после постановки диагноза и определения варианта клеточной линейности необходимо сделать правильный подбор терапии (ПХТ).
Для целенаправленного лечения при онкогематологических заболеваниях у больных детей и у взрослых и для достижения хорошего результата от проведенной полихимиотерапии необходимо проводить иммунофенотипирование по системе HLA - главного комплекса гистосовместимости. Проведение близкородственной, неродственной трансплантации гемопоэтических стволовых клеток позволяется при наличии HLA – идентичного здорового донора или плацентарной крови [6].
На сегодняшний день трансплантация костного мозга дает лучшие результаты для увеличения выживаемости при лечении онкогематологических заболеваний.
Целью нашего исследования является определить частоту распространенности и провести ранний диагностический анализ иммунофенотипа опухолевой клеточной линейности при острых лимфобластных лейкозах у больных детей в Кыргызской Республике (Киргизии).
Материал и методы исследования
В группу исследования с ноября 2016 года по декабрь 2018 года вошли с острым лимфобластным лейкозом - 70 пациентов-детей (женского пола - 25, мужского пола - 45), все граждане Кыргызской Республики (Киргизии), в возрасте от 1,5 года до 16 лет, из них 52 кыргызской национальности и жителей русскоязычного населения Кыргызской Республики (Киргизии) - 18 пациентов-детей (женского пола - 3, мужского пола - 15), проходившие обследование в отделении детской онкологии Национального центра онкологии и гематологии Министерства здравоохранения Кыргызской Республики и в отделении детской гематологии Ошской межобластной клинической детской больницы г. Ош; в г. Санкт-Петербург на базе Евразийского центра онкогематологии, иммунологии и терапии больные консультированы врачами-гематологами. Иммунофенотипирование с помощью проточной цитофлуориметрии проводилось в г. Бишкек, Кыргызская Республика (Киргизия) [1].
Иммунофенотипирование с помощью метода проточной цитофлуориметрии
Материалом для исследования был костный мозг. Больным произведена пункция грудины. При получении материала необходимо соблюдать технику сбора. И для информативного, качественного результата пункционный анализ не должен быть с примесью крови и механически в пробирках с ЭДТА не разрушать клетки во время пробоподготовки к иммунофенотипированию. Иммунофенотипирование лейкозных (бластных) клеток проводят на проточном цитофлуометре Cytomics FC500 (Beckman Coulter, США) с использованием моноклональных антител Beckman Coulter.
Статистическая обработка полученных результатов включала в себя анализ стандартных критериев. χ2 -квадрат использовали для оценки достоверности различий по встречаемости определенных признаков между исследуемой группой. Определение величины «р», соответствующей найденному значению χ2–квадрат, велось на компьютерной программе с учетом одной степени свободы. Все математические расчеты и общий статистический анализ полученных исследований проводили с помощью персонального компьютера с использованием пакета прикладных программ для электронных таблиц Microsoft - ExcelM Версия 7,0 для Windows 95, для Windows 2010, Statistica 5.
Результаты исследования и их обсуждение
При проведении нами исследований диагноз «острый лимфобластный лейкоз» устанавливался на основании общих клинических данных и комплексных лабораторно-диагностических показателей. Диагностирование иммунофенотипированием с помощью метода проточной цитофлуориметрии даёт возможность определить вариант Т- и В-линейной направленности.
Сравнительная характеристика частоты встречаемости варианта иммунофенотипа при
В-лимфобластном лейкозе/лимфоме (В-ОЛЛ) и Т-лимфобластном лейкозе/лимфоме (Т-ОЛЛ) в Кыргызской Республике (Киргизии) (по классификации Европейской группы иммунологической характеристики острых лейкозов) [4]
Иммунофенотипирование острых лейкозов - цели, задачи
Острые лейкозы - история изучения, причины
Онкогематологические заболевания (гемобластозы) — злокачественные опухоли, происходящие из клеток крови. К основным группам гемобластозов относятся острые лейкозы, миелодиспластические синдромы, хронические миелопролиферативные заболевания и лимфопролиферативные заболевания.
Острые лейкозы (ОЛ) — опасные для жизни онкологические заболевания, опухолевые клетки которых происходят из клеток крови.
Первое описание лейкоза (лейкемии, или «белокровия») принадлежит R. Virchow (1845). Вскоре ОЛ были описаны немецкими и русскими врачами Е. Freidreich (1857), К. Славянским (1867) и В. Kussner (1876). Термины «острый» и «хронический», использующиеся для определения и классификации лейкозов, имеют историческое происхождение: до внедрения в практику эффективных методов лечения больные ОЛ погибали в течение нескольких недель; продолжительность жизни пациентов с хроническими лейкозами колебалась от нескольких месяцев до нескольких лет.
Острые лейкозы представляют собой отдельную нозологическую форму и никогда не трансформируются в хронические лейкозы.
Частота острых лейкозов в среднем составляет 4-5 случаев на 100 000 населения в год и приблизительно одинакова в различных регионах. На долю ОЛ приходится лишь 3% в структуре онкологической заболеваемости, однако значительно снижает общую выживаемость у лиц моложе 35 лет.
Выделяют два вида заболевания, которые различаются по течению, характеру проводимой химиотерапии и результатам лечения:
1) острый лимфобластный лейкоз (ОЛЛ), составляющий 80-90% в структуре лейкозов детей;
2) острые миелоидные лейкозы (ОМЛ), которые в 80% случаев развиваются у взрослых.
Средний возраст больных ОЛЛ составляет 10 лет, ОМЛ — 60-65 лет, однако обе формы острого лейкоза могут возникать в любом возрасте.
Заболеваемость острым миелобластным лейкозом составляет 2,5-3 случая на 100 000 населения в год, острым лимфобластным лейкозом — 1,5-2 случая на 100 000 населения в год.
Частота острого миелобластного лейкоза несколько выше у мужчин (1,5:1,0). Заболевание относительно редко встречается до 40-летнего возраста (1 случай на 100 000 населения), после чего начинает увеличиваться, достигая 15 на 100 000 у лиц 75 лет и старше. При ОЛЛ пик заболеваемости приходится на возрастную группу до 10 лет (это самая частая злокачественная опухоль у детей). В целом около 80% больных О Л составляют взрослые.
В связи с особенностями течения заболевания в различном возрасте выделяют две основные группы: острого лейкоза детей (до 15 лет) и острого лейкоза взрослых (старше 15 лет). Выделяется также третья группа — ОЛ пожилых (старше 60 лет), эффективность лечения которой существенно ниже из-за плохой переносимости интенсивной химиотерапии.
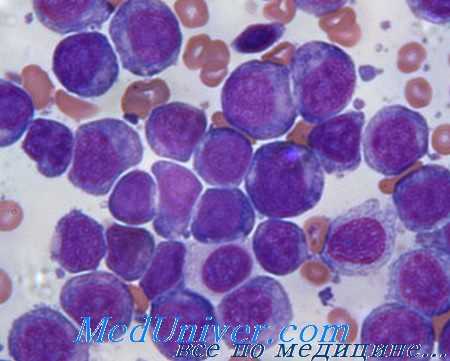
Мазок крови при остром лейкозе
Этиология острых лейкозов
В большинстве случаев этиологию заболевания установить невозможно. В связи с частым выявлением в опухолевых бластных клетках различных хромосомных изменений в качестве причин острых лейкозов предполагаются различные канцерогены.
Ионизирующая радиация как причина острого лейкоза. У лиц, переживших атомную бомбардировку Хиросимы и Нагасаки, отмечено 30-50-кратное увеличение частоты вторичных острых лейкозов (практически всегда — ОМЛ), причем наибольшее количество заболеваний возникло через 4-8 лет после воздействия ионизирующего излучения.
Повышенному риску развития острого миелобластного лейкоза (ОМЛ) способствует лучевая терапия и, особенно, комбинированное химиолучевое лечение. Лейкозогенное влияние малых доз ионизирующей радиации (диагностические рентгенологические или радионуклидные исследования) и электромагнитных полей не доказано.
Сигаретный дым содержит множество различных канцерогенов и поэтому является фактором риска развития острого лейкоза (ОЛ). У курящих больных старше 60 лет часто выявляются специфичные хромосомные нарушения, типичные для воздействия химических мутагенов. Предполагается, что не менее 20% случаев ОМЛ связано с курением.
Химическими соединениями со строго доказанными лейкозогенными свойствами являются бензол и цитостатические препараты. Бензол способствует развитию вторичных острых лейкозов при длительном производственном контакте.
Вторичные лейкозы — острые миелобластные лейкозы (ОМЛ), возникающие в различные сроки (чаще через 5-6 лет) после завершения химио- и/или лучевой терапии по поводу опухолевых или неопухолевых заболеваний. Среди цитостатических препаратов наибольшим лейкозогенным потенциалом обладают алкилирующие агенты и подофиллотоксины. Вероятность развития вторичного ОМЛ увеличивается у больных раком молочной железы и раком яичников, получавших алкилирующие агенты.
Среди алкилирующих агентов наименьшим лейкозогенным потенциалом обладает циклофосфамид. Применение подофиллотоксинов (этопозид и тенипозид) и алкилирующих агентов при остром лимфобластном лейкозе детей увеличивает частоту вторичного острого миелобластного лейкоза (ОМЛ).
Лечение подофиллотоксинами у взрослых и детей сопровождается повышенной частотой вторичного острого монобластного лейкоза с хромосомной аномалией llq23. Использование этопозида, доксорубицина увеличивает риск развития острого промиелоцитарного лейкоза (ОПЛ) с t(15;17).
Генетические заболевания как причина острого лейкоза. Некоторые генетические дефекты (синдром Дауна, анемия Фанкони, синдром Блюма, атаксия-телеангиэктазия) сопровождаются повышенным риском развития ОЛ. При синдроме Дауна наблюдается 20-кратное увеличение частоты ОЛ (у детей до 3 лет — мегакариобластного лейкоза, старше 3 лет — пре-В-ОЛЛ). У больных анемией Фанкони достоверно чаще развивается ОМЛ, при атаксии-телеангиэктазии — ОЛЛ и неходжкинские лимфомы.
Вирусы как причина острого лейкоза. Установлено, что Т-лимфотропный ретровирус человека (HTLV-1) имеет значение в возникновении Т-клеточной лейкемии/лимфомы взрослых. Роль онкогенных ретровирусов в развитии ОЛ человека не доказана. Вирус Эпштейна-Барр (ВЭБ) имеет значение в онкогенезе при В-ОЛЛ, эндемичных лимфомах Беркитта и лимфомах, ассоциированных с вирусом иммунодефицита человека.
Иммунологическая предрасположенность к развитию острого лейкоза не доказана, однако анализ различных цитогенетических вариантов острого миелобластного лейкоза (ОМЛ) позволил выявить ассоциацию между определенными локусами HLA и нарушениями кариотипа.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Гематология. ОСТРЫЕ ЛЕЙКОЗЫ: КЛАССИФИКАЦИЯ, ДИАГНОСТИКА И ЛЕЧЕНИЕ
Для цитирования: Нурмухаметова Е. Гематология. ОСТРЫЕ ЛЕЙКОЗЫ: КЛАССИФИКАЦИЯ, ДИАГНОСТИКА И ЛЕЧЕНИЕ. РМЖ. 1997;18:9.
Острый лейкоз - заболевание, в основе которого лежит образование клона злокачественных (бластных) клеток, имеющих общую клетку-предшественницу. Бласты инфильтрируют костный мозг, вытесняя постепенно нормальные гемопоэтические клетки, что приводит к резкому угнетению кроветворения. Для многих типов лейкозов характерна также бластная инфильтрация внутренних органов.
Острый лейкоз подразделяют на лимфобластный (ОЛЛ) и миелобластный (ОМЛ). Считается, что возникновение острого лейкоза могут обусловить следующие факторы:
- неустановленные (чаще всего);
- наследственные:
- синдром Дауна
- синдром Блума
- анемия Фанкони
- атаксия-телеангиэктазия
- синдром Клайнфелтера
- несовершенный остеогенез
- синдром Вискотта - Олдрича
- лейкоз у близнецов
- химические:
- бензол
- алкилирующие агенты (хлорамбуцил, мельфалан)
- радиоактивное облучение
- предрасполагающие гематологические расстройства (миелодисплазия, апластическая анемия)
- вирусы HTLV-I, вызывающие Т-клеточный лейкоз и лимфому у взрослых.
В последние десятилетия достигнуты значительные успехи в лечении острых лейкозов. Пятилетняя выживаемость зависит от типа лейкоза и возраста пациентов:
- ОЛЛ у детей - 65 - 75%;
- ОЛЛ у взрослых - 20 - 35%;
- ОМЛ у пациентов моложе 55 лет - 40 - 60%;
- ОМЛ у пациентов старше 55 лет - 20%.
Классификация
Различия между ОЛЛ и ОМЛ базируются на морфологических, цитохимических и иммунологических особенностях названных типов лейкозов. Точное определение типа лейкоза имеет первостепенное значение для терапии и прогноза.
Как ОЛЛ, так и ОМЛ в свою очередь подразделяются на несколько вариантов согласно FAB- классификации (French-American-British). Так, существуют три варианта ОЛЛ - L1, L2, L3 и семь вариантов ОМЛ:
- М0 - недифференцированный ОМЛ;
- М1 - миелобластный лейкоз без созревания клеток;
- М2 - миелобластный лейкоз с неполным созреванием клеток;
- М3 - промиелоцитарный лейкоз;
- М4 - миеломоноцитарный лейкоз;
- М5 - монобластный лейкоз;
- М6 - эритролейкоз;
- М7 - мегакариобластный лейкоз.
В соответствии с экспрессируемыми антигенами ОЛЛ делится на Т-клеточный и В-клеточный типы, включающие в себя в зависимости от степени зрелости несколько подтипов (пре-Т-клеточный, Т-клеточный, ранний пре-В-клеточный, пре-В-клеточный, В-клеточный). Четкая корреляция между морфологическими и иммунофенотипическими вариантами отсутствует, за исключением того, что морфология L3 характерна для В-клеточного лейкоза.
Что касается ОМЛ, иммунофенотипирование (т.е. определение экспрессируемых антигенов) не всегда помогает различить варианты М0 - М5. С этой целью дополнительно используют специальное цитохимическое окрашивание. Для постановки диагноза эритролейкоза (М6) и мегакариобластного лейкоза (М7) бывает достаточно иммунофенотипирования.
Распространенность
ОЛЛ наиболее часто возникает в возрасте 2 - 10 лет (пик в 3 - 4 года), затем распространенность заболевания снижается, однако после 40 лет отмечается повторный подъем. ОЛЛ составляет около 85% лейкозов, встречающихся у детей. ОМЛ, напротив, наиболее часто встречается у взрослых, причем частота его увеличивается с возрастом.
Клинические проявления
Клинические проявления при лейкозах обусловлены бластной инфильтрацией костного мозга и внутренних органов. Анемия проявляется бледностью, вялостью, одышкой. Нейтропения приводит к различным инфекционным осложнениям. Основные проявления тромбоцитопении - спонтанное образование гематом, кровотечения из носа, матки, мест инъекций, десен. Характерны также боли в костях, лимфаденопатия, гепатоспленомегалия. Возможны затруднение дыхания в связи с наличием медиастинальных масс, увеличение яичек, менингеальные симптомы. При ОМЛ встречается гипертрофия десен.
Обследование пациентов
Общий анализ крови: возможно снижение уровня гемоглобина и числа тромбоцитов; содержание лейкоцитов - от менее 1,0 • 10 9 /л до 200 • 10 9 /л, дифференцировка их нарушена, присутствуют бласты.
Коагулограмма может быть изменена, особенно при промиелоцитарном лейкозе, когда в бластных клетках имеются гранулы, содержащие прокоагулянты.
Биохимический анализ крови при высоком лейкоцитозе может свидетельствовать о почечной недостаточности.
Рентгенограмма органов грудной клетки позволяет выявить медиастинальные массы, которые встречаются у 70% больных с Т-клеточным лейкозом.
Костномозговая пункция: гиперклеточность с преобладанием бластов.
Иммунофенотипирование - определяющий метод в разграничении ОЛЛ и ОМЛ.
Цитогенетические и молекулярные исследования позволяют выявлять хромосомные аномалии, например филадельфийскую хромосому (продукт транслокации части 9-й хромосомы на 22-ю; определяет плохой прогноз при ОЛЛ).
Люмбальная пункция используется для выявления поражения центральной нервной системы (нейролейкоз).
Все пациенты с подозреваемым или установленным лейкозом должны быть как можно быстрее направлены для обследования и лечения в специализированные стационары.
Поддерживающая терапия предусматривает трансфузии тромбоцитов, эритроцитов, свежезамороженной плазмы, антибиотикотерапию инфекционных осложнений.
Цель химиотерапии - индукция ремиссии (менее 5% бластов в костном мозге) и последующая элиминация резидуальных бластных клеток посредством консолидирующей терапии. Химиопрепараты нарушают способность злокачественных клеток к делению, а комбинирование двух или трех препаратов повышает эффективность терапии и снижает риск развития резистентности бластов к терапии. Для профилактики и лечения нейролейкоза используются эндолюмбальные введения метотрексата и краниальное облучение.
Трансплантация костного мозга (ТКМ). Аллогенная ТКМ может применяться в случае плохого прогноза при ОЛЛ, при ОМЛ в первую ремиссию, при рецидивах лейкозов. Однако в связи с дефицитом совместимых доноров эта возможность доступна далеко не всем пациентам.
Факторы,обусловливающие плохой прогноз при острых лейкозах, представлены в таблице.
Токсичность терапии
Ранняя токсичность включает тошноту, рвоту, мукозиты, выпадение волос, нейропатии, печеночную и почечную недостаточность, выраженное угнетение кроветворения.
Поздняя токсичность может проявляться поражениями различных органов:
- сердце - аритмии, кардиомиопатии;
- легкие - фиброз;
- эндокринная система - задержка роста, гипотиреоидизм, бесплодие;
- почки - снижение гломерулярной фильтрации;
- психика - эмоциональные и интеллектуальные нарушения;
- вторичные опухоли;
- катаракта.
Все пациенты с острым лейкозом должны наблюдаться не менее 10 лет по завершении лечения. Особого внимания требуют к себе такие проблемы, как задержка роста и эндокринные дисфункции у детей.
Liesner RJ, Goldstone AH. The acute leukaemias. BMJ 1997;314:733-6.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
ИММУНОДИАГНОСТИКА ОСТРЫХ ЛЕЙКОЗОВ
Иммунофенотипирование методом проточной цитометрии является важным компонентом в диагностике острых лейкозов. Данная работа представляет результаты иммунофенотипирования острых лейкозов, что позволяет глубже охарактеризовать фенотип клеток опухолевой природы и способствует выбору наиболее рациональной терапии.
Ключевые слова: острые лейкозы, проточная цитометрия, иммунофенотипирование.
Острый лейкоз (ОЛ) — это клональное злокачественное новообразование, в основе которого лежит дефект стволовых клеток различного уровня, либо поражение клеток-предшественников. Морфологическим субстратом заболевания являются неопластически трансформированные клетки, обладающие способностью к подавлению нормального гемопоэза и инфильтрирующие костный мозг, постепенно вытесняя и угнетая нормальные ростки кроветворения [1]. Алгоритм диагностики острых лейкозов в современной клинике основан на пяти базовых компонентах:
— получение клинических данных;
— морфологический анализ бластов;
— цитохимический анализ бластов;
— иммунофенотипирование методом проточной цитометрии;
Поистине революционное значение для диагностической иммунологии и гематологии оказала разработка методов получения моноклональных антител, что было подтверждено в 1984 присуждением Нобелевской премии Kohler и Milstein вместе с Jerne за вклад в развитие теоретической иммунологии и биотехнологии [2]. Иммунодиагностика гемобластозов основана на сопоставлении морфофункциональных характеристик лейкозных бластов и нормальных/нетрансформированных клеток гемопоэза. По набору мембранных и цитоплазматических антигенов можно установить линейную принадлежность, стадию зрелости и функциональное состояние клетки. С начала 80-х годов ХХ века, когда развитие моноклональных антител пошло по экспоненте, стало возможным нарастающее по сложности иммунофенотипирование. К настоящему времени ИФТ превратилось в быстрый и полезный способ получения подробной характеристики опухолевых клеток, необходимой для диагностики ОЛ [3].
Для иммунофенотипирования ОЛ достаточна оценка экспрессии маркеров скриннинговой панели (BCSH, 2002) [4]:
(a) миелоидные маркеры:
МПО, CD13, CD33;
(b) Лимфоидные маркеры:
1. Маркеры Т-лимфоцитов — CD2, CD7, cyCD3 и sCD3;
2. Маркеры В-лимфоцитов — CD10, CD19, cyCD22 и sCD22.
3. Незрелость клетки характеризуют TdT, CD34, HLA-DR.
Цель исследования: изучение значения иммунофенотипирования клеток костного мозга в диагностике острых лейкозов.
Материалы и методы исследования: нами обследовано 35 больных с ОЛ в отделении гематологии ГКБ №7 г. Алматы. Для диагностики мы использовали общеклиническое обследование, морфологическое цитологическое и цитохимическое исследование, иммунофенотипирование костного мозга. Для иммунодиагностики ОЛ были использованы панели моноклональных антител и скрининг Европейской группы по иммунологической диагностики, 2002г. Иммунофенотипирование проводилось на проточном цитофлуометре FacsCalibur (Becton Dickinson — Германия).
Результаты и обсуждение: средний возраст обследованных 35,5±3 лет, 54% больных составили мужчины; 46% – женщины. При клиническом исследование выявлены следующие синдромы: опухолево-интоксикационный в 97% случаях, гиперпластический – 43%, анемический – 94%, геморрагический – 46%, специфическая лихорадка – 78%, язвенно-некротический – 28%, вторичного иммунодефицита – 86%.
При анализе результатов ИФТ костного мозга взрослых больных с острыми лейкозами, острые миелобластные варианты лейкоза диагностированы в 77% случаев и ОЛЛ — в 23% случая, в том числе В-линейные ОЛЛ — у 88,9% пациентов, Т- линейные ОЛЛ — у 11,1%.
Иммунофенотип М0 FAB-подварианта ОНЛ -CD117, ц-МП, CD13±, CD33±(м.б. HLA-DR, CD34, CD38; в 50-70% случаев экспрессия лимфоидных антигенов CD2, CD4, CD7, CD10 и TdT)
Иммунофенотип М1 FAB -подварианта ОНЛ-CD33, CD13, CD65, CD117, ц-МП, (м.б. HLA-DR, CD38; CD34±, нечасто CD4, CD11b, CD15 и CD65)
Иммунофенотип М2 FAB -подварианта ОНЛ-ц- МП, CD11b, CD15, CD65, CD13, CD33, CD65, CD117 (в 50-60% наблюдений CD34, HLA-DR; м.б. экспрессия лимфоидных маркеров CD10, CD2, CD7, CD19).
Иммунофенотип М3 FAB -подварианта ОНЛ — резко увеличена экспрессия МП, CD13, CD33 и CD65; вариабельна CD11b и CD15, слабая CD34 при отсутствии HLA-DR; в 40% наблюдений CD2).
Иммунофенотип М4 FAB -подварианта ОНЛ-МПО, CD11b, CD11c, CD14, CD15, CD13, CD33, CD65, HLA-DR, CD38, CD34±.
Иммунофенотип М5 FAB -подварианта ОНЛ-МПО, HLA-DR, CD4; CD11b, CD11c, CD14, CD15, CD33, CD65, CD36±.
Иммунофенотип М6 FAB -подварианта ОНЛ-Гликофорин А (GPA), HLA-DR, CD38, трансфериновый рецептор CD71, CD34± .
Иммунофенотип М7 FAB -подварианта ОНЛ-CD41a, CD42b и/или CD61 (м.б. экспрессия CD13, CD33, HLA-DR, CD38, CD34).
Иммунофенотип ОЛЛ из ранних предшественников (про- B-ОЛЛ)- CD19, cytCD22, cyt79a, TdT, CD34, у ½ CD20, слабая экспрессия CD22, CD45 (при наличии обменов 11q23 экспрессия CD15)
Иммунофенотип пре-пре-В- клеточного варианта ОЛЛ-CD10, CD19, CD22, CD79a, TdT, CD20, редко CD34.
Иммунофенотип пре В- клеточного варианта ОЛЛ-Cyt μ- цепь при отсутствии Sm Ig, CD10, CD19, CD22, CD79a, TdT, редко CD20, CD34.
Иммунофенотип В- клеточного варианта ОЛЛ-CD19, CD22, CD20, Sm IgM с рестрикцией κ или λ, редко TdT, отсутствие CD34 .
Иммунофенотип Т- клеточных вариантов ОЛЛ-Главное — CytCD3.
Выводы. Таким образом, иммунофенотипирование опухолевых элементов при остром лейкозе позволяет глубже охарактеризовать фенотип клеток опухолевой природы, диагностировать М0, М7, ОМЛл, ОЛЛм и БОЛ варианты ОЛ, что способствует выбору наиболее рациональной врачебной тактики ведения больных. Данный метод совместно с результами цитогенетического исследования дает возможность определять минимальную остаточную болезнь и точнее оценивать прогноз этих заболеваний.
1 Абдулкадыров К.М. Гематология. Новейший справочник. – СП-б.: 2004 г.
2 Bene M., Castoldi G., Knapp W. et al. Proposals for the immunological classification of acute leukemias. European Group for the Immunological Characterization of Leukemias (EGIL).// Leukemia. – 1995. — 9(10).- P. 1783–6.
3 Методические рекомендации «Современные методы диагностики острых лейкозов у детей и взрослых». – Минск: 2001.
4 Craig F. E., Foon K. A. Flow cytometric immunophenotyping for hematologic neoplasms // Blood – 2008.- 111. – P. 3941–67.
Э.З. ГАББАСОВА, А.К. КОСАНОВА, З.Б. ИБРАГИМОВА, Г.Ә. ТӘЖЕН, Ж.Е. СҮГІРӘЛІ, К.А. ТАУШАН, Б.Е. ТУРЛЫХАНОВА
ЖЕДЕЛ ЛЕЙКОЗДАРДЫҢ ИММУНОДИАГНОСТИКАСЫ
Түйін: Ағымдық цитометрия әдісімен иммунофенотиптеу жедел лейкоздардың диагностикасында маңызды компонент болып табылады. Аталған жұмыс жедел лейкоздарды иммунофенотиптеу нәтижесін көрсетеді, бұл ісік жасушаларының фенотипін тереңірек сипаттауға және неғұрлым рациональды емді таңдауға мүмкіндік береді.
Түйінді сөздер: жедел лейкоздар, ағымды цитометрия, иммунофенотиптеу.
E.Z. GABBASSOVA, A.K. KOSSANOVA, Z.B. IBRAGIMOVA,
G.A. TAZHEN, ZH.E. SUGIRALI, K.A. TAUSHAN, B.E.TURLYKHANOVA
IMMUNODIAGNOSIS ACUTE LEUKEMIAS
Resume: Immunophenotyping by flow cytometry is an important component in the diagnosis of acute leukemia. This work presents the results of immunophenotyping of acute leukemia, which allows deeper characterize the phenotype of the tumor cells and promotes the natural selection of the most rational therapy.
Keywords: acute leukemia, flow cytometry, immunophenotyping.
Узнать по антигену. Как иммунофенотипирование помогает бороться с раком крови
Что такое иммунофенотипирование?
Это метод, который позволяет детально описать фенотип опухоли, создать ее биологический портрет на основе определения антигенов, находящихся на поверхности и в цитоплазме опухолевых клеток. Кроме того, метод позволяет «засечь» остаточные опухолевые клетки, сохраняющиеся в организме во время ремиссии и никак себя не проявляющие. Все это дает возможность высокоточной диагностики ремиссии, прогноза заболевания и выбора оптимальной тактики лечения. Анализ выполняется на многоцветном проточном цитометре с последующей обработкой и интерпретацией результатов. Современный 12-цветный цитометр может охватить широкий спектр антигенов на большом количестве клеток. Наибольшее использование метод иммунофенотипирования получил при заболеваниях крови.

Фенотип опухоли, что это?
Как человек имеет свой индивидуальный цвет глаз и волос, рост, строение скелета и так так и популяции клеток имеют индивидуальный набор белков на мембране и в цитоплазме. Опухолевые клетки отличаются от нормальных, то есть имеют аберрантный фенотип. Мы выявляем этот фенотип, окрашивая опухолевые белки-антигены специальными моноклональными антителами. Помеченная таким образом клетка, попадая в луч лазера на цитометре, дает определенную длину волны. Получается точечная диаграмма, каждая точка это клетка, имеющая свои уникальные характеристики: размер, плотность цитоплазмы и так далее. Клетки можно группировать в популяции по общим характеристикам и подсчитывать их количество.
Какие возможности дает метод иммунофенотипирования для лечения онкогематологических заболеваний?
Успехи в лечении онкогематологических заболеваний связаны с использованием новых технологий, в том числе иммунофенотипирования. В современные протоколы лечения внедрены понятия оценки минимальной остаточной болезни (МОБ) у пациентов с острыми лейкозами. На ранних этапах мониторинг МОБ является стратифицирующим фактором выбора терапии, на поздних стадиях наличие остаточных опухолевых клеток указывает на высокую вероятность рецидива и необходимость менять терапию. Иммунофенотипирование и определение МОБ помогает подбирать терапию более персонализированно. Благодаря финансовому участию Фонда борьбы с лейкемией, этот анализ делается бесплатно для пациентов Москвы, Московской области и регионов РФ. По договору с фондом, мы можем делать 120 таких анализов в месяц. Остальные иммунофенотипические исследования, к сожалению, платные, они не входят в ОМС. Мы стараемся это изменить, но пока решение не принято.
Можно ли лечить онкогематологические заболевания, не используя иммунофенотипирование?
Можно, но мы вернемся к результатам 20—30-летней давности. Применение современных эффективных препаратов невозможно без современной диагностики.
Чем иммунофенотипирование отличается от других видов диагностики?
Даже «обычная» диагностика требует специального оборудования, реактивов и подготовленного персонала. особый тип диагностики, оно на порядок сложнее, чем ряд рутинных методов. Необходимо оценить и свести в единую систему большое количество параметров с помощью компьютерных технологий. При этом сам аппарат не будет выдавать результат, интерпретировать полученные данные может исключительно человек. За анализами стоит принятие решений о терапии. Это накладывает большую ответственность. Мы работаем в тесном контакте с врачами, обсуждаем заключения, чтобы найти оптимальное решение в пользу пациента. Если нас не устраивает качество биологического образца, мы просим сделать исследование повторно, так как нам нужно добиться истины.
Кто может обратиться за исследованием?
Мы работаем не только с отделениями НМИЦ гематологии. Нам доставляют образцы из московских и региональных клиник, у нас заключены договоры с государственными и частными лабораториями. Пациент может обратиться к нам самостоятельно или по направлению лечащего врача. Можем сделать пункцию здесь или исследовать готовый образец костного мозга.
Как организована работа лаборатории?
В лаборатории работает восемь человек: два фельдшера, два врача, биолог, медицинский физик, стажер, заведующий. У нас разделение труда: одни проводят пробоподготовку и «красят» образцы, другие записывают на цитометре и обрабатывают результаты на компьютере. С восьми утра приносят пробы. При нагрузке 40 анализов в день получается почти 10 000 анализов в год для клинических подразделений и еще столько же с научной целью. Пробоподготовка (так называемое раскапывание реактивов) требует огромной концентрации. Костный мозг или периферическую лизируют, отмывают, отбирают определенное количество клеток, инкубируют, окрашивают. Одна и полностью неправильный ответ. Поэтому в рабочей зоне разговоров нет вообще.

Заведующая лабораторией иммунофенотипирования И. В. Гальцева (справа), медицинский физик Н. М. Капранов, врач КЛД К. А. Никифорова.
Метод требует не только современного и дорогостоящего оборудования и реактивов, но и глубоких знаний о созревании и этапах дифференцировки нормальных клеток костного мозга. Мы делаем выводы о наличии патологии, опираясь на знание нормы. Свою базу нормы мы создавали на здоровых донорах и учитывали данные литературы.
Где готовят специалистов для работы методом проточной цитометрии?
Проблема подготовки кадров очень актуальна. Сейчас в регионах появляется современное оборудование, но этого недостаточно, чтобы начать проводить исследования. Купите пианино и ноты, вы сможете играть? Надо учиться. К сожалению, в нашей стране совсем не много мест, где врач может пройти дополнительную подготовку по этому направлению. Сотрудники нашей лаборатории учились и проходили стажировки не только в России, но и за рубежом. Мы подготовили и проводим обучающие программы для врачей клинической лабораторной диагностики, врачей-гематологов, онкологов, аллергологов-иммунологов. Занятия проводятся в очном, дистанционном или комбинированном формате, с отрывом или без отрыва от основной работы. По результатам, учащиеся получают полный объем необходимых профессиональных компетенций, а также баллы непрерывного медицинского образования. Вся информация о программах есть на официальном сайте НМИЦ гематологии в разделе «Образование».

Фельдшер В. Милевский проводит пробоподготовку.
Для чего еще используется метод имммунофенотипирования, кроме мониторинга минимальной остаточной болезни?
Кроме мониторинга МОБ, метод иммунофенотипирования используется для диагностики заболеваний крови, для исследования ПНГ-клона, Т-клеточного и В-клеточного иммунитета. Это один из диагностических методов помимо цитологии, гистологии, хромосомной цитогенетики, молекулярных исследований. Метод необходим для определения количества стволовых клеток для ауто- и аллогенной трансплантации гемопоэтических стволовых клеток крови или костного мозга.
Читайте также:
