Инфекционная апластическая анемия - инфекции поражающие костный мозг
Добавил пользователь Алексей Ф. Обновлено: 24.01.2026
Химическая и лекарственная апластическая анемия - лекарства поражающие костный мозг
Апластическая анемия, обусловливаемая химическими и физическими агентами характеризуется прямым отношением количества воздействующего на костный мозг токсического вещества и интенсивности развиваемой им гипоплазии (Мунтяну, Rohr); наличием — в клинической картине — отдельных признаков поражения участков паренхимы органов большого значения, таких как печень, почки, центральная нервная система, что реже наблюдается при остальных видах апластической анемии.
К токсическим веществам, оказывающим большое влияние на костный мозг и очень хорошо изученным, относятся бензол, хлорамфеникол и ряд других медикаментов.
Ниже приведены вещества, определяющие гипоплазию костного мозга и оценка представляющего ими риска.
Физические и химические факторы, обусловливающие развитие апластической анемии:
А. Факторы, наличие которых в определенном количестве, в любом случае способствуют развитию аплазии костного мозга, в том числе, ионизирующие излучения, соединения иприта (азотный иприт и пр.), цитостатические медикаменты (антиметаболиты, антифолиевые препараты), бензол, его соединения.
Б. Факторы, вызывающие лишь случайно костномозговую аплазию, в том числе:
1. Противомикробные:
Мышьякобензолы
Хлорамфеникол
Сульфамид
Стрептомицин
2. Противосудорожные:
Мезантоин
Триметадион
3. Антитиреоидные: Метилтиоурацил
4. Антигистаминные: Фенерган
5. Инсектициды: ДДТ
6. Различные факторы:
Соли золота
Фенилбутазон
Нитрофенол
Мепробамат
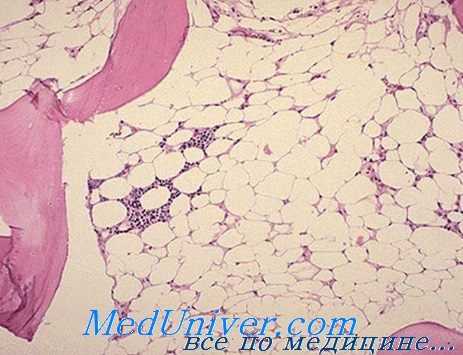
Бензол и его соединения как причина апластической анемии. Несчастные случаи, вызываемые бензолом, начали обнаруживаться в начале нашего века, в связи с промышленным применением этого вещества в качестве органического растворителя (Robr). В принципе бензол угнетает костный мозг, что означает приостановление синтеза РНК в уже дифференцированных элементах.
Видимо бензол не угнетает колонии клеток-штамм, в чем следует искать объяснение полной обратимости нарушений в случаях непродолжитекьности токсического воздействия (Nomiyama).
Влияние на костный мозг тесно связано с количеством воздействующего на больного вещества. Исходно отмечается раздражение костного мозга и общая, в частности эритроидная, гиперплазия, сопровождающаяся лейкоцитозом, нейтрофилией и отклонением влево в периферической крови; затем, постепенно, развивается костномозговая гипоплазия с обширными участками жирного преобразования, наличием редких миелоидных элементов, выраженной реакцией лимфатической или плазмоцитной ткани, а в отдельных случаях моноцитной реакцией, которую часто нелегко различить от лейкемического поцесса (Мунтяну).
После развития костномозговой гипоплазии имеются лишь немногие шансы на его восстановление. Вот почему внимание направлено на предупреждение заболевания путем ограничения концентрации бензола в атмосферном воздухе соответствующих заводов, максимально до 34 частей на 1 млн. и выявление первых признаков поражения костного мозга с помощью наблюдения за развитием эритроцитного макроцитоза у рабочих данных предприятий (Мунтяну).
Однако бензол оказывает и ряд других влияний на костный мозг, в том числе обусловливает: выраженную гиперплазию эритроидного ряда и приостановление деления (мегалобластоз), картину, называемую бензоловой эритропатией, имеющей большое сходство с острой эритемией; хронический миелосклероз с миелоидной метаплазией; гипоплазию лимфатической тнани, равно как и острую лейкемию (Rohr, Wintrobe).
Хлорамфеникол это антибиотик, вызвавший большой энтузиазм в 1948 г. когда был проверен его чрезвычайный эффект при заболеваниях брюшным тифом, а затем и отдельными риккетсиозами. Но в дальнейшем широкое применение препарата в борьбе с инфекцией грамм-отрицательными возбудителями начало выявлять его вредные последствия, поскольку он способствует развитию весьма тяжелой необратимой костномозговой аплазии.
В клинике риск развития аплазии после лечения хлорамфениколом составляет 1/10 тыс.—1/20 тыс. Однако по иным статистическим данным, например Объединения американских врачей, хлорамфеникол составил причину развития 44% всех заболеваний панцитопенией в США (Williams).
Формула хлорамфеникола включает бензоловое ядро с боковой цепью дихлорацетамида (Мунтяну). В связи с этим создалось мнение о том, что токсический эффект следует отнести за счет бензолового ядра. За справедливость такого предположения говорит и тот факт, что, подобно бензолу, медикамент поражает исходно эритроидный ряд, приостанавливая созревание, блокируя включение железа в гем с последующим ростом показателей сывороточного железа, костномозговых сидеробластов и развитием ретикулоцитопении.
Дальнейшие исследования выявили одновременное по существу поражение всех рядов крови, при этом первым морфологическим признаком поражения костного мозга оказалось появление вакуолей в костномозговых клетках, которые лучше выражены в эритробластах (Мунтяну, Ward).
Эти данные совпадают с результатами экспериментальных наблюдений, по которым медикамент угнетает синтез белков в клетках костного мозга в результате соревнования с ARNm (Ward), а также и синтез РНК (Williams).
В дальнейшем были обнаружены довольно тяжелые осложнения спустя некоторое время после прекращения лечения этим медикаментом. В связи с этим была выдвинута гипотеза о возможных, вызываемых им изменениях в геноме клеток-штамм, результатом чего являются необратимые сдвиги механизма деления последних, развитие необратимой костномозговой аплазии и острой лейкемии (Mukherji) или ночной пароксизмальной гемоглобинурии (Дачие и Левис).
В клинической практике целесообразно помнить, что этот медикамент вызывает тяжелые, смертельные аплазии и его применение следует ограничивать заболеваниями, вызываемыми строго чувствительными к нему возбудителями.
Прочие химические агенты, приводящие к апластической анемии. К категории иных химических факторов, обусловливающих костномозговую аплазию относятся ДДТ, сульфонамиды, противосудорожные средства, равно как и соединения золота. Также доказано, что атебрин создает чрезмерную чувствительность и тем самым способствует развитию костномозговой аплазии.
Ночная пароксизмальная гемоглобинурия как последствие апластической анемии. По результатам ряда наблюдений ночная пароксизмальная гемоглобинурия развивается после костномогзовой аплазии (Dacie и Lewis). Описаны также 2 случая костномозговой аплазии, сопровождающейся ночной пароксизмальной гемоглобинурией, а в конечном итоге — острой миелобластической лейкемией («трехзтапная» эволюция) (Holden и Lichtman).
Утверждается, что, по началу, токсический агент поражает (вызывает мутацию) клетки-штамм (Dacie и Lewis). Выживающие при этом клетки-штамм порождают аномальные популяции: эритроцитов — чувствительных к комплементу, гранулоцитов — лишенных лейкоцитной щелочной фосфатазы и тромбоцитов с недостатком ферментов.
Апластическая анемия отмечена и при беременности (Evans), гипопитуитаризме, почечной недостаточности и пр.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Инфекционная апластическая анемия - инфекции поражающие костный мозг
Причины апластической анемии - конституционная апластическая анемия Фанкони
Этиология апластической анемии весьма разнообразна. Основные причины заболевания и их классификация приведены в ниже.
Этиологическая классификация апластических анемий:
I. Генуинные
II. Конституционные
III. Вызываемые физическими или химическими факторами
IV. Вирусные заболевания (гепатит), бактериальные инфекции (туберкулез).
V. Иммунологические заболевания (диссеминированная красная волчанка, аллергия и пр.).
VI. Ночная пароксизмальная гемоглобинурйя.
VII. Прочие: беременность, эндокринные болезни (Симмондса), хронический панкреатит и пр.
Не забывать, что тот же возбудитель обусловливает различные аспекты костного мозга вплоть до очень тяжелой формы аплазии.

Генуинная форма апластической анемии
К этой группе заболеваний относятся все те случаи, при которых не обнаруживается какой-либо причинный фактор (50%).
Однако, за последние десятилетия отмечается рост показателя заболеваемости этой формой болезни, что, видимо, следует отнести за счет загрязненности среды (ионизирующие излучения), питания, чрезмерного потребления медикаментов, вирусных заболеваний.
Привлекает внимание очень тяжелое течение этой формы у детей, картина носит острый характер и нередко смертельный исход наступает быстро. Гистологическое исследование выявило различную степень поражения костного мозга — от нормопластического аспекта вплоть до весьма тяжелой аплазии.
Необходимо отметить также формы с минимальной бластической реакцией в строении костного мозга или с лимфоидной реакцией, которые нередко трудно различить от острой лейкемии с небольшим процентом » или от апластической формы хронической лимфатической лейкемии (Bryon, Dreyfus и Bessis).
Впрочем в литературе описаны случаи так называемой генуинной апластической анемии, которые, по существу, оказывались «предлейкемическим состоянием» (Dreyfus и Bessis).

Конституционная или семейная генуинная анемия - апластическая анемия Фанкони
Первый случай был описан Фанкони в 1927 г. К этой патегории относятся случаи семейного характера, развивающиеся у детей с костномозговой аплазией и дефектами, как, например, синдактилия, правое сердце, стрельчатое небо, микроцефалия, умственная отсталость.
Гематологическая картина отражает наличие периферической панцитопении и нормоцитной или умеренно макроцитной анемий; показатель плодного гемоглобина бывает завышенным. При этом костный мозг представляется гипопластическим, жирным, иной раз нормо- или гипоцеллюлярным (Fanconi, Rohr Williams). Синдром видимо определяет рецессивный ген, в то же время цитогенетические исследования выявили большое разнообразие структурнохромосомных сдвигов (Bloom и сотр.). Описаны случаи, преобразовавшиеся в дальнейшем в острую лейкемию (Wintrobe).
Отмечается также другой вид семейной панцитопении, когда этому заболеванию сопутствует недостаточность поджелудочной железы по причине ее кистовидного фиброзирования (Williams).
Апластическая анемия ( Гипопластическая анемия )
Апластическая анемия – угнетение функции кроветворения красного костного мозга (эритроцитопоэза, лейкопоэза и тромбоцитопоэза), приводящее к пангемоцитопении. К основным клиническим проявлениям гематологического синдрома принадлежат головокружение, слабость, обмороки, одышка, покалывание в груди, кожные геморрагии, кровотечения, склонность к развитию инфекционно-воспалительных и гнойных процессов. Заболевание диагностируется на основании характерных изменений гемограммы, миелограммы и гистологического исследования трепанобиоптата. Лечение патологии включает проведение гемотрансфузий, иммуносупрессивной терапии, миелотрансплантации.
МКБ-10
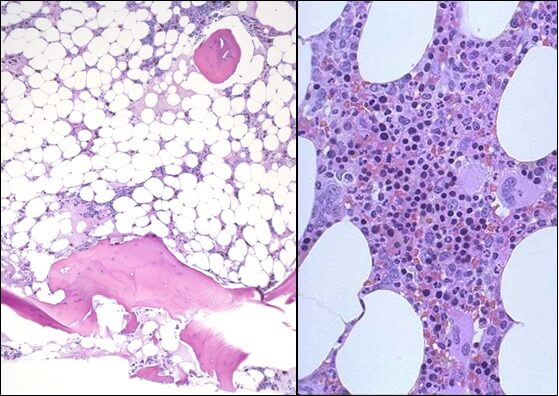
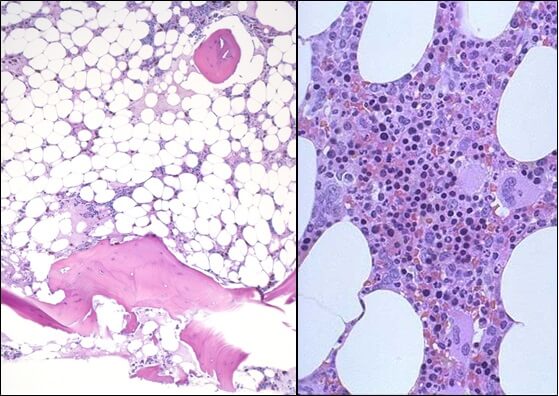
Общие сведения
Апластическая (гипопластическая) анемия – тяжелое расстройство гемопоэза (чаще всех его звеньев), сопровождающееся развитием анемического, геморрагического синдромов и инфекционных осложнений. Развивается в среднем у 2 человек на 1 млн. населения в год. Приблизительно с одинаковой частотой патология поражает мужчин и женщин. Возрастные пики заболеваемости приходятся на возраст 10–25 и старше 50 лет. При данной патологии в костном мозге чаще нарушается образование всех трех типов клеточных элементов крови (эритроцитов, лейкоцитов и тромбоцитов), иногда - только одних эритроцитов; в зависимости от этого различают истинную и парциальную апластическую анемию. В гематологии данный вид анемии относится к числу потенциально фатальных заболеваний, приводящих к гибели 2/3 заболевших.
Причины
По происхождению апластическая анемия может быть врожденной (связанной с хромосомными аберрациями) и приобретенной (развившейся в течение жизни). Принято считать, что угнетение миелопоэза связано с появлением в красном костном мозге и крови цитотоксических T-лимфоцитов, производящих фактор некроза опухолей и γ-интерферон, которые в свою очередь подавляют ростки кроветворения. Запускать этот механизм могут различные внешнесредовые (химические соединения, физические явления, лекарственные вещества), а также эндогенные факторы (вирусы, аутоиммунные реакции). К числу наиболее значимых причин относят:
- Прием миелотоксических препаратов. Достоверно установлена связь анемии с приемом некоторых противоопухолевых, противосудорожных, антибактериальных, антитиреоидных, противомалярийных препаратов, транквилизаторов, препаратов золота и др., обладающих потенциальным миелотоксическим эффектом. Лекарственные вещества могут вызывать как прямое повреждение стволовых кроветворных клеток, так и опосредованное - через аутоиммунные реакции. Анемии, связанные с таким механизмом развития, называются лекарственными.
- Контакт с химическими и физическими агентами. Супрессию костного мозга может вызывать взаимодействие с органическими растворителями, соединениями мышьяка, бензольными соединениями, пестицидами, облучение всего тела. В некоторых случаях недостаточность гемопоэза является временной и обратимой - главными факторами здесь являются концентрация/доза вещества и время контакта. супрессию костного мозга.
- Вирусные инфекции. Из вирусных агентов наибольшее значение уделяется возбудителям гепатитов В, С и D. В этом случае гипопластическая анемия обычно развивается в течение полугода после перенесенного вирусного гепатита. При изучении патогенеза было замечено, что репликация вируса происходит в мононуклеарах крови и костного мозга, а также в иммунных клетках. Предполагается, что подавление миелопоэза в этом случае является своеобразным иммунным ответом, возникающим против клеток, несущих на своей поверхности вирусные антигены. Такой вид анемии выделяется в отдельную форму – постгепатитную. Среди других вирусных инфекций называются ЦМВ, инфекционный мононуклеоз, грипп.
Также описаны случаи панцитопении, вызванные инфицированием туберкулезом, интоксикацией, лучевой болезнью, лимфопролиферативными заболеваниями (тимомой, лимфомой, хроническим лимфобластным лейкозом), беременностью. Почти в половине наблюдений причину анемии выявить не удается - такие случаи относят к идиопатической форме.
Патогенез
В основе апластической анемии может лежать либо первичное повреждение гемопоэтических стволовых клеток, либо нарушение их эффективной дифференцировки. При наследственных анемиях недостаточность гемопоэза опосредована кариотипическими аберрациями, приводящими к нарушению репарации ДНК и невозможности репликации стволовых клеток костного мозга. В случае приобретенной анемии под влиянием этиофакторов наблюдается активация Т-клеток, которые начинают продуцировать цитокины (интерферон-гамма, ФНО), поражающие клетки-предшественники гемопоэза. В стволовых клетках костного мозга повышается экспрессия генов, отвечающих за апоптоз и активизацию клеточной гибели. Основные клинические проявления обусловлены пангемоцитопенией – снижением в составе крови всех ее форменных элементов (эритроцитов, лейкоцитов, тромбоцитов).
Классификация
Кроме различных этиологических вариантов (лекарственного, постгепатитного, идиопатического), различают острую (до 1 мес. течения), подострую (от 1 до 6 мес.) и хроническую (более 6 мес.) форму заболевания. Анемию, протекающую с избирательным угнетением эритропоэза, называют парциальной красноклеточной аплазией. На основании выраженности тромбо- и гранулоцитопении данная форма анемии подразделяется на 3 степени тяжести:
- очень тяжелую (тромбоцитов менее 20,0х109/л; гранулоцитов менее 0,2х109/л)
- тяжелую (тромбоцитов менее 20,0х109/л; гранулоцитов менее 0,5х109/л), по данным трепанобиопсии – низкая клеточность костного мозга (менее 30% от нормы)
- умеренную (тромбоцитов более 20,0х109/л; гранулоцитов более 0,5х109/л)
Симптомы апластической анемии
Поражение трех гемопоэтических ростков (эритро-, тромбоцито- и лейкопоэза) обусловливает развитие анемического и геморрагического синдромов, инфекционных осложнений. Дебют апластической анемии обычно происходит остро. Анемический синдром сопровождается общей слабостью и утомляемостью, бледностью кожи и видимых слизистых, шумом в ушах, головокружением, покалыванием в груди, одышкой при нагрузке.
Основным проявлением тромбоцитопении выступает геморрагический синдром. Больные отмечают появление петехий и экхимозов на коже, повышенную кровоточивость десен, спонтанные носовые кровотечения, меноррагии. Возможно возникновение гематурии, маточных и желудочно-кишечных кровотечений. Следствием лейкопении и агранулоцитоза служит частое развитие инфекционных процессов – стоматитов, пневмоний, инфекций кожи и мочевыводящих путей. Для апластической анемий нехарактерны похудание, лимфаденопатия, гепато- и спленомегалия – при этих признаках следует искать другую причину пангемоцитопении.
Врожденная апластическая анемия (синдром Фанкони) обычно развивается у детей в возрасте до 10 лет и кроме аплазии костного мозга характеризуется другими нарушениями: микроцефалией, гипоплазией почек, низкорослостью, аномалиями развития верхних конечностей (гипоплазией первой пястной и лучевой кости), гипоспадией, гиперпигментацией кожи, крайней степенью тугоухости и др. При наследственной анемии Эстрена-Дамешека отмечается тотальное поражение кроветворения и панцитопения при отсутствии врожденных аномалий развития. Для анемии Даймонда-Блекфена или парциальной красноклеточной аплазии характерно только снижение количества эритроцитов.

Осложнения
Летальный исход может быть обусловлен кровоизлияниями во внутренние органы, массивными кровотечениями, инфекционными осложнениями, анемической комой. Наиболее грозное из геморрагических осложнений – кровоизлияние в головной мозг (геморрагический инсульт). Больные склонны к частым и тяжело протекающим вирусным и бактериальным инфекциям респираторного тракта. Значительное или стремительное снижение уровня красных кровяных телец может привести к анемической коме. При молниеносной форме крайне быстро развиваются тяжелейшая анемия, иммунодефицит, коагулопатии, имеющие фатальные последствия.
Диагностика
Оценка гематологического статуса включает внимательный клинический осмотр и проведение тщательной лабораторной диагностики. При физикальном обследовании выявляется выраженная бледность или желтушность кожи, артериальная гипотония, тахикардия. Основу диагностического алгоритма составляет проведение общего и биохимического анализа крови, стернальной пункции, трепанобиопсии:
- Исследования крови. Для гемограммы при гипопластической анемии типичны эритро-, лейкоцито- и тромбоцитопения, нейтропения и относительный лимфоцитоз. Оценка биохимических показателей (печеночных проб, нефрологического комплекса, сывороточного железа, билирубина) информативна для исключения других анемий.
- Исследованиепунктата костного мозга. В миелограмме обнаруживается уменьшение количества миелокариоцитов и мегакариоцитов, снижение клеточности. В трепанобиоптате определяется замещение красного костного мозга жировым (желтым).
В рамках диагностического поиска апластическую анемию необходимо дифференцировать с мегабластными (В12-дефицитными, фолиеводефицитными) анемиями, идиопатической тромбоцитопенической пурпурой, пароксизмальной ночной гемоглобинурией, острым лейкозом.

Лечение апластической анемии
Больные с апластической анемией госпитализируются в специализированные отделения. Им обеспечиваются полная изоляция и асептические условия для предупреждения возможных инфекционных осложнений. Проведение эффективного лечения является сложной проблемой практической гематологии. В зависимости от уровня цитопении используются следующие лечебные подходы:
- Иммуносупрессиная терапия. При умеренной цитопении назначается фармакотерапия, включающая комбинацию антитимоцитарного иммуноглобулина и циклоспорина А. Поддерживающая терапия проводится анаболическими стероидами или их сочетанием с циклоспоринами.
- Гемотрансфузии. В комплексе с курсом иммуносупрессивной терапии при низких показателях красной крови показано проведение заместительной гемотрансфузионной терапии (переливание тромбоцитов и эритроцитарной массы), плазмафереза. Данная мера не оказывает воздействия на патогенетическое звено заболевания, но позволяет восполнить дефицит кровяных телец, не вырабатываемых костным мозгом.
- Трансплантация КМ и СК. Наиболее благоприятные прогнозы на долгосрочную выживаемость оказывает выполнение аллогенной трансплантации костного мозга. Однако ввиду сложности подбора иммунологически совместимого донора процедура используется ограниченно. В качестве экспериментальных подходов рассматриваются аутологичные трансплантации, пересадка стволовых клеток периферической крови. Больным с нетяжелой формой анемии может быть показано проведение спленэктомии, эндоваскулярной окклюзии селезеночной артерии.
Прогноз и профилактика
Прогноз определяется этиологической формой, тяжестью и остротой течения анемии. Критериями неблагоприятного исхода служат быстрое прогрессирование заболевания, тяжелый геморрагический синдром и инфекционные осложнения. После трансплантации костного мозга ремиссии удается достичь у 75–90% пациентов. Первичная профилактика данной разновидности анемии предполагает исключение влияния неблагоприятных внешнесредовых факторов, необоснованного применения лекарственных препаратов, предупреждение инфекционной заболеваемости и др. Пациентам с уже развившимся заболеванием требуется диспансерное наблюдение гематолога, систематическое обследование и длительная поддерживающая терапия.
2. Комплексная программа диагностики апластической анемии с определением прогностически значимых патогенетических особенностей заболевания. Методические рекомендации. - 2015.
4. Апластическая анемия: современные представления о патогенезе и терапии/ Айсариева Б. К., Раймжанов А. Р., Айтбаев К.// Молодой ученый. - 2011 - №9.
Острый лейкоз
Острый лейкоз – опухолевое поражение кроветворной системы, морфологической основой которого выступают незрелые (бластные) клетки, вытесняющие нормальные гемопоэтические ростки. Клиническая симптоматика острого лейкоза представлена прогрессирующей слабостью, немотивированным подъемом температуры, артралгиями и оссалгиями, кровотечениями различных локализаций, лимфаденопатией, гепатоспленомегалией, гингивитами, стоматитами, ангинами. Для подтверждения диагноза необходимо исследование гемограммы, пунктата костного мозга, биоптата подвздошной кости и лимфоузлов. Основу лечения острых лейкозов составляют химиотерапевтические курсы и сопроводительная терапия.
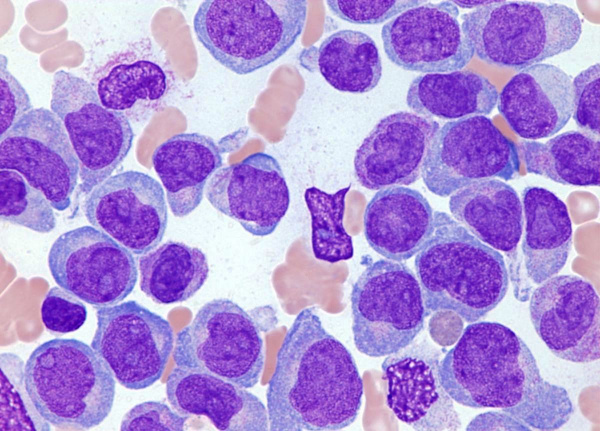
Острый лейкоз - форма лейкемии, при которой нормальное костномозговое кроветворение вытесняется мало дифференцированными клетками-предшественниками лейкоцитов с их последующим накоплением в периферической крови, инфильтрацией тканей и органов. Термины «острый лейкоз» и «хронический лейкоз» отражают не только длительность течения заболевания, но также морфологическую и цитохимическую характеристику опухолевых клеток. Острый лейкоз является наиболее частой формой гемобластозов: он развивается у 3-5 из 100 тыс. человек; соотношение взрослых и детей – 3:1. При этом у лиц старше 40 лет статистически чаще диагностируется острый миелоидный лейкоз, а у детей – острый лимфобластный лейкоз.
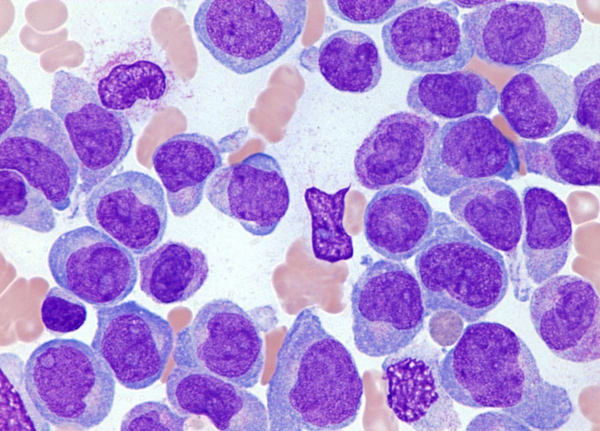
Причины острого лейкоза
Первопричиной острого лейкоза является мутация гемопоэтической клетки, дающей начало опухолевому клону. Мутация кроветворной клетки приводит к нарушению ее дифференцировки на ранней стадии незрелых (бластных) форм с дальнейшей пролиферацией последних. Образующиеся опухолевые клетки замещают нормальные ростки гемопоэза в костном мозге, а в дальнейшем выходят в кровь и разносятся в различные ткани и органы, вызывая их лейкемическую инфильтрацию. Все бластные клетки несут в себе одинаковые морфологические и цитохимические признаки, что свидетельствует в пользу их клонального происхождения от одной клетки-родоначальницы.
Причины, запускающие мутационный процесс, не известны. В гематологии принято говорить о факторах риска, повышающих вероятность развития острого лейкоза. В первую очередь, это генетическая предрасположенность: наличие в семье больных с острым лейкозом практически утраивает риск заболевания у близких родственников. Риск возникновения острого лейкоза повышается при некоторых хромосомных аномалиях и генетических патологиях - болезни Дауна, синдроме Клайнфельтера, Вискотта-Олдрича и Луи-Барра, анемии Фанкони и др.
Вероятно, что активация генетической предрасположенности происходит под действием различных экзогенных факторов. В числе последних могут выступать ионизирующая радиация, химические канцерогены (бензол, мышьяк, толуол и др.), цитостатические препараты, используемые в онкологии. Нередко острый лейкоз становится следствием противоопухолевой терапии других гемобластозов – лимфогранулематоза, неходжкинских лимфом, миеломной болезни. Подмечена связь острых лейкозов с предшествующими вирусными инфекциями, угнетающими иммунную систему; сопутствующими гематологическими заболеваниями (некоторыми формами анемий, миелодисплазиями, пароксизмальной ночной гемоглобинурией и др.).
Классификация острого лейкоза
В онкогематологии общепринята международная FAB-классификация острых лейкозов, дифференцирующая различные формы заболевания в зависимости от морфологии опухолевых клеток на лимфобластные (вызываемые низкодифференцированными предшественниками лимфоцитов) и нелимфобластные (объединяющие остальные формы).
1. Острые лимфобластные лейкозы взрослых и детей:
- пре-В-форма
- В-форма
- пре-Т-форма
- Т-форма
- ни Т ни В-форма
2. Острые нелимфобластные (миелоидные) лейкозы:
- о. миелобластный (вызван неконтрорлируемой пролиферацией предшественников гранулоцитов)
- о. моно- и о. миеломонобластный (характеризуются усиленным размножением монобластов)
- о. мегакариобластный (связан с преобладанием недифференцированных мегакариоцитов – предшественников тромбоцитов)
- о. эритробластный (обусловлен пролиферацией эритробластов)
3. Острый недифференцированный лейкоз.
Течение острых лейкозов проходит ряд стадий:
- I (начальную) - преобладают общие неспецифические симптомы.
- II (развернутую) - характеризуется четко выраженными клиническими и гематологическими симптомами гемобластоза. Включает: дебют или первую «атаку», неполную или полную ремиссию, рецидив или выздоровление
- III (терминальную) – характеризуется глубоким угнетением нормального гемопоэза.

Симптомы острого лейкоза
Манифестация острого лейкоза может быть внезапной или стертой. Типично начало, характеризующееся высокой лихорадкой, интоксикацией, потливостью, резким упадком сил, анорексией. Во время первой «атаки» больные отмечают упорные боли в мышцах и костях, артралгии. Иногда начальная стадия острого лейкоза маскируется под ОРВИ или ангину; первыми признаками лейкемии могут быть язвенный стоматит или гиперпластический гингивит. Довольно часто заболевание обнаруживается случайно при профилактическом исследовании гемограммы или ретроспективно, когда острый лейкоз переходит в следующую стадию.
В развернутом периоде острого лейкоза развиваются анемический, геморрагический, интоксикационный и гиперпластический синдромы.
Анемические проявления обусловлены нарушением синтеза эритроцитов, с одной стороны, и повышенной кровоточивостью – с другой. Они включают бледность кожных покровов и слизистых, постоянную усталость, головокружение, сердцебиение, повышенное выпадение волос и ломкость ногтей и др. Усиливается выраженность опухолевой интоксикации. В условиях абсолютной лейкопении и упадка иммунитета легко присоединяются различные инфекции: пневмонии, кандидоз, пиелонефрит и т. д.
В основе геморрагического синдрома лежит выраженная тромбоцитопения. Диапазон геморрагических проявлений колеблется от мелких единичных петехий и синяков до гематурии, десневых, носовых, маточных, желудочно-кишечных кровотечений и пр. По мере прогрессирования острого лейкоза кровотечения могут становиться все массивнее вследствие развития ДВС-синдрома.
Гиперпластический синдром связан с лейкемической инфильтрацией как костного мозга, так и других органов. У больных острым лейкозом наблюдается увеличение лимфоузлов (периферических, медиастинальных, внутрибрюшных), гипертрофия миндалин, гепатоспленомегалия. Могут возникать лейкозные инфильтраты кожи (лейкемиды), оболочек мозга (нейролейкоз), поражение легких, миокарда, почек, яичников, яичек и др. органов.
Полная клинико-гематологическая ремиссия характеризуется отсутствием внекостномозговых лейкемических очагов и содержанием бластов в миелограмме менее 5% (неполная ремиссия – менее 20%). Отсутствие клинико-гематологических проявлений в течение 5 лет расценивается как выздоровление. В случае увеличения бластных клеток в костном мозге более 20%, их появления в периферической крови, а также выявления внекостномозговых метастатических очагов диагностируется рецидив острого лейкоза.
Терминальная стадия острого лейкоза констатируется при неэффективности химиотерапевтического лечения и невозможности достижения клинико-гематологической ремиссии. Признаками данной стадии служат прогрессирование опухолевого роста, развитие несовместимых с жизнью нарушений функции внутренних органов. К описанным клиническим проявлениям присоединяются гемолитическая анемия, повторные пневмонии, пиодермии, абсцессы и флегмоны мягких тканей, сепсис, прогрессирующая интоксикация. Причиной смерти больных становятся некупируемые кровотечения, кровоизлияния в мозг, инфекционно-септические осложнения.
Диагностика острого лейкоза
Во главе диагностики острых лейкозов стоит оценка морфологии клеток периферической крови и костного мозга. Для гемограммы при лейкемии характерна анемия, тромбоцитопения, высокая СОЭ, лейкоцитоз (реже лейкопения), присутствие бластных клеток. Показателен феномен «лейкемического зияния» - промежуточные стадии между бластами и зрелыми клетками отсутствуют.
С целью подтверждения и идентификации разновидности острого лейкоза выполняется стернальная пункция с морфологическим, цитохимическим и иммунофенотипическим исследованием костного мозга. При исследовании миелограммы обращает внимание увеличение процента бластных клеток (от 5% и выше), лимфоцитоз, угнетение красного ростка кроветворения (кроме случаев о. эритромиелоза) и абсолютное снижение или отсутствие мегакариоцитов (кроме случаев о. мегакариобластного лейкоза). Цитохимические маркерные реакции и иммунофенотипирование бластных клеток позволяют точно установить форму острого лейкоза. При неоднозначности трактовки анализа костного мозга прибегают к проведению трепанобиопсии.
С целью исключения лейкемической инфильтрации внутренних органов производится спинномозговая пункция с исследованием ликвора, рентгенография черепа и органов грудной клетки, УЗИ лимфатических узлов, печени и селезенки. Кроме гематолога, больные острым лейкозом должны быть осмотрены неврологом, офтальмологом, отоларингологом, стоматологом. Для оценки тяжести системных нарушений может потребоваться исследование коагулограммы, биохимического анализа крови, проведение электрокардиографии, ЭхоКГ и др.
Дифференциально-диагностические мероприятия направлены на исключение ВИЧ-инфекции, инфекционного мононуклеоза, цитомегаловирусной инфекции, коллагенозов, тромбоцитопенической пурпуры, агранулоцитоза; панцитопении при апластической анемии, В12 и фолиеводефицитной анемии; лейкемоидных реакций при коклюше, туберкулезе, сепсисе и др. заболеваниях.

Лечение острого лейкоза
Пациентов с острым лейкозом лечат в стационарах онкогематологического профиля. В палатах организуется усиленный санитарно-дезинфекционный режим. Больные с острым лейкозом нуждаются в проведении гигиенической обработки полости рта, профилактики пролежней, туалета половых органов после физиологических отправлений; организации высококалорийного и витаминизированного питания.
Непосредственно лечение острых лейкозов проводится последовательно; основные этапы терапии включают достижение (индукцию) ремиссии, ее закрепление (консолидацию) и поддержание, профилактику осложнений. Для этого разработаны и используются стандартизированные схемы полихимиотерапии, которые подбираются гематологом с учетом морфологической и цитохимической формы острого лейкоза.
При благоприятной ситуации ремиссия обычно достигается в течение 4-6 недель усиленной терапии. Затем, в рамках консолидации ремиссии проводится еще 2-3 курса полихимиотерапии. Поддерживающая противорецидивная терапия осуществляется еще в течение не менее 3-х лет. Наряду с химиотерапией при остром лейкозе необходимо проведение сопроводительного лечения, направленного на предупреждение агранулоцитоза, тромбоцитопении, ДВС-синдрома, инфекционных осложнений, нейролейкемии (антибиотикотерапия, переливание эритроцитарной, тромбоцитарной массы и свежезамороженной плазмы, эндолюмбальное введение цитостатиков). При лейкемической инфильтрации глотки, средостения, яичек и др. органов проводится рентгенотерапия очагов поражения.
В случае успешного лечения достигается уничтожение клона лейкозных клеток, нормализация кроветворения, что способствует индукции длительного безрецидивного периода и выздоровления. Для предупреждения рецидивов острого лейкоза может быть проведена трансплантация костного мозга после предварительного кондиционирования путем химиотерапии и тотального облучения.
По имеющимся статистическим сведениям, использование современных цитостатических средств приводит к переходу острого лейкоза в фазу ремиссии у 60-80% больных; из них у 20-30% удается добиться полного выздоровления. В целом прогноз при острых лимфобластных лейкозах более благоприятен, чем при миелобластных.
Плазмоцитома
Плазмоцитома – это злокачественная опухоль из плазматических клеток, которая поражает кости и внутренние органы. Заболевание может протекать в солитарной форме при наличии только одного патологического очага либо в генерализованном варианте, когда в процесс вовлекаются разные системы организма. Плазмоцитома отличается многообразием и неспецифичностью клинической симптоматики, которая зависит от вида и локализации опухоли. Диагностика заболевания включает рентгенографию и КТ, исследование биоптатов костного мозга, клинический и биохимический анализы крови. Для лечения используется лучевая терапия, полихимиотерапия, комплексная реабилитация.
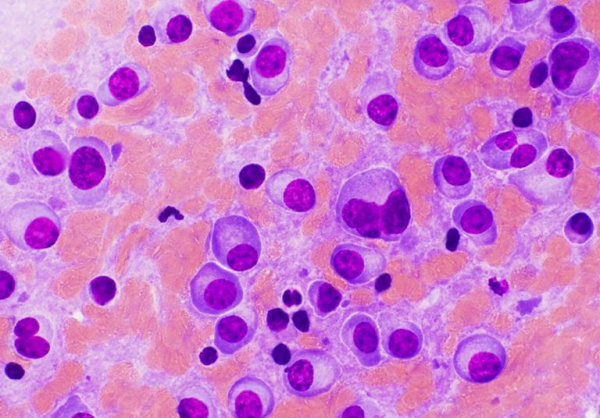
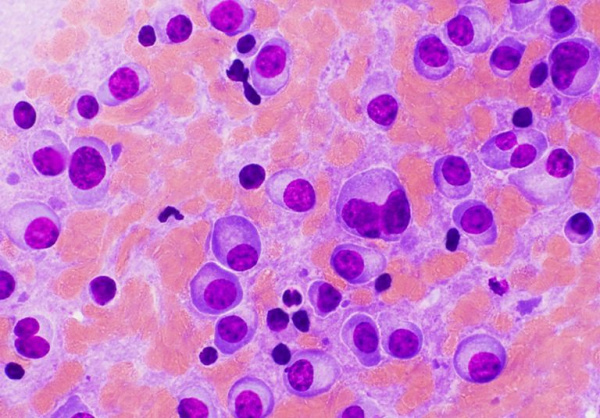
В клинической онкогематологии плазмоцитома относится к парапротеинемическим лейкозам. Она встречается с частотой около 3 случаев на 100 тыс. населения, однако распространенность болезни резко увеличивается с возрастом ‒ до 37 случаев на 100 тыс. пожилых людей. Средний возраст пациентов при диагностике опухоли составляет 55-74 года. Среди всех больных мужчины составляют 61%. Более подвержены заболеванию лица негроидной расы. Среди опухолевых процессов кроветворной системы на долю всех типов плазмоцитомы приходится 10-14%.
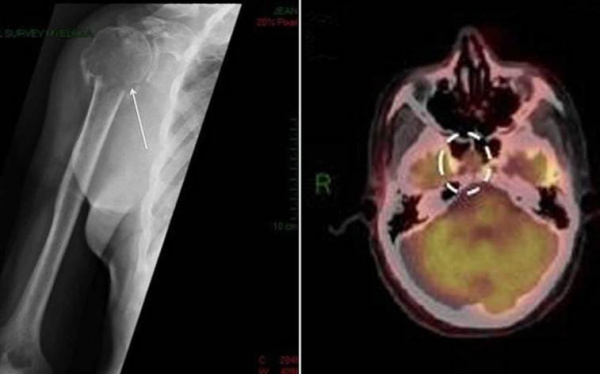
Причины плазмоцитомы
Этиологическая структура плазмоклеточных опухолей точно не установлена. Важная роль в развитии заболевания отводится продолжительной антигенной стимуляции иммунных клеток на фоне хронических инфекций, аутоиммунных заболеваний, воздействия экзогенных токсинов и радиации. Доказана генетическая предрасположенность к возникновению парапротеинемических опухолей. Риск развития болезни повышается у людей с хромосомными аберрациями.
Основным немодифицируемым фактором риска плазмоцитомы признан возраст. Единичные (солитарные) опухоли более характерны для пациентов предпенсионного возраста 55-60 лет, около 30% случаев болезни развиваются среди людей младше 50 лет. Генерализованная форма болезни имеет возрастную медиану около 70 лет, только у 35% людей она выявляется до 65-летнего возраста. К модифицируемым предрасполагающим факторам относят профессиональные вредности, проживание в регионах с неблагоприятной экологической ситуацией.
Парапротеинемические гемобластозы, к которым относится плазмоцитома, представляют собой опухоли из единого клона В-лимфоцитов. Под действием провоцирующих факторов происходит злокачественная трансформация первичной клетки, из которой образуется линия с аналогичными мутациями и способностью к неограниченному делению. Новообразование секретирует определенный вид иммуноглобулинов, наличие которых является основой для постановки диагноза.
Патоморфологически мутантные В-лимфоциты характеризуются выраженным полиморфизмом и атипией, наличием клеточных ядер аномальной формы, крупными ядрышками. Характерным признаком считается «пламенеющая» цитоплазма с множественными включениями. Цитологические отличия плазматических клеток более выражены при малодифференцированных вариантах опухоли.

Существует несколько вариантов систематизации новообразований. По степени зрелости мутантных клеток бывают высоко- и низкодифференцированные плазмоцитомы. По иммуногистохимическим особенностям выделяют А-миелому, D-миелому, G-миелому. Наиболее важна классификация по клинико-морфологическим признакам, согласно которой выделяют две разновидности плазмоцитомы:
- Солитарная. Составляет до 5% всех опухолевых образований, характеризуется наличием локальной пролиферации клональных плазматических клеток. Признана прогностически благоприятным вариантом заболевания.
- Генерализованная (множественная миелома). Характеризуется неконтролируемой пролиферацией В-лимфоцитов в разных органах и тканях тела, развивается на фоне хромосомных нарушений и патологии стромального окружения. Распространенная форма, которая составляет до 1% среди всех злокачественных новообразований.
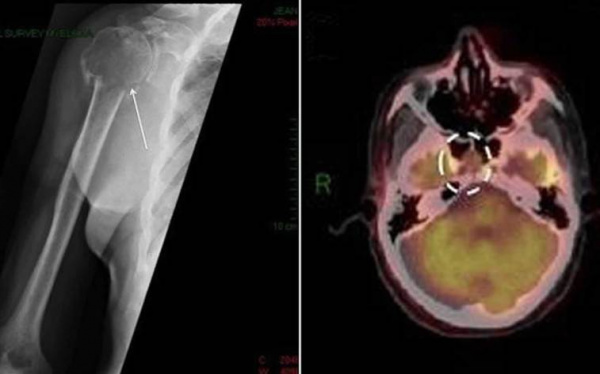
Единичные парапротеинемические опухоли дополнительно делятся на две подгруппы: солитарная плазмоцитома кости (СПК) и экстрамедуллярная плазмоцитома (ЭМП). СПК встречается в 2-5 раз чаще, чем ЭМП. В основном поражаются кости позвоночника (42-61%), таза (15%), ребер (12%). Среди экстрамедуллярных новообразований до 85% расположено в зоне головы и шеи, также возможно вовлечение в процесс легких, органов ЖКТ, урогенитального тракта.
Симптомы плазмоцитомы
Клинические проявления солитарного новообразования определяются расположением опухолевого очага. При поражении костной ткани на первый план выходит локализованный болевой синдром, который беспокоит пациента постоянно, не имеет четкой связи с физической нагрузкой или сменой положения тела. При сдавлении близлежащих нервных структур развиваются нейропатии и радикулопатии, для которых характерны стреляющие боли, нарушения чувствительности.
Ведущими симптомами при ЭМП считаются признаки поражения ЛОР-органов, что связано с типичной локализацией опухоли. Пациенты жалуются на заложенность носа, которая не купируется сосудосуживающими каплями, периодические носовые кровотечения, образование сухих корок в назальной полости. Реже встречается осиплость голоса, затруднения глотания, снижение слуха и боль в ухе.
ЭМП в нижних дыхательных путях манифестирует эпизодами одышки на фоне бронхообструкции, длительным кашлем, тяжестью и болями в грудной клетке. При расположении экстрамедуллярной плазмоцитомы в брюшной полости возникают неспецифические боли в животе, хронические запоры, тошнота и рвота. Парапротеинемическая опухоль урогенитального тракта проявляется расстройствами мочеиспускания, появлением крови в моче, болями в области поясницы.
Множественная миелома в 10-20% случаев протекает бессимптомно, манифестные варианты заболевания характеризуются разнообразными сочетаниями вышеописанных признаков. Чаще всего появляются боли в позвоночнике, грудине и ребрах, которые сопровождаются патологическими переломами и остеопорозом. Пациентов беспокоят диспепсические и дизурические расстройства, мелкие кровоизлияния в кожу, желудочные, носовые и легочные кровотечения.
У 60% больных с множественной миеломой обнаруживается средняя или тяжелая степень анемии, которая сопровождается гемической гипоксией. В 50-90% случаев присоединяется почечная патология, которая является одной из основных причин сокращения продолжительности жизни пациентов. На фоне приобретенной иммунной недостаточности развиваются рецидивирующие и генерализованные инфекции органов дыхания, мочевыводящих путей.
При плазмоцитоме наблюдается гиперпродукция моноклональных иммуноглобулинов, которая вызывает амилоидоз внутренних органов. Экстрамедуллярная опухоль может стать причиной механической желтухи, перфорации кишечника, межпетлевой фистулы. При появлении опухолевых масс в области шеи происходит компрессия дыхательных путей, которая в ряде случаев вызывает асфиксию и требует неотложной медицинской помощи.
Обследование пациента проводится врачом-онкогематологом. Диагностические мероприятия начинаются со сбора жалоб, выяснения условий появления симптоматики, физикального осмотра с пальпацией болезненных участков тела. Выявление парапротеинозов требует всестороннего обследования здоровья, которое включает следующие лабораторно-инструментальные методы:
- Рентгенодиагностика. При костных болях назначается рентгенография грудной клетки, позвоночника и конечностей, с помощью которой определяются объемные новообразования. Для точной визуализации опухолей и определения степени распространенности процесса проводится КТ пораженной области тела. Методика ПЭТ-КТ показана для диагностики генерализованной плазмоцитомы.
- Биопсия костного мозга. При солитарной форме обнаруживается нормальная цитологическая картина. При множественной миеломе в результатах исследования выявляется более 10% плазматических опухолевых клеток. При солитарных новообразованиях целесообразно проведение биопсии опухолевой ткани для гистологической диагностики.
- Анализы крови. При плазмоцитоме обнаруживается снижение уровня гемоглобина менее 100 г/л, повышение СОЭ, слипание эритроцитов в виде «монетных столбиков». Реже встречается лейкопения и тромбоцитопения. У 20-40% больных определяется гиперкальциемия.
- Иммунологическая диагностика. Патогномоничным признаком болезни является сывороточный моноклональный М-белок (парапротеин). Для уточнения диагноза проводится определения типа и класса иммуноглобулинов в сыворотке крови и образцах мочи. Для выяснения степени зрелости плазмоцитомы назначаются иммуногистохимические исследования опухолевых биоптатов.

Дифференциальная диагностика
При постановке диагноза «солитарная плазмоцитома» необходимо проводить тщательную оценку инструментальных данных, поскольку нередко при дифференциальной диагностике выявляется множественная миелома. В процессе обследования нужно исключить:
- саркому Юинга;
- моноклональные доброкачественные гаммапатии;
- макроглобулинемию Вальденстрема;
- гиперпаратиреоз;
- остеохондроз;
- хронический гломерулонефрит.
Лечение плазмоцитомы
Консервативная терапия
Злокачественные плазмоцитарные клетки имеют высокую чувствительность к радиации, поэтому при солитарных новообразованиях методом выбора является локальная лучевая терапия. Она способствует стабилизации или регрессу плазмоцитомы у 80% пациентов. Рентгенологическими маркерами эффективности лечения считаются склероз и реминерализация пораженной костной ткани. Курсовая лучевая терапия проводится всем пациентам с множественной миеломой.
Эффективным направлением лечения плазмоцитомы является полихимиотерапия, которая показывает наилучшие результаты у пациентов младше 65 лет без тяжелых сопутствующих заболеваний. Лечение направлено на максимально возможную редукцию клона опухолевых клеток. Для химиотерапии плазмоцитарной опухоли могут назначаться 5 классов лекарственных средств:
- алкилирующие агенты;
- глюкокортикостероиды;
- ингибиторы протеосомы;
- иммуномодулирующие препараты;
- антрациклины.
Хирургическое лечение
Оперативное вмешательство рассматривается как метод выбора при солитарной плазмоцитоме, которая находится в доступном для удаления месте. Иссечение основного объема опухолевых клеток улучшает функцию пораженного органа или кости, повышает эффективность радиотерапии. При патологических переломах требуется помощь травматолога-ортопеда для репозиции костных отломков, проведения оптимального метода остеосинтеза.
Паллиативная помощь
Несмотря на усовершенствование методов лечения, средняя выживаемость при генерализованной плазмоцитоме составляет около 3 лет. Пациентам в терминальной стадии заболевания показано паллиативное лечение, которое включает адекватные дозы наркотических анальгетиков и других обезболивающих препаратов, профилактику и лечение инфекционных осложнений, дистантную лучевую терапию. Больным необходим уход в рамках специализированных стационаров.
Реабилитация
Всем пациентам с плазмоцитомой требуется диспансерное наблюдение у онкогематолога на протяжении жизни. Для улучшения качества жизни подбирается программа комплексной реабилитации, которая включает симптоматическое лечение, контроль свертывающей способности крови, применение ортезов для улучшения функции опорно-двигательного аппарата. Большое внимание уделяется психосоциальной реабилитации.
Результативность лечения и ожидаемая продолжительность жизни зависит от формы и степени тяжести парапротеиноза. Генерализованная плазмоцитома считается прогностически неблагоприятным заболеванием, особенно в сочетании с выраженной миелодепрессией, быстрым ростом опухолей, стремительным нарастанием уровня сывороточного парапротеина. Учитывая неясную этиологию, эффективные меры профилактики не разработаны.
1. Солитарная (экстрамедуллярная) плазмоцитома. Клинические рекомендации/ Н.А. Фалалеева, А.Ю. Терехова, В.В. Птушкин, Е.А. Османов// Клиническая онкология. – 2020. – №1.
2. Цитологические особенности плазмоцитомы и дифференциальные признаки опухоли Юинга, неходжкинских лимфом и железистого рака/ Л.С. Болгова, О.И. Алексеенко, Т.Н. Туганова, Т.М. Ярощук// Клиническая онкология. – 2019. – №1.
Читайте также:
- Изменения почек, печени при интоксикации йодом
- Синдром вегетативно-сосудисто-трофических нарушений. Признаки вегетативно-сосудисто-трофических нарушений.
- Развитие контрастной чувствительности зрения
- Дооперационная диагностика рака желудка. Мультицентрический рак желудка
- Судороги при отравлении - признаки, причины
